一种法尼基转移酶变体及其制备方法与流程
1.本发明属于生物技术领域,特别涉及一种法尼基转移酶变体及其制备方法。
背景技术:
2.法尼基转移酶(farnesyl transferase,ftase)由两个亚基组成:一个48kda的α亚基和一个46kda的β亚基,两个亚基主要由α螺旋组成。α亚基由双层平行堆叠的成对α螺旋构成,其围绕β亚基部分包裹,就像毯子一样。β亚基的α螺旋形成一个桶。活性位点由β亚基的中心形成,α亚基的一部分侧接在β亚基的中心(如图5)。
3.ftase可催化以下化学反应:
4.法尼基二磷酸盐+蛋白质-半胱氨酸s-法尼基蛋白+二磷酸
5.该酶具有用于法尼基二磷酸酯(脂质供体分子)的疏水结合口袋,主要向目标蛋白质的羧基末端带有caax四个氨基酸序列的部位加法尼基(十五碳类异戊二烯基团)。其中:c是异戊烯基化的半胱氨酸,a是任何脂肪族氨基酸,x是m,s,q,a或c。目标蛋白质羧基末端半胱氨酸(c)中的-sh与法尼基形成硫醚键,caax基序的最后三个氨基酸随后被去除,使翻译后的蛋白质完成法尼基化修饰。
6.蛋白药物的开发过程中,尤其是药物偶联抗体,往往在其蛋白序列的羧基末端加入caax基序。ftase可以识别抗体分子羧基末端的caax框,通过硫醚键将具有生物活性的小分子药物连接到抗体分子上,而抗体作为载体将小分子药物运输到靶细胞中。ftase作为定向偶联工具酶,解决了传统偶联技术中所得产品是有不同药物分子数的混合物且无法实现特定位置偶联的缺点。所以越来越多的学者和医药企业将开发ftase作为研发重点。
7.目前关于法尼基转移酶制备等相关研究的文献或专利非常少;本领域需要提供一种法尼基裂解酶的蛋白序列以及制备方法,可以实现其作为工具酶的应用价值。
技术实现要素:
8.本发明的目的之一是提供一种法尼基转移酶变体。
9.本发明的目的之二是提供本发明所述的法尼基转移酶变体的制备方法。
10.本发明所述的目的通过以下方案实现:
11.本发明所述的法尼基转移酶变体,包括被修饰的法尼基转移酶α亚基和β亚基。
12.本发明所述的法尼基转移酶变体的制备方法,是将被修饰的法尼基转移酶α亚基和β亚基基因在大肠杆菌中可溶性表达和纯化,制备得到的法尼基转移酶可以应用于实验研究。
13.本发明具体的技术方案如下:
14.一种法尼基转移酶变体,包括被修饰的法尼基转移酶α亚基和β亚基,其中,被修饰的法尼基转移酶α亚基序列结构从n端到c端依次包括a1-a2-a3,a1为his标签,a2为evddddk连接位点,a3为法尼基转移酶α亚基。
15.在一种实施例中,a1为3~8个his标签,在一种具体实施例中,a1为6个his标签,其
核苷酸序列为seq id no.3,氨基酸序列为seq id no.4。
16.在一种实施例中,a2为evddddk连接位点,核苷酸序列为seq id no.5,氨基酸序列为seq id no.6。
17.在一种实施例中,a3为法尼基转移酶α亚基,核苷酸序列为seq id no.7,氨基酸序列为seq id no.8。
18.在一种实施例中,本发明所述的被修饰的法尼基转移酶α亚基核苷酸序列为seq id no.1,氨基酸序列为seq id no.2。
19.在一种实施例中,法尼基转移酶β亚基,核苷酸序列为seq id no.9,氨基酸序列为seq id no.10。
20.在一种实施例中,本发明所述的法尼基转移酶变体,所述变体的核苷酸序列包括seq id no.1和seq id no.9,氨基酸序列包括seq id no.2和seq id no.10。
21.本发明是采用大肠杆菌为宿主,为了增加宿主的表达效率,本发明将法尼基转移酶α亚基和β亚基及两者变体的核苷酸序列进行密码子偏好性优化。在本发明优选的实施方式中,编码所述的法尼基转移酶基因序列分别为seq id no.7和seq id no.9所示的核苷酸序列。
22.本发明进一步提供一类表达载体,包含编码所述的含被修饰的法尼基转移酶α亚基和β亚基基因序列。该表达载体属于petduet类,含有两个多克隆酶切位点区域,可用于在大肠杆菌中同时表达两个目的基因。
23.为插入petduet中,在合成包含被修饰的的法尼基转移酶α亚基时,两端分别添加了ncoi/hindiii限制酶酶切位点。在合成法尼基转移酶β亚基时,两端分别添加了ndei/xhoi限制酶酶切位点。将其插入质粒petduet的ncoi/hindiii和ndei/xhoi酶切位点。
24.另外,本发明提供所述法尼基转移酶变体的制备方法,该方法是以大肠杆菌作为表达宿主的可溶性表达方法,包括以下步骤:
25.(1)高密度发酵法尼基转移酶变体;
26.(2)收集菌体;
27.(3)破碎菌体;
28.(4)收集上清;
29.(5)ni
2+-nta基质纯化上述法尼基转移酶变体;
30.(6)离子交换纯化法尼基转移酶变体;
31.(7)浓缩。
32.在一种实施例中,步骤(1)中高密度发酵所用的工程菌为大肠杆菌bl21(de3),本发明的方法对大肠杆菌宿主的种类没有任何限制。优选那些能够直接表达构象正确目的蛋白的宿主。将前述表达载体转化大肠杆菌bl21(de3)的转化方法在本领域是公知的,例如电穿孔法、cacl2转化法等。
33.在一种实施例中,步骤(1)中的高密度发酵可采用本领域技术人员所公知的诱导宿主表达蛋白的技术。
34.在本发明优选的实施方式中,步骤(1)中的高密度发酵法尼基转移酶在发酵1.5-5小时od
600
为50-250进行诱导,诱导温度20-30℃。发明人发现采用该条件,可以使得目的蛋白获得更高效的表达。为了获得更高效的表达,进一步优选发酵3-5小时od
600
为150-250进
行诱导。诱导可以采用本领域常规的方法,在一种实施例中,是采用终浓度为0.lmm至2mm的异丙基硫代半乳糖苷(iptg)进行诱导。
35.本发明步骤(1)中的高密度发酵法尼基转移酶可以采用本领域常用的培养基;为了获得更高效的表达,在一种实施例中,本发明的种子培养基和基础发酵罐培养基均采用葡萄糖或甘油作为碳源,更优选为甘油。
36.在一种实施例中,本发明提供一种可以提高表达的种子培养基,包含:12~15g/l胰蛋白胨(typtone),30~35g/l酵母提取物(yeast extraction)和4~6ml/l甘油。
37.在一种实施例中,本发明提供一种可以提高标的基础发酵罐培养基,包含:12~15g/l胰蛋白胨(typtone),30~35g/l酵母提取物(yeast extraction)和4~6ml/l甘油。
38.本发明步骤(2)收集菌体的方法可以为本领域的常规方法。
39.本发明步骤(3)破碎菌体可以采用本领域的常规方法,包括但不限于高压匀浆、渗透压冲击、冻融、超声波破碎等。
40.本发明步骤(4)收集上清的方法可以为本领域的常规方法。
41.在一种实施方式中,本发明步骤(5)中ni
2+-nta基质纯化具体是采用ni
2+-nta基质,通过梯度为20mm至1m的咪唑溶液洗脱法尼基转移酶变体。
42.在一种实施方式中,本发明步骤(6)离子交换纯化法尼基转移酶变体采用的阴离子基质包括但不限于uniq30s、unimsp30s、unigel80q、unicore10q、bestaroseff、sepaxmc60q、porostm50hq等。
43.本发明通过活性测定表明利用大肠杆菌可溶性表达可以制备得到有活性的法尼基转移酶变体。
44.本发明还提供所述的法尼基转移酶变体、所述的编码基因或所述表达载体在酶联反应中的应用。
45.本发明所提供的法尼基转移酶变体,以及制备法尼基转移酶变体的方法具有以下优点:
46.(1)通过引入his标签,使后续纯化工作简单易行。
47.(2)通过引入连接序列,使法尼基转移酶α链蛋白更容易形成正确的空间结构,保证其活性,也确保了被修饰的法尼基转移酶α亚基和法尼基转移酶β亚基同时表达后可以更准确的利用自身性质进行组装。
48.(3)通过使用具有两个多克隆位点区域的载体(例如petduet等),使被修饰的法尼基转移酶α亚基和法尼基转移酶β亚基可以同时表达,最终使目的基因两个亚基利用自身性质,通过非共价键在宿主体内组装成有活性的法尼基转移酶。
49.(4)在可溶性表达系统中进行诱导表达时,温度控制在20-30℃,表达被修饰的法尼基转移酶α链蛋白和法尼基转移酶β链蛋白,无需经过变性和复性,且产量较高,其存在于菌体中,经采用ni
2+-nta基质粗纯后,再经阴离子基质精纯后即可得到有活性的纯度较高(纯度≥95%)法尼基转移酶,且本发明实施例2和3证明,采用甘油作为碳源时可以提高蛋白表达;实施例2、4-6证明,在od
600
为150-250进行诱导时可以进一步提高蛋白表达。
附图说明
50.图1.法尼基转移酶工程菌表达电泳图。
51.图2.法尼基转移酶蛋白纯化电泳图ni
2+-nta层析纯化洗脱峰电泳图。
52.图3.法尼基转移酶阴离子纯化电泳图。
53.图4.浓缩后成品电泳图。
54.图5法尼基转移酶亚基示意图。
具体实施方式
55.本发明所述方法,若无特别说明,均为本领域的常规方法。
56.部分材料:
57.菌株和质粒:表达菌株bl21(de3)和质粒petduet由南京金斯瑞有限公司提供。
58.酶和试剂:
59.实施例中涉及分子生物学操作所用的酶均购于购自takara,相应的操作步骤完全按照相关的产品说明书进行。
60.实施例中所涉及的法尼基转移酶α亚基或被修饰的法尼基转移酶α亚基和β亚基基因合成、和测序工作由南京金斯瑞有限公司完成。
61.其他未标明来源的原、辅料均为市售产品。
62.实施例1:法尼基转移酶工程菌的制备
63.一、法尼基转移酶表达载体和工程菌的构建
64.1、构建法尼基转移酶核苷酸序列:evddddk酶切位点和法尼基转移酶α亚基的氨基酸序列分别如下(seq id no.6和seq id no.8,)。按照大肠杆菌密码子偏好性对氨基酸序列的的原始核苷酸进行优化,该优化方法为本领域技术人员所公知的技术,可参见例如内蒙古大学学报:大肠杆菌和酵母密码子使用对比,006,voi.37,no.1:34-39;得到最终的核苷酸序列:seq id no.5和seq id no.7。在初步修饰后的法尼基转移酶α亚基的5’端加入6个his(基因序列为seq id no.3),获得包含6个his标签的修饰的法尼基转移酶α亚基核苷酸序列(seq id no.1,1-3bp为甲硫氨酸,4-21bp为6个his基因序列,22-42bp为evddddk连接位点,43-1131bp为法尼基转移酶α亚基基因序列;氨基酸序列如seq id no.2,1aa为甲硫氨酸,2-7aa为6个his,8-14aa为evddddk连接位点,15-377aa为法尼基转移酶α亚基氨基酸序列),在该核苷酸序列两端引入ncoi/hindiii连入载体中。在法尼基转移酶β亚基核苷酸序列(seq id no.9,1-3bp为甲硫氨酸编码序列,4-1311bp为法尼基转移酶β亚基基因序列,氨基酸序列如seq id no.10,1aa为甲硫氨酸,2-437aa为法尼基转移酶β亚基氨基酸序列)两端引入ndei/xhoi酶切位点。
65.2、人工合成上述基因序列。通过xba i/hind i酶切位点将α链基因插入到质粒petduet-1相应酶切位点中,通过nde i/xho i酶切位点将β链基因插入到质粒petduet-1相应酶切位点中,构建成的重组质粒。
66.3、构建法尼基转移酶工程菌:将上述重组质粒通过cac12转化的方法导入到bl21(de3)中,构建法尼基转移酶工程菌。如果需要,转化也可用电转的方法进行。经测序,工程菌中的修饰的法尼基转移酶α亚基和β亚基序列与设计一致。经后续发酵纯化测序后获得法尼基转移酶变体,氨基酸序列为seq id no.11。
67.实施例2:工程菌的高密度发酵方法1
68.1.发酵培养基配制
69.1.1培养基
70.种子培养基:称取27typtone,63g yeast extraction,量取甘油10ml放入5l烧杯中,搅拌至完全溶解,用量筒定容至2000ml。分装至2个250ml摇瓶中(每瓶装50ml tb种子培养基)和3个2l(每瓶装500ml tb种子培养基)。
71.80l基础罐基:称取1080g typtone,2520g yeast extraction,量取甘油400ml放入10l烧杯中,搅拌至完全溶解,在发酵罐中补足水至80l。
72.2.发酵过程
73.2.1一级种子培养
74.向培养基中加入氨苄青霉素使其终浓度为100μg/ml,按照1%的接种量接入tb种子培养基中,37℃培养,转速200
±
20rpm,培养14~16h。
75.2.2二级种子培养
76.按照1%的接种量,将过夜活化的一级种子接入3个2l摇瓶中,向培养基中加入氨苄青霉素使其终浓度为100μg/ml,37℃培养,转速200
±
20rpm,3~5h。
77.2.3 100l发酵过程控制
78.罐基灭菌后降温至37℃后,溶氧校正100%,将通气量设定在0.2m3/h,搅拌设定为500rpm,待溶氧稳定设定溶氧100%,然后将转速设定为200rpm。ph设定为7.0,自动控制,死区设定为0.2,即ph在7.0
±
0.2的范围内不自动控制,调整ph用30%磷酸和氨水。用50%甘油作为碳源和酵母粉、蛋白胨混合氮源作进行流加补料。
79.向发酵罐中加入氨苄青霉素使其终浓度为100μg/ml,并接入1500ml种子。随菌体生长溶氧不断下降,不断提高转速和通气量,保证溶氧维持在20%以上。转速每次提高20~30rpm,最高转速500rpm;通气量每次提高0.1m3/h,最大通气量为2.4m3/h,增加通气量时注意罐压,罐压不得大于0.5公斤;转速和通气量交替提高。用50%甘油作为碳源,酵母粉、蛋白胨混合氮源作进行流加补料。发酵1.5h(菌体生长至od
600
约50)时,降温至25℃,加入iptg诱导(iptg终浓度为0.5mm)。诱导15h后结束发酵。
80.2.4菌体收获
81.出罐菌液在管式离心机中离心,离心参数:9000rpm,4℃,30minutes。弃去上清,称重菌体沉淀。
82.2.5菌体破碎
83.离心收集的菌体按重量体积比1:5加入破碎缓冲液(含150mm nacl,50mmtris-hcl,ph8.0),加入1%曲拉通x-100充分搅匀,无块状菌体,悬浮液即可进行高压匀浆破菌,破菌时采用的操作压力为850
±
50bar,连续破碎两遍。使用离心机将破碎后混悬液离心,离心参数:离心转速为9000rpm,离心60min,离心温度为4℃,离心两遍,收取上清液。
84.2.6结果
85.单位发酵液菌体重量(g/l)菌体总重量(g)破菌后上清液蛋白浓度(g/l)127698.57.77
86.实施例3:工程菌的高密度发酵方法2
87.1.发酵培养基配制
88.1.1tb培养基
89.种子培养基:称取24typtone,48g yeast extraction,量取葡萄糖16g放入5l烧杯
中,搅拌至完全溶解,用量筒定容至2000ml。分装至2个250ml摇瓶中(每瓶装50ml tb种子培养基)和3个2l(每瓶装500ml tb种子培养基)。
90.80l基础罐基:称取960g typtone,1920g yeast extraction,磷酸二氢钾184g,磷酸氢二钾1312g,秤取葡萄糖640g放入10l烧杯中,搅拌至完全溶解,在发酵罐中补足水至80l。
91.2.发酵过程
92.2.1一级种子培养
93.向培养基中加入氨苄青霉素使其终浓度为100μg/ml,按照1%的接种量接入tb种子培养基中,37℃培养,转速200
±
20rpm,培养14~16h。
94.2.2二级种子培养
95.按照1%的接种量,将过夜活化的一级种子接入3个2l摇瓶中,向培养基中加入氨苄青霉素使其终浓度为100μg/ml,37℃培养,转速200
±
20rpm,3~5h。
96.2.3 100l发酵过程控制
97.罐基灭菌后降温至37℃后,溶氧校正100%,将通气量设定在0.2m3/h,搅拌设定为500rpm,待溶氧稳定设定溶氧100%,然后将转速设定为200rpm。ph设定为7.0,自动控制,死区设定为0.2,即ph在7.0
±
0.2的范围内不自动控制,调整ph用30%磷酸和氨水。用20g/l葡萄糖作为碳源和酵母粉、蛋白胨混合氮源作进行流加补料。
98.向发酵罐中加入氨苄青霉素使其终浓度为100μg/ml,并接入1500ml种子。随菌体生长溶氧不断下降,不断提高转速和通气量,保证溶氧维持在20%以上。转速每次提高20~30rpm,最高转速500rpm;通气量每次提高0.1m3/h,最大通气量为2.4m3/h,增加通气量时注意罐压,罐压不得大于0.5公斤;转速和通气量交替提高。用50%甘油作为碳源,酵母粉、蛋白胨混合氮源作进行流加补料。发酵1.5h(菌体生长至od
600
约50)时,降温至25℃,加入iptg诱导(iptg终浓度为0.5mm)。诱导15h后结束发酵。
99.2.4菌体收获
100.出罐菌液在管式离心机中离心,离心参数:9000rpm,4℃,30minutes。弃去上清,称重菌体沉淀。
101.2.5菌体破碎
102.离心收集的菌体按重量体积比1:5加入破碎缓冲液(含150mm nacl,50mmtris-hcl,ph8.0),加入1%曲拉通x-100充分搅匀,无块状菌体,悬浮液即可进行高压匀浆破菌,破菌时采用的操作压力为850
±
50bar,连续破碎两遍。使用离心机将破碎后混悬液离心,离心参数:离心转速为9000rpm,离心60min,离心温度为4℃,离心两遍,收取上清液。
103.2.6结果
104.单位发酵液菌体重量(g/l)菌体总重量(g)破菌后上清液蛋白浓度(g/l)1226716.05
105.实施例4:工程菌的高密度发酵方法3
106.1.发酵培养基配制
107.1.1培养基
108.种子培养基:称取27typtone,63g yeast extraction,量取甘油10ml放入5l烧杯中,搅拌至完全溶解,用量筒定容至2000ml。分装至2个250ml摇瓶中(每瓶装50ml tb种子培
养基)和3个2l(每瓶装500ml tb种子培养基)。
109.80l基础罐基:称取1080g typtone,2520g yeast extraction,量取甘油400ml放入10l烧杯中,搅拌至完全溶解,在发酵罐中补足水至80l。
110.2.发酵过程
111.2.1一级种子培养
112.向培养基中加入氨苄青霉素使其终浓度为100μg/ml,按照1%的接种量接入tb种子培养基中,37℃培养,转速200
±
20rpm,培养14~16h。
113.2.2二级种子培养
114.按照1%的接种量,将过夜活化的一级种子接入3个2l摇瓶中,向培养基中加入氨苄青霉素使其终浓度为100μg/ml,37℃培养,转速200
±
20rpm,3~5h。
115.2.3 100l发酵过程控制
116.罐基灭菌后降温至37℃后,溶氧校正100%,将通气量设定在0.2m3/h,搅拌设定为500rpm,待溶氧稳定设定溶氧100%,然后将转速设定为200rpm。ph设定为7.0,自动控制,死区设定为0.2,即ph在7.0
±
0.2的范围内不自动控制,调整ph用30%磷酸和氨水。用50%甘油作为碳源和酵母粉、蛋白胨混合氮源作进行流加补料。
117.向发酵罐中加入氨苄青霉素使其终浓度为100μg/ml,并接入1500ml种子。随菌体生长溶氧不断下降,不断提高转速和通气量,保证溶氧维持在20%以上。转速每次提高20~30rpm,最高转速500rpm;通气量每次提高0.1m3/h,最大通气量为2.4m3/h,增加通气量时注意罐压,罐压不得大于0.5公斤;转速和通气量交替提高。用50%甘油作为碳源,酵母粉、蛋白胨混合氮源作进行流加补料。发酵3h(菌体生长至od
600
约150)时,降温至30℃,加入iptg诱导(iptg终浓度为0.5mm)。诱导15h后结束发酵。
118.2.4菌体收获
119.出罐菌液在管式离心机中离心,离心参数:9000rpm,4℃,30minutes。弃去上清,称重菌体沉淀。
120.2.5菌体破碎
121.离心收集的菌体按重量体积比1:5加入破碎缓冲液(含150mm nacl,50mmtris-hcl,ph8.0),加入1%曲拉通x-100充分搅匀,无块状菌体,悬浮液即可进行高压匀浆破菌,破菌时采用的操作压力为850
±
50bar,连续破碎两遍。使用离心机将破碎后混悬液离心,离心参数:离心转速为9000rpm,离心60min,离心温度为4℃,离心两遍,收取上清液。
122.2.6结果
123.单位发酵液菌体重量(g/l)菌体总重量(g)破菌后上清液蛋白浓度(g/l)17598013.17
124.实施例5:工程菌的高密度发酵方法4
125.1.发酵培养基配制
126.1.1培养基
127.种子培养基:称取27typtone,63g yeast extraction,量取甘油10ml放入5l烧杯中,搅拌至完全溶解,用量筒定容至2000ml。分装至2个250ml摇瓶中(每瓶装50ml tb种子培养基)和3个2l(每瓶装500ml tb种子培养基)。
128.80l基础罐基:称取1080g typtone,2520g yeast extraction,量取甘油400ml放
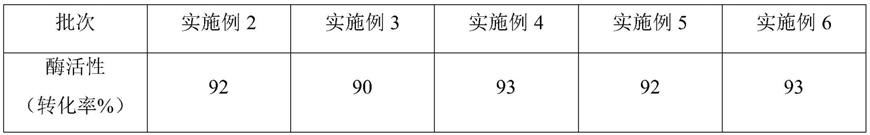
入10l烧杯中,搅拌至完全溶解,在发酵罐中补足水至80l。
129.2.发酵过程
130.2.1一级种子培养
131.向培养基中加入氨苄青霉素使其终浓度为100μg/ml,按照1%的接种量接入tb种子培养基中,37℃培养,转速200
±
20rpm,培养14~16h。
132.2.2二级种子培养
133.按照1%的接种量,将过夜活化的一级种子接入3个2l摇瓶中,向培养基中加入氨苄青霉素使其终浓度为100μg/ml,37℃培养,转速200
±
20rpm,3~5h。
134.2.3 100l发酵过程控制
135.罐基灭菌后降温至37℃后,溶氧校正100%,将通气量设定在0.2m3/h,搅拌设定为500rpm,待溶氧稳定设定溶氧100%,然后将转速设定为200rpm。ph设定为7.0,自动控制,死区设定为0.2,即ph在7.0
±
0.2的范围内不自动控制,调整ph用30%磷酸和氨水。用50%甘油作为碳源和酵母粉、蛋白胨混合氮源作进行流加补料。
136.向发酵罐中加入氨苄青霉素使其终浓度为100μg/ml,并接入1500ml种子。随菌体生长溶氧不断下降,不断提高转速和通气量,保证溶氧维持在20%以上。转速每次提高20~30rpm,最高转速500rpm;通气量每次提高0.1m3/h,最大通气量为2.4m3/h,增加通气量时注意罐压,罐压不得大于0.5公斤;转速和通气量交替提高。用50%甘油作为碳源,酵母粉、蛋白胨混合氮源作进行流加补料。发酵3h(菌体生长至od
600
约150)时,降温至25℃,加入iptg诱导(iptg终浓度为0.5mm)。诱导15h后结束发酵。
137.2.4菌体收获
138.出罐菌液在管式离心机中离心,离心参数:9000rpm,4℃,30minutes。弃去上清,称重菌体沉淀。
139.2.5菌体破碎
140.离心收集的菌体按重量体积比1:5加入破碎缓冲液(含150mm nacl,50mmtris-hcl,ph8.0),加入1%曲拉通x-100充分搅匀,无块状菌体,悬浮液即可进行高压匀浆破菌,破菌时采用的操作压力为850
±
50bar,连续破碎两遍。使用离心机将破碎后混悬液离心,离心参数:离心转速为9000rpm,离心60min,离心温度为4℃,离心两遍,收取上清液。
141.2.6结果
142.单位发酵液菌体重量(g/l)菌体总重量(g)破菌后上清液蛋白浓度(g/l)172963.215.69
143.实施例6:工程菌的高密度发酵方法5
144.1.发酵培养基配制
145.1.1培养基
146.种子培养基:称取27typtone,63g yeast extraction,量取甘油10ml放入5l烧杯中,搅拌至完全溶解,用量筒定容至2000ml。分装至2个250ml摇瓶中(每瓶装50ml tb种子培养基)和3个2l(每瓶装500ml tb种子培养基)。
147.80l基础罐基:称取1080g typtone,2520g yeast extraction,量取甘油400ml放入10l烧杯中,搅拌至完全溶解,在发酵罐中补足水至80l。
148.2.发酵过程
149.2.1一级种子培养
150.向培养基中加入氨苄青霉素使其终浓度为100μg/ml,按照1%的接种量接入tb种子培养基中,37℃培养,转速200
±
20rpm,培养14~16h。
151.2.2二级种子培养
152.按照1%的接种量,将过夜活化的一级种子接入3个2l摇瓶中,向培养基中加入氨苄青霉素使其终浓度为100μg/ml,37℃培养,转速200
±
20rpm,3~5h。
153.2.3 100l发酵过程控制
154.罐基灭菌后降温至37℃后,溶氧校正100%,将通气量设定在0.2m3/h,搅拌设定为500rpm,待溶氧稳定设定溶氧100%,然后将转速设定为200rpm。ph设定为7.0,自动控制,死区设定为0.2,即ph在7.0
±
0.2的范围内不自动控制,调整ph用30%磷酸和氨水。用50%甘油作为碳源和酵母粉、蛋白胨混合氮源作进行流加补料。
155.向发酵罐中加入氨苄青霉素使其终浓度为100μg/ml,并接入1500ml种子。随菌体生长溶氧不断下降,不断提高转速和通气量,保证溶氧维持在20%以上。转速每次提高20~30rpm,最高转速500rpm;通气量每次提高0.1m3/h,最大通气量为2.4m3/h,增加通气量时注意罐压,罐压不得大于0.5公斤;转速和通气量交替提高。用50%甘油作为碳源,酵母粉、蛋白胨混合氮源作进行流加补料。发酵3h(菌体生长至od
600
约150)时,降温至20℃,加入iptg诱导(iptg终浓度为0.5mm)。诱导15h后结束发酵。
156.2.4菌体收获
157.出罐菌液在管式离心机中离心,离心参数:9000rpm,4℃,30minutes。弃去上清,称重菌体沉淀。
158.2.5菌体破碎
159.离心收集的菌体按重量体积比1:5加入破碎缓冲液(含150mm nacl,50mmtris-hcl,ph8.0),加入1%曲拉通x-100充分搅匀,无块状菌体,悬浮液即可进行高压匀浆破菌,破菌时采用的操作压力为850
±
50bar,连续破碎两遍。使用离心机将破碎后混悬液离心,离心参数:离心转速为9000rpm,离心60min,离心温度为4℃,离心两遍,收取上清液。
160.2.6结果
161.单位发酵液菌体重量(g/l)菌体总重量(g)破菌后上清液蛋白浓度(g/l)140963.216.55
162.实施例7:法尼基转移酶ni
2+
亲和纯化
163.将破碎离心后上清用0.45μm滤膜过滤,使用akta process层析系统,装入层析介质为chelating bestarose ff的填料。用niso4溶液进行纯化ni
2+
挂柱再生。用溶液a:50mm tris-hcl+150mm nacl,ph8.0平衡柱子,上样,在用溶液b:50mm tris-hcl+150mm nacl+
[0164]1‰
tritonx-100,ph8.0液进行等度洗脱以除去杂蛋白,最后用溶液c:50mm tris-hcl+150mm nacl+1m咪唑,ph8.0梯度洗脱目的蛋白(法尼基转移酶),收集组分峰(如图2),得到含有咪唑的法尼基转移酶溶液。
[0165]
实施例8:法尼基转移酶离子纯化
[0166]
使用akta process层析系统,装入层析介质为sepaxmc60q的填料。用溶液d:20mm pb,ph 7.5平衡柱子,用溶液e:20mm pb+1m nacl,ph 7.5梯度洗脱目的蛋白(法尼基转移酶),收集组分峰(如图3)。
[0167]
实施例9:法尼基转移酶的浓缩
[0168]
取主峰纯度≥95%的法尼基转移酶溶液,用装有1kd板膜进行浓缩,同时用25mm hepes,40mm nacl,5mm dtt洗涤,浓缩至法尼基转移酶蛋白浓度为2-5mg/ml。分装置于petg瓶中,放-70℃保存,浓缩后的电泳图如图4所示。
[0169]
实施例10:法尼基转移酶活性检测
[0170]
1实验条件
[0171]
1.1酶联反应:
[0172]
caax-body抗体原液终浓度5mg/ml,10
×
酶联反应buffer,dtt终浓度0.33mmol/l,ftase终浓度0.25μmol/l,小分子溶液终浓度0.5mmol/l,总体积1ml。反应条件:25℃-28℃水浴反应12~15h。
[0173]
1.2氧化反应
[0174]
向酶联反应液重加入8mmol/l dhaa(脱氢抗坏血酸)溶液氧化恢复二硫键。加入量为dhaa/抗体摩尔比为30倍。25℃-28℃水浴反应2-3h。
[0175]
1.3hplc检测
[0176]
调整积分事件,确保保留时间在5.0-30.0min之间的色谱峰都得到积分。按5.0-30.0min之间各色谱峰面积比例进行报告。
[0177]
检测:1ml反应体系中抗体和小分子转化率。
[0178]
2结果
[0179][0180]
表明,本发明所述的法尼基转移酶变体具有很好的酶活性。
[0181]
需要说明的是上述实施例仅仅是本发明的较佳实施例,并没有用来限定本发明的保护范围,在上述基础上做出的等同替换或者替代均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1