一种雷氏普罗威登斯菌rtxD基因引物及荧光定量PCR检测方法和应用与流程
本发明属于分子生物学技术领域,尤其是一种雷氏普罗威登斯菌rtxd基因引物及荧光定量pcr检测方法和应用。
背景技术:
雷氏普罗威登斯菌(providenciarettgeri)属于肠杆菌科,普罗威登斯菌属。雷氏普罗威登斯菌广泛分布于土壤、水体等自然环境中。雷氏普罗威登斯菌不仅影响鱼、虾、龟鳖、鳄等水产动物健康养殖,而且对人类饮食构成潜在危害。目前认为雷氏普罗威登斯菌是条件致病菌,作为一种“人-兽-鱼”共患病病原菌,主要导致心包炎、尿道炎、腹泻等疾病。研究表明,人类感染雷氏普罗威登斯菌可引发腹泻、肺炎、尿道炎等多种疾病。近年来,雷氏普罗威登斯菌可以导致鱼、虾、鳖等多种水产动物发病死亡,且雷氏普罗威登斯菌对很多抗生素产生耐药,其产生的金属β-内酰胺酶可以水解所有的β-内酰胺类药物,造成细菌的多重耐药性,感染之后几乎无药可用,对人类和动物健康造成严重影响,已经受到广大研究者的关注和重视。但是,目前在人-兽-鱼疾病领域尚未有雷氏普罗威登斯菌荧光快速诊断技术。
由于雷氏普罗威登斯菌对人类生活造成严重危害,目前在人-兽-鱼疾病领域尚未有雷氏普罗威登斯菌荧光快速诊断技术,所以急需开发一种针对此菌的快速检测的手段。
通过检索,尚未发现与本发明专利申请相关的专利公开文献。
技术实现要素:
本发明目的在于克服现有技术的不足之处,提供一种雷氏普罗威登斯菌rtxd基因引物及荧光定量pcr检测方法和应用,该引物灵敏度高,特异性强,成本低廉,能够利用其快速检测雷氏普罗威登斯菌,为雷氏普罗威登斯菌感染的早期诊断,减少雷氏普罗威登斯菌的危害,对人类和动物的健康安全具有重要意义。
本发明解决其技术问题所采用的技术方案是:
一种荧光定量pcr检测雷氏普罗威登斯菌rtxd基因引物,所述引物的核苷酸序列如下:
rd-f:seqno.1;
rd-r:seqno.2。
一种利用如上所述的基因引物荧光定量pcr检测雷氏普罗威登斯菌的方法,步骤如下:
⑴提取待测细菌样品dna;
⑵以步骤⑴中所提取的dna为模板,采用荧光定量pcr方法扩增雷氏普罗威登斯菌rtxd基因,其中所使用引物的核苷酸序列为rd-f和rd-r,在58-61℃退火阶段根据荧光信号积累确定cq值,在扩增条件后增加65℃至95℃,进行融解曲线分析;
⑶雷氏普罗威登斯菌的标准曲线的绘制:根据所选用的重组质粒作为模板,进行荧光定量扩增,绘制标准曲线;
⑷实验结果判定标准:若阴性对照品无cq值,且无规则扩增曲线,同时cq值应在15-35之间,扩增曲线规则,判断为阳性,并将所得cq值在步骤⑶中所得标准曲线上确定样品中雷氏普罗威登斯菌的数量;反之,判断为阴性。
而且,所述步骤⑵中荧光定量pcr方法中使用的荧光染料为tbgreenii。
而且,所述步骤⑶中重组质粒dna的浓度为1.0×103-1.0×107拷贝/反应,绘制标准曲线,e=99.1%,r2=0.999。
而且,所述步骤⑵的具体步骤为:
以步骤⑴中所提取的dna为模板,采用荧光定量pcr方法扩增雷氏普罗威登斯菌rtxd基因,体系为greenpremixextaqii10μl,10μmol/l上下游引物各0.5μl,dna模板2μl,使用depc水补足至20μl;
采用两步法进行荧光定量pcr扩增,pcr反应条件为:95℃3min;95℃10s,58-61℃1min,40个循环;
72℃延伸2min,在退火阶段根据荧光信号积累确定cq值,在扩增条件后增加65℃至95℃,进行融解曲线分析。
而且,所述步骤⑶中重组质粒的制备如下:
提取雷氏普罗威登斯菌的总dna,使用引物序列rd-f和rd-r进行pcr扩增:
pcr扩增反应体系为25μl:taqpcrmix10μl;rd-f1μl,rd-r1μl;dna模板2μl;用ddh2o补足到25μl;
pcr反应条件为:95℃5min;95℃30s,58-61℃40s,72℃1min30个循环;72℃再延伸10min;
回收目的条带并与pm18-t连接、转化、鉴定正确后测序,经测序分析,雷氏普罗威登斯菌rtxd基因序列扩增正确;
将所得含有重组质粒的大肠杆菌在37℃,150r/min的摇床中培养12-16h,提取质粒,即可用作荧光定量pcr扩增的模板的重组质粒。
而且,所述步骤⑶中绘制标准曲线的具体步骤如下:
使用重组质粒作为荧光定量pcr扩增的模板,经10倍梯度稀释,得到不同浓度的dna模板:1.0×107、1.0×106、1.0×105、1.0×104、1.0×103拷贝/反应;
采用荧光定量pcr方法扩增,体系为greenpremixextaqii10μl,10μmol/l上下游引物各0.5μl,dna模板2μl,使用depc水补足至20μl;
采用两步法进行荧光定量pcr扩增,pcr反应条件为:95℃3min;95℃10s,58-61℃1min,40个循环;
72℃延伸2min,在退火阶段根据荧光信号积累确定cq值,在扩增条件后增加65℃至95℃,进行融解曲线分析,每个样本三个平行;
进行荧光定量pcr后得到每个浓度的cq值,以拷贝数log10值和cq值制作细菌悬液的标准曲线,e=99.1%,r2=0.999。
如上所述的利用基因引物荧光定量pcr检测雷氏普罗威登斯菌的方法在检测雷氏普罗威登斯菌所导致疾病方面中的应用。
本发明取得的优点和积极效果为:
1、本发明引物灵敏度高,特异性强,成本低廉,能够利用其快速检测雷氏普罗威登斯菌,如由雷氏普罗威登斯菌所导致的疾病,为雷氏普罗威登斯菌感染的早期诊断,减少雷氏普罗威登斯菌的危害,对人类和动物(如兽和鱼类)的健康安全具有重要意义。
2、本发明雷氏普罗威登斯菌的荧光定量pcr检测方法的灵敏度较高,其灵敏度可达到1.07×102拷贝,特异性强、成本低、快速等优点,可用于雷氏普罗威登斯菌感染的早期诊断,对人和兽、鱼的健康安全具有重要意义。
3、本发明雷氏普罗威登斯菌的检测引物及荧光定量pcr检测方法,检测其灵敏度和特异性,并对该方法的稳定性进行了评价。因荧光定量pcr灵敏度高,特异性强,成本低廉,耗时短等优点而被广泛应用。目前尚未有tbgreenii检测雷氏普罗威登斯菌的报道。本技术采用tbgreenii,基于雷氏普罗威登斯菌的rtxd基因序列设计引物,优化反应体系和条件,对特异性、敏感性及重复性进行验证,建立了荧光定量pcr检测方法。为雷氏普罗威登斯菌感染的早期检测与快速鉴定提供一种特异、敏感和成本较低的检测方法。为雷氏普罗威登斯菌感染的早期诊断和快速鉴定奠定基础;
4、本发明的原理是,通过进行全基因组测序,寻找雷氏普罗威登斯菌中的毒力基因序列,以此设计rtxd基因引物序列,进行荧光定量pcr检测雷氏普罗威登斯菌。采用tbgreenii法进行检测,灵敏度高且特异性强。
附图说明
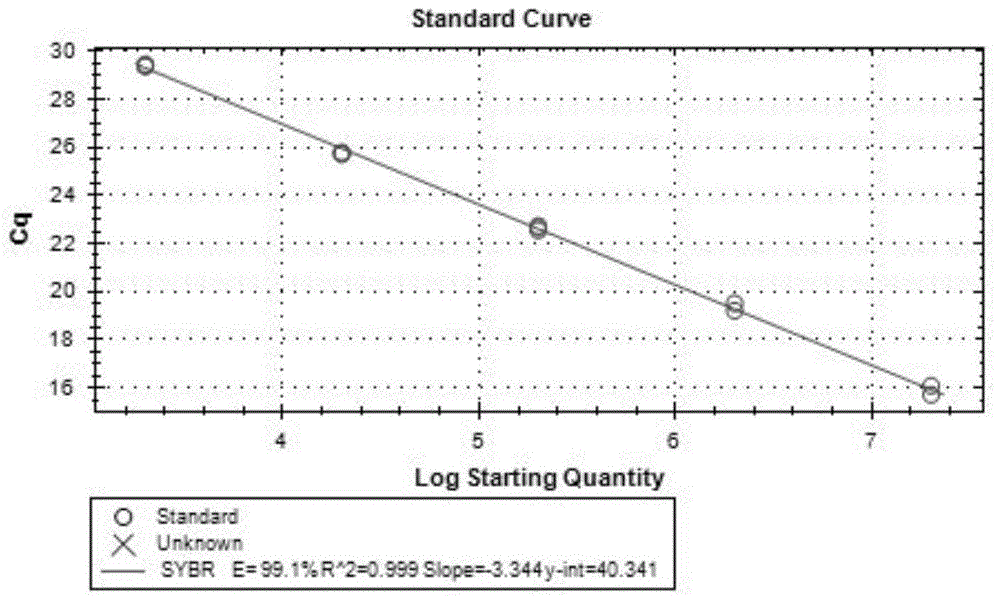
图1为本发明中雷氏普罗威登斯菌rtxd基因荧光定量pcr扩增标准曲线图;
图2为本发明中荧光定量pcr检测雷氏普罗威登斯菌rtxd基因的敏感性实验结果图;从左至右为1.07×107-1.07×102拷贝/反应;
图3为常规pcr检测雷氏普罗威登斯菌rtxd基因的敏感性实验结果图;从左至右为1.07×107-1.07×102拷贝/反应;
图4为本发明中雷氏普罗威登斯菌rtxd基因荧光定量pcr扩增特异性实验结果图;其中,1-3:雷氏普罗威登斯菌(1-2曲线重合);4:鲍氏不动杆菌;5:弗氏柠檬酸杆菌;6:副溶血弧菌;7:维氏气单胞菌;8:嗜水气单胞菌;
图5为本发明中雷氏普罗威登斯菌感染检测图。
具体实施方式
下面详细叙述本发明的实施例,需要说明的是,本实施例是叙述性的,不是限定性的,不能以此限定本发明的保护范围。
本发明中所使用的原料,如无特殊说明,均为常规的市售产品;本发明中所使用的方法,如无特殊说明,均为本领域的常规方法。
一种雷氏普罗威登斯菌荧光定量pcr的检测rtxd基因引物,所述引物的核苷酸序列如下:
rd-f:seqno.1ccaccgtcttacttggcact;
rd-r:seqno.2taccttgcgtggttgcttga。
一种利用如上所述的基因引物荧光定量pcr检测雷氏普罗威登斯菌的方法,步骤如下:
⑴提取待测细菌样品dna;
⑵以步骤⑴中所提取的dna为模板,采用荧光定量pcr方法扩增雷氏普罗威登斯菌rtxd基因,其中所使用引物的核苷酸序列为rd-f和rd-r,在58-61℃退火阶段根据荧光信号积累确定cq值,在扩增条件后增加65℃至95℃,进行融解曲线分析;
⑶雷氏普罗威登斯菌的标准曲线的绘制:根据所选用的重组质粒作为模板,进行荧光定量扩增,绘制标准曲线;
⑷实验结果判定标准:若阴性对照品无cq值,且无规则扩增曲线,同时cq值应在15-35之间,扩增曲线规则,判断为阳性,并将所得cq值在步骤⑶中所得标准曲线上确定样品中雷氏普罗威登斯菌的数量;反之,判断为阴性。
较优地,所述步骤⑵中荧光定量pcr方法中使用的荧光染料为tbgreenii。
较优地,所述步骤⑶中重组质粒dna的浓度为1.0×103-1.0×107拷贝/反应,绘制标准曲线,e=99.1%,r2=0.999。
较优地,所述步骤⑵的具体步骤为:
以步骤⑴中所提取的dna为模板,采用荧光定量pcr方法扩增雷氏普罗威登斯菌rtxd基因,体系为greenpremixextaqii10μl,10μmol/l上下游引物各0.5μl,dna模板2μl,使用depc水补足至20μl;
采用两步法进行荧光定量pcr扩增,pcr反应条件为:95℃3min;95℃10s,58-61℃1min,40个循环;
72℃延伸2min,在退火阶段根据荧光信号积累确定cq值,在扩增条件后增加65℃至95℃,进行融解曲线分析。
较优地,所述步骤⑶中重组质粒的制备如下:
提取雷氏普罗威登斯菌的总dna,使用引物序列rd-f和rd-r进行pcr扩增:
pcr扩增反应体系为25μl:taqpcrmix10μl;rd-f1μl,rd-r1μl;dna模板2μl;用ddh2o补足到25μl
pcr反应条件为:95℃5min;95℃30s,58-61℃40s,72℃1min30个循环;72℃再延伸10min;
回收目的条带并与pm18-t连接、转化、鉴定正确后测序,经测序分析,雷氏普罗威登斯菌rtxd基因序列扩增正确;
将所得含有重组质粒的大肠杆菌在37℃,150r/min的摇床中培养12-16h,提取质粒,即可用作荧光定量pcr扩增的模板的重组质粒。
较优地,所述步骤⑶中绘制标准曲线的具体步骤如下:
使用重组质粒作为荧光定量pcr扩增的模板,经10倍梯度稀释,得到不同浓度的dna模板:1.0×107、1.0×106、1.0×105、1.0×104、1.0×103拷贝/反应;
采用荧光定量pcr方法扩增,体系为greenpremixextaqii10μl,10μmol/l上下游引物各0.5μl,dna模板2μl,使用depc水补足至20μl;
采用两步法进行荧光定量pcr扩增,pcr反应条件为:95℃3min;95℃10s,58-61℃1min,40个循环;
72℃延伸2min,在退火阶段根据荧光信号积累确定cq值,在扩增条件后增加65℃至95℃,进行融解曲线分析,每个样本三个平行;
进行荧光定量pcr后得到每个浓度的cq值,以拷贝数log10值和cq值制作细菌悬液的标准曲线,e=99.1%r2=0.999。
如上所述的利用基因引物荧光定量pcr检测雷氏普罗威登斯菌的方法能够应用在检测雷氏普罗威登斯菌所导致疾病方面中。
更为具体地,相关制备如下:
一、一种荧光定量pcr检测雷氏普罗威登斯菌的方法,步骤如下:
1、引物的设计与合成:
选择rtxd基因设计特异性引物。引物序列rd-f和rd-r如下:
rd-f:ccaccgtcttacttggcact;
rd-r:taccttgcgtggttgcttga。
2、通过对雷氏普罗威登斯菌rtxd基因序列的克隆,制备重组质粒
利用细菌基因组dna提取试剂盒(bioteke)提取雷氏普罗威登斯菌的总dna,使用上述引物序列rd-f和rd-r进行pcr扩增:
pcr扩增反应体系为25μl:taqpcrmix(上海生工)10μl;rd-f1μl,rd-r1μl;dna模板2μl;用ddh2o补足到25μl
pcr反应条件为:95℃5min;95℃30s,58-61℃40s,72℃1min30个循环;72℃再延伸10min。
将所获得的pcr产物用1%琼脂糖凝胶电泳分析,结果显示,扩增雷氏普罗威登斯菌rtxd基因部分片段112bp。回收目的条带并与pm18-t(takara)连接,转化,鉴定正确后送苏州金唯智测序。经测序分析发现,与拟克隆的基因序列一致,说明雷氏普罗威登斯菌rtxd基因序列扩增正确。
将所得含有重组质粒的大肠杆菌在37℃,150r/min的摇床中培养12-16h,利用质粒提取试剂盒提取质粒,用做荧光定量pcr扩增的模板。
3、荧光定量pcr标准曲线的绘制:
使用重组质粒作为荧光定量pcr扩增的模板,经10倍梯度稀释,得到不同浓度的dna模板:1.0×107、1.0×106、1.0×105、1.0×104、1.0×103拷贝/反应。
采用荧光定量pcr方法扩增,体系为greenpremixextaqii10μl,10μmol/l上下游引物各0.5μl,dna模板2μl,使用depc水补足至20μl。
采用两步法进行荧光定量pcr扩增,pcr反应条件为:95℃3min;95℃10s,58-61℃1min,40个循环;
72℃延伸2min,在退火阶段根据荧光信号积累确定cq值,在扩增条件后增加65℃至95℃,进行融解曲线分析,每个样本三个平行。
进行荧光定量pcr后得到每个浓度的cq值,以拷贝数log10值和cq值制作细菌悬液的标准曲线,e=99.1%r2=0.999(图1),说明本发明建立的检测方法可以准确定量待测样品中的雷氏普罗威登斯菌。
4、检测待测样品中的雷氏普罗威登斯菌
a、采用细菌基因组提取试剂盒提取待测细菌样品dna;
b、以步骤a中所提取的dna为模板,采用荧光定量pcr方法扩增雷氏普罗威登斯菌,体系为greenpremixextaqii10μl,10μmol/l上下游引物各0.5μl,dna模板2μl,使用depc水补足至20μl。
采用两步法进行荧光定量pcr扩增,pcr反应条件为:95℃3min;95℃10s,58-61℃1min,40个循环;
72℃延伸2min,在退火阶段根据荧光信号积累确定cq值,在扩增条件后增加65℃至95℃,进行融解曲线分析;
c、实验结果判定标准:若阴性对照品无cq值,且无规则扩增曲线,同时cq值应在15-35之间,扩增曲线规则,判断为阳性,并将所得cq值在步骤c中所得标准曲线上确定样品中雷氏普罗威登斯菌的数量;反之,判断为阴性。
二、灵敏度试验
灵敏度检测采用最佳反应条件,对雷氏普罗维登斯菌提取dna进行10倍梯度稀释出各梯度作为dna模板,进行荧光定量pcr反应。
以10倍梯度稀释的标准品为模板,进行荧光定量pcr检测,结果显示其灵敏度可达到1.07×102拷贝/反应,最大cq值为33.55,如图2所示。
同时将所稀释的标准品,进行普通pcr检测,将所获得的pcr产物用1%琼脂糖凝胶电泳分析,结果如图3所示,表明本发明一种雷氏普罗威登斯菌的荧光定量pcr检测方法敏感性更高。
三、特异性试验
选择也含有rtxd基因的细菌,可以充分证明本发明一种雷氏普罗威登斯菌的检测引物的特异性。以鲍氏不动杆菌、弗氏柠檬酸杆菌、副溶血弧菌、维氏气单胞菌、嗜水气单胞菌(天津市水产生态及养殖重点实验室保存)的dna作为模板,作为阴性对照,进行荧光定量pcr反应,从而验证引物的特异性。
用本发明检测方法检测了鲍氏不动杆菌、弗氏柠檬酸杆菌、副溶血弧菌、维氏气单胞菌、嗜水气单胞菌,结果显示,仅雷氏普罗威登斯菌出现特异性扩增,而其它菌与阴性对照均无扩增曲线,如图4所示。
四、使用本发明提供的氏普罗威登斯菌的检测引物及荧光定量pcr检测方法检测患败血症而死亡的巴西龟,以确定是否为雷氏普罗威登斯菌感染。
具体方法如下:
1、提取细菌dna
无菌操作取病龟脾脏,使用无菌生理盐水清洗后,用组织研磨器匀浆,采用细菌提取试剂盒提取dna。
2、以步骤1所提取的dna为模板,利用荧光定量pcr扩增rtxd基因部分片段;
pcr反应体系为greenpremixextaqii10μl,10μmol/l上下游引物0.5μl,dna模板2μl,使用depc水补足至20μl。其中上下游引物核苷酸序列见步骤一。
采用两步法进行荧光定量pcr扩增,pcr反应条件为:95℃3min;95℃10s,58-61℃1min,40个循环;72℃延伸2min,在退火阶段根据荧光信号积累确定cq值,在扩增条件后增加65℃至95℃,进行融解曲线分析。
3、检测结果判定:参照实施例1中所建立的标准曲线,对照标准曲线,确定是否为雷氏普罗威登斯菌感染。
在对病龟的检测中,cq值平均为22.52(如图5所示),判定为雷氏普罗威登斯菌感染。由此可见,本发明可用于雷氏普罗威登斯菌感染检测,对保障动物健康安全具有重要意义。
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
序列表
<110>天津农学院
<120>一种雷氏普罗威登斯菌rtxd基因引物及荧光定量pcr检测方法和应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna/rna
<213>rd-f(unknown)
<400>1
ccaccgtcttacttggcact20
<210>2
<211>20
<212>dna/rna
<213>rd-r(unknown)
<400>2
taccttgcgtggttgcttga20
- 还没有人留言评论。精彩留言会获得点赞!