一种GLP-1类似物的纯化方法与流程
一种glp-1类似物的纯化方法
技术领域
1.本发明属于纯化方法技术领域,具体涉及一种glp-1类似物的纯化方法。
背景技术:
2.胰高血糖素样肽-1,简称glp-1,是回肠内分泌细胞分泌的一种脑肠肽,是目前2型糖尿病药物作用的重要靶点之一。glp-1具有抑制胃排空和减少肠胃蠕动的效果,因此有助于饮食控制和减轻体重。由于天然的glp-1容易被人体内的二肽基肽酶iv(dpp-iv)降解,因此,制药企业开发了多种glp-1类似物,如索玛鲁肽、利拉鲁肽等。
3.由于glp-1类似物的肽链较长,且可能会经过侧链修饰,因此在化学合成的过程中会产生较多的杂质,如异构体杂质、氨基酸缺失或增加杂质、副反应杂质等。目前对于化学合成的glp-1类似物,主要是通过两步或以上的反相色谱纯化,才能制备得到纯度≥99.0%、单杂≤0.15%的精肽。例如,专利cn 106749613a采用三步反相纯化、专利cn 108640985a采用两步反相纯化得到索玛鲁肽精肽,专利cn 107903318a和专利cn 109438569a均采用两步反相纯化得到利拉鲁肽精肽。反相色谱固然有很强的分离能力,但同时也伴随着大量有机溶剂的使用和有机废液的产生,其在环境污染、废液回收处理和生产成本等方面并不占优势。
4.在本发明中,第一步先采用阴离子交换进行纯化,第二步再采用反相色谱进行纯化,可得到纯度≥99.0%、单杂≤0.15%的索玛鲁肽和利拉鲁肽。第一步的阴离子交换纯化,载量大,实现对目标物富集的同时,与第二步的反相纯化形成互补,除去了反相纯化时难除的氨基酸缺失杂质;此外,阴离子交换纯化时无需使用有机溶剂,在降低生产和废液处理成本的同时,也更为环保。第二步再采用高分辨率的反相色谱纯化,最终得到纯度≥99.0%、单杂≤0.15%的索玛鲁肽和利拉鲁肽。
技术实现要素:
5.为了解决上述背景技术中所提出的问题,本发明的目的在于提供一种glp-1类似物的纯化方法。在本发明中,第一步纯化时,采用的是更为环保、溶剂成本更低、载量更大的阴离子交换纯化技术,实现了对目标物富集的同时,与反相色谱技术形成了互补,去除了反相纯化时难除的氨基酸缺失杂质,同时降低了成本和环保压力;第二步纯化时,再采用高分辨率的反相纯化技术,去除阴离子交换纯化无法除去的异构体杂质和副反应杂质等,最终得到纯度≥99.0%、单杂≤0.15%的索玛鲁肽和利拉鲁肽。
6.为了达到上述目的,本发明所采用的技术方案为:一种glp-1类似物的纯化方法,包括以下步骤:
7.1)采用阴离子交换对glp-1类似物进行纯化;
8.2)采用反相色谱对1)所得纯化物质进行纯化。
9.进一步地,步骤1)前还包括将glp-1类似物溶解并过滤。
10.进一步地,所述glp-1类似物溶解所用的溶剂为tris、磷酸氢二钾、磷酸氢二钠、磷
酸氢二铵、碳酸氢铵、醋酸铵中的一种,浓度为10~30mm,ph为7~9。
11.进一步地,所述glp-1类似物为索玛鲁肽或利拉鲁肽。
12.进一步地,所述阴离子交换纯化采用的是强阴离子交换填料,粒径10~30μm,孔径
13.进一步地,所述阴离子交换纯化时,缓冲盐体系为tris、磷酸氢二钾、磷酸氢二钠、磷酸氢二铵、碳酸氢铵、醋酸铵中的一种,浓度为10~30mm,ph为7~9;洗脱时用的盐为nacl,洗脱梯度为0~1.0m。通常用的是缓冲盐体系对应的酸或碱来调节ph。
14.进一步地,所述ph采用盐酸、磷酸、甲酸、醋酸、氢氧化钾、氢氧化钠、氨水中的一种或两种来调节。
15.进一步地,所述阴离子交换纯化为:用缓冲盐体系作为平衡液,平衡强阴离子交换柱5个cv;平衡后,上样;上样后,先用平衡液洗脱5个cv,再用平衡液和含1.0m nacl的平衡液进行线性梯度洗脱,含1.0m nacl的平衡液的洗脱梯度从0~100%。
16.进一步地,所述反相色谱采用的是c8反相填料,粒径10μm,孔径
17.进一步地,所述反相色谱纯化的有机相为乙腈,水相为0.05~0.15%(v/v)磷酸,有机相的洗脱梯度为23~51%。
18.本发明的有益效果为:
19.(1)第一步用离子交换纯化,载量大于传统的反相纯化,可对目标物进行富集。
20.(2)第一步用离子交换纯化,不必使用有机溶剂,不产生有机废液,更为环保;使用的是盐类进行洗脱,更为环保,价格更低。
21.(3)离子交换纯化与反相纯化形成互补,去除部分反相纯化时难除的氨基酸缺失杂质;再经过反相纯化,得到纯度≥99.0%、单杂≤0.15%的精肽。
附图说明
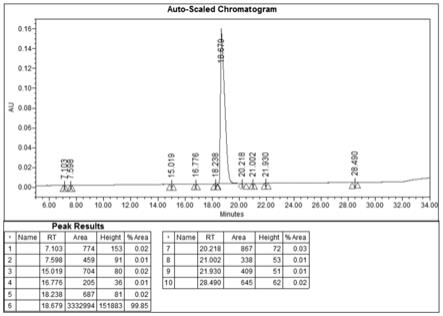
22.图1是实施例1中索玛鲁肽精肽色谱图;
23.图2是实施例1中索玛鲁肽精肽质谱图;
24.图3是实施例2中索玛鲁肽精肽色谱图;
25.图4是实施例2中索玛鲁肽精肽质谱图;
26.图5是实施例3中索玛鲁肽精肽色谱图;
27.图6是实施例3中索玛鲁肽精肽质谱图;
28.图7是实施例4中利拉鲁肽精肽色谱图;
29.图8是实施例4中利拉鲁肽精肽质谱图;
30.图9是实施例5中利拉鲁肽精肽色谱图;
31.图10是实施例5中利拉鲁肽精肽质谱图;
32.图11是实施例6中利拉鲁肽精肽色谱图;
33.图12是实施例6中利拉鲁肽精肽质谱图;
34.图13是对比例1中索玛鲁肽精肽色谱图;
35.图14是对比例1中索玛鲁肽精肽质谱图;
36.图15是对比例2中利拉鲁肽精肽色谱图;
37.图16是对比例2中利拉鲁肽精肽质谱图。
具体实施方式
38.为了更好地理解本发明的内容,下面结合具体实施方法对本发明内容作进一步说明,但本发明的保护内容不局限以下实施例。
39.说明书和权利要求书中所使用的缩写的含义列于下表中:
40.缩写及英文含义glp-1胰高血糖素样肽-1dpp-iv二肽基肽酶ivhis组氨酸aib氨基异丁酸ala丙氨酸cv柱体积
41.实施例1:索玛鲁肽纯化
42.样品处理:用20mm、ph=8.5的tris缓冲液(hcl调ph)溶解索玛鲁肽粗肽,浓度约为20mg/ml;用孔径为0.45μm的微孔滤膜过滤后,待纯化。
43.第一步纯化:用20mm、ph=8.5的tris缓冲液(hcl调ph)作为平衡液a相,用含1.0m nacl的a相作为b相;100%的a相平衡强阴离子交换柱(10*150mm,15μm,)5个cv;平衡后,上样,上样量为0.5g;上样后,先用100%的a相洗脱5个cv,再用a相和b相进行线性梯度洗脱(b相从0~100%,洗脱50min),流速为5.0ml/min,检测波长280nm;收集主峰,即得索玛鲁肽的第一步纯化馏分。
44.第二步纯化:以第一步纯化馏分为样品,以八烷基硅烷键合硅胶填料为固定相(20*250mm,10μm,),以0.15%磷酸为水相、乙腈为有机相,进行梯度线性洗脱(有机相23~43%,洗脱时间60min),流速20ml/min,检测波长280nm。收集目标峰,得到的索玛鲁肽纯度≥99.0%、单杂≤0.15%,其中des-his1、des-aib2和des-his
1-aib2杂质均≤0.05%,纯化收率55.81%。索玛鲁肽精肽色谱图如图1所示,索玛鲁肽精肽质谱图如图2所示。
45.实施例2:索玛鲁肽纯化
46.样品处理:用10mm、ph=8.0的磷酸氢二铵缓冲液(氨水和磷酸调ph)溶解索玛鲁肽粗肽,浓度约为15mg/ml;用孔径为0.45μm的微孔滤膜过滤后,待纯化。
47.第一步纯化:用10mm、ph=8.0的磷酸氢二铵缓冲液(氨水和磷酸调ph)作为平衡液a相,用含1.0m nacl的a相作为b相;100%的a相平衡强阴离子交换柱(10*150mm,30μm,)5个cv;平衡后,上样,上样量为0.4g;上样后,先用100%的a相洗脱5个cv,再用a相和b相进行线性梯度洗脱(b相从0~100%,洗脱40min),流速为5.0ml/min,检测波长280nm;收集主峰,即得索玛鲁肽的第一步纯化馏分。
48.第二步纯化:以第一步纯化馏分为样品,以八烷基硅烷键合硅胶填料为固定相(20*250mm,10μm,),以0.10%磷酸为水相、乙腈为有机相,进行梯度线性洗脱(有机相25~45%,洗脱时间80min),流速20ml/min,检测波长280nm。收集目标峰,得到的索玛鲁肽纯度≥99.0%、单杂≤0.15%,其中des-his1、des-aib2和des-his
1-aib2杂质均≤0.05%,纯化收率54.74%。索玛鲁肽精肽色谱图如图3所示,索玛鲁肽精肽质谱图如图4所示。
49.实施例3:索玛鲁肽纯化
50.样品处理:用15mm、ph=7.5的磷酸氢二钠缓冲液(氢氧化钠和磷酸调ph)溶解索玛鲁肽粗肽,浓度约为25mg/ml;用孔径为0.45μm的微孔滤膜过滤后,待纯化。
51.第一步纯化:用15mm、ph=7.5的磷酸氢二钠缓冲液(氢氧化钠和磷酸调ph)作为平衡液a相,用含1.0m nacl的a相作为b相;100%的a相平衡强阴离子交换柱(10*150mm,10μm,)5个cv;平衡后,上样,上样量为0.6g;上样后,先用100%的a相洗脱5个cv,再用a相和b相进行线性梯度洗脱(b相从0~100%,洗脱60min),流速为5.0ml/min,检测波长280nm;收集主峰,即得索玛鲁肽的第一步纯化馏分。
52.第二步纯化:以第一步纯化馏分为样品,以八烷基硅烷键合硅胶填料为固定相(20*250mm,10μm,),以0.05%磷酸为水相、乙腈为有机相,进行梯度线性洗脱(有机相26~46%,洗脱时间100min),流速20ml/min,检测波长280nm。收集目标峰,得到的索玛鲁肽纯度≥99.0%、单杂≤0.15%,其中des-his1、des-aib2和des-his
1-aib2杂质均≤0.05%,纯化收率55.29%。索玛鲁肽精肽色谱图如图5所示,索玛鲁肽精肽质谱图如图6所示。
53.实施例4:利拉鲁肽纯化
54.样品处理:用25mm、ph=7.0的磷酸氢二钾缓冲液(氢氧化钾和磷酸调ph)溶解利拉鲁肽粗肽,浓度约为20mg/ml;用孔径为0.45μm的微孔滤膜过滤后,待纯化。
55.第一步纯化:用25mm、ph=7.0的磷酸氢二钾缓冲液(氢氧化钾和磷酸调ph)作为平衡液a相,用含1.0m nacl的a相作为b相;用100%的a相平衡强阴离子交换柱(10*150mm,30μm,)5个cv;平衡后,上样,上样量为0.4g;上样后,先用100%的a相洗脱5个cv,再用a相和b相进行线性梯度洗脱(b相从0~100%,洗脱50min),流速为5.0ml/min,检测波长280nm;收集主峰,即得利拉鲁肽的第一步纯化馏分。
56.第二步纯化:以第一步纯化馏分为样品,以八烷基硅烷键合硅胶填料为固定相(20*250mm,10μm,),以0.10%磷酸为水相、乙腈为有机相,进行梯度线性洗脱(有机相29~49%,洗脱时间80min),流速20ml/min,检测波长280nm。收集目标峰,得到的利拉鲁肽纯度纯度≥99.0%、单杂≤0.15%,其中des-his1和des-his
1-ala2杂质均≤0.05%,纯化收率53.85%。利拉鲁肽精肽色谱图如图7所示,利拉鲁肽精肽质谱图如图8所示。
57.实施例5:利拉鲁肽纯化
58.样品处理:用30mm、ph=9.0的碳酸氢铵缓冲液(氨水和甲酸调ph)溶解利拉鲁肽粗肽,浓度约为25mg/ml;用孔径为0.45μm的微孔滤膜过滤后,待纯化。
59.第一步纯化:用30mm、ph=9.0的碳酸氢铵缓冲液(氨水和甲酸调ph)作为平衡液a相,用含1.0m nacl的a相作为b相;用100%的a相平衡强阴离子交换柱(10*150mm,15μm,)5个cv;平衡后,上样,上样量为0.5g;上样后,先用100%的a相洗脱5个cv,再用a相和b相进行线性梯度洗脱(b相从0~100%,洗脱70min),流速为5.0ml/min,检测波长280nm;收集主峰,即得利拉鲁肽的第一步纯化馏分。
60.第二步纯化:以第一步纯化馏分为样品,以八烷基硅烷键合硅胶填料为固定相(20*250mm,10μm,),以0.15%磷酸为水相、乙腈为有机相,进行梯度线性洗脱(有机相28~48%,洗脱时间90min),流速20ml/min,检测波长280nm。收集目标峰,得到的利拉鲁肽纯度纯度≥99.0%、单杂≤0.15%,其中des-his1和des-his
1-ala2杂质均≤0.05%,纯化收率53.20%。利拉鲁肽精肽色谱图如图9所示,利拉鲁肽精肽质谱图如图10所示。
61.实施例6:利拉鲁肽纯化
62.样品处理:用20mm、ph=8.5的醋酸铵缓冲液(醋酸和氨水调ph)溶解利拉鲁肽粗肽,浓度约为15mg/ml;用孔径为0.45μm的微孔滤膜过滤后,待纯化。
63.第一步纯化:用20mm、ph=8.5的醋酸铵缓冲液(醋酸和氨水调ph)作为平衡液a相,用含1.0m nacl的a相作为b相;用100%的a相平衡强阴离子交换柱(10*150mm,10μm,)5个cv;平衡后,上样,上样量为0.6g;上样后,先用100%的a相洗脱5个cv,再用a相和b相进行线性梯度洗脱(b相从0~100%,洗脱60min),流速为5.0ml/min,检测波长280nm;收集主峰,即得利拉鲁肽的第一步纯化馏分。
64.第二步纯化:以第一步纯化馏分为样品,以八烷基硅烷键合硅胶填料为固定相(20*250mm,10μm,),以0.05%磷酸为水相、乙腈为有机相,进行梯度线性洗脱(有机相31~51%,洗脱时间100min),流速20ml/min,检测波长280nm。收集目标峰,得到的利拉鲁肽纯度纯度≥99.0%、单杂≤0.15%,其中des-his1和des-his
1-ala2杂质均≤0.05%,纯化收率52.88%。利拉鲁肽精肽色谱图如图11所示,利拉鲁肽精肽质谱图如图12所示。
65.对比实施例1:
66.与实施例1~3不同之处主要在于,第一步采用的是反相色谱进行纯化。
67.样品处理:用0.4%的氨水溶液溶解索玛鲁肽粗肽,浓度约为20mg/ml;用孔径为0.45μm的微孔滤膜过滤后,待纯化。
68.第一步纯化:以索玛鲁肽粗肽溶液为样品,以八烷基硅烷键合硅胶填料为固定相(20*250mm,10μm,),以0.05%三氟乙酸为水相、乙腈为有机相,上样量为0.3g,进行梯度线性洗脱(有机相31~51%,洗脱时间50min),流速20ml/min,检测波长280nm;收集主峰,即得索玛鲁肽的第一步纯化馏分。
69.第二步纯化:以第一步纯化馏分为样品,以八烷基硅烷键合硅胶填料为固定相(20*250mm,10μm,),以0.15%磷酸为水相、乙腈为有机相,进行梯度线性洗脱(有机相23~43%,洗脱时间60min),流速20ml/min,检测波长280nm。收集目标峰,得到的索玛鲁肽纯度≥99.0%、单杂≤0.15%,其中des-his1、des-aib2和des-his
1-aib2杂质分别为0.08%、0.06%和0.12%,纯化收率52.66%。索玛鲁肽精肽色谱图如图13所示,索玛鲁肽精肽质谱图如图14所示。
70.对比实施例2:
71.与实施例4~6不同之处在于,第一步采用的是反相色谱进行纯化。
72.样品处理:用0.5%的氨水溶液溶解利拉鲁肽粗肽,浓度约为20mg/ml;用孔径为0.45μm的微孔滤膜过滤后,待纯化。
73.第一步纯化:以利拉鲁肽粗肽溶液为样品,以八烷基硅烷键合硅胶填料为固定相(20*250mm,10μm,),以0.10%三氟乙酸为水相、乙腈为有机相,上样量为0.3g,进行梯度线性洗脱(有机相37~57%,洗脱时间60min),流速20ml/min,检测波长280nm;收集主峰,即得利拉鲁肽的第一步纯化馏分。
74.第二步纯化:以第一步纯化馏分为样品,以八烷基硅烷键合硅胶填料为固定相(20*250mm,10μm,),以0.10%磷酸为水相、乙腈为有机相,进行梯度线性洗脱(有机相29~49%,洗脱时间80min),流速20ml/min,检测波长280nm。收集目标峰,得到的利拉鲁肽
纯度纯度≥99.0%、单杂≤0.15%,其中des-his1和des-his
1-ala2杂质分别为0.06%和0.11%,纯化收率51.34%。利拉鲁肽精肽色谱图如图15所示,利拉鲁肽精肽质谱图如图16所示。
75.对比例3:索玛鲁肽纯化(cn 106749613a)
76.对比例3中的实施例,采用三步反相色谱进行纯化,得到的索玛鲁肽精肽纯度和最大单杂为:98.86%/0.40%。
77.对比例4:利拉鲁肽纯化(cn 109438569a)
78.对比例4中的两个实施例,均采用两步反相色谱进行纯化,得到的利拉鲁肽精肽纯度和最大单杂为:99.48%/0.18%和99.40%/0.25%。
79.以上所述仅为本发明的具体实施方式,不是全部的实施方式,本领域普通技术人员通过阅读本发明说明书而对本发明技术方案采取的任何等效的变换,均为本发明的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1