杂环亚砜亚胺化合物及其中间体、制备方法和应用与流程
1.本发明涉及药物化学领域,具体涉及一种杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物,用于合成该化合物的中间体化合物及其制备方法,以及包含该化合物的药物组合物及其应用。
背景技术:
2.ret是一种酪氨酸受体激酶,属于胶质细胞源性神经营养因子(gdnf)家族,是神经系统和其它几个组织发育必需的激酶。它的丧失功能突变(loss of function mutations)导致hirschsprung病,而它的获得功能突变(gain of function mutations)则与多种人类肿瘤有关。
3.ret激酶容易发生突变和与其它伴侣(partners)形成融合蛋白。ret点突变主要发生在多发性内分泌肿瘤(men2a和men2b)和甲状腺髓样癌(mtc)中,而ret融合蛋白主要发生在乳头状甲状腺癌和非小细胞肺癌中。目前,在乳头状甲状腺癌中,与ret形成融合蛋白的伴侣有十几种之多,主要包括ret-ccdc6和ret-ncoa4。在非小细胞肺癌中的融合蛋白主要为ret-kif5b。
4.在一项包括多种肿瘤的4,871例病人样品研究(s.kato et al.clin.cancer res.2017,23,1988-1997)中发现,ret总变异率大约1.8%,主要的变异为三种:突变(mutation:38.6%)、融合(fusion:30.7%)和扩增(amplification:25%)。主要突变体为ret(m918t),发生在甲状腺髓样癌(mtc)中。其中,散发性mtc中ret突变>60%,遗传性mtc中ret突变>90%。ret融合蛋白(ret-kif5b、ret-ccdc6和ret-ncoa4)发生率:非小细胞肺癌:2%,甲状腺乳头状癌及其他甲状腺癌中:10-20%。ret扩增发生率:输卵管腺癌:8.3%,子宫癌肉瘤:5.3%,十二指肠腺癌:5%。
5.除了上面提到的ret突变体和融合蛋白以外,还有许多此类突变体和融合蛋白包括,但不限于这些突变体和融合蛋白包括但不限于ret(a883f)、ret(e762q)、ret(g691s)、ret(l790f)、ret(r749t)、ret(r813q)、ret(r912p)、ret(s891a)、ret(s904a)、ret(s904f)、ret(v804m)、ret(v778i)、ret(v804e)、ret(v804l)、ret(g810r)-kif5b、ret(v804l)-kif5b、ret(v804m)-kif5b、ret(y791f)、ret(y806h)、ret-bcr、ret-kif5b(kex15rex14)、ret-prkar1a(ptc2)等。
6.由于ret突变体和融合蛋白在多种人类肿瘤中扮演重要角色,研发针对这些生物靶点的抑制剂具有临床意义。实际上,近几年美国fda已经批准几款包含ret靶点的多激酶抑制剂(multikinase inhibitors)用于肿瘤的治疗(r.roskoski,jr.and a.sadeghi-nejad,pharmacol.res.2018,128,1-17),例如,卡博替尼(cabozantinib)和凡德他尼(vandetanib)用于甲状腺髓样癌(mtc)的治疗;来伐替尼(lenvatinib)和索拉非尼(sorafenib)用于分化型甲状腺癌的治疗。尽管包含ret靶点的多激酶抑制剂已经被批准临床使用,高选择性的ret抑制剂尚未被批准临床使用,blu-667和loxo-292等选择性ret抑制剂目前正在进行临床试验。
7.s.w.andrews et al报道了一类取代吡唑并[1,5-a]吡啶化合物作为ret抑制剂(wo2017/011776,wo2018/071447,wo2018/071454)。
[0008]
s.w.andrews et al报道了一类取代吡唑并[1,5-a]吡嗪化合物作为ret抑制剂(wo2018/136661)。
[0009]
j.d.brubaker and colleagues报道了一类环己基取代嘧啶化合物作为ret抑制剂(wo2017/079140)。
[0010]
h.inagaki and colleagues报道了一类取代吡啶化合物作为ret抑制剂(wo2018/060714)。
[0011]
m.p.demartino et al报道了一类取代吡啶基吡啶酮化合物作为ret抑制剂(wo2017/145050)。
[0012]
尽管ret、ret突变体或ret融合蛋白抑制剂研发取得良好的进展,目前还没有批准用于临床治疗肿瘤的高选择性ret、ret突变体及/或ret融合蛋白抑制剂。本发明的目的之一就是公开一类具有潜在临床应用价值的ret、ret突变体及/或ret融合蛋白高选择性抑制剂。
技术实现要素:
[0013]
本发明的目的是提供一种具有ret、ret突变体或ret融合蛋白抑制活性的杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物,及其制备方法。
[0014]
本发明另一个目的是提供一种含有上述杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物的药物组合物,及上述杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物,以及药物组合物在治疗因ret、ret突变体或ret融合蛋白异常活性所引起的疾病中的应用。
[0015]
本发明还有一个目的是提供一种用于合成上述杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物的中间体化合物及其制备方法。
[0016]
为实现上述目的,本发明采用如下技术方案:
[0017]
一种杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物,该化合物分子结构式如式(i)所示:
[0018][0019]
式中:
[0020]
cy为(ia)或(ib):
[0021][0022]
*代表cy与式(i)所示分子结构中其余部分的连接点;
[0023]
x为n或c-r;
[0024]
y1、y2、y3和y4相同或不同,各自独立地代表n或c-r';
[0025]
z为n或c-r”;
[0026]
r、r'或r”相同或不同,各自独立地选自氢、氘、卤素、cn、or
a
、nr
b
r
c
、s(=o)
w
r
d
、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基;r、r'或r”中的一个或多个氢可任选地被相同或不同的氘、卤素、cn、no2、oh、och3、ocf3或cf3取代;
[0027]
r1和r2相同或不同,各自独立地选自一个或两个相同或不同的氢、氘、卤素、cn、no2、or
a
、nr
b
r
c
、s(=o)
w
r
d
、co2r
e
、conr
b
r
c
、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基,c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基,其中所述c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基,c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基中的一个或多个氢可任选地被相同或不同的g1取代;
[0028]
r3选自氢、氘、s(=o)
w
r
d
、s(=o)
w
nr
f
r
g
、c(=o)r
h
、c(=o)nr
i
r
j
、c(=o)or
k
、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基;r3中的一个或多个氢可任选地被相同或不同的g2取代;
[0029]
r4和r5相同或不同,各自独立地选自氢、氘、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基;当r4和r5代表两个相同或不同的c
1-12
烷基时,所述两个相同或不同的c
1-12
烷基可彼此相连,并与它们共同连接的s原子一起形成一个杂脂环,所述杂脂环可任选地包含一个或多个额外的o、n或s(=o)
w
杂原子;r4和r5中的一个或多个氢可任选地被相同或不同的g3取代;
[0030]
r
a
、r
b
、r
c
、r
d
、r
e
、r
f
、r
g
、r
h
、r
i
、r
j
或r
k
各自独立地选自氢、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基;r
a
、r
b
、r
c
、r
d
、r
e
、r
f
、r
g
、r
h
、r
i
、r
j
或r
k
中的一个或多个氢可任选地被相同或不同的g4取代;
[0031]
r
b
和r
c
相同或不同,当r
b
和r
c
代表连接在同一氮原子上的两个相同或不同的c
1-12
烷基时,所述两个相同或不同的c
1-12
烷基可任选地彼此相连,并与该氮原子一起形成一个杂脂环,所述杂脂环可任选地包含一个或多个额外的o、n或s(=o)
w
杂原子;
[0032]
r
f
和r
g
相同或不同,当r
f
和r
g
代表连接在同一氮原子上的两个相同或不同的c
1-12
烷基时,所述两个相同或不同的c
1-12
烷基可任选地彼此相连,并与该氮原子一起形成一个杂脂环,所述杂脂环可任选地包含一个或多个额外的o、n或s(=o)
w
杂原子;
[0033]
r
i
和r
j
相同或不同,当r
i
和r
j
代表连接在同一氮原子上的两个相同或不同的c
1-12
烷基时,所述两个相同或不同的c
1-12
烷基可任选地彼此相连,并与该氮原子一起形成一个杂脂环,所述杂脂环可任选地包含一个或多个额外的o、n或s(=o)
w
杂原子;
[0034]
g1、g2、g3和g4相同或不同,各自独立地选自一个或多个相同或不同的氘、卤素、cn、no2、oh、ocf3、cf3、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基、c
5-12
杂芳基、r6o-、r7r8n-、r6s(=o)
w-、r7r8ns(=o)
w-、r6c(=o)-、r7r8nc(=o)-、r6oc(=o)-、r6c(=o)o-、r7r8nc(=o)o-、r6c(=o)nr
9-、r7r8nc(=o)nr
9-、r6oc(=o)nr
9-、r6s(=o)
w
nr
9-、r7r8ns(=o)
w
nr
9-、r7r8nc(=nr
10
)nr
9-、r7r8nc(=chno2)nr
9-、r7r8nc(=n-cn)nr
9-、r7r8nc(=nr
10
)-、r6s(=o)(=nr
10
)nr
9-或r7r8ns(=o)(=nr
10
)-,其中所述c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基中的一个或多个氢可任选地被相同或不同的氘、卤素、cn、no2、oh、ocf3、cf3、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基、c
5-12
杂芳基、r6o-、r7r8n-、r6s(=o)
w-、r7r8ns(=o)
w-、r6c(=o)-、r7r8nc(=o)-、r6oc(=o)-、r6c(=o)o-、r7r8nc(=o)o-、r6c(=o)nr
9-、r7r8nc(=o)nr
9-、r6oc(=o)nr
9-、r6s(=o)
w
nr
9-、r7r8ns(=o)
w
nr
9-、r7r8nc(=nr
10
)nr
9-、r7r8nc(=chno2)nr
9-、r7r8nc(=n-cn)nr
9-、r7r8nc(=nr
10
)-、r6s(=o)(=nr
10
)nr
9-或r7r8ns(=o)(=nr
10
)-取代;
[0035]
r6、r7、r8、r9和r
10
相同或不同,各自独立地选自氢、氘、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基;当r7和r8为连接在同一氮原子上的两个相同或不同的c
1-12
烷基时,所述两个相同或不同的c
1-12
烷基可彼此相连,并与该氮原子一起形成一个杂脂环,所述杂脂环可任选地包含一个或多个额外的o、n或s(=o)
w
杂原子;且r6、r7、r8、r9和r
10
中的一个或多个氢可任选地进一步被相同或不同的氘、卤素、oh、cn、no2、och3、ocf3、c
1-12
烷基或c
3-12
环烷基取代;
[0036]
w为0、1或2。
[0037]
优选地,上述杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物中,所述化合物的结构式为(iia)或(iib):
[0038][0039]
其中,x、y1、y2、y3、y4、r1、r2、r3、r4和r5的定义同上。
[0040]
优选地,上述杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物中,所述化合物的结构式为(iiia)、(iiib)、(iiic)或(iiid):
[0041][0042]
其中,
[0043]
x为n或c-r;
[0044]
y1和y4为相同或不同的n或者c-r';
[0045]
r
a
选自氢、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基;r
a
中的一个或多个氢可任选地被相同或不同的g1取代;
[0046]
r和r'独立地选自氢、氘、卤素、cn、c
1-12
烷基、oh或c
1-12
烷基-o-,所述c
1-12
烷基中的一个或多个氢可任选地被相同或不同的氘、卤素、cn、no2、oh、och3、ocf3或cf3取代;
[0047]
ar代表c
6-12
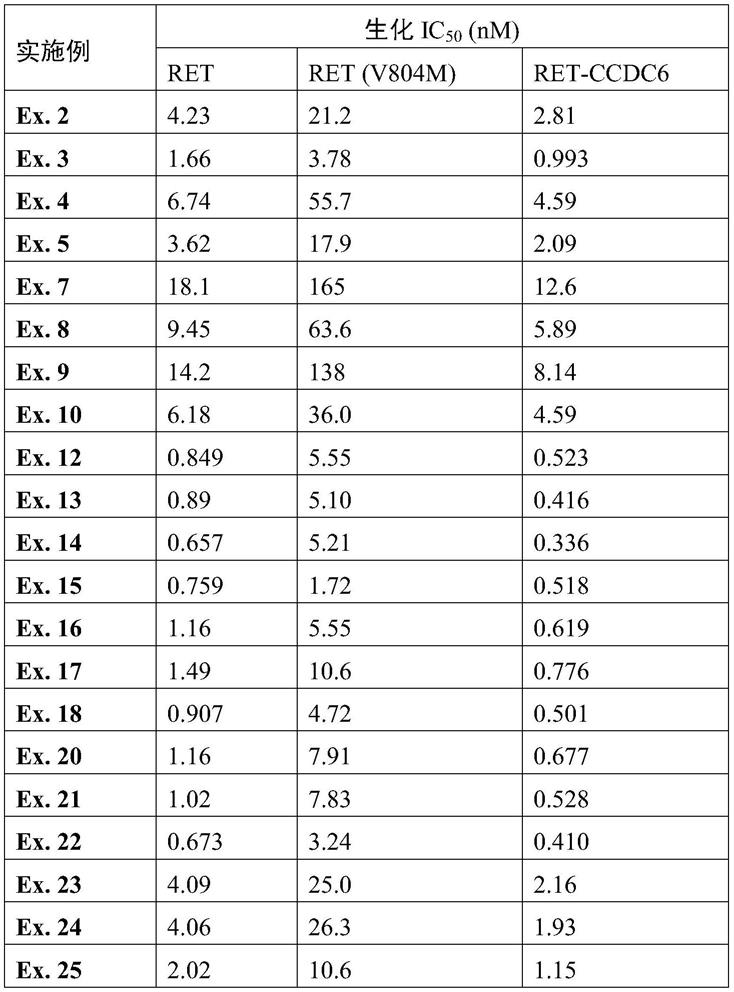
芳基或c
5-12
杂芳基;ar中的一个或多个氢可任选地被相同或不同的g1取代;
[0048]
r3、r4、r5和g1的定义同上。
[0049]
优选地,上述杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物中,所述化合物的结构式为(iva)、(ivb)、(ivc)、(ivd)、(ive)、(ivf)、(ivg)或(ivh):
[0050][0051]
其中,
[0052]
y1代表n或ch;
[0053]
r
a
选自氢、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基;r
a
中的一个或多个氢可任选地被相同或不同的g1取代;
[0054]
ar代表c
6-12
芳基或c
5-12
杂芳基;ar中的一个或多个氢可任选地被相同或不同的g1取代;
[0055]
r3代表氢、氘、c
1-12
烷基、c
2-12
烯基、c
2-12
炔基、c
3-12
环烷基、c
3-12
杂脂环基、c
6-12
芳基、c
5-12
杂芳基、s(=o)
w
r
d
、s(=o)
w
nr
f
r
g
、c(=o)r
h
、c(=o)nr
i
r
j
或c(=o)or
k
;r3中的一个或多个氢可任选地被相同或不同的g2取代;
[0056]
r
d
、r
f
、r
g
、r
h
、r
i
、r
j
或r
k
各自独立地选自氢、氘、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基;r
d
、r
f
、r
g
、r
h
、r
i
、r
j
或r
k
中的一个或多个氢可任选地进一步被相同或不同的氘、卤素、cn、no2、oh、och3、ocf3、c
1-12
烷基或c
3-12
环烷基取代;
[0057]
r
f
和r
g
相同或不同,当r
f
和r
g
代表连接在同一氮原子上的两个相同或不同的c
1-12
烷基时,所述两个相同或不同的c
1-12
烷基可任选地彼此相连,并与该氮原子一起形成一个杂脂环,所述杂脂环可任选地包含一个或多个额外的o、n或s(=o)
w
杂原子;
[0058]
r
i
和r
j
相同或不同,当r
i
和r
j
代表连接在同一氮原子上的两个相同或不同的c
1-12
烷基时,所述两个相同或不同的c
1-12
烷基可任选地彼此相连,并与该氮原子一起形成一个杂脂环,所述杂脂环可任选地包含一个或多个额外的o、n或s(=o)
w
杂原子;
[0059]
r4和r5相同或不同,各自独立地选自氢、氘、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基;当r4和r5各自代表一个相同或不同的c
1-12
烷基时,所述两个c
1-12
烷基可彼此相连,并与它们共同连接的s原子一起形成一个杂脂环,所述杂脂环可任选地包含一个或多个额外的o、n或s(=o)
w
杂原子;r4和r5中的一个或多个氢可任选地被相同或不同的g3取代;
[0060]
w、g1、g2和g3的定义同上。;
[0061]
优选地,上述杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物中,
[0062]
r
a
选自氢、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基;r
a
中的一个或多个氢可任选地被相同或不同的氘、卤素、cn、no2、oh、ch3、och3、ocf3、cf3取代;
[0063]
优选的,r
a
选自氢、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基或c
2-12
炔基;
[0064]
更优选的,r
a
选自氢或c
1-12
烷基。
[0065]
优选地,上述杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物中,
[0066]
ar代表c
6-12
芳基或c
5-12
杂芳基;ar中的一个或多个氢可任选地被相同或不同的氢、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基取代;
[0067]
优选的,ar代表c
5-12
杂芳基;ar中的一个或多个氢可任选地被相同或不同的氢、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基取代;
[0068]
更优选的,ar中的一个或多个氢可任选地被相同或不同的氢或c
1-12
烷基取代。
[0069]
优选地,上述杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物中,
[0070]
r3代表氢、氘、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
5-12
杂芳基或-c(=o)o-c
1-12
烷基;
[0071]
r3中的一个或多个氢可任选地被相同或不同的氘、卤素、cn、no2、oh、ocf3、cf3、c
1-12
烷基-o、c
3-12
环烷基-o、c
3-12
杂脂环基-o、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基、c
5-12
杂芳基或-c(=o)o-c
1-12
烷基取代,其中所述c
1-12
烷基、c
2-12
烯基、c
2-12
炔基、c
3-12
环烷基、c
3-12
杂脂环基、c
6-12
芳基、c
5-12
杂芳基或-c(=o)o-c
1-12
烷基中的一个或多个氢可任选地进一步被相同或不同的氘、卤素、cn、no2、oh、ocf3、cf3、c
1-12
烷基、c
1-12
烷基-o、c
3-12
环烷基-o或c
3-12
杂脂环基-o取代;
[0072]
更优选的,r3代表氢、氘、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
5-12
杂芳基或-c(=o)o-c
1-12
烷基;
[0073]
r3中的一个或多个氢可任选地被相同或不同的氘、c
1-12
烷基-o、c
3-12
环烷基-o、c
3-12
杂脂环基-o、c
1-12
烷基、c
3-12
环烷基、c
6-12
芳基、c
5-12
杂芳基或-c(=o)o-c
1-12
烷基取代,其中所述c
1-12
烷基、c
3-12
环烷基、c
6-12
芳基、c
5-12
杂芳基或-c(=o)o-c
1-12
烷基中的一个或多个氢可任选地进一步被相同或不同的氘、c
1-12
烷基-o、c
3-12
环烷基-o或c
3-12
杂脂环基-o取代。
[0074]
优选地,上述杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物中,
[0075]
r4和r5相同或不同,各自独立地选自c
1-12
烷基或c
6-12
芳基;
[0076]
r4和r5中的一个或多个氢可任选地被相同或不同的氘、卤素、cn、no2、oh、ocf3、cf3、c
1-12
烷基-o、c
3-12
环烷基-o、c
3-12
杂脂环基-o、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基取代,其中所述c
1-12
烷基、c
2-12
烯基、c
2-12
炔基、c
3-12
环烷基、c
3-12
杂脂环基、c
6-12
芳基或c
5-12
杂芳基中的一个或多个氢可任选地进一步被相同或不同的氘、卤素、cn、no2、oh、ocf3、cf3、c
1-12
烷基、c
1-12
烷基-o、c
3-12
环烷基-o或c
3-12
杂脂环基-o取代;
[0077]
优选的,r4和r5相同或不同,各自独立地选自c
1-6
烷基或c6芳基;
[0078]
r4和r5中的一个或多个氢可任选地被相同或不同的氘、卤素、cn、no2、oh、ocf3、cf3、c
1-12
烷基-o、c
3-12
环烷基-o、c
3-12
杂脂环基-o、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基取代,其中所述c
1-12
烷基、c
2-12
烯基、c
2-12
炔基、c
3-12
环
烷基、c
3-12
杂脂环基、c
6-12
芳基或c
5-12
杂芳基中的一个或多个氢可任选地进一步被相同或不同的氘、卤素、cn、no2、oh、ocf3、cf3、c
1-12
烷基、c
1-12
烷基-o、c
3-12
环烷基-o或c
3-12
杂脂环基-o取代。
[0079]
优选地,上述杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物中,所述化合物的结构式是下面任意一种:
[0080]
[0081]
[0082]
[0083]
[0084]
[0085]
[0086]
[0087]
[0088][0089]
本发明还提供用于合成上述杂环亚砜亚胺化合物的中间体化合物,所述中间体化合物的结构式为(va)、(vb)、(vc)、(vd)或(ve):
[0090][0091]
其中:
[0092]
l和t独立地选自氯、溴、碘、f3c-so3、硼酸基团、硼酸酯基团或硼酸盐基团;
[0093]
pg选自氢、(叔丁氧基)c(=o)-、(苄氧基)c(=o)-、(对甲基苄氧基)c(=o)-或苄基;
[0094]
pp为n保护基;
[0095]
r
33
选自氢、(叔丁氧基)c(=o)-、(苄氧基)c(=o)-、(对甲基苄氧基)c(=o)-、苄
基、三氟乙酰基、乙酰基、s(=o)
w
r
d
、s(=o)
w
nr
f
r
g
、c(=o)r
h
、c(=o)nr
i
r
j
、c(=o)or
k
、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基,其中所述c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基,c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基中的一个或多个氢可任选地被相同或不同的g2取代;
[0096]
r
44
和r
55
相同或不同,独立地选自c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基;当r
44
和r
55
代表两个相同或不同的c
1-12
烷基时,所述两个相同或不同的c
1-12
烷基可彼此相连,并与它们共同连接的s原子一起形成一个杂脂环,所述杂脂环可任选地包含一个或多个额外的o、n或s(=o)
w
杂原子;r
44
和r
55
中的一个或多个氢可任选地被相同或不同的g3取代;
[0097]
在结构式(vd)中,当pg为(苄氧基)c(=o)-时,r
44
和r
55
不能同时为甲基;;
[0098]
g2、g3、r
d
、r
f
、r
g
、r
h
、r
i
、r
j
、r
k
和w的定义同上;
[0099]
优选的,所述硼酸基团、硼酸酯基团或硼酸盐基团选自(ho)2b、(ch3o)2b、(ch3ch2o)2b、(异丙基-o)2b、bf3k或bf3na;
[0100]
pp选自boc、cbz、三氟乙酰基、乙酰基、bn或pmb。
[0101]
本发明还提供了上述中间体化合物的一种制备方法,作为一种实施方式,该方法可由scheme a所示的步骤组成:
[0102]
scheme a:
[0103][0104]
其中:
[0105]
起始原料a-1和a-2可购买到;
[0106]
l’选自氯、溴、碘或f3c-so3;
[0107]
m选自硼酸基团、硼酸酯基团或硼酸盐基团;
[0108]
r
3a
选自s(=o)
w
r
d
、s(=o)
w
nr
f
r
g
、c(=o)r
h
、c(=o)nr
i
r
j
、c(=o)or
k
、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基,其中所述c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基中的一个或多个
氢可任选地被相同或不同的g2取代;
[0109]
pp、w、g2、r
d
、r
f
、r
g
、r
h
、r
i
、r
j
和r
k
的定义同上;
[0110]
优选的,m选自(ho)2b、(ch3o)2b、(ch3ch2o)2b、(异丙基-o)2b、bf3k或bf3na;
[0111]
oxidation(氧化反应)使用的氧化试剂包括,但不限于naio4、间氯过氧苯甲酸(mcpba)、h2o2、ch3co3h等;
[0112]
borylation(硼化反应)指将卤素或f3c-so3转化成硼酸、硼酸酯、硼酸盐的反应。反应通常可以通过两种途径进行:(a)卤素-金属交换,然后与有机硼酸酯反应,所述有机硼酸酯包括,但不限于甲基硼酸酯、乙基硼酸酯、异丙酸硼酸酯等;(b)钯催化剂(pd catalyst)存在下与双(频哪醇合)二硼反应生成硼酸酯;
[0113]
deprotection代表从n上脱去保护基,当保护基是boc(即-co2bu-t)时,常用的脱保护试剂包括但不限于hcl、三氟乙酸、h2so4等,当保护基是cbz(即-co2ch2ph)时,常用的脱保护试剂包括但不限于浓hcl、h2+pd/c等,当保护基是bn(即-ch2ph)时,常用的脱保护试剂包括但不限于h2+pd/c、h2+pd(oh)2、h2+pd/c+hcl等,当保护基是pmb(即-ch2c6h
4-och
3-p)时,常用的脱保护试剂包括但不限于三氟乙酸、硝酸铈铵(ceric ammonium nitrate)等;
[0114]
alkylation(烷基化反应)指在亚砜亚胺基的n原子上导入一个烷基,常用两种方法实现:(a)通过亚砜亚胺中间体a-7与烷基卤化物(alkyl halide)或者烷基磺酸酯(alkyl sulfonate)发生亲核取代反应(nucleophilic substitution);(b)通过亚砜亚胺中间体a-7与醛或者酮化合物在还原剂(reducing reagents)发生还原胺化反应(reductive amination),所述还原剂包括,但不限于nabh4、nabh3cn、nab(oac)3h、bh3、bh3.thf、bh3.s(ch3)2、bh3.(2-甲基吡啶)、lialh4、h2+pd/c等;
[0115]
acylation(酰化反应)指在亚砜亚胺基的n原子上导入酰基、磺酰基、脲基、磺酰胺基等的反应,常用如下方法实现:(a)通过亚砜亚胺中间体a-7与与酰氯(acyl chloride)、磺酰氯(sulfonyl chloride)、氨基甲酰氯(carbamoyl chloride)、氨基磺酰氯(sulfamoyl chloride)等反应;(b)通过亚砜亚胺中间体a-7与羧酸在偶联试剂(coupling reagent)存在下发生偶联反应;
[0116]
base、solvent、pd catalyst和coupling reagent的意思见“术语定义”部分。
[0117]
本发明还提供了上述杂环亚砜亚胺化合物的一种制备方法,作为一种实施方式,该方法可由scheme b所示的步骤组成:
[0118]
scheme b:
[0119][0120]
其中:
[0121]
起始原料b-1可通过文献报道的方法合成,所述文献包括,但不限于wo2015017610、wo2017011776、wo2019075092、wo2019075108等;
[0122]
lg2代表氯、溴、碘或f3c-so3;
[0123]
r1、r2、x、pp、m和r
3a
的定义同上;
[0124]
arylation(芳基化反应)指中间体b-4在钯催化剂存在下与芳基卤化物(aryl halide)、杂芳基卤化物(heteroaryl halide)、芳基三氟磺酸酯(aryl triflate)、杂芳基三氟磺酸酯(heteroaryl triflate)反应,或者b-4在在碱(base)存在下与芳基卤化物(aryl halide)或杂芳基卤化物(heteroaryl halide)反应得到产物b-2;
[0125]
suzuki coupling(suzuki偶联反应)是有机化学和药物化学中最常用的化学反应之一,指杂芳基卤化物或三氟磺酸酯b-1在钯催化剂及碱的存在下与硼酸、硼酸酯或者硼酸盐a-9或者a-6反应得到偶联产物的反应。
[0126]
deprotection、alkylation和acylation的意思同上。base、solvent或pd catalyst的意思见“术语定义”部分。
[0127]
本发明还提供了上述中间体化合物的另一种制备方法,作为一种实施方式,该方法可由scheme c所示的步骤组成:
[0128]
scheme c:
[0129][0130]
其中:
[0131]
起始原料c-1、c-2和c-3可购买到;
[0132]
lg1选自氟、氯、溴、碘、h3c-so3、f3c-so3、c6h4so3、p-ch3c6h
4-so3或p-o2nc6h
4-so3;
[0133]
r
4a
和r
5a
相同或不同,独立地选自氢、氘、c
1-12
烷基、c
3-12
环烷基、c
3-12
杂脂环基、c
2-12
烯基、c
2-12
炔基、c
6-12
芳基或c
5-12
杂芳基;当r
4a
和r
5a
代表两个相同或不同的c
1-12
烷基时,所述两个相同或不同的c
1-12
烷基可彼此相连,并与它们共同连接的s原子一起形成一个杂脂环,所述杂脂环可任选地包含一个或多个额外的o、n或s(=o)
w
杂原子;r
4a
和r
5a
中的一个或多个氢可任选地被相同或不同的g3进一步取代;
[0134]
pp、g3、w、deprotection、reductive amination和nucleophilic substitution的定义同上。
[0135]
本发明还提供了上述杂环亚砜亚胺化合物的另一种制备方法,作为一种实施方式,该方法可由scheme d所示的步骤组成:
[0136]
scheme d:
[0137][0138]
其中:
[0139]
起始原料d-1和d-4可购买到;b-1根据文献报道的方法制备;
[0140]
r1、r2、x、lg2、r
4a
、r
5a
、suzuki coupling、nucleophilic substitution和reductive amination的定义同上。
[0141]
本发明还提供包含至少一种上述的杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物的药物组合物。
[0142]
优选的,上述药物组合物中,还包含至少一种药学上可接受的载体或稀释剂。
[0143]
优选的,上述的杂环亚砜亚胺化合物、其消旋体、对映异构体、非对映异构体、药学上可接受的盐、水合物、溶剂合物或前药通过制剂(formulation)过程,与适合的药学上可接受的载体及药学上常用的辅剂制备成利于给药的药物组合物。
[0144]
优选的,上述药物组合物中,所述药物组合物的制剂形式包括:口服剂、注射剂、肛塞剂、鼻孔吸入剂、滴眼剂或皮肤贴剂。
[0145]
优选的,上述药物组合物的各种剂型可以采用医药工业常用的方法制备。例如,混合、溶解、制粒、研磨、乳化、胶囊、糖衣、冷冻干燥、冷冻喷雾等。
[0146]
优选的,上述药物组合物用于治疗哺乳动物,如人类病人,因ret、ret突变体或ret融合蛋白异常活性引起的疾病。
[0147]
优选的,上述的杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物在药物组合物中的含量范围为0.001-100%。该药物组合物施用于包括人在内的哺乳动物的有效剂量为每日每千克体重0.1-500毫克,优化的剂量为每日每千克体重使用0.1-100毫克。在这个有效剂量范围内,本发明中的化合物发挥其抑制ret、ret突变体及/或ret融合蛋白活性及治疗因ret、ret突变体及/或ret融合蛋白活性异常引起的疾病(例如癌症)的药理作用。
[0148]
本发明还提供了上述的杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物,或上述的药物组合物在治疗因ret、ret突变体及/或ret融合蛋白异常活性所引起的疾病中的应用,所述疾病为肿瘤,包括实体瘤和液体瘤。
[0149]
优选的,上述应用中,所述肿瘤选自肺癌、骨癌、胰腺癌、皮肤癌、头颈癌、皮肤或眼内黑素瘤、子宫癌、卵巢癌、直肠癌、结直肠癌、肛门区癌、胃癌、结肠癌、乳腺癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、阴户癌、何杰金病、食道癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、慢性或急性白血病、膀胱癌、肾或输尿管癌、肾癌、肾上腺癌、肾细胞癌、肾盂癌、脑胶质瘤、脑干神经胶质瘤、神经内分泌胶质肿瘤、神经胶质瘤、中枢神经中枢系统(cns)赘生物、脊柱轴肿瘤、垂体腺瘤、胃肠间质肿瘤、结肠直肠癌、非小细胞肺癌、小细胞肺癌、肥大细胞增多症、胶质瘤、肉瘤、淋巴瘤中的一种或任意几种的组合。
[0150]
本发明还提供一种治疗因ret、ret突变体或ret融合蛋白异常活性所引起的疾病的药物,包含任意一种或任意几种上述杂环亚砜亚胺化合物或其在药学上可接受的盐、溶剂合物、前药,或任意一种或任意几种上述杂环亚砜亚胺化合物的消旋体、对映异构体、非对映异构体、或不同对映异构体或非对映异构体按照任意比例的混合物,或其在药学上可接受的盐、溶剂合物或前药。
[0151]
优选的,上述治疗因ret、ret突变体或ret融合蛋白异常活性所引起的疾病的药物中,还包含一种或几种药学上可接受的载体或/及稀释剂。
[0152]
优选的,上述药物的制剂形式如下:
[0153]
(1)口服剂、(2)注射剂、(3)肛塞剂、(4)鼻孔吸入剂、(5)滴眼剂或(6)皮肤贴剂。
[0154]
优选的,上述药物的给药途径可以为:(1)口服:例如片剂、胶囊等;(2)注射:例如静脉注射、皮下注射、肌肉注射、眼球注射、腹腔注射等;(3)肛塞:例如栓剂、凝胶剂等;(4)鼻孔吸入:例如喷雾剂、气雾剂等;(5)滴眼剂;(6)皮肤贴剂。也可使用药物释放系统,例如,脂质体(liposome)、缓释技术、控释技术等,其中优先选用的方法为口服及注射,更优先选用的方法为口服。
[0155]
优选的,上述药物的使用频率依所使用的化合物或其药物组合物及应用的疾病而有所变化,本发明中的药物组合物通常是每日给药1-6次,优化的给药频率为每日给药1-3次。
[0156]
优选的,上述药物的包装和保存和一般西药类似,例如固体剂型的药物可直接装入玻璃、塑料、纸质或金属瓶中,瓶内最好放入干燥剂等以保持药物的质量;液体剂型的药物一般装入玻璃、塑料或金属瓶或软管中;起雾剂型的药物一般装入耐压的附有减压阀等装置的金属或塑料容器中。
[0157]
经过一系列的实验证明,本发明的杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物具有如下有益效果:
[0158]
(1)通过测定本发明中的部分化合物对野生型ret,ret突变体的代表ret(v804m)和ret融合蛋白的代表ret-ccdc6的生化ic
50
值的结果可以看出,本发明的杂环亚砜亚胺化合物对ret、ret突变体及/或ret融合蛋白具有很强的抑制作用;
[0159]
(2)通过测定本发明中的部分化合物对肿瘤细胞lc-2/ad中磷酸化ret(phospho-ret)和磷酸化erk(phospho-erk)的抑制ic
50
值的结果可以看出,本发明的杂环亚砜亚胺化
合物对肿瘤细胞中磷酸化ret和磷酸化erk具有很强的抑制作用;
[0160]
(3)本发明的杂环亚砜亚胺化合物可与其他抗肿瘤药物包括但不限于传统化疗药物、靶向治疗药物或免疫治疗药物共同使用从而起到协同(synergistic)或加合(additive)效应;
[0161]
(4)本发明的杂环亚砜亚胺化合物可以与其他的肿瘤疗法,例如手术、放射线疗法、介入疗法等一同使用。
[0162]
由此可见,本发明的一种杂环亚砜亚胺化合物、其消旋体、对映异构体、药学上可接受的盐或溶剂合物可以作为一种有效治疗因ret、ret突变体及/或ret融合蛋白异常活性所引起的疾病的药物。
[0163]
术语的定义
[0164]
以下为本发明中所涉及的术语定义。
[0165]
根据本领域普通技术人员的公知常识,化学反应多数情况下需要在溶剂中进行,制备本发明的化合物常用的溶剂(solvent)包括但不限于水、甲醇、乙醇、异丙醇、正丙醇、正丁醇、异丁醇、叔丁醇、2-甲氧基乙醇、2,2,2-三氟乙醇、二氯甲烷、1,2-二氯乙烷、氯仿、四氢呋喃、甲基四氢呋喃、二氧六环、1,2-二甲氧基乙烷、乙酸乙酯、乙醚、甲基叔丁基醚、己烷、环己烷、甲苯、乙腈、二甲基亚砜、二甲基甲酰胺、二甲基乙酰胺或这些溶剂中的两种或几种的组合。
[0166]
本发明化合物的制备过程中,有些步骤需要在碱(base)的存在发生反应,所述的碱包括但不限于有机碱,例如,menh2、me2nh、me3n、etnh2、et2nh、et3n、n-prnh2、n-pr2nh、n-pr3n、i-prnh2、i-pr2nh、i-pr3n、n-bunh2、n-bu2nh、n-bu3n、s-bunh2、s-bu2nh、s-bu3n、i-bunh2、i-bu2nh、i-bu3n、t-bunh2、t-bu2nh、t-bu3n、i-pr2net、2-氨基-2-(羟甲基)丙烷-1,3-二醇、环丙胺、二环丙胺、环丁胺、二环丁胺、环戊胺、二环戊胺、环己胺、二环己胺、吡啶、dbu、dabco、四甲基胍、五甲基胍、四乙基胍、五乙基胍、吗啉、1-甲基吗啉、哌啶、1-甲基哌啶、1-乙基哌啶、哌嗪、1-甲基哌嗪、1-乙基哌嗪、1,4-二甲基哌嗪、1,4-二乙基哌嗪、吡咯烷、1-甲基吡咯烷、1-乙基吡咯烷、meona、meok、meoli、etoli、etona、etok、n-proli、n-prona、n-prok、i-proli、i-prona、i-prok、n-buoli、n-buona、n-buok、i-buoli、i-buona、i-buok、s-buoli、s-buona、s-buok、t-buoli、t-buona、t-buok、n-buli、s-buli、t-buli、nan(sime3)2、lin(sime3)2、kn(sime3)2等。所述的碱也包括但不限于无机碱,例如,氨气、氨水、lioh、naoh、koh、rboh、csoh、cs2co3、rb2co3、li2co3、na2co3、k2co3、nahco3、khco3、lif、naf、kf、rbf、csf、k3po3、k2hpo4、kh2po4、na3po3、na2hpo4、nah2po4、li3po3、li2hpo4、lih2po4、nah、lih、kh、rbh、csh、cao、ca(oh)2、ca2co3、ba(oh)2、mgo、mg(oh)2、mg2co3等,或上述碱中的两种或几种的组合。
[0167]
制备本发明的化合物有些步骤需要使用钯催化剂(pd catalyst),所述钯催化剂包括但不限于pd/c、pd(pph3)4、pd2(dba)3、pdcl2、pd(oac)2、pd(o2ccf3)2、pdcl2(dppf)、pdcl2(dppp)、pd(pph3)2cl2、pd(phcn)2cl2、pd(oh)2、ruphos pd g2(cas#:1375325-68-0)、ruphos pd g3(cas#:1445085-77-7)、ruphos pd g4(cas#:1599466-85-9)等的一种或几种组合。
[0168]
化学反应有些情况下需要在偶联试剂(coupling reagent)存在的情况下发生,制备本发明的化合物常用的偶联试剂(coupling reagent)包括但不限于dcc、edc、hatu、tbtu、pybop、hctu、bop、t3p、dic、hobt、hoat、cdi、depbt、comu的一种或几种组合等。
[0169]
制备本发明的化合物的反应通常在室温下进行,但有时需要降低至-78℃或加热至200℃;反应通常在前述的溶剂及温度及常规搅拌条件下进行,但有时需要在微波炉中进行;当使用的碱、试剂、催化剂对水或氧气敏感时,反应需在无水无氧条件下进行,在这种情况下,不能使用质子性溶剂。
[0170]“取代”在本文中是指任何基团由指定取代基单取代或多取代至这种单取代或多取代(包括在相同部位的多重取代)在化学上允许的程度,每个取代基可以位于该基团上任何可利用的位置,其可以通过所述取代基上任何可利用的原子连接。“任何可利用的位置”是指通过本领域已知的方法或本文教导的方法可化学得到,并且不产生过度不稳定的分子的所述基团上的任何位置。当在任何基团上有两个或多个取代基时,每个取代基独立于任何其它取代基而定义,因此可以是相同或不同的。
[0171]
在本说明书的各个位置,本发明化合物的取代基以基团或范围的形式进行公开。这具体意味着本发明包括这样的基团和范围的每个成员或成员中的每个个体的亚组合。如术语“c
1-4
烷基”具体意味着单独公开了甲基、乙基、c3烷基和c4烷基。
[0172]“本发明化合物”(除非另有具体指明)在本文中是指式(i)化合物及其所有纯的和混合的立体异构体、几何异构体、互变异构体、消旋体、对映异构体、非对映异构体、n-氧化物、s-氧化物、溶剂合物、代谢物、前药及同位素标记的化合物和任何药学上可接受的盐,也包括上述化合物可能存在的无定形体(amorphous form)、一种和多种晶型(crystal forms或polymorph),或两种或两种以上不同晶型的混合物。同位素标记使用的同位素包括,但不限于2h、3h、
13
c、
14
c、
15
n、
18
o等。
[0173]“溶剂合物”指本发明所述化合物与化学上常用的溶剂以共价键、氢键、离子键、范德华力、络合、包合等形成的稳定物质,所述的溶剂可以为:甲醇、乙醇、丙醇、丁醇、乙二醇、丙二醇、聚乙二醇、丙酮、乙腈、乙醚、甲基叔丁醚、二甲基亚砜、二甲基甲酰胺、二甲基乙酰胺等。
[0174]“水合物”指溶剂合物,其中的溶剂为水。
[0175]“药学上可接受”表示化合物或组合物在化学上、药理学上和/或毒理学上必须与构成制剂的其它成分和/或用其治疗的哺乳动物相容。
[0176]“前药”指通过化学合成或物理的方法将本发明中的化合物转化为另一种化合物,并将该化合物给予哺乳动物后,在动物体内被转化成本发明所述的化合物。利用“前药”方法通常是为了克服药物分子本身不良或欠佳的物理化学性质或成药性。
[0177]“消旋体(racemates or racemic mixtures)”、“对映异构体(enantiomers)”、“非对映异构体(diasteromers)”、“顺反异构体(cis/trans isomers or e-/z-isomers)”或别的“立体异构体(stero isomers)”指化合物具有相同的分子式及分子量,然而由于原子之间的不同键合方式及/或空间安排顺序而形成不同的化合物,这样的化合物叫异构体或称立体异构体。当这些立体异构体互为镜像关系,即看起来很像,却不能完全重合,就如左手与右手,这些化合物叫对映异构体。对映异构体的绝对构型通常用(r)-及(s)-或r-及s-来标示。具体确定对映异构体的绝对构型的规则见chapter 4of“advanced organic chemistry,”4
th edition(by j.march,john wiley and sons,new york,1992)。(r)-及(s)-对映异构体对偏振光具有相反的旋转作用,即左旋和右旋。当(r)-及(s)-对映异构体按1:1的比例混合或存在时,该混合物对偏振光没有旋转作用,这时该混合物称为消旋体。
当化合物分子中有两个或者两个以上的手性中心,就有可能存在非对映异构体的情况,即分子中的所有手性中心,至少有一个绝对构型相同,但也至少有一个得绝对构型不相同。
[0178]“互变异构体(tautomers)”在本文中是指具有不同能量的结构同分异构体可以越过低能垒,从而互相转化。诸如质子互变异构体包括通过质子迁移进行互变,如烯醇-酮互变异构体和亚胺-烯胺互变异构体,或者含有连接到环-nh-部分和环=n-部分的环原子的杂芳基基团的互变异构形式,如吡唑、咪唑、苯并咪唑、三唑和四唑。化合价互变异构体包括一些成键电子重组而进行互变。
[0179]
本发明所述化合物可能存在互变异构体(tautomers)、旋转异构体(rotamers)、顺反异构体等,这些概念都可在j.march的“advanced organic chemistry,”4
th edition中找到并得到理解。只要这些异构体具有与本发明所述化合物相同或类似的抑制ret、ret突变体及/或ret融合蛋白活性的作用,这些异构体也涵盖于本发明中。
[0180]
本发明中的化合物被给予哺乳动物(例如人)后,据本领域的常识,有可能在动物体内被不同的酶代谢成各种代谢产物(metabolites),只要这些代谢产物具有与本发明所述化合物类似的抑制ret、ret突变体及/或ret融合蛋白活性的作用,这些代谢产物也涵盖于本发明中。
[0181]“药物组合物”指将本发明所述化合物中的一个、多个、药学上可接受的盐或溶剂合物或水合物或前药与别的化学成分(例如药学上可接受的载体或稀释剂)混合制得的制剂。药物组合物的目的是促进给动物给药的过程。上述的药物组合物中,除了包括药学上可接受的载体外,还可以包括在药(剂)学上常用的辅剂,例如:抗细菌剂、抗真菌剂、抗微生物剂、保质剂、调色剂、增溶剂、增稠剂、表面活性剂、络合剂、蛋白质、氨基酸、脂肪、糖类、维生素、矿物质、微量元素、甜味剂、色素、香精或它们的结合等。
[0182]“药学上可接受的载体”或”稀释剂”指药物组合物中的非活性成分,包括但不限于:碳酸钙、磷酸钙、碳酸镁、硅胶、各种糖(例如乳糖、甘露醇等)、淀粉、环糊精、硬脂酸镁、纤维素、丙烯酸聚合物、甲基丙烯酸聚合物、凝胶、水、聚乙二醇、丙二醇、乙二醇、蓖麻油、氢化蓖麻油、多乙氧基氢化蓖麻油、芝麻油、玉米油、花生油等。
[0183]“药学上可接受的盐”指本发明所述化合物与无机酸、有机酸、无机碱、或有机碱通过化学反应形成的盐,这种盐保留本发明所述化合物的生物活性及有效性。所述的无机酸或有机酸包括但不限于:盐酸、氢溴酸、氢碘酸、硫酸、硝酸、碳酸、磷酸、高氯酸、醋酸、柠檬酸、草酸、乳酸、苹果酸、水杨酸、酒石酸、甲磺酸、乙磺酸、苯磺酸、取代的苯磺酸(例如,对甲基苯磺酸)、樟脑磺酸、异烟酸、油酸、鞣酸、泛酸、抗坏血酸、丁二酸、马来酸、龙胆酸、富马酸、葡萄糖酸、糖醛酸、葡萄糖二酸或蔗糖酸、甲酸、苯甲酸、谷氨酸、双羟萘酸、山梨酸等;所述的无机碱或有机碱包括但不限于氢氧化钠、氢氧化钾、氢氧化锂、氢氧化铁、氢氧化钙、氢氧化钡、氢氧化铝、氢氧化镁、氢氧化锌、氨水、氢氧化有机季铵盐、碳酸钠、碳酸钾、碳酸锂、碳酸钙、碳酸钡、碳酸镁、碳酸化有机季铵盐、碳酸氢钠、碳酸氢钾、碳酸氢锂、碳酸氢钙、碳酸氢钡、碳酸氢镁、碳酸氢化有机季铵盐等。
[0184]“烷基”指具有指定数目碳原子的直链或支链的饱和碳氢化合物基团,例如c
1-12
烷基指含最少1个,最多12个碳原子的直链或支链基团。c0烷基代表一个共价单键。本发明所述的烷基包括但不限于:甲基、乙基、丙基、丁基、异丙基、新戊基、2-甲基-1-己基等。本发明所述的烷基有时也指“亚烷基”,亚烷基是指烷基失去一个氢原子形成的基团。烷基或亚烷
基中的一个或全部氢原子可任选地被下列基团取代:环烷基、芳基、杂芳基、杂脂环、卤素、氨基、羟基、氰基、硝基、羧基、巯基、氧基(oxo)、烷氧基、芳氧基、烷基巯基、芳基巯基、羰基、硫羰基、c-酰胺基、n-酰胺基、o-氨羰氧基、n-氨羰氧基、o-硫代氨羰氧基、n-硫代氨羰氧基、c-酯基、o-酯基及-nr
a
r
b
,其中,r
a
及r
b
分别选自:氢、烷基、环烷基、芳基、乙酰基、羰基、磺酰基、三氟甲磺酰基等,并且r
a
及r
b
连同氮原子可形成5-或6-元杂脂环。
[0185]“环烷基”或“环烷”指具有指定数目碳原子的单、双或多环的碳氢化合物基团,双环或多环时,可以以“稠环”(两个环或多个环共用两个相邻的碳原子)、“螺环”(两个环或多个环共用一个碳原子)或“桥环”(两个环或多个环共用两个或多个不相邻的碳原子)的形式结合,例如c
1-12
环烷基指含最少1个,最多12个的单、双或多环的碳氢化合物基团。c0环烷基代表一个共价单键。环烷基中可以含有双键或三键,但不具有完全共轭的π电子体系。本发明所述的环烷基有时也指亚环烷基,即环烷基失去一个氢原子形成的基团。本发明所述的环烷基包括但不限于:环丙基、环丁基、环己基、环戊烯基、环庚三烯基、金刚烷等(举例如表a):
[0186]
表a
[0187][0188]
环烷基或环烷中的一个或全部氢原子可被下列基团取代:烷基、芳基、杂芳基、杂脂环、卤素、氨基、羟基、氰基、硝基、羧基、巯基、氧基(oxo)、烷氧基、芳氧基、烷基巯基、芳基巯基、羰基、硫羰基、c-酰胺基、n-酰胺基、o-氨羰氧基、n-氨羰氧基、o-硫代氨羰氧基、n-硫代氨羰氧基、c-酯基、o-酯基及-nr
a
r
b
,其中,r
a
及r
b
分别选自:氢、烷基、环烷基、芳基、乙酰基、羰基、磺酰基、三氟甲磺酰基等,并且r
a
及r
b
连同氮原子可形成5-或6-元杂脂环。
[0189]“杂脂环基(heteroalicyclyl或heterocycloalkyl)”或“杂脂环(heteroalicycle或heterocycloalkane)”或“杂脂环烷(heteroalicycle或heterocycloalkane)”指由3至18个非氢环原子组成的单环、双环或多环体系,其中至少一个环原子为选自o、n、s或p的杂原子,其余环原子为碳原子,例如,c8杂脂环基指的是由8个非氢环原子构成的单环、双环或多环基团,其中至少一个环原子选自o、n、s或p。这里的c8不是指8个碳原子,而是指8个由碳原子、o、n、s或p构成的环原子。这种环中除单键外,还可含有双键或叁键,但这些双键或叁键不构成全部共轭的芳香结构。这些单环、双环或多环体系可以以稠环、桥环或螺环的形式存在。本发明所述的杂脂环基有时也指亚杂脂环基,即杂脂环基失去一个氢原子形成的基团。本发明中的杂脂环基或杂脂环包括但不限于:哌啶、吗啉、哌嗪、吡咯烷、吲哚啉、四氢吡啶、四氢呋喃、托品醇等(举例如表b):
[0190]
表b
[0191][0192]
杂脂环基或杂脂环中的一个或全部氢原子可被下列基团取代:烷基、环烷基、芳基、杂芳基、杂脂环、卤素、氨基、羟基、氰基、硝基、羧基、巯基、氧基(oxo)、烷氧基、芳氧基、烷基巯基、芳基巯基、羰基、硫羰基、c-酰胺基、n-酰胺基、o-氨羰氧基、n-氨羰氧基、o-硫代氨羰氧基、n-硫代氨羰氧基、c-酯基、o-酯基及-nr
a
r
b
,其中,r
a
及r
b
分别选自:氢、烷基、环烷基、芳基、乙酰基、羰基、磺酰基、三氟甲磺酰基等,并且r
a
及r
b
连同氮原子可形成5-或6-元杂脂环。
[0193]“烯基”指含有至少两个碳原子及至少一个双键的直链或支链碳氢化合物基团,例如c
2-12
烯基指含最少2个,最多12个碳原子的直链或支链含至少一个双键的不饱和基团。本发明中的烯基包括但不限于:乙烯基、2-丙烯基、1-戊烯基等。
[0194]“炔基”指含有至少两个碳原子及至少一个三键的直链或支链碳氢化合物基团,例如c
2-12
炔基指含最少2个,最多12个碳原子的直链或支链含至少一个三键的不饱和基团。本发明中的炔基包括但不限于:乙烯基、2-丙烯基、1-戊烯基等。
[0195]“卤素”指氟、氯、溴或碘。
[0196]“烷氧基”指具有指定数目碳原子的烷基通过氧原子与其他基团相连。本发明中的烷氧基包括但不限于:甲氧基、乙氧基、丙氧基、丁氧基、环戊氧基、环己氧基、异丙氧基、新戊氧基、2-甲基-1-己氧基等。
[0197]“环烷氧基”指具有指定数目碳原子的环烷基通过氧原子与其他基团相连。本发明中的环烷氧基包括但不限于:环丙烷氧基、环丁烷氧基、环己烷氧基等。
[0198]“杂脂环氧基”指杂脂环基通过氧原子与其他基团相连。本发明中的杂脂环氧基包括但不限于:哌啶-4基氧基、氧杂环丁烷-3-基氧基等。
[0199]“芳基”指由指定数目碳原子组成的单环、双环或多环基团,其中至少一个环具有完全共轭的π电子体系并符合n+2规则,即具有芳香性,但整个基团不必全部共轭。例如,c6芳基指苯基。芳基也可以以亚芳基的形式出现,即芳基结构中与其他基团有两个或以上的连接点。本发明中的芳基包括但不限于:苯基、萘基、茚基、二氢化茚基、四氢化萘等。芳基中的一个或全部氢原子可被下列基团取代:烷基、环烷基、杂芳基、杂脂环、卤素、氨基、羟基、氰基、硝基、羧基、巯基、氧基(oxo)、烷氧基、芳氧基、烷基巯基、芳基巯基、羰基、硫羰基、c-酰胺基、n-酰胺基、o-氨羰氧基、n-氨羰氧基、o-硫代氨羰氧基、n-硫代氨羰氧基、c-酯基、o-酯基及-nr
a
r
b
,其中,r
a
及r
b
分别选自:氢、烷基、环烷基、芳基、乙酰基、羰基、磺酰基、三氟甲磺酰基等,并且r
a
及r
b
连同氮原子可形成5-或6-元杂脂环。
[0200]“杂芳基”指由指定数目非氢环原子组成的单环、双环或多环基团,其中至少一个环原子为选自o、n、s或p的杂原子,其余环原子为碳原子,并且,其中至少一个环具有完全共
轭的π电子体系并符合n+2规则,即具有芳香性,但整个基团不必全部共轭,例如,c5杂芳基指的是由5个非氢环原子构成的芳香环基团,其中至少一个环原子选自o、n、s或p,其余环原子为碳原子。杂芳基也可以以亚杂芳基的形式出现,即杂芳基结构中与其他基团有两个或以上的连接点。本发明中的杂芳基包括但不限于:砒啶、砒碇酮、四氢砒碇酮、咪啶、吡嗪、哒嗪、咪唑、噻唑、噻吩、呋喃、吲哚、氮杂吲哚、苯并咪唑、吲哚啉、吲哚酮、喹咛等(举例如表c):
[0201]
表c
[0202][0203]
杂芳基中的一个或全部氢原子可被下列基团取代:烷基、环烷基、芳基、杂脂环、卤素、氨基、羟基、氰基、硝基、羧基、巯基、氧基(oxo)、烷氧基、芳氧基、烷基巯基、芳基巯基、羰基、硫羰基、c-酰胺基、n-酰胺基、o-氨羰氧基、n-氨羰氧基、o-硫代氨羰氧基、n-硫代氨羰氧基、c-酯基、o-酯基及-nr
a
r
b
,其中,r
a
及r
b
分别选自氢、烷基、环烷基、芳基、乙酰基、羰基、磺酰基、三氟甲磺酰基等,并且r
a
及r
b
连同氮原子可形成5-或6-元杂脂环。
[0204]“含氮原子杂芳基”指杂芳基,但是该杂芳基中包含至少一个氮原子。本发明中的含氮原子杂芳基包括但不限于:吡啶基、喹啉基、吡嗪基、哒嗪基等。
[0205]“芳氧基”指芳基通过氧原子与其他基团相连。本发明中的芳氧基包括但不限于:苯氧基、萘氧基等。
[0206]“杂芳氧基”指杂芳基通过氧原子与其他基团相连。本发明中的杂芳氧基包括但不限于:4-砒啶氧基、2-噻吩氧基等。
[0207]“n-氧化物”指分子中的n原子与o原子通过双键相连,形成n=o或n
+-o-结构。
[0208]“氨基”指h2n-或其中氢原子被取代的h2n-,即r
a
hn-及r
a
r
b
n-。
[0209]“oxo”或“氧基”指=o或-o-,即氧原子通过双键或单键与碳或n、s、p等杂原子相连接。被氧基取代的例子包括但不限于表d中所示物质:
[0210]
表d
[0211][0212]“羟基”指-oh。
[0213]“硝基”指-no2。
[0214]“羧基”指-co2h。
[0215]“巯基”指-sh。
[0216]“烷基巯基”指烷基-s-。
[0217]“芳基巯基”指芳基-s-。
[0218]“羰基”指-c(=o)-。
[0219]“硫羰基”指-c(=s)-。
[0220]“c-酰胺基”指-c(=o)nr
a
r
b
。
[0221]“n-酰胺基”指c(=o)nr
a-。
[0222]“o-氨羰氧基”指-o-c(=o)nr
a
r
b
。
[0223]“n-氨羰氧基”指o-c(=o)nr
a-。
[0224]“o-硫代氨羰氧基”指-o-c(=s)nr
a
r
b
。
[0225]“n-硫代氨羰氧基”指o-c(=s)nr
a-。
[0226]“c-酯基”指-c(=o)or
a
。
[0227]“n-酯基”指c(=o)o-。
[0228]“乙酰基”指ch3c(=o)-。
[0229]“磺酰基”指-so2r
a
。
[0230]“三氟甲磺酰基”指cf3so
2-。
[0231]“ph”指苯基。
具体实施方式
[0232]
以下结合具体实施例对本发明作进一步详细说明,但不用来限制本发明的范围。
[0233]
下面列出在实施例中出现的英文缩写及相应的中文含义。如果实施例中出现没有列于此的缩写,则代表普遍接受的含义。
[0234]
h:小时
[0235]
rt:室温
[0236]
℃:摄氏度
[0237]
tlc:薄层色谱法
[0238]
hplc:高效液相色谱
[0239]
lc-ms:液质联用
[0240]
g:克
[0241]
mg:毫克
[0242]
mmol:毫摩尔
[0243]
nm:纳摩尔(浓度单位)
[0244]
μm:微摩尔(浓度单位)
[0245]
m:摩尔(浓度单位)
[0246]
ml:毫升
[0247]
(m+h)
+
:质谱中的分子离子峰
[0248]
m/z:质荷比
[0249]
nmr:核磁共振谱
[0250]
δ:化学位移
[0251]
dmso-d6:六氘代二甲基亚砜
[0252]
cdcl3:氘代氯仿
[0253]
cd3od:氘代甲醇
[0254]
dmso:二甲基亚砜
[0255]
dmf:n,n-二甲基甲酰胺
[0256]
dma:n,n-二甲基乙酰胺
[0257]
meoh:甲醇
[0258]
etoac:乙酸乙酯
[0259]
dcm:二氯甲烷
[0260]
dioxane:二氧六环
[0261]
dce:1,2-二氯乙烷
[0262]
hcl:氯化氢或盐酸
[0263]
tfa:三氟乙酸
[0264]
acoh:乙酸
[0265]
koac:乙酸钾
[0266]
nahco3:碳酸氢钠
[0267]
na2co3:碳酸钠
[0268]
k2co3:碳酸钾
[0269]
cs2co3:碳酸铯
[0270]
k3po4:磷酸钾
[0271]
pd/c:钯碳
[0272]
dipea:二异丙基乙基胺
[0273]
bbr3:三溴化硼
[0274]
naio4:高碘酸钠
[0275]
phi(oac)2:(二乙酰氧基碘)苯
[0276]
mgo:氧化镁
[0277]
na2so4:硫酸钠
[0278]
na2s2o3:硫代硫酸钠
[0279]
nh3.h2o:氨水
[0280]
bocnh2:氨基甲酸叔丁酯
[0281]
nab(oac)3h:三乙酰氧基硼氢化钠
[0282]
nabh3cn:氰基硼氢化钠
[0283]
rh2(oac)4:醋酸铑(ii)二聚体
[0284]
pd(pph3)4:四(三苯基膦)钯(0)
[0285]
pd2(dba)3:三(二亚苄基丙酮)二钯(0)
[0286]
pd(dppf)cl2:[1,1'-双(二苯基膦基)二茂铁]二氯钯(ii)
[0287]
xantphos:4,5-双(二苯基膦)-9,9-二甲基氧杂蒽
[0288]
xphos:2-二环己基膦基-2',4',6'-三异丙基联苯
[0289]
phn(tf)2:n,n
’-
双(三氟甲基磺酰基)苯胺
[0290]
pin2b2或b2pin2:双(频哪醇合)二硼
[0291]
ms:孔径为的分子筛一般实验条件:
[0292]
核磁共振氢谱及碳谱于varian 300或400mhz或bruker 300或400mhz仪器上获得(氘代二甲基亚砜,氘代氯仿,氘代甲醇等为溶剂,使用或不使用四甲基硅烷为内标)。质谱由液相色谱-质谱联用仪获得(美国waters或者agilent公司仪器)。高效液相色谱使用waters公司或者agilent公司高效液相色谱仪,除非另外说明。
[0293]
起始原料、试剂及溶剂从下列供应商购买:sigma-aldrich,milwaukee,wi,usa;acros,morris plains,nj,usa;frontier scientific,logan,utah,usa;alfa aesar,ward hill,ma,usa;shanghai aladdin bio-chem technology co.,ltd,shanghai,china;shanghai macklin bio-chemical co.,ltd.,shanghai,china;wuxi labnetwork,shanghai,china等或利用文献报道的方法合成。除非特别指出,溶剂一般不经干燥,而直接使用供应商的产品或经过分子筛干燥。
[0294]
中间体1:4-溴-6-羟基吡唑并[1,5-a]吡啶-3-甲腈(int-1):
[0295][0296]
int-1(cas#:2068065-05-2)按照文献(wo2019075092)报道的方法制备。
[0297]
中间体2:4-溴-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-3-甲腈(int-2):
[0298][0299]
往4-溴-6-羟基吡唑并[1,5-a]吡啶-3-甲腈(int-1,10.0g,42.0mmol)和k2co3(17.4g,126mmol)在dmf(50ml)中的混合物中加入2,2-二甲基环氧乙烷(3.03g,3.73ml,42.0mmol),所得混合物在85℃下搅拌12h,tlc显示反应完成。冷却至室温后将反应混合物倒入水(400ml)中,并搅拌1h,过滤收集产品,干燥得到4-溴-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-3-甲腈(int-2,11.0g,产率:84%),为褐色固体。
[0300]
中间体3:4-(6-氟吡啶-3-基)-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-3-甲腈(int-3):
[0301]
[0302]
int-3(cas#:2222653-74-7)按照文献(wo2019075108)报道的方法制备。中间体4:s,s-二甲基亚砜亚胺(int-4):
[0303][0304]
int-4(cas#:1520-31-6)从wuxi labnetwork购买。
[0305]
中间体5:(s)-(+)-s-甲基-s-苯磺酰亚胺(int-5):
[0306][0307]
int-5(cas#:33903-50-3)按照文献(m.r.yadav et al,chem.eur.j.2012,18,5541-5545)报道的方法制备。
[0308]
中间体6:(r)-(-)-s-甲基-s-苯磺酰亚胺(int-6):
[0309][0310]
int-6(cas#:60933-65-5)按照文献(h.zhao et al,mol.catalysis 2018,455,210-213)报道的方法制备。
[0311]
中间体7:(1-氧化-4-(5-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)吡啶-2-基)硫吗啉-1-亚氨基)甲酸叔丁酯(int-7):
[0312][0313]
第一步:4-(5-溴吡啶-2-基)硫吗啉(int-7.3):
[0314]
将5-溴-2-氯吡啶(int-7.1,38.0g,197mmol)和硫吗啉(int-7.2,102.0g,93.5ml,987mmol)的混合物在100℃下搅拌16h,tlc显示反应完成。冷却至室温后,往反应混合物中加入饱和nahco3溶液(400ml),所得混合物用乙酸乙酯(3
×
350ml)萃取,合并有机层,依次用水(500ml)和饱和食盐水(500ml)洗涤,用无水na2so4干燥,过滤,滤液减压浓缩得到残余物,通过硅胶柱色谱法纯化(洗脱剂:石油醚:乙酸乙酯=50:1至5:1)得到4-(5-溴吡啶-2-基)硫吗啉(int-7.3,30.0g,产率:58%),为无色油状液体。分析数据:1h-nmr(400mhz,cdcl3):δ=8.18(d,j=2.4hz,1h),7.51-7.54(m,1h),6.51(d,j=9.2hz,3h),3.90-3.92(m,4h),2.64-2.66(m,4h)。质谱(esi)m/z:259(m+h,
79
br)
+
,261(m+h,
81
br)
+
。
[0315]
第二步:4-(5-溴吡啶-2-基)硫吗啉-1-氧化物(int-7.4):
[0316]
在0℃下,往4-(5-溴吡啶-2-基)硫吗啉(int-7.3,30.0g,116mmol)在meoh(300ml)和水(300ml)中的混合物中加入naio4(27.2g,127mmol),所得混合物在0-10℃下搅拌16h,
tlc显示反应完成。将反应混合物过滤,水层用dcm(3
×
200ml)萃取,合并有机层并依次用饱和na2s2o3溶液(200ml)和饱和食盐水(200ml)洗涤,用无水na2so4干燥,过滤,滤液减压浓缩得到4-(5-溴吡啶-2-基)硫吗啉-1-氧化物(int-7.4,25.8g,产率:74.5%),为白色固体。不经进一步纯化直接用于下一步反应。分析数据:1h-nmr(400mhz,cdcl3):δ=8.23(d,j=2.4hz,1h),7.60(dd,j=2.4,8.8hz,1h),6.65(d,j=8.8hz,1h),4.08-4.19(m,4h),2.74-2.80(m,4h)。质谱(esi)m/z:275.1(m+h,
79
br)
+
,277.1(m+h,
81
br)
+
。
[0317]
第三步:(4-(5-溴吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)甲酸叔丁酯(int-7.5):
[0318]
在氮气下,往4-(5-溴吡啶-2-基)硫吗啉-1-氧化物(int-7.4,15.0g,54.5mmol),氨基甲酸叔丁酯(12.8g,109mmol),氧化镁(8.79g,218mmol)和phi(oac)2(26.3g,81.8mmol)在1,2-二氯乙烷(40ml)混合物中加入rh2(oac)4(1.20g,2.73mmol),所得混合物在40℃搅拌5h,tlc显示反应完成。冷却至室温后将反应混合物过滤,滤液用水(100ml)稀释,并用dcm(2
×
100ml)萃取,合并有机层,用无水na2so4干燥,过滤,滤液减压浓缩得到残余物,通过硅胶柱色谱法纯化(洗脱剂:石油醚:乙酸乙酯=10:1至1:1)得到(4-(5-溴吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)甲酸叔丁酯(int-7.5,11.5g,产率:54%),为无色油状液体。分析数据:1h-nmr(400mhz,cdcl3):δ=8.25(d,j=2.0hz,1h),7.65(dd,j=2.0,8.8hz,1h),6.67(d,j=8.8hz,1h),4.18-4.35(m,2h),4.00(ddd,j=2.0,8.4,14.4hz,2h),3.63(dd,j=6.7,14.4hz,2h),3.23-3.35(m,2h),1.50(s,9h)。质谱(esi)m/z:289.9(m+h-100,
79
br)
+
,291.9(m+h-100,
81
br)
+
。
[0319]
第四步:(1-氧化-4-(5-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)吡啶-2-基)硫吗啉-1-亚氨基)甲酸叔丁酯(int-7):
[0320]
在氮气下,往(4-(5-溴吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)甲酸叔丁酯(int-7.5,3.00g,7.69mmol),醋酸钾(2.26g,23.1mmol)和双(频哪醇合)二硼(pin2b2,5.86g,23.1mmol)的二恶烷(30ml)中加入pd(dppf)cl2(562mg,0.769mmol),所得混合物在80℃下搅拌12h,lc-ms显示反应完成。冷却至室温后,将反应混合物用乙酸乙酯(30ml)稀释并过滤,滤液减压浓缩得到粗产物,用石油醚(80ml)洗涤得到(1-氧化-4-(5-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)吡啶-2-基)硫吗啉-1-亚氨基)甲酸叔丁酯(int-7,3.2g,粗品),为黑褐色固体。不经进一步纯化直接用于下一步反应。质谱(esi)m/z:438.4(m+h)
+
。
[0321]
中间体8:4-(1-氧化-4-(5-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)吡啶-2-基)硫吗啉-1-亚氨基)哌啶-1-甲酸叔丁酯(int-8):
[0322][0323]
第一步:4-(5-溴吡啶-2-基)-1-亚氨基硫吗啉-1-氧化物(int-8.1):
[0324]
在0℃下,往(4-(5-溴吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)甲酸叔丁酯(int-7.5,1.50g,3.84mmol)的dcm(10ml)溶液中加入三氟乙酸(5ml,67.5mmol),所得混合物在室温下搅拌1h,tlc显示反应完成。将反应混合物减压浓缩,残余物在0℃下悬浮在甲基叔丁基醚(20ml)中,通过过滤收集固体产物4-(5-溴吡啶-2-基)-1-亚氨基硫吗啉-1-氧化物(int-8.1,1.2g,粗品),为黄色固体。该粗品用饱和碳酸钠水溶液碱化得到游离碱,不经进一步纯化直接用于下一步反应。分析数据:1h-nmr(400mhz,dmso-d6):δ=8.24(d,j=2.4hz,1h),7.80(dd,j=2.6,9.0hz,1h),7.04(d,j=9.2hz,1h),4.47(d,j=15.4hz,2h),3.65-3.76(m,2h),3.52-3.61(m,2h),3.40-3.49(m,2h)。
[0325]
第二步:4-(4-(5-溴吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)哌啶-1-甲酸叔丁酯(int-8.4):
[0326]
往4-(5-溴吡啶-2-基)-1-亚氨基硫吗啉-1-氧化物(int-8.1,0.50g,1.72mmol),4-氧代哌啶-1-羧酸叔丁酯(int-8.2,1.37g,6.89mmol)和acoh(1ml,17.5mmol)的meoh(3ml)溶液中加入2-甲基吡啶-硼烷络合物(int-8.3,221mg,2.07mmol),所得反应混合物在25℃下搅拌4h,lc-ms显示反应完成。将反应混合物过滤,滤液减压浓缩得到残余物,通过硅胶柱色谱纯化(洗脱剂:石油醚:乙酸乙酯=30:1至1:1)得到4-(4-(5-溴吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)哌啶-1-甲酸叔丁酯(int-8.4,0.34g,产率:41.7%),为黄色固体。分析数据:质谱(esi)m/z:473.1(m+h,
79
br)
+
,475.1(m+h,
81
br)
+
。
[0327]
第三步:4-(1-氧化-4-(5-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)吡啶-2-基)硫吗啉-1-亚氨基)哌啶-1-甲酸叔丁酯(int-8):
[0328]
在氮气下,往4-(4-(5-溴吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)哌啶-1-甲酸叔丁酯(int-8.4,340mg,0.718mmol),醋酸钾(211mg,2.15mmol)和双(频哪醇合)二硼(pin2b2,547mg,2.15mmol)的二恶烷(5ml)中加入pd(dppf)cl2(52.6mg,0.0718mmol),所得混合物在80℃下搅拌12h,lc-ms显示反应完成。将反应混合物冷却至室温后过滤,滤液减压浓缩,干燥得到4-(1-氧化-4-(5-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)吡啶-2-基)硫吗啉-1-亚氨基)哌啶-1-甲酸叔丁酯(int-8,360mg,粗品,产率:96%),为棕色固体,不经进一步纯化直接用于下一步反应。分析数据:质谱(esi)m/z:521.3(m+h)
+
。
[0329]
中间体9:n-(二甲基氧代-λ
4-亚磺酰基)-4-哌啶胺(int-9):
[0330][0331]
第一步:4-[(二甲基氧代-λ
4-亚磺酰基)氨基]哌啶-1-甲酸苄酯(int-9.2):
[0332]
往s,s-二甲基亚砜亚胺(int-4,5.0g,53.7mmol)和4-氧代哌啶-1-甲酸苄酯(int-9.1,25.0g,107mmol)的1,2-二氯乙烷(250ml)溶液中加入nab(oac)3h(45.5g,215mmol),所得混合物在35℃下搅拌12h,lc-ms显示反应完成。将反应混合物过滤,滤液减压浓缩,残余物用水稀释,用饱和碳酸氢钠水溶液调节至ph≈8,用dcm(3
×
200ml)萃取,合并有机层,用
无水na2so4干燥,过滤,滤液减压浓缩得到残余物,通过硅胶柱色谱纯化(洗脱剂:石油醚:乙酸乙酯=5:1至1:1)得到4-[(二甲基氧代-λ
4-亚磺酰基)氨基]哌啶-1-甲酸苄酯(int-9.2,5.3g,产率:32%),为白色固体。分析数据:1h-nmr(400mhz,cdcl3):δ=7.19-7.28(m,5h),5.04(s,2h),3.80-3.91(m,2h),3.30(m,1h),2.91-2.97(m,2h),2.94(s,6h),1.69-1.72(m,2h),1.43-1.46(m,2h)。质谱(esi)m/z:311.0(m+h)
+
。
[0333]
第二步:n-(二甲基氧代-λ
4-亚磺酰基)-4-哌啶胺(int-9):
[0334]
往4-[(二甲基氧代-λ
4-亚磺酰基)氨基]哌啶-1-甲酸苄酯(int-9.2,2.0g,6.44mmol)在meoh(30ml)中的溶液中加入10%pd/c(400mg),所得混合物在室温下氢化1h,tlc显示反应完成。将反应混合物过滤,滤液减压浓缩得到n-(二甲基氧代-λ
4-亚磺酰基)-4-哌啶胺(int-9,1.10g,产率:96%),为白色固体。分析数据:1h-nmr(400mhz,cdcl3):δ=3.47(br,m,1h),3.81-3.95(m,2h),3.20(m,1h),3.01(s,6h),2.80-2.83(m,2h),1.90-1.93(m,2h),1.58-1.62(m,2h)。
[0335]
中间体10:n-((s)-甲基-氧代-苯基-λ
4-亚磺酰基)-4-哌啶胺(int-10):
[0336][0337]
第一步:4-(((s)-甲基-氧代-苯基-λ
4-亚磺酰基)氨基)哌啶-1-甲酸叔丁酯(int-10.1):
[0338]
往(s)-(+)-s-甲基-s-苯磺酰亚胺(int-5,3.50g,22.6mmol)和4-氧代哌啶-1-甲酸叔丁酯(int-8.2,22.5g,112mmol)在meoh(50ml)和dcm(25ml)的溶液中加入乙酸(14ml,244mmol)和2-甲基吡啶-硼烷络合物(int-8.3,3.62g,33.8mmol),所得混合物在40℃下搅拌5h,lc-ms显示反应完成。将反应混合物用水(50ml)稀释,并用dcm(3
×
50ml)萃取,合并有机层,用na2so4干燥,过滤,滤液减压浓缩得到残余物,通过硅胶柱色谱纯化(洗脱剂:石油醚:乙酸乙酯=10:1至dcm:meoh=10:1)得到4-(((s)-甲基-氧代-苯基-λ
4-亚磺酰基)氨基)哌啶-1-甲酸叔丁酯(int-10.1,1.7g,产率:22%)。分析数据:质谱(esi)m/z:339.4(m+h)
+
。
[0339]
第二步:n-((s)-甲基-氧代-苯基-λ
4-亚磺酰基)-4-哌啶胺(int-10):
[0340]
在0℃下,往4-(((s)-甲基-氧代-苯基-λ
4-亚磺酰基)氨基)哌啶-1-甲酸叔丁酯(int-10.1,1.5g,4.43mmol)的dcm(15ml)溶液中加入三氟乙酸(5ml,67.5mmol),所得混合物在室温下搅拌2h,tlc显示反应完成。将反应混合物减压浓缩得到粗品(2.2g),使用饱和nahco3溶液碱化得到n-((s)-甲基-氧代-苯基-λ
4-亚磺酰基)-4-哌啶胺(int-10),为黄色油状液体,不经进一步纯化直接用于下一步反应。分析数据:质谱(esi)m/z:239(m+h)
+
。
[0341]
中间体11:n-((r)-甲基-氧代-苯基-λ
4-亚磺酰基)-4-哌啶胺(int-11):
[0342][0343]
第一步:4-(((r)-甲基-氧代-苯基-λ
4-亚磺酰基)氨基)哌啶-1-甲酸叔丁酯(int-11.1):
[0344]
往(r)-(-)-s-甲基-s-苯磺酰亚胺(int-6,2.70g,17.3mmol)和4-氧代哌啶-1-甲酸叔丁酯(int-8.2,17.3g,86.7mmol)在meoh(50ml)和dcm(25ml)的溶液中加入乙酸(10.4ml,182mmol)和2-甲基吡啶-硼烷络合物(int-8.3,2.78g,26mmol),所得混合物在40℃下搅拌2h,lc-ms显示反应完成。将反应混合物用水(50ml)稀释,并用dcm(3
×
50ml)萃取,合并有机层,用na2so4干燥,过滤,滤液减压浓缩得到残余物,通过硅胶柱色谱纯化(洗脱剂:石油醚:乙酸乙酯=10:1至dcm:meoh=10:1)得到4-(((r)-甲基-氧代-苯基-λ
4-亚磺酰基)氨基)哌啶-1-甲酸叔丁酯(int-11.1,1.6g,产率:24%)。分析数据:1h-nmr(400mhz,cdcl3):δ=7.91-7.93(m,2h),7.55-7.59(m,3h),4.74(d,j=8.0hz,2h),3.84-3.89(m,2h),3.08(s,3h),3.04(m,1h),2.74-2.80(m,2h),1.59-1.61(m,2h),1.43(s,9h)。质谱(esi)m/z:339.1(m+h)
+
。
[0345]
第二步:n-((r)-甲基-氧代-苯基-λ
4-亚磺酰基)-4-哌啶胺(int-11):
[0346]
在0℃下,往4-(((r)-甲基-氧代-苯基-λ
4-亚磺酰基)氨基)哌啶-1-甲酸叔丁酯(int-11.1,1.6g,4.2mmol)的dcm(16ml)溶液中加入三氟乙酸(6.09ml,82.2mmol),所得混合物在室温下搅拌2h,tlc显示反应完成。将反应混合物减压浓缩得到粗品(2.2g),使用饱和nahco3溶液碱化得到n-((r)-甲基-氧代-苯基-λ
4-亚磺酰基)-4-哌啶胺(int-11),为黄色油状液体,不经进一步纯化直接用于下一步反应。分析数据:质谱(esi)m/z:239(m+h)
+
。
[0347]
中间体12:3-氰基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-4-基三氟甲磺酸酯(int-12):
[0348][0349]
第一步:4-羟基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-3-甲腈(int-12.3):
[0350]
在氮气下,往6-溴-4-羟基吡唑并[1,5-a]吡啶-3-甲腈(cas#:(2068065-16-5),按照wo2019075092报道的方法制备,int-12.1,15.0g,63.0mmol)和1-甲基-4-(4,4,5,5-四甲
基-1,3,2-二氧杂戊硼烷-2-基)-1h-吡唑(int-12.2,15.7g,75.6mmol)在二恶烷(150ml)和na2co3水溶液(2m,94.5ml,189mmol)的混合物中加入pd(pph3)4(3.64g,3.15mmol),所得混合物在80℃下搅拌12h,lc-ms显示反应完成。将反应混合物过滤,滤饼用水(3
×
100ml)和dcm(100ml)洗涤,合并水相,用1m hcl调节至ph≈5,过滤收集固体产物,并用水(2
×
50ml)洗涤,干燥得到4-羟基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-3-甲腈(int-12.3,11.1g,产率:42%),为棕色固体,不经进一步纯化直接用于下一步反应。分析数据:质谱(esi)m/z:240.1(m+h)
+
。
[0351]
第二步:3-氰基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-4-基三氟甲磺酸酯(int-12):
[0352]
往4-羟基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-3-甲腈(int-12.3,5.10g,21.3mmol)在n,n-二甲基乙酰胺(50ml)的悬浮液中加入二异丙基乙基胺(7.43ml,42.6mmol),然后加入n-苯基-双(三氟甲烷磺酰亚胺)(int-12.4,8.38g,23.5mmol),将所得溶液在室温下搅拌2h,lc-ms显示反应完成。将反应混合物用水(100ml)稀释,并用dcm(2
×
200ml)萃取,合并有机层,用无水na2so4干燥,过滤,滤液减压浓缩得到残余物,通过硅胶柱色谱纯化(洗脱剂:石油醚:乙酸乙酯=10:1至1:1)得到3-氰基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-4-基三氟甲磺酸酯(int-12,5.40g,收率:25%)。分析数据:质谱(esi)m/z:372.1(m+h)
+
。
[0353]
中间体13:4-(6-氟吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-3-甲腈(int-13):
[0354][0355]
int-13(cas#:2068064-98-0),按照wo2017011776报道的方法制备。分析数据:质谱(esi)m/z:319.1(m+h)
+
。
[0356]
中间体14:3-氰基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-4-基三氟甲磺酸酯(int-14):
[0357][0358]
第一步:4-(苄氧基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(int-14.2):
[0359]
在氮气下,往4-(苄氧基)-6-氯吡唑并[1,5-a]吡嗪-3-甲腈(int-14.1,cas#:1650547-68-4,按照wo2015017610报道的方法合成,13.2g,46.3mmol)和1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)-1h-吡唑(int-12.2,10.6g,51.0mmol)在k3po4水溶液(2m,69.5ml,139mmol)和二恶烷(130ml)混合物中加入pd2(dba)3(2.12g,2.32mmol)和xphos(2.21g,4.64mmol),所得混合物在80℃下搅拌2h,lc-ms显示反应完成。将反应混合物用水(250ml)稀释,并用dcm(3
×
200ml)萃取,合并有机层,用饱和食盐水(100ml)洗涤,用无水na2so4干燥,过滤,滤液减压浓缩得到残余物,在室温下用石油醚:乙酸乙酯=5:1磨碎(trituration)5分钟得到4-(苄氧基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(int-14.2,9.0g,产率:53%,纯度:98.6%),为黄色固体。分析数据:质谱(esi)m/z:331.1(m+h)
+
。
[0360]
第二步:4-羟基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(int-14.3):
[0361]
在-78℃和氮气下,往4-(苄氧基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(int-14.2,9.0g,26.9mmol)的dcm(135ml)溶液中加入bbr3(12.9ml,33.7g,134mmol)的dcm(135ml)溶液,所得混合物在室温下搅拌1.25h,tlc显示反应完成。将反应用水(500ml)淬灭,过滤收集固体产物,得到4-羟基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(int-14.3,7g,粗品),为黄色固体,不经进一步纯化直接用于下一步反应。分析数据:1h-nmr(400mhz,dmso-d6):δ=12.07(m,1h),8.53(t,j=10.0hz,1h),8.33(d,j=9.2hz,1h),8.22-8.27(m,1h),8.08(s,1h),3.88(s,3h)。质谱(esi)m/z:241.1(m+h)
+
。
[0362]
第三步:3-氰基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-4-基三氟甲磺酸酯(int-14):
[0363]
往4-羟基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(int-14.3,5.0g,20.8mmol)在n,n-二甲基乙酰胺(50ml)溶液中加入n-苯基-双(三氟甲烷磺酰亚胺)(int-12.4,9.67g,27.1mmol)和二异丙基乙基胺(8.34ml,47.9mmol),所得混合物在室温下搅拌8h,tlc显示反应完成。反应用水(100ml)稀释,过滤收集产物,得到3-氰基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-4-基三氟甲磺酸酯(int-14,1.0g,产率:9.8%),为黄色固体,不经进一步纯化直接用于下一步反应。分析数据:1h-nmr(400mhz,dmso-d6):δ=
9.57(s,1h),8.93(m,1h),8.24(s,1h),8.07(s,1h),3.92(s,3h)。质谱(esi)m/z:373.0(m+h)
+
。
[0364]
中间体15:4-(6-氟吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(int-15):
[0365][0366]
在氮气下,往3-氰基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-4-基三氟甲磺酸酯(int-14,901mg,1.84mmol)和(6-氟吡啶-3-基)硼酸(int-15.1,311mg,2.21mmol)在k3po4水溶液(2m,2.76ml,5.52mmol)和二恶烷(10ml)的混合物中加入pd2(dba)3(84.3mg,0.092mmol)和xphos(87.7mg,0.184mmol),将所得混合物脱气,并在80℃下搅拌2h,lc-ms显示反应完成。冷却至0℃后,反应混合物用水(50ml)稀释,用dcm(2
×
100ml)萃取,合并有机层,用饱和食盐水(200ml)洗涤,经无水na2so4干燥,过滤,滤液减压浓缩得到残余物,通过硅胶柱色谱纯化(洗脱剂:二氯甲烷:甲醇=1:0至100:1)得到4-(6-氟吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(int-15,300mg,产率:43%),为黄色固体。分析数据:质谱(esi)m/z:319.9(m+h)
+
。
[0367]
实施例1:(4-(5-(3-氰基-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-4-基)吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)甲酸叔丁酯(ex.1):
[0368][0369]
在氮气下,往(1-氧化-4-(5-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)吡啶-2-基)硫吗啉-1-亚氨基)甲酸叔丁酯(int-7,2.50g,5.72mmol),4-溴-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-3-甲腈(int-2,886mg,2.86mmol,1eq)和na2co3(606mg,5.72mmol)在水(15ml)和二恶烷(25ml)的混合物中加入pd(dppf)cl2(209mg,0.286mmol),所得混合物在80℃搅拌12h,lc-ms显示反应完成。冷却至室温后将反应混合物过滤,滤液用水(30ml)稀释,并用dcm(3
×
30ml)萃取,合并有机层,用饱和食盐水(30ml)洗涤,经无水
na2so4干燥,过滤,滤液减压浓缩得到残余物,通过制备型hplc纯化(柱:phenomenex luna c18 150*40mm*15um;流动相:[水(0.225%甲酸)-乙氰];b%:1%-25%,9分钟)得到(4-(5-(3-氰基-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-4-基)吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)甲酸叔丁酯(ex.1,1.30g,产率:84%),为黄色固体。分析数据:1h-nmr(400mhz,cdcl3):δ=8.39(s,1h),8.19-8.20(m,2h),7.80(d,j=7.0hz,1h),7.19(s,1h),6.91(d,j=8.8hz,1h),4.38-4.42(m,2h),4.08(dd,j=8.0,13.2hz,2h),3.87(s,2h),3.67-3.70(m,2h),3.28-3.48(m,2h),1.50(s,9h),1.39(s,6h)。质谱(esi)m/z:441.2(m+h-100)
+
。
[0370]
实施例2:6-(2-羟基-2-甲基丙氧基)-4-(6-(1-亚氨基-1-氧化硫吗啉基)吡啶-3-基)吡唑并[1,5-a]吡啶-3-甲腈(ex.2):
[0371][0372]
往(4-(5-(3-氰基-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-4-基)吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)甲酸叔丁酯(ex.1,1.30g,2.40mmol)的dcm(10ml)溶液中加入三氟乙酸(5ml,67.5mmol),所得混合物在25℃下搅拌1h,lc-ms显示反应完成。将反应混合物减压浓缩得到粗产物,用石油醚洗涤,并用meoh溶解,滴加入nh3.h2o中和,所得固体产物通过过滤收集,干燥得到6-(2-羟基-2-甲基丙氧基)-4-(6-(1-亚氨基-1-氧化硫吗啉基)吡啶-3-基)吡唑并[1,5-a]吡啶-3-甲腈(ex.2,26mg,产率:2.4%,纯度:98.7%),为白色固体。分析数据:1h-nmr(400mhz,dmso-d6):δ=8.69(s,1h),8.57(s,1h),8.39(d,j=2.4hz,1h),7.85(dd,j=2.4,8.8hz,1h),7.34(d,j=2.0hz,1h),7.14(d,j=8.8hz,1h),4.70(s,1h),4.29(d,j=16.0hz,2h),3.87-3.93(m,5h),2.97-3.02(m,4h),1.22(s,6h)。质谱(esi)m/z:441.1(m+h)
+
。
[0373]
实施例3:6-(2-羟基-2-甲基丙氧基)-4-(6-(1-((6-甲氧基吡啶-3-基)亚氨基)-1-氧化硫吗啉基)吡啶-3-基)吡唑并[1,5-a]吡啶-3-甲腈(ex.3):
[0374][0375]
在氮气下,往6-(2-羟基-2-甲基丙氧基)-4-(6-(1-亚氨基-1-氧化硫吗啉基)吡啶-3-基)吡唑并[1,5-a]吡啶-3-甲腈(ex.2,159mg,0.361mmol),5-溴-2-甲氧基吡啶(67.8mg,0.361mmol)和cs2co3(353mg,1.08mmol)在二恶烷(1ml)中加入xantphos(20.9mg,0.036mmol)和pd2(dba)3(16.5mg,0.018mmol),所得混合物在100℃下搅拌5h,lc-ms显示反应完成。将反应混合物过滤,滤液减压浓缩得到残余物,通过制备型hplc纯化(柱:phenomenex luna c18150*40mm*15um;流动相:[水(0.225%甲酸)-乙氰];b%:1%-25%,9分钟)得到6-(2-羟基-2-甲基丙氧基)-4-(6-(1-((6-甲氧基吡啶-3-基)亚氨基)-1-氧化硫
基)吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)哌啶-1-甲酸叔丁酯(ex.6):
[0383][0384]
在氮气下,往4-(1-氧化-4-(5-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)吡啶-2-基)硫吗啉-1-亚氨基)哌啶-1-甲酸叔丁酯(int-8,360mg,0.692mmol),4-溴-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-3-甲腈(int-2,143mg,0.461mmol)和na2co3(97.7mg,0.922mmol)在水(0.5ml)和二恶烷(2ml)的混合物中加入pd(dppf)cl2(33.7mg,0.046mmol),所得混合物在80℃下搅拌12h,lc-ms显示反应完成。将反应混合物过滤,滤液减压浓缩得到残余物,通过制备型hplc纯化(柱:phenomenex luna c18 150*40mm*15um;流动相:[水(0.225%甲酸)-乙氰];b%:1%-25%,9分钟)得到4-(4-(5-(3-氰基-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-4-基)吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)哌啶-1-甲酸叔丁酯(ex.6,107mg,产率:37%),为黄色固体。分析数据:质谱(esi)m/z:624.3(m+h)
+
。
[0385]
实施例7:6-(2-羟基-2-甲基丙氧基)-4-(6-(1-氧化-1-(哌啶-4-基亚氨基)硫吗啉基)吡啶-3-基)吡唑并[1,5-a]吡啶-3-甲腈(ex.7):
[0386][0387]
在0℃下,往4-(4-(5-(3-氰基-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-4-基)吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)哌啶-1-甲酸叔丁酯(ex.6,110mg,0.172mmol)的dcm(1.5ml)溶液中加入三氟乙酸(0.332ml,4.46mmol),所得混合物在室温下搅拌0.5h,tlc显示反应完成。将反应混合物减压浓缩得到残余物,通过制备型hplc纯化(柱:phenomenex luna c18 150*40mm*15um;流动相:[水(0.225%甲酸)-乙氰];b%:1%-25%,9分钟)得到6-(2-羟基-2-甲基丙氧基)-4-(6-(1-氧化-1-(哌啶-4-基亚氨基)硫吗啉基)吡啶-3-基)吡唑并[1,5-a]吡啶-3-甲腈(ex.7,49.8mg,产率:55%),为黄色固体。分析数据:1h-nmr(400mhz,cd3od):δ=8.48(d,j=2.0hz,1h),8.39(d,j=2.4hz,1h),8.33(s,1h),7.86(dd,j=2.4,8.8hz,1h),7.34(d,j=2.0hz,1h),7.14(d,j=8.8hz,1h),4.36(dd,j=3.8,14.6hz,2h),4.10-4.13(m,2h),3.92(s,2h),3.72(m,1h),3.31-3.40(m,4h),3.09-3.13(m,
2h),2.05-2.10(m,2h),1.72-1.82(m,2h),1.36(s,6h)。质谱(esi)m/z:524.3(m+h)
+
。
[0388]
实施例8:4-(6-(4-((二甲基氧代-λ
4-亚磺酰基)氨基)哌啶-1-基)吡啶-3-基)-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-3-甲腈(ex.8):
[0389][0390]
n-(二甲基氧代-λ
4-亚磺酰基)-4-哌啶胺(int-9,200mg,1.13mmol),4-(6-氟吡啶-3-基)-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-3-甲腈(int-3,473mg,1.13mmol)和k2co3(313mg,2.27mmol)在dmso(2ml)中的混合物在90℃下搅拌12h,lc-ms显示反应完成。过滤收集固体产物,通过制备型hplc纯化(柱:phenomenex luna c18 150*40mm*15um;流动相:[水(0.225%甲酸)-乙氰];b%:1%-25%,9分钟)得到4-(6-(4-((二甲基氧代-λ
4-亚磺酰基)氨基)哌啶-1-基)吡啶-3-基)-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-3-甲腈(ex.8,40mg,产率:17%),为黄色固体。分析数据:1h-nmr(400mhz,cd3od):δ=8.43(d,j=2.0hz,1h),8.33(s,1h),8.26(dd,j=2.0,12.4hz,1h),7.75(dd,j=2.4,8.8hz,1h),7.29(d,j=2.0hz,1h),6.94(d,j=8.8hz,1h),4.31(d,j=13.2hz,2h),3.91(s,2h),3.54(m,1h),3.13(s,6h),3.08-3.12(m,2h),1.92(d,j=10.0hz,2h),1.54-1.64(m,2h),1.35(s,6h)。质谱(esi)m/z:483.2(m+h)
+
。
[0391]
实施例9:4-(6-(4-(((s)-s-甲基-s-苯基-氧代-λ
4-亚磺酰基)氨基)哌啶-1-基)吡啶-3-基)-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-3-甲腈(ex.9):
[0392][0393]
n-((s)-甲基-氧代-苯基-λ
4-亚磺酰基)-4-哌啶胺(int-10,541mg,2.27mmol),4-(6-氟吡啶-3-基)-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-3-甲腈(int-3,123mg,0.306mmol)和k2co3(414.6mg,4.0mmol)在dmso(2ml)中的混合物在90℃下搅拌2h,lc-ms显示反应完成。冷却至室温后过滤收集固体产物,通过制备型hplc纯化(柱:shim-pack c18 150*25*10um;流动相:[水(0.225%甲酸)-乙氰];b%:16%-49%,11分钟)得到4-(6-(4-(((s)-s-甲基-s-苯基-氧代-λ
4-亚磺酰基)氨基)哌啶-1-基)吡啶-3-基)-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-3-甲腈(ex.9,36.9mg,产率:12%),为浅棕色固体。分析数据:1h-nmr(400mhz,dmso-d6):δ=8.66(d,j=2.4hz,1h),8.57(s,1h),8.29(d,j=2.4hz,1h),7.91(dd,j=1.6,8.4hz,2h),7.65-7.72(m,4h),7.28(d,j=2.0hz,1h),6.91(d,j=9.2hz,1h),4.71(s,1h),4.10-4.16(m,2h),3.86(s,2h),3.14(s,3h),2.99-3.06(m,2h),1.36-1.82(m,5h),1.22(s,6h)。质谱(esi)m/z:545.2(m+h)
+
。
[0394]
实施例10:4-(6-(4-(((r)-s-甲基-s-苯基-氧代-λ
4-亚磺酰基)氨基)哌啶-1-基)
吡啶-3-基)-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-3-甲腈(ex.10):
[0395][0396]
n-[(r)-甲基-氧代-苯基-λ
4-亚磺酰基]-4-哌啶胺(int-11,183mg,0.519mmol),4-(6-氟吡啶-3-基)-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-3-甲腈(int-3,127mg,0.307mmol)和k2co3(207mg,2.0mmol)在dmso(2ml)中的混合物在90℃下搅拌2h,lc-ms显示反应完成。冷却至室温后过滤收集固体产物,通过制备型hplc纯化(柱:shim-pack c18 150*25*10um;流动相:[水(0.225%甲酸)-乙氰];b%:16%-49%,11分钟)得到4-(6-(4-(((r)-s-甲基-s-苯基-氧代-λ
4-亚磺酰基)氨基)哌啶-1-基)吡啶-3-基)-6-(2-羟基-2-甲基丙氧基)吡唑并[1,5-a]吡啶-3-甲腈(ex.10,40mg,产率:18%),为黄色固体。分析数据:1h-nmr(400mhz,dmso-d6):δ=8.66(d,j=2.4hz,1h),8.57(s,1h),8.29(d,j=2.4hz,1h),7.91(dd,j=1.6,8.4hz,2h),7.65-7.72(m,4h),7.28(d,j=2.0hz,1h),6.91(d,j=9.2hz,1h),4.71(s,1h),4.10-4.16(m,2h),3.86(s,2h),3.14(s,3h),2.99-3.06(m,2h),2.51-2.52(m,1h),1.36-1.75(m,4h),1.22(s,6h)。质谱(esi)m/z:545.2(m+h)
+
。
[0397]
实施例11:(4-(5-(3-氰基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-4-基)吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)甲酸叔丁酯(ex.11):
[0398][0399]
在氮气下,往3-氰基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-4-基三氟甲磺酸酯(int-12,2.0g,5.39mmol)和(1-氧化-4-(5-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)吡啶-2-基)硫吗啉-1-亚氨基)甲酸叔丁酯(int-7,2.83g,6.46mmol)在二恶烷(20ml)和na2co3水溶液(2m,8.08ml,16.16mmol)中的溶液中加入pd(dppf)cl2(394mg,0.539mmol),将所得混合物在80℃下搅拌12h,tlc显示反应完成。冷却至室温后将反应混合物用水(50ml)稀释,并用dcm(2
×
50ml)萃取,合并有机层,用无水na2so4干燥,过滤,滤液减压浓缩得到残余物,通过硅胶柱色谱纯化(洗脱剂:石油醚:乙酸乙酯=10:1至1:1)得到(4-(5-(3-氰基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-4-基)吡啶-2-基)-1-氧化硫
吡唑-4-基)吡唑并[1,5-a]吡啶-3-甲腈(ex.13,30mg,产率:6.8%),为白色固体。分析数据:1h-nmr(400mhz,cdcl3):δ=8.67(d,j=1.6hz,1h),8.41(d,j=2.0hz,1h),8.27(s,1h),7.82(dd,j=2.8,7.2hz,1h),7.80(s,1h),7.71(s,1h),7.43(s,1h),6.90(d,j=8.8hz,1h),4.29-4.31(m,2h),4.06-4.11(m,2h),4.01(s,3h),3.19-3.21(m,2h),3.12-3.15(m,2h),2.92(d,j=6.8hz,2h),1.78(m,1h),0.98(d,j=6.4hz,6h)。质谱(esi)m/z:489.2(m+h)
+
。
[0406]
实施例14:4-(6-(1-(((6-甲氧基吡啶-3-基)甲基)亚氨基)-1-氧化硫吗啉基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-3-甲腈(ex.14):
[0407][0408]
往4-(6-(1-亚氨基-1-氧化硫吗啉基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-3-甲腈三氟乙酸盐(ex.12.tfa,500mg,0.887mmol),6-甲氧基烟醛(487mg,3.55mmol)和乙酸(249mg,0.237ml,4.15mmol)在meoh(3ml)中的混合物中加入2-甲基吡啶-硼酸络合物(int-8.3,143mg,1.33mmol),所得混合物在40℃下搅拌12h,lc-ms显示反应完成。将反应混合物过滤,滤液减压浓缩得到残余物,通过制备型hplc纯化(柱:phenomenex luna c18 150*40mm*15um;流动相:[水(0.225%甲酸)-乙氰];b%:17%-47%,9分钟)得到4-(6-(1-(((6-甲氧基吡啶-3-基)甲基)亚氨基)-1-氧化硫吗啉基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-3-甲腈(ex.14,249mg,产率:50.5%),为白色固体。分析数据:1h-nmr(400mhz,cdcl3):δ=8.67(d,j=1.6hz,1h),8.40(d,j=2.0hz,1h),8.27(s,1h),8.17(d,j=2.0hz,1h),7.80-7.82(m,2h),7.70-7.73(m,2h),7.43(d,j=1.6hz,1h),6.88(d,j=8.4hz,1h),6.75(d,j=8.4hz,1h),4.26-4.30(m,4h),4.09-4.12(m,2h),4.01(s,3h),3.94(s,3h),3.10-3.16(m,4h)。质谱(esi)m/z:554.3(m+h)
+
。
[0409]
实施例15:4-(6-(1-((6-甲氧基吡啶-3-基)亚氨基)-1-氧化硫吗啉基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-3-甲腈(ex.15):
[0410][0411]
在氮气下,往4-(6-(1-亚氨基-1-氧化硫吗啉基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-3-甲腈(ex.12,200mg,0.462mmol),5-溴-2-甲氧基吡啶(87mg,0.462mmol),cs2co3(452mg,1.39mmol)和xantphos(26.8mg,0.046mmol)在二恶烷(5ml)中的混合物中加入pd2(dba)3(21.2mg,0.023mmol),所得混合物在100℃下搅拌5h,lc-ms显示反应完成。冷却至室温后将混合物过滤,滤液减压浓缩得到残余物,通过制备型hplc纯化(柱:phenomenex luna c18 150*40mm*15um;流动相:[水(0.225%甲酸)-乙氰];b%:
(4-(((s)-s-甲基-s-苯基-氧代-λ
4-亚磺酰基)氨基)哌啶-1-基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-3-甲腈(ex.17,44mg,产率:26%),为白色固体。分析数据:1h-nmr(400mhz,cdcl3):δ=8.62(d,j=1.6hz,1h),8.34(d,j=2.4hz,1h),8.26(s,1h),7.95-8.01(m,2h),7.79(s,1h),7.57-7.73(m,5h),7.38(d,j=1.6hz,1h),6.77(d,j=8.8hz,1h),4.23(d,j=4.0hz,2h),4.00(s,3h),3.22(m,1h),3.11(s,3h),3.01-3.11(m,2h),1.97-2.00(m,1h),1.72-1.84(m,3h)。质谱(esi)m/z:537.1(m+h)
+
。
[0418]
实施例18:4-(6-(4-(((r)-s-甲基-s-苯基-氧代-λ
4-亚磺酰基)氨基)哌啶-1-基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-3-甲腈(ex.18):
[0419][0420]
n-((r)-甲基-氧代-苯基-λ
4-亚磺酰基)-4-哌啶胺(int-11,225mg,0.942mmol),4-(6-氟吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-3-甲腈(int-13,100mg,0.314mmol)和k2co3(217mg,1.57mmol)在dmso(2ml)中的混合物在90℃下搅拌12h,lc-ms显示反应完成。冷却至室温后过滤收集固体产物,并通过制备型hplc纯化(柱:phenomenex synergi c18 150*25*10um;流动相:[水(0.225%甲酸)-乙氰];b%:12%-42%,10分钟)得到4-(6-(4-(((r)-s-甲基-s-苯基-氧代-λ
4-亚磺酰基)氨基)哌啶-1-基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡啶-3-甲腈(ex.18,27mg,产率:16%),为白色固体。分析数据:1h-nmr(400mhz,cdcl3):δ=8.62(d,j=1.6hz,1h),8.33(d,j=2.4hz,1h),8.25(s,1h),7.96-7.98(m,2h),7.79(s,1h),7.57-7.73(m,5h),7.38(d,j=1.6hz,1h),6.77(d,j=8.8hz,1h),4.23(td,j=4.8,9.2hz,2h),4.00(s,3h),3.21(m,1h),3.11(s,3h),2.95-3.08(m,2h),1.92-2.07(m,1h),1.72-1.86(m,3h)。质谱(esi)m/z:537.1(m+h)
+
。
[0421]
实施例19:(4-(5-(3-氰基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-4-基)吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)甲酸叔丁酯(ex.19):
[0422][0423]
在氮气下,3-氰基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-4-基三氟甲磺酸酯(int-14,0.20g,0.537mmol)和(1-氧化-4-(5-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)吡啶-2-基)硫吗啉-1-亚氨基)甲酸叔丁酯(int-7,258mg,0.591mmol)在k3po4水溶液(2.0m,0.806ml,1.61mmol)和二恶烷(5ml)的混合物中加入pd2(dba)3(24.6mg,0.0269mmol)和xphos(25.6mg,0.0537mmol),所得混合物于80℃下搅拌12h,lc-ms显示反应完成。冷却至室温后将混合物过滤,滤液减压浓缩得到残余物,通过硅胶柱色谱纯化(洗脱剂:dcm:乙酸乙酯=15:1至5:1,然后dcm:meoh=50:1)得到(4-(5-(3-氰基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-4-基)吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)甲酸叔丁酯(ex.19,110mg,0.206mmol,产率:38%),为黄色固体。分析数据:1h-nmr(400mhz,cdcl3):δ=8.83(d,j=2.8hz,1h),8.58(s,1h),8.36(s,1h),8.16(s,1h),7.87-8.01(m,2h),6.94(d,j=8.8hz,1h),4.47(dd,j=4.0,14.4hz,2h),4.32-4.34(m,2h),4.01(s,3h),3.68-3.71(m,2h),3.34-3.39(m,2h),1.51(s,9h)。质谱(esi)m/z:434.2(m+h-100)
+
。
[0424]
实施例20:4-(6-(1-亚氨基-1-氧化硫吗啉基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(ex.20):
[0425][0426]
往(4-(5-(3-氰基-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-4-基)吡啶-2-基)-1-氧化硫吗啉-1-亚氨基)甲酸叔丁酯(ex.19,100mg,0.187mmol)的dcm(3ml)溶液中加入三氟乙酸(1ml,13.5mmol),所得混合物在室温下搅拌1h,tlc显示反应完成。将反应混合物减压浓缩得到残余物,通过制备型hplc纯化(柱:phenomenex synergi c18 150*25*10um;流动相:[水(0.225%甲酸)-乙氰];b%:17%-41%,8分钟)得到4-(6-(1-亚氨基-1-氧化硫吗啉基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(ex.20,35mg,产率:43%),为白色固体。分析数据:1h-nmr(400mhz,dmso-d6):δ=9.33(s,1h),8.83(s,1h),8.71(d,j=2.4hz,1h),8.38(s,1h),8.11-8.14(m,2h),7.21(d,j=
8.8hz,1h),4.34(dd,j=1.6,14.8hz,2h),3.81-3.99(m,6h),2.96-3.11(m,4h)。质谱(esi)m/z:434.1(m+h)
+
。
[0427]
实施例21:4-(6-(1-(((6-甲氧基吡啶-3-基)甲基)亚氨基)-1-氧化硫吗啉基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(ex.21):
[0428][0429]
往4-(6-(1-亚氨基-1-氧化硫吗啉基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(ex.20,0.50g,1.15mmol),6-甲氧基烟醛(614mg,4.48mmol)和乙酸(0.299ml,5.23mmol)在meoh(10ml)中的溶液中加2-甲基吡啶-硼酸络合物(int-8.3,180mg,1.68mmol),所得混合物在40℃下搅拌12h,lc-ms显示反应完成。将反应混合物过滤,滤液减压浓缩得到残余物,通过制备型hplc纯化(柱:phenomenex luna c18 150*40mm*15um;流动相:[水(0.225%甲酸)-乙氰];b%:18%-48%,9分钟)得到4-(6-(1-(((6-甲氧基吡啶-3-基)甲基)亚氨基)-1-氧化硫吗啉基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(ex.21,27mg,产率:4.3%),为黄色固体。分析数据:1h-nmr(400mhz,cdcl3):δ=8.81(d,j=2.4hz,1h),8.57(s,1h),8.36(s,1h),8.08-8.21(m,2h),7.99(d,j=8.8hz,2h),7.68(dd,j=2.8,8.8hz,1h),6.89(d,j=8.8hz,1h),6.75(d,j=8.4hz,1h),4.31-4.34(m,2h),4.29(s,2h),4.00-4.16(m,2h),4.01(s,3h),3.94(s,3h),3.10-3.16(m,4h)。质谱(esi)m/z:555.2(m+h)
+
。
[0430]
实施例22:4-(6-(1-((6-甲氧基吡啶-3-基)亚氨基)-1-氧化硫吗啉基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(ex.22):
[0431][0432]
在氮气下,往4-(6-(1-亚氨基-1-氧化硫吗啉基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(ex.20,0.50g,0.913mmol),5-溴-2-甲氧基吡啶(172mg,0.913mmol)和cs2co3(892mg,2.74mmol)的二恶烷(5ml)悬浮液中,加入xantphos(52.8mg,0.091mmol)和pd2(dba)3(41.8mg,0.0457mmol),所得混合物在100℃下搅拌5h,lc-ms显示反应完成。将反应混合物过滤,滤液减压浓缩得到残余物,通过制备型hplc纯化(柱:phenomenex luna c18 150*40mm*15um;流动相:[水(0.225%甲酸)-乙氰];b%:22%-52%,9分钟)得到4-(6-(1-((6-甲氧基吡啶-3-基)亚氨基)-1-氧化硫吗啉基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(ex.22,52.5mg,产率:10%),为黄色固体。分析数据:1h-nmr(400mhz,cdcl3):δ=8.83(d,j=2.4hz,1h),8.58(s,1h),8.37(s,1h),8.15(dd,j=2.4,8.8hz,1h),7.93-8.07(m,3h),7.43(dd,j=2.8,8.8hz,1h),6.93(d,j=8.8hz,1h),6.68(d,j=8.8hz,1h),4.52(d,j=16.0hz,2h),4.08(dd,j=9.6,12.8hz,
2h),4.01(s,3h),3.91(s,3h),3.38(dd,j=2.4,12.0hz,2h),3.15-3.27(m,2h)。质谱(esi)m/z:541.2(m+h)
+
。
[0433]
实施例23:4-(6-(4-((二甲基氧代-λ
4-亚磺酰基)氨基)哌啶-1-基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(ex.23):
[0434][0435]
n-(二甲基氧代-λ
4-亚磺酰基)-4-哌啶胺(int-9,51.6mg,0.292mmol),4-(6-氟吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(int-15,100mg,0.266mmol)和k2co3(73.5mg,0.532mmol)在dmso(2ml)中的混合物在90℃下搅拌3h,lc-ms显示反应完成。过滤收集固体产物,并用制备型hplc纯化(柱:shim-pack c18 150*25*10um;流动相:[水(0.225%甲酸)-乙氰];b%:11%-31%,10分钟)得到4-(6-(4-((二甲基氧代-λ
4-亚磺酰基)氨基)哌啶-1-基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(ex.23,27mg,产率:21%),为黄色固体。分析数据:1h-nmr(400mhz,dmso-d6):δ=9.28(s,1h),8.82(s,1h),8.64(d,j=2.3hz,1h),8.37(s,1h),8.13(s,1h),8.02(dd,j=2.5,8.9hz,1h),6.98(d,j=8.8hz,1h),4.13-4.22(m,2h),3.90(s,3h),3.31(s,3h),3.15(s,6h),1.65-1.82(m,2h),1.38-1.54(m,2h)。质谱(esi)m/z:476.2(m+h)
+
。
[0436]
实施例24:4-(6-(4-(((s)-s-甲基-s-苯基-氧代-λ
4-亚磺酰基)氨基)哌啶-1-基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(ex.24):
[0437][0438]
化合物ex.24按照实施例23描述的方法制备。分析数据:1h-nmr(400mhz,dmso-d6):δ=9.28(s,1h),8.82(s,1h),8.64(d,j=2.4hz,1h),8.37(s,1h),8.13(s,1h),8.01(dd,j=2.8,8.8hz,1h),7.91-7.93(m,2h),7.65-7.70(m,3h),6.98(d,j=8.8hz,1h),4.16(m,2h),3.90(s,3h),3.31(s,3h),3.15(s,3h),3.10-3.20(m,2h),1.79-1.83(m,1h),1.64-1.68(m,1h),1.41-1.54(m,2h)。质谱(esi)m/z:538.1(m+h)
+
。
[0439]
实施例25:4-(6-(4-(((r)-s-甲基-s-苯基-氧代-λ
4-亚磺酰基)氨基)哌啶-1-基)吡啶-3-基)-6-(1-甲基-1h-吡唑-4-基)吡唑并[1,5-a]吡嗪-3-甲腈(ex.25):
[0440][0441]
化合物ex.25按照实施例23描述的方法制备。分析数据:1h-nmr(400mhz,cdcl3):δ=8.78(d,j=2.4hz,1h),8.51(s,1h),8.33(s,1h),7.96-8.01(m,5h),7.61-7.66(m,3h),6.77(d,j=8.8hz,1h),4.26-4.32(m,2h),3.99(s,3h),3.24(m,1h),3.08-3.15(m,2h),3.13(s,3h),1.97(m,1h),1.61-1.78(m,3h)。质谱(esi)m/z:538.0(m+h)
+
。
[0442]
实施例26:ret激酶及其突变体和融合体的生化ic
50
值测定:
[0443]
本发明实施例中制备的化合物对ret激酶野生型,ret(v804m)突变体和ret-ccdc6融合体的生化抑制活性委托美国reaction biology corporation公司(地址:one great valley parkway,suite 2,malvern,pa 19355,usa)测定。详细的试验方法参见如下文献:t.anastassiadis,s.w.deacon,k.devarajan,h.ma,j.r.peterson.comprehensive assay of kinase catalytic activity reveals features of kinase inhibitor selectivity.nat.biotech.2011,29(11),1039-1045.
[0444]
一、测定的一般性条件:
[0445]
将本发明所述的化合物溶解于二甲基亚砜(dmso)中,配制成10mm的储备溶液,从10mm开始按照3-倍系列稀释,10个不同的剂量。本测定中使用的atp浓度为1μm。
[0446]
二、使用的试剂:
[0447]
基础反应缓冲液:20mm 4-(2-羟乙基)-1-哌嗪乙烷磺酸缓冲液(hepes,ph7.5),10mm氯化镁,1mm乙二醇-双(β-氨基乙基醚)-n,n,n',n'-四乙酸(egta),0.02%brij
tm-35(购自thermofisher scientific),0.02mg/ml牛血清白蛋白(bsa),0.1mm原钒酸钠(na3vo
4)
,2mm二硫苏糖醇(dtt),1%二甲基亚砜(dmso)。
[0448]
三、反应步骤:
[0449]
a)将相应的底物加入新鲜制备的基础反应缓冲液中;
[0450]
b)加入必要的辅助因子;
[0451]
c)加入激酶,并且轻轻摇晃;
[0452]
d)使用acoustic技术(echo550;nanoliter range)加入化合物的dmso溶液,并且于室温下孵育20分钟;
[0453]
e)加入
33
p-atp(specific activity 10μci/μl)引发反应;
[0454]
f)室温下孵育激酶反应2个小时;
[0455]
g)将反应点到p81离子交换纸(购自whatman)上;
[0456]
h)通过滤膜结合法检测激酶活性。
[0457]
四、数据获得和处理:
[0458]
用0.75%的磷酸充分洗涤滤膜以除去未结合的磷酸盐,减去源自含有非活性酶的对照反应的背景后,激酶活性表达为:受试化合物试验组的激酶剩余活性占空白试验对照组(dmso)的百分比。使用prism(graphpad软件)产生ic
50
值。
ccdc6,ret-ncoa4(ptc3),ret-prkar1a(ptc2)。实施例26测定了本发明部分化合物对突变ret激酶的代表ret(v804m)和融合ret激酶的代表ret-ccdc6的抑制活性。这些结果并不用来限制本发明的保护范围,本发明里的化合物对这两种以外的其他ret突变体或融合体具有抑制活性的也属于本发明的保护范围。
[0465]
实施例27:对肿瘤细胞中磷酸化ret和磷酸化erk的ic
50
值测定:
[0466]
本发明实施例中制备的化合物对肿瘤细胞中的磷酸化ret(phospho-ret)和磷酸化erk(phospho-erk)的抑制活性委托美国reaction biology corporation公司(地址:one great valley parkway,suite 2,malvern,pa 19355,usa)测定。
[0467]
一、测定的一般性条件:
[0468]
将本发明所述的化合物溶解于二甲基亚砜(dmso)中,配制成10mm的储备溶液,从10mm开始按照3-倍系列稀释,10个不同的剂量。试验使用elisa测定方式。
[0469]
二、试剂及细胞培养:
[0470]
phospho-ret(pantyr)和p44/42mapk(thr202/tyr204)(erk)sandwich elisa试剂盒从cell signaling technology购买。lc-2/ad肺癌细胞株从sigma-aldrich购买。lc-2/ad细胞在rpmi-1640:f-12k(1:1)中培养。培养基中添加了10%胎牛血清(fbs),100μg/ml青霉素和100μg/ml链霉素,将培养物保持在37℃,加湿的5%co2和95%空气的气氛中。
[0471]
三、反应步骤:
[0472]
a)将1.5x10
4 lc-2/ad细胞接种在96孔组织培养板的孔中过夜;
[0473]
b)细胞用dmso或者受试化合物的dmso溶液(起始浓度1μm,3-倍连续稀释,10个剂量)处理一个小时;
[0474]
c)用200ul冰冷的磷酸盐缓冲液(pbs)洗涤细胞一次,并用100μl/孔的细胞裂解缓冲液(1%np-40,20mm tris/ph=8.0,137mm nacl,10%甘油,2mm edta,蛋白酶/磷酸酶抑制剂混合物)洗涤。将该板摇动1分钟,然后将其置于4℃的摇摆平台上摇动30分钟;
[0475]
d)将80μl/孔的裂解物添加到每个elisa板的适当孔中。将板在摇动平台上于4℃孵育过夜;
[0476]
e)将板的内容物丢弃到容器中,并用200μl/孔的1x elisa洗涤缓冲液洗涤孔四次;
[0477]
f)将100μl重构的phospho-ret(pantyr)或phospho-erk(thr202/tyr204;p44/42mapk)检测抗体添加至适当的孔中,并将板在37℃下孵育1小时;
[0478]
g)重复洗涤程序,并将100μl重构的hrp-连接的第二抗体加入两个板的每个孔中,将板在37℃孵育30分钟;
[0479]
h)重复洗涤程序,向每个孔中加入100μl tmb底物,将该板在37℃下孵育45分钟;
[0480]
i)将100μl stop溶液添加到每个孔中,并将平板轻轻摇动几秒钟。
[0481]
四、数据获得和处理:
[0482]
使用envision 2104multilabel reader(购自perkinelmer,santa clara,ca,usa)在460nm处读取吸光度;使用graphpad prism 4软件基于s型剂量响应方程式(sigmoidal dose-response equation)绘制ic
50
曲线,并计算ic
50
值。
[0483]
五、测定结果:
[0484]
本发明实施例中制备的化合物对lc-2/ad肺癌肿瘤细胞中phospho-ret和phospho-erk的ic
50
值列于表2中:
[0485]
表2
[0486][0487]
loxo292*是一款处于临床试验阶段的ret抑制剂,此处用做作阳性对照品。
[0488]
从表2所列数据可以看出,本发明实施例中合成的部分化合物对肿瘤细胞中的磷酸化ret和磷酸化erk具有很强的抑制作用,ic
50
值小于100nm,个别情况下小于1nm,达到皮摩尔级别。有趣的是,与阳性对照品loxo292相比,本发明中的化合物对磷酸化erk的抑制活性要强得多,前者的ic
50
值>1000nm,而本发明的化合物的ic
50
值多数低于个位数nm。这一点也说明本发明中的化合物比loxo292在抑制肿瘤细胞中的关键肿瘤驱动靶点erk具有明显的优势。
[0489]
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对其作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1