ssl2084基因在合成中长链脂肪酸中的应用的制作方法
本发明涉及ssl2084基因在合成中长链脂肪酸中的应用,特别涉及集胞藻pcc6803中ssl2084基因在低温条件下合成集胞藻中长链饱和脂肪酸的应用,属于基因工程技术领域。
背景技术:
脂肪酸是生物体基本组成之一,具有重要的生理功能。它们既是细胞膜脂的主要成分,又是重要的能源物质,还是一些信号分子的前体,可与其它物质一起分布于机体表面,防止机械损伤和热量散发等。此外它还与细胞识别、种特异性和组织免疫等有密切关系。
多不饱和脂肪酸(polyunsaturatedfattyacids,pufas)是指含有两个以上双键且碳原子数为16~22的直链脂肪酸。是构成高等动、植物细胞的重要成分之一,对人体具有重要的生理功能,在营养学和医学领域有着重要作用。目前市场上的pufas仍无法满足人们的需求,且价格昂贵,存在潜在的污染问题进而影响生态可持续发展。多不饱和脂肪酸的合成以中长链饱和脂肪酸,特别是c12:0,c16:0,c18:0脂肪酸为原料基础。中长链饱和脂肪酸在脂肪酸去饱和酶的作用下,在特定部位产生双键,最终产生不饱和脂肪酸。因此增加中长链饱和脂肪酸的产量,可为多不饱和脂肪酸的合成奠定基础。
蓝藻(cyanobacteria)是地球上出现最早的光合自养原核生物,是最重要的原初生产者之一,能适应多种环境。并且多数蓝藻及其提取物对人畜无毒,是转基因研究的良好受体。集胞藻pcc6803(synechocystissp.pcc6803)做为一种单细胞蓝藻,具有生长速度快、培养条件简单、不产生毒素、细胞结构简单、遗传背景清楚、方便分子操作等特点,适合于利用生物反应器大规模生产,是理想的蓝藻基因工程受体。
如何提高微藻中的脂肪酸含量已成为广泛研究的热点。而随着代谢工程技术的发展及日趋成熟,通过改造、阻断及引入新的代谢途径来提高细胞内不饱和脂肪酸的含量,可以在提高目标产物得率的同时减少副产物的生成。在众多方法中,基因工程手段已被证明是一种非常有效的方法而受到世界各国科学家的青睐,有关微藻脂肪酸代谢相关的基因工程研究仍处在起步阶段。研究表明,微藻在胁迫条件下生长时细胞分裂速率下降、细胞生长变得缓慢、新物质的合成会逐渐停止,但作为一种保护机制,脂肪酸的合成得以持续并积累。
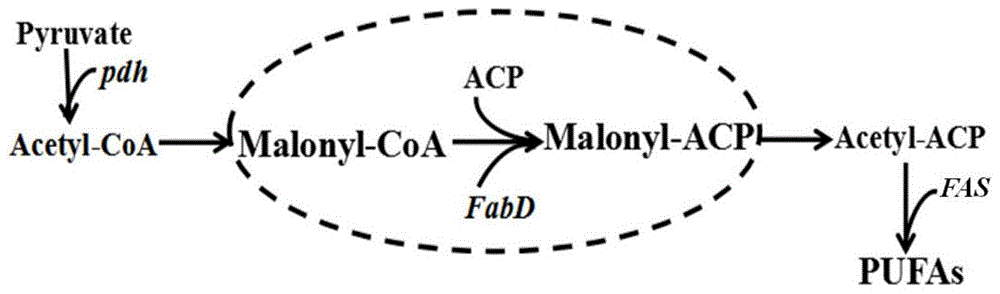
在微藻脂肪酸代谢途径中,丙酮酸在丙酮酸脱氢酶复合体(pyruvatedehydrogenase,pdh)的催化下氧化脱羧形成乙酰辅酶a,乙酰辅酶a在乙酰辅酶a羧化酶(acetyl-coacarboxylase,accase)的催化下生成丙二酰辅酶a(malonyl-coa)。丙二酰辅酶a在丙二酰coa酰基载体蛋白转移酶催化下,与酰基载体蛋白(acylcarrierprotein,acp)结合,生成脂肪酸延长过程中碳链的供体丙二酰-acp(malonyl-acp)。在脂肪酸合成酶(fattyacidssynthase,fas)的作用下,malony-acp经过一系列反应,最终能形成脂肪酸(fattyacids,fas),如图1所示。
acp位于脂肪酸代谢途径的中心,其能够与脂肪酸代谢途径中各种蛋白包括fabb、fabf、fabg、fabh和fabz等发生相互作用。acp作为载体蛋白大家族的一员,其三级结构极其保守。在细胞的新陈代谢过程中,acp联系着各种重要的蛋白复合体酶系,它的主要功能就是将酰基链在不同酶的中心位点之间转运,同时可作为许多天然产物的酰基供体,与脂肪酸合成酶途径息息相关。研究发现acp在细胞中初始主要以无活性的apo-acp形式存在,通过特殊的翻译后修饰,在其高度保守的丝氨酸位点连接4’-磷酸泛酰基巯基乙胺辅基组,将起始无活性的apo-acp转换为有活性的holo-acp,从而发挥作用。研究表明,acp不仅参与脂肪酸合成,还参与脂肪酸的不饱和反应;acp能够依靠串联酰基载体蛋白形成的四元结构增强催化效果,提高不饱和脂肪酸的产量;将acp的疏水残基用色氨酸替代可改变细胞内脂质组成,增加细胞内中链脂肪酸的含量。目前在集胞藻pcc6803中acp和中长链脂肪酸合成中的作用研究还未有报道。
技术实现要素:
本发明针对现有技术的不足,提供一种ssl2084基因在合成中长链脂肪酸中的应用。
本发明通过使用同源重组技术在集胞藻pcc6803中增加ssl2084基因的表达后,发现ssl2084基因过表达突变株中c12:0、c16:0和18:0的含量显著增加,分别为1.50mg/g、8.74mg/g和0.60mg/g,与野生型相比分别增加了54.71%、50.82%和155.86%。同时在低温(20℃)处理条件时,ssl2084基因过表达突变株中c12:0,c16:0,c18:0的含量进一步增加,分别达到1.70mg/g、11.85mg/g和2.31mg/g,与野生型相比分别提高了31.94%、47.35%和39.90%。
本发明技术方案如下:
一种在集胞藻中促进合成中长链脂肪酸的蛋白ssl2084,氨基酸序列如seqidno.2所示。
一种ssl2084基因在合成集胞藻中长链饱和脂肪酸中的应用,所述ssl2084基因核苷酸序列如seqidno.1所示。
根据本发明优选的,所述中长链饱和脂肪酸为c12:0、c16:0、c18:0饱和脂肪酸。
根据本发明优选的,上述应用,通过构建过表达中长链脂肪酸的蛋白ssl2084的集胞藻工程菌,然后经扩大培养,诱导培养,提纯,制得中长链饱和脂肪酸。
根据本发明优选的,所述集胞藻工程菌的构建过程如下:
(1)以pcpc560片段为启动子片段,与ssl2084基因进行基因融合,制得融合片段pcpc560+ssl2084;
所述pcpc560的核苷酸序列如seqidno.3所示;
(2)制备同源重组上游臂slr1285u基因片段,核苷酸序列如seqidno.4所示;
(3)制备同源重组下游臂slr1285d基因片段,核苷酸序列如seqidno.5所示;
(4)用kpni内切酶酶切步骤(2)制得的同源重组上游臂slr1285u基因片段,与同样经kpni内切酶酶切的质粒pbluescriptskt1t2连接,制得质粒pbluescriptskt1t2-slr1285u;
(5)用saci内切酶酶切步骤(3)制得的同源重组下游臂slr1285d基因片段,与同样经saci内切酶酶切的步骤(4)制得的质粒pbluescriptskt1t2-slr1285u连接,制得质粒pbluescriptskt1t2-slr1285ud;
(6)将步骤(1)制得的融合片段pcpc560+ssl2084经sali、ecori内切酶酶切后,与同样经sali、ecori内切酶酶切的步骤(5)制得的质粒pbluescriptskt1t2-slr1285ud连接,制得重组载体p5s1285ud-ssl2084;
(7)用bamhi内切酶酶切质粒pbluescript-spe,回收壮观霉素抗性spe片段,与同样经bamhi内切酶酶切的步骤(6)制得的质粒p5s1285ud-ssl2084连接,制得质粒pbluescriptskt1t2-slr1285ud-spe;
(8)将步骤(7)制得的重组载体pbluescriptskt1t2-slr1285ud-spe转化集胞藻pcc6803,经筛选,制得转基因集胞藻。
根据本发明优选的,所述步骤(1)中,基因融合步骤如下:
初次融合反应体系如下:
分别取pcpc560启动子片段和集胞藻pcc6803ssl2084基因片段各2μl为模板,
初次融合反应程序如下:
94℃预变性5min,94℃变性1min,55℃退火1min,72℃延伸5min,2个循环;
二次融合反应体系如下:
向初次融合反应后的体系内加入引物pcpc560-sali-f和ssl2084-ecori-his-r各0.5μl,使总反应体系达到20μl。
二次融合反应程序如下:
94℃变性30s,55℃退火30s,72℃延伸3min,25个循环;72℃延伸10min,4℃保存。
根据本发明优选的,所述扩大培养条件为:温度28~32℃、40~50μmolphoton·m-2·s-1持续光照条件下,在bg-11培养基中振荡培养。
根据本发明优选的,所述诱导培养条件为:温度18~22℃、40~50μmolphoton·m-2·s-1持续光照条件下,在bg-11培养基中振荡培养。
进一步优选的,所述bg-11液体培养基每升组份如下:
bg-11固体培养基为在bg-11液体培养基基础上每升再加入如下组分:
硫代硫酸钠3g
浓度1mol/l、naoh调ph值至8.2的三羟甲基甲胺基乙磺酸10ml
琼脂粉15g
上述100×bg-11(不含fe、磷酸盐、碳酸盐)每升组份如下:
其中traceminerals每升组份如下:
根据本发明优选的,所述提纯,步骤如下:
(i)将诱导培养后的发酵液经离心,收集藻体,经干燥,研磨破碎,制得藻粉,然后加入甲醇-氯仿提取液中,超声混合萃取,固液分离,保留有机相,残渣用甲醇-氯仿提取液重复萃取,合并有机相,制得提取粗液;
(ii)向步骤(i)制得的提取粗液中加入提取粗液体积25%的氯仿和30%质量浓度为1%的氯化钠溶液,混合均匀,静置分层,回收下层溶液,对上层溶液重复上述步骤,合并下层溶液,干燥至恒重,即得。
根据本发明进一步优选的,所述步骤(i)中,甲醇-氯仿提取液甲醇-氯仿提取液中甲醇与氯仿的体积比为2:1。
根据本发明进一步优选的,所述步骤(i)中,所述离心为6000rpm离心15min。
根据本发明进一步优选的,所述步骤(i)中,藻粉与甲醇-氯仿提取液的质量体积比为1:(30~40),单位g/ml。
根据本发明进一步优选的,所述步骤(i)和(ii)中,重复次数均为两次。
根据本发明进一步优选的,所述步骤(ii)中,干燥为在50℃氮气条件下干燥。
本发明所述集胞藻pcc6803中的ssl2084基因序列为234个碱基,编码78个氨基酸。以pcpc560片段为启动子片段,与ssl2084基因进行基因融合。以slr1285u片段为上游臂,以slr1285d为下游臂,并插入壮观霉素抗性片段,构建同源重组载体,再进行遗传转化集胞藻pcc6803,增加集胞藻pcc6803内源基因ssl2084的表达,得到集胞藻pcc6803ssl2084基因过量表达的转基因突变藻株。
有益效果
1、本发明首次公开了集胞藻pcc6803的ssl2084基因在低温下对合成中长链饱和脂肪酸合成的重要作用,通过在集胞藻pcc6803中利用过表达方法增加ssl2084基因的表达,突变株中c12:0、c16:0和18:0的含量显著增加,分别为1.50mg/g、8.74mg/g和0.60mg/g,与野生型相比分别增加了54.71%、50.82%和155.86%。同时经低温处理后,突变株中c12:0,c16:0,c18:0的含量进一步增加,分别达到1.70mg/g、11.85mg/g和2.31mg/g,与野生型相比分别提高了31.94%、47.35%和39.90%;这改变了本领域通常认为低温容易合成不饱和脂肪酸的认识;
2、本发明在集胞藻pcc6803中,通过双同源重组方法增加ssl2084基因在集胞藻pcc6803中的表达水平并将突变株进行低温胁迫,显著提高了集胞藻pcc6803中的中长链脂肪酸的含量,尤其c12:0,c16:0,c18:0的含量。因此,该基因在集胞藻pcc6803中增加中长链脂肪酸含量具有重要意义,这为提高集胞藻pcc6803的中长链脂肪酸研究提供了新的思路;
3、本发明应用的基因与方法可以为微藻及中长链脂肪酸的研究提供理论支持。
附图说明
图1为集胞藻pcc6803中脂肪酸生物合成途径示意图;
图2为集胞藻pcc6803ssl2084基因过量表达载体结构图;
图3为集胞藻pcc6803ssl2084基因过量表达突变体pcr扩增检测电泳图;
图中:(a),ssl2084基因过量表达载体结构图;(b),ssl2084基因过量表达突变体pcr扩增检测电泳图;
图4为集胞藻pcc6803ssl2084基因过量表达突变体westernblot检测图;
图5为集胞藻pcc6803ssl2084基因过量表达突变株不同温度处理条件下生长曲线图;
图中:(a),常温(28~32℃、40~50μmolphoton·m-2·s-1)处理条件下生长曲线图;(b),低温(18~22℃、40~50μmolphoton·m-2·s-1)处理条件下生长曲线图;
图6为集胞藻pcc6803ssl2084基因过量表达突变株不同温度处理条件下脂肪酸分析检测图;
图中:(a),常温(28~32℃、40~50μmolphoton·m-2·s-1)处理条件下脂肪酸分析检测图;(b),低温(18~22℃、40~50μmolphoton·m-2·s-1)处理条件下脂肪酸分析检测图;
图7为集胞藻pcc6803ssl2084基因过量表达突变株低温处理条件下gc-ms脂肪酸检测图;
图中:低温处理条件下为18~22℃、40~50μmolphoton·m-2·s-1处理条件下;wt,集胞藻pcc6803藻株gc-ms脂肪酸检测图;ssl2084(+),集胞藻pcc6803ssl2084基因过量表达突变株gc-ms脂肪酸检测图。
具体实施方式
以下实施例描述了本发明在构建集胞藻pcc6803的ssl2084基因过量表达载体及转化集胞藻pcc6803的方法及其在增加中长链脂肪酸方面的应用。下面结合说明书附图及实施例对本发明做进一步说明,但本发明所保护范围不限于此。
施例中所用实验材料来源如下:
大肠杆菌菌株(escherichiacoli)dh5α感受态细胞及快速连接载体t3购自北京全式金生物技术有限公司;野生型集胞藻pcc6803购自中国科学院典型培养物保藏委员会淡水藻种库;
质粒pbluescriptskt1t2购自天津博美科生物技术有限公司;
质粒pbluescript-spe购自中国质粒载体菌株细胞株基因保藏中心;
其它所使用的酶、试剂及试剂盒等均为市售产品;
培养基:
bg-11液体培养基每升组份如下:
bg-11固体培养基为在bg-11液体培养基基础上每升再加入如下组分:
硫代硫酸钠3g
浓度1mol/l、naoh调ph值至8.2的三羟甲基甲胺基乙磺酸10ml
琼脂粉15g
上述100×bg-11(不含fe、磷酸盐、碳酸盐)每升组份如下:
其中traceminerals每升组份如下:
实施例1
分离克隆用于构建转集胞藻pcc6803ssl2084基因过表达载体的ssl2084基因cdna片段、pcpc560启动子片段,同源重组上游片段slr1285ucdna片段和同源重组下游片段slr1285dcdna片段。
集胞藻pcc6803pcpc560启动子片段克隆:根据genbank登陆的集胞藻pcc6803(登录号:ba000022,ap012205)中将pcpc560作为启动子,设计引物:
pcpc560-sali-f:5’-aatgtcgacacctgtagagaagagtccct-3’;
pcpc560-r:5’-tgaattaatctcctacttgac-3’。
扩增体系如下:
扩增程序如下:
94℃预变性5min,94℃变性30s,55℃复性30s,72℃延伸1min,35个循环后,72℃10min,4℃保存。
pcr反应结束后进行电泳切胶回收,连接到t3载体克隆载体后转化大肠杆菌dh5α,筛选阳性克隆并测序。获得集胞藻pcc6803pcpc560启动子片段,核苷酸序列如seqidno.3所示。
pcpc560+ssl2084片段克隆:
根据ncbiblast网站(http://blast.st-va.ncbi.nlm.nih.gov/blast.cgi?program=blastn&page_type=blastsearch&link_loc=blasthome)公布的序列号为cp028094的集胞藻pcc6803中的ssl2084基因序列,设计扩增引物(3'端加his标签):
ssl2084-fpcpc-f:5’-agtaggagattaattcaatgaatcaggaaatttttg-3’;
ssl2084-ecori-his-r:
5-gcggaattcttaatgatgatgatgatgatgtttactttcgatatgctc-3’。
扩增体系如下:
扩增程序如下:
94℃预变性5min,94℃变性30s,60℃复性30s,72℃延伸1min,35个循环后,72℃10min,4℃保存。
pcr反应结束后进行电泳切胶回收,获得集胞藻pcc6803ssl2084基因片段,核苷酸序列如seqidno.1所示。
分别取pcpc560启动子片段和集胞藻pcc6803ssl2084基因片段2μl为模板,进行融合pcr反应,连接到t3载体克隆载体后转化大肠杆菌dh5α,筛选阳性克隆并测序。获得pcpc560+ssl2084片段。
初次融合反应体系如下:
分别取pcpc560启动子片段和集胞藻pcc6803ssl2084基因片段2μl为模板,
融合pcr反应中,初次融合反应程序如下:
94℃预变性5min,94℃变性1min,55℃退火1min,72℃延伸5min,2个循环;
二次融合反应体系如下:
向初次融合反应后的体系内加入引物pcpc560-sali-f和ssl2084-ecori-his-r各0.5μl,使总反应体系达到20μl。
二次融合反应程序如下:
94℃变性30s,55℃退火30s,72℃延伸3min,25个循环;72℃延伸10min,4℃保存。
同源重组上游臂slr1285u基因片段克隆:
根据genbank数据库中公布的集胞藻pcc6803slr1285序列(登录号为:cp003265.1)上游1627bp到上游624bp处作为上游臂,设计扩增引物:
slr1285u-kpni-f:5’-ataggtaccgaaacctgggtgagtctggct-3’;
slr1285u-kpni-r:5’-ataggtacctgttggaaggttgctgattact-3’。
扩增程序如下:
94℃预变性5min;94℃变性30s,60℃复性30s,72℃延伸1min,35个循环;72℃延伸10min,4℃保存。pcr反应结束后进行电泳切胶回收,获得同源重组上游臂slr1285u基因片段;
扩增体系如下:
同源重组下游臂slr1285d基因片段克隆:
根据genbank数据库中公布的集胞藻pcc6803slr1285序列(登录号为:cp003265.1)上游611bp到slr1285orf392bp处作为下游臂,设计扩增引物:
slr1285d-saci-f:5’-atagagctctttagtgaaaaaatattgac-3’;
slr1285d-saci-r:5’-atagagctcgtcatcagccagcaaaattgc-3’。
扩增程序如下:94℃预变性5min,94℃变性30s,60℃复性30s,72℃延伸1min,35个循环后,72℃10min,4℃保存。
pcr反应结束后进行电泳切胶回收,获得同源重组下游臂slr1285d基因片段;
扩增体系如下:
实施例2
集胞藻pcc6803ssl2084基因过表达载体的构建:
实施例1制得的同源重组上游臂slr1285u基因片段用kpni单酶切,回收slr1285u基因片段;用同样的方法单酶切质粒pbluescriptskt1t2,回收载体片段1。连接回收的slr1285u基因片段和载体片段1,转化大肠杆菌dh5α。通过筛选阳性克隆,获得前期载体,命名为pbluescriptskt1t2-slr1285u。
连接反应体系为:
t4dna连接酶1μl,载体片段3μl,目的片段3μl,10×t4dnaligationbuffer2μl,ddh2o11μl,总反应体系为20μl。16℃连接过夜。
实施例1制得的同源重组下游臂slr1285d基因片段用saci单酶切,回收slr1285d基因片段;用同样的方法单酶切质粒pbluescriptskt1t2-slr1285u回收载体片段2。连接回收的slr1285d基因片段和载体片段2,转化大肠杆菌dh5α。通过筛选阳性克隆,获得前期载体,命名为pbluescriptskt1t2-slr1285ud。
连接反应体系为:
t4dna连接酶1μl,载体片段3μl,目的片段3μl,10×t4dnaligationbuffer2μl,ddh2o11μl,总反应体系为20μl。16℃连接过夜。
将实施例1中得到的阳性克隆pcpc560+ssl2084质粒dna用sali、ecori酶切,回收基因片段pcpc560+ssl2084。同样,对含有t1t2终止子的质粒pbluescriptskt1t2-slr1285ud进行sali、ecori单酶切,回收载体片段3。连接基因片段pcpc560+ssl2084和载体片段3,转化大肠杆菌dh5α。
连接反应体系为:
t4dna连接酶1μl,载体片段3μl,目的片段3μl,10×t4dnaligationbuffer2μl,ddh2o11μl,总反应体系为20μl。16℃连接过夜。
将质粒pbluescript-spe用bamhi单酶切,回收壮观霉素抗性spe片段,质粒pbluescriptskt1t2-slr1285ud用bamhi单酶切,回收载体片段4。连接回收的spe片段和载体片段4,转化大肠杆菌dh5α。连接反应体系为:
t4dna连接酶1μl,载体片段3μl,目的片段3μl,10×t4dnaligationbuffer2μl,ddh2o11μl,总反应体系为20μl。16℃连接过夜。
通过酶切筛选阳性克隆,获得含壮观霉素抗性的集胞藻pcc6803原核表达载体,命名为表达载体p5s1285udssl2084,如图2所示。
通过自然转化方法(williams,j.g.k.,1988.constructionofspecificmutationsinphotosystemiiphotosyntheticreactioncenterbygeneticengineeringmethodsinsynechocystispcc6803.methodsenzymol.167:766-778.)将构建好的载体导入集胞藻pcc6803中,经抗生素筛选,鉴定得到转基因阳性集胞藻,步骤如下:
取对数培养期(od730=0.6)的集胞藻pcc6803培养液30ml,在室温条件下,4500g离心8min,弃上清;加新鲜bg-11液体培养基洗涤一次后,加新鲜bg-11液体培养基至终浓度od730=4.8,并立刻用来转化;将收集的藻液分装到到1.5mlep管中(每管400μl),每管加5~10μg质粒,弱光条件下光照温育6小时,期间摇晃一次。将混合物涂到含有壮观抗生素(50μg/ml)的bg-11固体培养基上。约10天可见转化子。制得含ssl2084基因过表达载体p5s1285udssl2084的转基因集胞藻pcc6803。
实施例3
ssl2084基因过量表达藻株pcr检测
以含表达载体p5s1285udssl2084的转基因集胞藻pcc6803和野生型集胞藻pcc6803为材料,提取总dna进行pcr检测分析。具体方法如下:
采用中性酚试剂(购自invitrogen公司)并利用玻璃珠震荡法从ssl2084基因过表达的突变株和野生型集胞藻pcc6803中提取dna。具体操作步骤如下:取50mlod730=1.8的蓝藻,4℃,5000rpm离心10min收集藻细胞,加入0.4ml中性酚接0.4mlbg-11液体培养基,然后加入适量的直径为0.17mm左右的玻璃珠(购自sigma公司)至玻璃珠界面上方有0.5ml的悬浮液。通过涡旋振荡器以最大速率震荡1min,4℃,11900rpm离心10min,取上清液至新的1.5ml离心管中,加入0.5ml苯酚/三氯甲烷/异戊醇(体积比25:24:1),颠倒混匀15s,静置3~5min,4℃,11900rpm离心10~15min。取上清到新的1.5ml离心管中,加入0.5ml异丙醇,颠倒混匀后室温静置10min。4℃,11900rpm离心10min。去上清,加入1ml75%乙醇(v/v),颠倒振荡几次,4℃,7500rpm离心10min。弃上清,室温下敞口晾干至沉淀透明,加入适量ddh2o溶解沉淀,制得ssl2084基因过表达的集胞藻和野生型集胞藻总dna。
以ssl2084基因过量表达转基因集胞藻基因组dna和野生型集胞藻dna为模板,分别以pcpc560-sali-f和ssl2084-ecori-his-r,pcpc560-sali-f和t1t2-r,slr1285u-kpni-f和ssl2084-ecori-his-r,pcpc560-sali-f和slr1285d-saci-r,slr1285u-kpni-f和slr1285d-saci-r为引物对,进行pcr扩增,扩增体系分别如下:
具体扩增程序均如下:
94℃预变性5min,94℃变性30s,60℃复性30s,72℃延伸1min,35个循环后,72℃10min,4℃保存。
电泳检测pcr产物如图3所示。
实施例4
ssl2084基因过量表达藻株westernblot检测
以含表达载体p5s1285udssl2084的转基因集胞藻pcc6803和野生型集胞藻pcc6803为材料,提取总蛋白进行westernblot检测分析。具体方法如下:
采用超声破碎法从ssl2084基因过表达的突变株和野生型集胞藻pcc6803中提取总蛋白。
具体操作步骤如下:
取50mlod730=1.8的蓝藻,4℃,5000rpm离心10min收集藻细胞,用tris-hcl(40mmol/l,ph8.0)重悬藻细胞,并加入蛋白酶抑制剂pmsf(苯甲基磺酰氟,0.1mol/l)至终浓度为1mmol/l。藻细胞超声破碎,每超声3s间隔3s,总计超声破碎时间为15min左右,整个超声过程样品都放置在冰水浴中。在4℃,5000g离心10min去除破碎的细胞残渣。吸取上清,转移到新的洁净离心管中,即得到藻细胞总蛋白。
根据标准方法(sambrookj,fritschefandmaniatist.molecularcloning.alaboratorymanual,3nded[m].newyork,coldspringharborlabotatorypress,2001.)进行westernblot,将蛋白质上清经质量百分比浓度12%的sds-page胶电泳后恒流转移至pvdf膜上,用质量百分比浓度5%脱脂奶粉室温封闭1h,弃封闭液,用一抗(his-tag)室温孵育1h,tbst洗膜3次,二抗(羊抗兔血清igg)室温孵育1h,tbst洗膜3次。利用ecl化学发光检测试剂盒进行显色,用凝胶成像仪(chemidocxrs+,美国)曝光成像。westernblot检测结果如图4所示。
实施例5
集胞藻pcc6803ssl2084基因过表达突变藻株温度处理条件下生长曲线测定
将野生型集胞藻pcc6803和ssl2084基因过量表达转基因藻株分别接种于50mlbg-11液体培养基中,调节初始接种浓度od730一致,于28~32℃、40~50μmolphoton·m-2·s-1和18~22℃,40~50μmolphoton·m-2·s-1条件下振荡培养(180rpm),每24小时取一次样,通过测定od730来监测其生长情况,结果如图5所示。
由图5(a)可以看出,发现ssl2084基因过量表达突变株的生长趋势与野生型集胞藻相似,说明过量表达ssl2084基因没有对藻株的生长趋势产生明显的影响,但与野生型相比,ssl2084基因过量表达突变株的生长状态受到轻微限制。
由图5(b)可以看出,野生型和ssl2084基因过量表达突变株在20℃条件下的生长速率都明显低于30℃条件下的生长速率。说明低温对藻株的生长都产生了限制影响。ssl2084基因过量表达突变株在第1~5天的生长速率略高于野生型,但之后的生长速率则低于野生型,但并没有出现显著的差异。说明ssl2084基因过量表达突变株对低温的响应可能比野生型略微敏感。
实施例6
集胞藻pcc6803ssl2084基因过量表达突变株温度处理条件下脂肪酸分析检测
以野生型集胞藻pcc6803作为对照,将ssl2084基因过量表达突变藻株接种于新鲜的1lbg-11液体培养基中,在28~32℃、40~50μmolphotonsm-2s-1光强条件下通气培养至对数生长期后,取一瓶于18~20℃、40~50μmolphotonsm-2s-1光强条件下通气培养,另一瓶仍在28~32℃、40~50μmolphotonsm-2s-1光强条件下通气培养。3d后4500rpm离心10min收集藻细胞。每个样品在不同条件的处理组均收集3个,作为平行样。将收集的藻细胞在真空冷冻干燥仪进行冷冻干燥处理得到藻粉。
准确称取200mg藻粉,液氮研磨破碎藻细胞后用甲醇-氯仿(2:1)超声提取,离心分离后,残渣再加甲醇-氯仿提取,离心分离,保留有机相,重复2次;合并有机相提取液转移到分液漏斗中,加入氯仿和1%氯化钠溶液混匀,静置分层,回收下层;加2.5ml氯仿于原上、中层溶液中再萃取一次,回收下层,重复2次;合并下层液,置于提脂瓶中,50℃氮气挥干溶剂至恒重,于天平称量得到总脂含量。
将提取的总脂用氯仿溶于10ml具塞试管中,加入5.0ml0.04mol/l氢氧化钾-甲醇溶液混匀,置于60℃水浴中皂化1h,每隔10min振荡一次。将皂化好的样品取出冷却后加入4.0ml盐酸-甲醇(1:9)溶液混匀,再加20.0μl十九碳酸内标(1.5mg/ml),在60℃水浴中甲酯化20min,期间振荡一次;将甲酯化好的样品冷却后加入饱和食盐水3.0ml,加入正己烷1.0ml,充分振荡,静置,取正己烷层进行gc-ms分析,结果如图6所示。
由图6(a)可以看出,在28~32℃、40~50μmolphotonsm-2s-1培养条件下,ssl2084基因过量表达突变株产生的总脂肪酸含量为24.41±0.95mg/g(dcw),是野生型的1.5倍(16.31±1.08mg/g)。同时ssl2084(+)突变株中c12:0、c16:0和18:0的含量显著增加,分别为1.50mg/g、8.74mg/g和0.60mg/g,与野生型相比分别增加了54.71%、50.82%和155.86%。ssl2084基因过量表达突变株中c11:0含量为2.10mg/g,比野生型相比降低了124.41%。以上结果表明,在集胞藻pcc6803中过表达ssl2084基因能提高总脂肪酸中的中长链饱和脂肪酸的含量。
由图6(b)可以看出,在18~20℃、40~50μmolphotonsm-2s-1培养条件下,ssl2084基因过量表达突变株中总脂肪酸含量为31.26±1.93mg/g,含量低于相同条件下野生型产生的总脂肪酸(42.30±2.56mg/g)。但c12:0、c16:0和c18:0含量进一步提高,分别达到1.70mg/g、11.85mg/g和2.31mg/g,与野生型相比分别提高了31.94%、47.35%和39.90%。说明ssl2084基因过量表达突变株在低温胁迫条件下,总脂肪酸及c12:0、c16:0和c18:0的含量得到进一步提高。以上结果表明低温促进了ssl2084基因过量表达突变株产生更多的中长链饱和脂肪酸。
序列表
<110>山东省农业科学院生物技术研究中心
<120>ssl2084基因在合成中长链脂肪酸中的应用
<160>5
<170>siposequencelisting1.0
<210>1
<211>234
<212>dna
<213>集胞藻(synechocystissp.)
<400>1
atgaatcaggaaatttttgaaaaagtaaaaaaaatcgtcgtggaacagttggaagtggat60
cctgacaaagtgacccccgatgccacctttgccgaagatttaggggctgattccctcgat120
acagtggaattggtcatggccctggaagaagagtttgatattgaaattcccgatgaagtg180
gcggaaaccattgataccgtgggcaaagccgttgagcatatcgaaagtaaataa234
<210>2
<211>77
<212>prt
<213>集胞藻(synechocystissp.)
<400>2
metasnglngluilepheglulysvallyslysilevalvalglugln
151015
leugluvalaspproasplysvalthrproaspalathrphealaglu
202530
aspleuglyalaaspserleuaspthrvalgluleuvalmetalaleu
354045
glugluglupheaspilegluileproaspgluvalalagluthrile
505560
aspthrvalglylysalavalgluhisilegluserlys
657075
<210>3
<211>560
<212>dna
<213>集胞藻(synechocystissp.)
<400>3
acctgtagagaagagtccctgaatatcaaaatggtgggataaaaagctcaaaaaggaaag60
taggctgtggttccctaggcaacagtcttccctaccccactggaaactaaaaaaacgaga120
aaagttcgcaccgaacatcaattgcataattttagccctaaaacataagctgaacgaaac180
tggttgtcttcccttcccaatccaggacaatctgagaatcccctgcaacattacttaaca240
aaaaagcaggaataaaattaacaagatgtaacagacataagtcccatcaccgttgtataa300
agttaactgtgggattgcaaaagcattcaagcctaggcgctgagctgtttgagcatcccg360
gtggcccttgtcgctgcctccgtgtttctccctggatttatttaggtaatatctctcata420
aatccccgggtagttaacgaaagttaatggagatcagtaacaataactctagggtcatta480
ctttggactccctcagtttatccgggggaattgtgtttaagaaaatcccaactcataaag540
tcaagtaggagattaattca560
<210>4
<211>1000
<212>dna
<213>人工序列(人工序列)
<400>4
gaaacctgggtgagtctggcttgggtatagagcaacaaaattctctgcagttggggagac60
tgctcaaactctcgtaaaagtatatgggcacttagtttccaagcttccccttgcacctgg120
acgatgacctggcttgtggtttgttttccccccagaataatgggcaatcccaccattcct180
tcattgccaattaaaccaatttctgtggtggagccatcttccataattgagacaacggaa240
atcatagctgtattgggaaaataggcaaattccatcacctcattgggctcgtatagtact300
gtgccggtcttgtagacaacttttttgagatggggcgctaaacgtttataagcttcgacg360
gggaggagtcctaataactgatttaattttatgggaggattattggtcattggcaatgca420
attaattaaaaatggcatctcaattcactaacaatcataagggttgtatgctaacgccac480
ttagattcatttgaattaaaatgtttatgactccttgtctcccaaagcttggaaaaattt540
actctgcacgataagctgatctctgtatagagtaaggattgtgcgcaaacgggacgccgg600
tcaggcccaaaccaagagtttatcttcggaactacattcttatctgtacgaaacaggact660
ttaggagaatttattaatagaaaattttccggccatagtcaatatcaaggcgatttagtc720
tcgacttcaacctttttactctgtaattcataaatcttttaatccgatttagtgaaaata780
atcaattctctatggcctcgatgatggcgatcgccaaaacttgatagctggtgccgattt840
tatttttttcggtaactaagtatctctattagacttgatacaaaacaggattctacagtg900
agaaatactaaatttattagcgtttttttctgtctgtgttgggtccgatttcactgtggg960
ggcgatcgccaagggtggagtaatcagcaaccttccaaca1000
<210>5
<211>1003
<212>dna
<213>人工序列(人工序列)
<400>5
tttagtgaaaaaatattgacattaagatatcttaattgactctcggtgatctcttcttca60
aaaggagtgaagtcatgaccagttctagcattgatggcgtgggggtggcatttttagtac120
gggtttagaccggcgatcggttgcttaaaaataacagggtgacggagttcttccgctgga180
tatgttcaccgtaggaggacaattgctcggagtagttgacaccaccagtgcaaaacctta240
attaggtaattagattttaaaaccgcataaactcataatttctattggatcgtacctgcg300
ccaatgatcatagtgttaatgcatcacaaaaatgattgaggaattaacgtagttttgccc360
tggtcaagacggagagcggtataggtttgtcatcctttcttcgcgcctttgcgtccatcc420
gtcggattttgttcggttttacgcctaagggggaaaggaaaatgggcttaccatcaggga480
gagaggccacacaagactgctgagtctgttaaattgcagtggcaaaaagtttgctatttc540
ctattccctttcagaacatcgtcccccgttgttaccgctgttaactttcccatcctaaaa600
atctggttcccgtgaatgaagtttgcctaaagttgagtgatttgtttgtgtcttccggtt660
ggggaggatatgaccgagggcgggctccccagtgggcccatcccagagcacagcaacaat720
ggtttggggcgatcgccgctttggaaccatttttaagacaaactttgcccaatgttgggg780
gagaattaccgggaatttgtttgacgggccctgccccagtgctgaaagatgcggtgctgg840
tgcgaaatttttaccaaggcattgccaccccctgggaagagttttccccctggccctgtt900
tagctggcgaggaatccgaatggagtgctgtcccccccatgcgggaaattcccctgtttc960
cccaggaccccttggcggaagagcaattttgctggctgatgac1003
- 还没有人留言评论。精彩留言会获得点赞!