以锌结合剂为基础的EBNA1特异性化合物的制作方法
相关申请的交叉引用
本申请要求2018年1月18日提交的美国临时专利申请号62/619,093、2018年4月3日提交的美国临时专利申请号62/652,304、2018年6月7日提交的美国临时专利申请号62/682,161以及2019年1月17日提交的美国专利申请号16/249,987的优先权,其公开内容通过引用整体并入本文。
本发明大体上涉及一种化合物,其可用作治疗、成像和/或诊断药剂。具体而言,本发明涉及结合锌及ebna1的化合物,其具有响应型成像特性,以及对ebna1稳定的抑制作用,可用以治疗ebv阳性细胞,例如癌症。
背景技术:
艾伯斯坦-巴尔病毒(epstein-barrvirus,ebv)感染全世界大部分的人口并会在宿主中确立终生潜伏感染。目前已知悉潜伏的ebv感染与特定淋巴瘤及上皮恶性肿瘤的发生之间的关系。ebv编码核抗原1(ebna1)是一种高度受限基因,其在ebv感染的潜伏期表达,且是唯一一个在所有ebv潜伏感染细胞中表达的蛋白质,ebv编码核抗原1(ebna1)可作为治疗ebv-阳性癌症的有前景及有效的标靶。
尽管已知其重要性,但ebna1在ebv潜伏感染中的确切作用尚未被充分了解,且尚未有任何以ebna1为标靶治疗ebv阳性癌症的疗法被验证。因此,有必要继续致力于开发有效的ebna1抑制剂。过去几年已使用数种策略以抑制ebna1或ebna1依赖性细胞功能,包括:抑制ebna1的表达、ebna1-dna结合活性、ebna1-rna相互作用及ebna1同源二聚化。尽管此等抑制剂在体外及体内皆显示出可抑制其标靶,但它们也存在问题,例如:缺乏特异性、细胞通透性差及欠缺对作用机制的了解。此等问题部份源自于这样的事实:所述抑制剂使用以筛选为基础的方法被确认,而不能揭示与ebna1的直接结合,这大大限制了其应用。
此外,传统ebna1抑制剂没有荧光特性,因此为追踪及研究抑制剂分布及其细胞功能产生了障碍。荧光成像因其独特的潜在优势而有利于感测活体系统中的生物分子,此优势例如:优异的灵敏性及选择性、高度时空分辨率、简便性及实行性、易可视化、细胞内动力学实时分析及次细胞层级的生物分子定位。
因此,需要改良的ebna1抑制剂来解决上述一种或多种问题。
技术实现要素:
本发明涉及结合锌的ebna1特异性的探针,其用以检测及调节ebna1,并有助于治疗ebv阳性癌症。
在第一方面中,本文提供一种化学式i的化合物:
或其药学上可接受的盐,其中,
m是选自0-4的整数;
n是选自0-4的整数;
p是选自0-4的整数;
x为h2、s或o;
r各自独立地为h或烷基;
r1选自seqidno:1、seqidno:2、seqidno:3、seqidno:4、seqidno:5及seqidno:6所组成的群组;
r2为h或烷基;
r3选自如下所组成的群组:
r4各自独立地为h或烷基;
r5为h或烷基;
r6的每个实例独立地为h、烷基、烯基、炔基、环烷基、芳香基、杂芳基、卤化物、腈、硝基、or或nr2;
r7的每个实例独立地为h、烷基、烯基、炔基、环烷基、芳香基、杂芳基、卤化物、腈、硝基、or或nr2;
r8及r9各自独立地为h或烷基;且
r10的每个实例独立地为h、烷基、烯基、炔基、环烷基、芳香基、杂芳基、卤化物、腈、硝基、or或nr2。
在第一方面的第一实施方案中,本文提供了第一方面的化合物,其中,r6、r7及r10每次出现时各自独立地选自h、烷基、卤化物、腈及硝基所组成的群组。
在第一方面的第二实施方案中,本文提供了第一方面的化合物,其中r2及r5为h。
在第一方面的第三实施方案中,本文提供了第一方面的化合物,其中r4、r8及r9各自为h。
在第一方面的第四实施方案中,本文提供了第一方面的化合物,其中x为o且r3为:
在第一方面的第五实施方案中,本文提供了第一方面的第四实施方案的化合物,其中r6、r7及r10每次出现时各自独立地选自h、烷基、卤化物、腈及硝基所组成的群组。
在第一方面的第六实施方案中,本文提供了第一方面的第五实施方案的化合物,其中r4、r8及r9各自为h。
在第一方面的第七实施方案中,本文提供了第一方面的化合物,其中所述化合物具有化学式ii:
或其药学上可接受的盐,
m是选自0-4的整数;
n是选自0-4的整数;
p是选自0-4的整数;
r1选自seqidno:1、seqidno:2、seqidno:3、seqidno:4、seqidno:5及seqidno:6所组成的群组;
r3选自如下所组成的群组:
r6的每个实例独立地为h、烷基、烯基、炔基、环烷基、芳香基、杂芳基、卤化物、腈、硝基、or或nr2;
r7的每个实例独立地为h、烷基、烯基、炔基、环烷基、芳香基、杂芳基、卤化物、腈、硝基、or或nr2;
r8及r9各自独立地为h或烷基;以及
r10的每个实例独立地为h、烷基、烯基、炔基、环烷基、芳香基、杂芳基、卤化物、腈、硝基、or或nr2。
在第一方面的第八实施方案中,本文提供了第一方面的化合物,其中所述化合物具有化学式iii:
或其药学上可接受的盐,其中r1选自seqidno:1、seqidno:2、seqidno:3、seqidno:4、seqidno:5及seqidno:6所组成的群组。
在第一方面的第九实施方案中,本文提供了第一方面的化合物,其中,x为h2且r3为:
在第一方面的第十实施方案中,本文提供了第一方面的第九实施方案的化合物,其中,r6、r7及r10每次出现时各自独立地选自h、烷基、卤化物、腈及硝基所组成的群组。
在第一方面的第十一实施方案中,本文提供了第一方面的第十实施方案的化合物,其中,r2及r5各自为h。
在第一方面的第十二实施方案中,本文提供了第一方面的第十一实施方案的化合物,其中,r4、r8及r9各自为h。
在第一方面的第十三实施方案中,本文提供了第一方面的第十二实施方案的化合物,其中,r6、r7及r10各自为h。
在第二方面中,本文提供了治疗有需求的患者的艾伯斯坦-巴尔病毒(ebv)阳性细胞的方法,包括将治疗有效量的第一方面的化合物施用给所述患者。
在第二方面的第一实施方案中,本文提供了第二方面的方法,其中,ebv阳性细胞为癌细胞。
在第二方面的第二实施方案中,本文提供了第二方面的第一实施方案的方法,其中所述癌细胞为伯基特淋巴瘤(burkitt’slymphoma)、非霍奇金氏淋巴瘤(non-hodgkin’slymphoma)、霍奇金氏疾病(hodgkin’sdisease)、t细胞淋巴瘤(t-celllymphoma)、b细胞淋巴瘤(b-celllymphoma)、移植相关的淋巴增生疾病(transplant-associatedlymphoproliferativedisorders)、鼻咽癌(nasopharyngealcarcinoma)、胃腺癌(gastricadenocarcinoma)、腮腺癌(parotidcarcinoma)或平滑肌肉瘤(leiomyosarcoma)。
在第二方面的第三实施方案中,本文提供了第二方面的方法,其中,所述化合物具有化学式iii:
或其药学上可接受的盐,
r1选自seqidno:1、seqidno:2、seqidno:3、seqidno:4、seqidno:5及seqidno:6所组成的群组。
在第三方面中,本文提供了用于使ebv阳性细胞成像的方法,其包括下述步骤:使第一方面的化合物与ebv阳性细胞接触以及测量所述化合物的荧光。
在第三方面的第一实施方案中,本文提供了第三方面的方法,其中,所述化合物具有化学式iii:
或其药学上可接受的盐,其中,r1选自seqidno:1、seqidno:2、seqidno:3、seqidno:4、seqidno:5及seqidno:6所组成的群组。
附图简述
结合附图,通过下面对本发明的描述,本发明的上述及其他目的与特征将变得显而易见,在所述附图中:
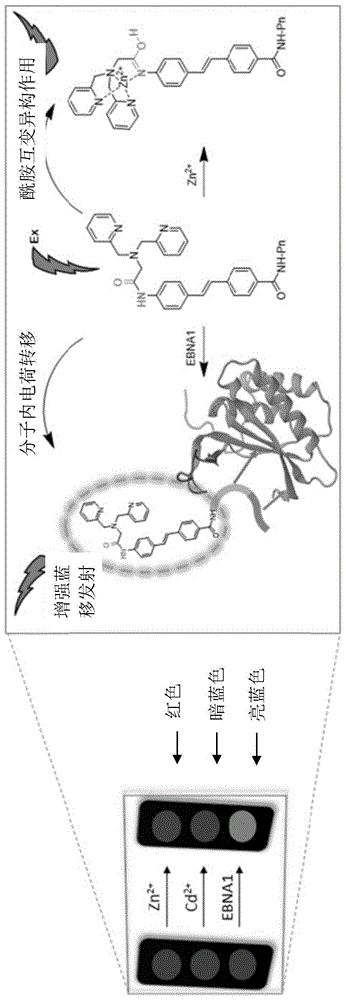
图1表示本发明的化合物与zn2+/ebna1结合的双响应发射及阻断ebna1二聚化的示意图。
图2a表示zrl5p4(2μm;在337nm激发)在含有zn2+的水溶液中(ch3cn/0.05mhepes,ph7.4=50:50)的荧光光谱变化。
图2b表示zrl5p4(2μm;在337nm激发)在添加zn2+的水溶液(ch3cn/0.05mhepes,ph7.4=50:50)后的荧光光谱变化。
图2c表示zrl5p4(2μm;在337nm激发)的溶剂化研究,用以确定探针是否呈现分子内电荷转移(ict)态发射。
图2d表示zrl5p4(2μm;在337nm激发)在加入ebna1后的荧光光谱变化。
图2e表示zrl5p4(2μm;在337nm激发)在加入人类血清白蛋白(has)后的荧光光谱变化。zrl5p4对ebna1相对于对hsa的选择性以加入蛋白质之前及之后的荧光强度比表示。
图2f表示zrl5p4在1当量的zn2+存在下加入ebna1后的荧光光谱变化。附图中的插图表示存在及不存在zn2+的情况下在加入ebna1后的荧光强度性能。
图3a表示zrl5p2(2μm;在337nm激发)在含有zn2+及cd2+的水溶液(ch3cn/0.05mhepes,ph7.4=50:50)中的荧光光谱变化。
图3b表示zrl5p6(2μm;在337nm激发)在含有zn2+及cd2+的水溶液(ch3cn/0.05mhepes,ph7.4=50:50)中的荧光光谱变化。
图4a表示zrl5p4(2μm;在337nm激发)在含有cd2+、cu2+、co2+及ni2+的水溶液(ch3cn/0.05mhepes,ph7.4=50:50)中的荧光光谱变化。
图4b表示zrl5p4(2μm;在337nm激发)在含有hg2+及mg2+的水溶液(ch3cn/0.05mhepes,ph7.4=50:50)中的荧光光谱变化。
图5a表示zrl5p2在溶剂极性下降时的溶剂化研究。
图5b表示zrl5p6在溶剂极性下降时的溶剂化研究。
图6a表示l2p4(左)及zrl5p4(右)的化学结构。
图6b表示利用mmpbsa计算zrl5p4及zn2+-zrl5p4与推定的ebna1dbd单体的结合能。
图7(a-f)表示对于p4-ebna1复合体模型(#9)的500nsnpt模拟,该复合体模型选自柔性的肽对接(peptidedocking)。(a)为推定的ebna1dbd单体的均方根波动(rmsf)。(b)为p4的rmsf。(c)为关于(w.r.t.)ebna1dbd主链原子的起始及末端结构的均方根误差(rmsd)。(d)为关于p4主链原子的起始及末端结构的rmsd。(e)为rrrk模体(motif)与ebna1dbdc末端内的酸残基之间的盐桥接。(f)为yfmvf(seqidno:2)模体与ebna1dbd的二聚体界面之间的疏水性堆积。
图8(a-e)表示利用分子力学计算而得的zrl5-nme及zn2+-zrl5-nme的推定的3d结构。(a)为zrl5-nme的2d结构。(b)为zrl5-nme的计算后3d结构。(c)为zn2+-zrl5-nme的2d结构。(d)为zn2+-zrl5-nme的计算后3d结构。(e)为计算后的zn2+-zrl5-nme3d结构迭加至ztf-zn2+晶体结构,其中所述ztf-zn2+是之前报道的相似度高的化合物。
图9(a-b)表示具5配位的zn2+的zn2+-zrl5-nme复合物的推定结构,其中溶剂提供一配位位点。(a)为计算后dmso-zn2+-zrl5-nme的3d结构。(b)为计算后h2o-zn2+-zrl5-nme的3d结构。
图10(a-f)表示对于zrl5p4-ebna1复合物模型(#1)的200nsnpt模拟。(a)为推定ebna1dbd单体的rmsf。(b)为zrl5p4的rmsf。(c)为关于(w.r.t)ebna1dbd主链原子的起始及末端结构的rmsd。(d)为关于zrl5p4配体的主链原子的起始(红)及末端(蓝)结构的rmsd。(e)为rrrk模体与ebna1dbdc末端内的酸残基之间的盐桥接。(f)为yfmvf(seqidno:2)模体与ebna1dbd的二聚体界面之间的疏水相互作用。
图11(a-f)表示对于zrl5p4-ebna1复合物模型(#2)的200nsnpt模拟。(a)为推定ebna1dbd单体的rmsf。(b)为zrl5p4的rmsf。(c)为关于(w.r.t)ebna1dbd主链原子的起始及末端结构的rmsd。(d)为关于zrl5p4主链原子的起始及末端结构的rmsd。(e)为rrrk模体与ebna1dbdc末端内的酸残基之间的盐桥接。(f)为yfmvf(seqidno:2)模体与ebna1dbd的二聚体界面之间的疏水相互作用。
图12(a-f)表示对于zn2+-zrl5p4-ebna1复合物模型(#1)的200nsnpt模拟。(a)为推定ebna1dbd单体的rmsf。(b)为zn2+-zrl5p4的rmsf。(c)为关于(w.r.t)ebna1蛋白的主链原子的起始及末端结构的rmsd。(d)为关于zn2+-zrl5p4配体的主链原子的起始及末端结构的rmsd。(e)为rrrk模体与ebna1dbdc末端内的酸残基之间的盐桥接。(f)为yfmvf(seqidno:2)模体与ebna1dbd的二聚体界面之间的疏水相互作用。
图13(a-f)表示对于zn2+-zrl5p4-ebna1复合物模型(#2)的200nsnpt模拟。(a)为推定ebna1dbd单体的rmsf。(b)为zn2+-zrl5p4的rmsf。(c)为关于(w.r.t)ebna1dbd主链原子的起始及末端结构的rmsd。(d)为关于zn2+-zrl5p4主链原子的起始及末端结构的rmsd。(e)为rrrk模体与ebna1dbdc末端内的酸残基之间的盐桥接。(f)为yfmvf(seqidno:2)模体与ebna1dbd的二聚体界面之间的疏水相互作用。
图14(a-d)表示zrl5p4-ebna1及zn2+-zrl5p4-ebna1复合物的推定结构。(a、b)为由两个独立的md(分子动力学)模拟而得的zrl5p4-ebna1复合物的代表性构型。计算的gb及pb值代表其结合自由能。(c、d)为由两个独立的分子动力学模拟而得的zn2+-zrl5p4-ebna1复合物的代表性构型。计算的gb及pb值代表其结合自由能。
图15(a-b)表示化合物5在含有zn2+的cd3cn(a)及dmso-d6(b)中的1hnmr光谱。cd3cn中羰基氧与zn2+的结合阻断酰胺基团的共振结构并使质子8向高场区移动;而dmso-d6中酰胺氮与zn2+的结合起到拉电子基团的作用,使质子8向低场区移动。
图16表示500ns分子动力学模拟后的代表性p4-ebna1复合结构。p4-ebna1dbd结合通过如下手段被调节:yfmvf(seqidno:2)与ebna1dbd的二聚体界面的疏水相互作用;及rrrk模体至ebna1dbdc末端的盐桥接。
图17(a-d)表示用于分子动力学模拟的zrl5(a、b)及zn2+-zrl5(c、d)的部分电荷(a、c)及amber原子类型(b、d)。
图18(a-i)表示被zrl5p4抑制的ebna1二聚化(a-b)及ebna1的反式激活(transactivation)(c-d)。l2p4/zrl5p4(缓冲液中的对照组)于存在/不存在zn2+的情况下进行mbs交联的、全长ebna1的二聚化(a)以及其经计算的ebna1单体/二聚体的谱带强度(b)。edta、tpen、zrl5p4及l2p4差别地影响ebna1在ebv阳性c666-1(c)及npc43(d)细胞中反式激活orip-cp-荧光素酶的能力。(c)及(d)中的虚线表示不同化合物中的反式激活的较佳的比较。测量zrl5p2、zrl5p4及zrl5p6在ebv阴性hk-1细胞(e)、hone-1细胞(f)(浓度为1、5、10、20、50、100μm)及ebv阳性npc43细胞(g)、c666-1细胞(h)、raji细胞(i)(浓度为1、3、5、10、15、20μm)中的细胞毒性测试。用不同的探针处理细胞,接着培养5天以测试其细胞毒性(每4天以含有适当浓度的探针的新鲜培养基更换一半的培养基)。
图19(a-c)表示zrl5p2、zrl5p4及zrl5p6在活ebv阳性(a)npc43细胞、(b)c666-1细胞及ebv阴性(c)hone-1细胞中的双光子荧光成像。zrl5pn信号从相应的ebna1探针发出。draq5为用以标记所示的活细胞的细胞核的荧光染剂。
图20(a-f)表示在ebv阳性c666-1小鼠异体移植模型中zrl5p2、zrl5p4及zrl5p6的体内抗肿瘤活性。每周以4μg/注射剂的探针处理小鼠2次,持续18天。在整个处理期间测量肿瘤体积(a)及体重(b)。实验结束时将肿瘤切除。(c)为肿瘤重量,(d)为肿瘤代表图。数据以平均值±平均值标准误差(sem)表示。相对于载体组的差异,*p<0.05;**p<0.005;***p<0.005。比例尺:10mm。(e)为来自上述体内动物实验的肿瘤切片的代表图。在以zrl5p4及zrl5p6处理的肿瘤结节中观察到细胞坏死(无细胞区以*表示)。h&e为苏木精及伊红。t为与肿瘤细胞邻近的区域。放大倍率:40倍。比例尺:20μm。(f)为zrl5p2、zrl5p4及zrl5p6在ebv阳性npc43及ebv阴性hone-1细胞的细胞核中的体内发射光谱(来自共聚焦显微镜)。zrl5p4及zrl5p6的发射强度在ebv阳性细胞中强得多。
图21(a-d)表示ebv溶裂(lytic)基因及蛋白质对ebna1探针响应的表达分析。(a)为图20所述的移植c666-1衍生肿瘤组织中的溶裂蛋白bzlf1(zta)及bmrf1的免疫组织化学染色法分析(ihcanalysis)。显示出代表性结果。在坏死肿瘤区域中观察到zta及bmrf1对于zrl5p2、zrl5p4及zrl5p6响应的核染色。放大倍率:400倍。比例尺:2μm。(b、c)为ebv溶裂基因brlf1(rta)及bmrf1在含有或不含10μmzrl5p2及zrl5p4下培养3天(c666-1细胞)或7天(npc43细胞)的c666-1细胞及npc43细胞中的基因表达分析。利用qrt-pcr分析基因表达。将每次处理后相对基因表达的倍数变化与溶剂对照组(dmso)进行比较,并在两种处理之间进行比较。(d)为早期(rta及bmrf1)及晚期(gp350/220)ebv溶裂蛋白在含有或不含10μmzrl5p2及zrl5p4下培养7天(npc43细胞)的ebv阳性npc43细胞中的蛋白质表达分析。以蛋白质印记法检测蛋白质表达,并以β肌动蛋白作为上样对照。
图22(a-b)表示ebv粒子对zrl5p4响应的产量。使用可表达gfp来表示ebv基因组的存在的hone-1-ebv细胞系。以10μmzrl5p2及zrl5p4处理此细胞系4天,并用raji细胞分析检测培养基中释放的病毒颗粒。将培养基添加至raji细胞达3天,gfp表达反应hone-1释放的ebv粒子的再感染。(a)为与溶剂对照组(dmso)相比,对zrl5p2或zrl5p4响应的相对平均病毒滴度。对于各处理进行三重复的raji细胞分析。**p<0.01,统计上有显著差异。(b)显示出代表性结果。以紫外线曝光检测gfp信号,并利用位相差光学显微镜捕捉细胞形态,再将明视野图像与gfp图像合并。放大倍率:40倍。比例尺:20μm。
图23(a-e)表示zrl5p2/zrl5p4/zrl5p6对重要器官重量的影响。在实验结束时依小鼠的体重将(a)心脏、(b)肺、(c)肝、(d)肾及(e)脾的重量标准化。数据以平均值±平均值标准误差表示。与对照组的差异,*p<0.05;**p<0.005;***p<0.005。与对照组相比,以zrl5p2、zrl5p4及zrl5p6处理并无显著改变器官重量。
图24(a-d)表示在ebv阴性hela异体移植下zrl5p2、zrl5p4及zrl5p6的体内抗肿瘤活性。每3天以4μg/注射剂的探针处理小鼠,持续19天。在整个处理期间测量(a)肿瘤体积及(b)体重。实验结束时将肿瘤切除,(c)为肿瘤重量,(d)为肿瘤代表图。数据及以平均值±平均值标准误差表示。与对照组的差异,*p<0.05;**p<0.005;***p<0.005表示。比例尺:10mm。对照组的小鼠及探针处理的小鼠之间在肿瘤体积及肿瘤重量上皆无显著差异。而且,与对照组相比,以zrl5p2、zrl5p4及zrl5p6处理体重并无显著改变。
具体实施方式
本公开的范围并不限于以下描述的具体实施方案。示出下述实施方案仅用于例示。
本领域的技术人员将理解,除了具体描述的方法和组合物,本文描述的方法及组合可进行变化与修改。
本发明包含所有此类变化与修改。本发明亦包含说明书中单独地或统称地提及或指明的所有步骤及特征,以及步骤或特征的所有组合或任何两个或更多个。
遍及说明书,除非上下文另有要求,否则词语“包含(comprise)”或诸如“含有(comprises)”或“包括(comprising)”的变型,应被理解为暗指包含所记载的整数或整数组,但不排除任何其他整数或整数组。另须注意,本说明书中,特别是权利要求书和/或段落中,诸如“包含”、“含有”、“包括”等用语可具有美国专利法中赋予其的意义;例如,其可意味着“包含(includes)”、“包括(included)”、“包含…在内(including)”等;并且诸如“基本上由…组成”及“基本上由…构成”的用语具有美国专利法中赋予其的意义,例如,其容许未明确描述的组件,但排除先前技术中发现或影响本发明的基础或新颖性的组件。
此外,遍及说明书及权利要求书,除非上下文另有要求,否则词语“包含”或诸如“包括”或“包含…在内”的变型,应理解为暗指包含所记载的整数或整数组,但不排除任何其他整数或整数组。
本文中使用的“卤”、“卤素”或卤化物是指氟、氯、溴及碘。
本文中使用的“烷基”是指直链或支链饱和烃基。烷基的例子包括:甲基(me)、乙基(et)、丙基(如n-丙基及z'-丙基)、丁基(如n-丁基、z'-丁基、仲丁基、叔丁基)、戊基(如n-戊基、z'-戊基、-戊基)及己基等。在不同实施方案中,烷基可具有1至40个碳原子(即,c1-40烷基),例如1至30个碳原子(即,c1-30烷基)。在一些实施方案中,烷基可具有1至6个碳原子,因而可称作“低级烷基”。低级烷基的例子包括:甲基、乙基、丙基(如n-丙基及z'-丙基)、及丁基(如n-丁基、z'-丁基、仲丁基、叔丁基)。在一些实施方案中,烷基可如本文所述地被取代。烷基通常不被其他烷基、烯基或炔基所取代。
除非另有说明,本文中使用的“环烷基”本身或作为别的取代基的一部分,是指在环系中具有3至12个碳原子的单环烃,包括氢、直链、支链和/或环取代基。示例性的环烷基包括:环丙基、环丁基、环戊基、环己基、环庚基等。
本文中使用的“烯基”是指具有一个或多个碳-碳双键的直链或支链烷基。烯基的例子包括:乙烯基、丙烯基、丁烯基、戊烯基、己烯基、丁二烯基、戊二烯基、己二烯基等。一个或多个碳-碳双键可在内部(如2-丁烯)或末端(如1-丁烯)。在不同实施方案中,烯基可具有2至40个碳原子(即,c2-40烯基),例如2至20个碳原子(即,c2-20烯基)。在一些实施方案中,烯基可如本文所述地被取代。烯基通常不被其他烯基、烷基或炔基所取代。
本文中使用的“稠环(fusedring)”或“稠环部分(fusedringmoiety)”是指具有至少两个环的多环系,其中至少一个环为芳香环,且此芳香环(碳环或杂环)与至少一个其他环具有共享键,所述其他环可为芳香环或非芳香环、以及碳环或杂环。这些多环系可为高度p-共轭及如本文所述地任意地被取代。
本文中使用的“杂原子”是指除了碳或氢以外的任何元素的原子,其包括例如氮、氧、硅、硫、磷及硒。
本文中使用的“芳香基”是指芳香族单环烃环系或多环系,其中两个或更多个芳香族烃环稠合(即具有共享键)在一起,或至少一个芳香族单环烃环与一个或多个环烷基和/或环杂烷基环稠和。芳香基在其环系中可具有6至24个碳原子(如c6-24芳香基),其中可包含多个稠和环。在一些实施方案中,多环芳香基可具有8至24个碳原子。芳香基的任何合适的环位置可与经定义的化学结构共价键联。仅具有芳香族碳环的芳香基的实例包括:苯基、1-萘基(双环)、2-萘基(双环)、蒽基(三环)、菲基(三环)、稠五苯基(五环)等基团。其中至少一芳香族碳环与一个或多个环烷基和/或环杂烷基稠合的多环系的实例包括:环戊烷的苯并衍生物(即二氢茚基,其为5,6-双环环烷基/芳香环系)、环己烷的苯并衍生物(即四氢萘基,其为6,6-双环环烷基/芳香环系)、咪唑啉的苯并衍生物(即苯并咪唑啉基,其为5,6-双环环杂烷基/芳香环系)、以及吡喃的苯并衍生物(即苯并吡喃基(chromenyl),其为6,6-双环环杂烷基/芳香环系)等等。芳香基的其他实例包括:苯并二噁烷基、苯并二氧杂环戊基、苯并二氢吡喃基(chromanyl)、二氢吲哚基等。在一些实施方案中,芳香基可如本文所述地被取代。在一些实施方案中,芳香基可具有一个或多个卤素取代基,因此可称为“卤代芳基”。“全卤芳香基”,即所有氢原子被卤素原子所取代的芳香基(如-c6f5),包含在“卤代芳香基”的定义中。在一些实施方案中,芳香基被其他芳香基取代,因此可称作联芳基。联芳基中的每个芳香基可如本文所述地被取代。
本文中使用的“杂芳基”是指含有至少一个选自氧(o)、氮(n)、硫(s)、硅(si)及硒(se)的环杂原子的芳香族单环环系,或其中环系中至少一个环为芳香族并含有至少一个环杂原子的多环系。多环杂芳基包括具有两个或更多个稠合在一起的杂芳基环,以及至少一个单环杂芳基环与一个或多个芳香族碳环、非芳香族碳环和/或非芳香族环杂烷基环稠合的那些。杂芳基整体而言可具有例如:5至24个环原子且包含1至5个环杂原子(即5至20元杂芳基)。杂芳基可在任何杂原子或碳原子上与经定义的化学结构连接,从而产生稳定的结构。一般而言,杂芳基环并不包含o-o、s-s或s-o键。然而,杂芳基中的一个或多个n或s原子可被氧化(如吡啶氮氧化物噻吩硫氧化物、噻吩s,s-二氧化物)。杂芳基的例子包括例如如下所示的5-或6-元单环及5-6双环环系,其中t为o、s、nh、n-烷基、n-芳香基、n-(芳烷基)(如n-芐基)、sih2、sih(烷基)、si(烷基)2、sih(芳烷基)、si(芳烷基)2或si(烷基)(芳烷基)。此类杂芳环的例子包括:吡咯基、呋喃基、噻吩基、吡啶基、嘧啶基、哒嗪基、吡嗪基、三唑基、四唑基、吡唑基、咪唑基、异噻唑基、噻唑基、噻二唑基、异噁唑基、噁唑基、噁二唑基、吲哚基、异吲哚基、苯并呋喃基、苯并噻吩基、喹啉基、2-甲基喹啉基、异喹啉基、喹喔啉基、喹唑啉基、苯并三唑基、苯并咪唑基、苯并噻唑基、苯并异噻唑基、苯并异唑基、苯并噁二唑基、苯并噁唑基、噌啉基、1h-吲唑基、2h-吲唑基、吲哚嗪基、异苯并呋喃基、萘啶基、酞嗪基、喋啶基、嘌呤基、噁唑并吡啶基、噻唑并吡啶基、咪唑并吡啶基、呋喃并吡啶基、噻吩并吡啶基、吡啶并嘧啶基、吡啶并吡嗪基、吡啶并哒嗪基、噻吩并噻唑基、噻唑并噁唑基、噻吩并咪唑基等。杂芳基的其他实例包括:4,5,6,7-四氢吲哚基、四氢喹啉基、苯并噻吩并吡啶基、苯并呋喃并吡啶基等。在一些实施方案中,杂芳基可如本文所述地被取代。
本说明书所记载的化合物可包含一种或多种作为立体异构体存在的基团。所有此类立体异构体的异构体皆包含于本发明中。在指出立体化学(如e/z双键异构体)的情形下,应理解为了简单起见而仅描述一种立体异构体。然而,本发明内容包含所有立体异构物及其混合物。
本文中使用的“肠胃外的给药(parenteraladministration)”及“经肠胃外给药(administeredparenterally)”的用语是指除了肠及局部给药之外的给药方式,通常为注射,其包含但不限于静脉(intravenous)、肌肉内(intramuscular)、动脉(intraarterial)、鞘内(intrathecal)、囊内(intracapsular)、眶内(intraorbital)、心内(intracardiac)、皮内(intradermal)、腹膜内(intraperitoneal)、经气管(transtracheal)、皮下(subcutaneous)、表皮下(subcuticular)、关节内(intraarticulare)、囊下(subcapsular)、蛛网膜下(subarachnoid)、脊椎内(intraspinal)及胸骨内(intrasternal)注射以及输注。
本文中使用的“全身给药(systemicadministration)”、“经全身给药(administeredsystemically)”、“外周给药(peripheraladministration)”及“经外周给药(administeredperipherally)”的用语是指非直接进入中枢神经系统以外的化合物、药物或其他物质的给药,使其进入病患系统,故可受新陈代谢等其他过程影响,例如皮下给药。
“ebv阳性癌症细胞”是指例如以潜伏形式表达ebv的那些癌症及癌细胞。此类癌症的实例包含但不限于鼻咽癌、伯基特淋巴瘤、霍奇金氏疾病、t细胞淋巴瘤、b细胞淋巴瘤、移植相关的淋巴增生疾病、胃腺癌、腮腺癌、乳癌、平滑肌肉瘤。在一些实施方案中,ebv阳性癌症为约大于30%、约大于40%、约大于50%、约大于60%、约大于70%或约大于80%含有ebv病毒的癌症。以本发明的方法治疗的最优选的癌症和/或癌细胞是鼻咽癌(npc)。
本文中使用的术语药剂的“治疗有效量”是指该量足以产生有益或期望的结果,包含临床结果,意义上而言“治疗有效量”取决于其应用的情形。例如,在施用抑制ebv阳性癌细胞增生的化合物的情形,化合物的有效量是例如与不施用该药剂所获得的反应相比,足以达到此类抑制效果的量。
“药学上可接受的盐”或“盐”的用语是指一种或多种化合物的盐。适合的药学上可接受的化合物的盐包含酸加成盐,其可例如通过将化合物的溶液与药学上可接受的酸的溶液混合而形成,所述药学上可接受的酸例如:盐酸、氢溴酸、硫酸、富马酸、马来酸、琥珀酸、苯甲酸、乙酸、柠檬酸、酒石酸、磷酸、碳酸等。当化合物带有一个或多个酸性部分时,可通过药学上可接受的碱的溶液处理该化合物的溶液来形成药学上可接受的盐,所述药学上可接受的碱例如:氢氧化锂、氢氧化钠、氢氧化钾、氢氧化四烷铵、碳酸锂、碳酸钠、碳酸钾、氨、烷基胺等。药学上可接受的盐亦可包含两性离子。
“组合物”的用语意图涵盖包含特定量的特定成分的产物,以及直接或间接由特定量的特定成分组合而成的任何产物。
“药学上可接受的载体”的用语是指用于制备所需剂型的化合物的介质。药学上可接受的载体可包含一种或多种溶剂、稀释剂或其他液态载体;分散或悬浮助剂;表面活性剂;等渗剂;增稠或乳化剂;防腐剂;固体黏合剂;润滑剂等。remington'spharmaceuticalsciences,第十五版,e.w.martin(mackpublishingco.,easton,pa.,1975)及handbookofpharmaceuticalexcipients,第三版,a.h.kibbeed.(americanpharmaceuticalassoc.2000)揭露用于配制药物组合物的各种载体以及用于其制备的已知技术。
本文中使用的“受试者”的用语是指动物,通常是即将成为或已经成为治疗、观察和/或实验对象的哺乳动物或人类。当该用语与化合物或药物的给药一起使用时,该受试者即为化合物或药物的治疗、观察和/或给药的对象。
如本说明书中所使用的以及如本领域中所知悉的,“治疗”是指一种获得有益或期望结果(包含临床结果)的方法。无论可检测或不可检测,有益或期望的临床结果可包含但不限于缓解或改善一种或多种症状或病症、减轻患病范围、稳定(即不恶化)疾病状态、预防疾病传播、推迟或减缓疾病进展、改善或缓和疾病状态、以及缓解(无论是部分或是全部)。“治疗”亦可意指与如果不接受治疗的预期存活时间相比,延长存活时间。
“抑制”或“压制”或“减少”功能或活性,例如ebv阳性癌细胞的增生,是指当与除了感兴趣的条件或参数之外其他条件相同相比或与另一条件相比,减少功能或活性。
本说明书所使用的选定用语的其他定义可在本发明的详细描述中找到并全文适用。除非另有说明,本说明书使用的所有其他技术用语与本发明所属领域的普通技术人员一般理解的含义相同。
通过下述的描述,本发明的其他方面及优点对于本领域的技术人员而言是显而易见的。
本发明所提供的化合物可包含:分子内电荷转移(ict)特征的荧光团、包含肽抑制剂序列且任选地包含核定位序列(nucleuslocalizationsequence,nls)的肽、及用以增加对ebv阳性癌症的抑制作用并维持化合物的响应信号的锌键结部分。如mtt分析所示,所产生的化合物改善了对于ebna1的抑制作用。荧光滴定显示出本发明所提供的化合物,相较于hsa,对于ebna1有高度选择性,此外,在zn2+存在下,亦显示出与ebna1的强力键结。本文所提供的化合物提供了用于治疗、成像及诊断ebv阳性细胞(如癌细胞)的强力且有前景的探针。
本文提供了化学式i的化合物:
或其药学上可接受的盐,其中,
m是选自0-4的整数;
n是选自0-4的整数;
p是选自0-4的整数;
x为h2、s或o;
r各自独立地为h或烷基;
r1选自seqidno:1(cyfmvf)、seqidno:2(yfmvf)、seqidno:3(cahxrrrkggyfmvf)、seqidno:4(cahxyfmvfggrrrk)、seqidno:5(ahxyfivfggrrrk)及seqidno:6(yfivf)所组成的群组;
r2为h或烷基;
r3选自如下所组成的群组:
r4各自独立地为h或烷基;
r4为h或烷基;
r5为h或烷基;
r6的每个实例独立地为h、烷基、烯基、炔基、环烷基、芳香基、杂芳基、卤化物、腈、硝基、or或nr2;
r7的每个实例独立地为h、烷基、烯基、炔基、环烷基、芳香基、杂芳基、卤化物、腈、硝基、or或nr2;
r8及r9各自独立地为h或烷基;且
r10的每个实例独立地为h、烷基、烯基、炔基、环烷基、芳香基、杂芳基、卤化物、腈、硝基、or或nr2。
本说明书所记载的化合物是包含烯烃。烯烃能以(e)-异构体、(z)-异构体或其组合存在。在一些实施方案中,烯烃为(e)-异构体。
当x为h2时,化学式i的化合物可由如下结构表示:
在一些实施方案中,r1选自seqidno:2(yfmvf)、seqidno:4(cahxyfmvfggrrrk)及seqidno:6(yfivf)所组成的群组。
在一些实施方案中,m、n及p各自独立地是选自0、1及2的整数。在一些实施方案中,m、n及p各自独立地是选自0及1的整数。
在一些实施方案中,r2为h或c1-c6烷基。在一些实施方案中,r2为h。
在一些实施方案中,r3选自如下所组成的群组:
当r3为
在1至4个之间的r10可键结到如下所示的位置2、3、4、5、6或7:
在一些实施方案中,r4为h或c1-c6烷基。在一些实施方案中,r4为h。
在一些实施方案中,r5为h或c1-c6烷基。在一些实施方案中,r5为h。
在一些实施方案中,r6、r7及r10每次出现时各自独立地选自h、c1-c6烷基、c2-c6烯基、c2-c6炔基、c3-c6环烷基、c6-c10芳香基、杂芳基、卤化物、腈、硝基、-or及nr2所组成的群组,其中r每次出现时为h或c1-c6烷基。在一些实施方案中,r6、r7及r10每次出现时各自独立地选自h、c1-c6烷基、卤化物、腈及硝基所组成的群组。在一些实施方案中,r6、r7及r10各自为h。
在一些实施方案中,r8及r9各自为h或c1-c6烷基。在一些实施方案中,r8及r9各自为h。
在一些实施方案中,化合物具有化学式ii:
或其药学上可接受的盐,其中
m是选自0-4的整数;
n是选自0-4的整数;
p是选自0-4的整数;
r1选自seqidno:1(cyfmvf)、seqidno:2(yfmvf)、seqidno:3(cahxrrrkggyfmvf)、seqidno:4(cahxyfmvfggrrrk)、seqidno:5(ahxyfivfggrrrk)及seqidno:6(yfivf)所组成的群组;
r3选自如下所组成的群组:
r6的每个实例独立地为h、烷基、烯基、炔基、环烷基、芳香基、杂芳基、卤化物、腈、硝基、or或nr2;
r7的每个实例独立地为h、烷基、烯基、炔基、环烷基、芳香基、杂芳基、卤化物、腈、硝基、or或nr2;
r8及r9各自独立地为h或烷基;且
r10的每个实例独立地为h、烷基、烯基、炔基、环烷基、芳香基、杂芳基、卤化物、腈、硝基、or或nr2。
在化学式ii的化合物的一些实施方案中,m、n及p各自独立地选自0、1及2。
在化学式ii的化合物的一些实施方案中,r6及r7各自独立地为h、c1-c6烷基、c2-c6烯基、c2-c6炔基、c3-c6环烷基、c6-c10芳香基、杂芳基、卤化物、腈、硝基、-or或nr2,其中r每次出现时为h或c1-c6烷基。在化学式ii的化合物的一些实施方案中,r6及r7各自独立地为h、c1-c6烷基、卤化物、腈或硝基。在化学式ii的化合物的一些实施方案中,r6及r7各自为h。
在化学式ii的化合物的一些实施方案中,r8及r9各自独立地为h或c1-c6烷基。在化学式ii的化合物的一些实施方案中,r8及r9各自为h。
在化学式ii的化合物的一些实施方案中,r10的每个实例独立地为h、c1-c6烷基、c2-c6烯基、c2-c6炔基、c3-c6环烷基、c6-c10芳香基、杂芳基、卤化物、腈、硝基、or或nr2,其中r每次出现时为h或c1-c6烷基。在化学式ii的化合物的一些实施方案中,r10的每个实例独立地为h、c1-c6烷基、卤化物、腈或硝基。在化学式ii的化合物的一些实施方案中,r10为h。
在一些实施方案中,化合物是选自如下所组成的群组:
或其药学上可接受的盐。
在一些实施方案中,化合物选自如下所组成的群组:
或其药学上可接受的盐,其中r1选自seqidno:1(cyfmvf)、seqidno:2(yfmvf)、seqidno:3(cahxrrrkggyfmvf)、seqidno:4(cahxyfmvfggrrrk)、seqidno:5(ahxyfivfggrrrk)及seqidno:6(yfivf)所组成的群组。
在一些实施方案中,化合物具有化学式iv:
或其药学上可接受的盐,其中,
m是选自0-4的整数;
n是选自0-4的整数;
p是选自0-4的整数;
r各自独立地为h或烷基;
r1选自seqidno:1(cyfmvf)、seqidno:2(yfmvf)、seqidno:3(cahxrrrkggyfmvf)、seqidno:4(cahxyfmvfggrrrk)、seqidno:5(ahxyfivfggrrrk)及seqidno:6(yfivf)所组成的群组。
r2为h或烷基;
r3选自如下所组成的群组:
r4各自独立地为h或烷基;
r4为h或烷基;
r5为h或烷基;
r6的每个实例独立地为h、烷基、烯基、炔基、环烷基、芳香基、杂芳基、卤化物、腈、硝基、or或nr2;
r7的每个实例独立地为h、烷基、烯基、炔基、环烷基、芳香基、杂芳基、卤化物、腈、硝基、or或nr2;
r8及r9各自独立地为h或烷基;且
r10的每个实例独立地为h、烷基、烯基、炔基、环烷基、芳香基、杂芳基、卤化物、腈、硝基、or或nr2。
在化学式iv的化合物的一些实施方案中,m、n及p各自独立地选自0、1及2。
在化学式iv的化合物的一些实施方案中,r2及r5各自为h。
在化学式iv的化合物的一些实施方案中,r6、r7及r10各自独立地选自h、c1-c6烷基、c2-c6烯基、c2-c6炔基、c3-c6环烷基、c6-c10芳香基、杂芳基、卤化物、腈、硝基、-or及nr2所组成的群组,其中r每次出现时为h或c1-c6烷基。在一些实施方案中,r6、r7及r10各自独立地为h、c1-c6烷基、卤化物、腈或硝基。在一些实施方案中,r6、r7及r10各自为h。
在化学式iv的化合物的一些实施方案中,r8及r9各自为h。
在化学式iv的化合物的一些实施方案中,化合物是选自如下所组成的群组:
或其药学上可接受的盐,其中r1选自seqidno:1(cyfmvf)、seqidno:2(yfmvf)、seqidno:3(cahxrrrkggyfmvf)、seqidno:4(cahxyfmvfggrrrk)、seqidno:5(ahxyfivfggrrrk)及seqidno:6(yfivf)所组成的群组。
本公开还提供了药物组合物,其包含本说明书所记载的任一化合物及至少一种药学上可接受的赋形剂。
本说明书所记载的化合物及其药学上可接受的盐,可单独或与药学上可接受的载体或稀释剂组合在药物组合物中而根据标准药学操作对受试者给药。化合物可经口服或肠胃外的给药。肠胃外给药包含:静脉、肌肉内、腹膜内、皮下及局部给药,优选的方法为静脉给药。
因此,本发明提供药学上可接受的组合物,其包含治疗有效量的一种或多种本说明书所记载的化合物,所述化合物与一种或多种药学上可接受的载体(添加剂)和/或稀释剂一起配制。本发明的药物组合物可以被特别配制用于以固体或液体的形式给药,所述形式包含适用于下述的那些形式:(1)肠胃外给药,如通过皮下、肌肉内、静脉或硬脊膜外注射,作为例如无菌溶液或悬浮液、或缓释制剂;及(2)口服给药,如灌药(水溶液或非水溶液或悬浮液)、片剂、大丸剂、粉末、颗粒剂、用于舌头应用的糊剂,所述片剂是例如针对口腔、舌下及全身吸收的片剂。本发明的化合物的最佳给药方法为肠胃外给药(静脉给药)。
如本说明书所述,本说明书所记载的化合物的一些实施方案可包含碱性官能团,如胺基或烷胺基,因此能够与药学上可接受的酸形成药学上可接受的盐。在此方面,术语“药学上可接受的盐”是指本发明的化合物的相对无毒性、无机及有机的酸加成盐。这些盐可在给药载体或剂型制造过程中原位制备,或单独地使本发明的经纯化的化合物以其游离碱形式与合适的有机或无机酸反应,并在后续的纯化过程中分离所形成的盐。代表性的盐包含:溴化物、氯化物、硫酸盐、硫酸氢盐、硝酸盐、醋酸盐、戊酸盐、油酸盐、棕榈酸盐、硬脂酸盐、月桂酸盐、苯甲酸盐、乳酸盐、磷酸盐、甲苯磺酸盐、柠檬酸盐、马来酸盐、富马酸盐、琥珀酸盐、酒石酸盐、萘磺酸盐、甲磺酸盐、葡庚糖酸盐、乳糖酸盐及月桂基磺酸盐等。
本发明的化合物的药学上可接受的盐包含化合物的通常的(如源自无毒有机酸或无机酸的)无毒盐或季铵盐。例如,此类常规无毒盐包含从无机酸所衍生的那些,例如:盐酸盐、氢溴酸、硫酸、胺基磺酸、磷酸、硝酸等;以及由有机酸所制备的盐,例如:乙酸、丙酸、琥珀酸、乙醇酸、硬脂酸、乳酸、苹果酸、酒石酸、柠檬酸、抗坏血酸、棕榈酸、马来酸、羟基马来酸、苯乙酸、谷氨酸、苯甲酸、水杨酸、磺胺酸、2-乙酰氧苯甲酸、富马酸、甲苯磺酸、甲磺酸、乙烷二磺酸、草酸、异硫羰酸(isothionic)等。
在其他情形下,本说明书所记载的化合物可包含一个或多个酸性官能团,因此能够与药学上可接受的碱形成药学上可接受的盐。在这些情形下,“药学上可接受的盐”的用语是指本发明的化合物的相对无毒性、无机及有机碱加成盐。这些盐可同样地在给药载体或剂型制造过程中原位制备,或单独地通过使经纯化的化合物以其游离酸形式与合适的碱、与氨或与药学上可接受的有机一级、二级或三级胺反应,所述合适的碱例如:药学上可接受的金属阳离子的氢氧化物、碳酸盐或碳酸氢盐。代表性的碱金属或碱土金属盐包括:锂盐、钠盐、钾盐、钙盐、镁盐及铝盐等。可用于形成碱加成盐的代表性的有机胺包括:乙胺、二乙胺、乙二胺、乙醇胺、二乙醇胺、哌嗪等。
润湿剂、乳化剂及润滑剂,如十二烷基硫酸钠及硬脂酸镁,以及着色剂、释出剂、被膜剂、甜味剂、调味剂及芳香剂、防腐剂、助溶剂、缓冲剂及抗氧化剂也可存在于组合物中。
制备这些制剂或组合物的方法包含使本说明书所记载的化合物与载体,及任选地,一种或多种助剂结合的步骤。一般而言,通过将本发明的化合物与液体载体(液体制剂)或细分化的固体载体或两者均匀且紧密地结合以制备制剂,所述液体载体随后进行冷冻干燥(用于利用无菌水等进行重构的粉末制剂)。接着,如果需要,将产物成形或包装。
适用于肠胃外的给药的本发明的药物组合物包含一种或多种本发明的化合物与一种或多种药学上可接受的无菌等渗水溶液或非水溶液、分散剂、悬浮剂或乳化剂、或无菌粉末的组合,所述无菌粉末可在使用前被重构为无菌注射溶液或分散液,并可含有醣类、醇类、抗氧化剂、缓冲液、抑菌剂、螯合剂、使制剂与预期接受者的血液等渗的溶质、悬浮剂或增稠剂。在这些实例中,将活性成分与药学上可接受的载体一起置于溶液中,接着进行冷冻干燥,从而得到干燥粉末。将干燥粉末包装为单位剂型,接着通过在粉末中加入无菌溶液如水或生理盐水而重构以用于肠胃外给药。
可用于本发明的药物组合物的合适的水性载体或非水性载体的实例包括:水、乙醇、多元醇(如甘油、丙二醇、聚乙二醇等)及其合适的混合物、植物油如橄榄油、及可注射的有机酯如油酸乙酯。可通过使用涂料如卵磷脂、在分散体的情况下保持所需的粒度、以及使用表面活性剂来保持适当的流动性。
这些组合物亦可含有辅助剂,如防腐剂、润湿剂、乳化剂及分散剂。通过包含各种抗细菌剂及抗真菌剂,如对羟基苯甲酸酯、氯丁醇、苯酚山梨酸等,可确保防止微生物对本发明化合物的作用。将等渗剂,如醣类、氯化钠等包含到组合物中也是期望的。另外,通过包含延迟吸收的试剂如单硬脂酸铝及明胶,可延长可注射药物形式的吸收。
在一些情形中,为了延长药物作用,期望减缓皮下或肌肉内注射的药物吸收。这可通过使用结晶或水溶性差的非晶材料的液体悬浮液来实现。药物的吸收速率因此取决于其溶解速率,而溶解速率又取决于晶体大小及晶形。或者,通过将药物溶解或悬浮在油性载体中来实现肠胃外给药的药物形式的延迟吸收。
合成。方案1显示zrl5pn的示例性合成。合成路径始于霍纳尔-沃兹沃思-埃蒙斯烯化反应(horner-wadsworth-emmonsolefination),以制得化合物2。使用氯化亚锡还原图中化合物2中的硝基而制得化合物3,接着使化合物3与氯乙酰氯反应而生成化合物4。使用n,n-二异丙基乙基胺(dipea)作为碱,使化合物4与二-2-氨甲基吡啶(dpa)反应,接着进行酯皂化及肽接合而制得化合物7。化合物7上的树脂的裂解生成目标探针zrl5pn。
方案1:zrl5p2/zrl5p4/zrl5p6(p2为seqidno:2(yfmvf);p4为seqidno:4(cahxyfmvfggrrrk);p6为seqidno:5(ahxyfivfggrrrk)的合成路径。
本说明书所记载的化合物可与ebna1结合并抑制其二聚化。因此,本说明书所记载的化合物可用于治疗其中ebna1二聚化的抑制具有治疗效果的病症或疾病状态。本文提供了在有需求的患者中治疗艾伯斯坦-巴尔病毒(ebv)阳性细胞的方法,其包含向患者施用治疗有效量的本说明书所记载的化合物。在一些实施方案中,ebv阳性细胞为癌细胞。在一些实施方案中,所述癌细胞为伯基特淋巴瘤、非霍奇金氏淋巴瘤、霍奇金氏疾病、t细胞淋巴瘤、b细胞淋巴瘤、移植相关的淋巴增生疾病、鼻咽癌、胃腺癌、腮腺癌或平滑肌肉瘤。
本文还提供了ebv阳性细胞成像的方法,其包含使ebv阳性细胞与本说明书所记载的化合物接触并测量所述化合物的荧光的步骤。在一些实施方案中,测量荧光的步骤包含双光子激发显微术。在一些实施方案中,测量荧光的步骤包含在含有本说明书所记载的化合物的情况下,以波长在650-750nm之间的光照射ebv阳性细胞并检测发射光。
ebna1具有许多功能结构域,其中一小结构域称作独特域1(ur1,a.a.64-89),被报导通过其所包含的一对半胱胺酸来配位锌。ur1中的半胱胺酸的点突变会消除ebna1对锌的配位、自我结合及活化转录的能力。因此,锌的配位对于ebna1的自我结合、反式激活及及反式激活相关细胞功能是关键。
本发明所提供的化合物不仅定位在ebna1主要定位的细胞核,而且还表现出对ebna1结合的响应型发射。
为了确定是否可通过利用ebna1锌配位的必要性来提高探针的总体功效,设计并合成了一种多效合一的探针zrl5p4(图6a)。
在该架构中,酰胺基团用于连接两部分–肽缀合的荧光团及dpa锌螯合剂。酰胺连接的dpa作为响应型锌螯合剂,当其与锌配位时会触发伴随红移发射的酰胺互变异构。酰胺连接体中的n原子亦可作为供体,探针的另一侧的羰基作为受体,因此若探针结合ebna1时,可触发伴随增强蓝移发射的ict(分子内电荷转移)表征的发射。因此当结合zn2+和/或ebna1时,探针可反映双响应发射。有利点是,如下所详述的,化学式1的化合物的锌结合部分与肽模体可协同地作用,以抑制ebna1,例如抑制ebna1的自我结合与ebna1的反式激活,以及阻断ebna1二聚化,进而达到如图1所示更好的抑制效果。
开发过度表达蛋白靶向癌症治疗的关键限制因素是不同人种的遗传变异。对于ebv相关癌症,作为唯一在所有ebv相关肿瘤中表达的病毒蛋白,ebna1在调节受感染细胞中的病毒基因组中扮演重要的角色。因此ebna1蛋白不仅用作用于临床成像的完善标记,亦可作为治疗的分子标靶。然而,目前研究显示,在中国人及印度尼西亚人鼻咽癌(npc)样本中存在的ebna1基因变异频繁。在此情况下,已知的ebna1靶向药剂对ebv相关癌症生长的抑制作用也被弱化。
已知ebna1的锌配位促成ebna1的自我结合并活化ebna1的转录。显示阻断ebna1的锌配位可增加抑制作用。从初步数据得知,相较仅使用“单一”方法(即没有锌结合位点)的ebna1二聚化抑制剂,对ebv癌症发展的抑制作用可强4倍。“双”抑制作用可通过水溶液中、体外/体内的双响应发射变化(发射的zn-21nm红移及发射的ebna1-39nm蓝移;动态)、以及通过在与ebna1结合(kd,19.1μm)后的水溶液中的等温量热滴定(热力学)的热变化而“直接”监测。本说明书所记载的化合物提供了新的癌症抑制方法——同时干扰蛋白质二聚化之间的细胞辅因子及物理结合,其可用于治疗ebv潜伏感染的肿瘤,并且推进为了提高整体治疗效果而结合其他辅助因素的设计策略。
新锌螯合探针zrl5p4的合理探针设计及分子动力学模拟。为了确定zrl5p4与ebna1dna结合域(dbd)之间的相互作用,以及确定zn2+结合的zrl5p4是否可能会影响其与dbd的相互作用,利用先前解析的ebna1dbd结构进行分子动力学(md)模拟。仅针对ebna1dbd的apo及dna结合形式解析x射线晶体结构,而目前尚无ebna1单体的其他晶体结构。ebna1dbd(蛋白质数据库id为1b3t;链a;残基461-607)的x射线晶体结构包含由多个环状结构(loops)连接的4个α螺旋结构及4个β折叠模体的α/β混合折迭(图1)。β片层结构β1-β4通过疏水相互作用驱使二聚体的形成,这呈现位于羧基末端的第一个ebna1二聚化界面。首先使用柔性肽对接工具cabs将配体p4嵌合至ebna1dbd单体的二聚体界面中。选择先前定义的p4--ebna1复合物模型并进行另外的500ns的模拟(图7)。五肽p2(yfmvf(seqidno:2))可通过疏水相互作用占据二聚化界面,且nls四肽-rrrk可与相邻带负电的残基(d601、d602、d605)形成盐桥,这进一步增强相互作用,因此确认p4为ebna1二聚化的物理阻断剂。
利用分子力学及构型搜索工具lowmodemd建立并优化锌-螯合剂及响应型荧光团zrl5在无zn2+及zn2+配位的情形下的3d模型。最终优化的zn2+--zrl5的zn2+-配位的dpa螯合剂片段与极相似的化合物zn2+--ztf11的晶体结构良好地重迭(图8),表明此两种构型在全局能量最小值处收敛。考虑zn2+--ztf晶体结构中形成的五配位复合物(一配位位点被溶剂分子占据)以及zrl5及ztf间的高度结构相似性,构建了dmso--zn2+--zrl5及h2o--zn2+--zrl5的模型,其中溶剂o原子作为电子供体(图9)。
zn2+结合及zn2+未结合的zrl5p4与ebna1(zrl5p4--ebna1及zn2+--zrl5p4-ebna1复合物)的三级相互作用模型基于前述p4--ebna1dbd及zrl5/zn2+--zrl5模型而构建。接着,对这两个相互作用模型进行200nsmd模拟以优化结构并计算结合能(图10-13)。两种相互作用模型皆显示稳定的探针–蛋白质相互作用,且最终优化的模型如图7b6b所示(模拟#1,两种复合物皆被模拟两次,第二个模拟如图11、13及14所示)。具有由yfmvf(seqidno:2)介导的疏水相互作用及rrrk所形成的盐桥的所述p4-ebna1复合物的特征化相互作用模型的保守性佳。结果显示zn2+的存在并不影响zrl5p4与ebna1dbd的相互作用,使用mmpbsa计算的结合能进一步支持此观察结果(图6b、图14及表1)。
表1.zrl5p4/zn2+-zrl5p4与ebna1dbd间的结合亲和力计算。
当与zn2+及ebna1结合时,三种新ebna1探针的双响应发射。在存在2当量的zn2+的水溶液[ch3cn/0.05mhepes(ph7.4),50:50]中,先测量三种新ebna1探针(zrl5p2、zrl5p4、zrl5p6)的荧光光谱变化(图2a及图3a-b;本次工作中使用的所有金属盐皆是过氯酸盐,应谨慎使用)。只有zrl5p4在加入zn2+后才显示21nm的红移发射(451至472nm),而另两种探针显示略微蓝移发射(zrl5p2,448至445nm)或其最大发射波长并未改变(zrl5p6,438nm)。因此,注重zrl5p4的红移发射的详细动力学。研究以不同浓度的zn2+滴定来检查结合化学计量后的zrl5p4的发光。观察到逐渐红移的发射伴随着发射强度的降低,且若1当量的zn2+加入时则该趋势停止,表明zrl5p4-zn2+复合物具有1:1的化学计量(图2b)。另外,还测量zrl5p4对zn2+相对于各种重金属离子及过渡金属离子的选择性(图4a-b)。结果显示cd2+、cu2+、co2+及ni2+(图4a)差别地降低发射强度,其中cd2+显示10nm蓝移发射,hg2+及mg2+(图4b)几乎没有影响zrl5p4发射;这些结果皆未显示zn2+引起竞争性响应发射。
接着研究zrl5p2、zrl5p4及zrl5p6的ebna1结合活性。在进行测试前,进行溶剂化研究来确定每种探针的分子内电荷转移(ict)特征。当与ebna1结合时,ebna1探针的荧光团基于ict机制的原理发出响应信号。有充分证据显示,ict介导的发射具有强烈的溶剂依赖性;即,溶剂极性减少会增强发射及发生蓝移(图2c)。如图2a及图5a-b所示,zrl5p4表现最佳ict特征,而zrl5p6亦表现发射强度的增强但没有蓝移发射。因此,zrl5p4代表最佳候选探针并测定其对ebna1dbd蛋白的活性。发现加入1.2μmebna1到zrl5p4引发2.7倍的发射增强,其是39nm的蓝移(466至427nm)(图2d)。将不相关的人类血清白蛋白(hsa)用作阴性对照靶蛋白,且将hsa加入zrl5p4显示其发射强度仅增加1.2倍(图2e)。图2e(插图)清楚表示相较于hsa,zrl5p4的结合对于ebna1具有高度选择性。另外,也在zn2+存在下测量zrl5p4对ebna1的荧光响应(图2f)。观察到具有51nm蓝移(477nm至426nm)的2.4倍发射增强,表示zn2+的存在并不影响zrl5p4-ebna1dbd结合,此亦反映在没有zn2+下的相同数量级的增强发射(图2d)。md模拟结果支持此观察现象(图6b)。此外,此观察还表明在zn2+存在下的光谱响应将导致zrl5p4较大的蓝移及轻微发射增强。
利用核磁共振(nmr)研究确认zrl5p4与锌(ii)的相互作用。为了表征zrl5p4如何与锌(ii)相互作用的机制,在含有和不含有1当量的锌(ii)的情况下对zrl5p4的进行1hnmr滴定实验。如先前研究所述,该锌螯合剂在不同溶剂中采用酰胺–亚氨酸互变异构体结合模式;具体而言,锌(ii)螯合复合物在ch3cn中是酰胺互变异构体,而在dmso中是亚胺互变异构体。为了确定zrl5p4是否能以类似方式与锌(ii)相互作用,在含有/不含有锌(ii)的cd3cn及dmso-d6中对化合物5(zrl5的前体)进行1hnmr光谱实验。该研究中,化合物5用作zrl5p4的替代物,因为肽部分的存在将导致难以在目标区域中指定峰值。与先前研究一致,质子8在cd3cn中显示出从10.93至9.43ppm的大的高场区位移,但在dmso-d6中显示出10.72至10.84ppm的低场区位移(图15a-b)。该发现确认了zrl5p4在mecn及dmso中的两种结合模式,因此可推断先前研究所记载的锌(ii)–触发的酰胺互变异构化亦将在zrl5p4中发生。zrl5p4降低ebna1的同源二聚化以及ebna1所活化的转录。分析zrl5p4在不存在和存在zn2+情况下预防ebna1二聚化的能力并与l2p4进行比较。因zn2+在ebna1ur1(a.a.64-89)处介导锌指形成并且zrl5p4强烈结合zn2+,故此分析采用全长ebna1而不是ebna1dbd。未进行探针处理的情况下,zn2+的存在稍微增加ebna1二聚化(缓冲液,-或+zn2+),因此确认zn2+在ebna1二聚化中的作用。不存在zn2+的情况下二聚化抑制作用仅来自肽部分,因此zrl5p4将ebna1二聚体降低至与l2p4所示的相似水平(图18a-b左侧部分)。然而,存在zn2+的情况下两种探针表现相异,zrl5p4比l2p4表现出强得多的二聚化抑制作用。此观察结果显示zrl5p4耗尽zn2+导致更大的抑制作用,因此鼓励进一步探索zrl5p4在ebv阳性细胞的体外细胞毒性。
在检测zrl5p4的细胞毒性前,如图18c-d所示,测量其结合细胞内的锌并影响ebna1反式激活的能力。使ebv阳性c666-1及npc43细胞暴露于zrl5p4、两种已知对于锌具有高度特异性的螯合剂:乙二胺四乙酸(edta)及n,n,n',n'-四(2-吡啶甲基)乙二胺(tpen)、以及l2p4。zrl5p4及l2p4均以剂量依赖性方式削减ebna1的反式激活,并且在c666-1(p值=0.00616)及npc43细胞系(p值=0.00007)中,zrl5p4的作用皆比l2p4更强。
zrl5p4降低ebv阳性细胞的活力并定位于其细胞核。接着测量以zrl5p2、zrl5p4及zrl5p6处理的一组ebv阴性(hk-1及hone-1npc细胞)以及ebv阳性(npc43、c666-1、raji淋巴瘤细胞)细胞的细胞活力(图18e-i)。包含zrl5p2是为了显现细胞核通透性对由锌螯合剂及ebna1结合肽所引发的细胞毒性至关重要,而包含zrl5p6是为了检查ebna1结合序列的变异对于肿瘤细胞生长是否为必需。通过mtt分析测量细胞毒性。所有3种探针在ebv阴性细胞中的治疗显示出在1-100μm的范围内为可忽略的抑制作用(图18e-f),然而,即使用低剂量的1-20μm探针处理,在ebv阳性细胞(ebv阳性鼻咽癌细胞及ebv阳性伯基特淋巴瘤细胞)中仍观察到明显的细胞毒性(图18g-i)。zrl5p4及zrl5p6表现出极相似的生长抑制作用,而zrl5p2效果最小。当与l2p4的细胞毒性研究比较时(ic50;npc43中23μm、c666-1中27μm及raji细胞中27μm),zrl5p4可能更有效(ic50;npc43中5μm、c666-1中13μm及raji细胞中12μm),表示无论源自上皮或淋巴,锌螯合剂的利用将增强ebv潜伏感染细胞中ebna1探针的细胞毒性。另一方面,zrl5p6的结果表明ebna1结合五肽中胺基酸序列的变异对于抑制体外生物活性并非必需。
鉴于核定位是ebna1维持及复制ebv病毒基因组的先决条件,优选具有核通透性的探针。上述mtt试验结果亦显示进入细胞核对于ebna1探针抑制肿瘤细胞活力是必需的。因此,利用双光子激发显微镜(λex:700nm)评估zrl5p2、zrl5p4及zrl5p6在ebv阳性(c666-1及npc43)以及ebv阴性细胞系(hone-1)中的亚细胞定位。双光子激发显微镜有利于更深的组织穿透及减少光漂白。在培养3小时后,在蓝色通道中收集zrl5p2、zrl5p4及zrl5p6的荧光信号。如图19a-c所示,在被引入的nls(rrrk)的帮助下,zrl5p4及zrl5p6在ebv阳性细胞中显示出明显的核定位,从而达到更佳的生长抑制作用(图18e-18i),而zrl5p2只在细胞质中被发现(图19a-b、20f)。此外,所有3种探针在ebv阴性细胞中皆未显示出核通透性(图19c、20f)。而且,在ebv感染细胞的细胞核中发现大部分的zrl5p4及zrl5p6,而此结果与先前报道的l2p4成像结果(显示大部分的l2p4定位于细胞质,只有一小部分于细胞核中被发现)形成对比。
zrl5p4抑制balb/c小鼠中ebv阳性肿瘤的生长。研究完体外细胞毒性后,接着检验3种新ebna1探针(zrl5p2、zrl5p4、zrl5p6)的体内作用。用这些探针(4μg/每次注射)或载体对照处理经ebv阳性c666-1异体移植物移植的balb/c裸小鼠。进行肿瘤内注射以将药剂递送至动物内,并且每两周进行注射。每周测量体重及肿瘤体积两次。18天处理期后,处死小鼠,然后切除肿瘤及器官并且称重。
以zrl5p4及zrl5p6处理可以显著地抑制肿瘤生长。处理期间结束时(第18天),与对照组相比,以zrl5p4处理的小鼠的平均肿瘤体积减少41.9%(p<0.01)。与对照组相比,以zrl5p6处理导致肿瘤体积减少29.6%(p<0.05)(图20a及20d)。当比较zrl5p4及zrl5p6的作用时,肿瘤体积及肿瘤重量并无显著差异。然而,没有nls的zrl5p2在任一剂量中皆没有显著影响肿瘤生长。也在实验结束时对肿瘤进行称重。与对照组相比,分别以zrl5p4及zrl5p6处理后,平均肿瘤重量减少49.2%(p<0.05)及31.4%(p<0.05)(图20c)。如图20b及图23a-e所示,与载体对照组相比,以zrl5p2、zrl5p4或zrl5p6处理不会造成身体或器官重量的显著改变,表示探针皆不会在体内表现出毒性作用。综上所述,这些结果显示,zrl5p4及zrl5p6是有潜力的抗ebv剂,其无明显的体内毒性。而且,zrl5p4作为与ebna1及zn2+结合的报道探针表现更佳。当将肿瘤切片用h&e染色以检查组织形态时,比起zrl5p2及溶剂对照组,在zrl5p4或zrl5p6处理的肿瘤组织中更频繁地观察到细胞坏死(图20e)。细胞死亡可能归因于c666-1细胞的mtt试验中观察到的zrl5p4及zrl5p6的细胞毒性活性(图19b),此结果亦可解释为什么肿瘤在用新ebna1探针处理后缩小。对于helaebv阴性异体移植物(图24a-d),在对照组小鼠及以探针处理的小鼠之间的肿瘤体积及肿瘤重量并无显著差异。
通过zrl5p4再活化ebv裂解周期。为了研究zrl5p4及zrl5p6导致体内坏死肿瘤的机制(图20e),接着要确定此现象是否可归因于对ebv溶裂基因产物的诱导,因为完全的溶裂诱导会导致肿瘤细胞死亡及ebv粒子释放。在上述动物试验中的c666-1衍生肿瘤组织中检验立即早期及早期溶裂蛋白bzlf1(zta)及bmrf1(图20a-e)。以免疫组织化学法(ihc)分析肿瘤切片,ebv溶裂蛋白zta及bmrf1主要在注射zrl5p4及zrl5p6的肿瘤中被检测到。在与坏死肿瘤组织相邻的肿瘤细胞中观察到此两种溶裂蛋白的核染色(图21a)。以zrl5p4处理后,对于zta及bmrf1,分别有约12.5%及18.8%的肿瘤区呈阳性。另一方面,此两种蛋白在溶剂对照组中仅检测到阴性染色,而对于bmrf1,在zrl5p2中观察到1.15%。zta及bmrf1对zrl5p6响应的ihc结果与zrl5p4相似(zta为18.8%及bmrf1为15.6%)。因此,这些ihc结果表示肿瘤组织坏死可能是zrl5p4及zrl5p6所诱导的裂解周期所导致。
本发明人还包括了另一ebv感染细胞系npc43用于溶裂阶段分析,在响应10μmzrl5p4的npc43及c666-1细胞系中研究立即早期及早期溶裂基因brlf1(rta)及bmlf1的基因表达。使用qrt-pcr检测基因表达。zrl5p4显著地诱导rta及bmrf1的基因表达,而其响应zrl5p2的表达与溶剂对照组相似(图21b-c)。在npc43细胞中,响应zrl5p4导致的变化为约26至约59倍,而对c666-1细胞为约6至约11倍的诱导。蛋白质印记法分析支持rta及bmrf1的基因表达结果,其显示在两种npc细胞系中蛋白水平被zrl5p4特异性地诱导(图21d)。除了这两种早期溶裂蛋白,zrl5p4亦诱导用于病毒颗粒组装的晚期蛋白gp350/220。虽然rta及bmrf1的表达亦被zrl5p2诱导,但表达水平的增加相比zrl5p4低得多,并且gp350/220水平与溶剂对照组相似。zrl5p4进入细胞核可能对于晚期溶裂蛋白表达的诱导至关重要。
为了验证是否能通过zrl5p4确实产生ebv粒子,使用含ebv的重组hone-1(hone-1-ebv)细胞系。通过感染性raji细胞(已建立的b细胞系)来检测病毒粒子的存在,因重组ebv基因组编码绿色荧光蛋白(gfp),故表达gfp的raji细胞反映hone-1-ebv细胞的病毒粒子的产生。由此可见,10μmzrl5p4可引发病毒粒子的产生,其是dmso对照组的10.4倍(p=0.009),并且是无nls形式的zrl5p2的约4倍(p=0.006)(图22a-b)。虽然zrl5p4的病毒滴度是溶剂对照组的2.6倍,但差异并不显著(p=0.06)。综上所述,zrl5p4进入ebv感染细胞可诱导ebv的再活化及病毒粒子的释放,并且其可通过在暴露于zrl5p4时使肿瘤细胞的细胞死亡来介导移植的c666-1肿瘤的缩小(图20a-e)。
探讨
尽管近几十年以来已尽力鉴定及测试各种习知及新颖的ebv溶裂诱导剂,但仍没有建立针对ebv基因或蛋白的特异性药剂。zrl5p4探针可能是特异性破坏ebna1蛋白并有效地将ebv从潜伏期再活化的类型中的第一个,其导致肿瘤细胞溶裂和/或诱导可被免疫细胞及抗病毒剂靶向的病毒蛋白,从而消除ebv感染的肿瘤细胞。在病毒驱动的肿瘤内靶向再活化潜伏病毒基因组及诱导细胞毒性作用的策略,称作溶细胞病毒活化(clva)疗法,并且有些ebv溶裂诱导剂最近已进入第i/ii阶段临床试验。此外,已证实zrl5p4的体内给药可缩小皮下肿瘤,并且ihc染色结果指出坏死的肿瘤组织可能归因于ebv裂解周期的诱导。ebv早期与晚期溶裂基因/蛋白表达分析及体外raji细胞感染分析指出zrl5p4可专一诱导病毒再活化,其可能通过破坏功能性ebna1二聚体而影响肿瘤细胞活力(从mtt试验所反映)及缩小eba相关的肿瘤(源自c666-1细胞)。同该发现一致,据报道在ebv感染的上皮细胞系中通过小干扰rna(sirna)消除ebna1基因表达可活化自发性裂解周期的诱导,表示ebna1具有抑制ebv再活化的功能。pml蛋白与ebna1间的关联可能解释zrl5p4如何诱导ebv裂解周期。由当前研究及其他研究可知,显然ebna1不仅维持ebv游离基因组的稳定持久性,而且还参与其他细胞功能,包含促成细胞增生及存活的病毒再活化的调节。该研究为证明ebna1及ebv在体内肿瘤形成及溶裂诱导的功能作用的少数研究之一。
如前所述,先前研究显示zn2+对于ebna1协同活化orip相关转录及通过胺基末端结构域二聚化为必需的。ebna1二聚化的当前的结果及orip报告分析与他们的结果一致,因zrl5p4中的锌螯合剂可进一步破坏ebna1单体的自我结合及密切相关的反式激活活性,以及破坏细胞活力及ebv溶裂基因诱导。对于ebna1自我结合分析,在没有zn2+时,zrl5p4及l2p4(缺乏锌螯合剂)处理的抑制作用并没有显著差异;但存在zn2+时,zrl5p4更有效地抑制二聚体形成(图18a及18b)。如前所述,ebna1中的ur1区域通过一对必需半胱胺酸而与zn2+配位,而该zn2+的配位,对于ur1形成在dbd的第一个二聚化位点以外的第二个ebna1二聚化位点是必需的。zn2+的存在可能有助于增加两个相邻全长ebna1单体的亲和力。因此,zrl5p4可同时阻碍ur1及dbd处的二聚化界面,而l2p4仅会干扰dbd处的二聚化位点。如本发明md模拟及荧光滴定的结果所示,zn2+的存在并不影响zrl5p4与ebna1dbd结合。认为dbd区域没有与zn2+的结合残基,故zrl5p4与dbd的这种结合仅是由于探针中有p4肽。这表示锌螯合剂所产生的额外抑制作用与dbd没有直接相关。
通过ebv阳性细胞系的细胞成像亦反映出zrl5p4在l2p4之后对各种ebna1及细胞活性的效力增加。成像结果可解释较强的抑制作用归因于探针的核定位,在此大部分ebna1被定位,并且核ebna1对其依赖功能至关重要。相反地,大部分l2p4位于细胞质中,剩余的探针位于细胞核中。由此可知,新生物探针zrl5p4可选择性地进入ebv阳性细胞的细胞核,并且可比l2p4更有效地破坏ebna1的功能。nlsrrrk序列及zrl5p4中的锌螯合剂皆在强化与核ebna1蛋白更特异性的结合和/或促进进入细胞核中发挥重要作用。
另一方面,本发明人最初认为ebna1二聚化序列的基因变异(胺基酸563)可能是设计ebna1探针的重要因子。zrl5p6被建构为靶向在变异位置处具有“i”残基的ebna1蛋白。然而,各种生物分析的实验结果显示,zrl5p4及zrl5p6在所有这些分析中皆一样有效,表示此胺基酸残基对于破坏ebna1单体的自我结合并非必要。这些发现表示zrl5p4及zrl5p6对于抑制各种ebv细胞系的ebna1蛋白一样有效。
总而言之,zn2+被用作ebna1起作用的重要辅助因子,并且已经用锌螯合剂及ebna1结合肽构建了一系列的新ebna1探针。锌螯合剂可进一步加强对功能性自我结合的ebna1二聚体及相关的与orip相关联的反式激活的抑制活性。值得注目的是,新zrl5p4探针可以再活化ebv裂解诱导作用,这与动物模型中ebv阳性肿瘤的缩小有关。这是成功靶向单一蛋白(ebna1)来诱导ebv裂解周期的首次研究。理论上因为ebna1对于宿主为外来蛋白,这种消除ebv相关肿瘤细胞的策略与所有其他裂解诱导治疗相比可确保绝对特异性。本发明的裂解分析结果还显示,ebna1的功能以及ebv的作用与通过抑制裂解周期再激活而维持肿瘤细胞存活有关联。
实验
通则。除非另有说明,所有化学品均未经进一步纯化而如购买时直接使用。具有n-末端his标签的全长ebna1购自abcam公司(ab138345)。使用标准程序干燥溶剂。使用waters半制备型hplc系统进行zrl5p2、zrl5p4及zrl5p6的纯化。使用bruker400mhznmr光谱仪记录nmr光谱,化学位移以四甲基硅烷或相应的溶剂残留物为内部参照,以百万分率(ppm)为单位;耦合常数以赫兹(hz)为单位。使用brukerautoflexmaldi-tof或agilent6450uhdaccurate-massq-tof光谱仪取得高解析质谱,其以m/z为单位。使用cary8454光谱仪记录uv-可见光吸收光谱。
合成。以1h及13cnmr光谱及hrmaldi-tofms表征所有新化合物。
分子动力学模拟。使用具有aff99sbildn力场的amber14中的全原子无偏倚md模拟。系统准备及模拟程序与之前报道的那些相同。简言之,采用周期边界、立方体、具有
发光测量。在配备有氙灯的horibafluorolog-3分光荧光计上记录发光、激发及发射光谱。具体而言,zrl5p4对金属离子的选择性的荧光滴定分析在使用过氯酸盐作为金属源[zn(clo4)2、cd(clo4)2、cu(clo4)2、co(clo4)2、ni(clo4)2、hg(clo4)2及mg(clo4)2]的hepes缓冲液(0.05m,ph7.4)/ch3cn(50:50)中进行。在磷酸盐缓冲盐水(pbs)中进行zrl5p4与蛋白质的选择性结合的发光滴定分析。通过逐渐增加zrl5p4水溶液中分析物(如zn2+、ebna1及hsa)的浓度来进行发光滴定实验;当zrl5p4发光的变化停止时,实验终止。
ebna1dbd的表达及纯化。用于表达与谷胱甘肽s-转移酶融合的ebna1dbd的氨基酸379-641的质粒,在大肠杆菌中被表达并通过谷胱甘肽琼脂糖凝胶4b冲洗(gedharmacon)被纯化。
mbs交联二聚化试验。在该试验中使用具有n-末端his标签(ab138345,abcam)的全长ebna1(残基1-641)。为了使已存在的二聚体共价交联,在交联试剂3-马来酰亚胺基苯甲酰基n-羟基琥珀酰亚胺酯(mbs)及探针(缓冲液/l2p4/zrl5p4)的存在下,于室温下将每5μg的ebna1在含有或不含有10μmzn2+的情况下培养2小时。培养后,在各体系中加入sds上样缓冲液,接着使用变性sds-page进行分离,并转移到硝化纤维膜上,其以抗体转渍(blotted);所获得的蛋白质条带提供二聚化抑制作用的信息。
ebna1-oripi依赖性反式激活作用的荧光素酶报告分析。为了研究ebna1依赖性反式激活作用,构建含有ebvc启动子及oripi(重复序列家族,fr)的荧光素酶载体j988f。ebvc启动子及oripi(核甘酸7447-11412)域,作为hindiii片段从已知质粒pgcp(-3889)cat被亚克隆到pgl3basic荧光素酶载体中(promega)。使用abiprismbigdye终止子循环测序试剂盒(appliedbiosystems),通过桑格测序(sangersequencing)确定正确的序列。接着以j988f报告质粒瞬时转染ebv阳性c666-1及npc43细胞。将细胞接种于12孔板中,并使用lipofectamine2000(invitrogen)将其与j988f质粒(2μg/孔)与prlrenilla荧光素酶对照报告子(500ng/孔)(promega)共同转染。24小时后,以zrl5p4、l2p4、edta或tpen(10μm)另外处理细胞8小时。用passivelysisbuffer(promega)溶裂细胞,接着将溶裂物转移到白色不透明的96孔板上。使用双荧光素酶报告分析系统(promega)及glomax96微孔板光度计(promega)测量荧光素酶活性。以prlrenilla荧光素酶报告子作为内部对照,将样品之间的转染效率标准化。
细胞培养。本研究中使用5种细胞系:ebv阴性hk-1及hone-1细胞系及ebv阳性npc43、c666-1及raji细胞系。hk-1、hone-1、c666-1及raji细胞于37℃及5%co2下在补充有10%胎牛血清(fbs)、1%青霉素及链霉素的rpmi1640培养基中生长。npc43细胞在含有10%fbs及4μmy27362(rho相关的、含有卷曲螺旋的蛋白激酶的抑制剂;enzolifesciences)的rpmi1640中维持。
mtt试验。所有细胞皆以最佳生长密度(hk-1,1×104细胞/100μl每孔;hone-1,8×103细胞/100μl每孔;npc43,8×103细胞/100μl每孔;c666-1,3×104细胞/100μl每孔;raji,1×104细胞/100μl每孔)在96孔板中继代培养24小时。接着以zrl5p2、zrl5p4或zrl5p6溶液替换生长培养基,其中对ebv阴性细胞的浓度为1、5、10、20、50及100μm,对ebv阳性细胞的浓度为1、3、5、10、15及20μm(对c666-1及raji细胞的悬浮液,在每次更换/取出培养基之前将96孔板以1000rpm离心3分钟并在试验期间小心操作)。培养另外5天后(每4天以含有适当的药物浓度的新鲜培养基更换培养基体积的一半),用pbs洗细胞,接着在37℃下于含有3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(mtt,0.5mg/ml,50μl)溶液的pbs溶液中培养3小时。接着,小心地移除70%培养基,加入dmso(100μl),摇晃培养皿30分钟以溶解活细胞所产生的甲
活力(%)=(odi/odc)×100%(2)
其中,odi及odc分别为进行或不进行药物处理的存活细胞的光密度。
双光子成像及共同染色。以zrl5p2/zrl5p4/zrl5p6(10μm)培养细胞3小时,接着以draq5(5μm)共同染色30分钟。使用配有同调飞秒激光(680-1050nm)、氩激光(432、457及488nm)、氦氖激光(632nm)、紫外线灯及控制co2含量的上盖组织培养室(37℃,2-7%co2)的leicatcssp8共聚焦激光扫描显微镜获得图像。在双光子激发(μex=700nm)下获得zrl5p2/zrl5p4/zrl5p6的体外图像,而在单光子激发(μex=638nm)下获得draq5的图像。
裸小鼠异体移植及肿瘤内注射。将悬浮在100μl无血清rpmi培养基中的c666-1细胞(8×106)注射到6至8周龄雄性balb/c裸小鼠的右侧腹。在接种21天后,肿瘤长到约220mm3的平均体积时,小鼠被分配到处理组(每组n=5),使得组之间的平均肿瘤体积差异不超过10%。小鼠每周两次接受使用29号注射器的肿瘤内注射,所述肿瘤内注射是4μg/肿瘤的0.1%的zrl5p2、zrl5p4或zrl5p6。将仅接受同体积的0.1%dmso的小鼠作为对照组。处理期间持续18天。每周测量体重及肿瘤体积两次,并将肿瘤体积以(长×宽2)/2计算。处理期间结束时,处死小鼠,取其肿瘤及重要器官并称重。在实验及数据分析期间,研究人员对处理的分组为盲测。所有动物实验皆经过香港政府卫生署及香港理工大学动物受试伦理小组委员会许可。
定量聚合酶链反应基因表达分析。如所报道地进行qpcr分析。
蛋白质印记法分析。如所报道地进行brlf1(rta)、bmrf1及gp350/220的蛋白质印记法分析。rta抗体由argene(法国韦尔尼奥尔市)供应,上样对照组所使用的β-肌动蛋白抗体由cellsignalingtechnology(美国麻州丹弗斯)供应。针对bmrf1及gp350/220的抗体是由jaapm.middeldorp教授(荷兰阿姆斯特丹自由大学医疗中心)慷慨提供。使用1:400稀释的一级抗体。
福尔马林固定的、石蜡包埋(ffpe)的肿瘤组织的制备、苏木精及伊红(h&e)染色、以及免疫组织化学(ihc)。移植的肿瘤组织依一般操作用福尔马林固定并以石蜡包埋。准备组织切片并以苏木精及伊红染色。用针对zta及dbmf1的ihc抗体来染色溶裂蛋白标记物。bzlf1(zta)抗体由argene提供,而bmrf1抗体是用于蛋白质印记法分析的抗体。如前所述,载玻片与ihc所用的一级抗体(1:100稀释)一起培养。
ebv感染试验。使用hone-1-ebv细胞系来产生用于溶裂分析的感染性ebv颗粒,此细胞系是通过将重组akataebv基因组中的绿色荧光蛋白(gfp)开放阅读框架引入到ebv阴性npc细胞系hone-1中而产生。然后,如前所述地进行病毒颗粒的产生步骤及病毒滴度的定量。简而言之,在与各种ebna1探针培养96小时后,以0.45μm孔过滤器过滤上清液,并通过在20,000g下离心2小时来浓缩病毒颗粒。通过raji细胞试验来确定相对病毒滴度,并通过待分析的病毒原液(virusstock)所感染的raji细胞的gfp表达将其定量。在96孔板中培养raji细胞(1×105),并在37℃培养3天以使gfp表达。使用紫外线显微镜计算gfp阳性细胞的数量。
二乙基(4-硝基芐基)磷酸盐(1)的合成
二乙基(4-硝基芐基)磷酸盐(1)的合成。根据先前的报道制备化合物1。将4-硝基溴化苄(200mg,0.93mmol)及三乙基亚磷酸盐(216mg,1.30mmol)的混合物在氮气气氛下于160℃下加热2小时。将多余的三乙基亚磷酸盐在减压下除去,得到棕色油状的化合物1(241mg,95%)。1hnmr(400mhz,cdcl3):δ8.19(dd,j=8.8,0.8hz,2h),7.48(dd,j=8.8,2.4hz,2h),4.07(dq,j=7.6,0.4hz,2h),4.05(dq,j=7.6,0.4hz,2h),3.25(d,j=22.4hz,2h),1.27ppm(t,j=6.8hz,6h);13cnmr(100mhz,cdcl3):δ139.7(d,2j(c,p)=8.9hz),130.6(d,3j(c,p)=6.4hz),123.7(d,4j(c,p)=2.9hz),62.4(d,2j(c,p)=6.7hz),34.0(d,1j(c,p)=136.7hz),16.4ppm(d,3j(c,p)=5.9hz);hrms(maldi-tof):m/z:计算c11h16no5p273.0766[m]+;得到:273.0755。
二-(2-吡啶甲基)胺(2)的合成
在0℃下,将含2-甲基吡啶胺(5.0g,46.24mmol)的无水etoh(100ml)溶液滴加到含2-吡啶甲醛(4.9g,46.05mmol)的无水etoh(100ml)悬浮液中。加入后,搅拌反应溶液4小时,然后冷却至0℃。将nabh4(3.5g,92.10mmol)小量地加至冷却的溶液中。此反应是在室温下再搅拌12小时。接着,缓慢加入hcl(5n,120ml)并将混合物搅拌1小时。接着加入naoh水溶液(2n)直到ph值达到11。用dcm(6×50ml)萃取混合物,合并的有机相用无水mgso4干燥并过滤。除去溶剂,得到分析纯度的化合物2,为棕色油状(7.8g,85%)。1hnmr(400mhz,cd3od):δ8.49(qd,j=4.8,0.8hz,2h),7.81(dt,j1=7.6,1.6hz,2h),7.51(d,j=8.0hz,2h),7.31(m,2h),3.93ppm(s,4h);13cnmr(100mhz,cd3od):δ160.3,149.8,138.7,124.1,123.8,54.8ppm;hrms(maldi-tof):m/z:计算c12h14n3200.1188[m+h]+;得到:200.1326。
(e)-甲基4-(4-硝基苯乙烯基)苯甲酸盐(3)的合成
将含二乙基4-硝基芐基磷酸盐(200mg,0.73mmol)及甲基4-甲酰基苯甲酸盐(120mg,0.73mmol)的四氢呋喃(thf)(3ml)溶液加到甲醇钠(79mg,1.46mmol)的四氢呋喃(6ml)悬浮液中。在0℃下搅拌混合溶液20分钟。减压下除去溶剂。加入h2o(100ml),所得的水溶液以hcl(0.1n)中和,接着用dcm(3×50ml)萃取。合并的有机相以无水mgso4干燥并过滤。接着,减压下除去溶剂。用dcm作为冲提液(182mg,88%),通过硅胶过滤粗料,得到纯产物的化合物3(黄色固体)。1hnmr(400mhz,cdcl3):δ8.25(dd,j1=6.8,2hz,2h),8.07(dd,j1=6.8,1.6hz,2h),7.67(dd,j1=7.2,2hz,2h),7.61(d,j=8.4hz,2h),7.28-7.26(2h,与剩余chcl3一致),3.94ppm(s,3h);13cnmr(100mhz,cdcl3):δ166.7,147.2,143.2,140.5,132.1,130.2,130.0,128.7,127.2,126.9,124.2,52.2ppm;hrms(maldi-tof):m/z:计算c16h14no4284.0923[m+h]+;得到:284.0895。
(e)-甲基4-(4-胺基苯乙烯基)苯甲酸盐(4)的合成
在氮气气氛下,于75℃下搅拌化合物3(200mg,0.71mmol)在etoac(10ml)中的溶液。加入氯化亚锡二水合物(801mg,3.55mmol)并将混合物在75℃下加热并且搅拌过夜。反应完成后(由薄层层析法(tlc)确定),使混合物冷却至室温,然后加入nahco3水溶液直到ph值达到8。悬浮液通过硅藻土过滤并用etoac清洗。滤液用h2o(两次)及盐水清洗,接着用无水mgso4干燥,过滤,并在减压下浓缩,得到橘黄色固体的化合物4(144mg,80%)。1hnmr(400mhz,cdcl3):δ7.99(d,j=8.0hz,2h),7.51(d,j=8.4hz,2h),7.36(d,j=8.4hz,2h),7.13(d,j=16.4hz,1h),6.93(d,j=16.4hz,1h),6.69(d,j=8.4hz,2h),3.92ppm(s,3h);13cnmr(100mhz,cdcl3):δ167.0,146.7,142.6,131.3,130.0,128.2,128.1,127.4,125.8,123.8,115.2,52.0ppm。hrms(maldi-tof):m/z:计算c16h15no2253.1103[m]+;得到:253.1084
(e)-甲基4-[4-(2-氯乙酰胺基)苯乙烯基]苯甲酸盐(5)的合成
在0℃下,将含2-氯乙酰氯(53mg,0.47mmol)的dcm(3ml)溶液滴加到化合物4(100mg,0.39mmol)及4-(二甲氨基)吡啶(81mg,0.66mmol)的dcm(15ml)溶液中,并在氮气气氛下搅拌。在室温下搅拌2小时后,在减压下除去溶剂。以dcm作为冲提液,将得到的浅黄色固体用硅胶纯化,得到橙色固体的化合物5(109mg,85%)。1hnmr(400mhz,cdcl3):δ8.28(s,1h),8.03(d,j=8.4hz,2h),7.60-7.53(m,6h),7.19(d,j=16.4hz,1h),7.09(d,j=16.4hz,1h),4.22(s,2h),3.93ppm(s,3h);13cnmr(100mhz,cdcl3):δ167.8,163.7,141.7,136.5,133.7,130.2,130.0,128.9,127.5,127.3,126.2,120.1,52.1,42.9ppm;hrms(maldi-tof):m/z:计算c18h16clno3329.0819[m]+;得到:329.0807。
(e)-甲基4-(4-{2-[双(吡啶-2-基甲基)氨基]乙酰胺基}苯乙烯基)苯甲酸盐(6)的合成
将化合物5(50mg,0.15mmol)、二(2-吡啶甲基)胺(dpa,36mg,0.18mmol)、n,n-二异丙基乙基胺(dipea,33mg,0.26mmol)及碘化钾(16mg,0.67mmol)加至mecn(25ml)中。在氮气气氛下搅拌并回流加热过夜后,将混合物冷却至室温,溶剂在减压下除去,得到黄褐色固体。接着通过硅胶柱层析使用dcm/meoh纯化粗料(100:1;dcm在使用前用nh3水溶液萃取,dcm/nh3200:1v/v),得到化合物6(59mg,80%)。1hnmr(400mhz,cdcl3):δ11.04(s,1h),8.64(qd,j1=4.8,0.8hz,2h),8.02(d,j=8.4hz,2h),7.82(d,j=8.4hz,2h),7.64(dt,j=7.6,2.0hz,2h),7.56(d,j=8hz,2h),7.53(d,j=8.4hz,2h),7.29(d,j=7.6hz,2h),7.22-7.18(m,3h),7.07(d,j=16.4hz,1h),3.95(s,4h),3.93(s,3h),3.49ppm(s,2h);13cnmr(100mhz,cdcl3):δ169.8,166.9,158.0,149.4,142.0,138.7,136.7,132.2,130.8,130.0,127.4,126.2,126.1,123.3,122.6,119.8,60.4,58.7,52.1ppm;hrms(maldi-tof):m/z:计算c30h28n4nao3515.2059[m+na]+;得到:515.2654。
zrl5(7)的合成
zrl5(7)的合成。将koh(114mg,2.03mmol)加至含化合物6(200mg,0.41mmol)的etoh/h2o(1:1,8ml)悬浮液中。搅拌并回流加热过夜后,将反应混合物冷却至室温。溶剂体积减少到大约50%,接着加入hcl(1n)直到溶液呈酸性。过滤并收集所得的沉淀物,得到黄色固体的化合物7(157mg,78%)。1hnmr(400mhz,cdcl3):δ10.74(s,1h),8.68(d,j=4.4hz,2h),8.00(d,j=8.4hz,2h),7.73(d,j=8.4hz,2h),7.67(dt,j=7.6,1.6hz,2h),7.51(d,j=8.4hz,2h),7.43(d,j=8.8hz,2h),7.33(d,j=7.6hz,2h),7.26-7.22ppm(m,2h),7.16(d,j=16.4hz,1h),7.02(d,j=16.4hz,1h),4.02(s,4h),3.54ppm(s,2h);13cnmr(100mhz,cdcl3):δ169.4,157.4,149.1,142.4,138.5,137.2,132.4,130.9,130.5,127.3,126.3,126.1,123.7,122.9,120.1,60.3,59.0ppm;hrms(maldi-tof):m/z:计算c29h26n4nao3501.1903[m+na]+;得到:501.1902。
zrl5p2/zrl5p4/zrl5p6的合成
缀合。将化合物7(148mg,0.30mmol)及(苯并三唑-1-基氧基)三吡咯烷基磷六氟磷酸盐(pybop,156mg,0.3mmol)的溶液溶解在dmf(3ml)中。加入dipea(90mg,0.70mmol)并搅拌溶液1分钟。将该溶液加至适当的肽(p2/p4/p6,0.1mmol),该肽被加载到具有pe玻璃料的8ml固相萃取(spe)管柱上的王氏树脂上。使肽树脂在dmf中溶胀过夜,并且在添加前将室排空。将所得的混合物在摇动器上震荡45分钟,接着过滤溶液并以dmf清洗3次。根据相同的步骤进行第二轮偶合,并进行与pybop(156mg,0.3mmol)及dipea(90mg,0.70mmol)在dmf(3ml)中的空白对照偶合循环。45分钟后,如上述过滤并清洗溶液。
树脂的裂解。将tfa/h2o/tips(0.95:0.25:0.25;tfa,三氟乙酸;tips,三异丙基硅烷)的混合物加入到经乙醚收缩的粗树脂中。将混合物在摇动器上震荡3小时。接着通过过滤除去树脂并用meoh清洗3次。接着将合并的滤液在减压下浓缩,得到粗zrl5p2/zrl5p4/zrl5p6,再通过制备型hplc纯化(表2)。
本发明所提供的化合物可使用任何习知纯化技术纯化。在一些实施方案中,本发明所提供的化合物使用制备型hplc被纯化。下述表2例示制备型hplc纯化条件。
表2。用于制备型hplc的溶剂梯度。溶剂a是含有0.5%tfa的dih2o,溶剂b是hplc级mecn。
zrl5p2。滞留时间,24.061分钟。hrms(q-tof):计算[m+h]+1166.5174,得到:1166.5195;计算[m+2h]/2583.7626,得到:583.7619。
zrl5p4。滞留时间,16.845分钟。hrms(maldi-tof):计算[m+h]2094.0552,得到:2094.2452。
zrl5p6。滞留时间,17.319分钟。hrms(q-tof):计算[m+2h]/2987.0487,得到:987.0501;计算[m+3h]/3658.3684,得到:658.3686;计算[m+4h]/4494.0282,得到:494.0280。
dss交联二聚化试验。在该分析中使用具有n-末端his标签(ab138345,abcam)的全长ebna1(a.a.1-641)。为了使已存在的二聚体共价交联,在dss交联剂及分析的探针(缓冲液/l2p4/zrl5p4)的存在下,在室温下将5g的ebna1在没有(-)或有(+)zn2+的情况下培养2小时。培养后,在各体系中加入sds上样缓冲液,将其在sds-page变性凝胶上分离,转移到硝化纤维膜上,并用抗体转渍,得到的蛋白质条带提供二聚化抑制作用的信息。
分子动力学(md)模拟
p4-ebna1复合物的建模及模拟。使用在线cabs-dock工具将p4(cahxyfmvfggrrrk,seqidno:4)嵌合至之前的研究中推定的ebna1dbd单体的二聚体界面。生成10个p4-ebna1复合物模型,并在具有cuda加速的amber14中进行定压及定温(npt)模拟。通过观察各复合物中p4的波动(数据未显示),选择最稳定的复合物模型并使其另外进行500nsnpt模拟。结果显示p4稳定地占据推定的ebna1dbd单体的二聚体界面,表示其为有效的ebna1二聚化抑制剂(图7a-f)。通过构象聚类分析获得代表性的p4-ebna1dbd单体复合物结构。与之前的研究一致,由yfmvf(seqidno:2)介导的疏水性堆积效应及由rrrk形成的盐桥皆有助于p4-ebna1dbd单体结合(图16)。
zn2+-zrl5复合物的建模。通过分子操作环境(moe,版本2012.10)构建zrl5在无zn2+(图8及17中表示为l5)及zn2+配位(图8及17中表示为zn2+-l5)的情况下的3d模型。使用mmff94x力场(ff)来最小化能量,另外,使用lowmodemd来辨识全局能量最小构象(图8a-e)。使用在线red服务器计算zrl5及zn2+-zrl5的部分电荷,并用parmchk工具的输出结果手动确定其原子类型(图17a-d)。而且,从gaff中的相当的原子或red衍生结果(表3和表4)的测量值确定zrl5及zn2+-zrl5所缺失的ff参数。
表3。无锌zrl5残基的修正amber力场参数。
表4。zn2+-zrl5残基的修正amber力场参数。
zrl5p4-ebna1及zn2+-zrl5p4-ebna1复合物的建模及模拟。zrl5p4-ebna1(图10、11、14中表示为l5p4-ebna1)及zn2+-zrl5p4-ebna1(图12、13、14中表示为zn2+-l5p4-ebna1)复合物的初始结构基于p4-ebna1复合物结构及推定的zn2+-zrl5结构而构建,且以cahx将zrl5p4/zn2+-zrl5p4连接到p4。接着在具有ff99sbildn力场的amber14中进行200ns的全原子无偏倚md模拟。系统准备及模拟步骤与之前的研究相同。简而言之,使用周期边界、立方体、具有
模拟后分析。通过使用默认设置以及由主链原子均方根误差(rmsd)定义的距离,由cpptraj计算10个p4-ebna1dbd复合物的构象聚类。保留最丰富聚类(聚类0)的代表性构象用于p4-ebna1dbd相互作用分析。通过mmpbsa计算整个生产轨迹的结合自由能。调整时间间隔以确保计算中包含200帧(frame)。使用mbondi2,在广义玻恩(generalizedborn,gb)计算中将盐浓度设为0.1m;使用prmtop档的半径,将离子强度设为0.1mm用于泊松-玻尔兹曼(poisson-boltzman,pb)计算。
产业利用性
本发明属于药学及化学产业领域。更具体而言,本发明涉及结合锌的、ebna1特异性的化合物,其具有响应型成像及ebna1的抑制作用,可用以治疗ebv阳性细胞,例如癌症。
序列表
<110>香港浸会大学
<120>以锌结合剂为基础的ebna1特异性化合物
<130>p20021pc00
<150>62/619,093
<151>2018-01-18
<150>62/652,304
<151>2018-04-03
<150>62/682,161
<151>2018-06-07
<150>16/249,987
<151>2019-01-17
<160>6
<170>patentin版本3.5
<210>1
<211>6
<212>prt
<213>人工序列
<220>
<223>在实验室中制备的合成肽。
<400>1
cystyrphemetvalphe
15
<210>2
<211>5
<212>prt
<213>人工序列
<220>
<223>在实验室中制备的合成肽。
<400>2
tyrphemetvalphe
15
<210>3
<211>17
<212>prt
<213>人工序列
<220>
<223>在实验室中制备的合成肽。
<220>
<221>xaa是6-氨基己酸
<222>(2)..(2)
<220>
<221>xaa是d-精氨酸
<222>(4)..(4)
<223>xaa是d-精氨酸
<220>
<221>misc_feature
<222>(6)..(6)
<223>xaa可以是任何自然存在的氨基酸。
<400>3
cysxaaalaalaargxaaalaalaarglysglyglytyrphemetval
151015
phe
<210>4
<211>17
<212>prt
<213>人工序列
<220>
<223>在实验室中制备的合成肽。
<220>
<221>xaa是6-氨基己酸
<222>(2)..(2)
<220>
<221>xaa是d-精氨酸
<222>(11)..(11)
<220>
<221>misc_feature
<222>(13)..(13)
<223>xaa可以是任何自然存在的氨基酸。
<400>4
cysxaaalaalatyrphemetvalpheglyglyargxaaalaalaarg
151015
lys
<210>5
<211>16
<212>prt
<213>人工序列
<220>
<223>在实验室中制备的合成肽。
<220>
<221>xaa是6-氨基己酸
<222>(1)..(1)
<220>
<221>xaa是d-精氨酸
<222>(10)..(10)
<220>
<221>misc_feature
<222>(12)..(12)
<223>xaa可以是任何自然存在的氨基酸。
<400>5
xaaalaalatyrpheilevalpheglyglyargxaaalaalaarglys
151015
<210>6
<211>5
<212>prt
<213>人工序列
<220>
<223>在实验室中制备的合成肽。
<400>6
tyrpheilevalphe
15
- 还没有人留言评论。精彩留言会获得点赞!