β-NMN的制造方法以及含有其的组合物与流程
本发明涉及β-烟酰胺单核苷酸(β-nicotinamidemononucleotide,β-nmn)制造方法以及含有β-nmn的组合物,上述β-烟酰胺单核苷酸制造方法具有以下工序:使由米曲霉(aspergillusoryzae)等曲霉属制备的代谢组合物、粗酶或纯化酶作用于β-烟酰胺腺嘌呤二核苷酸(β-nicotinamideadeninedinucleotide,nad)或由酵母即产朊假丝酵母(candidautilis)等得到的含有nad的溶液。
背景技术:
β-烟酰胺单核苷酸(β-nmn)为生物体内的补救途径(salvage)中的β-烟酰胺腺嘌呤二核苷酸(nad)的中间代谢物(专利文献1~4、非专利文献1)。通过使生物体摄取β-nmn,可直接诱导nad的生物合成,可提高生物体内的nad浓度(非专利文献2)。以通过β-nmn诱导生物合成的nad为底物,使以nad依赖性脱乙酰化酶即sirt1为代表的去乙酰化酶(sirtuin)家族蛋白等(sirt2、sirt3、sirt4、sirt5、sirt6、sirt7)活化。通过去乙酰化酶(sirtuin)家族蛋白等,显现出与生物寿命相关的代谢改善·抗疾病·抗老化作用等广泛的生理活性(非专利文献1)。作为β-nmn参与的具体功能,报告了“改善糖代谢异常(非专利文献2)”、“参与昼夜节律(非专利文献3)4)”、“改善衰老线粒体的功能(非专利文献5)”、“保护心脏因缺血再灌注而受损(非专利文献6)”、“抑制衰老导致的神经干细胞减少(非专利文献7)”、“通过表观遗传调控机制来抑制claudin-1的表达,降低糖尿病性肾病的白蛋白尿(非专利文献8)”、“控制细胞凋亡(非专利文献9)”、“改善帕金森病(非专利文献10)”、“衰老导致的氧化应激、血管功能障碍的恢复(非专利文献11)”等。另外,已知β-nmn不仅活化去乙酰化酶(sirtuin)家族蛋白等,而且还改善眼功能等(专利文献5)。因此,可期待通过给药β-nmn来提高nad的生物合成,活化以sirt1为中心的sirt2、sirt3、sirt4、sirt5、sirt6、sirt7的去乙酰化酶(sirtuin)家族蛋白等,从而在细胞或组织、脏器水平恢复、改善、预防多数负面的生理现象。
酵母被用于各种食品等。另外,产朊假丝酵母(candidautilis)是被美国食品药品管理局(fda)评价为营养功能性高、食用经验方面具有安全性的食用酵母。因此长年被有效地用于药品、补充剂、调味料等。
现有技术文献
专利文献
专利文献1:国际公开wo2014/146044
专利文献2:中国专利公报公布第101601679b
专利文献3:美国专利公开第2011-0123510a1
专利文献4:美国专利公布第7737158号
专利文献5:国际公开wo2016/171152
非专利文献
非专利文献1:liana,rstein.etal.thedynamicregulationofnadmetabolisminmitochondria.trendsinendocrinologyandmetabolism.2012,vol.23,no.9
非专利文献2:j,yoshino.etal.nicotinamidemononucleotide,akeynad+intermediate,treatsthepathophysiologyofdiet-andage-induceddiabetesinmice.cellmetab.2011,14(4),p.528-536.
非专利文献3:clarabienpeek1.etal.circadianclocknad+cycledrivesmitochondrialoxidativemetabolisminmice.science.2013,342(6158),1243417.
非专利文献4:ramsey,km.etal.circadianclockfeedbackcyclethroughnampt-mediatednad+biosynthesis.science.2009,324(5927),p.651-654.
非专利文献5:ana,p.gomes.etal.decliningnad+inducesapseudohypoxicstatedisruptingnuclear-mitochondrialcommunicationduringaging.cell.2013,155(7),p.1624-1638.
非专利文献6:t,yamamoto.etal.nicotinamidemononucleotide,anintermediateofnad+synthesis,protectstheheartfromischemiaandreperfusion.plosone.2014,9(6),e98972.
非专利文献7:liana,rstein.etal.specificablationofnamptinadultneuralstemcellsrecapitulatestheirfunctionaldefectsduringaging.emboj.2014,33(12),p.1321-1340
非专利文献8:k,hasegawa.etal.renaltubularsirt1attenuatesdiabeticalbuminuriabyepigeneticallysuppressingclaudin-1overexpressioninpodocytes.natmed.2013,19(11),p.1496-1504
非专利文献9:nicolaspreyat.etal.complexroleofnicotinamideadeninedinucleotideintheregulationofprogrammedcelldeathpathways.biochempharmacology.2015,s0006-2952(15)
非专利文献10:leilu.etal.nicotinamidemononucleotideimprovesenergyactivityandsurvivalrateinaninvitromodelofparkinson’sdisease.expthermed.2014,8(3),p.943-950.
非专利文献11:nataliee.depicciotto.etal.nicotinamidemononucleotidesupplementationreversesvasculardysfunctionandoxidativestresswithaginginmice.agingcell.2016,15,p.522-530.
技术实现要素:
发明所要解决的技术问题
本发明的课题在于得到生成β-nmn的酶,以及得到也能够适用于食品的制造β-nmn的方法,例如,从有食用经验的酵母中到富含β-nmn的组合物。
用于解决问题的技术方案
本发明人发现,通过利用从属于曲霉属的微生物得到的代谢组合物、粗酶或纯化酶进行最适(温度50~70度,ph3.0~7.0)化的酶反应,可高效得到β-nmn,从而完成本发明。
本发明为以下所示的发明。
(a)一种β-烟酰胺单核苷酸的制造方法,其包括以下工序:以β-烟酰胺腺嘌呤二核苷酸为底物,使用属于曲霉属的微生物的代谢组合物进行反应;
(b)一种β-烟酰胺单核苷酸的制造方法,其包括以下工序:使用来自属于曲霉属的微生物的、显示具有以下性质的酶活性的蛋白质进行反应。
(1)作用:水解β-烟酰胺腺嘌呤二核苷酸结构中的高能磷酸键即磷酸酐键(焦磷酸键),生成β-烟酰胺单核苷酸和amp。
(2)焦磷酸酶活性
(3)最适ph:ph3.0~7.0
(4)最适温度:40℃~70℃。
(c)包含β-烟酰胺单核苷酸1%(w/w)以上的组合物的制造方法,其包括以下工序:以酵母提取物所包含的β-烟酰胺腺嘌呤二核苷酸、或β-烟酰胺腺嘌呤二核苷酸为底物,使用来自属于曲霉属的微生物的、具有以下性质的酶进行反应。
(1)作用:水解β-烟酰胺腺嘌呤二核苷酸结构中的高能磷酸键即磷酸酐键(焦磷酸键),生成β-烟酰胺单核苷酸。
(2)焦磷酸酶活性;
(3)最适ph:ph3.0~7.0;
(4)最适温度:40℃~70℃;
(d)一种来自属于曲霉属的微生物的酶,其具有以下理化性质。
(1)作用:水解β-烟酰胺腺嘌呤二核苷酸结构中的高能磷酸键即磷酸酐键(焦磷酸键),生成β-烟酰胺单核苷酸。
(2)焦磷酸酶活性;
(3)最适ph:ph3.0~7.0;
(4)最适温度:40℃~70℃。
发明的效果
根据本发明,可以nad为底物取得β-nmn,例如可从有食用经验的酵母提取物简便取得β-nmn。特别地,产朊假丝酵母为从古至今有食用经验的酵母,从该酵母取得的酵母提取物的安全性高。这样的富含β-nmn的酵母提取物可作为药品、补充剂、功能性食品等来摄取。而且,本发明的富含β-nmn的酵母提取物也生成amp(5’-腺苷酸),因此不仅作为富含β-nmn的酵母提取物,而且也作为富含amp的酵母提取物来利用。
附图说明
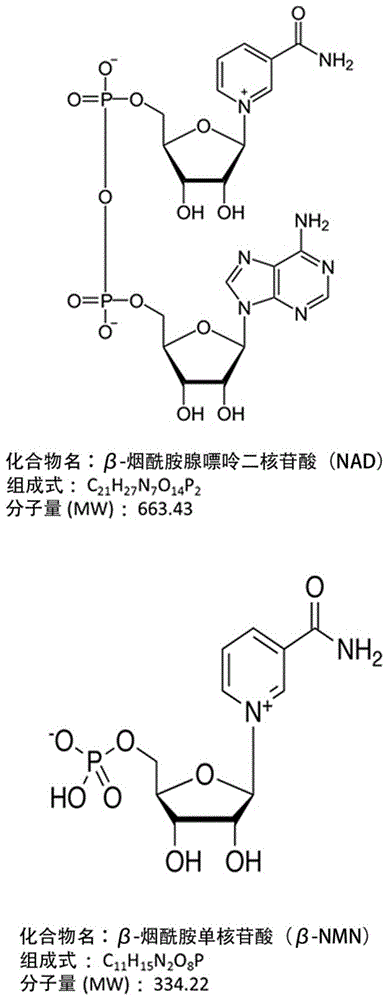
图1:表示β-nmn和nad的分子结构以及组成式、分子量。
图2:通过从属于曲霉属的微生物得到的纯化酶或粗酶与包含底物nad的提取液的反应而得到的包含β-nmn的组合物的反应模型。
图3:最适反应条件1(30℃/ph1、2、3、4、5、6、7、8、9、10)
图4:最适反应条件2(40℃/ph1、2、3、4、5、6、7、8、9、10)
图5:最适反应条件3(50℃/ph1、2、3、4、5、6、7、8、9、10)
图6:最适反应条件4(60℃/ph1、2、3、4、5、6、7、8、9、10)
图7:最适反应条件5(70℃/ph1、2、3、4、5、6、7、8、9、10)
图8:最适反应条件6(80℃/ph1、2、3、4、5、6、7、8、9、10)
图9是表示通过从产朊假丝酵母iam4264制备的提取液与来自黑曲霉的粗酶的反应得到的酵母提取物中的nad的色谱图。
图10是表示包含通过从产朊假丝酵母iam4264制备的提取液与来自黑曲霉的粗酶的反应得到的酵母提取物中的β-nmn的组合物的色谱图。
具体实施方式
本发明的代谢组合物、粗酶或纯化酶是以nad为底物而生成β-nmn的酶,作为nad,也能够以酵母或酵母提取物中含有的nad为底物。nad只要nad是通常可获得的nad,就可利用本发明的组合物。
在使用酵母提取物时,作为酵母,可使用食用酵母。例如可举出,属于酵母菌(saccharomyces)属的酵母、克鲁维氏酵母(kluyveromyces)属、假丝酵母(candida)属、毕赤酵母(pichia)属等,其中优选为假丝酵母属的产朊假丝酵母。更具体而言,为产朊假丝酵母iam4264、产朊假丝酵母atcc9950、产朊假丝酵母atcc9550、产朊假丝酵母iam4233、产朊假丝酵母ahu3259等。进一步优选使用富含谷胱甘肽的酵母,则β-nmn的含量提高。富含谷胱甘肽的酵母可使用通过公知的方法得到的酵母(日本特开昭59-151894,日本特开昭60-156379等)。
在培养酵母时的培养基中,作为碳源,可使用葡萄糖、乙酸、乙醇、甘油、糖蜜、亚硫酸盐纸浆废液等,作为氮源,可使用尿素、氨、硫酸铵、氯化铵、硝酸盐等。磷酸、钾、镁源也可以为过磷酸钙、磷酸铵、氯化钾、氢氧化钾、硫酸镁、氯化镁等通常的工业用原料,此外添加锌、铜、锰、铁离子等无机盐。此外,不使用维生素、氨基酸、核酸相关物质等也可进行培养,但是也可以添加这些物质。可以添加玉米浆、酪蛋白、酵母提取物、肉提取物、蛋白胨等有机物。
培养温度、ph等培养条件,可没有特别限制地应用,根据使用的酵母菌株设定、进行培养即可。一般而言,培养温度可以为21~37℃,优选25~34℃,ph优选为3.0~8.0、特别优选为3.5~7.0。
作为本发明的培养方式,可以为分批培养或连续培养中的任一种,工业上优选为后者。培养时的搅拌、通气等条件没有特别限制,为常规方法即可。
培养后的菌体通过前处理而进行提取液的制备。通过反复进行将菌体培养后的湿润酵母菌体悬浮于离子交换水并进行离心分离而洗涤,然后进行提取。提取方法可跟使用的酵母菌体的种类适宜调整,为了提高β-nmn的含量,优选在不分解酵母中的nad和β-nmn的条件下进行。通过自消化法、碱提取法、酸提取、温水提取法、或它们的组合来进行。使用产朊假丝酵母时的方法的菌体浓度按照干燥重量换算为7~10%,优选为8~9%的方式重悬于离子交换水。在对该菌体悬浮液进行提取时,根据需要调节ph。例如,在酸提取的情况下,提取ph为1.5~7.0,最优选将提取时的ph调整到6.0附近。可以利用公知的方法进行ph调节。
提取温度为50~90℃,优选为50~65℃。温度的调整方法只要使提取液达到上述温度就没有特别限制,可利用公知的方法。
关于提取时间,进行5分钟以上即可。提取中优选进行搅拌。搅拌速度等适宜调整即可,没有特别限制。另外,如果提取时间为40~50分钟则β-nmn的含量提高,因此进一步优选。
提取后,通过离心分离除去菌体悬浮液,得到上清。将该上清作为提取液,制成本发明的酶反应的底物溶液。在本申请的方法中,也可直接使用通过上述方法从酵母中提取的溶液,但是也可以在对酵母提取液中的nad进行纯化、浓缩等后,进行该阶段以后的工序。
使用的酶,使用以此前阶段得到的溶液中所包含的nad为底物,生成β-nmn的酶。具体而言,使用来自属于曲霉属的微生物的酶。曲霉属可举出蜂蜜曲霉(nbrc4339等)、米曲霉(nbrc100959等)、黑曲霉(atcc10254等)等,可使用具有食用经验的来自曲霉属的酶。
本发明中使用的酶可使用如上述所示从曲霉属的微生物制备的粗酶。曲霉属的微生物可以为食品工业等中使用的菌株。曲霉属的微生物可以为通常可获得的菌株。曲霉属的微生物可以为由atcc、nbrc等菌株分让机构或市售的种菌株销售公司等获得的菌株。本发明中使用的粗酶的制备可通过常规的酶制备法来进行。培养基可以使用用于曲霉属的常规培养基,培养后的蛋白质组合物的制备也可使用常规方法。例如,经过日本特开2010-004760、日本特开2009-232835等中记载的菌体培养方法、提取、基于溶剂分级的粗纯化工序而取得包含酶等蛋白质组的级分。
更具体而言,利用液体培养基(马铃薯葡萄糖培养基等)培养米曲霉no.2007(樋口松之助商店公司制)等曲霉属微生物的孢子。培养条件通常可在ph5.5~8.5,优选为ph6~8且,温度25~42℃,优选为30~37℃的条件下进行。培养时间根据使用的菌株等条件而不同,通常培养2~7天左右。
本申请可使用包含来自曲霉属的微生物的包含粗酶的代谢组合物、粗酶或纯化酶。包含粗酶的代谢组合物为从培养上清分取包含蛋白质组的级分而得的,或者将培养液和黑曲霉等的微生物破碎而分取包含细胞内的蛋白质组的级分而得的。此外,在作为粗酶或纯化酶使用的情况下,也可使用通过公知的蛋白质纯化方法分离回收目标粗酶或纯化酶而得的酶,上述蛋白质纯化方法例如为离子交换色谱法、正相色谱法、反相色谱法、凝胶过滤色谱法、凝胶渗透色谱法、吸附色谱法、亲水性相互作用色谱法、亲和色谱法、超临界色谱法等各种色谱法。可以经过干燥工序制成干燥物。此外,来自曲霉属的酶作为酶制剂而有各种销售,这样的市售酶大多含有杂酶,因此也能够获得可在本申请的方法中使用的酶。
本发明人等首次发现以上这样的酶具有以nad为底物而生成β-nmn的酶活性,不仅可以用于酵母中的nad,也可以用于以包含nad的酵母以外的组合物或nad纯品为底物而生成β-nmn的酶。nad可利用通常可获得的nad。
本发明中使用的酶具有切断nad的焦磷酸键(磷酸酐键)等高能磷酸键的焦磷酸酶活性。本发明的反应如图2所示。本发明中使用的酶使用具有该活性的类型,因此以nad为底物而生成含有β-nmn和腺苷5'-单磷酸酯(amp,5’-腺苷酸)作为产物的组合物。
本发明中使用的酶具有上述那样的活性,因此在以酵母提取物中的nad为底物时,可得到在酵母提取物中含有β-nmn和amp的酵母提取物。在以酵母提取物中的nad为底物时,可以设置富含酵母提取物中的nad的工序。例如,在提取酵母提取物之后,可使该提取物通液至用于食品制造等的常见的阳离子交换树脂等,从而浓缩酵母提取物中的nad。酵母提取物中的β-nmn含量根据酶反应前的nad含量而不同,nad含量越高则反应后的β-nmn含量也越高。
关于反应中使用的酶的添加量,根据酶的制备方法而不同,通常以总蛋白质含量相对于溶液中所包含的底物的nad总量为0.1%(w/w)~20(w/w)的方式来添加。更优选添加1~10(w/w)。应予说明,本申请中研究酶的最适反应条件时使用的β-nmn和含有β-nmn的组合物的测定方法基于实施例中记载的hplc测定条件。
粗酶的反应的最适温度为40~70℃,优选为50℃~60℃,最优选为60℃。应予说明,本申请中,研究酶的最适反应条件时使用的β-nmn和含有β-nmn的组合物的测定方法基于实施例中记载的hplc测定条件。
粗酶的反应的最适ph为3.0~7.0,优选为4.0~6.0,最优选为ph5.0。应予说明,本申请中研究酶的最适反应条件时使用的β-nmn和含有β-nmn的组合物的测定方法基于实施例中记载的hplc的测定条件。
在如上述那样从培养的酵母制备的提取液中添加来自曲霉属的总蛋白、粗酶或纯化酶,在最适反应条件下进行酶反应,从而可以得到例如相对于酵母提取物的干燥固体成分含有1.0%(w/w)以上的β-nmn的酵母提取物。通过使用酶反应前的底物(nad)含量高的酵母,虽然也取决于底物的浓缩,但是可得到含有5%(w/w)以上的β-nmn的酵母提取物。此外,在将酵母提取物中的nad浓缩到30~50%(w/w)的情况下,可得到含有20%(w/w)以上的β-nmn的酵母提取物。本发明β-nmn不同于由酵母中的nad含量生成的β-nmn的含量。如果提高从酵母菌体提取的酶反应的底物溶液中所包含的nad含量,则可进一步富含β-nmn。应予说明,本申请中研究酶的最适反应条件时使用的β-nmn和含有β-nmn的组合物的测定方法基于实施例中记载的hplc的测定条件。
实施酶反应后的提取液在浓缩后也可通过进行冷冻干燥或热风干燥而制成含有β-nmn的酵母提取物。
另外,作为另一方式,还可以通过从含有β-nmn的酵母提取物纯化β-nmn而得到进一步富含来自酵母的β-nmn的组合物。另外,通过从此前阶段的干燥前的酵母提取液纯化β-nmn,也可得到富含来自酵母的β-nmn的组合物。纯化方法可利用使用活性碳以及离子交换树脂等的常规的色谱纯化法。应予说明,在以并非酵母提取物中的nad、的nad为底物时,与以酵母提取物中的nad为底物的方法相同也可生成β-nmn。
本发明的酵母提取物或含有来自酵母的β-nmn的组合物的摄取方法没有特别限制,可举出口服给药、静脉内、腹膜内或皮下给药等非口服给药。具体而言,可以为片剂、散剂、颗粒剂、丸剂、悬浮剂、乳剂、浸剂·煎剂、胶囊剂、糖浆剂、液剂、酏剂、浸膏剂、酊剂、流浸膏剂等口服剂、或注射剂、点滴剂、涂布剂、贴剂、气雾剂、口腔剂、点鼻剂、点眼剂、栓剂等非口服剂中的任一种。
本申请发明中,在作为酵母提取物来制造的情况下,酵母提取物不仅可作为药品来摄取,而且也可作为食品来摄取,还可作为功能性食品、营养辅助食品、补充剂等来摄取。
另外,本发明还可与不会使β-nmn的活性降低或使β-nmn的活性增强的其它组合物并用。例如,成为赋形剂、稀释剂的糊精、麦芽糖醇、山梨糖醇、淀粉等。β-nmn的活性例如可例示去乙酰化酶活性等。
关于本发明的摄取量,只要给药显现出β-nmn活性的量即可。通常在确定β-nmn活性所需要的给药量时,通过给药的组合物的选择、摄取者的年龄、体重以及应答、摄取者的状态等来决定。通常以100mg/天~1000mg/天左右来摄取。
实施例
以下具体示出本申请发明,但是本申请发明不限定于此。
<β-nmn以及组合物的检测中使用的hplc的测定条件>
泵:chromaster5110(hitachihigh-technologies公司)
自动进样器:chromaster5210(hitachihigh-technologies公司)
uv检测器:chromaster5410(hitachihigh-technologies公司)
柱温箱:chromaster5310(hitachihigh-technologies公司)
流动相:50mm磷酸缓冲液(ph2.8)
·0.5%磷酸二氢铵(wako公司)
·使用85%磷酸-高效液相色谱用(wako公司)调节到ph2.8。
色谱柱:unisonuk-c18
柱温箱温度:30℃
流速:1.2ml/min
洗脱方式:等度洗脱
检测uv波长:210nm
分析时间:25分钟
样本注入量:5ul
样本冷却温度:3℃±2℃
<蛋白质组合物的制备>
利用ypds液体培养基(淀粉30g、葡萄糖2.5g、多聚蛋白胨10g、酵母浸膏5g、黄豆粉1g、生物素0.02mg、精氨酸盐酸盐0.55g/l)将从马铃薯葡萄糖琼脂斜面培养基切出的黑曲霉(atcc10254)的孢子在30℃培养3天。接着,对于将培养上清100μl真空干燥而得到的酶组合物,确认以下的β-nmn的生成。
<以nad为底物的最适酶反应ph的研究>
使用市售的nad(兴人lifescience公司制造),进行此前阶段得到的酶组合物的最适酶反应ph的研究。反应条件如下所示。
反应温度:30℃、40℃、50℃、60℃、70℃、80℃
反应ph:ph1.0、ph2.0、ph3.0、ph4.0、ph5.0、ph6.0、ph7.0、ph8.0、ph9.0、ph10.0
溶剂组成:
100mmkcl-hcl(ph1.0)
100mmkcl-hcl(ph2.0)
100mmkhc8h4o4-hcl(ph3.0)
100mmkhc8h4o4-naoh(ph4.0)
100mmmes-naoh(ph5.0)
100mmmes-naoh(ph6.0)100mmpipes-naoh(ph7.0)
100mmhepes-naoh(ph8.0)
100mmches-naoh(ph9.0)
100mmches-naoh(ph10.0)
反应时间:30分钟
酶添加量:相对于nad总量,添加1%(w/w)的从黑曲霉制备的酶组合物。
底物浓度:终浓度1%(w/v)nad
将结果示于图3~8。
应予说明,本申请中在研究酶的最适反应条件时使用的β-nmn以及含有β-nmn的组合物的测定方法基于实施例中记载的hplc的测定条件。关于各β-nmn生成活性能力,以将ph6.0、30℃下进行反应时的β-nmn生成为最大活性100的相对活性来示出。
<酵母的培养>
预先将产朊假丝酵母iam4264在包含ypd培养基(酵母提取物1%、多聚蛋白胨2%、葡萄糖2%)的三角烧瓶中进行种子培养,将其以1~2%接种到30l容积的发酵槽中的18l培养基中。培养基组成使用葡萄糖4%、磷酸二氢铵0.3%、硫酸铵0.161%、氯化钾0.137%、硫酸镁0.08%、硫酸铜1.6ppm、硫酸铁14ppm、硫酸锰16ppm、硫酸锌14ppm。培养条件,在ph4.0、培养温度30℃、通气量1vvm、搅拌600rpm下进行,添加氨进行ph控制。进行16小时的菌体培养后,回收培养液,通过离心分离收集菌体,得到180g的湿润酵母菌体。
将得到的酵母菌体悬浮于蒸馏水,反复进行离心分离,由此进行洗涤。重悬于蒸馏水,使干燥固体成分浓度为82.88g/l。此时ph为5.8。
<酵母提取物的提取>
对于上述菌体悬浮液,一边在70℃的水浴下缓慢搅拌悬浮液一边升温到60℃,一边搅拌一边进行10分钟的提取处理。在提取处理后,将取样得到的菌体悬浮液25ml在冰中冷却,以10000rpm在4℃下离心分离10分钟,取得上清。在沉淀物中添加与上清等量的超纯水,悬浮,再次离心分离而取得上清。将首次离心分离取得的上清和第2次离心分离取得的上清合并,利用超纯水定容到50ml,将其作为提取液。
<从酵母提取物进行的高度分级nad>
将提取液通液至阳离子交换树脂而浓缩nad。浓缩后的酵母提取物中的nad含量为45%(w/w)。
<最适酶反应条件下的β-nmn含量的测定>
使用产朊假丝酵母iam4264,与上述相同培养酵母并进行提取处理,将酵母提取液的温度调整为50℃,利用9nhcl或9nnaoh将反应ph调整为ph6.0,相对于酵母提取物所包含的nad总量添加5%的从上述米曲霉制备的粗酶和通过与米曲霉相同的方法从黑曲霉(atcc10254)制备的粗酶,进行7小时的最适反应。然后,通过干燥工序得到包含β-nmn和组合物的酵母提取物的干燥物。燥物在上述测定条件下进行定量分析。关于色谱图,如图10、11所示。将最适酶反应条件下的酵母提取物中的β-nmn含量进行定量,结果每干燥固体成分为10%(w/w)(米曲霉)、20%(w/w)(黑曲霉)。反应前每干燥固体成分包含nad25%(w/w),反应后nad减少到每干燥固体成分为2重量%,且生成β-nmn和amp。由此推测,基于该酶反应的β-nmn的生成为图2所示的机制。
使用市售的曲霉属的酶确认β-nmn的生成。nad(兴人lifescience公司制)在与本申请实施例相同的条件下使用以下市售酶确认β-nmn的生成。此外,与本申请实施例相同,制备酵母提取液,每nad总量添加1%(w/w)以下市售酶后进行1小时的最适反应,“denazymeap(曲霉属)”(nagasechemtex公司制造)、“deamizymeg(蜂蜜曲霉)”(天野酶制剂公司制)、“phytaseamano3000(黑曲霉)”(天野酶制剂公司制造)、“sumizymelp50d(米曲霉)”(新日本化学工业公司制造)、“sumizymephy-g(黑曲霉)”(新日本化学工业公司制造)、“sumizymephyf-l(黑曲霉)”(新日本化学工业公司制造)、“sumizymephy(黑曲霉)”(新日本化学工业公司制造),反应条件在ph6.0、温度60℃进行。其结果分别确认到β-nmn的生成。
产业上的可利用性
根据本发明,可以由nad取得包含β-nmn和amp的组合物,此外可从食用上安全的酵母得到包含β-nmn和amp的酵母提取物组合物。通过本发明,不仅可作为药品,还可作为功能性食品、营养辅助食品来摄取,通过本发明产品的摄取,可得到β-nmn具有的功能性。
符号说明
1nad
2β-nmn
3amp
4来自属于曲霉属的微生物的粗酶
- 还没有人留言评论。精彩留言会获得点赞!