作物中的生物氮固定的制作方法
背景技术:
本申请涉及将植物基因工程化为能够固定大气的元素氮(分子氮;n2)的方法。更特别地,本申请涉及基因转化植物细胞的线粒体以表达固氮酶的方法。
提高包括小麦、玉米和大米的谷物作物的生产力的关键因素是肥料,特别是氮和磷肥料的使用。目前,全世界人口消耗的食物中有一半以上是使用氮肥料生产的,其有助于40-60%的作物产量。然而,氮肥料如氨(nh3)和尿素(nh2conh2)的生产和使用对环境可具有严重的不利影响。从元素氮(n2)和氢(h2)生产的用于肥料的氨的哈伯-博世(haber-bosch)工艺需要大量使用通常从化石燃料中获得的能源。此外,氮肥料的过度使用或低效使用可导致过多的肥料流失到环境中。所产生的富营养化可导致生物多样性的变化和水质的下降。此外,氮肥料的反硝化产生温室气体一氧化氮(n2o),其可导致全球变暖。在不损失作物生产力的情况下减少对氮肥料的需求将对农民和环境两者提供好处。
固氮(diazotrophic)原核微生物可通过将n2转变为可被附近植物吸收的生物学上有用的含氮化合物来“固定”大气的n2。这些微生物产生多亚基(subunit)固氮酶(也称为二氮酶)金属酶复合物,其催化n2还原为nh3并且是对氧气敏感的,以及依赖于高水平的atp和还原剂。固氮酶活性是由在操纵子中组织的大量高度保守的nif基因编码。例如,肺炎克雷伯氏菌(klebsiellapneumoniae)和产酸克雷伯氏菌(klebsiellaoxytoca)中存在二十个这种基因。
固氮酶复合物本身的组分由基因nifh、nifd、nifk和nify编码。基因nifd和nifk分别编码二氮酶的异四聚体铁-钼组分(组分i)的α和β亚基,而nifh基因编码同源二聚体铁蛋白组分(组分ii)的亚基。nify基因编码铁钼辅因子生物合成蛋白,其最初与铁钼蛋白固氮酶(apodinitrogenase)寡聚体缔合,但当通过添加铁-钼辅因子激活铁钼蛋白固氮酶时,与复合物解离。其他nif基因也涉及二氮酶的调控、组装、成熟和功能。特别地,基因nife、nifn、nifx、nifu、nifs、nifv、nifw、nifz、nifm、nifb和nifq涉及辅因子生物合成,基因nifj和niff涉及电子转移,并且基因nifl和nifa涉及nif基因表达的调控。
已经考虑了各种方法来利用生物氮固定,以便减少谷物植物的栽培中对氮肥料的依赖。一种可能的方法是生产基因工程化的固氮生物和/或谷物植物,其可以形成共生关系,类似于如根瘤菌的某些固氮生物可通过如下与如豆类的某些植物形成的内共生关系:通过侵入植物的根部组织,使响应于入侵形成的根瘤群集(colonizing),并提供促进植物生长的益处,其包括释放氮固定产物以被植物吸收。另一种方法是改进与谷物自然地缔合的氮固定细菌内生菌,如固氮螺菌属(azospirillum)、固氮弧菌属(azoarcus)和草螺菌属(herbaspirillum)的某些物种的效率。然而,这两种方法都依赖于生物肥料接种剂的使用,其有效性可能不总是可靠的。此外,即使在谷物植物中已发现了与生节有关的生化因子,这些因子在谷物作物中的作用还未完全了解。可替选的方法是将谷物植物工程化以携带和表达nif基因,从而提供这些植物自身固定元素大气氮的能力。然而,到目前为止,这该方法仅部分地成功。
质体和线粒体是提供潜在的亚细胞定位以表达固氮酶的细胞器。两种类型的细胞器可提供固氮酶发挥作用所需的atp和电子,尽管质体和线粒体在它们的内部o2水平和它们将铵并入氨基酸的能力方面不同。植物非核细胞器在细胞核上作为固氮酶表达的亚细胞位置的其他优势包括质体和线粒体的细菌起源、线粒体和质体内的小的基因组尺寸、基因组拷贝的丰度以及类似于细菌中的那些的基因调控机制的存在。此外,线粒体或质体中没有表观遗传作用或沉默,其导致可再生的和可遗传的蛋白质积累。
尝试在叶绿体中表达nif基因已经部分地成功。然而,线粒体提供了具有由分解代谢产生的低氧水平和高能量含量的环境,以支持需要能量的n2代谢途径,因此潜在地是表达固氮酶的合适位置。因此,期望提供在植物细胞线粒体内表达固氮酶基因的方法。
技术实现要素:
本发明的一个方面提供了转化植物细胞的线粒体以表达固氮酶的方法,方法包括将植物细胞暴露于靶向线粒体的纳米载体多肽和一种或多种核酸,其中一种或多种核酸包含一种或多种编码固氮酶的基因。在至少一个实施方式中,一种或多种编码固氮酶的基因包括一种或多种nif基因。在至少一个实施方式中,一种或多种核酸进一步包括至少一种选择标记基因。
在另外的方面中,本发明提供了基因工程化植物细胞,其包括通过本文所述方法转化的线粒体。本发明的进一步方面提供了包括基因工程化植物细胞的基因工程化植物以及从基因工程化植物细胞产生基因工程化植物的方法。
附图说明
本发明的进一步特征将从以下书面描述和附图变得显而易见,其中:
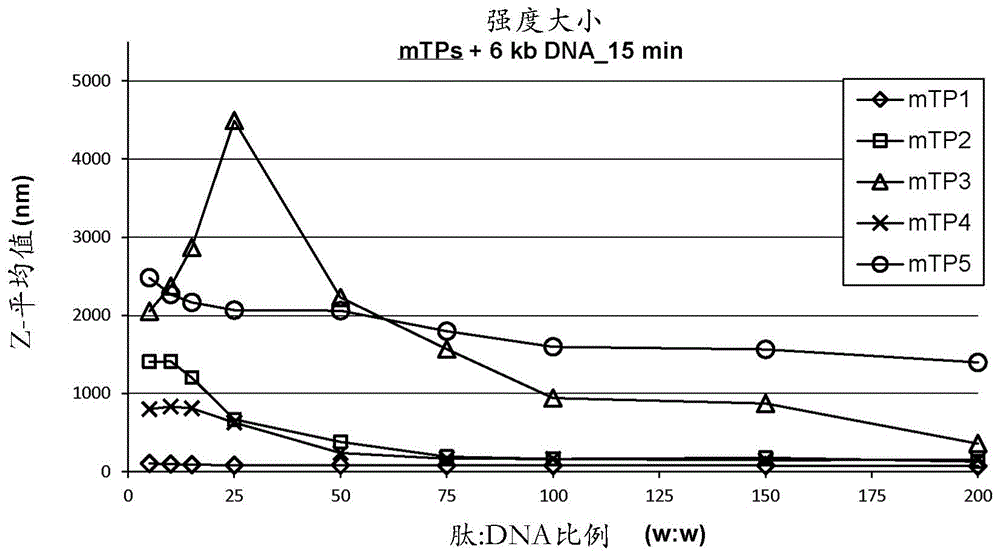
图1a是示出通过将各种靶向线粒体的肽(mtp)与6千碱基对(kb)的线性dna以按重量计肽与dna的各种比例孵育15分钟形成的纳米复合物的z-平均尺寸的图;
图1b是示出图1a的纳米复合物的ζ-电位的图;
图1c是示出图1a的纳米复合物的按数目计(bynumber)的最小尺寸;
图1d是示出图1a的纳米复合物的按数目计的峰尺寸;
图1e是示出图1a的纳米复合物的按数目计的最大尺寸;
图1f是示出通过以按重量计15:1的比例的肽与dna孵育15分钟制备的图1a的纳米复合物的稳定性的图,其通过以15分钟的间隔进行z-粒度仪(sizer)分析来确定;
图1g是示出通过以按重量计100:1的比例的肽与dna制备的图1a的纳米复合物的稳定性的图,其通过以15分钟的间隔进行z-粒度仪分析来确定;
图2a是示出通过将不同尺寸的dna(1-8kb长的线性dna或11或22kb质粒dna)与mtp4以按重量计100:1的肽:dna比例孵育15分钟产生的纳米复合物的z-平均尺寸的图;
图2b是示出通过将3kb长的线性dna或2.8kb质粒dna与mtp4以按重量计15:1的肽:dna比例孵育15分钟产生的纳米复合物的z-平均尺寸和以15分钟间隔进行z-粒度仪分析的图;
图2c是示出图2a的纳米复合物的稳定性的图;
图3a是产酸克雷伯氏菌中发现的nif基因簇的示意性图示;
图3b是用于黑小麦和小麦线粒体中nif基因簇的表达的优化的构建体的示意性图示,其包括除植物线粒体启动子p1(taatpa;普通小麦(triticumaestivum)atp合成酶亚基α)、p2(taatp6;普通小麦atp合成酶亚基6)、p3(atatp6;拟南芥(arabidopsisthaliana)atp合成酶亚基6)、p4(ntatp6;普通烟草(nicotianatabacum)atp合成酶亚基6)和p5(tacoxii;普通小麦细胞色素c氧化酶亚基ii)以及终止子序列t1(ntatp6;普通烟草atp合成酶亚基6)和t2(tacoba;普通小麦细胞色素b)(未表明核糖体结合位点(rbs)和基因间表达元件(iee))之外的图3a的许多nif基因。spdaao代表来自裂殖酵母(saccharomycespombe)的daao(d-氨基酸氧化酶)基因,aada代表来自大肠杆菌(escherichiacoli)的链霉素3’-腺苷酰基转移酶基因,以及5’hrtrnfm-1和3’hrrrn18-1分别代表与小麦线粒体重复区域的trnfm-1基因(甲酰蛋氨酸转移rna)区域和rrn18-1基因(18s核糖体rna)同源的序列;
图3c是小麦线粒体w_m_daao构建体的图示,其中p5、t2、spdaao、5’hrtrnfm-1和3’hrrrn18-1是与图3b的构建体中表明的那些相同的元件;
图4是示出nifhdky操纵子在用由mtp和nifhdkydna的各种组合形成的纳米复合物转染的黑小麦小孢子中的相对表达水平的图;
图5a是示出nifhdky操纵子在用由以15:1(w/w)的肽:dna比例的mtp和nifhdkydna形成的各种量的纳米复合物转染的黑小麦小孢子中的瞬时表达的图;
图5b是示出nifhdky操纵子在用由以100:1(w/w)的肽:dna比例的mtp和nifhdkydna的各种组合形成的标准量的纳米复合物转染的黑小麦小孢子中的瞬时表达的图;
图6是示出从用mtp-nifhdky纳米复合物转染的黑小麦小孢子中分离的总蛋白提取物的蛋白质印迹分析的一系列照片。湿印迹上含有nifh蛋白的泳道用*表示。箭头
图7a是示出用通过以各种比例和量的mtp3或mtp4与每个nif簇片段1、2和3分别地(s)或合并的(p)混合形成的各种纳米复合物转染的黑小麦小孢子中的图3b的nif簇片段1的nifh基因的瞬时表达的柱状图;
图7b是示出用图7a的纳米复合物转染的黑小麦小孢子中的图3b的nif簇片段2的nifb基因的瞬时表达的柱状图;
图7c是示出用图7a的纳米复合物转染的黑小麦小孢子中的图3b的nif簇片段3的nifu基因的瞬时表达的柱状图;
图8是示出用图7a的纳米复合物mtp4_nif1,2,3(p)_15_5x转染的黑小麦小孢子中的nif簇基因的瞬时表达的柱状图;
图9a是示出并入至对照黑小麦小孢子和用nif基因转染的黑小麦小孢子的15n的原子百分比(at%)的柱状图。ic表示初始培养;
图9b是示出图9a的转染的黑小麦小孢子的15n含量与14n对照的倍数差异的柱状图。使用anova与tukey检验的成对统计分析示出以“b”表示治疗的显著性差异,p<0.05的显著性,以“a”表示治疗无显著性;
图10a是示出在各种浓度的d-丙氨酸(d-ala)的存在下随着时间黑小麦小孢子的生存力的图;
图10b是示出在各种浓度的d-ala的存在下黑小麦小孢子的胚胎发生的一系列照片;
图10c是示出来自各种浓度的d-ala的存在下培养并且转移至不具有d-ala的萌发培养基中的黑小麦小孢子的绿苗的表型的柱状图。具有≥5cm的高度的苗被评分为大(l)、具有3-4cm的高度的苗被评分为中等(m)、具有1-2cm的高度的苗被评分为小(s)和具有<1cm的高度的苗被评分为超小(xs);
图10d是示出来自在没有d-ala的情况下培养并且转移至至各种浓度的d-ala的存在下的萌发培养基中的黑小麦小孢子的绿苗的再生效率的柱状图;
图11是示出用从图3c的mtp4和dna构建体(mtp4-dao)形成的纳米复合物转染的黑小麦小孢子中daao基因的相对瞬时表达的水平的柱状图;
图12a是示出在不同浓度的d-ala和链霉素的存在下黑小麦小孢子的胚胎发生的一系列照片;
图12b是示出暴露于不同浓度的d-ala和链霉素的黑小麦胚胎的再生效率的柱状图;
图13是示出在具有和不具有组合选择的情况下,从用通过将mtp4与包括aada和daao基因的dna构建体形成的纳米复合物(mtp4-aada+dao)转染的黑小麦小孢子的胚胎发育的一系列照片;和
图14是示出在存在或不存在氮源(nh4)2so4和/或谷氨酰胺(δgln)和谷胱甘肽(δglnδgsh)的情况下黑小麦小孢子的胚胎发生的一系列照片。
详细的描述
本申请描述了转化植物细胞的线粒体以表达固氮酶的方法,以及含有通过该方法转化的线粒体以表达固氮酶的植物细胞。合适的植物细胞是植物物种的细胞,其包括但不限于草类植物和谷物作物(包括但不限于黑小麦、小麦、大麦、荞麦、金丝雀种子、羊茅草、狐尾草、玉米、小米、燕麦、黑麦、稻、高粱、甘蔗和梯牧草)、油料植物或作物(包括但不限于拟南芥、油菜籽、花生、油菜、亚麻、向日葵、大豆和红花)和其他非豆类作物(包括但不限于棉花、烟草、蔬菜和水果植物)。在至少一个实施方式中,植物细胞是黑小麦细胞。在至少一个实施方式中,植物细胞是小麦细胞。在至少一个实施方式中,植物细胞是小孢子。其他合适的植物细胞是本领域众所周知的。
转化植物细胞的线粒体的方法包括将植物细胞暴露于靶向线粒体的纳米载体多肽和一种或多种核酸。在至少一个实施方式中,所述靶向线粒体的纳米载体多肽是有效介导核酸向植物细胞内和植物细胞内的线粒体内的转运的多肽。这种多肽的实例在国际专利申请公开wo2013/016810中描述,并且可易于被技术人员鉴定和制备。在至少一个实施方式中,靶向线粒体的纳米载体多肽是:
mtp1mfsylpryplraasaralvratrpsyrsallryq(seqidno:1)
mtp2maawmrslfsplkklwirmh(seqidno:2)
mtp3mkllwrlilsrkw(seqidno:3)
mtp4mwwrrsrtnslryt(seqidno:4)或
mtp5mlfrlrrsvrlrglla(seqidno:5)。
根据本方法,一种或多种核酸包含一种或多种编码固氮酶的基因。在至少一个实施方式中,固氮酶是有效地将元素分子氮(n2)还原为氨(nh3)的酶或其复合物。在至少一个实施方式中,固氮酶由源自细菌的物种的一种或多种基因编码。在至少一个实施方式中,细菌的物种是固氮物种,其包括但不限于克雷伯氏菌属(klebsiella)、根瘤菌属(rhizobium)、梭菌属(clostridium)、固氮菌属(azotobacter)、鱼腥藻属(anabaena)、念珠藻属(nostoc)和红细菌属(rhodobacter)的物种。在至少一个实施方式中,细菌的物种是克雷伯氏菌属的物种。编码固氮酶的基因的其他合适来源对本领域技术人员将是显而易见的。
在至少一个实施方式中,固氮酶由一种或多种nif基因编码。在至少一个实施方式中,nif基因包括但不限于nifh、nifd和nifk。在至少一个实施方式中,nif基因包括但不限于nifh、nifd、nifk和nify。在至少一个实施方式中,nif基因进一步包括nife、nifn、nifu、nifs、nifv、nifw、nifz、nifm、nifb、nifq、nifj和niff中的一种或多种。在至少一个实施方式中,nif基因进一步包括nife、nifn、nifx、nifu、nifs、nifv、nifw、nifz、nifm、nifb、nifq、nifj、niff、nifl和nifa中的一种或多种。
在至少一个实施方式中,一种或多种nif基因位于单个核酸片段上。在至少一个实施方式中,一种或多种nif基因位于两个或更多个核酸片段上。在至少一个实施方式中,nifh、nifd、nifk和nify基因位于单个核酸片段上。在至少一个实施方式中,nifb、nifq、nife、nifn、niff和nifj基因位于单个核酸片段上。在至少一个实施方式中,nifu、nifs、nifv、nifw、nifz和nifm基因位于单个核酸片段上。在至少一个实施方式中,核酸片段还包含调控元件,其包括但不限于有效控制植物线粒体中的nif基因的复制、转录和翻译中的一种或多种的启动子、终止子、核糖体结合位点、基因内表达元件和重复区域。鉴于本文的教导,这种调控元件是已知的并且可被本领域技术人员识别和使用以设计在植物线粒体中有效表达nif基因的核酸构建体。
在至少一个实施方式中,在核酸进入细胞和进入细胞内的线粒体的条件下,通过将植物细胞暴露于一种或多种核酸和靶向线粒体的纳米载体多肽,将一种或多种核酸引入植物细胞的线粒体中。在至少一个实施方式中,将靶向线粒体的纳米载体多肽和dna混合以形成植物细胞所暴露于的纳米复合物。在至少一个实施方式中,纳米复合物中的靶向线粒体的纳米载体多肽与核酸的按重量计的比例(w/w)为约2.5:1至约200:1。在至少一个实施方式中,纳米复合物中的靶向线粒体的纳米载体多肽与核酸的按重量计的比例(w/w)为约5:1至约16:1。在至少一个实施方式中,纳米复合物中的靶向线粒体的纳米载体多肽与核酸的按重量计的比例(w/w)为约15:1。在至少一个实施方式中,纳米复合物中的靶向线粒体的纳米载体多肽与核酸的按重量计的比例(w/w)为约100:1。鉴于本文的教导,技术人员将能够容易地确定植物细胞可暴露于一种或多种核酸和靶向线粒体的纳米载体多肽使得核酸进入细胞和进入细胞内的线粒体的其他可能条件。
在至少一个实施方式中,一种或多种核酸进一步包括至少一种选择标记基因。如本文使用的,术语“选择标记基因”旨在指的是当在转基因细胞或生物体(包括但不限于转基因植物或植物细胞)中存在时,可被表达以提供具有特定可检测特征或表型的基因。用这种方式,区分拥有该基因的生物体与不具有该基因的生物体是可能的。在某些实施方式中,选择标记基因还可仅选择性地允许包含该基因的那些细胞或生物体在某些条件下存活或生长。用这种方式,在不包含该基因的另外的相似或相同的细胞或生物体可无法存活或生长的条件下,有可能选择性地产生包含该基因的细胞或生物体的群体。如果选择标记基因与另一个基因位于相同的核酸上,则在细胞或生物体中选择标记基因的存在也可指示在细胞或生物体中其他基因的存在。这种选择标记基因是本领域众所周知的,并且可易于被技术人员选择和利用。
在至少一个实施方式中,选择标记基因适合于包括但不限于线粒体或叶绿体的基因组的细胞内非核细胞器的基因组的转化。在至少一个实施方式中,选择标记基因适合于在包括但不限于线粒体或叶绿体的非核细胞器中表达。
在至少一个实施方式中,选择标记基因是大肠杆菌链霉素3”-腺苷酰基转移酶基因,也表示为aada。缺乏这种基因的未转化的小孢子的胚胎发生在抗生素链霉素的存在下被抑制。相反地,由aada基因表达的酶催化链霉素的腺苷酰化,从而保护并入该基因的转基因植物小孢子免受链霉素的有害影响。因此,当在链霉素的存在下培养或萌发时,表达aada基因的转基因小孢子或由其产生的胚胎预期比不表达该基因的小孢子和胚胎具有存活优势。
在至少一个实施方式中,选择标记基因是裂殖酵母d-氨基酸氧化酶基因,也表示为daao。当在存在d-丙氨酸(d-ala)的情况下发生胚胎发生和/或萌发时,源自缺少该基因的未转化的小孢子的胚胎具有降低的萌发和形成健康苗的能力。然而,由daao基因表达的酶催化d-丙氨酸的氧化,保护并入该基因的转基因植物细胞或包括但不限于胚胎的组织,免受d-丙氨酸的有害作用。因此,当在d-丙氨酸存在下培养或萌发时,预期由表达daao基因的转基因小孢子产生的胚胎比不表达该基因的小孢子产生的胚胎具有存活优势。
在进一步方面中,本申请描述了从包含能够表达如本文所述的固氮酶的线粒体的植物细胞产生基因工程化植物的方法,以及通过这种方法产生的基因工程化植物。由包括但不限于小孢子的基因工程植物细胞产生基因工程植物的方法是本领域众所周知的,并且其包括但不限于胚胎发生和体外植物再生技术。
如本文使用的,应用于数值或值的范围的术语“大约”或“近似”旨在意指所列举的值可在考虑测量的性质或精度所测量的量的可接受误差程度内变化,使得该变化在本领域中被认为等同于所列举的值并且提供相同的功能或结果。例如,如本领域所理解的,误差程度可以由为测量提供的有效数字的数量来表示,并且其包括但不限于在为测量报告的最精确有效数字中的±1的变化。典型的示例性误差程度在给定值或值的范围的20百分比(%)之内,优选地10%之内、并且更优选地在5%之内。可替代地和特别地在生物系统中,术语“大约”或“近似”可以意指值在给定值的数量级内、优选地在5倍之内和更优选地在2倍之内。除非另有说明,否则本文给出的数值是近似的,其意味着当没有明确说明时,可以推出术语“大约”或“近似”。
如本文使用的,术语“基本上”指的是动作、特征、性质、状态、结构、项目(item)或结果的完整或接近完整的范围或程度。例如,“基本上”对齐的物体意味着物体完全地对齐或几乎完全地对齐。在一些情况中,与绝对完整性的精确的允许程度的偏离可取决于具体的上下文。然而,一般而言,完成的接近度将以便具有好像获得绝对和全部完成的相同的总体结果。
当以否定含义使用以提及完全或接近完全缺乏动作、特征、特性、状态、结构、项目或结果时,“基本上”的使用是同等适用的。例如,“基本上没有”颗粒的组合物可完全地没有颗粒,或几乎完全地没有颗粒,其效果将与完全地没有颗粒的效果相同。换句话说,只要没有其可测量的效果,“基本上没有”的成分或元素的组合物实际上仍可包含这种项目。
实施例
本发明的其他特征由通过举例的方式说明本发明的原理的以下非限制性实施例将变得显而易见。
实施例1:mtp-dna纳米复合物的表征
肽
在国际专利申请公开wo2013/016810中描述的靶向线粒体的纳米载体多肽(mtp)1-5由加拿大的canpeptideinc.合成。以下提供了mtp1至5的序列。
mtp1mfsylpryplraasaralvratrpsyrsallryq(seqidno:1)
mtp2maawmrslfsplkklwirmh(seqidno:2)
mtp3mkllwrlilsrkw(seqidno:3)
mtp4mwwrrsrtnslryt(seqidno:4)
mtp5mlfrlrrsvrlrglla(seqidno:5)
测试了五个mtp的非共价结合至核酸的能力,一种使双链dna(dsdna)分子易位所需的性质。用每种肽分别地进行凝胶迁移率变动测定和核酸酶保护测定,以确定在小孢子转染的制备中结合至线性化dsdna和使线性化dsdna完全饱和所需肽的最小量。
凝胶变动测定
将1μg的线性双链质粒dna(pdna,6.0kb)与增加量(0至20μg)的五个mtp中的每一个以单独的反应混合物(50μl总体积)混合,将反应混合物孵育15分钟,然后在用溴化乙锭染色的0.8%琼脂糖凝胶上进行电泳。
在2.5:1至8:1的重量比(weight-to-weight)的肽:dna结合比例,观察到由肽引起的dna迁移率的完全变动。
dnase保护测定
如以上凝胶变动测定所述的mtp1-5分别地与pdna混合。将5μl的dnasei(无rnase的dnase组;qiagen,valencia,ca,usa)添加至混合物体积(50μl)中。将混合物在室温孵育15分钟,然后在冰上孵育5分钟。用商业上可获得的dna纯化试剂盒(qiaquicktmpcr纯化试剂盒;qiagen)进行质粒-肽的解离和质粒纯化。在无菌水中洗脱dna,并进行0.8%琼脂糖凝胶电泳。
发现所有的mtp能够在比凝胶变动所需的肽:dna比例高~2倍的肽:dna比例保护dna免于核酸酶降解。对于mtp1、mtp2、mtp3、mtp4和mtp5,最佳的肽:dna比例分别是5:1、12:1、8:1、15:1和16:1。
zeta-粒度仪(sizer)分析
如以上对凝胶迁移率变动测定描述的,形成mtp-dna复合物。在173°反向散射下用633nm激光的zetasizertmnanozs(malvern)上在小体积石英定径比色皿(sizingcuvette)(zen2112)中孵育后,立即进行20μl样品的尺寸分析。使用zetasizertm软件v.7.02(malvern)中的contin算法分析数据。对每种样品进行三次重复测量,并计算和绘制一次粒径分布峰和多分散指数(pdi)二者的平均值和标准偏差。如本文使用的,术语“多分散指数”或“pdi”旨在意指从包含在媒介中分散的亚微米尺寸的颗粒的样品上进行的动态光散射实验获得的数据计算的参数。多分散指数的值表示进行实验的样品中的颗粒尺寸的不均匀程度。多分散指数的计算可如iso标准22412:2017,修订iso标准22412:2008和13321:1996中描述的进行。
在zetasizertm-nano(malvern)中,使用具有金电极的毛细管zeta-比色皿读取剩余样品(80μl)的ζ-电位。将样品制备成700μl的体积以填充杯。如本文使用的,术语“ζ-电位”旨在指的是围绕分散在分散媒介中的颗粒周围的流体静止层与本体分散媒介中远离颗粒和媒介之间的滑动平面或界面的点之间的静电电位差。ζ-电位是在媒介中分散的携带相似电荷的纳米颗粒之间的静电排斥的量度。
mtp-dna纳米复合物的尺寸和电荷在复合物上确定,所述复合物由mtp与6.0kb长的线性dna以按重量计5:1至200:1的范围的各种肽:dna比例形成。从图1a和1b中显示的结果看出,在低肽:dna比例下,仅mtp1形成了具有最高ζ-电位(图1b)的小复合物(图1a)。此外,增加肽:dna比例至≥按重量计100:1导致复合物尺寸的急剧降低,尤其是对于肽mtp2、mtp3和mtp4,并且纳米复合物电荷增加。从图1c、1d和1e中显示的结果看出,另一种按数量计尺寸的表达纳米复合物大小的方法显示用mtp2-5形成的纳米复合物的尺寸范围广泛,其包括以按重量计大于100:1的高肽:dna比例的一小部分相对小的复合物(<100nm)。通常,mtp1、mtp2和mtp4与dna形成最小的复合物。
另外,从图1f和1g中显示的结果看出,观察到用mtp2-5以高的肽:dna比例产生的纳米复合物比以较低比例产生的纳米复合物更稳定。在按重量计15:1的肽:dna比例下,由mtp2、3、4和5形成的复合物是不稳定的并趋于聚集(尺寸增加50-100%;图1f),而以按重量计100:1的肽:dna比例,这些复合物更稳定(尺寸增加10-30%;图1g)。mtp1肽不同于mtp2-5肽,因为其甚至以最低的肽:dna比例,与dna形成小的且非常稳定的复合物(图1a和1c-1g)。
mtp4肽用于研究用各种尺寸和形式的dna形成的纳米复合物。因为整个nif基因簇的长度超过20kb,而其操纵子的长度从4kb至10kb变化,因此测试了大范围的dna尺寸(1-22kb)。从图2a和2c中显示的结果看出,观察到以相同的肽:dna比例(100:1),由mtp4与1-8kb长的dna形成的复合物示出相似的尺寸(~150nm,图2a)和稳定性(尺寸增加10-30%;图2c)。对于较长的dna(11kb和22kb),注意到复合物的尺寸和不稳定性增加,其对22kb长的dna分子尤为显著。
为了测试dna的形式是否对纳米复合物的尺寸具有任何影响,使用低(15:1)的肽:dna比例,因为以该比例的复合物尺寸相对较大(~800nm),因此允许观察到来源于质粒dna的更紧凑结构的电位变化。然而,如图2b和2c中显示的结果看出,由mtp4与线性和质粒dna形成的纳米复合物示出相似的尺寸(图2b)和稳定性(图2c)。
实施例2:黑小麦小孢子的转染
nif构建体设计和合成
使用geneioustm软件设计了用于在小麦/黑小麦线粒体中表达的nif基因簇。nif构建体被设计为包括四个nif操纵子,其被调整用于通过密码子使用优化、用植物线粒体基因表达调控元件取代nif操纵子启动子/终止子和细菌调控基因的消除在小麦/黑小麦线粒体中表达。图3b中示出构建体的图示。此外,nif簇带有两个选择性标记基因(daao(d-氨基酸氧化酶)和aada(链霉素3’-腺苷酰基转移酶)),侧翼为与小麦线粒体重复区域的trnfm-1和rrm18基因同源的1kb序列。
由于由mtp与小于10kb的dna形成的纳米复合物的更好的特征,决定将nif簇(27.6kb)分成三个包含1kb的序列重叠的(9-10kb)片段(片段1、2和3,分别如图3b所示)。nif簇的片段1、2和3由lifetechnologies(geneart)dna合成服务合成,分别作为poa_nifclusterfrag1、pmk-v-bs_nifclusterfrag2和pmk-rq_nifclusterfrag3质粒递送。
小孢子分离
使用先前公开的提取方案的修改版本(asifet等,plantcelltissueorg.cult.(2013),116(1):125-130)从黑小麦(triticosecalesp.whittmackcvsunray)植物中提取小孢子。简而言之,在小孢子发育的单核阶段的早期至中期从供体植物切下分蘖,将其包裹在铝箔中,并且将茎浸入4℃的蒸馏水中21±1天。除去颖片并且从九个分蘖中收获小花(floret),将其放置在具有50ml提取缓冲液(13.4mmkno3、1.8mm(nh4)2so4、1.5mmkh2po4、0.56mmcacl2、0.38mmmgso4、0.1mmfeso4、0.1mmna2edta(乙二胺四乙酸)、89.6μmmes水合物(4-吗啉乙磺酸)和400mm甘露醇,用koh调节至ph6.5)的waringtm搅拌杯(vwrinternational,#58983-093)中并且在低速(18,000rpm)混合7s两阵(burst)。然后将匀浆通过高压灭菌处理的筛网(1mm2的孔)过滤,并且用另外的50ml的提取缓冲液冲洗搅拌杯,然后过滤。将组合的菌株通过100μm无菌滤网(vwrinternational,#ca21008-950)过滤至50ml的falcontm管中。小孢子在4℃以100×g5分钟使其成球,并倒出上清液。然后将细胞重悬浮于在15ml管中的15ml的cimc(谷物分离小孢子培养物)洗涤液(13.4mmkno3、1.8mm(nh4)2so4、1.5mmkh2po4、0.56mmcacl2、0.38mmmgso4、2.4μmki、29.6μmmnso4、80.9μmh3bo3、17.4μmznso4、52.5nmcocl2、50nmcuso4、52nmna2moo4、0.1mmfeso4、0.1mmna2edta、89.6μmmes水合物、14.8μm硫胺素、2.43μm吡哆醇、4.06μm烟酸、26.6μm甘氨酸、1.7mm肌醇、3.43mml-谷氨酰胺、3.25mm还原的l-谷胱甘肽、10mg/laglarcolltm、100mg/l头孢噻肟、90g/l麦芽糖、9g/l甘露醇、0.2mg/l2,4二氯苯氧基乙酸、1mg/l苯乙酸和0.2mg/l激动素,用koh调节至ph7.0),并且再次在4℃以100×g5分钟使其成球。然后将小球重悬浮于补充有ss-31肽的15mlcimc洗涤液中(canpeptideinc.加拿大;d-arg-dmt-lys-phe-nh2;最终浓度:6.6mg/ml),并其如前所述使其成球。将小球再次重悬浮于7ml20%(w/v)的麦芽糖溶液中,并且将1ml的cimc洗涤液在15mlfalcontm管中在顶部分层放置,并在4℃以100×g离心13分钟。用1ml移液管除去cimc洗涤液和麦芽糖的界面处的活的小孢子的带,然后将细胞重悬浮于15mlcimc洗涤液中,并且在4℃以150×g5分钟使其成球。倒出上清液,在falcon管的底部留下近似400μl的小孢子小球。用1mlcimc洗涤液将这些细胞重悬浮,随后使用血球计定量。最后,用cimc洗涤液将小孢子悬液稀释至最终浓度500细胞/μl。
dna制备
包含第一nif操纵子(nifhdky)的dna通过如下产生:用sfii和asci酶(neb)限制酶消化poa_nifclusterfrag1质粒dna,然后从琼脂糖凝胶中提取5.3kb长的dna并且依照供应商手册使用nucleospintm凝胶和pcr纯化试剂盒(macherey-nagel)纯化。可替选地,在含有phusiontm-hf缓冲液、0.2mmdntp、0.5μm的每种引物(az114(cacatgggtctggtcaggaa(seqidno:6);正向引物)和az115(cgaggacctttatagccataattca(seqidno:7);反向引物))、50pg质粒dna和0.25μlphusiontm-hf酶(lifetechnologies)的25μl反应物中通过pcr产生5.3kbdna。如以下进行循环:在98℃进行30秒,98℃进行10秒、60℃进行30秒、72℃进行3分钟和72℃进行10分钟的30个循环。使用nucleospintm凝胶和pcr纯化试剂盒(macherey-nagel)纯化pcr产物。
小孢子转染
将dna(1.5μg)与实施例1中列出的五种靶向线粒体的纳米载体多肽(mtp)中的每一种在100μloptimatmdh2o(fisherscientific)的最终体积中以各种重量比(w/w)的肽:dna比例组合。将混合物在室温孵育15min,以在mtp和dna之间形成纳米复合物,然后与分离的黑小麦小孢子(200μl,1x105细胞)在室温孵育15min。添加cimc洗涤液(500μl),并且将混合物在室温孵育45min。接下来,通过在室温以100×g离心5分钟使小孢子成球,除去600μl的上清液,并且将小孢子重悬浮于剩余的200μl中。然后,将转化混合物添加至含有补充有psk-α肽的3.3mlcimc洗涤液(canpeptideinc.加拿大;tyr(4-oso3h)-ile-tyr(4oso3h)-thr-gln;最终浓度:85ng/ml)的3.5cm皮氏培养皿中用于瞬时实验,或含有3.3ml具有psk-α肽和四个子房的cimc-7培养基(包括补充有ficoll的cimc洗涤液的小孢子培养和胚胎诱导培养基(最终浓度:10%(w/v)))的3.5cm皮氏培养皿中用于胚胎发生和选择实验。小孢子在黑暗中在28℃培养。对照培养是在没有转染肽或dna的情况下处理的小孢子上进行(阴性转染对照)。
来自转染的小孢子的rna提取物
通过离心合并且收获来自四次转染的小孢子:首先在室温以4000rpm在15mlfalcontm管中5分钟,然后以10,000rpm在2ml研磨管中1分钟。除去上清液,添加6个不锈钢珠(2.38mm宽;mobiolaboratoriesinc.),将细胞立即在液氮中冷冻并在-80℃储存。
根据制造商的说明,以少量改进使用plantrneasytm试剂盒(qiagen)提取总rna。通过在450μlrlt/βme缓冲液中重悬浮来解冻细胞,并且通过在室温以最大速度在vortex-genietm2混合器(fisherscientific)中将水平放置的管涡旋15分钟进行细胞裂解。此外,还包括两种dnase处理:在色谱柱上和在管中,后者依照制造商的方案进行rna纯化。每种dnase处理在37℃在包含10u的turbotmdnasei(fisherscientific)的100μl反应物(reaction)进行30分钟。使用在nanodroptm8000仪器(thermofisherscientific)上的紫外可见光谱定量纯化的rna。
qrt-pcr分析
根据制造商的说明使用superscripttmvilocdna合成试剂盒(lifetechnologies)合成cdna,其中每20μl反应物中总共400ng的rna模板。在20μl反应体积中使用quantitecttmsybrtmgreenpcrmastermix(qiagen)进行所有实时pcr反应。每个样品一式三份测试,并且2μl(40ng)的模板连同0.1μm的每种正向引物和反向引物(表1)一起用于每个反应。如以下进行循环:在95℃进行15分钟,95℃进行15秒、60℃进行30秒、72℃进行30秒的40个循环,随后是解离曲线。使用以新鲜的未转染的小孢子作为参考样品的标准曲线方法或相对标准曲线方法进行用quantstudiotm软件的分析,关于线粒体内源性cob(细胞色素b)、coxii(细胞色素c氧化酶亚基ii)和rps13(核糖体蛋白s13)基因的表达计算nif基因的相对表达。使用标准曲线方法,关于线粒体内源性cob基因表达计算daao基因的相对表达。
表1:引物序列
nifhdky基因的瞬时表达
nif操纵子1dna(nifhdky)作为dna(1.5μg)和mtp之间的纳米复合物被递送。基于dna结合和dnase保护试验的结果,选择低的肽:dna比例来配制纳米复合物:具体地,如在图4中表明的,5:1w/w的mtp1肽:dna比例(mtp1(5:1))、12:1w/w的mtp2肽:dna比例(mtp2(12:1))、8:1w/w的mtp3肽:dna比例(mtp3(8:1))、15:1w/wmtp4肽:dna比例(mtp4(15:1))和16:1w/w的mtp5肽:dna比例(mtp5(16:1))。通过qrt-pcr分析转染后48h黑小麦小孢子中的nif转录物丰度。使用标准曲线方法,使用三个重复来测量标准化nifmrna表达与cob、coxii和rps13基因的线粒体的内源性mrna表达的对照水平相比的倍数差异。
从图4示出的结果看出,对从转染的小孢子中分离的总rna的qrt-pcr分析示出,转染后48小时可检测到所有四种nif基因转录物,而在对照小孢子中未检测到nif转录物。有趣的是,观察到在低的肽:dna比例,mtp4是nifhdky操纵子的最佳载体,随后是mtp3和mtp5,而在低的肽:dna比例,通过mtp1和mtp2肽递送的nif基因的表达非常低。
递送nifhdky基因至黑小麦小孢子的优化
如图4示出,观察到平均nif基因表达通常是低的:mtp4介导的递送的参考基因表达(内源性线粒体基因)的~30%,其可能太低而无法检测nif蛋白。因此,测试了两种策略来增加nif基因递送和表达:(i)使用较高的肽:dna比例和(ii)递送更高量的以低的肽:dna比例形成的纳米复合物。因此,将黑小麦小孢子如上所述与以15:1w/w的肽:dna比例的mtp4和增加量的nif操纵子1dna(如上所述,从图3b示出的片段1获得)的混合物孵育;尤其是由1.5μg的dna(1x)、3.75μg的dna(2.5x)、7.5μg的dna(5x)、11.25μg的dna(7.5x)和15μg的dna(10x)形成的纳米复合物。结果在图5a中示出。此外,在单独的实验中,将黑小麦小孢子如上所述与由以100:1w/w的肽:dna比例的mtp1、mtp2、mtp3、mtp4和mtp5中的每种与1.5μg的nif操纵子1dna(如上所述,从图3b示出的片段1获得)形成的纳米复合物一起孵育。结果在图5b中示出。
从图5a和5b中示出的结果可以看出,两种策略导致nif基因表达显著增加,其中mtp3在100:1w/w的肽:dna比例以标准的纳米复合物量(基于1.5μgdna)(图5b;mtp3_100_1x)和mtp4在15:1w/w的肽:dna比例与5倍高的量的纳米复合物(基于7.5μgdna)结合(图5a;mtp4_15_5x)获得最佳结果。
实施例3:转染的黑小麦小孢子中nif蛋白的产生
为了检测转染的细胞中nif蛋白的产生,开发了用于从黑小麦小孢子中分离总蛋白提取物并且用于检测这些提取物中线粒体蛋白的方案。抗nifh抗体用于检测来源于递送的nifhdky操纵子的表达的nifh蛋白,而抗idh和抗coxii抗体应用于检测线粒体内源性蛋白idh(异柠檬酸脱氢酶)和coxii(细胞色素氧化酶亚基ii),其作为蛋白提取物质量的控制。
总蛋白提取物
如实施例2中描述的,转染小孢子。根据制造商的说明,通过在蛋白溶液化缓冲液(cedarlane)中超声处理,在转染后第0、1、2、3、4、5和7天从小孢子中提取总蛋白。提取物中的蛋白浓度使用dctm蛋白质测定(biorad)确定。
免疫印迹
使用bolttm12%bis-trisplus凝胶和bolttmmessds运行缓冲液(lifetechnologies)在两个平行的sds-page电泳凝胶(laemmliuk,nature(1970),227:680–685)中分离10μg的总蛋白提取物,然后如先前描述的(towbin等,proc.natl.acad.sci.usa(1979),76:4350–4354),使用bolttm转移缓冲液(lifetechnologies)电转移到聚偏二氟乙烯(pvdf)(0.2μm)膜(millipore)上。完成转移后,将膜在补充有0.5%(v/v)tween20(pbs-t)的1×pbs(磷酸盐缓冲盐水,bioshop)中洗涤三次5分钟,并且用包含5%脱脂乳的pbs-t(pbs-tb;bioshop)封闭30分钟。在4℃将膜与第一抗体:母鸡多克隆抗-nifhigy抗体、兔多克隆抗-coxii或抗-idhigg抗体(agrisera;稀释1:1,000)孵育过夜。在pbs-tb中反复洗涤后,在室温将膜与山羊抗-鸡igy或山羊抗-兔igghrp-缀合物(agrisera;稀释1:5,000)孵育2小时。在pbs-t中洗涤几次后,在室温使用bolttmtmb-印迹底物溶液(thermoscientific)进行免疫检测。在湿膜上标记具有与nifh蛋白相对应的可见谱带的泳道。然后使用imagelab软件(程序:印迹/比色/图像颜色:灰色)在bioradgeldocxr+成像系统中拍摄干燥膜的图像。
从图6中呈现的结果看出,转染的小孢子的蛋白质印迹分析示出,从用nifhdky操纵子dna和mtp:mtp3_100_1x和mtp4_15_5x,但不是mtp4_15_1x形成的纳米复合物转染的小孢子分离的提取物中在转染后3-7天存在低量但可检测量的nifh蛋白。这些结果表明,nifhdky操纵子在黑小麦小孢子线粒体中起作用,并且nif基因不仅在转录物水平而且在蛋白质水平被表达。
实施例4:递送nif簇进入黑小麦小孢子
在图3b中示出的nif簇dna片段1、2和3是通过用sfii限制酶分别从poa_nifclusterfrag1、pmk-v-bs_nifclusterfrag2和pmk-rq_nifclusterfrag3质粒载体切除(在实施例2中描述的),随后在0.8%琼脂糖中分离,并且依照供应商手册使用nucleospintm凝胶和pcr纯化试剂盒(macherey-nagel)纯化来制备的,并且制备了纳米复合物。
每个nif簇片段1、2和3分别(s)与mtp4以15:1(w/w)的肽:dna比例在各个75μl反应体积中使用标准(1.5μg)量的每个dna片段在室温孵育15分钟。然后组合三种单独的纳米复合物混合物(对于片段1、2和3中的每个为一个)(4.5μg总dna;总体积225μl),以提供纳米复合物mtp4_nif1,2,3(s)_15_1x。类似地,将每个nif簇片段1、2和3分别与mtp4以15:1(w/w)肽:dna比例使用五倍高的量(7.5μg)的每个dna片段孵育,并且组合各个混合物(22.5μg总dna;总体积225μl),以提供纳米复合物mtp4_nif1,2,3(s)_15_5x。最后,每个nif簇片段1、2和3分别(s)与mtp3以100:1的(w/w)肽:dna比例使用标准量(1.5μg)的dna孵育,并且组合各个混合物(4.5μg总dna;总体积225μl),以提供纳米复合物mtp3_nif1,2,3(s)_100_1x。
另外,在室温将合适的mtp(mtp4或mtp3)与合并的(p)dna片段(片段1、2和3)在200μl的总体积中孵育15分钟,以制备合并的纳米复合物。因此,mtp4以15:1(w/w)的肽:dna比例使用标准(1.5μg)量的每个dna片段1、2和3(4.5μg总dna)的反应提供了合并的纳米复合物mtp4_nif1,2,3(p)_15_1x;mtp4以15:1(w/w)的肽:dna比例使用5x(7.5μg)量的每个dna片段1、2和3(22.5μg总dna)的反应提供了合并的纳米复合物mtp4_nif1,2,3(p)_15_5x;和mtp3以100:1(w/w)的肽:dna比例使用标准量(1.5μg)的每个dna片段1、2和3(4.5μg总dna)的反应提供了合并的纳米复合物mtp3_nif1,2,3(p)_100_1x。
使用实施例2中描述的方法用纳米复合物转染小孢子。在转染后48小时,如实施例2中描述的,通过qrt-pcr测量每个片段中第一nif基因的转录物的相对丰度。使用相对标准曲线方法(quantstudiotm软件)和新鲜的未转染小孢子作为参考样品,使用三次重复以测量标准化nifmrna表达与线粒体内源性mrna表达(cob基因)的对照水平的倍数差异。
从图7a至c中呈现的结果看出,在转染的小孢子中检测到所有三个nif转录物:nifh(片段1)、nifb(片段2)和nifu(片段3),但在对照小孢子中未检测到,因此证实了所有三个nif簇片段被递送至黑小麦小孢子中。在用mtp3_100_1x纳米复合物转染的小孢子中,nifh、nifb和nifu基因的表达最高,在用mtp4_15_5x纳米复合物转染的小孢子中表达中等,在用mtp4_15_1x纳米复合物转染的小孢子中表达低。有趣的是,作为mtp-合并的(p)dna纳米复合物传递的nif基因比作为mtp-分开的(s)dna纳米复合物传递的那些更有效地表达。
测试了作为mtp-合并的dna纳米复合物递送的nif簇的三个片段的所有四个nif操纵子(nifhdky、nifbqen、niffj和nifusvwzm)的表达。从图8中呈现的结果看出,对于合并的纳米复合物mtp4_nif1,2,3(p)_15_5x,qrt-pcr分析显示检测到nif簇(片段1、2和3)的所有16个nif转录物,因此证实表达了所有递送入黑小麦小孢子的nif基因。注意到各种nif基因的表达水平不同,最可能是由于启动子强度和转录物稳定性的差异。
实施例5:瞬时转染的小孢子中的氮固定
n2固定测定
为了测试nif-转染的黑小麦小孢子固定大气的氮(n2)的能力,已经开发用于细菌细胞的15n2并入测定的方案(temme等,proc.natl.acad.sci.usa(2012),109:7085–7090)被调整用于小孢子。作为阳性对照,使用在98原子百分比(at%)和9.8at%15n2气体的存在下在去抑制(de-repression)培养基中培养的产酸克雷伯氏菌(klebsiellaoxytoca)菌株m5a1的厌氧培养物。使用抑制培养基(cimc洗涤液,没有无机和有机氮源,即不具有(nh4)2so4、谷氨酰胺和谷胱甘肽)代替标准cimc洗涤液,如实施例2中描述的分离小孢子,然后用合并的mtp_nif1,2,3dna纳米复合物转染,所述合并的mtp_nif1,2,3dna纳米复合物通过使nif簇片段1、2和3与mtp4以15:1(w/w)的肽:dna比例使用标准(t4_nif_15_1)或五倍高的量的dna(t4_nif_15_5),或与mtp3以100:1(w/w)的肽:dna比例使用标准量的dna(t3_nif_100_1)反应如实施例4中描述的形成。接下来,3.0ml去抑制培养基(如先前对克雷伯氏菌属描述的,用d-丝氨酸补充的抑制培养基(temme等,proc.natl.acad.sci.usa(2012),109:7085–7090))在具有包含橡胶密封盘(isomassscientificinc.,#e2850-5)的开口塑料盖的12.0ml玻璃管中被接种对照和转染的小孢子(250μl,1x105个细胞)。通过将压缩的15n2标记的空气通过管的橡胶密封件注入,同时将未标记的(自然)空气通过排气针(ventneedle)排空,用15n2标记的空气置换管的顶部空间(9ml)。通过将15n2(98at%;sigma)气体和o2以80:20(v:v)的比例在包含1g草酸的150ml玻璃管(用橡胶盘和金属盖密封)中混合产生压缩的15n2标记的空气,以在通过真空排气且用天然n2气体冲洗管后消除无机n污染物。并行地,使用自然空气代替15n2标记的空气。在黑暗中在28℃将对照和nif转染的细胞培养7天,然后在室温通过以150xg离心5分钟收获,并且然后在60℃在实验室烘箱中将细胞小球干燥24h。通过使用finniganmatdeltaplustm同位素比质谱仪分析干燥的细胞样品的氮含量和15n与总n的比例(at%)。
从图9a和9b中呈现的结果看出,对照和转染的小孢子的初始培养物中以及在自然和标记的空气中培养的对照小孢子中的15n含量是相同的,并且对应于15n同位素的天然丰度(0.366at%),如预期的。这证实了未转染的小孢子不具有固定大气的氮的能力。在nif-转染的小孢子中检测到15n含量的可检测的富集。用t4_nif_15_1纳米复合物转染的小孢子中,干燥细胞生物量中15n量增加了10%,而用t4_nif_15_5和t3_nif_100_1纳米复合物转染的细胞中分别增加了2.1倍和3.6倍。转染的小孢子中15n含量的这种增加表明nif基因簇递送导致在nif-阳性小孢子的线粒体中nif基因的功能表达,从而导致大气的氮并入细胞生物量中(氮固定)。
实施例6:选择标记基因
细胞活力测试–fda测定
将重悬浮在270μlcimc洗涤液中的分离的黑小麦小孢子(10,000-20,000个细胞)的样品与60μl的fda(荧光素二乙酸盐,cimc洗涤液中的100ng/ml溶液)混合,并且在黑暗中孵育5分钟。使用leicaevostm荧光显微镜观察并且计数绿色荧光(存活)和非荧光(死亡)细胞(每个样品的总计数:100个细胞)。
小孢子胚胎发生和胚胎萌发
在28℃在黑暗中,在具有或不具有各种浓度的选择剂d-丙氨酸(d-ala,sigma)和/或链霉素(strep;sigma)的3.5mlcimc-7培养基中培养小孢子(每板1x105个细胞)。在第4周,将发育中的胚胎转移到包含各种浓度的选择剂d-丙氨酸和/或链霉素的固体cimc-4培养基(13.4mmkno3、1.8mm(nh4)2so4、1.5mmkh2po4、0.56mmcacl2、0.38mmmgso4、2.4μmki、29.6μmmnso4、80.9μmh3bo3、17.4μmznso4、52.5nmcocl2、50nmcuso4、52nmna2moo4、0.1mmfeso4、0.1mmna2edta、89.6μmmes水合物、29.7μm硫胺素、142μm抗坏血酸、4.86μm吡哆醇、8.12μm烟酸、75μml-天冬氨酸、52μm柠檬酸、26.6μm甘氨酸、1.7mm肌醇、3.43mml-谷氨酰胺、4.3μml-脯氨酸、100mg/l头孢噻肟、1mg/l精胺、4mg/l亚精胺、60g/l麦芽糖、9g/l甘露醇、1mg/l苯乙酸、2mg/l6-苄基氨基嘌呤、0.5mg/lmeta-topoline和3g/l[0.3%(w/v)]gelritetm,用koh调节至ph5.8)上,并且在16℃在递送80μmm-2s-1(16-h灯光周期)的sylvaniagro-luxtm宽光谱灯泡(40瓦特)之下培养。在培养3-4周后对萌发的胚胎评分。植物再生效率被定义为从100个胚胎中萌发的绿苗的数量,以百分比表示。
daao选择
测试了选择剂d-丙氨酸(d-ala)对小孢子生存力、胚胎发生和胚胎萌发的影响。如从图10a和b呈现的结果看出,未观察到以浓度达至10mm的d-ala对小孢子生存力和胚胎发生的显著影响。然而,当源于在各种浓度的d-ala的存在中培养的小孢子的胚胎被转移至不具有d-ala的萌发培养基中时,如图10c所示,从2.5mmd-ala开始观察到萌发绿苗的质量下降,这取决于d-ala浓度,尽管植物再生效率没有显著降低(从12%至10%)。此外,从图10d呈现的结果看出,在不具有d-ala的培养基中培养的小孢子发育的胚胎示出更严重的植物再生效率降低(从12%至2%),同时降低了萌发的苗的质量。基于这些发现,开发了用于黑小麦的daao选择程序:用于小孢子培养的2.5mmd-ala和用于胚胎萌发和植物再生的5mmd-ala。
通过将w_m_daao构建体(4.7kb,图3c)克隆至puc18/19克隆载体(genebank#l09137)中来构建puc_w_m_daao质粒。在侧翼为1kb长的5’和3’同源区域(hr)的小麦线粒体启动子和终止子的控制下,w_m_daao构建体携带来自裂殖酵母的线粒体密码子优化的daao(d-氨基酸氧化酶)基因(gisby等,plantphysiol.(2012),160:2219-2226)。包含w_m_daao构建体的dna(图3c)通过用xbai和ecori酶限制性消化puc_w_m_daao质粒dna,随后从琼脂糖凝胶中提取4.7kb长的dna,且根据供应商手册使用nucleospintm凝胶和pcr纯化试剂盒(macherey-nagel)纯化来产生。
用通过将mtp4和w_m_daaodna以15:1(w:w)的肽:dna比例混合形成的纳米复合物,如实施例2中描述的转染黑小麦小孢子。如实施例2中描述的,通过总分离的rna的qrt-pcr分析转染后48h的黑小麦小孢子中的daao转录物丰度。使用标准曲线方法,使用三次重复来测量标准化daaomrna表达与线粒体内源性cobmrna表达的对照水平相比的倍数差异。
从图11呈现的结果看出,可在转染后48小时的转染的小孢子(mtp4-dao)中检测到daao基因转录物,而在对照小孢子中未检测到daao转录物。在具有和不具有2.5mmd-ala选择的情况下,将转染的小孢子在胚胎诱导培养基中培养4周。然后将胚转移到包含5mmd-ala的胚胎萌发培养基上以产生绿苗。初步结果显示,尽管绿苗是由源于mtp4-daao-转染的小孢子的胚胎获得,但对胚胎的选择压力可需要增加。
组合的选择
组合的选择包括如以上描述的daao标记基因的选择和如由macmillan(plantorganelletargetingcellpenetrationpeptides.ph.d.thesis,2013,universityoflethbridge,canada;macmillan等,plantbiotechnologyreports,2018,inpress,doi:10.1007/s11816-018-0502-y)描述的氨基糖苷-3"-腺苷酰基转移酶基因(aada)标记基因的选择。测试了两种选择剂(d-ala和链霉素)对小孢子胚胎发生和胚胎萌发的影响。从图12a中呈现的结果看出,100mg/l链霉素的存在显著降低了小孢子形成胚胎的能力,并且较高浓度的链霉素(400mg/l)导致小孢子胚胎发生的完全消除。添加2.5mm或5.0mm浓度的d-ala至包含低于400mg/l的链霉素的培养基中具有最小的效果,如果有的话。另外,如从图12b中呈现的结果看出,在存在或不存在d-ala(2.5mm和5mm)的情况下,暴露于浓度≥200mg/l的链霉素的黑小麦胚胎不能再生为绿苗。基于这些发现,开发了黑小麦的组合选择程序:用于小孢子培养的100mg/l链霉素加2.5mmd-ala和用于胚胎萌发和植物再生的200mg/l链霉素加5mmd-ala。
黑小麦小孢子用肽-dna复合物转染,所述肽-dna复合物通过将mtp4与携带aada和daao可选择的标记基因的质粒dna以15:1(w:w)的肽与dna比例混合来形成。将转染的小孢子在具有或不具有单一(2.5mmd-ala或100mg/l链霉素)或组合2.5mmd-ala+100mg/l链霉素选择的胚胎诱导培养基中培养4周。从图13中呈现的结果看出,与对照:未处理的小孢子(对照1)和单独用dna处理的细胞(对照2)相比,稍微较高数量的胚胎由转染的小孢子(mtp4-aada+dao)形成。然后将胚转移到包含5mmd-ala+200mg/l链霉素的胚胎萌发培养基上,以产生绿苗。初步结果显示,尽管从源自mtp4-aada+daao-转染的小孢子的胚胎中获得了绿苗,但可能需要增加对胚胎的选择压力。
氮缺乏选择
在存在或不存在(nh4)2so4(氮的矿物或无机源)、谷氨酰胺(δgln)和谷胱甘肽(δglnδgsh)(氮的有机源)的情况下,在增加的抑制培养基(改进的cimc-7)上培养黑小麦小孢子。(nh4)2so4的含量从100%(1.76mm)减少至80、60、40、20和0%(分别为1.41、1.06、0.7、0.35和0mm)。此外,包含各种浓度的无机氮的培养基中耗尽了有机氮源,其包括通常分别以3.43mm和3.25nm的浓度存在的氨基酸谷氨酰胺(gln)和肽谷胱甘肽(gsh)。从图14中呈现的结果看出,省略无机氮源仅稍微降低小孢子胚胎发生的效率,而缺少gln和gsh对小孢子胚胎发生具有显著影响。无机和有机氮源减少对胚胎萌芽的影响可通过在cimc-4标准萌发培养基以及包含具有或不具有谷氨酰胺和脯氨酸的60、40或0%(nh4)2so4培养基上培养黑小麦胚胎来测试。
本文所述的实施方式旨在说明本发明的组合物和方法,并且不旨在限制本发明的范围。与本说明书整体一致的并且对于本领域技术人员而言显而易见的各种修改和改变旨在被包括在内。所附权利要求书不应受到实施例中提出的具体实施方式的限制,而应给予与说明书整体一致的最宽泛的解释。
序列表
<110>加拿大农业及农业食品部
<120>作物中的生物氮固定
<130>3688-190
<150>us62/619,949
<151>2018-01-22
<160>47
<170>patentin版本3.5
<210>1
<211>34
<212>prt
<213>人工序列
<220>
<223>mtp1
<400>1
metphesertyrleuproargtyrproleuargalaalaseralaarg
151015
alaleuvalargalathrargprosertyrargseralaleuleuarg
202530
tyrgln
<210>2
<211>20
<212>prt
<213>人工序列
<220>
<223>mtp2
<400>2
metalaalatrpmetargserleupheserproleulyslysleutrp
151015
ileargmethis
20
<210>3
<211>13
<212>prt
<213>人工序列
<220>
<223>mtp3
<400>3
metlysleuleutrpargleuileleuserarglystrp
1510
<210>4
<211>14
<212>prt
<213>人工序列
<220>
<223>mtp4
<400>4
mettrptrpargargserargthrasnserleuargtyrthr
1510
<210>5
<211>16
<212>prt
<213>人工序列
<220>
<223>mtp5
<400>5
metleupheargleuargargservalargleuargglyleuleuala
151015
<210>6
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>6
cacatgggtctggtcaggaa20
<210>7
<211>25
<212>dna
<213>人工序列
<220>
<223>引物
<400>7
cgaggacctttatagccataattca25
<210>8
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>8
ctgctgaagtgggatccgtt20
<210>9
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>9
ctcgtccagcacatccaaca20
<210>10
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>10
tgactgttcgtggatgtgct20
<210>11
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>11
ccacaccagaaacaccggta20
<210>12
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>12
tgcttggactactaccgctg20
<210>13
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>13
gcaacacatccttgggatcc20
<210>14
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>14
tgcttggactactaccgctg20
<210>15
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>15
gcaacacatccttgggatcc20
<210>16
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>16
atcatgcagccagaacagct20
<210>17
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>17
acaagctggagcaacaggaa20
<210>18
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>18
ctcctcgagattggcaagct20
<210>19
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>19
aggtccagcatcttgttgca20
<210>20
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>20
acccgatatcatcctgctgc20
<210>21
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>21
atcacatcaccagcaggacg20
<210>22
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>22
cctgctgatcttttggtggc20
<210>23
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>23
tccttgacgaacacgacgaa20
<210>24
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>24
tctgctcgtggtgctcaaat20
<210>25
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>25
agccaagaagcaagacgagc20
<210>26
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>26
tggaactgctgcttgggaaa20
<210>27
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>27
agagcaggacgaatagcagc20
<210>28
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>28
ctcctgctgttgcttctgga20
<210>29
<211>21
<212>dna
<213>人工序列
<220>
<223>引物
<400>29
ccagacaaagacacggtcact21
<210>30
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>30
gggtgctgcttgtgaattgg20
<210>31
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>31
caggaacagcaggttgtcca20
<210>32
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>32
aggattgggagaacgtgctg20
<210>33
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>33
gccacacgttgacaagaagc20
<210>34
<211>21
<212>dna
<213>人工序列
<220>
<223>引物
<400>34
tgatgaacttcgatccgctga21
<210>35
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>35
aagaggcacttcagcacgaa20
<210>36
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>36
tcaaccatggcttgctggaa20
<210>37
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>37
acagaaaaccaacgaccgga20
<210>38
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>38
gctcgtgttcctgaaggtga20
<210>39
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>39
ctggttgaggagcttgtcga20
<210>40
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>40
agaatggcatggatcggtag20
<210>41
<211>19
<212>dna
<213>人工序列
<220>
<223>引物
<400>41
tcctaatgttttgggcatc19
<210>42
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>42
ttccacgaatctcactgcac20
<210>43
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>43
gttgggctgtaccttcctca20
<210>44
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>44
gtaagggcgatccatcttga20
<210>45
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>45
gggaattgaagaggggagaa20
<210>46
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>46
gaattgttccacggcaaggg20
<210>47
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>47
cagcttggtatcctgtgcca20
- 还没有人留言评论。精彩留言会获得点赞!