稠环噻吩分子、p型半导体膜和电子器件的制作方法
本申请涉及稠环噻吩分子、p型半导体膜和电子器件。
背景技术:
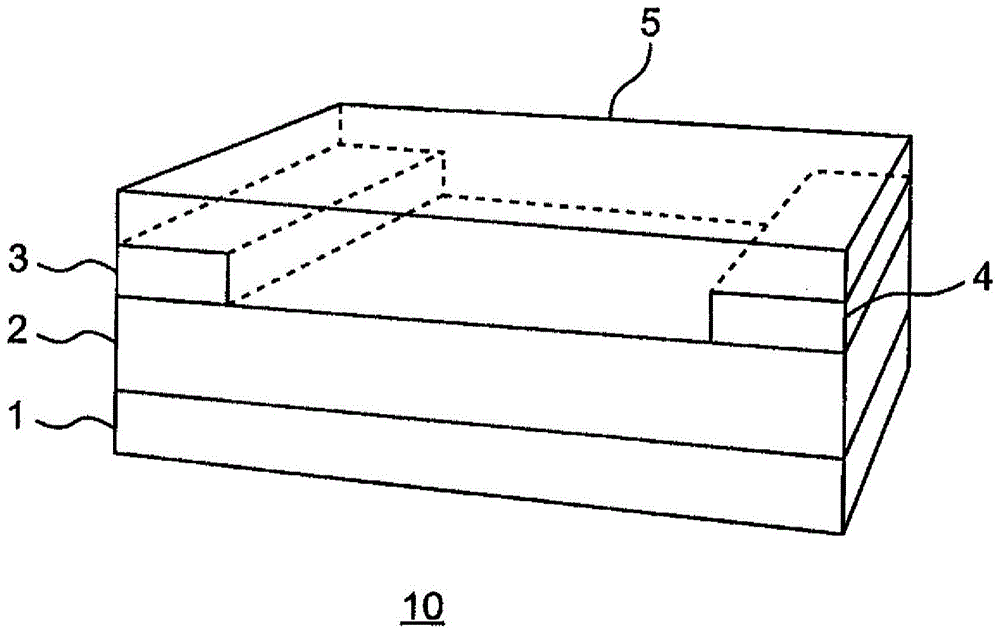
:近年来,提出了许多使用有机材料作为半导体层(半导体膜)的形成材料的电子器件、特别是薄膜晶体管(thinfilmtransistor、tft),其研究开发变得盛行。将有机材料用于半导体层有各种优点。例如,以无机非晶硅等作为基体的以往的无机薄膜晶体管需要350~400℃左右的加热工序,与此相比,有机tft能够以50~200℃左右的低温加热工序来制造。因此,能够在塑料膜等耐热性更弱的基底上制作元件。此外,作为有机材料的优点,还可举出:能够用旋涂法、喷墨法、印刷等之类的容易的形成方法来形成半导体层,以低成本制造大面积的器件。作为用于判断tft的性能而使用的指标之一,有半导体层的载流子迁移率,为了提高有机tft中的有机半导体层(有机半导体膜)的迁移率,进行了许多研究。这些研究中,作为主要着眼于形成有机半导体层(有机半导体膜)的有机材料的分子的研究,有例如使用了具有在1分子中稠合了包含2个噻吩环的4个~9个芳香环的结构的稠环噻吩分子的研究(专利文献1~3)、以及使用了具有在1分子中稠合了包含4个噻吩环的8个~13个芳香环的结构的稠环噻吩分子的研究(专利文献4)等。这样,得到具有良好特性的有机半导体及其膜关系着电子器件的性能提高。因此,用于进一步提高有机半导体及其膜的特性的研究成为必要。另外,作为稠环噻吩分子的p型有机半导体材料,特别是苯并噻吩并苯并噻吩(btbt)及其衍生物(c8-btbt)作为载流子迁移率高的材料广为人知。现有技术文献专利文献专利文献1:国际公开第2017/150474号专利文献2:国际公开第2016/152889号专利文献3:日本专利第6318452号专利文献4:欧洲专利公开第3050887号公报技术实现要素:本公开的发明人等发现,就以往的p型有机半导体材料而言,产生了如以下所示的新问题。以往已知的稠环噻吩分子的空穴迁移率称不上充分高,因此无法得到工作速度充分高的电子器件。具体而言,btbt及其衍生物等分子系材料的空穴迁移率至多为5~10cm2/vs左右。该情况下,就栅极长为10μm的元件而言,只能得到1mhz左右的工作速度。用涂敷法能够形成的几乎是下限的栅极长为1μm,即使是这样的元件,也只能得到10mhz左右的工作速度。因此,为了实现rf-id(射频识别,radiofrequencyidentifications)中需要的100mhz左右的工作速度,要求具有更高的空穴迁移率的有机半导体材料。本公开的目的在于提供空穴迁移率更充分高的稠环噻吩分子、包含该稠环噻吩分子的p型半导体膜、以及使用了该p型半导体膜的电子器件。本公开提供一种稠环噻吩分子、包含该稠环噻吩分子的p型半导体膜、以及使用了该p型半导体膜的电子器件,上述稠环噻吩分子在1分子中具有包含3个噻吩环的7个芳香环,且上述7个芳香环具有1个或2个萘结构部。本公开的稠环噻吩分子显示出更充分高的空穴迁移率,因此包含该稠环噻吩分子的p型半导体膜可以使电子器件的频率特性提高。附图说明图1为示出使用了本公开的稠环噻吩分子的晶体管的基本结构的一例的结构示意图。图2为示出使用了本公开的稠环噻吩分子的晶体管的基本结构的另一例的结构示意图。具体实施方式[稠环噻吩分子]本公开的稠环噻吩分子具有在1分子中稠合了包含3个噻吩环的7个芳香环的结构。噻吩环属于芳香环。本公开的稠环噻吩分子所包含的除噻吩环以外的芳香环通常为苯环。因此,本公开的稠环噻吩分子所具有的7个芳香环通常以稠合形态包含3个噻吩环和4个苯环。稠合是指相邻的2个芳香环具有2个碳原子及它们之间形成的键(即共用键),或为该状态。稠环噻吩分子包含2个以下或4个噻吩环的情况下,得不到充分高的空穴迁移率。即便假设稠环噻吩分子包含3个噻吩环,但构成该稠环噻吩分子的芳香环(包括噻吩环)的数量不为7个的情况下,也得不到充分高的空穴迁移率。本公开中,由7个芳香环构成的芳香环部(即芳香环稠合部)具有线性结构。芳香环部具体而言是指在化学结构式中7个芳香环稠合的部分。本公开的稠环噻吩分子具有这样的芳香环部,可以根据期望进一步具有取代基。这样的芳香环部具有线性结构是指,该芳香环部在其化学结构式中不具有分支结构,而作为整体具有呈1根线形的结构。即,构成该芳香环部的全部芳香环各自仅与相邻的1个或2个芳香环稠合,作为整体具有线性结构。构成具有线性结构的芳香环部的7个芳香环中,与相邻的3个以上芳香环稠合的芳香环1个都不包含。需要说明的是,构成该芳香环部的7个芳香环中,只要包含1个与相邻的3个以上芳香环稠合的芳香环时,就视为该芳香环部具有分支结构。具有线性结构的芳香环部中,2个末端的芳香环各自为仅与相邻的1个芳香环稠合的芳香环。2个末端的芳香环各自独立地可以为苯环,或者也可以为噻吩环。末端的芳香环为噻吩环的情况下,该噻吩环与相邻的仅有的1个芳香环以共有以下碳原子的方式稠合:该噻吩环中的2位和3位的碳原子、3位和4位的碳原子、或者4位和5位的碳原子。需要说明的是,通常噻吩环中的1位为硫原子的位置。另一方面,除该2个末端的芳香环以外的芳香环各自为仅与相邻的2个芳香环稠合的芳香环。除2个末端的芳香环以外的芳香环各自独立地可以为苯环,或者也可以为噻吩环。具有线性结构的芳香环部中除2个末端的芳香环以外的芳香环中,就为苯环的全部芳香环各自而言,该苯环与相邻的一个芳香环以共有该苯环中的1位和2位的碳原子的方式稠合的情况下,与相邻的另一个芳香环以共有以下碳原子的方式稠合:该苯环中的3位和4位的碳原子、4位和5位的碳原子、或者5位和6位的碳原子(优选为4位和5位的碳原子)。具有线性结构的芳香环部中除2个末端的芳香环以外的芳香环中,就为噻吩环的全部芳香环各自而言,该噻吩环与相邻的一个芳香环以共有该噻吩环中的2位和3位的碳原子的方式稠合的情况下,与相邻的另一个芳香环以共有以下碳原子的方式稠合:该噻吩环中的4位和5位的碳原子。本公开的稠环噻吩分子在1分子中具有1个或2个萘结构部。本公开的稠环噻吩分子在1分子中具有1个或2个萘结构部是指,本公开的稠环噻吩分子的芳香环部在其化学结构式中具有1个或2个的、2个苯环连续稠合的部分。萘结构部的数量的计算以不产生属于2个以上萘结构部的苯环的方式进行。即便假设稠环噻吩分子包含3个噻吩环和4个苯环,但在该稠环噻吩分子1个萘结构部都不具有的情况下,也得不到充分高的空穴迁移率。通过萘结构部中的分子堆积,可得到更高的空穴迁移率,因此在不具有萘结构部的分子中,得不到充分高的空穴迁移率。从更进一步高的空穴迁移率的观点出发,本公开的稠环噻吩分子优选在1分子中具有2个萘结构部。从更进一步高的空穴迁移率的观点出发,本公开的稠环噻吩分子的芳香环部中,优选2个末端的芳香环中的至少一个芳香环为噻吩环,更优选两个芳香环为噻吩环为佳。本公开的稠环噻吩分子的芳香环部可以具有对称性,或者也可以不具有,但从基于合成容易性的成本降低和更进一步高的空穴迁移率的观点出发,优选具有所谓的c2、c2v或c2h或者比它们更高阶的对称性。作为本公开的稠环噻吩分子的具体例,例如可举出下述通式(i)、(ii)、(iii)和(iv)所示的化合物。通式(i)的化合物为具有线性结构的芳香环部的稠环噻吩分子,具有c2v的对称性。通式(ii)的化合物为具有线性结构的芳香环部的稠环噻吩分子,不具有任何对称性。通式(iii)的化合物为具有线性结构的芳香环部的稠环噻吩分子,不具有任何对称性。通式(iv)的化合物为具有线性结构的芳香环部的稠环噻吩分子,不具有任何对称性。[化学式1]通式(i)中,ra1~ra12(即ra1、ra2、ra3、ra4、ra5、ra6、ra7、ra8、ra9、ra10、ra11和ra12)各自独立地为:氢原子,碳原子数1~20、优选1~10、更优选3~8的烷基,或者碳原子数6~18、优选6~12的芳基。从稠环噻吩分子对有机溶剂的溶解性、以及更进一步高的空穴迁移率的观点出发,优选ra1~ra12中至少1个基团(例如,ra3和ra10)为烷基或芳基(此时,其他基团为氢原子)。作为ra1~ra12中的烷基,例如可举出甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、己基、庚基、辛基、壬基、癸基等。作为ra1~ra12中的芳基,例如可举出苯基(ph)、萘基、4-联苯基、3-联苯基、2-联苯基等。通式(i)中,在优选的实施方式中,各基团如下所述。ra1、ra2、ra4~ra9、ra11和ra12各自独立地为氢原子或碳数1~10的烷基,更优选为氢原子。ra3和ra10各自独立地为氢原子、碳原子数1~10的烷基、或碳原子数6~18的芳基,更优选为氢原子、碳原子数3~8的烷基、或碳原子数6~12的芳基,进一步优选为氢原子。作为通式(i)所示的化合物的具体例,例如可举出以下的表所示的化合物。[表1a]通式(i)的化合物的具体例化合物ra1ra2ra3ra4ra5ra6ra7ra8ra9ra10ra11ra12i-1hhhhhhhhhhhhi-2hhc8h17hhhhhhc8h17hhi-3hhphhhhhhhphhhi-4hhc8h17hhhhhhphhhi-5hh4-联苯基hhhhhh4-联苯基hhi-6hh4-联苯基hhhhhhphhh[化学式2]通式(ii)中,rb1~rb12(即rb1、rb2、rb3、rb4、rb5、rb6、rb7、rb8、rb9、rb10、rb11和rb12)各自独立地为:氢原子,碳原子数1~20、优选1~10、更优选3~8的烷基,或者碳原子数6~18、优选6~12的芳基。从稠环噻吩分子对有机溶剂的溶解性、以及更进一步高的空穴迁移率的观点出发,优选rb1~rb12中至少1个基团(例如,rb3和rb9)为烷基或芳基(此时,其他基团为氢原子)。作为rb1~rb12中的烷基,可举出作为ra1~ra12的烷基而例示的同样的烷基。作为rb1~rb12中的芳基,可举出作为ra1~ra12的芳基而例示的同样的芳基。通式(ii)中,在优选的实施方式中,各基团如下所述。rb1、rb2、rb4~rb8和rb10~rb12各自独立地为氢原子或碳数1~10的烷基,更优选为氢原子。rb3和rb9各自独立地为氢原子、碳原子数1~10的烷基、或碳原子数6~18的芳基,更优选为氢原子、碳原子数3~8的烷基、或碳原子数6~12的芳基,进一步优选为氢原子。作为通式(ii)所示的化合物的具体例,例如可举出以下的表所示的化合物。[表1b]通式(ii)的化合物的具体例[化学式3]通式(iii)中,rc1~rc12(即rc1、rc2、rc3、rc4、rc5、rc6、rc7、rc8、rc9、rc10、rc11和rc12)各自独立地为:氢原子,碳原子数1~20、优选1~10、更优选3~8的烷基,或者碳原子数6~18、优选6~12的芳基。从稠环噻吩分子对有机溶剂的溶解性、以及更进一步高的空穴迁移率的观点出发,优选rc1~rc12中至少1个基团(例如,rc3和rc4)为烷基或芳基,更优选为烷基(此时,其他基团为氢原子)。作为rc1~rc12中的烷基,可举出作为ra1~ra12的烷基而例示的同样的烷基。作为rc1~rc12中的芳基,可举出作为ra1~ra12的芳基而例示的同样的芳基。通式(iii)中,在优选的实施方式中,各基团如下所述。rc1、rc2和rc5~rc12各自独立地为氢原子或碳数1~10的烷基,更优选为氢原子。rc3和rc4各自独立地为氢原子、碳原子数1~10的烷基、或碳原子数6~18的芳基,更优选为氢原子、碳原子数3~8的烷基、或碳原子数6~12的芳基,最优选为氢原子。作为通式(iii)所示的化合物的具体例,例如可举出以下的表所示的化合物。[表1c]通式(iii)的化合物的具体例化合物rc1rc2rc3rc4rc5rc6rc7rc8rc9rc10rc11rc12iii-1hhhhhhhhhhhhiii-2hhc8h17c8h17hhhhhhhhiii-3hhphphhhhhhhhh[化学式4]通式(iv)中,rd1~rd12(即rd1、rd2、rd3、rd4、rd5、rd6、rd7、rd8、rd9、rd10、rd11和rd12)各自独立地为:氢原子,碳原子数1~20、优选1~10、更优选3~8的烷基,或者碳原子数6~18、优选6~12的芳基。从稠环噻吩分子对有机溶剂的溶解性、以及更进一步高的空穴迁移率的观点出发,优选rd1~rd12中至少1个基团(例如,rd4和rd10)为烷基或芳基,更优选为烷基(此时,其他基团为氢原子)。作为rd1~rd12中的烷基,可举出作为ra1~ra12的烷基而例示的同样的烷基。作为rd1~rd12中的芳基,可举出作为ra1~ra12的芳基而例示的同样的芳基。通式(iv)中,在优选的实施方式中,各基团如下所述。rd1~rd3和rd5~rd9以及rd11~rd12各自独立地为氢原子或碳数1~10的烷基,更优选为氢原子。rd4和rd10各自独立地为氢原子、碳原子数1~10的烷基、或碳原子数6~18的芳基,更优选为氢原子、碳原子数3~8的烷基、或碳原子数6~12的芳基,最优选为氢原子。作为通式(iv)所示的化合物的具体例,例如可举出以下的表所示的化合物。[表1d]通式(iv)的化合物的具体例化合物rd1rd2rd3rd4rd5rd6rd7rd8rd9rd10rd11rd12iv-1hhhhhhhhhhhhiv-2hhhc8h17hhhhhc8h17hhiv-3hhhphhhhhhphhh[稠环噻吩分子的制造]稠环噻吩分子可以通过公知的方法制造。例如,使用构成作为目标的稠环噻吩分子具有的芳香环部的一部分的原料(例如,萘),反复进行所需位置的氢原子的卤化反应(例如,碘化反应)和sonogashira偶联反应。所需位置是指为了得到作为目标的稠环噻吩分子而应该形成稠合噻吩环或稠合苯环的位置。由此,可以在所需位置处形成稠合噻吩环和稠合苯环,其结果是可以制造作为目标的稠环噻吩分子。所需位置的氢原子经卤化的中间体无法单独得到,而以混合物的形式得到的情况下,通过柱色谱等公知的分离法进行分离或提纯即可。用于形成稠合噻吩环的sonogashira偶联反应中,在溶剂中、催化剂存在下使用三甲基甲硅烷基乙炔导入三甲基甲硅烷基乙炔基后,在所需位置处导入甲硫基,进行回流。由此,三甲基甲硅烷基乙炔基与甲硫基反应,形成稠合噻吩环。甲硫基向所需位置的导入可以通过卤化反应(例如,溴化反应)和与二甲基二硫醚的反应以及其后的基于柱色谱等公知方法的分离和提纯来实现。用于形成稠合苯环的sonogashira偶联反应中,在溶剂中、催化剂存在下使用三甲基甲硅烷基乙炔,在1分子中导入2个三甲基甲硅烷基乙炔基。其后,使这2个三甲基甲硅烷基乙炔基反应(闭环反应),由此形成稠合苯环。基于2个三甲基甲硅烷基乙炔基的闭环反应例如可以通过在氢氧化钠、硼氢化钠和一水合肼的水溶液中添加碲的粉末、包含导入了2个三甲基甲硅烷基乙炔基的中间体的经脱气的溶液和甲基三正辛基氯化铵,在40~50℃下放置数小时,从而实现。[稠环噻吩分子的鉴定]本公开的稠环噻吩分子可以通过元素分析、质量分析法和13c-nmr(碳13核磁共振)进行鉴定。即,通过元素分析来获知构成稠环噻吩分子1分子的原子数,并通过质量分析来测定稠环噻吩分子的分子量,由此可以确定稠环噻吩分子的分子式。接下来,解析通过13c-nmr得到的各峰的化学位移量,由此可以鉴定稠环噻吩分子的结构式和取代基及其取代位置。[稠环噻吩分子的用途]本公开的稠环噻吩分子显示出更充分优异的空穴迁移率,因此作为分子系有机半导体材料或碳系空穴传输材料、特别是p型半导体材料是有用的。因此,本公开的稠环噻吩分子通过用于电子器件(电子元件)例如晶体管,可以使电子器件的频率特性提高。将使用了本公开的稠环噻吩分子的晶体管的基本结构的一例示于图1。图1中,晶体管基本结构体10包含:栅电极1;在上述栅电极1上形成的栅极绝缘膜2;在上述栅极绝缘膜2上隔离地形成的源电极3和漏电极4;以及与上述栅极绝缘膜2的露出区域、上述源电极3和上述漏电极4接触地形成的半导体膜5。构成栅电极1的材料只要是在电子器件的领域中作为电极材料而使用的材料就没有特别限定,例如可举出硅、金、铜、镍、铝等。构成栅极绝缘膜2的材料只要是具有电绝缘性的材料就没有特别限定。作为构成栅极绝缘膜2的材料的具体例,例如可举出硅氧化物(sio2等)、硅氮化物(si3n4等)、钽氧化物(ta2o5等)、铝氧化物(al2o3等)、钛氧化物(tio2等)、钇氧化物(y2o3等)、镧氧化物(la2o3等)等金属氧化物、氮化物,以及环氧树脂、聚酰亚胺(pi)树脂、聚苯醚(ppe)树脂、聚苯醚树脂(ppo)、聚乙烯基吡咯烷酮(pvp)树脂等高分子材料等。构成源电极3和漏电极4的材料可以是作为构成栅电极1而例示的材料。半导体膜5为包含本公开的稠环噻吩分子的p型半导体膜。半导体膜5只要包含本公开的稠环噻吩分子即可,也可以包含其他材料。例如,半导体膜5可以仅由本公开的稠环噻吩分子构成,或者也可以除本公开的稠环噻吩分子以外,还包含富勒烯、苝二酰亚胺、聚噻吩、其他稠环噻吩。半导体膜5中的本公开的稠环噻吩分子的含量例如为0.1质量%以上,优选为1质量%以上,从空穴迁移率的进一步提高的观点出发,优选为10质量%以上,更优选为50质量%以上,最优选为100质量%。就半导体膜5而言,除使用本公开的稠环噻吩分子作为半导体材料以外,可以通过与真空蒸镀法或涂覆法等公知的方法同样的方法形成。该情况下,通过仅使用稠环噻吩分子作为真空蒸镀法中的蒸镀材料,从而可以形成稠环噻吩分子的含量为100质量%的半导体膜。将使用了本公开的稠环噻吩分子的晶体管的基本结构的另一例示于图2。图2中,晶体管基本结构体11包含:绝缘性的基底基板12;在上述绝缘性的基底基板12上隔离地形成的源电极13和漏电极14;与上述绝缘性的基底基板12的露出区域、上述源电极13和上述漏电极14接触地形成的半导体膜15;在上述半导体膜15上形成的栅极绝缘膜16;以及在上述栅极绝缘膜16上从上表面观察时成为上述源电极13和上述漏电极14之间的位置处形成的栅电极17。构成绝缘性的基底基板12的材料只要是具有电绝缘性的材料就没有特别限定。作为构成基底基板12的材料的具体例,例如可举出在硅晶圆上形成的、硅氧化物(sio2等)、硅氮化物(si3n4等)、钽氧化物(ta2o5等)、铝氧化物(al2o3等)、钛氧化物(tio2等)、钇氧化物(y2o3等)、镧氧化物(la2o3等)等金属氧化物或金属氮化物,以及环氧树脂、聚酰亚胺(pi)树脂、聚苯醚(ppe)树脂、聚苯醚树脂(ppo)、聚乙烯基吡咯烷酮(pvp)树脂等高分子材料等。构成源电极13和漏电极14的材料只要是在电子器件的领域中作为电极材料而使用的材料就没有特别限定,例如可举出硅、金、铜、镍、铝等。半导体膜15为包含本公开的稠环噻吩分子的p型半导体膜。半导体膜15只要包含本公开的稠环噻吩分子即可,也可以包含其他材料。例如,半导体膜15可以仅由本公开的稠环噻吩分子构成,或者也可以除本公开的稠环噻吩分子以外,还包含富勒烯、苝二酰亚胺、聚噻吩、其他稠环噻吩。半导体膜15中的本公开的稠环噻吩分子的含量例如为0.1质量%以上,优选为1质量%以上,从空穴迁移率的进一步提高的观点出发,优选为10质量%以上,更优选为50质量%以上,最优选为100质量%。构成栅极绝缘膜16的材料只要是具有电绝缘性的材料就没有特别限定。作为构成栅极绝缘膜16的材料的具体例,例如可举出硅氧化物(sio2等)、硅氮化物(si3n4等)、钽氧化物(ta2o5等)、铝氧化物(al2o3等)、钛氧化物(tio2等)、钇氧化物(y2o3等)、镧氧化物(la2o3等)等金属氧化物或金属氮化物,以及环氧树脂、聚酰亚胺(pi)树脂、聚苯醚(ppe)树脂、聚苯醚树脂(ppo)、聚乙烯基吡咯烷酮(pvp)树脂等高分子材料等。构成栅电极17的材料可以是作为构成源电极13和漏电极14而例示的材料。实施例<实验例i>发明人实施了稠环噻吩分子的空穴迁移率的基于分子动力学和分子轨道计算的预测。就迁移率的计算方法而言,应用大卫·埃文斯等,有机电子第29卷(2016年)第50~56页(davidr.evansetal.,“estimationofchargecarriermobilityinamorphousorganicmaterialsusingpercolationcorrectedrandom-walkmethod”,organicelectronicsvol.29(2016)pages50-56)记载的方法。即,已知迁移率的计算中所需要的电荷跳跃率(κ)通过下式给出。[数学式1]其中,δg为电荷迁移的自由能变化、λ为marcus重定向能,hab为分子间的电子耦合,kb为玻尔兹曼常数,t为温度,[数学式2]为普朗克常数。将δg设为零。κ的计算中,将成为对象的分子随机配置64分子,通过室温下的数10ns左右的分子动力学计算,从而计算其平衡状态。从其中得到的结果中,任意取出50对分子对,对于取出的全部对,通过密度泛函法求出κ。上述的分子动力学计算使用作为分子动力学计算的软件包的schradinger公司的商品名“desmond”(鲍尔斯等,2006年acm/ieee超级计算会议会报,佛罗里达州坦帕市,文献编号84(k.j.bowersetal.,proc.2006acm/ieeeconferenceonsupercomputingacm,tampa,florida,2006no.84))。此外,λ和hab的计算使用作为密度泛函法的计算软件的schradinger公司的商品名“jaguar”(博切巴罗夫等,量子化学国际期刊,第113卷,2013年,第2110-2142页(a.d.bochevarovetal.,intl.j.quantumchem.vol.113(2013)p.2110-2142))。像这样,对各分子对进行基于密度泛函法的计算,得到50个κ的值,在由其计算迁移率时,应用考虑了埃文斯等的上述文献(有机电子第29卷(2016年)第50~56页)中记载的渗流的方法。即,迁移率μh,p(p)由下式导出。其中,e为元电荷的电荷量。[数学式3]另外,dp通过[数学式4](对于所有i,dh,i≥dth)给出,其中,pi为[数学式5]另外,dh,i为[数学式6]需要说明的是,i表示各分子对的编号。ri为第i个分子对的分子间的距离。此外,dth为满足下式的量,[数学式7]dpθ(p)≤dth(a)且θ(p)通过下式给出。[数学式8]dth由式(a)与式(b)自恰地确定。另外,pc为0.3116,v为2。通过该方法,计算作为稠环噻吩分子的化合物(i-1)、(ii-1)、(iii-1)和(iv-1)的空穴迁移率(cm2/vs)。将计算值示于以下。需要说明的是,计算值为将btbt(化合物(x-1))的空穴迁移率的计算值设为1时的相对值。[表2a]实施例通过与上述同样的方法,计算以下的化合物(x-1)~(x-7)的空穴迁移率(cm2/vs)。将计算值示于以下。需要说明的是,这些计算值也是将btbt的空穴迁移率的计算值设为1时的相对值。化合物(x-1)对应于btbt。[化学式5][表2b]比较例如表2a和表2b所示,可知本公开的稠环噻吩分子显示出更充分高的空穴迁移率。本实验例i中计算的空穴迁移率的相对值与实际测量的空穴迁移率非常接近。<实验例ii>(化合物(i-1)的制造)通过将市售的萘与碘和硝酸进行加热还原,从而合成碘化萘的混合物。将该混合物通过柱色谱(己烷/二氯甲烷=1/3)进行分离提纯,由此合成以下的2,7-二碘萘。[化学式6]使该化合物在二乙胺和四氢呋喃的混合溶剂中与三甲基甲硅烷基乙炔(购自东京化成株式会社)、双(三苯基膦)二氯化钯(ii)(购自东京化成株式会社)和碘化铜(购自sigma-aldrichcompanylimitedliabilitycompany(sigma-aldrichco.,llc.))反应。由此,基于sonogashira偶联反应合成以下的化合物。[化学式7]对于上述化合物,实施利用溴气的处理。进而,在处理后的混合物的二甲基甲酰胺(dmf)溶液中在-78℃下加入叔丁基锂的戊烷溶液(sigma-aldrichcompanylimitedliabilitycompany),将该混合液缓慢恢复到室温。其后,加入二甲基二硫醚(东京化成株式会社),将得到的混合物通过柱色谱(己烷/二氯甲烷=1/3)进行分离提纯,由此得到以下的化合物。[化学式8]将上述化合物的二氯甲烷溶液进行回流,进而在其中添加碘的粉末,接下来,在-10℃的环境下在上述二氯甲烷溶液中添加氯化碘的二氯甲烷溶液,在室温下放置半天左右,由此得到以下的化合物。[化学式9]进而,通过对上述的二氯甲烷溶液照射紫外线(365nm),从而促进脱碘反应,得到以下的化合物。[化学式10]使该化合物在二乙胺和四氢呋喃的混合溶剂中与三甲基甲硅烷基乙炔(购自东京化成株式会社)、双(三苯基膦)二氯化钯(ii)(购自东京化成株式会社)和碘化铜(购自sigma-aldrichcompanylimitedliabilitycompany)反应,由此基于sonogashira偶联反应得到以下的反应产物。[化学式11]接下来,在氢氧化钠(购自东京化成株式会社)、硼氢化钠(购自东京化成株式会社)和一水合肼(购自sigma-aldrichcompanylimitedliabilitycompany)的水溶液中,添加碲的粉末(购自株式会社高纯度化学研究所),接下来,在脱气处理后,添加ariquat336(购自sigma-aldrichcompanylimitedliabilitycompany),在45℃下放置数小时,将生成沉淀物提纯,得到以下的化合物。[化学式12]进而,将该化合物与碘和硝酸进行加热还原,将由此生成的物质通过柱色谱(己烷-二氯甲烷=1∶3)进行分离提纯,由此得到以下记载的化合物。[化学式13]使该化合物在二乙胺和四氢呋喃的混合溶剂中与三甲基甲硅烷基乙炔(购自东京化成株式会社)、双(三苯基膦)二氯化钯(ii)(购自东京化成株式会社)和碘化铜(购自sigma-aldrichcompanylimitedliabilitycompany)反应,由此基于sonogashira偶联反应得到以下的反应产物。[化学式14]接下来,在氢氧化钠(购自东京化成株式会社)、硼氢化钠(购自东京化成株式会社)和一水合肼(购自sigma-aldrichcompanylimitedliabilitycompany)的水溶液中,添加碲的粉末(购自株式会社高纯度化学研究所),接下来,在脱气处理后,添加ariquat336(购自sigma-aldrichcompanylimitedliabilitycompany),在45℃下放置数小时,将生成沉淀物提纯,得到以下的化合物。[化学式15]对于该化合物,通过与碘和硝酸进行加热还原,得到该化合物的碘化物的混合物,将其通过柱色谱(己烷/二氯甲烷=1/3)进行分离提纯,由此得到以下的化合物。[化学式16]使该化合物在二乙胺和四氢呋喃的混合溶剂中与三甲基甲硅烷基乙炔(购自东京化成株式会社)、双(三苯基膦)二氯化钯(ii)(购自东京化成株式会社)和碘化铜(购自sigma-aldrichcompanylimitedliabilitycompany)反应,由此基于sonogashira偶联反应得到反应产物。对该反应产物实施利用溴气的处理,进而将生成的化合物通过柱色谱(己烷/二氯甲烷=1/3)进行分离提纯,由此得到以下记载的化合物。[化学式17]在上述化合物的dmf溶液中在-78℃下加入叔丁基锂的戊烷溶液(sigma-aldrichcompanylimitedliabilitycompany),将该溶液缓慢恢复到室温。其后,加入二甲基二硫醚(东京化成株式会社),得到反应产物。将该反应产物的二氯甲烷溶液进行回流,进而在其中添加碘的粉末,进而在-10℃的环境下添加氯化碘的二氯甲烷溶液,在室温下放置半天左右,由此得到以下的化合物。[化学式18]最后,通过对上述的二氯甲烷溶液照射紫外线(365nm),从而促进脱碘反应,得到以下的化合物(i-1)。[化学式19]化合物(i-1)的生成通过以下的分析得到确认:·碳/氢/硫分析c∶s∶h=8∶1∶4·质量分析:396.55(实施例1和比较例1)使用化合物(i-1)或化合物(x-1),制造图2中所示的晶体管基本结构体11。具体而言,通过利用氧化扩散炉的热氧化法,对硅晶圆形成膜厚350nm的氧化膜。在其上用剥离法形成5μm间隔的金电极(厚度100nm)。进而,在其上,将要测量迁移率的有机分子(实施例1:化合物(i-1),比较例1:化合物(x-1)的btbt(市售品))以成为厚度200nm的方式用真空蒸镀法制膜。接下来,作为绝缘层,将氮化硅以成为100nm的厚度的方式制膜。其后,在氮化硅膜的上部,以从上表面观察时配置在上述5μm间隔的金电极之间的内侧的方式,用剥离法形成第3个电极。实施例1中有机分子膜中的化合物(i-1)的含量相对于膜总量为100质量%。比较例1中有机分子膜中的化合物(x-1)的含量相对于膜总量为100质量%。使用像这样进行而制作的晶体管结构,进行迁移率的测量。已知迁移率通过下式给出。[数学式9]其中,这里,id为漏极电流,μ为迁移率,w为沟道宽度,l为沟道长度,ci为栅极绝缘膜每单位面积的电容,vg为栅极电压,vth为阈值电压。可知通过测量漏极电流的栅极电压依赖性,可以利用上式求出迁移率。通过上述的方法测量的稠环噻吩分子化合物(i-1)的膜(实施例1)的空穴迁移率为20cm2/vs。另一方面,化合物(x-1)的膜(比较例1)的空穴迁移率为11cm2/vs。如上所述,可知本公开的稠环噻吩分子根据实测也显示出比以往的稠环噻吩分子更充分高的空穴迁移率。可知实验例i中计算的空穴迁移率的相对值与本实验例ii中实际测量的实施例1和比较例1的空穴迁移率非常接近。产业上的可利用性本公开的稠环噻吩分子显示出更充分优异的空穴迁移率,因此作为分子系有机半导体材料或碳系空穴传输材料、特别是p型半导体材料是有用的。因此,本公开的稠环噻吩分子在电子器件或电子元件例如晶体管中是有用的。本公开的稠环噻吩分子可以使电子器件的频率特性提高。附图标记说明1、17:栅电极;2:栅极绝缘膜;3、13:源电极;4、14:漏电极;5、15:半导体膜;12:基底基板;16:栅极绝缘膜。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1