活性增加的单卤素或甲基取代的5-HT2B拮抗剂的制作方法
本文公开了单卤素或甲基取代的5-ht2b拮抗剂化合物,已经发现所述化合物由于卤素或甲基的取代而与5-ht2b受体的结合活性增加,和使用所述化合物治疗或预防由5-ht2b介导的障碍的方法。
背景技术:
包括阿米替林、赛庚啶、多塞平、去甲替林、苯噻啶等的三环类抗抑郁剂(tca)是一类通常用于缓解抑郁症的药物。它们通常是高度混杂的配体,对各种g蛋白偶联受体(gpcr)具有纳摩尔亲和力。
报道了一些tca(例如多塞平和去甲替林)对5-ht2b受体具有拮抗剂活性。5-ht2b是由5-ht2a、5-ht2b和5-ht2c组成的5-ht2家族中的三种亚型之一。已经发现5-ht2b受体在许多医学障碍中起作用,这表明5-ht2b受体拮抗剂很可能对患有这些障碍的患者具有有益的作用。通常,可能已经发现5-ht2b受体拮抗剂可用于预防或治疗多种障碍,包括但不限于心血管障碍、慢性下背痛、便秘、腹泻、纤维肌痛、纤维化、功能性胃肠障碍、胃肠(gi)道障碍、胃食管反流疾病(gerd)、肝细胞癌、炎性疼痛、肠易激综合征(ibs)、偏头痛、伤害性疼痛、肺动脉高压(pah)、小肠神经内分泌肿瘤、或内脏疼痛等。报道了5-ht2b受体调节平滑肌的收缩以介导gi运动,并且其抑制作用显示出对排便异常产生益处。
在2010年,在clinicaltrials.gov网站(https://clinicaltrials.gov/ct2/show/record/nct01268709)中报道了上述tca(即多塞平和去甲替林)对ibs的作用。然而,在此方面没有报告或更新结果。
本发明的诸位发明人发现,用单卤素或低级烷基(即c1-6烷基,尤其是甲基)对现有的5-ht2b拮抗剂(包括那些tca(作为抗抑郁剂))的进一步修饰出人意料地增加了与5-ht2b受体的结合活性,这表明更有效的5-ht2b拮抗剂。
技术实现要素:
在第一方面,本文公开了一种用于预防或治疗受试者的5-ht2b介导的障碍的方法,所述方法包括向有需要的受试者施用治疗有效量的选自:
在一个实施方案中,所述5-ht2b介导的障碍选自心血管障碍、慢性下背痛、便秘、腹泻、纤维肌痛、纤维化、功能性胃肠障碍、胃肠(gi)道障碍、胃食管反流疾病(gerd)、肝细胞癌、炎性疼痛、肠易激综合征(ibs)、偏头痛、伤害性疼痛、肺动脉高压(pah)、小肠神经内分泌肿瘤、或内脏疼痛。在优选的实施方案中,所述5-ht2b介导的障碍是肠易激综合征。在更优选的实施方案中,所述5-ht2b介导的障碍是腹泻主导型肠易激综合征。
在一些实施方案中,上式中的x是cl、br或甲基。
在一些实施方案中,式(i)的化合物呈构型e。
在一些实施方案中,式(ii)的化合物呈构型e。
在一些实施方案中,式(iii)的化合物呈构型e。
在一些实施方案中,式(iv)的化合物呈构型z。
在一些实施方案中,所述化合物是:
在第二方面,本文公开了一种选自
在一个实施方案中,所述化合物不是以下中的任一种:
在一些实施方案中,上式中的x是cl、br或甲基。
在一些实施方案中,式(i)的化合物呈构型e。
在一些实施方案中,式(ii)的化合物呈构型e。
在一些实施方案中,式(iii)的化合物呈构型e。
在一些实施方案中,式(iv)的化合物呈构型z。
在一些实施方案中,所述化合物是:
本发明公开了一种用于治疗或预防如上所述的5-ht2b介导的障碍的药物组合物,所述组合物包含选自式(i)、(ii)、(iii)、(iv)、(v)或(vi)的化合物、或其药学上可接受的盐、或其异构体以及药学上可接受的载体。在一个实施方案中,所述化合物不是以下中的任一种:
与未经取代的tca(即去甲替林、阿米替林、多塞平、赛庚啶和苯噻啶)相比,单卤素或甲基取代的tca展现出更有效的5-ht2b拮抗剂活性。更具体地,单氯、溴和甲基取代导致与5-ht2b受体的结合亲和力提高约10倍。
附图说明
参考以下附图描述了本实施方案的非限制性和非穷举的实施方案:
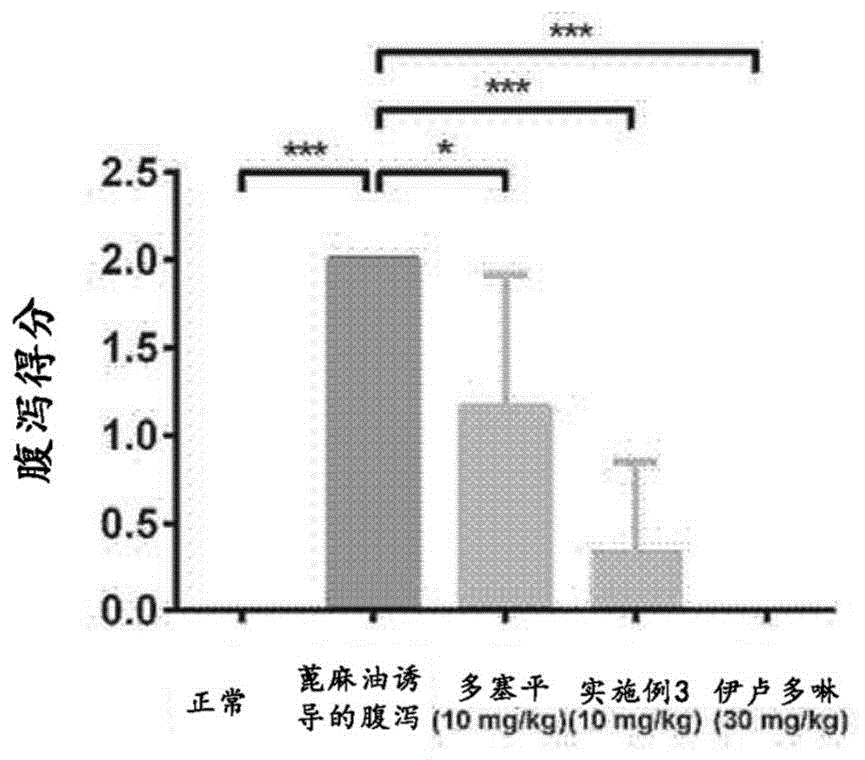
图1示出了在蓖麻油诱导的腹泻模型中多塞平、本文公开的化合物和伊卢多啉的腹泻得分。
图2示出了在蓖麻油诱导的腹泻模型中多塞平、本文公开的化合物和伊卢多啉的粪便重量。
图3示出了在蓖麻油诱导的腹泻中的体重减轻。
具体实施方式
以下术语在整个说明书中具有指示的含义:
如本文(包括所附权利要求书)所用,除非上下文另外清楚地指示,否则单数形式的词语如“一个/一种(a、an)”和“所述(the)”包括它们对应的复数指代物。
除非上下文另外清楚地指示,否则术语“或”用于意指术语“和/或”,并且可与术语“和/或”互换使用。
本文的术语“卤素”是指氟(f)、氯(cl)、溴(br)和碘(i)。
当本文公开的化合物含有烯属双键时,除非另有说明,否则此类双键意在包括e和z几何异构体两者。
“药学上可接受的盐”是指在合理的医学判断范围内适合于与人和低等动物的组织接触使用而没有过度毒性、刺激、过敏反应等并且与合理的利益/风险比相称的那些盐。药学上可接受的盐可以在本文公开的化合物的最终分离和纯化期间原位制备,或者通过使游离碱官能团与合适的有机酸反应或通过使酸性基团与合适的碱反应而单独制备。
当应用于动物、人、实验受试者、细胞、组织、器官或生物流体时,本文的术语“施用”(administration、administering)、“治疗”(treating和treatment)意指外源性药剂、治疗剂、诊断剂或组合物与所述动物、人、受试者、细胞、组织、器官或生物流体的接触。细胞的治疗涵盖试剂与所述细胞的接触,以及试剂与流体的接触,其中所述流体与所述细胞接触。术语“施用”和“治疗”还意指通过试剂、诊断剂、结合化合物或者通过另一种细胞对例如细胞的体外和离体治疗。本文的术语“受试者”包括任何生物体,优选动物,更优选哺乳动物(例如,大鼠、小鼠、狗、猫和兔)并且最优选人。
术语“有效量”或“治疗有效量”是指活性成分(诸如化合物)的如下量,当向受试者施用以治疗疾病或者疾病或障碍的至少一种临床症状时足以影响对所述疾病、障碍或症状的这种治疗。“治疗有效量”可以随化合物,疾病、障碍和/或疾病或障碍的症状,疾病、障碍和/或疾病或障碍的症状的严重程度,待治疗的受试者的年龄和/或待治疗的受试者的体重而变化。在任何给定的情况下,适当的量对于本领域技术人员来说可以是清楚的,或者可以通过常规实验来确定。在一些实施方案中,“治疗有效量”是本文公开的至少一种化合物和/或其至少一种立体异构体、和/或其至少一种其药学上可接受的盐对“治疗”(如上所定义)受试者的疾病或障碍有效的量。在组合疗法的情况下,“治疗有效量”是指用于有效治疗疾病、障碍或病症的组合对象的总量。
包含本文公开的化合物的药物组合物可以经由口服、吸入、直肠、肠胃外或局部施用而施用于有需要的受试者。对于口服施用,药物组合物可以是常规固体配制品诸如片剂、粉剂、颗粒剂、胶囊剂等,液体配制品诸如水或油悬浮液,或其他液体配制品诸如糖浆、溶液、悬浮液等;对于肠胃外施用,药物组合物可以是溶液、水溶液、油悬浮液浓缩物、冻干粉末等。优选地,药物组合物的配制品选自片剂、包衣片剂、胶囊剂、栓剂、鼻喷雾剂或注射剂,更优选片剂或胶囊剂。药物组合物可以是具有准确剂量的单个单位施用物。此外,药物组合物还可以包含另外的活性成分。
本文公开的药物组合物的所有配制品都可以通过制药领域中的常规方法生产。例如,可以将活性成分与一种或多种赋形剂混合,然后从而制备所希望的配制品。“药学上可接受的赋形剂”是指适用于所希望的药物配制品的常规药物载体,例如:稀释剂、媒介物(诸如水、各种有机溶剂等)、填充剂(诸如淀粉、蔗糖等)、粘合剂(诸如纤维素衍生物、藻酸盐、明胶和聚乙烯吡咯烷酮(pvp));润湿剂,诸如甘油;崩解剂,诸如琼脂、碳酸钙和碳酸氢钠;吸收促进剂,诸如季铵化合物;表面活性剂诸如十六醇;吸收载体,诸如高岭土和皂土;润滑剂,诸如滑石、硬脂酸钙、硬脂酸镁、聚乙二醇等。此外,所述药物组合物还包含其他药学上可接受的赋形剂,诸如分散剂、稳定剂、增稠剂、络合剂、缓冲剂、渗透促进剂、聚合物、芳香剂、甜味剂和染料。
除非在本文件的其他地方明确定义,否则本文使用的所有其他技术和科学术语具有本发明所属领域的普通技术人员通常理解的含义。
通用合成
本文公开的化合物(包括其盐)可以使用已知的有机合成技术来制备,并且可以根据多种可能的合成途径中的任何一种来合成。
用于制备本文公开的化合物的反应可以在可由有机合成领域的技术人员容易选择的合适的溶剂中进行。合适的溶剂可以是在进行反应的温度(例如,可以在从溶剂的沸点温度的范围的温度)下与起始材料、中间体或产物基本上不反应的。给定的反应可以在一种溶剂或多种溶剂的混合物中进行。
本领域技术人员可以容易地确定适当的保护基团的选择。
可以根据本领域已知的任何合适的方法(诸如nmr、uv、hplc、lc-ms和tlc)监测反应。化合物可以通过多种方法(包括hplc和正相二氧化硅色谱法)纯化。
方案1:用于合成实施例1-3的化合物的通用程序。
首先将起始材料4-取代-2-甲基苯甲酸酯用卤化剂(例如n-溴琥珀酰亚胺(nbs))卤化。然后使卤化化合物与苯酚反应形成化合物3,可以将化合物3水解形成酸4。酸4可以环化为化合物5,然后将化合物5与胺缩合形成所希望的化合物。举例来说,试剂和条件可以如下:(a)nbs,aibn,ccl4,回流;(b)苯酚,k2co3,dmf,80℃;(c)10%naoh水溶液,etoh,回流;(d)草酰氯,催化剂dmf,dcm,室温,然后alcl3,0℃至室温;(e)3-氯-n,n-二甲基丙-1-胺,催化剂i2,mg,thf,回流然后浓hcl。
本文公开的化合物是参照方案中所述的通用程序制备的。
所有的溶剂、化学品和试剂均可商购并且无需纯化而使用。在oxford仪器(varian)上在300mhz下在25℃下在cdcl3、d6-dmso、cd3od、或d6-丙酮中获得1hnmr谱,其中用相对于作为内标的tms报告化学位移(δ,ppm)。用shimadzulc-ms-2020系统获得hplc-ms色谱图和质谱。使用的制备型hplc仪器包括gilsongx-281(gilson)和elitep230制备型梯度系统(elite)。使用tharprep-80和tharsfcx-5柱,用elitep230制备型梯度系统进行手性制备型hplc。使用的微波仪器是cemdiscoversp。所有的测试化合物的纯度>95%。
实施例1:3-(8-氟二苯并[b,e]噁庚英-11(6h)-亚基)-n,n-二甲基丙-1-胺。
向4-氟-2-甲基苯甲酸甲酯(500mg,3.0mmol)在ccl4中的溶液中添加nbs(635mg,3.6mmol)和自由基起始剂偶氮二异丁腈(aibn)(15mg,0.09mmol)。将混合物在回流下搅拌3小时。将上清液通过过滤分离并且用水洗涤。在减压下除去溶剂。将残余物通过柱色谱法纯化(硅胶,石油醚/乙酸乙酯=20:1)以给出2-(溴甲基)-4-氟苯甲酸甲酯(700mg,产率94%)。271hnmr(400mhz,氯仿-d):δ(ppm)8.02(dd,j=8.8,5.8hz,1h),7.19(dd,j=9.2,2.6hz,1h),7.05(ddd,j=8.7,7.7,2.7hz,1h),4.93(s,2h),3.93(s,3h)。
向苯酚(119mg,1.26mmol)在dmf中的溶液中添加k2co3,将混合物在室温下搅拌10min,然后将2-(溴甲基)-4-氟苯甲酸甲酯(260mg,1.0mmol)添加到以上混合物中并且在80℃下搅拌3小时。反应完成后,将混合物倒入水中并且用etoac萃取。将有机层浓缩并且通过柱色谱法纯化(硅胶,石油醚/乙酸乙酯=40:1)以给出4-氟-2-(苯氧基甲基)苯甲酸甲酯(160mg,产率61%)。1hnmr(400mhz,氯仿-d):δ(ppm)8.10(dd,j=8.6,5.8hz,1h),7.50(dd,j=10.1,2.5hz1h),7.26-7.31(m,2h),6.99-7.02(m,4h),5.50(s,2h),3.91(s,3h)。
向4-氟-2-(苯氧基甲基)苯甲酸甲酯(180mg)在etoh(3ml)中的溶液中添加10%naoh水溶液(m/m)(1ml),将混合物在100℃下加热1h。反应完成后,将混合物在真空中浓缩并且将残余物用乙酸乙酯萃取。将有机层浓缩,并且将残余物通过柱色谱法纯化为4-氟-2-(苯氧基甲基)苯甲酸(150mg,产率88%)。质谱(esi),m/z:针对c14h11fo3[m-h]-的计算值:245.07,实测值:245.48。1hnmr(400mhz,氯仿-d):δ(ppm)8.21(dd,j=8.7,5.8hz,1h),7.59(dd,j=10.2,2.6hz,1h),7.37-7.28(m,2h),7.09(td,j=8.6,2.7hz,1h),7.05-6.96(m,3h),5.54(t,j=0.8hz,2h)。
将一滴dmf添加到4-氟-2-(苯氧基甲基)苯甲酸(150mg,0.6mmol)在干dcm中的溶液中,然后将草酰氯(60μl,0.72mmol)添加到以上溶液中。将混合物在室温下搅拌30min,在0℃下将alcl3(200mg,1.5mmol)逐批添加到混合物中。允许将所得悬浮液温热至室温并且通过tlc监测。当反应完成时,将10%naoh水溶液添加到混合物中,将有机层浓缩,并且将残余物通过柱色谱法纯化以提供8-氟二苯并[b,e]噁庚英-11(6h)-酮(100mg,产率73%)。281hnmr(400mhz,氯仿-d):δ(ppm)8.26(dd,j=8.1,1.8hz,1h),7.97(dd,j=8.7,5.6hz,1h),7.54-7.46(m,1h),7.19-7.10(m,2h),7.07(ddd,j=8.6,2.1,0.8hz,2h),5.16(s,2h)。
将碘(5mg,催化剂)添加到镁粉末(290mg,12mmol)在干thf中的悬浮液中,将3-氯-n,n-二甲基丙-1-胺(1200mg,10mmol)溶解于10ml干thf中并且将2ml溶液添加到以上悬浮液中,将悬浮液加热直到看见气泡并且黄色消失,经30min逐滴添加剩余的3-氯-n,n-二甲基丙-1-胺溶液。将混合物加热至回流持续1h,将其不经进一步纯化用于后续反应。在ar下,将1ml以上格氏试剂溶液添加到8-氟二苯并[b,e]噁庚英-11(6h)-酮(50mg,0.24mmol)在干thf中的溶液中,将混合物在65℃下加热2h。将浓hcl缓慢添加到混合物中并且搅拌1h。将所得的混合物用氨水处理并且用乙醚萃取。将有机相用硫酸钠干燥并且将残余物通过柱色谱法纯化(硅胶,dcm:meoh:nh3水溶液=100:5:1)以给出3-(8-氟二苯并[b,e]噁庚英-11(6h)-亚基)-n,n-二甲基丙-1-胺(20mg,产率28%,e/z=5:1)。29ms:针对c19h20fno[m+h]+的计算值:298.2,实测值:298.0。1hnmr(400mhz,cdcl3):δ(ppm)7.26(dd,j=6.4,1.6hz,1h),7.19(dd,j=6.6,1.6hz,1h),7.17(dd,j=6.7,1.7hz,1h),7.15(dd,j=6.7,1.7hz,1h),7.10(td,j=6.8,5.8,1.5hz,1h),6.87(td,j=6.8,5.7,1.2hz,1h),6.75(dd,j=8.4,1.6hz,1h),6.04(t,j=5.8hz,1h),4.50-5.50(brs,2h),2.36(t,j=6.0hz,2h),2.31(t,j=6.2hz,2h),2.16(s,3h)。
实施例2:3-(8-氯二苯并[b,e]噁庚英-11(6h)-亚基)-n,n-二甲基丙-1-胺。
用不同的起始材料,以与针对实施例1所述的相同的程序来制备实施例2的化合物。
2-(溴甲基)-4-氯苯甲酸乙酯(1.5g,产率55%)。1hnmr(400mhz,氯仿-d):δ(ppm)7.92(d,j=8.4hz,1h),7.46(d,j=2.1hz,1h),7.34(dd,j=8.4,2.2hz,1h),4.90(s,2h),4.40(q,j=7.1hz,2h),1.42(t,j=7.1hz,3h)。
4-氯-2-(苯氧基甲基)苯甲酸乙酯(1.5g,产率92%)。1hnmr(400mhz,氯仿-d):δ(ppm)7.92(d,j=8.4hz,1h),7.46(d,j=2.1hz,1h),7.34(dd,j=8.4,2.2hz,1h),4.90(s,2h),4.40(q,j=7.1hz,2h),1.42(t,j=7.1hz,3h)。
4-氯-2-(苯氧基甲基)苯甲酸(1.15g,产率75%)。1hnmr(400mhz,氯仿-d):δ(ppm)8.12(d,j=8.4hz,1h),7.88(s,1h),7.40(dd,j=8.4,2.2hz,1h),7.33(dd,j=8.8,7.3hz,2h),7.05-6.97(m,3h),5.51(s,2h)。
8-氯二苯并[b,e]噁庚英-11(6h)-酮(900mg,80%)。1hnmr(400mhz,氯仿-d):δ(ppm)8.24(dd,j=8.1,1.8hz,1h),7.89(d,j=8.3hz,1h),7.50(ddd,j=8.4,7.1,1.8hz,1h),7.45(dd,j=8.3,2.1hz,1h),7.38(d,j=2.0hz,1h),7.15(t,j=7.8hz,1h),7.07(d,j=8.3hz,1h),5.16(s,2h)。
3-(8-氯二苯并[b,e]噁庚英-11(6h)-亚基)-n,n-二甲基丙-1-胺(30mg,25%,e:z=3:1)。ms:针对c19h20clno[m+h]+的计算值:314.1,实测值:313.9。hrms:针对c19h20clno[m+h]+的计算值:314.1312,实测值314.1317。1hnmr(400mhz,氯仿-d):δ(ppm)7.37(d,j=2.1hz,1h),7.31(dd,j=8.1,2.2hz,1h),7.27-7.21(m,2h),7.19-7.13(m,2h),7.13-7.08(m,1h),6.91-6.84(m,1h),6.76(dd,j=8.2,1.2hz,1h),6.05(t,j=7.3hz,1h),5.24-4.78(br,2h),2.38(t,j=6.6hz,2h),2.31(t,j=6.5hz,2h),2.17(s,6h)。
实施例3:(e)-3-(8-溴二苯并[b,e]噁庚英-11(6h)-亚基)-n,n-二甲基丙-1-胺。
用不同的起始材料,以与针对实施例1所述的相同的程序来制备实施例2的化合物。
4-溴-2-(溴甲基)苯甲酸甲酯(2.6g,产率97%)。1hnmr(400mhz,氯仿-d):δ(ppm)7.84(d,j=8.4hz,1h),7.63(d,j=2.0hz,1h),7.51(dd,j=8.4,2.0hz,1h),4.90(s,2h),3.94(s,3h)。
4-溴-2-(苯氧基甲基)苯甲酸甲酯(产率54%)。1hnmr(400mhz,氯仿-d):δ(ppm)7.99(dd,j=2.1,1.0hz,1h),7.90(d,j=8.3hz,1h),7.54-7.48(m,1h),7.35-7.28(m,2h),7.06-6.93(m,3h),5.47(d,j=0.8hz,2h),3.90(s,3h)。
4-溴-2-(苯氧基甲基)苯甲酸(产率84%)。1hnmr(400mhz,氯仿-d):δ(ppm)8.08-7.97(m,2h),7.57(dd,j=8.4,2.0hz,1h),7.33(dd,j=8.8,7.3hz,2h),7.07-6.95(m,3h),5.50(t,j=0.9hz,2h)。
8-溴二苯并[b,e]噁庚英-11(6h)-酮(产率85%)。1hnmr(400mhz,氯仿-d):δ(ppm)8.24(dd,j=8.1,1.8hz,1h),7.80(d,j=8.3hz,1h),7.62(dd,j=8.3,1.9hz,1h),7.56-7.53(m,1h),7.50(ddd,j=8.2,7.0,1.8hz,1h),7.14(ddd,j=8.2,7.0,1.2hz,1h),7.07(dd,j=8.3,1.1hz,1h),5.15(s,2h)。
3-(8-溴二苯并[b,e]噁庚英-11(6h)-亚基)-n,n-二甲基丙-1-胺(产率29%)。ms:针对c19h20brno[m+h]+的计算值:358.08,实测值:358.30。hrms:针对c19h20clno[m+h]+的计算值:358.0807,实测值358.0808。1hnmr(400mhz,cd3od):δ(ppm)7.60(d,j=2.1hz,1h),7.52(dd,j=8.1,2.1hz,1h),7.27(dd,j=7.8,1.7hz,1h),7.16(d,j=8.0hz,1h),7.10(ddd,j=8.2,7.2,1.7hz,1h),6.86(ddd,j=7.7,7.2,1.3hz,1h),6.71(dd,j=8.2,1.3hz,1h),6.03(t,j=7.4hz,1h),5.36(s,2h),2.48-2.39(m,2h),2.37-2.27(m,2h),2.16(s,6h).13cnmr(100mhz,cd3od):δ156.4,141.3,140.7,138.2,132.6,132.2,131.0,130.8,130.2,127.9,122.3,122.2,120.1,70.2,59.8,45.2,28.3。
方案2用于合成实施例4的化合物的程序
试剂和条件:(f)ch3i(3.5当量),[nicl2(dppp)](10mol%),zn(3.0当量),nai(1.5当量),thf(5ml)搅拌24h。(e)3-氯-n,n-二甲基丙-1-胺,催化剂i2,mg,thf,回流然后浓hcl。
实施例4:n,n-二甲基-3-(8-甲基二苯并[b,e]噁庚英-11(6h)-亚基)丙-1-胺
在填充氮气的手套盒中,向火焰干燥的25ml圆形烧瓶中添加锌粉末(3.0当量,98.1mg,1.5mmol)、nicl2(dppp)(0.1当量,29.1mg,0.05mmol)、nai(1.5当量,112.4mg,0.75mmol)。将密封的烧瓶从手套盒中取出。在火焰干燥的瓶中,将芳基卤7(0.5mmol)和碘甲烷(3.5当量,1.75mmol)溶解于thf(5ml)中。在氮气气氛下,将溶液经由塑料注射器添加到烧瓶中。将反应混合物在室温下搅拌24h。在减压下浓缩后,然后将粗残余物在硅胶上通过色谱法纯化以提供90mg产物8(产率:80%)。1hnmr(400mhz,氯仿-d)δ8.26(dd,j=8.1,1.8hz,1h),7.84(d,j=7.9hz,1h),7.47(ddd,j=8.2,7.0,1.8hz,1h),7.30-7.26(m,1h),7.18-7.15(m,1h),7.12(ddd,j=8.2,7.0,1.2hz,1h),7.05(dd,j=8.2,1.2hz,1h),5.16(s,2h),2.43(d,j=0.7hz,3h)。
n,n-二甲基-3-(8-甲基二苯并[b,e]噁庚英-11(6h)-亚基)丙-1-胺9(产率:30%,e/z=10:3)。ms:针对c20h23no[m+h]+的计算值:294.42,实测值:294.57。1hnmr(400mhz,氯仿-d)δ7.30-7.24(m,1h),7.18(s,1h),7.15-7.05(m,3h),6.86(td,j=7.5,1.3hz,1h),6.75(dd,j=8.2,1.2hz,1h),6.01(t,j=7.1hz,1h),5.02(s,2h),2.43-2.30(m,7h),2.18(s,6h)。
方案3用于合成实施例5-7的通用程序
试剂和条件:(g)naoac,240℃;(h)红磷,hi水溶液,回流;(i)h3po4,175℃;(j)nbs,ccl4,回流;(k)et3n;(l)烯丙基溴化镁,乙醚;(m)乙酰氯,ag2o;(n)甲基胺,phmgbr。
实施例5:3-(2-氯-5h-二苯并[a,d][7]轮烯-5-亚基)-n-甲基丙-1-胺
使用在240℃下的油浴将邻苯二甲酸酐(1.5g,10mmol)与2-(3-氯苯基)乙酸(1.7g,10mmol,1.0当量)和naoac(1.0g,12mmol,1.2当量)一起加热,搅拌3小时。反应完成后,将反应混合物倒入100ml水中,用etoac萃取,在减压下除去溶剂。将残余物通过柱色谱法纯化(硅胶,石油醚/乙酸乙酯=30:1)以给出3-(3-氯苯亚基)异苯并呋喃-1(3h)-酮(产率:64%)。ms:针对c15h9clo2[m+h]+的计算值257.04,实测值257.33。
1hnmr(400mhz,氯仿-d)δ7.91(dd,j=7.2,1.6hz,1h),7.86-7.80(m,2h),7.64-7.53(m,3h),7.45-7.38(m,1h),7.27(ddt,j=9.0,7.1,1.6hz,1h),6.96(s,1h)。
向在hi水溶液(5ml)中的3-(3-氯苯亚基)异苯并呋喃-1(3h)-酮(2.0g,3.9mmol)中添加5mlh3po4,然后在ar下回流1小时。反应完成后,将混合物倒入冰水中,用etoac萃取,在减压下除去溶剂。将残余物通过柱色谱法纯化(硅胶,石油醚/乙酸乙酯=1:1)以给出2-(3-氯苯乙基)苯甲酸(产率:77%)。ms:针对c15h13clo2[m-h]-的计算值259.05,实测值:259.11。1hnmr(400mhz,氯仿-d)δ7.91(dd,j=7.4,1.6hz,1h),7.44(td,j=7.5,1.6hz,1h),7.36(td,j=7.5,1.6hz,1h),7.29-7.17(m,5h),2.90-2.80(m,4h)。
将2-(3-氯苯乙基)苯甲酸(1.5g,5.8mmol)溶解于h3po4中,然后在175℃下加热30min。反应完成后,将混合物倒入冰水中,用etoac萃取,在减压下除去溶剂。将残余物通过柱色谱法纯化(硅胶,石油醚/乙酸乙酯=12:1)以给出2-氯-10,11-二氢-5h-二苯并[a,d][7]轮烯-5-酮(产率:58%)。1hnmr(400mhz,氯仿-d)δ7.73-7.68(m,1h),7.49-7.41(m,2h),7.27(m,4h),2.95(m,4h)。
添加在ccl4中的2-氯-10,11-二氢-5h-二苯并[a,d][7]轮烯-5-酮(1.2g,5mmol)、nbs(1270mg,7.2mmol)。将混合物在回流下搅拌3小时。将上清液通过过滤分离并且用水洗涤。在减压下除去溶剂。将残余物通过柱色谱法纯化(硅胶,石油醚/乙酸乙酯=20:1)以给出10-溴-2-氯-10,11-二氢-5h-二苯并[a,d][7]轮烯-5-酮(产率:98%)。1hnmr(400mhz,氯仿-d)δ8.40(d,1h),7.88(d,1h),7.48-7.52(m,4h),7.38(dd,1h),5.51(m,1h),3.21-3.45(m,2h)。
将10-溴-2-氯-10,11-二氢-5h-二苯并[a,d][7]轮烯-5-酮(1.0g,3.1mmol)溶解于et3n(2ml)中,在ar气氛下回流12小时。在减压下除去溶剂。将残余物通过柱色谱法纯化(硅胶,石油醚/乙酸乙酯=40:1)以给出2-氯-5h-二苯并[a,d][7]轮烯-5-酮(产率:79%)。ms:针对c15h9clo[m+h]+的计算值241.04,实测值:241.34。1hnmr(400mhz,氯仿-d)δ8.28(dd,j=7.5,1.5hz,1h),7.72-7.60(m,3h),7.50-7.42(m,3h),6,54-6.39(m,2h)。
在ar气氛下向在干thf中的2-氯-5h-二苯并[a,d][7]轮烯-5-酮(800mg,3.3mmol)中添加烯丙基溴化镁格氏试剂,在60℃下加热3小时。反应完成后,将混合物倒入100ml1nhcl水溶液中,用etoac萃取,在减压下除去溶剂以给出粗5-烯丙基-2-氯-5h-二苯并[a,d][7]轮烯-5-醇,然后将在thf中的粗产物用乙酰氯(1ml)和ag2o(50mg)处理,在50℃下加热3小时。反应完成后,将上清液通过过滤分离并且用水洗涤,然后用etoac萃取,在减压下除去溶剂。将残余物通过柱色谱法纯化(硅胶,石油醚/乙酸乙酯=1:1)以给出5-亚烯丙基-2-氯-5h-二苯并[a,d][7]轮烯(产率:56%)。1hnmr(500mhz,氯仿-d)δ7.64-7.56(m,2h),7.50-7.43(m,2h),7.35-7.26(m,5h),7.00(td,j=13.4,8.4hz,1h),6.70(d,j=8.4hz,1h),5.29(d,j=13.4hz,2h)。
将5-亚烯丙基-2-氯-5h-二苯并[a,d][7]轮烯(520mg,2.0mmol)溶解于干thf中,在氮气气氛下将在thf(10ml)中的1mol/lphmgbr经由塑料注射器添加到混合物中,然后添加在etoh中的甲基胺,回流1h。将混合物倒入冰水中,用etoac萃取,在减压下除去溶剂。将残余物通过柱色谱法纯化(硅胶,石油醚/乙酸乙酯=1:1)以给出3-(2-氯-5h-二苯并[a,d][7]轮烯-5-亚基)-n-甲基丙-1-胺(产率:56%,z/e=3:1)。ms:针对c19h18cln[m+h]+的计算值296.12,实测值296.34。1hnmr(500mhz,氯仿-d)δ7.60-7.52(m,2h),7.50-7.42(m,2h),7.32(d,j=20.7hz,3h),7.30-7.24(m,2h),6.21(t,j=6.2hz,1h),2.92(tq,j=4.9,2.6hz,1h),2.79(dt,j=7.5,6.6hz,2h),2.67-2.59(m,2h),2.39(d,j=2.6hz,3h)。
实施例6:3-(2-溴-5h-二苯并[a,d][7]轮烯-5-亚基)-n-甲基丙-1-胺
3-(3-溴苯亚基)异苯并呋喃-1(3h)-酮(产率:56%)。ms:针对c15h9bro2[m+h]+的计算值:300.98,实测值300.67。1hnmr(400mhz,氯仿-d)δ7.83(dd,j=7.0,1.3hz,1h),7.84-7.80(m,2h),7.61-7.50(m,3h),7.45-7.38(m,1h),7.32(ddt,j=9.0,7.1,1.6hz,1h),6.89(s,1h)。
2-(3-溴苯乙基)苯甲酸(产率:67%)。1hnmr(400mhz,氯仿-d)δ7.91(dd,j=7.4,1.6hz,1h),7.54(td,j=7.5,1.6hz,1h),7.33(td,j=7.5,1.6hz,1h),7.39-7.27(m,5h),2.91-2.70(m,4h)。
2-溴-10,11-二氢-5h-二苯并[a,d][7]轮烯-5-酮(产率:89%)。1hnmr(400mhz,氯仿-d)δ7.75-7.65(m,1h),7.59-7.40(m,2h),7.29(m,4h),2.45-2.35(m,4h)。
2,10-二溴-10,11-二氢-5h-二苯并[a,d][7]轮烯-5-酮(产率:89%)。1hnmr(400mhz,氯仿-d)δ8.50(d,1h),7.98(d,1h),7.58-7.42(m,4h),7.51(dd,1h),5.54(m,1h),3.40-3.20(m,2h)。
2-溴-5h-二苯并[a,d][7]轮烯-5-酮(产率:51%)。1hnmr(400mhz,氯仿-d)δ8.18(dd,j=7.4,1.4hz,1h),7.78-7.61(m,3h),7.50-7.40(m,3h),6,54-6.39(m,2h)。
5-亚烯丙基-2-溴-5h-二苯并[a,d][7]轮烯(两步产率:62%)。1hnmr(500mhz,氯仿-d)δ7.66-7.58(m,2h),7.48-7.40(m,2h),7.38-7.29(m,5h),7.10(td,j=13.4,8.4hz,1h),6.80(d,j=8.4hz,1h),5.34(d,j=13.4hz,2h)。
3-(2-溴-5h-二苯并[a,d][7]轮烯-5-亚基)-n-甲基丙-1-胺(产率:73%,z/e=4:1)。ms:针对c19h18brn[m+h]+的计算值340.07,实测值:340.22。1hnmr(500mhz,氯仿-d)δ7.58-7.52(m,2h),7.49-7.41(m,2h),7.31(d,j=20.7hz,3h),7.30-7.23(m,2h),6.20(t,j=6.2hz,1h),2.90(tq,j=4.9,2.6hz,1h),2.80(dt,j=7.5,6.6hz,2h),2.63-2.59(m,2h),2.38(d,j=2.6hz,3h)。
实施例6的可替代合成
将pph3(14.3g,54.5mmol)、1,3-二溴丙烷(10.0g,49.5mmol)在甲苯(70.0ml)中的混合物脱气并且用n2吹扫3次,并且然后在n2气氛下将混合物在110℃下搅拌16小时。tlc(石油醚:乙酸乙酯=0:1)显示起始材料被完全消耗并且形成新的点(rf=0.01)。将溶液过滤并且然后将滤饼在减压下浓缩以给出呈白色固体的(3-溴丙基)三苯基鏻(20.0g,43.0mmol,86.8%产率,hbr)。1hnmr(400mhz,dmso)δ7.93-7.98(m,15h),3.76-3.65(m,4h),2.15-2.02(m,2h)。
(3-溴丙基)三苯基鏻(5.00g,10.8mmol,hbr)的混合物,然后向混合物中添加menh2(33.4g,355mmol),脱气并且用n2吹扫3次,并且然后在n2气氛下将混合物在100℃下搅拌1.5小时。lcms(产物:rt=0.742min)显示检测到所希望的化合物ms。将溶液在减压下浓缩以给出残余物,并且然后将混合物溶解于meoh20.0ml中,并且然后向其中添加100mlmtbe,并且然后将其过滤,然后将滤饼在减压下浓缩以给出呈白色固体的(3-(甲基氨基)丙基)三苯基鏻(5.00g,2hbr,粗品)。1hnmr(400mhz,dmso)δ8.50(s,1h),7.94-7.79(m,15h),3.78-3.70(m,2h),3.09-3.05(m,2h),2.54(s,3h),1.93-1.86(m,2h)。
2-(溴甲基)苯甲酸甲酯(21.0g,91.7mmol)在mecn(140ml)中的混合物,然后向其中添加pph3(21.6g,82.5mmol),脱气并且用n2吹扫3次,并且然后在n2气氛下将混合物在100℃下搅拌1小时。tlc(石油醚:乙酸乙酯=5:1)显示形成新的点(rf=0.02)。将溶液用50.0mlmtbe洗涤,然后将溶液过滤,然后将滤饼在减压下浓缩以给出呈白色固体的化合物2-((溴三苯基磷烷基)甲基)苯甲酸甲酯(28.0g,56.9mmol,62.0%产率,hbr)。
化合物2-((溴三苯基磷烷基)甲基)苯甲酸甲酯(10.0g,20.3mmol,hbr)在thf(70.0ml)中的混合物,然后在20℃下向混合物中添加3-溴苯甲醛(4.18g,22.6mmol),在下-5℃至0℃添加t-buok(5.57g,49.7mmol),然后将混合物在20℃下搅拌2小时。tlc(石油醚:乙酸乙酯=10:1)显示起始材料完全消耗并且形成新的点(rf=0.55)。将溶液用100mletoac萃取,并且然后用20.0mlh2o萃取,并且然后将有机物用10.0ml盐水洗涤,并且然后将有机物在减压下浓缩以给出呈棕色油状物的(e)-甲基2-(3-溴苯乙烯基)苯甲酸酯(7.00g,粗品)。
(e)-甲基2-(3-溴苯乙烯基)苯甲酸酯(7.00g,22.1mmol)在meoh(49.0ml)中的混合物,然后向混合物中添加naoh(2m),并且然后在n2气氛下将混合物在25℃下搅拌12小时。tlc(石油醚:乙酸乙酯=0:1)显示起始材料完全消耗并且形成新的点(rf=0.02)。将溶液用100mlh2o萃取,并且然后用120mletoac萃取,并且然后将水相用hcl调节ph至3,然后将其用50.0mletoac萃取,并且然后将有机物在减压下浓缩以给出残余物。将残余物通过柱色谱法纯化(sio2,石油醚/乙酸乙酯=100/1至3/1)以给出呈白色固体的(e)-2-(3-溴苯乙烯基)苯甲酸(3.00g,9.90mmol,44.8%产率)。
将(e)-2-(3-溴苯乙烯基)苯甲酸(2.40g,7.92mmol)、socl2(1.05g,8.87mmol)在dcm(15.0ml)中的混合物脱气并且用n2吹扫3次,并且然后在n2气氛下将混合物在60℃下搅拌1.5小时。tlc(石油醚:乙酸乙酯=1:1)显示形成新的点(rf=0.36)。将溶液在减压下浓缩以给出呈棕色油状物的(e)-2-(3-溴苯乙烯基)苯甲酰氯(2.00g,粗品)。
(e)-2-(3-溴苯乙烯基)苯甲酰氯(2.00g,6.22mmol)在dcm(14.0ml)中的混合物,然后向混合物中添加alcl3(954mg,7.15mmol)脱气并且用n2吹扫3次,并且然后在n2气氛下将混合物在25℃下搅拌3小时。将溶液在减压下浓缩以给出呈棕色油状物的2-溴-5h-二苯并[a,d][7]轮烯-5-酮(1.30g,粗品)。
在n2下在20℃下向2-溴-5h-二苯并[a,d][7]轮烯-5-酮(100mg,351umol)和(3-(甲基氨基)丙基)三苯基鏻(226mg,456umol,2hbr)在thf(2.00ml)中的反应中添加1,4,7,10,13,16-六氧杂环十八烷(92.7mg,351umol)和khmds(1m,982ul),然后将混合物温热至80℃持续17小时。tlc(石油醚:乙酸乙酯=10:1)显示起始材料仍然剩余。将残余物通过制备型hplc纯化(柱:nano-microkromasilc18100*30mm5um;流动相:[水(0.1%tfa)-acn];b%:25%-45%,10min)以给出呈白色固体的3-(2-溴-5h-二苯并[a,d][7]轮烯-5-亚基)-n-甲基丙-1-胺(13.1mg,37.3umol,10.6%产率,98.8%纯度)。ms:针对c19h18brn[m+h]+的计算值340.07,实测值:340.10。1hnmr(400mhz,meoh)δ7.58-7.20(m,7h),6.95-6.84(m,2h),5.56-5.52(m,1h),3.01-2.97(m,2h),2.60-2.54(m,3h),2.54-2.37(m,2h)。
实施例7:n-甲基-3-(2-甲基-5h-二苯并[a,d][7]轮烯-5-亚基)丙-1-胺
3-(3-甲基苯亚基)异苯并呋喃-1(3h)-酮(产率:86%)。1hnmr(400mhz,氯仿-d)δ7.73(dd,j=7.0,1.3hz,1h),7.84-7.80(m,2h),7.61-7.48(m,3h),7.45-7.38(m,1h),7.30(ddt,j=9.0,7.1,1.6hz,1h),6.87(s,1h),2.42(s,3h)。
2-(3-甲基苯乙基)苯甲酸(产率:48%)。1hnmr(400mhz,氯仿-d)δ7.91(dd,j=7.4,1.6hz,1h),7.54(td,j=7.5,1.6hz,1h),7.33(td,j=7.5,1.6hz,1h),7.39-7.27(m,5h),2.51(s,3h),2.91-2.70(m,4h)。
2-甲基-10,11-二氢-5h-二苯并[a,d][7]轮烯-5-酮(产率:59%)。1hnmr(400mhz,氯仿-d)δ7.78-7.63(m,1h),7.60-7.40(m,2h),7.28(m,4h),2.45-2.35(m,7h)。
10-溴-2-甲基-10,11-二氢-5h-二苯并[a,d][7]轮烯-5-酮(产率:79%)。
1hnmr(400mhz,氯仿-d)δ8.49(d,1h),7.98(d,1h),7.59-7.42(m,4h),7.52(dd,1h),5.53(m,1h),3.40-3.22(m,2h),2.48(s,3h)。
2-甲基-5h-二苯并[a,d][7]轮烯-5-酮(产率:90%)。1hnmr(400mhz,氯仿-d)δ8.19(dd,j=7.4,1.4hz,1h),7.78-7.60(m,3h),7.52-7.40(m,3h),6,64-6.39(m,2h),2.52(s,3h)。
5-亚烯丙基-2-甲基-5h-二苯并[a,d][7]轮烯(产率:89%)。1hnmr(500mhz,氯仿-d)δ7.67-7.58(m,2h),7.49-7.40(m,2h),7.37-7.29(m,5h),7.10(td,j=13.4,8.4hz,1h),6.81(d,j=8.4hz,1h),5.32(d,j=13.4hz,2h),2.56(s,3h)。
n-甲基-3-(2-甲基-5h-二苯并[a,d][7]轮烯-5-亚基)丙-1-胺(产率:72%,z/e=5:1)。ms:针对c20h21n[m+h]+的计算值276.17,实测值:276.29。1hnmr(500mhz,氯仿-d)δ7.68-7.52(m,2h),7.50-7.41(m,2h),7.30(d,j=20.7hz,3h),7.29-7.23(m,2h),6.22(t,j=6.2hz,1h),2.92(tq,j=4.9,2.6hz,1h),2.81(dt,j=7.5,6.6hz,2h),2.62-2.59(m,2h),2.56-2.38(m,6h)。
生物学测定
多塞平、去甲替林和伊卢多啉分别购自topscience(http://www.tsbiochem.com)和sinochemtech(http://www.sinochemtech.com)。
拮抗剂活性测定
使用flipr方法将稳定的细胞系cho-k1/5-ht2b应用于细胞拮抗剂测定。简而言之,在实验那天之前18h,将表达5-ht2b的cho-k1细胞在20μl生长培养基(10%透析fbs+90%f12)中以20,000个细胞/孔的密度接种于384孔黑壁透明底板中,并且维持在37℃/5%co2。将20μl染料加载溶液和10μl测试化合物溶液(以最终测定浓度的五倍的浓度)添加到孔中。然后将板放入37℃培养箱中持续60min,然后在室温下持续15min。最后,添加12.5μl对照激动剂(以ec80浓度的五倍的浓度)。在20s时将对照激动剂添加到读数板上,并且监测荧光信号持续另外的100s(21s至120s)。在筛选中,选择用含有0.1%dmso的测定缓冲液(hbss-hepes)刺激的细胞作为背景;选择用12nm(细胞系的ec80)的5-ht刺激的细胞作为激动剂对照;选择用3,5-二氢-5-甲基-n-3-吡啶基苯并[1,2-b:4,5-b']二吡咯-1(2h)-甲酰胺(先前报道的5-ht2b拮抗剂,在5-ht2b拮抗剂/结合活性测定中用作阳性对照)处理的细胞作为筛选的阳性对照。
使用screenworks(版本3.1)程序进行数据采集和分析。计算在1s至20s期间的平均荧光强度值作为基线读数。用最大荧光单位(21s至120s)减去基线读数的平均值来计算相对荧光单位(δrfu)强度值。从以下等式计算测试物的%抑制:
%抑制=[1-(δrfu化合物-δrfu背景)/(δrfu激动剂对照-δrfu背景)]*100
结合测定
按照标准方案通过美国国家心理卫生研究所的精神活性药物筛选程序(nationalinstituteofmentalhealth’spsychoactivedrugscreeningprogram,pdsp)进行实验结合测定。简而言之,在标准结合缓冲液中,将放射标记的参考化合物(对于5-ht2b的[3h]lsd)稀释至5x最终测定浓度(对于10μm的最终测定浓度,为50μm)。随后,将50μl等分试样的缓冲液(阴性对照)、测试化合物和参考化合物一式四份地添加到96孔板的孔中,每个孔含有50μl5x放射性配体和100μl缓冲液。最终,将含受体的粗膜级分重悬于适当体积的缓冲液中,并且分配(50μl/孔)到96孔板中。允许将放射性配体结合平衡(典型地在室温下持续1.5小时),并且然后通过使用96孔filtermate收集器过滤到0.3%聚乙烯亚胺处理的96孔过滤垫上来分离结合放射活性。将过滤垫干燥,然后将闪烁体熔化到过滤器上并且在microbeta闪烁计数器中将保留在过滤器上的放射活性计数。在pdspdb上分析来自microbeta计数器的原始dpm数据。从不含有测试化合物或参考化合物的一式四份孔估计总结合放射活性,并且将其调节至100%;从含有10μm的合适参考化合物的一式四份孔评估非特异性结合放射活性,并且将其调节至0%。在测试化合物(10μm最终测定浓度,一式四份测定)的存在下的平均结合放射活性以百分比量度表示。如下计算放射性配体的百分比抑制:%抑制=100%-%放射活性-结合。pdsp在线数据输入和分析系统计算一式四份测定的方差(针对总、非特异性和测试化合物结合值),并且将大于20%的方差标记用于进一步检查,并且如果必要,重复测定。
表1和表2示出了本文公开的化合物的结合活性。
表1
表2
动物模型制备。
将雄性c57bl/6小鼠(8周龄,北京国立生物科学研究所的实验室动物中心(laboratoryanimalcenterofthenationalinstituteofbiologicalsciences))放入新的吸收性衬里底部的笼中,在测试前2h内无法获取食物和水。在即将测试前,将吸收性衬里丢弃,并且将新鲜预称重的衬里放入笼中。通过口服施用蓖麻油(0.3ml/小鼠;bellancom#259853)诱导腹泻。对粪便进行评分(腹泻得分为0=正常;1=湿润和不规则形状;或2=不成形),并且在4-h时间段内称重。每小时后,将吸收性衬里称重,并且将另一个预称重的衬里放入笼中。腹泻得分代表在4-h时间段内单独小鼠的粪便的最明显变化。在蓖麻油施用前15min口服施用化合物。在蓖麻油施用前和施用后4h测量体重。将伊卢多啉用作阳性对照。26所有程序均经北京国立生物科学研究所(nationalinstituteofbiologicalsciences,beijing)的机构动物护理和使用委员会(institutionalanimalcareandusecommittee,iacuc)批准进行。
以上结果显示,与多塞平(广泛使用的tca)相比,引入氯和溴取代分别使实施例2、3和4的化合物的结合亲和力提高8倍和10倍。然而,如实施例1所述的氟修饰对结合亲和力无影响。
从在小鼠中蓖麻油诱导的腹泻模型获得的体内数据显示本文公开的化合物(尤其是实施例3)与多塞平相比展现出优异的治疗有效性,显著改善了粪便的稠度(图1)并且使粪便输出正常化(图2)。此外,通过实施例3,体重减轻也强烈减弱(图3)。
应当理解,如果在本文提到了任何现有技术公开案,则这一参考文献并不构成承认所述公开案构成任何国家的本领域的一般常识的一部分。
通过标识引用而在本文提到的所有公开案、专利、专利申请和公开的专利申请的公开内容通过引用以其整体特此并入本文。
尽管为了理解清楚的目的,已经通过说明和实施例详细地描述了前述发明,但是对于本领域技术人员清楚的是,可以实施某些较小的改变和修改。因此,描述和实施例不应被解释为限制本发明的范围。
- 还没有人留言评论。精彩留言会获得点赞!