具有氧化细胞质的大肠杆菌菌株的制作方法
相关申请
本申请要求2018年11月8日提交的美国临时申请第62/757,498号的优先权。所述临时申请的全部内容在此出于所有目的通过引用并入。
发明背景
商业上有价值的蛋白质,如治疗性蛋白质,通常具有二硫键。这些二硫键对于蛋白质稳定性和功能是重要的。用于蛋白质生产的常规细菌宿主具有还原性细胞溶质,因此不能在胞质中表达的蛋白质中形成二硫键。结果,目前许多蛋白质不能容易地在细菌细胞溶质中表达,而是在真核或周质表达系统中表达。尽管已经通过将突变引入到细菌宿主基因组中以破坏还原途径来尝试促进细菌细胞溶质中二硫键的形成,但这些努力产生了有限的成功。因此,细菌中二硫化物键合的蛋白质的胞质产生仍然是一个挑战。
发明概述
应理解,本文描述的实施例和实施方案仅用于说明目的,并且根据其的各种修改或变化将被暗示给本领域技术人员,并且将被包括在本申请的精神和范围内以及所附权利要求的范围内。本文引用的所有出版物、序列登录号、专利和专利申请在此出于所有目的通过引用以其整体并入。
在一些实施方案中,本公开内容提供了大肠杆菌菌株,其缺乏由trxb编码的硫氧还蛋白还原酶活性和由trxa编码的硫氧还蛋白1活性以及由gor编码的谷胱甘肽还原酶活性。所述大肠杆菌菌株表达具有谷胱甘肽还原酶活性的突变的ahpc蛋白和胞质原核二硫化物异构酶。在一些实施方案中,突变的ahpc蛋白是ahpc*。在一些实施方案中,大肠杆菌菌株表达野生型ahpc蛋白和具有谷胱甘肽还原酶活性的突变的ahpc蛋白。
在一些实施方案中,所述菌株还包含编码目的蛋白的基因。目的蛋白可以是选自以下的一种:抗体、其片段或来自igg的抗体+轻链。在一些实施方案中,所述大肠杆菌还表达重组脯氨酰异构酶。
在一些实施方案中,在大肠杆菌中表达的胞质二硫化物异构酶是dsbc。
在一些实施方案中,编码目的蛋白的基因与诱导型启动子,例如t7启动子可操作地连接。在一些实施方案中,t7启动子可以由阿拉伯糖诱导。在一些实施方案中,ahpc*基因在大肠杆菌中的表达由pc0启动子控制。在一些实施方案中,胞质原核二硫化物异构酶在大肠杆菌中的表达由mtl启动子控制。在一些实施方案中,大肠杆菌来自k-12菌株。
本文还提供了在大肠杆菌细菌菌株中表达可溶性重组目的蛋白的方法,所述方法包括以下步骤:在允许目的蛋白作为可溶性蛋白表达的条件下培养大肠杆菌细菌菌株,所述大肠杆菌细菌菌株包含氧化细胞溶质和用于表达目的蛋白的表达盒,其中所述菌株进行如下遗传修饰:i)硫氧还蛋白还原酶编码基因trxb不是功能性的;ii)硫氧还蛋白1trxa不是功能性的;iii)谷胱甘肽还原酶基因(gor)不是功能性的;iv)ahpc基因,其已经被突变使得表达的酶缺乏过氧化还原酶活性并且具有谷胱甘肽还原酶活性;以及v)将编码胞质原核二硫化物异构酶的基因重组引入该细菌菌株。在一些实施方案中,所述大肠杆菌菌株包含功能性基因ahpc基因和突变的ahpc基因。在一些实施方案中,突变的ahpc基因是ahpc*。在一些实施方案中,trxc基因是非功能性的。在一些实施方案中,trxb基因是非功能性的。
在一些实施方案中,胞质二硫化物异构酶是dsbc或酵母蛋白二硫化物异构酶(ypdi)。在一些实施方案中,大肠杆菌菌株还表达一种或多种重组脯氨酰异构酶。在一些实施方案中,重组脯氨酰异构酶选自亲环蛋白、fkbp、细小蛋白、slyd、tig和ycpr6。在一些实施方案中,大肠杆菌菌株还表达一种或多种解聚酶。在一些实施方案中,解聚酶选自skp、groel、groes、dnak、dnaj和grpe。
在一些实施方案中,大肠杆菌表达选自以下的目的蛋白:igg、来自igg的轻链或来自igg的重链。在一些实施方案中,抗体轻链是抗her2抗体的轻链。在一些实施方案中,编码目的蛋白的基因与诱导型启动子,例如t7启动子可操作地连接。在一些实施方案中,大肠杆菌菌株还表达t7聚合酶。在一些实施方案中,t7聚合酶在诱导型启动子的控制下。在一些实施方案中,诱导型启动子是parabad、lac、phoa、teta、xylab、tac或鼠李糖启动子。在一些实施方案中,t7聚合酶可以识别t7启动子,其控制目的蛋白的表达。
在一些实施方案中,大肠杆菌菌株表达由gsha基因编码的gsha。在一些实施方案中,gsha是插入到trxb基因座中的重组基因。
本文还提供了包含以上实施方案中任一个的大肠杆菌的试剂盒,并且所述试剂盒还包含生长培养基。所述试剂盒还可以包含编码目的蛋白的质粒。
附图简述
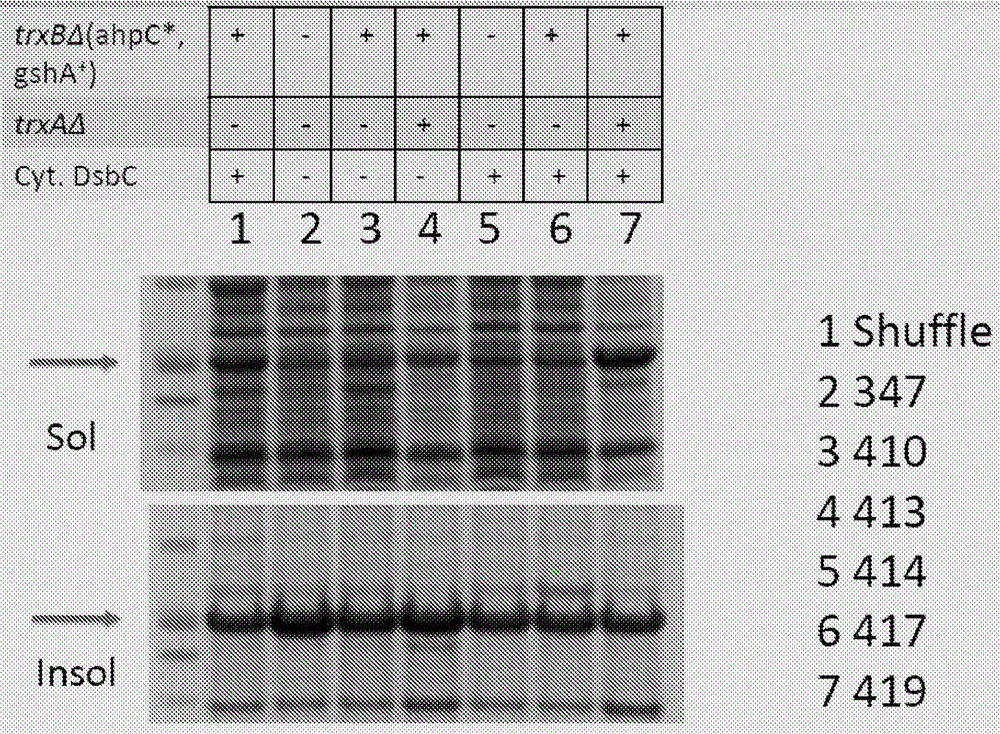
图1a显示了来自表达抗muc1抗体的抗体轻链(lc)muc1g09klc的7种修饰的大肠杆菌菌株的细胞裂解物的可溶性(sol)和不溶性(insol)级分的sdspage分析的结果。这些大肠杆菌菌株中的各种突变显示在以上sds-page结果的表中。
图1b显示了来自表达7219lc、抗cd74igg轻链的三种修饰的大肠杆菌菌株的细胞裂解物的可溶性级分的sds-page分析的结果。这些大肠杆菌菌株的基因型显示在以上sds-page结果的表中。
图1c显示了与图1a类似的sds-page分析的结果,除了被表达的lc是曲妥珠单抗的轻链之外,曲妥珠单抗是相对容易表达的蛋白质。
图2显示了在shuffle和snuggle大肠杆菌菌株中具有78-92%序列同一性的4种不同lc的相对表达结果。与shuffle菌株相比,snuggle菌株在lc生产中显示出20-110%的改进。
发明详述
引言
本公开内容提供了已经被基因工程化以含有氧化细胞质的大肠杆菌菌株。这种氧化细胞质对于维持具有二硫键的蛋白质的三维结构和稳定性是必不可少的。本发明提供了一种基于大肠杆菌的高产率生产蛋白质如抗体轻链(lc)的生产系统。
先前,产生了突变的大肠杆菌菌株(“shuffle”)。lobstein等人,microbialcellfactories2012,11:56。该突变菌株缺乏硫氧还蛋白还原酶活性(trxb)和谷胱甘肽还原酶活性(gor)。shuffle还过表达没有其信号序列的dsbc以及编码缺乏perioxireductase活性但具有谷胱甘肽还原酶活性的酶的ahpc基因的变体(ahpc*)。据报道,shuffle显示出产生正确折叠的二硫键结合蛋白的能力。
与shuffle相比,本文公开的大肠杆菌菌株已经被进一步工程化,使得其还缺乏硫氧还蛋白1活性(trxa)。因此,在一些实施方案中,大肠杆菌菌株在trxa、trxb和gor中包含无效突变。因此,该菌株缺乏硫氧还蛋白还原酶活性(trxb)、硫氧还蛋白1活性(trxa)和谷胱甘肽还原酶活性(gor)。本文公开的大肠杆菌菌株还过表达没有其信号序列的dsbc以及过表达编码缺乏perioxireductase活性但具有谷胱甘肽还原酶活性的酶的ahpc基因的变体(ahpc*)。
令人惊奇的是,与shuffle相比,本文公开的大肠杆菌菌株能够产生更高产量的一些二硫化物键合的蛋白质。考虑到trxb编码细胞质硫氧还蛋白还原酶,其可逆地还原由trxa编码的氧化的硫氧还蛋白;根据常规想法,灭活硫氧还蛋白还原酶应使底物硫氧还蛋白1的失活不必要,因为在氧化还原生化途径中前者位于后者的上游。因此,令人惊讶的是,缺乏trxa和trxb的大肠杆菌菌株提供了一些含有二硫键的可溶性生物活性蛋白的优异产量。
定义
术语“还原酶”是指硫氧还蛋白还原酶(trxb)、谷胱甘肽或谷胱甘肽还原酶(gor)或能够还原硫氧还蛋白或谷胱甘肽系统成员的任何其它酶。
术语“硫氧还蛋白”包括硫氧还蛋白1(trxa)和硫氧还蛋白2(trxc),如rietsch和beckwith(1998)ann.rev.genet.32:163中所述。硫氧还蛋白是特征在于在其活性位点中存在基序cys-xaa-xaa-cys(其中xaa表示任何氨基酸)的小蛋白。硫氧还蛋白被硫氧还蛋白还原酶(由trxb基因编码)和nadph再还原。在trxb突变体中,硫氧还蛋白以氧化形式积累。trxa由trxa基因编码,trxb由trxb基因编码。
术语“gor”是指谷胱甘肽氧化还原酶基因,术语“gor”是指谷胱甘肽氧化还原酶。
“dsbc”是由基因dsbc编码的蛋白,其催化二硫键异构化。dsbc无效突变体在具有多个二硫键的蛋白质折叠中具有缺陷。
术语“谷胱甘肽”是指γ-l-谷氨酰-l-半胱氨酰-甘氨酸(gsh),其是在许多有机体(包括蓝细菌、变形菌、一些革兰氏阳性细菌菌株以及在具有线粒体和叶绿体的所有真核生物中)中发现的高度保守的低分子量硫醇。谷胱甘肽通过两种酶的作用合成:谷氨酸-半胱氨酸连接酶(gsha)和谷胱甘肽合成酶(gshb)。谷氨酸-半胱氨酸连接酶催化谷氨酸和半胱氨酸之间的反应以形成γ-谷氨酰半胱氨酸,γ-谷氨酰半胱氨酸随后通过谷胱甘肽合成酶与甘氨酸缀合以形成gsh。
当核酸与另一核酸序列处于功能关系时,它与另一核酸“可操作地连接”。例如,如果启动子或增强子影响序列的转录,则其与编码序列可操作地连接;或者如果将核糖体结合位点定位以促进翻译,则将其与编码序列可操作地连接。通常,“可操作地连接”意指被连接的dna序列是连续的,并且在分泌前导序列的情况下,dna序列是连续的并且处于阅读阶段。通过在方便的限制位点连接来完成连接。如果不存在这样的位点,则根据常规实践使用合成的寡核苷酸适配子或接头。
ahpc是烷基过氧化氢还原酶ahpcf的两个亚基中的一个。ahpcf的另一个亚基是黄素酶ahpf。tarataglia等人,j.biol.chem.,volume265,10535-10540,1990;smillie等人,genbanksubmissionncblgi;216542,1993)。这两种蛋白一起起作用;ahpf使用nadh或nadph作为ahpc的电子供体,其将生理脂质过氧化物(如亚油酸氢过氧化物和胸腺嘧啶氢过氧化物)和非生理烷基氢过氧化物还原为它们各自的无毒醇形式。这种酶复合物(或体系)清除氧及其衍生物。已经证明ahpc作为特定的烷基氢过氧化物清除酶用于保护免受氧自由基损伤,尽管也已经证明出现了消除反应性氮中间体。ahpf涉及硫氧还蛋白还原酶,其具有特异性还原ahpc所必不可少的延伸的另外的n-末端片段。
当用于描述蛋白质时,术语“胞质”是指该蛋白质存在于细胞的细胞溶质中。
“异源蛋白或多肽”是指通常不在宿主细胞中产生的蛋白或多肽。异源多肽可以来自与宿主细胞相同的种类和类型,条件是它由引入宿主细胞的核酸表达。
“外源多肽”是指通常不在细胞中产生的多肽。
“无效突变”是指基因中导致非功能性基因的突变。无效突变可导致相关基因产物或不能正确发挥功能的产物完全缺乏。
与术语“二硫化物异构酶”或“pdi”可互换使用的术语“蛋白质二硫化物异构酶”是指催化二硫键形成和异构化的酶。通过体外数据,pdi参与二硫键形成和重排的催化。(creighton等人,(1980)j.mol.biol.142:43;feedman等人,(1989)biochem.soc.symp.5:167;bardwell和beckwith(1993)cell74:899。已经显示pdi中的酵母突变体在羧肽酶y中二硫键的形成中具有缺陷(lamantia和lennarz(1993)cell74:899)。pdi用于在宿主细胞中表达异源蛋白的用途进一步描述在pct申请中,其公开号为:wo93/25676;wo94/08012;和ep509,841。
与“肽基脯氨酰异构酶”或“pplase”互换使用的术语“脯氨酰异构酶”是指在原核生物和真核生物中发现的酶,其使肽键的顺式和反式异构体与氨基酸脯氨酸互换。具有脯氨酰异构酶活性的蛋白质包括但不限于亲环蛋白(例如,登录号q13427)、fkbp(例如,登录号q02790)、细小蛋白(例如,登录号q9y237)、tig(例如,登录号p0a850)、slyd(例如,登录号p0a9k9)和ycpr6(例如,登录号s000004206)。
术语“解聚酶”是指有助于解聚和/或溶解例如在无细菌翻译系统中产生的目的蛋白的蛋白伴侣。此类伴侣在高浓度下是特别有用的,因为它们的作用机理是化学计量的而非催化的,并且被认为是通过在蛋白质折叠时稳定新合成的蛋白质的疏水补丁起作用。解聚酶的非限制性实例包括skp(例如,登记号p0aeu7)、groel(例如,登记号p0a6f5)、groes(例如,登记号p0a6f9)、dnak(例如,登记号p0a6y8)、dnaj(例如,登记号p08622)、grpe(例如,登录号p09372)或。
当提及处于“还原状态”的蛋白质时,它是指具有比其氧化形式更多的电子的蛋白质。
术语“氧化细胞质”是指其中与还原相比,底物更可能被氧化的细胞的细胞溶质。
术语“硫氧还蛋白还原酶活性”是指硫氧还蛋白还原酶(trxb)将硫氧还蛋白1维持在还原状态的能力。
术语“硫氧还蛋白1活性”是指硫氧还蛋白1(trxa)将核糖核苷酸还原酶维持在还原状态的能力。
术语“过氧化还原酶活性”是指ahpc还原生理性脂质氧化物的能力。
术语“谷胱甘肽还原酶活性”是指催化谷胱甘肽二硫化物(gssg)还原成巯基形式谷胱甘肽(gsh)的能力。例如,谷胱甘肽还原酶(gor)具有谷胱甘肽还原酶活性。
术语“重组的”或“重组地”是指生物分子,例如基因或蛋白质,其(1)已经从其天然存在的环境中去除,(2)不与其中自然界中存在的基因的多核苷酸的全部或部分相关,(3)可操作地连接于在自然界中不被连接的多核苷酸,或者(4)在自然界中不存在。术语“重组的”可以用于提及克隆的dna分离物、化学合成的多核苷酸类似物或通过异源系统生物合成的多核苷酸类似物,以及由此类核酸编码的蛋白质和/或mrna。
修饰大肠杆菌中的还原途径。
本发明改变大肠杆菌中的两个还原途径以产生具有二硫键的适当折叠的细胞质蛋白:硫氧还蛋白途径和谷氧还蛋白/谷胱甘肽途径。
在硫氧还蛋白途径中,硫氧还蛋白还原酶(trxb基因的产物)使用nadph的还原潜能将硫氧还蛋白1(trxa基因的产物)维持在还原状态,使得硫氧还蛋白1继而可以还原底物蛋白,如核糖核苷酸还原酶。只要细胞中存在谷胱甘肽或谷氧还蛋白途径,就可以消除该途径。这在本发明中通过trxa和trxb的染色体缺失来实现。
在谷胱甘肽/谷氧还蛋白途径中,谷胱甘肽氧化还原酶(gor基因的产物)使用nadph的还原潜能来还原谷胱甘肽(由gsha和gshb编码)。然后谷胱甘肽能够还原三种谷氧还蛋白(由grxa、grxb和grxc编码)。stewart等人,emboj.第17卷,第19期,pp.5543-5550(1998)。在本发明中,该途径被修饰,使得谷胱甘肽通过突变的过氧化还原酶而不是gor被还原。
本文公开的大肠杆菌菌株已经被遗传修饰,使得其与野生型大肠杆菌相比具有不同的还原途径。在一些实施方案中,大肠杆菌菌株含有编码突变的ahpc蛋白的突变的ahpc基因。在一些实施方案中,突变的aphc蛋白获得谷胱甘肽还原酶的活性,因此可以恢复trxbgor突变大肠杆菌菌株的生长。在优选的实施方案中,与野生型aphc蛋白相比,突变的aphc蛋白在第165位保留半胱氨酸残基。这些突变体可以将电子引导到谷胱甘肽/谷氧还蛋白途径中,而不是硫氧还蛋白途径中。在一些实施方案中,突变的aphc蛋白缺乏野生型ahpc蛋白所具有的过氧化还原酶活性。在一些实施方案中,突变的aphc蛋白保留野生型ahpc蛋白所具有的过氧化还原酶活性。
在一些实施方案中,突变的aphc蛋白相对于野生型aphc含有一个或多个点突变,并且所述一个或多个点突变不涉及第165位的半胱氨酸残基。在一些实施方案中,一个或多个点突变选自s159p、p161s、a167t、p166s、c46y、c46f、r119c和g141s。在一些实施方案中,这些突变的ahpc蛋白保留野生型ahpc所具有的过氧化还原酶活性。在yamamoto等人,mol.cell.january18;29(1):36-45(2008)中描述了这些突变体中的一些,相关公开内容通过引用并入本文。
在一些实施方案中,突变的aphc基因是seqidno:4(下文称为“ahpc*基因”),其编码seqidno:5(下文称为“ahpc*蛋白)。ahpc*蛋白失去野生型ahpc蛋白所具有的过氧化还原酶活性,但获得谷胱甘肽还原酶的活性。ahpc*含有在野生型ahpc蛋白的残基36与37之间的苯丙氨酸的插入。在一些实施方案中,将ahpc*基因插入到flp重组酶从该基因缺失留下的疤痕位点。在一个实例中,将ahpc*插入到tnaa(色氨酸酶)基因座从该基因缺失的疤痕位点。
大肠杆菌菌株也已经被基因工程改造,使得其缺乏硫氧还蛋白还原酶活性。在一个实施方案中,大肠杆菌在trxb基因中含有无效突变,这导致细菌缺乏硫氧还蛋白还原酶活性。
大肠杆菌菌株也已经被基因工程改造,使得其缺乏硫氧还蛋白1活性。在一个实施方案中,大肠杆菌在trxa基因中含有无效突变,这导致细菌缺乏硫氧还蛋白还原酶活性。
大肠杆菌菌株也已经被基因工程改造,使得谷胱甘肽还原酶基因(gor)不是功能性的。在一个实施方案中,大肠杆菌在gor基因中含有无效突变,这导致细菌缺乏谷胱甘肽还原酶活性。
在一些实施方案中,大肠杆菌菌株表达gsha基因。gsha负责谷胱甘肽生物合成的第一步,并且表达功能gsha蛋白可以确保细胞仍具有功能性谷胱甘肽合成途径,并确保细胞存活。
大肠杆菌菌株也已经被修饰以表达重组的胞质原核二硫化物异构酶。重组的胞质原核二硫化物异构酶可以促进蛋白质折叠,这对于更具挑战性的lc尤其重要。在一些实施方案中,伴侣通过去除前导序列以分泌出细胞而定位于细胞质。在一个实施方案中,二硫化物异构酶是dsbc。在一个实施方案中,二硫化物异构酶是酵母蛋白二硫化物异构酶(ypdi),例如,如groff等人,mabs6(3):671-678(2014)中所述,其显示了ypdi和dsbc在用于原核系统中的免疫球蛋白折叠中是功能上可互换的。因此,预期人蛋白二硫化物异构酶和其它密切相关的蛋白也适于在该菌株中功能性替代dsbc。在一些实施方案中,蛋白质异构酶是脯氨酰异构酶,并且合适的脯氨酰异构酶可以包括但不限于亲环蛋白、fkbp、细小蛋白、解聚酶skp或slyd、groel/groes、dank、dnaj或grpe。
可以以多种方式鉴定必须去除以将分泌的伴侣转化成胞质伴侣的信号序列。对于充分表征的有机体,如大肠杆菌和人,大多数蛋白质的信号序列是已知的。这减少了在克隆过程中消除分泌序列以仅去除该序列的任务。对于研究较少的有机体(包括其它细菌或动物),仍然可以通过与其细菌或人同源物的同源性推断信号序列。在没有已知信号序列的同源物的情况下,存在用于预测大约70%的时间正确的信号序列的算法,nielsenh,engelbrechtj,brunaks和vonheijneg.proteineng.1997年1月;10(1):1-6。
目的蛋白
本文提供的方法可以用于任何蛋白质,其在其生物活性确认中具有至少一个二硫键,或者其成熟形式不含有二硫键,但其前体含有至少一个二硫键。
二硫键通常通过两个半胱氨酸侧链之间的巯基的氧化形成,从而形成共价键。二硫键可以通过以共价方式连接残基将折叠单元锁定成稳定的构象来稳定三级蛋白结构。许多二硫化物键合的蛋白质被分泌或保持锚定到暴露于环境的质膜上。二硫化物键合的蛋白质的这些特征使得它们成为制药工业的优异治疗剂或靶标。
在原核细胞中,当dsba蛋白将其二硫键赠予在其天然结构中包含二硫键的新合成的多肽时,形成二硫键。整合膜蛋白dsbb在其自身内产生二硫键,然后将其转移至dsba。dsbc是催化二硫键异构化的蛋白质。在野生型大肠杆菌菌株中,dsbc被输出到周质中,因此不适于产生含二硫化物的细胞质蛋白。如本文所公开的,在一些实施方案中,修饰的大肠杆菌菌株表达胞质原核二硫化物异构酶,例如dsbc。该胞质dsbc蛋白在没有其信号序列的情况下表达;结果,该dsbc蛋白保留在细胞质中以促进目的蛋白的二硫化物组装。在一些真核细胞中,主要的二硫化物途径由膜相关的黄素蛋白eroi和可溶性硫氧还蛋白样蛋白pdi组成。eroi使用黄素辅因子介导其半胱氨酸对被氧气再氧化,在其自身内产生二硫键,然后将该键转移至pdi。接着,pdi将二硫键直接转移到尚未采用其天然结构的新合成的多肽。
二硫键存在于许多蛋白中,包括但不限于分泌蛋白、免疫蛋白、细胞外基质蛋白、糖蛋白、溶酶体蛋白和膜蛋白。二硫键和具有二硫键的蛋白质的详细描述可以见于例如fass,d.annu.rev.biophys.,2012,41:63-79,sevier,c.s.和kaiser,c.a.antioxidants&redoxsignaling,2006,8(5):797-811以及demarco,a.,microbialcellfactories,2009,8:26。也可以使用本文公开的系统产生这些蛋白质。
目的蛋白可以是真核蛋白、原核蛋白、病毒蛋白或植物蛋白。在一些实施方案中,目的蛋白是哺乳动物来源的,包括鼠、牛、绵羊、猫、猪、犬、山羊、马和灵长类动物来源的。在一些实施方案中,目的蛋白是人来源的。
在一些实施方案中,目的蛋白是抗体,如单链抗体、抗体片段以及由多个多肽链组成的抗体。在一些实施方案中,目的蛋白是抗体的轻链或重链。在一些实施方案中,目的蛋白是scfv。在一些实施方案中,目的蛋白是fab片段。示例性抗体包括但不限于抗her2抗体。示例性轻链包括但不限于抗her2抗体的轻链,例如曲妥珠单抗轻链。
可以产生的目的蛋白的另外实例包括以下蛋白质:哺乳动物多肽,包括分子,诸如例如肾素、生长激素、激素受体或生长因子受体;cd蛋白,如cd-3、cd4、cd8和cd-19;白细胞介素;干扰素;t细胞受体;表面膜蛋白;衰变加速因子;病毒抗原,诸如例如,aids包膜的一部分;转运蛋白;归巢受体;地址素;调节蛋白;抗体;以及以上列出的多肽中任一种的片段。
本发明产生的蛋白质可以用于一种或多种以下目的或效果:抑制传染原的生长、感染或功能或者杀死传染原,所述传染原包括但不限于细菌、病毒、真菌和其它寄生虫;影响(抑制或增强)身体特征,包括但不限于身高、体重、毛发颜色、眼睛颜色、皮肤、肥瘦比或其它组织色素沉着或者器官或身体部位的尺寸或形状(诸如,例如,乳房增大或减小,骨形式或形状的变化);影响生物节律或者生理节奏循环或节律;影响雄性或雌性对象的生育力;影响膳食脂肪、脂质、蛋白质、碳水化合物、维生素、矿物质、辅因子或其它营养因子或组分的新陈代谢、分解代谢、合成代谢、加工、利用、储存或消除;影响行为特征,包括但不限于食欲、性欲、压力、认知(包括认知障碍)、抑郁(包括抑郁病症)和暴力行为;提供镇痛作用或其它疼痛减轻作用;促进除造血谱系外的谱系中的胚胎干细胞的分化和生长;激素或内分泌活性;在酶的情况下,校正酶的缺乏和治疗与缺乏相关的疾病;过度增殖性病症(诸如例如银屑病)的治疗;免疫球蛋白样活性(如结合抗原或补体的能力);以及在疫苗组合物中充当抗原以引发针对此类蛋白质或与此类蛋白质交叉反应的另一种材料或实体的免疫应答的能力。
本发明产生的多肽和蛋白质可以用于本领域技术人员已知的任何目的。优选的用途包括医学用途,其包括诊断用途、预防和治疗用途。例如,可以制备用于局部或其它类型施用的蛋白质。另一种优选的医学用途是用于制备疫苗。因此,将本发明产生的蛋白质溶解或悬浮在药理学上可接受的溶液中以形成用于施用至对象的药物组合物。用于医学目的的适当缓冲液和药物组合物的施用方法在下文中进一步阐述。本领域技术人员将理解,药物组合物也可以施用至除人以外的对象,如用于兽医目的。
一般方法
除非另有定义,否则本文使用的所有技术和科学术语具有本发明所属领域的普通技术人员通常理解的含义。从业者特别针对green,m.r和sambrook,j.,eds.,molecularcloning:alaboratorymanual,第4版,coldspringharborlaboratorypress,coldspringharbor,n.y.(2012)以及ausubel,f.m.,等人,currentprotocolsinmolecularbiology(supplement99),johnwiley&sons,newyork(2012),将其通过引用并入本文,用于本领域的定义和术语。标准方法也出现在bindereif,
蛋白质纯化、层析、电泳、离心和结晶的方法描述在coligan等人,(2000)currentprotocolsinproteinscience,第1卷,johnwileyandsons,inc.,newyork中。无细胞合成的方法描述在spirin&swartz(2008)cell-freeproteinsynthesis,wiley-vch,weinheim,germany中。使用无细胞合成将非天然氨基酸掺入蛋白质的方法描述在shimizu等人,(2006)febsjournal,273,4133-4140中。
pcr扩增方法是本领域众所周知的,并且描述在例如innis等人,pcrprotocols:aguidetomethodsandapplications,academicpressinc.sandiego,calif.,1990中。扩增反应通常包括要扩增的dna、热稳定的dna聚合酶、两种寡核苷酸引物、脱氧核苷酸三磷酸(dntp)、反应缓冲液和镁。通常,所需的热循环数目是1至25。引物设计和pcr条件优化的方法是本领域众所周知的,并且可以见于标准分子生物学教科书,如ausubel等人,shortprotocolsinmolecularbiology,第5版,wiley,2002以及innis等人,pcrprotocols,academicpress,1990。计算机程序可用于设计具有所需特异性和最佳扩增特性的引物(例如oligoversion5.0(nationalbiosciences))。在一些实施方案中,pcr引物可以另外含有限制性内切酶的识别位点,以促进扩增的dna片段插入到载体的特异性限制酶位点中。如果将限制位点加入到pcr引物的5’末端,则优选包括一些(例如两个或三个)额外的5’碱基以允许酶更有效地切割。在一些实施方案中,pcr引物还可以含有rna聚合酶启动子位点,如t7或sp6,以允许随后的体外转录。体外转录的方法是本领域技术人员众所周知的(参见,例如,vangelder等人,proc.natl.acad.sci.u.s.a.87:1663-1667,1990;eberwine等人,proc.natl.acad.sci.u.s.a.89:3010-3014,1992)。
当通过名称提及本文所述的蛋白质时,应理解这包括具有类似功能和类似氨基酸序列的蛋白质。因此,本文所述的蛋白质包括野生型原型蛋白质以及同源物、多态性变异和重组产生的突变蛋白。例如,名称“dsbc蛋白”包括来自大肠杆菌的野生型原型蛋白质(例如,seqidno:1)以及来自其它物种的同源物、多态性变异和重组产生的突变蛋白。如果蛋白质如dsbc具有与野生型蛋白基本上相同的生物活性或功能能力(例如,任一种的至少80%),则它们被定义为具有类似的功能。如果蛋白质如dsbc和ahpc*与原型蛋白质具有至少80%、85%、90%、95%、96%、97%、98%或99%的序列同一性,则它们被定义为具有类似的氨基酸序列。使用blastp程序(默认字长为3,期望值(e)为10)和blosum62评分矩阵测定蛋白质的序列同一性(参见henikoff和henikoff,proc.natl.acad.sci.usa89:10915-10919,1992)。
确定蛋白质同源物、多态性变体或重组突变蛋白是否包括具有本文所述功能的蛋白质的容易的常规试验是通过与针对原型蛋白质产生的多克隆抗体特异性结合。通常,特异性或选择性反应将是背景信号或噪声的至少两倍,更通常是背景的10-100倍以上。例如,dsbc蛋白包括与针对seqidno:1的原型蛋白质产生的多克隆抗体结合的蛋白。
向大肠杆菌中引入突变的方法
在一些实施方案中,基因修饰,例如trxa和trxb的敲除,可以用位点特异性重组进行。位点特异性重组使用既具有核酸内切酶活性又具有连接酶活性的酶,该酶识别dna序列的某一部分,并用任何其它相应的dna序列代替它,参见yangw.和mizuuchik.,structure,1997,vol.5,1401-1406(9)。位点特异性重组系统是本领域众所周知的,例如来自杀菌λ噬菌体的int/att系统、来自pi噬菌体的cre/loxp系统和来自酵母的flp-frt系统是充分开发的位点特异性重组系统。
将位点特异性重组引入本文公开的各种蛋白质的方法的非限制性实例包括cre/lox和flp/frt重组系统。这两种系统是本领域众所周知的。例如,已经报道了进入细菌染色体的位点特异性整合(参见,例如,sauer等人,proc.natl.acad.sci..85.5166-5170(1988);fukushige等人,proc.natl.acad.sci.,89.7905-7907(1992);baubonis等人,nucleicacidsresearch.21,2025-2029(1993);hasan等人,gene,150.51-56(1994);golic等人,cell.5_9,499-509(1989);sauer,mol.cell.biolo.1_,2087-2096(1987);sauer等人,methods:companiontomethodsinenzymol..4.,143-149(1992);sauer等人,thenewbiologist.2.,441-449(1990);sauer等人,nucleicacidsres..17.147-161(1989);qin等人,proc.natl.acad.sci.91.1706-1710(1994);orban等人,proc.natl..acad.sci.,89,6861-6865(1992))。染色体序列的特异性缺失和重排也已经被工程化,并且目前有可能从λ载体中切除作为质粒的外源dna(参见,例如,barinaga,science.265,27-28(1994);sauer,methodsinenzvmol..225.890-900(1993);sauer等人,gene,70.331-341(1988);brunelli等人,yeast,,1309-1318(1993);invitrogen(sandiego,ca)1995catalog,35;clontech(paloalto,ca)1995/1996catalog,187-188)。已经产生了克隆方案,使得重组通过缺失或反转重组位点之间序列来重构或灭活功能性转录单位(参见,例如,odell等人,plantphvsiol..106.447-458(1994);gu等人,cell.73.1155-1164(1993);lakso等人,proc.natl.acad.sci..89.6232-6236(1992);fiering等人,proc.natl.acad.sci.90.8469-8473(1973);o'gorman等人,science.251,1351-55(1991);jung等人,science,259,984-987(1993))。
编码cre或flp重组酶的基因可以在组成型、诱导型或发育调节型启动子的控制下反式提供,或者已经引入了纯化的重组酶(参见,例如,baubonis等人,见上文;dang等人,develop.genet..13,367-375(1992);chou等人,genetics.131.643-653(1992);morris等人,nucleicacidsres..19.5895-5900(1991))。
在一些实施方案中,本文公开的基因组操作用来自kirilla.datsenko和barryl.wannerprocnatlacadsciusa.2000jun6;97(12):6640–6645的修饰的位点特异性重组方案进行。在一个实施方案中,敲除基因,例如trxa,可以如下进行。产生pcr扩增子,其包含两侧为两个frt位点和同源性延伸(h1和h2)的抗生素抗性基因,所述同源性延伸与待敲除基因的两端同源。在用该pcr产物转化细胞之后,通过在这些侧翼同源区中的red介导的重组,用抗生素抗性基因代替待敲除的基因。在选择之后,可以使用表达flp重组酶的辅助质粒消除抗性基因,所述辅助质粒作用于侧面有抗性基因的直接重复的frt(flp识别靶标)位点。red和flp辅助质粒可以通过在37℃生长而简单处理,因为它们是温度敏感的复制子。可以通过本领域技术人员众所周知的标准分子克隆技术进行敲入基因,如dsbc。
在一些实施方案中,使用crispr/cas系统进行基因的敲除。crispr/cas系统使用cas蛋白和至少一种至两种核糖核酸,其能够将cas蛋白引导至靶基因(例如gor)中的序列以去除基因。使用crispr/cas系统来消除基因表达的方法是众所周知的,并且描述在例如美国专利公开号2014/0170753中,其公开内容在此通过引用以其整体并入。
敲除靶基因的另外方法包括但不限于同源重组技术、效应物核酸酶的转录活化(转录激活因子样效应物核酸酶,talen)技术、锌指核酸酶(zinc-fingernuclease,zfn)。这些方法也是本领域众所周知的。
载体和启动子
编码目的蛋白、伴侣(例如,dsbc)或其它蛋白(例如,ahpc*)的核酸可以插入到可复制的载体中,以在合适的原核启动子的控制下在大肠杆菌中表达。许多载体可用于此目的,本领域技术人员可以容易地确定适当载体的选择。除了目的基因之外,载体通常包含以下中的一种或多种:信号序列、复制起点、一个或多个标志物基因和启动子。
可以使用的启动子可以是适于真核或原核宿主细胞的任何适当的启动子序列,其显示出转录活性,包括突变体、截短的和杂合的启动子,并且可以从编码细胞外或细胞内多肽的多核苷酸获得,所述多肽是细胞的内源性的(天然的)或异源性的(外来的)。启动子可以是组成型启动子或诱导型启动子。
在一些实施方案中,启动子是组成型启动子。用于实施本发明的合适的原核启动子包括但不限于pc0、pl59、mtl、parabad、lac、t3、t7、λpr'p1'、trp的启动子,spc核糖体蛋白操纵子启动子pspc,质粒pbr322的β-内酰胺酶基因启动子pbla,噬菌体λ的pl启动子,质粒pbr322的复制控制启动子prnai和prnaii,rrnb核糖体rna操纵子的p1和p2启动子,tet启动子和pacyc启动子。四环素调节的转录调节剂和cmv启动子描述在wo96/01313、美国专利第5,168,062号和第5,385,839号中,其全部公开内容通过引用并入本文。
在一些实施方案中,启动子在其可以产生的表达量方面可以具有不同的强度。启动子可以是中等强度启动子、弱强度启动子和强启动子。启动子的强度可以测量为在该启动子处启动的基因产物相对于合适对照的转录量。对于指导基因产物在表达构建体中表达的组成型启动子,合适的对照可以使用相同的表达构建体,不同之处在于使用“野生型”形式的启动子或来自“管家”基因的启动子来代替待测试的启动子。
在一些实施方案中,通过测量与对照启动子相比来自启动子的转录物的量来确定启动子强度。例如,含有具有待测试启动子的表达构建体的宿主细胞(“测试宿主细胞”)和含有对照表达构建体的对照宿主细胞可以一式两份在培养物中生长。可以提取宿主细胞和对照的总rna,并通过在260nm处的吸光度进行测量。然后可以由来自测试宿主细胞和对照宿主细胞的等量的总rna合成cdna。可以进行rt-pcr以扩增对应于从启动子产生的转录物的cdna。示例性方法描述在demey等人("promoterknock-in:anovelrationalmethodforthefinetuningofgenes",bmcbiotechnol2010mar24;10:26)中。
在一些实施方案中,各种转基因在不同强度的启动子的控制下在大肠杆菌中表达以确保重组蛋白,例如ahpc*蛋白和dsbc蛋白以适当的水平表达。这对于在细菌中维持氧化细胞质和建立替代的还原途径以确保存活、活力(生长速率)是有用的。在一个实施方案中,ahpc*基因由pc0启动子(中等强度启动子)控制。pl59启动子(弱启动子)和wtgsha启动子(中等强度启动子)都可以用于指导gsha基因的表达。在一些实施方案中,强启动子t7用于驱动目的蛋白的表达以确保最大产率。在一些实施方案中,大肠杆菌菌株在parabad启动子的控制下表达重组t7聚合酶,该启动子允许例如通过添加或不存在阿拉伯糖来紧密调节和控制目的蛋白。guzman等人,j.bacteriol.july1995177(14):4121-4130。
任选地,可以通过有限稀释来选择如本文所公开的携带所需修饰的大肠杆菌的克隆。任选地,可以对这些克隆进行测序以确认所需的突变存在于各种基因中,或者将所需的转基因,例如dsbc和ahpc*插入到基因组中。在一些情况下,可以进行全基因组测序以确定染色体中插入或突变的位置。
宿主细胞
本公开内容中的大肠杆菌菌株可以是本领域技术人员已知的任何大肠杆菌菌株。在一些实施方案中,大肠杆菌菌株是a(k-12)、b、c或d菌株。
测量酶促活性
在一些实施方案中,在一个或多个基因(例如,trxa)中引入的突变不会取消蛋白质表达或mrna表达,但导致缺乏相应野生型蛋白具有的活性(例如,trxa的硫氧还蛋白活性)的突变蛋白。本领域技术人员应理解,有时敲除基因不需要完全取消其活性,因此出于本公开内容的目的,缺乏活性意味着突变蛋白损失对照蛋白(例如野生型蛋白)的活性的85-100%。可以测试产生的各种突变蛋白以确认它们缺乏野生型蛋白的活性。例如,突变蛋白的每个编码序列可以分别在宿主菌株中表达,并且如下所述纯化突变蛋白并测试其活性。
确认硫氧还蛋白还原酶活性的损失
在一个实施方案中,硫氧还蛋白还原酶活性可以通过在nadph存在下其还原5,5-二硫代双(2-硝基苯甲酸)(dtnb)的活性来测量。通常,通过将dtnb与硫氧还蛋白还原酶(trxr)、硫氧还蛋白(trx)和nadph混合,并监测412nm处吸光度随时间的增加来开始反应。活性可以定义为吸光度增加的速率。检测硫氧还蛋白还原酶活性的实施方案公开于美国专利第8,592,468号中。
确认硫氧还蛋白活性的损失
用于测定硫氧还蛋白活性的方法也是众所周知的。在一个实施方案中,测定是胰岛素沉淀测定,如sung-jongjeon等人,europeanjournalofbiochemistry,第269卷,第22期,所述。已知硫氧还蛋白具有作为胰岛素的二硫化物还原酶的活性;胰岛素二硫键的还原可以通过由于游离胰岛素b链的沉淀而引起的浊度增加来测量。在一个说明性实例中,在不存在或存在重组蛋白的情况下,标准测定混合物含有0.1m磷酸钾(ph7.0)、1mmedta和0.13mm牛胰岛素,并且在加入1mm二硫苏糖醇时开始反应。在30℃监测650nm处的吸光度增加。
确认谷胱甘肽还原酶活性的损失
也可以监测ahpc*的谷胱甘肽还原酶活性或突变蛋白gor的谷胱甘肽还原酶活性的损失。在一些实施方案中,谷胱甘肽还原酶活性通过其还原半胱氨酸的活性来测量。例如,在辅因子存在下,将半胱氨酸与含有候选蛋白,例如,ahpc*或突变蛋白gor的还原溶液一起温育。优选地,辅因子是辅酶。优选地,辅因子是烟酰胺腺嘌呤二核苷酸磷酸(nadph)或烟酰胺腺嘌呤二核苷酸(nadh)。该反应将胱氨酸还原为半胱氨酸。示意性反应如下:
cys-cys+2gsh→2cys+gssg
gssg+nadph→2gsh+nadp+h
可以通过测量半胱氨酸的产生来测量活性。在一个特定实例中,就还原半胱氨酸而言的谷胱甘肽还原酶活性描述在wo2018114576中。
确认ahpc的过氧化还原酶活性的损失
ahpc*的过氧化还原酶活性的缺乏可以通过在nadh存在下将蛋白质与有机氢过氧化物或过氧化氢一起温育来确认。功能性过氧化还原酶将以nadh依赖性机制将这些底物转化成水;缺乏此类转化的证据表明缺乏过氧化还原酶活性。
确认大肠杆菌菌株的细胞溶质处于氧化状态
本文公开的大肠杆菌菌株含有氧化细胞质。这可以通过具有二硫键的蛋白质(例如在野生型大肠杆菌菌株中难以表达的lc)的生物活性来确认。在一些实施方案中,确认大肠杆菌具有氧化细胞质可以通过用编码通常含有至少一个二硫键的多肽(“测试”多肽)的基因转化细菌来进行。优选的测试多肽或蛋白质是通常从细胞分泌的那些或作为膜蛋白的那些。在一些情况下,这些多肽通过信号序列的缺失或突变而被修饰,使得蛋白质不会被输出到细胞的细胞质外。
作为一个说明性实例,可以将上述lc蛋白(例如抗muc1抗体轻链(seqidno:15))的编码序列工程改造成在合适启动子下的表达盒,并且转化到修饰的大肠杆菌菌株中。测量含有lc的可溶性蛋白级分。合适的大肠杆菌菌株将能够表达至少1mg/100ml的可溶性形式的lc。用于制备细菌裂解物和测量裂解物中蛋白质表达(例如lc的表达)的量的方法是众所周知的。在一些实施方案中,可以用裂解剂处理大肠杆菌细胞以产生裂解物。可以通过用酶如benzonase和蛋白溶菌酶处理裂解物来释放细胞质蛋白。不溶性蛋白级分可以通过例如离心从可溶性级分中分离。可以收集可溶性蛋白级分(含有lc)并通过sds-page分析。然后可以通过例如密度测定法定量可溶性蛋白级分中lc蛋白的量。分析lc表达的一个具体实例描述在实施例2中,其可以用于评估细胞溶质是否处于氧化状态。
确认表达
各种方法可以用于测定大肠杆菌中各种修饰基因的蛋白表达水平,和/或确认基因是否已被敲除或插入。例如,基因的表达可以通过常规northern印迹来确定,以定量mrna的转录。可以使用各种标记物,最常见的是放射性同位素。然而,也可以使用其它技术,如使用生物素修饰的核苷酸引入多核苷酸。然后,生物素充当结合亲和素或抗体的位点,所述亲和素或抗体可以用多种标记物(如放射性核素、荧光剂、酶等)标记。
在一些实施方案中,可以使用凝胶电泳(例如,page)、western分析或毛细管电泳(例如,caliperlabchip)来纯化和定量表达的蛋白质。无细胞翻译反应中的蛋白质合成可以通过掺入放射性标记的氨基酸(通常是35s-标记的甲硫氨酸或14c-标记的亮氨酸)来监测。放射性标记的蛋白质可以使分子大小可视化,并在电泳之后通过放射自显影进行定量,或者通过免疫沉淀分离。重组his标签的掺入提供了通过ni2+亲和柱层析纯化的另一种手段。来自表达系统的蛋白质产生可以测量为可溶性蛋白产率或通过使用酶促活性或结合活性的测定来测量。
在一些实施方案中,如果待定量的蛋白质具有确定的生物活性,例如酶促活性(如碱性磷酸酶)或生长抑制活性,则可以通过用适当的底物温育测定其活性来确认目的蛋白的表达。
本发明的试剂盒
本公开内容还提供了试剂盒,其包含本发明的宿主细胞和任选的生长培养基、编码目的蛋白的质粒、探针、抗体和/或使用说明书。在一些实施方案中,所述试剂盒还可以包含用于产生具有生物活性的或适当折叠的含二硫化物的蛋白质的一种或多种必需组分。
在一些实施方案中,所述试剂盒可以包含制备本发明的宿主细胞所必需的一种或多种试剂。此类试剂盒可以包含降低还原酶表达所必需的一种或多种试剂或者将突变引入宿主细胞的一种或多种还原酶所必需的试剂。试剂盒可以包含改善宿主细胞生长所必需的试剂,例如还原剂,或者任选包含在质粒中的编码改善生长的蛋白质的基因。
示例性实施方案
本公开内容包括以下非限制性实施方案:
1.大肠杆菌菌株,其中:
i)所述菌株缺乏由trxb编码的硫氧还蛋白还原酶活性;
ii)所述菌株缺乏由trxa编码的硫氧还蛋白1活性;
iii)所述菌株缺乏由gor编码的谷胱甘肽还原酶活性;
iv)所述菌株表达突变的ahpc蛋白,其中所述突变的ahpc蛋白具有谷胱甘肽还原酶活性;以及
v)所述菌株表达胞质原核二硫化物异构酶。
2.如实施方案1所述的大肠杆菌菌株,其中所述菌株还包含编码目的蛋白的基因。
3.如实施方案2所述的大肠杆菌菌株,其中所述目的蛋白选自:抗体、其片段或来自igg的抗体+轻链。
4.如实施方案1-3中任一项所述的大肠杆菌菌株,其中所述胞质二硫化物异构酶是dsbc。
5.如实施方案1-4中任一项所述的大肠杆菌菌株,其中所述大肠杆菌还表达重组脯氨酰异构酶和/或解聚酶。
6.如实施方案1-4中任一项所述的大肠杆菌菌株,其中所述脯氨酰异构酶选自亲环蛋白、fkbp、细小蛋白、slyd、tig、ycpr6;
并且其中所述解聚酶选自skp、groel、groes、dnak、dnaj和grpe。
7.如实施方案2-6中任一项所述的大肠杆菌菌株,其中编码所述目的蛋白的基因与组成型启动子可操作地连接。
8.如实施方案2-7中任一项所述的大肠杆菌菌株,其中编码所述目的蛋白的基因与t7启动子可操作地连接。
9.如实施方案1-8中任一项所述的大肠杆菌菌株,其中所述突变的ahpc基因的表达由pc0启动子控制。
10.如实施方案1-9中任一项所述的大肠杆菌菌株,其中所述胞质原核二硫化物异构酶的表达由mtl启动子控制。
11.如实施方案1-9中任一项所述的大肠杆菌菌株,其中所述大肠杆菌菌株是k-12菌株。
12.在大肠杆菌细菌菌株中表达可溶性重组目的蛋白的方法,其包括以下步骤:
a.在允许目的蛋白作为可溶性蛋白表达的条件下培养大肠杆菌细菌菌株,所述大肠杆菌细菌菌株包含氧化细胞溶质和用于表达目的蛋白的表达盒,其中所述菌株来源于野生型细菌菌株,所述野生型细菌菌株具有功能性硫氧还蛋白还原酶编码基因trxb;功能性硫氧还蛋白1编码基因trxa、功能性硫氧还蛋白2编码基因trxc;功能性谷胱甘肽还原酶基因(gor)和功能性ahpc基因,其中所述菌株进行如下遗传修饰:i)硫氧还蛋白还原酶编码基因trxb不是功能性的;ii)硫氧还蛋白1trxa不是功能性的;iii)谷胱甘肽还原酶基因(gor)不是功能性的;iv)ahpc基因,其已经被突变使得其具有谷胱甘肽还原酶活性;以及v)将编码胞质原核二硫化物异构酶的基因重组引入该细菌菌株。
13.如实施方案12所述的方法,其中所述大肠杆菌菌株在trxc中含有无效突变。
14.如实施方案12-13中任一项所述的方法,其中所述大肠杆菌菌株在trxb中含有无效突变。
15.如实施方案12-14中任一项所述的方法,其中所述大肠杆菌菌株在trxa中含有无效突变。
16.如实施方案12-15中任一项所述的方法,其中所述目的蛋白选自:igg、来自igg的轻链或来自igg的重链。
17.如实施方案12-16中任一项所述的方法,其中胞质二硫化物异构酶是dsbc或酵母蛋白二硫化物异构酶(ypdi)或人蛋白二硫化物异构酶(hpdi)。
18.如实施方案12-17中任一项所述的方法,其中所述大肠杆菌菌株还表达重组脯氨酰异构酶和/或重组解聚酶。
19.如权利要求18所述的方法,其中所述重组脯氨酰异构酶选自亲环蛋白、fkbp、细小蛋白、slyd、tig和ycpr6;以及所述解聚酶选自skp、groel、groes、dnak、dnaj和grpe。
20.如实施方案12-19中任一项所述的方法,其中编码所述目的蛋白的基因与组成型启动子可操作地连接。
21.如实施方案12-20中任一项所述的方法,其中编码所述目的蛋白的基因与t7启动子可操作地连接。
22.如实施方案16所述的方法,其中所述抗体轻链是抗her2抗体的轻链。
23.如实施方案12-22中任一项所述的方法或者如实施方案1-11中任一项所述的大肠杆菌菌株,其中所述大肠杆菌菌株表达由所述gsha基因编码的gsha。
24.如实施方案12-22中任一项所述的方法或者如实施方案1-11中任一项所述的大肠杆菌菌株,其中将所述gsha插入到trxb的基因座。
25.如实施方案12-22中任一项所述的方法或者如实施方案1-11中任一项所述的大肠杆菌菌株,其中所述大肠杆菌菌株还表达t7聚合酶。
26.如实施方案12-22中任一项所述的方法或者如实施方案1-11中任一项所述的大肠杆菌菌株,其中所述t7聚合酶在诱导型启动子的控制下。
27.如实施方案26所述的方法,其中所述诱导型启动子是parabad、lac、lacuv5phoa、teta、xylab、tac或鼠李糖启动子。
28.试剂盒,其包含实施方案1-11中任一项所述的大肠杆菌,其中所述试剂盒还包含生长培养基。
29.如实施方案27所述的试剂盒,其中所述试剂盒还包含编码目的蛋白的质粒。
实施例1:一般方法
所有的基因组操作、敲入和敲除用来自kirilla.datsenko和barryl.wannerprocnatlacadsciusa.2000jun6;97(12):6640–6645的改进的位点特异性重组方案进行。这些方法允许在特定位点发生交换,如整合要敲入的目的基因和从其中切除要敲除的基因。位点特异性重组涉及特异性的反向重复序列,例如cre-loxp系统。对于插入,整合盒由待插入的基因(例如dsbc(np_417369))组成,该基因与两侧是loxp位点的可选择标志物相邻。在整个盒撞上染色体之后,随后通过短暂暴露于cre重组酶来消除可选择标志物基因(这通过对编码cre重组酶的质粒进行电穿孔来实现),同时将目的基因整合到基因组中。对于敲除,缺失盒由两侧为loxp位点的可选择标志物组成。在盒撞上染色体之后,随后通过瞬时暴露于cre重组酶来消除可选择标志物基因,这通过对编码cre重组酶的质粒进行电穿孔来实现。
实施例2:snuggle菌株的产生
所有具有氧化细胞质的菌株的背景是s97。该菌株具有菌株kgk10中存在的所有突变(knappkg,goerkear和swartzj,biotechnolbioeng.2007jul1;97(4):901-8),其中开发了ompt敏感性rf1以促进无细胞蛋白质合成系统中的nnaa掺入(yin等人,scirep.2017jun8;7(1):3026.)。另外,该菌株具有t7rna聚合酶的染色体拷贝,其已经在parabad启动子的控制下进行染色体整合以紧密控制来自强t7启动子的蛋白质的表达。使用具有以下修改的基本上如ritz等人,science,2001中所述的平板测定法来检查如以下所述产生的所有菌株的活力。在染色体修饰之后将细胞直接铺板在富培养基平板(richmediaplate)上。
将5个另外的突变引入s97菌株中。这些突变负责产生小分子的替代还原途径,在不存在硫氧还蛋白还原酶或谷胱甘肽还原酶的情况下,其是活力所必需的。首先,通过敲入ahpc基因的突变变体ahpc*,将ahpc变体引入从该基因缺失tnaa基因座留下的frt重组酶疤痕中。在弱启动子pl57或中等强度启动子pc0的控制下测试该基因。如表2所示,与编码在残基36和37含有两个苯丙氨酸的野生型蛋白的野生型ahpc基因相比,ahpc*编码在该位置含有三个苯丙氨酸的突变蛋白。ahpc*突变蛋白失去了过氧化还原酶活性(如野生型ahpc蛋白所表现出的),但获得了谷胱甘肽还原酶活性。ahpcδ在该位置仅具有一个苯丙氨酸并且不编码功能性过氧化还原酶。据报道,ahpcδ突变体恢复了缺乏trxb和gor的大肠杆菌的突变体b菌株(“b菌株”)的生长。
其次,将先前从大肠杆菌的前体菌株中缺失的gsha基因敲入到以上在弱启动子pl59或中等强度wtgsha启动子下产生的突变菌株的trxb中。用任一启动子获得了可行的组合。这同时具有完成新的ahpc*-谷胱甘肽还原途径和消除硫氧还蛋白介导的途径的效果。我们预期这些蛋白的表达水平对于建立可行的替代还原途径将是重要的。
用具有pl59或wtgsha启动子的gsha敲入实现了可行的组合。然而,仅含有具有pc0启动子的ahpc*的细胞(如www.ncbi.nlm.nih.gov/pmc/articles/pmc1134079中所述)是存活的,表明该蛋白的较高水平是至关重要的,而较宽浓度范围的gsha对于生长是足够的。以上产生的该菌株含有三种不同的突变,ahpc*和gsha敲入和trxb敲除,其足以产生能够形成二硫化物的氧化细胞质。
第三,将无前导的dsbc基因敲入具有强的mtl启动子的染色体。无前导的dsbc蛋白缺乏分泌信号肽并且在细胞质中作为二硫化物异构酶起作用,这促进细胞质蛋白的天然二硫化物组装。因此,这样产生的具有这三种突变(即trxb敲除、dsbc敲入和ahpc*突变)的菌株(被称为“shuffle”)能够进行lc折叠组装。
尽管在其它报道中报道了产生高滴度的二硫化物键合的哺乳动物蛋白,但产生shuffle大肠杆菌所需的突变在本文不会导致高水平的lc产生。因此通过敲除硫氧还蛋白1(trxa)引入第四种突变以解决该问题。该突变产生了能够以高水平表达所有lc的所需lc菌株。缺乏这些修饰中的任一种的菌株不能产生大量的lc。具有所有五种突变的这种新菌株(表2中所示的“419”)称为“snuggle”,产生的产量高于用于产生二硫化物键合的蛋白的先前的“shuffle”菌株。考虑到trxa、trxb的主要还原酶已经被缺失,该结果是特别令人惊讶的,因此trxa不应作为细胞质还原酶起作用。
二硫键的形成和还原是受促氧化蛋白和小分子(如dsba和o2)以及促还原蛋白和小分子(如半胱氨酸和硫氧还蛋白)影响的动态过程。因此,难以说出需要给定蛋白的多少活性来产生给定的表型。也就是说,对于当存在trxb,trxa时或者当不存在dsbc时难以产生的lc,观察到显著较低的lc产生潜能。这种显著的差异表明,即使是少量的trxa或trxb活性也可能足以在某种程度上破坏细胞溶质的氧化还原环境和lc折叠。预期对于trxa或trxb,蛋白质表达或活性水平>内源性水平的25%将引起有害作用。对于ldsbc,lc折叠所需的细胞质浓度不太清楚,因为snuggle和shuffle使用不同的启动子来产生胞质dsbc。因为起到伴侣和二硫化物异构酶的作用,所以仍然可能需要该蛋白的过表达,其水平至少是snuggle中存在的水平的25%。
确认了如实施例2中所述产生的7种大肠杆菌菌株具有下表1中列出的表型:
表1:菌株表型
“+”表示如第一列所述的突变,存在相应的行。
用来自atum(newwark,california)的含有针对大肠杆菌表达进行了密码子优化的lc基因(muc1g09klc,7219lc或曲妥珠单抗lc)的质粒pj411转化每个菌株。在37℃下,使细胞在补充有40mg/l卡那霉素的terrificbroth(tb)(thermofisherscientific,waltham,ma)中生长过夜。第二天,将细胞以1:100稀释到含有卡那霉素的新鲜tb中,并在37℃下生长直至od为2.0。在那时,通过加入0.2%阿拉伯糖诱导细胞并将细胞移动至25℃。在过夜诱导之后,在早晨收获细胞。将细胞重悬于含有1μl/mlbenzonase核酸酶和10mg/ml蛋白溶菌酶的bper细菌裂解试剂(thermofisherscientific,waltham,ma)中以释放可溶性细胞质蛋白。将100μl的总细胞裂解物转移到新的管中,并通过在20,000×g下离心10分钟使细胞碎片和不溶性蛋白沉淀。将含有可溶性蛋白的上清液转移到新管中。然后将沉淀重悬并溶解在100μl1xlds样品缓冲液中。为了分析各级分中的lc,将10μl可溶性和不溶性蛋白质样品上样到nupagesds凝胶上并运行直至染料前沿在凝胶底部为止。将凝胶用simplybluesafestain染色,用水脱色,然后用bioradgeldocez成像。使用密度测定法确定凝胶强度和相对蛋白质定量。
图1a显示了表现差的lc(抗muc1抗体muc1g09klc的轻链)的表达谱。muc1g09klc也称为ht186-d11并且描述在thie等人,plosone,2011jan14;6(1):e15921中,相关公开内容通过引用并入本文。对于这些样品,可商购获得的shuffle菌株提供了可溶性蛋白的合理产生。不足为奇的是,所有具有还原细胞质的突变体或缺乏胞质dsbc的那些突变体不能产生合理滴度的lc。令人惊奇的是,具有与包括胞质dsbc和氧化细胞质在内的shuffle类似的基因型的sutro菌株突变体(s417)不能以合理的滴度表达该lc。然而,含有trxa的另外突变的s419使得lc产生的水平高于shuffle菌株,表明对该菌株进行的一系列改变使其成为lc产生的优良宿主。
图1b显示了在具有还原细胞质的前体sutro菌株的shuffle细胞和snuggle中制备的挑战性lc,7219lc的另一个实例。7219lc是抗cd74igg,如wo/2016/014434中所述的,其全部公开内容通过引用并入本文。对于这些样品,用以上方法仅分析了可溶性蛋白。同样,我们在具有还原细胞质的菌株中观察到非常少的lc表达,而snuggle菌株产生明显高于shuffle菌株的滴度。
图1c显示了在大肠杆菌中相对更容易产生的lc(曲妥珠单抗lc)的实例。对于该lc,无论宿主如何,都存在极好的可溶性表达。在这种情况下,lc不需要用于折叠或稳定性的二硫键。几乎没有lc最终变为不溶性级分。
实施例3:恢复δgor/trxb菌株生长的突变的ahpc
野生型ahpc蛋白是一种过氧化还原酶,在残基36和37处含有两个苯丙氨酸。参见表2中的最后一行。恢复基于k12的菌株生长的突变ahpc*显示在表2中的第三行。ahpc*突变菌株含有插入在残基36和37的两个苯丙氨酸之间的另外的苯丙氨酸残基。据报道恢复b菌株生长的ahpc突变体ahpcδ显示在中间。ahpc突变菌株仅具有一个苯丙氨酸,如表2所示;为方便起见,残基37显示为缺失,但原则上该缺失可以被分配给残基36或37。在产生snuggle菌株期间,将任一突变体引入gor和trxb缺失的大肠杆菌k12衍生细胞的染色体上。仅ahpc*突变体在这些细胞中恢复活力,这被认为是因为该菌株具有k12谱系。
表2
基于ahpc突变体将氧化型谷胱甘肽(gssg)转化为还原型谷胱甘肽(gsh)的能力来分析该ahpc突变体以确定其是否具有谷胱甘肽还原酶活性。方法描述在yamamoto等人,mol.cell.january18;29(1):36-45(2008)中。简而言之,将5μm纯化的ahpc突变蛋白与含有1mmgssg、0.5μm的蛋白质烷基氢过氧化物还原酶亚基f(ahpf)、10μm蛋白质谷氧还蛋白1(grxa)和0.8mmnadh的反应混合物一起温育。结果显示ahpc*突变体产生了游离的谷胱甘肽gsh,表明该突变体具有谷胱甘肽还原酶活性。缺乏该活性的wt蛋白和ahpcδ突变体不能从gssg产生gsh。
实施例4:重组lc在shuffle和snuggle大肠杆菌菌株中的表达
将编码四种不同lc(lc-1、lc-2、lc-3和lc-4)的质粒转化到shuffle大肠杆菌菌株(c3026j,newenglandbiosciences)和如实施例2中所述产生的snuggle大肠杆菌菌株中。这四种lc彼此共有78-92%的序列同一性。在37℃下在摇瓶中使细胞在tb中生长至od为1.5,并用0.1%阿拉伯糖(snuggle)或1%阿拉伯糖和1mmiptg(shuffle)诱导。蛋白质表达在25℃下进行16小时。通过在台式离心机中以21,000×g离心1ml发酵培养基10分钟来收获细胞。将所得沉淀重悬,并在含有50mg/l溶菌酶(l6876,sigmaaldrich)和25u/mlbenzonase(e1014,sigmaaldrich)的b-per细菌蛋白提取试剂(78248,thermofisher)中以10ml/g湿细胞重量的比率裂解。通过在台式离心机中以21,000×g离心10分钟去除不溶性材料。每孔用4μl所得裂解物运行还原性sdspage凝胶,并通过凝胶密度测定法确定考马斯染色的lc条带的相对表达。
如图2所示,与shuffle菌株相比,snuggle菌株在lc产量方面表现出20-110%的提高。
说明性序列
seqidno:1dsbc核酸序列
seqidno:2ahpc核酸序列
seqidno:3ahpc蛋白质序列
seqidno:4ahpc*核酸序列(为了在大肠杆菌中表达而密码子优化的)
atgagcctgatcaacacgaaaatcaagccgttcaagaaccaagctttcaaaaatggtgagttcatcgagattaccgagaaagataccgagggtcgttggagcgtgttcttcttcttttatccggcggactttacttttgtttgtcctaccgagctgggtgacgttgcggaccattatgaagaactgcagaaattgggcgtcgacgtttacgccgtcagcacggacacgcactttacgcacaaggcatggcactctagcagcgaaaccatcgcaaagatcaaatacgcaatgattggcgacccgacgggtgcactgacccgcaatttcgataacatgcgtgaagatgaaggcctggcggatcgtgcgaccttcgtcgtggacccgcagggtatcattcaggctatcgaagttaccgccgagggtattggtcgtgatgcgagcgatctgctgcgcaagattaaagccgcgcaatacgttgcatcccatccgggcgaagtgtgcccagccaagtggaaagagggcgaggcgaccctggcgccgagcctggacttggtgggtaagatt
seqidno:5ahpc*蛋白质序列
seqidno:6dsbc蛋白质序列(加下划线的是信号序列)
seqidno:7trxa核酸序列
seqidno:8trxa蛋白质序列
seqidno:9trxb核酸序列
seqidno:10trxb蛋白质序列
seqidno:11gor核酸序列
seqidno:12gor蛋白质序列
seqidno:13gsha核酸序列
seqidno:14gsha蛋白质序列
mipdvsqalawlekhpqalkgiqrgleretlrvnadgtlattghpealgsalthkwittdfaeallefitpvdgdiehmltfmrdlhrytarnmgdermwplsmpcyiaegqdielaqygtsntgrfktlyreglknrygalmqtisgvhynfslpmafwqakcgdisgadakekisagyfrvirnyyrfgwvipylfgaspaicssflqgkptslpfektecgmyylpyatslrlsdlgytnksqsnlgitfndlyeyvaglkqaiktpseeyakigiekdgkrlqinsnvlqienelyapirpkrvtrsgespsdallrggieyievrsldinpfspigvdeqqvrfldlfmvwcaladapemssselactrvnwnrvilegrkpgltlgigcetaqfplpqvgkdlfrdlkrvaqtldsinggeayqkvcdelvacfdnpdltfsarilrsmidtgiggtgkafaeayrnllreepleilreedfvaereaserrqqemeaadtepfavwlekha
seqidno:15抗muc抗体轻链(ht186-d11-lc)的氨基酸序列
qsvltqppsvsvapgktaritcggnnigsksvhwyqqkpgqapalviyygsnrpsgiperfsgsnsgntatltisrveagdeadyycqvwdsssdwvfgggtkltvl
- 还没有人留言评论。精彩留言会获得点赞!