用于高密度生物反应器培养中的膜气体转移的方法与流程
本发明总体上涉及生物工艺领域,例如,单克隆抗体或双特异性抗体或其它目的蛋白质的生物反应器细胞培养生产。本发明进一步涉及用于改善生物反应器细胞培养条件,以实现高密度细胞培养的方法和装置。更进一步,本发明涉及用于在生物反应器细胞培养中实现改善的气体交换条件,从而增加细胞培养密度和产物滴度的方法和装置。
背景技术:
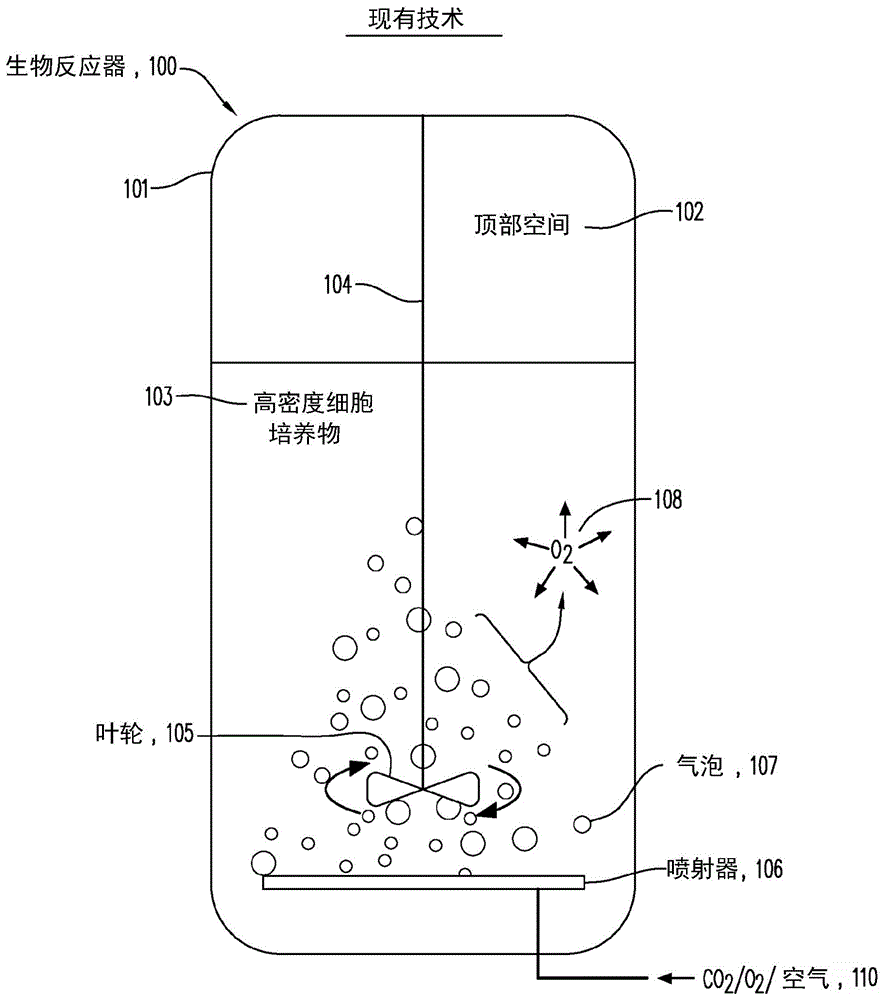
:最近的技术发展已允许细胞培养达到非常高的细胞密度,其导致生物制品例如单克隆抗体或双特异性抗体的高生产率。[1]然而,由于需要高水平的氧和二氧化碳转移来支持高密度培养,因此在这些生物工艺中的溶解氧(do)控制仍然是挑战性的。为了实现高水平的气体转移,采用了方法如微量喷射,其中将微米级的气泡释放到反应器内。[2]然而,微量喷射的使用可以增加气泡破裂相关的细胞死亡和生物反应器起泡的风险,其可能导致运行提前终止和产物损失。[3,4]进一步地,在极端情况下需要以可能对细胞有毒的水平添加消泡剂和剪切保护剂的添加,以防止起泡以及气泡破裂相关的细胞死亡[5]。为了消除与微量喷射相关的挑战,具有多孔膜和无孔膜的无气泡通气已就细胞培养应用进行研究。例如,具有微米级孔的聚合物多孔膜已在无气泡通气中进行描述,其中培养物和气体之间的压力平衡允许通过膜中的孔,在气液界面处的无气泡转移[6-8]。在另一个实例中,疏水膜(其避免了孔润湿的问题)的使用已证实了与亲水膜相比增强的气体转移,因为截留在孔内的液体对于向培养物的气体转移产生了另外的障碍。[9]无孔硅酮聚合物基膜(例如,聚二甲基硅氧烷,pdms)也已用于无气泡气体转移,其中气体分子扩散通过致密聚合物,并且在膜-培养物接触表面处转移至培养物。[10-12]尽管多孔膜和无孔膜已应用于细胞培养中,但由于膜设计中的局限性以及与膜操作相关的挑战,所以仅实现了低密度(即,<20e6个细胞/ml)。[13]例如,在多孔膜的情况下,如果气体和培养物的压力彼此不适当地平衡,则由于可能出现的微米级气泡的形成,细胞培养可能是受损的。相反,在无孔膜的情况下,气体分子从中穿过的质量转移很慢,从而阻止了足够的气体交换来支持高密度培养。为了克服与高密度细胞培养中基于喷射的气体交换过程相关的许多挑战,需要用于无气泡气体交换的替代方法和材料。技术实现要素:总体上,本发明涉及生物反应器以及使用生物反应器的生物工艺方法。本发明部分涉及以下令人惊讶的发现:通过用一个或多根中空纤维膜模块替换高密度细胞培养生物反应器的喷射器(例如,用于细胞培养物的氧合和/或将气体引入细胞培养物内),可以在高细胞密度(例如至少120x106个细胞/ml)下,实现持续水平的溶解氧(例如60%do),而不伴随在操作过程中对培养物健康的不利作用。结果,用于生物工艺中的细胞在工艺自始至终维持在活的状态下,从而增加了生物反应器的生产率。在一个方面,本公开内容提供了在生物反应器中培养细胞的方法,其包括提供进入/来自生物反应器的气体的质量转移,而不在生物反应器内部生成气泡。在某些实施方案中,生物反应器是灌注生物反应器。生物反应器也可以是分批补料生物反应器。在某些实施方案中,进入/来自生物反应器的气体的质量转移由气体转移模块提供。在各个实施方案中,气体转移模块包括无孔膜,其可以是例如聚合物、金属或陶瓷。聚合物可以包括硅酮橡胶均聚物、聚二甲基硅氧烷(pdms)或硅酮-聚碳酸酯共聚物。在各个实施方案中,无孔膜包括多根中空纤维。在各个实施方案中,气体转移模块包括穿过中空纤维、用于一种或多种气体的通过的第一流动路径,以及围绕中空纤维、用于细胞培养基和/或细胞的流动的第二流动路径。在其它实施方案中,气体转移模块位于生物反应器的外部。在某些实施方案中,多根中空纤维提供了用于培养基和细胞行进穿过分开中空纤维的空间的流动路径。空间可以是同质的或异质的。空间可以具有足够的尺寸,以允许细胞通过而不对细胞引起剪切力。在某些实施方案中,空间包含约15μm至约2000μm的距离。在某些其它实施方案中,空间包含15-30μm、20-40μm、30-60μm、40-80μm、60-120μm、80-160μm、100-200μm、150-300μm、200-400μm、200-500μm、200-600μm、200-700μm、200-800μm、200-900μm、200-1000μm、或500-2000μm或其组合的距离。在各个实施方案中,细胞培养基和/或细胞的流动包括切向流动、轴向流动或其组合。细胞培养基和/或细胞的流动可以是这样的速率,其足以维持培养物同质性而不对细胞引起剪切力。在各个实施方案中,气体可以是二氧化碳、氧或氮、或其它气体或甚至空气。在各个实施方案中,生物反应器包含以下的细胞密度:约20x106个细胞/ml、约30x106个细胞/ml、约40x106个细胞/ml、约50x106个细胞/ml、约60x106个细胞/ml、约70x106个细胞/ml、约80x106个细胞/ml、约90x106个细胞/ml、约100x106个细胞/ml、约110x106个细胞/ml、约120x106个细胞/ml、约130x106个细胞/ml、约140x106个细胞/ml、约150x106个细胞/ml、约160x106个细胞/ml、约170x106个细胞/ml、约180x106个细胞/ml、约190x106个细胞/ml、约200x106个细胞/ml、约210x106个细胞/ml、约220x106个细胞/ml、约230x106个细胞/ml、约240x106个细胞/ml、或约250x106个细胞/ml。在各个实施方案中,该方法避免了在细胞培养期间的泡沫产生和/或不需要消泡剂。在其它实施方案中,生物反应器不包含顶部空间或基本上不包含顶部空间。在各个实施方案中,生物反应器包括两个或更多个气体转移模块。两个或更多个气体转移模块可以提供不同气体包含氧、二氧化碳或氮气且甚至空气的质量转移。在另一个方面,本说明书提供了用于高密度细胞培养的生物反应器系统,其包括用于在细胞培养基中生长细胞的生物反应器器皿、以及与生物反应器器皿流体连通的液体流动路径,其中所述液体流动路径形成生物反应器器皿外部的回路,用于通过第一膜气体转移模块和第二膜气体转移模块将细胞培养基易位(translocate)。在各个实施方案中,第一膜气体转移模块用于将氧加入细胞培养基中。在其它实施方案中,第二膜气体转移模块用于从细胞培养基中脱除(strip)二氧化碳。在另外其它实施方案中,第一膜气体转移模块包括氧流动路径和细胞培养基流动路径,其中所述气体流动路径和细胞培养物流动路径通过透气膜分开。在另外其它实施方案中,第一膜气体转移模块包括空气/二氧化碳流动路径和细胞培养基流动路径,其中所述空气/二氧化碳流动路径和细胞培养物流动路径通过透气膜分开。本文所述的生物反应器的液体流动路径形成了回路,所述回路进一步包括一个或多个另外元件,其可以包括细胞收获过滤器、灌注泵、氧源、空气/二氧化碳源、氧传感器和/或ph传感器。在本文描述的生物反应器的各个实施方案中,高密度细胞培养的细胞为以下的密度:约20x106个细胞/ml、约30x106个细胞/ml、约40x106个细胞/ml、约50x106个细胞/ml、约60x106个细胞/ml、约70x106个细胞/ml、约80x106个细胞/ml、约90x106个细胞/ml、约100x106个细胞/ml、约110x106个细胞/ml、约120x106个细胞/ml、约130x106个细胞/ml、约140x106个细胞/ml、约150x106个细胞/ml、约160x106个细胞/ml、约170x106个细胞/ml、约180x106个细胞/ml、约190x106个细胞/ml、约200x106个细胞/ml、约210x106个细胞/ml、约220x106个细胞/ml、约230x106个细胞/ml、约240x106个细胞/ml、或约250x106个细胞/ml。在各个实施方案中,第一膜气体转移模块和第二膜气体转移模块向细胞培养基添加气体和/或去除来自细胞培养基的气体,而不形成气泡。在下文的描述中阐述了本公开内容的一个或多个实施方案的细节。根据下述附图和几个实施方案的详细描述以及所附权利要求,本公开内容的其它特征或优点将是显而易见的。附图说明下述附图构成本说明书的部分,并且被包括以进一步证实本公开内容的某些方面,通过参考与本文呈现的具体实施方案的详细描述组合的这些附图中的一个或多个,所述本公开内容的某些方面可以得到更好地理解。图1a提供了本领域中已知的生物反应器100的示意图,所述生物反应器100包括喷射器(或微量喷射器)106以及氧/空气/二氧化碳或其它气体源110,用于将气体转移至细胞培养物103。现有技术的生物反应器100在气体转移过程期间形成或产生气泡或微气泡107,其对培养物的细胞是有害的并且可以导致发泡,并且因此,导致低细胞密度和/或低细胞培养产物产率。图1b显示了本文公开的生物反应器的一个实施方案的示意图。在该实施方案中,改进的生物反应器300包括一个或多个位于外部的膜气体转移模块309,其通过泵312沿流动路径314来/往串联的生物反应器供给细胞培养物。第一膜气体转移模块309b具有进气口310b和排气口311b。第二膜气体转移模块309a也具有进气口310a和排气口311a。泵312使细胞培养物从生物反应器300沿流动路径314(即,再循环回路)移动通过第一膜气体转移模块309b,然后通过第二膜气体转移模块309a,允许细胞培养物与流经膜模块的气体相互作用,所述气体在进气口处引入并从排气口离开。气体通过穿过模块中的透气膜的通道与细胞培养物相互作用,所述膜将气体流动区带与细胞培养物流动路径分开。模块允许添加某些气体(例如氧)和/或从生物反应器细胞培养物中去除其它气体(例如co2),而无气泡的生成。一旦通过沿流动路径314的模块处理,细胞培养物就返回生物反应器300。图1b中所示的确切配置并不预期限制本文考虑的其它可能的配置。可以包括计算机控制器,以使对于膜的o2、co2、n2、空气或其它气流共混,以使溶解的o2和co2维持在生物反应器中的优选浓度下。图1c显示了典型的2升(2l)工作体积的玻璃搅拌槽生物反应器系统400,其具有tff再循环回路(409和411),所述tff再循环回路含有泵415、过滤器(410)和气泡较少的膜气体转移模块(412),以替换用于高密度培养的微量喷射器。计算机控制器(405和407)调节对于膜412的o2气流401,以维持溶液中的溶解o2。二氧化碳(402)和空气(403)流可以直接供给生长器皿408。ph传感器404与co2流连通,所述co2流调控细胞培养物的ph水平。在操作中,细胞培养物通过灌注泵415通过流1(409)取出,并且通过过滤器410(tff模块)供给并任选地收获。该流的一部分可以离开过滤器410,并且经由流2(411)返回细胞培养器皿。该流的第二部分可以离开过滤器410,并且进入膜气体转移模块412,在其中它可以通过与氧流401的相互作用而被氧合,所述氧流401可以任选地与空气(403)共混。二氧化碳可以通过出口414脱除出来。二氧化碳也可以通过顶部空间出口413被释放。图1d显示了2升(2l)无气泡的高密度生物反应器系统500,其包括tff再循环回路(509和511流动路径)、tff过滤器510、泵515以及一系列膜气体转移模块(512a和512b),用于向高密度细胞培养物添加和减去气体,而不添加气泡。第一模块512a作用于使细胞培养基氧合,以维持持续的溶解氧(“do”)含量或优选浓度。第一模块512a由氧流503供应。细胞培养物中的氧水平由溶解氧传感器505测量。第二膜气体转移模块512b作用于从细胞培养物中脱除二氧化碳。第二膜气体转移模块512b由空气流501(其含有用于二氧化碳脱除所需的氮气)和二氧化碳流502供应。然后通过ph传感器504和计算机506控制流501和502的水平。图1e显示了可以与本发明的改进的生物反应器结合使用的膜气体转移模块600的一般示意图。作为一般但非限制性的配置,膜模块可以包括具有透气性中空纤维管609的中空纤维束601,所述中空纤维管609由灌封件或密封件603(未示出)固定在一起。然后封装在外壳或壳体605(未示出)内,并且在每一端处装配有入口帽604,以允许一种或多种气流通过每根中空纤维的内部引入。外壳还可以包括用于细胞培养物的流动路径的一个或多个入口/出口端口(605、608),所述细胞培养物在一个端口中进入,在中空纤维周围的空间中流经外壳,然后离开出口端口。外壳还可以包括一个或多个入口/出口端口(606、607),用于一种或多种气流穿过每根透气性中空纤维管的内腔。在实践中,细胞培养物的流动路径被泵入外壳上的入口605内,并且通过围绕中空纤维束的每根中空纤维的外部空间流经外壳,并且通过出口端口608离开。虽然在外壳内部,但细胞培养物与中空纤维束的透气膜接触,所述中空纤维束在腔空间中携带一或多种气流。使用中,气体的“进料”混合物可以通过入口端口进入并且流入中空纤维609的内部内。气体从中空纤维的内部通过透气膜壁610转移到细胞培养物流动路径(其位于中空纤维的外部)内。穿过膜的气体是“渗透物”,而保留在中空纤维内部的气体是“渗余物”。图2显示了可以与本文所述的改进的生物反应器结合使用的膜气体转移模块800的一个实施方案。该模块包括用于接受细胞培养基的“壳体侧面向内的”入口801,所述细胞培养基然后在中空纤维束的每根中空纤维周围的空间中,穿过外壳或壳体各处。培养基最终通过“壳体侧面向外的”出口端口802离开外壳。在这个实例中,存在两个出口端口;然而,可以使用任何数目的出口端口。该模块还包括一个或多个“管(腔)侧面向内的”入口端口804,用于接受一种或多种气体或气体混合物,并且其进入中空纤维束的每根中空纤维的腔或内部空间内。然后,气体穿过中空纤维的长度,并且从一个或多个“管(腔)侧面向外的”出口端口803离开。这种配置建立了在中空纤维腔的内部空间中的“气体流动区带”,以及“培养基或细胞培养物流动区带”,其是局限在壳体或外壳内但在中空纤维外部的空间。气体流动区带中的气体可能渗透膜,从而转移到培养基流动区带内。可替代地,溶解的气体(例如,co2)可能渗透中空纤维膜,从而转移到气体流动区带内,并且通过气体出口端口作为“废气”离开模块。图3a、3b和3c显示了典型的膜气体转移模块中的气体(用“*”标记的箭头)和细胞培养基(用“**”标记的箭头)的流动路径的各种配置。用“x”标记的端口被阻断。与给出相同流速的图3a和图3b的配置相比,气体转移效率在图3c的配置中是最高的。图3d中所示的表提供了对于通过膜气体转移模块的氧转移测量的示例性的kla(液相质量转移系数),所述膜气体转移模块具有2500cm2表面积用于气体转移。图3a和图3c中的流动路径中的限制阻止了实现大于0.5lpm(升/分钟)的流量的能力。替代的膜尺寸可以用于不同的kla,以支持更大或更小的生物反应器。图4a-4c显示了例如使用图1b、图1c或图1d的生物反应器系统,用膜气体交换替换微量喷射器,在稳态至非稳态操作下培养的有专利权的cho细胞系(cho1)的活细胞密度(vcd)、活力和ldh。图4a显示了在具有喷射器的灌注培养中实现了40e6个细胞/ml的稳态vcd。在稳态操作四天后,关闭反应器之一的微量喷射器,并且通过膜添加o2,以将所需的do(溶解氧)维持在设定点(*)下,并且在稳态下操作三天。在稳态操作后,降低细胞流出(**),并且使用通过膜供应的o2实现120e6个细胞的密度,以控制do。图4b显示了在培养过程期间,使用膜和传统喷射的活力百分比是可比较的。图4c显示了用膜气体交换操作的生物反应器的ldh(乳酸脱氢酶活性测定),与用传统喷射操作的生物反应器的ldh相匹配。在第13天后,关于膜培养物的ldh中的增加可能归于增加的细胞密度。图5a-5c显示了例如使用图1b、图1c或图1d的生物反应器系统,在稳态和非稳态操作期间,在具有膜气体交换的培养过程中的do(溶解氧)水平。图5a显示了在升至稳态密度的过程中建立的基线do概况。微量喷射在第1-2天(*)开始,并且到第2-3天达到40e6个细胞/ml的密度时稳定。图5b显示了在第7天(*)时,将o2管线切换至膜。通过调整增益和积分(*至**)来控制波动,并且通过钻孔喷射器喷射空气(0.25lpm)和o2(0.25lpm)的混合物而不是0.5lpmo2,使得do中的波动进一步稳定,因为膜为培养物提供了太多的氧(**)。图5c显示了,细胞流出在第11天时降低并且密度增加至120e6个细胞/ml。do中的波动可能通过纤维和气体出口通风口过滤器的润湿引起,在操作期间造成气体转移的阻塞和丧失。图6a-6c显示了例如使用图1b、图1c或图1d的生物反应器系统,在升至高细胞密度的过程中,培养的cho1细胞的vcd(活细胞密度)、活力百分比和ldh(乳酸脱氢酶活性测定)。图6a显示了,在用传统喷射升至高细胞密度的过程中,达到了~130e6个细胞/ml的密度,而用膜气体交换达到了~100x106个细胞/ml的密度。来自膜的剪切可能在升至高密度的过程中影响培养物健康。图6b显示了,在培养过程期间,细胞对于膜和喷射器通气两者具有可比较的活力(>85%)。图6c显示了,ldh对于膜气体交换和传统喷射两者是可比较的。由于较高的细胞密度,对于具有传统喷射的培养物,预计更高的ldh,其指示了膜交换器可能在操作过程中引起对细胞的剪切和损害。图7a-7c显示了使用图1b、图1c或图1d的生物反应器系统,在升至高细胞密度的过程中的do控制。图7a显示了,最初,通过钻孔喷射器用喷射来控制do。随着密度增加,另外的o2通过膜发送,以将do维持在60%(*)下。mfc故障导致在膜启动阶段过程中的广泛波动和控制do的问题。一旦恢复对mfc的控制,do就围绕设定点波动,最终在第6-7天达到在80e6个细胞/ml左右的细胞密度下的稳态操作。图7b显示了在峰值密度下,通过膜的do控制保持稳定,伴随在暂时的mfc故障期间发生的一些波动。图7c显示了在整个培养期过程中离线监测的每日po2读数,证实了用喷射或膜气体交换控制的培养物中的溶解氧的可比较水平。图8a-8c显示了例如使用图1b、图1c或图1d的生物反应器系统,在用无气泡通气的膜操作的生物反应器中,培养的cho2细胞的vcd(活细胞密度)、活力百分比和ldh(乳酸脱氢酶活性测定)。图8a显示了培养数周达到25-30e6个细胞/ml的活细胞密度。膜培养需要额外的一天,以达到稳态操作密度,其指示了可能存在膜对培养物健康的一些作用。图8b显示了膜培养物的活力与传统的喷射可比较,但略微更低,其进一步指示了膜对细胞的作用。图8c显示了膜培养物的ldh高于气泡喷射的生物反应器,其指示了由于当前膜单元设计中的密集包装纤维,可能发生细胞剪切和裂解。图9a-9b显示了例如使用图1b、图1c或图1d的生物反应器系统,通过硅酮基膜用无气泡气体交换的do(溶解氧)控制。图9a显示了在培养期间控制在60%左右的do,支持了25-30e6个细胞/ml的cho2密度。在第7天时,增加再循环以支持在高细胞密度(*)下的氧需求。在第9天时,将控制切换为手动,用于更好地控制do(**)中的波动。图9b显示了在整个培养期过程中离线监测的每日po2和pco2读数,其证实了在用喷射或膜气体交换控制的培养物中的溶解氧的可比较水平。注意到,在第6天pco2中的增加很可能是由于对于两个膜的100%纯o2流。为了解决高pco2,通过第一个喷射器将空气与o2混合,并且使pco2恢复到与喷射器培养物可比较的水平。图10显示了与图1a的现有技术生物反应器相比,用配制为具有100l体积、充满65l水的图1b、图1c或图1d的生物反应器系统,关于o2转移的初始测试。与内置的喷射器系统相比,用基于膜的生物反应器观察到更快速的气体转移。图11显示了泵速度对于由图3c所示的流动路径更高,以实现由图3b所示的流动路径中运行的类似流速,其指示了流动路径c中的限制(上图)。这些限制导致在流动路径c中观察到较高的压力(下图)。具体实施方式氧的提供是细胞需氧代谢过程中的关键因素,因为它是能量合成过程中的主要电子受体。确保溶解氧的有效供应是细胞培养生物反应器操作面临的最大挑战,并且特别是对于商业生产场景中常见的高密度细胞培养生物过程,例如单克隆抗体或双特异性抗体的临床生产。除向细胞供应氧之外,溶解二氧化碳的浓度也起着控制变量的作用。存在两种常规的通气方法:对生物反应器的顶部空间进行通气和通过通气环直接注入气体。取决于它们的气体开口孔径,此类装置更普遍地被称为“喷射器”或“微量喷射器”。喷射器包括钻孔或开管喷射器通常具有例如0.8mm的气体出口开口,而一般由烧结塑料或金属制成的微量喷射器具有例如15至45μm的孔径。这两种均具有特异性优点和缺点。喷射器产生较大的气泡,这意味着需要更高的气体通过率来实现相同的“氧转移速率”。然而,当气泡穿过细胞培养物时,通过对细胞引入剪切力,喷射器可以导致气泡诱导的细胞毒性。然而,喷射器的一个优点在于,由于其较大尺寸的气泡,它们适合于脱除或清除co2。微量喷射器主要开发为通过降低引入细胞培养物内的气泡大小,来改善对培养物的气体转移。然而,由于微气泡与细胞培养物中的蛋白质相互作用,微量喷射器趋于产生发泡,其可以导致运行提前终止和产物损失。与喷射器相似,由微量喷射器生成的微气泡也对培养中的细胞引起剪切力。特别地,这些剪切力由于在细胞附近的气泡破裂而生成,其可以导致膜损害和细胞死亡。本发明部分涉及以下令人惊讶的发现:在高密度细胞培养生物反应器的背景下,通过用一个或多根中空纤维膜模块替换喷射器或微量喷射器,可以在高细胞密度下,实现持续水平的溶解氧,而不伴随在操作过程中对培养物健康的不利作用。相应地,本发明涉及使用改进的生物反应器以用于细胞培养的改进的生物工艺系统和方法,例如用于生产单克隆抗体或双特异性抗体的分批补料或灌注生物反应器细胞培养系统,所述生物反应器被修饰为包括一个或多个膜气体转移模块代替基于喷射器或微量喷射器的通气系统,以即使在高细胞密度下,也更好地调控生物反应器细胞培养物中的关键气体水平,例如,o2和co2的溶解水平,而不使细胞经受剪切和气泡破裂相关的细胞死亡。本文的实施例和附图以及下文描述中提供了非限制性方面和实施方案。定义除非另外定义,否则本文使用的所有技术和科学术语都具有本发明所属领域的普通技术人员通常理解的含义。下述参考文献为本发明所属领域的技术人员提供了本发明中使用的许多术语的一般定义:singleton等人,dictionaryofmicrobiologyandmolecularbiology(第2版,1994);thecambridgedictionaryofscienceandtechnology(walker编辑,1988);hale&marham,theharpercollinsdictionaryofbiology(1991);和lackie等人,thedictionaryofcell&molecularbiology(第3版,1999);以及cellularandmolecularimmunology,编辑,abbas,lichtman和pober,第2版,w.b.saunderscompany。为了本发明的目的,进一步定义了下述术语。如本文和权利要求中使用的,单数形式的“一个”、“一种”和“该/所述”包括单数和复数所指物,除非上下文另有明确指示。因此,例如,对“试剂”的提及包括单个试剂和多个此类试剂。应注意,在本公开内容中,且特别是在权利要求和/或段落中,术语如“包含(comprises)”、“包含(comprised)”、“包含(comprising)”等等可以具有美国专利法中归于其的含义;例如,它们可以意指“包括(includes)”、“包括(included)”、“包括(including)”等等;并且术语如“基本上由……组成(consistingessentiallyof)”和“基本上由……组成(consistsessentiallyof)”具有美国专利法中归于其的含义,例如,它们允许未明确叙述的要素,但排除了现有技术中发现的或者影响本发明的基础或新颖特性的要素。如在“获得孢子相关蛋白质”中的术语“获得”,预期包括购买、合成或以其它方式获取孢子相关蛋白质(或者所示物质或材料)。“分离的细胞”指已与组织或哺乳动物中天然伴随分离的细胞的其它组分和/或细胞分开的细胞。如本文使用的,“样品”指包含生物材料的组合物,例如(但不限于)生物反应器细胞培养样品。“细胞培养”或“培养”意指细胞在多细胞生物或组织外部的生长和繁殖。用于哺乳动物细胞的合适培养条件是本领域已知的。参见例如,animalcellculture:apracticalapproach,d.rickwood,编辑,oxforduniversitypress,newyork(1992)。哺乳动物细胞可以悬浮培养或在附着至固体基质时进行培养。可以使用具有或不具有微载体的流化床生物反应器、中空纤维生物反应器、滚瓶、摇瓶或搅拌槽生物反应器。在一个实施方案中,使用500l至2000l生物反应器。在一个优选的实施方案中,使用1000l至2000l生物反应器。为了本发明的目的,细胞培养基是在体外细胞培养中,适合于动物细胞例如哺乳动物细胞生长的培养基。细胞培养基制剂是本领域众所周知的。通常,细胞培养基包含缓冲液、盐、碳水化合物、氨基酸、维生素和微量必需元素。“无血清”适用于不含动物血清如胎牛血清的细胞培养基。各种组织培养基,包括成分确定的培养基,是商购可得的,例如,尤其可以使用下述细胞培养基中的任何一种或组合:rpmi-1640培养基、rpmi-1641培养基、达尔贝科改良伊格尔培养基(dmem)、最低基础培养基eagle、f-12k培养基、ham的f12培养基、伊斯科夫改良达尔贝科培养基、mccoy的5a培养基、leibovitz的l-15培养基、以及无血清培养基例如ex-celltm300系列(jrhbiosciences,lenexa,kansas)。此类培养基的无血清版本也是可获得的。细胞培养基可以补充有另外或增加浓度的组分,例如氨基酸、盐、糖、维生素、激素、生长因子、缓冲液、抗生素、脂质、微量元素等等,取决于待培养细胞的要求和/或所需的细胞培养参数。如本文使用的,短语“低密度细胞培养”指细胞浓度小于20x106个细胞/ml的细胞培养。如本文使用的,短语“高密度细胞培养”指细胞浓度等于或大于20x106个细胞/ml的细胞培养物。高密度细胞培养包括细胞浓度为以下的细胞培养:约25x106个细胞/ml、约35x106个细胞/ml、约45x106个细胞/ml、约55x106个细胞/ml、约65x106个细胞/ml、约75x106个细胞/ml、约85x106个细胞/ml、约95x106个细胞/ml、约100x106个细胞/ml、约110x106个细胞/ml、约120x106个细胞/ml、约130x106个细胞/ml、约140x106个细胞/ml、约150x106个细胞/ml、约160x106个细胞/ml、约170x106个细胞/ml、约180x106个细胞/ml、约190x106个细胞/ml、约200x106个细胞/ml、约210x106个细胞/ml、约220x106个细胞/ml、约230x106个细胞/ml、约240x106个细胞/ml、约250x106个细胞/ml、约260x106个细胞/ml、约270x106个细胞/ml、约280x106个细胞/ml、约290x106个细胞/ml和约300x106个细胞/ml。生物反应器本文所述的改进的生物反应器可以衍生自已知的生物反应器系统,且特别是包括用于进行培养物通气的喷射器或微量喷射器系统的生物反应器。生物反应器通常用于生物工艺中。如本文使用的,“生物反应器”可以指支持生物活性环境的任何制造或改造的装置或系统。在一种情况下,生物反应器是在其中进行化学过程的器皿,所述化学过程涉及生物或衍生自此类生物的生物化学活性物质。该过程可以是需氧的或厌氧的。这些生物反应器通常是圆柱形的,大小范围从升到立方米,并且经常由不锈钢或其它材料制成。生物反应器还可以指在细胞培养的背景下,意欲使细胞或组织生长的装置或系统,其目的经常是产生所需的生物产生的产物,例如单克隆抗体或双特异性抗体。“生物工艺”指涉及生长培养基中的细胞的需氧和厌氧过程,其中细胞(天然地或通过基因工程)产生一种或多种有用的生物产物或物质,包括例如单克隆抗体、双特异性抗体和酶。生物过程的实例包括酵母发酵、细菌发酵、哺乳动物细胞培养、细菌培养、以及使用细胞例如使用哺乳动物细胞例如cho细胞来表达蛋白质例如治疗性蛋白质或酶的产物生产。生物反应器一般包括在其中进行生物过程的器皿,以及允许监测和控制过程的参数的传感器和过程控制。生物反应器通常还包括搅拌器,例如rushton或船用叶轮,其在生物工艺过程中混合器皿内容物。一般重要的是在生物工艺过程中小心地控制工艺参数,例如气体流速、温度、ph、溶解氧水平、以及搅动速度和条件。溶解氧水平是氧从气相转移到液相的量度,其对许多生物过程是重要的,并且可能难以实现。虽然一般通过搅动来帮助氧转移,但搅动速度经常受功率消耗以及在一些情况下损害微生物的风险的限制。在一些情况下,例如在哺乳动物细胞的情况下,微生物是脆弱的,并且可能对热、剪切和/或其它工艺条件敏感。本文使用的生物反应器可以是永久的(例如,不锈钢或玻璃生物反应器)或一次性的(例如,塑料烧瓶或塑料袋)。适用于本发明的反应器的实例包括但不限于搅拌槽器皿、气体提升器皿和一次性袋,其可以通过摇动、振荡运动或搅拌进行混合。优选地,使用一次性(生物)反应器,因为它们是有利的,因为它们需要相对较低的投资成本,具有很大的操作灵活性、较短的周转时间并且可容易地对工艺进行配置。一次性(生物)反应器是商购可得的。还可以基于目的生物过程类型,来选择可以在本发明中使用的生物反应器。例如,哺乳动物细胞的生物工艺通常以三种主要形式发生:分批培养、补料分批培养和灌注培养。分批培养,一种不连续的方法,其中细胞在固定体积的培养基中生长较短的时间段,随后为完全收获。使用分批方法生长的培养物经历细胞密度中的增加,直到达到最大细胞密度,随后为随着培养基组分消耗和代谢副产物(如乳酸盐和氨)的水平累积,活细胞密度中的下降。收获通常在达到最大细胞密度(例如,通常为5-10x106个细胞/ml,取决于培养基制剂、细胞系等)时发生。分批生物过程是最简单的培养方法,然而,活细胞密度受营养素利用率的限制,并且一旦细胞处于最大密度下,培养物下降,且生产减少。无法延长生产阶段,因为废产物的累积和营养素消耗快速导致培养物下降(例如,通常在3至7天左右)。通过提供大剂量或连续培养基进料来补充已消耗的那些培养基组分,补料分批培养改善了分批工艺。由于补料分批培养在运行自始至终接受另外的营养素,因此当与分批方法相比时,它们具有实现更高的细胞密度(>20x106个细胞/ml,取决于培养基制剂、细胞系等)、以及增加的产物滴度的潜力。与分批工艺不同,可以通过操纵进料策略和培养基制剂来产生且维持双相培养,以区分实现所需细胞密度的细胞增殖时期(生长阶段)与悬浮或缓慢细胞生长的时期(生产阶段)。像这样,与分批培养相比,补料分批培养具有实现更高产物滴度的潜力。通常,在生长阶段过程中使用分批方法,且在生产阶段过程中使用补料分批方法,但在整个工艺自始至终可以使用补料分批供给策略。然而,与分批工艺不同,生物反应器的体积是限制进料量的限制因素。同样,与分批方法一样,代谢副产物的累积导致培养物下降,其限制了生产阶段的持续时间,约1.5至3周。补料分批培养是不连续的,并且收获通常在代谢副产物水平或培养物活力达到预定水平时发生。通过添加新鲜培养基并同时去除耗尽培养基,灌注方法提供了超过分批和补料分批方法的潜在改进。典型的大规模商业细胞培养策略努力达到高细胞密度(大于20e106个细胞/ml),其中反应器体积的近三分之一至一半以上是生物量。使用灌注培养,已达到了>1x108个细胞/ml的极限细胞密度,且预测了甚至更高的密度。典型的灌注培养始于持续一或两天的分批培养启动,随后向培养物中连续、逐步和/或间歇添加新鲜的进料培养基,且同时去除耗尽培养基,伴随在培养的生长和生产阶段自始至终,细胞和另外的高分子量化合物如蛋白质(基于过滤器的分子量截断)的保留。各种方法例如沉降、离心或过滤可以用于去除耗尽培养基,同时维持细胞密度。已报告了每天工作体积的一小部分到每天许多个工作体积的灌注流速。灌注工艺的一个优点在于,与分批或补料分批培养方法相比,生产培养可以维持更长的时期。然而,增加的培养基制备、使用、贮存和处置对于支持长期灌注培养是必要的,特别是具有高细胞密度的那些培养,其还需要甚至更多的营养素,并且与分批和补料分批方法相比,所有这些都使生产成本甚至更高。另外,较高的细胞密度可以引起在生产过程中的问题,例如维持溶解氧水平以及增加的除气问题,包括供应更多的氧和去除更多的二氧化碳,其导致更多的发泡以及更改消泡策略的需要;以及在收获和下游加工过程中的问题,其中去除过量细胞材料所需的努力可以导致产物损失,抵消了由于细胞团块增加的滴度增加的益处。本发明涉及改进的生物反应器,包括上文指出的任何类型的生物反应器,其中喷射器/微量喷射器被替换为本文所述的一个或多个膜气体转移模块。本发明部分涉及以下令人惊讶的发现:在高密度细胞培养生物反应器的背景下,通过用一个或多根中空纤维膜模块替换喷射器或微量喷射器,无论是在生物反应器本身内还是在其外部,都可以在高细胞密度下,实现持续水平的溶解氧,而不伴随在操作过程中对培养物健康的不利作用。相应地,本发明涉及使用改进的生物反应器用于细胞培养的改进的生物工艺系统和方法,例如用于生产单克隆抗体或双特异性抗体的分批补料或灌注生物反应器细胞培养系统,所述生物反应器被修饰为包括一个或多个膜气体转移模块代替基于喷射器或微量喷射器的通气系统,以即使在高细胞密度下,也更好调控生物反应器细胞培养物中的关键气体水平,例如,o2和co2的溶解水平,而不使细胞经受气泡破裂相关的细胞死亡。一般而言,本发明的生物反应器可以包括生物过程在其中发生的器皿。器皿,例如图1a的器皿101或图1b的302,一般是可高压灭菌的惰性材料,例如玻璃、塑料或不锈钢,并且可能是加套或不加套的。在一些情况下,器皿可能是相对较小的体积,例如,小于约0.5l、或1l、或2l、或4l、或10l、或20l、或40l、或100l。在其它情况下,器皿可能是相对较大的体积,例如,大于100l、或200l、或300l、或500l、或1000l、或5,000l、或10,000l、或30,000l。合适的小体积器皿可以具有例如约0.5l至5l的总容量,例如0.5l、1l、2l、4l、10l、20l、40l或50l。例如,器皿的总容量可以是75l、150l、300l、500l、1000l、1500l、3000l或5000l。器皿具有例如约0.5:1至约4:1、或约0.5:1至2:1,例如约0.5:1至1:1的长宽比(直径:高度)可能是优选的。本发明考虑使用任何合适的生物反应器的体积或长宽比,并且它并不限于上文指出的那些。轴(例如,图1a的轴104)延伸到器皿内,并且叶轮(例如,图1a的叶轮104)安装在轴的远端处。如下文详细讨论的,叶轮在器皿中的液体(例如细胞培养基)中产生循环流,如通过叶轮周围的箭头所示。一般而言,轴由电动机驱动。生物反应器可以包括任何其它所需的生物反应器部件和特征,包括泵、用于替换生长培养基的容器、用于营养素的容器、收集或收获模块(例如图1b的收获模块313)、以及气体源或多重气体源,以及适当的阀门、配管和混合装置。本文考虑的生物反应器还可以包括用于监测这些参数的溶解氧探针、溶解二氧化碳探针、ph探针和氧化还原(orp)探针(参见图1c和1d)、以及用于取样或收获器皿内容物的取样探针。还可以提供冷凝器用于挥发物的冷凝。本文考虑的生物反应器一般包括控制器,其被配置为通过接受来自各种监测装置(例如,图1c和1d中所示的探针)的信号,并且基于该数据调整工艺参数,来控制工艺参数。控制器可以是例如具有操作员界面的可编程逻辑控制器(plc)。控制器可以任选地被配置为控制多重器皿。在一些实施方案中,气体递送是通过叶轮的轴。例如,轴可以包括气体通过其递送的孔、以及气体通过其进入器皿内的一个或多个孔口。本文考虑的生物反应器还可以包括许多其它特征,以增强生物工艺。例如,器皿可以例如用水套或其它冷却/加热系统进行冷却(或加热),以维持所需的工艺温度。器皿也可以用任何合适的加热系统,包括配置在生长器皿外部或放置在生长器皿内的加热系统进行加热。可以提供泡沫检测器,并且可以包括消泡剂递送系统,以在发生过量发泡时将消泡剂递送到器皿。在一些实施方案中,生物反应器例如用自动蒸汽注入系统可原位灭菌。可以在器皿中提供各种接入端口。本文考虑的生物反应器还可以包括一个或多个膜气体转移模块,其可以位于生物反应器器皿内,或位于器皿外部,但与细胞培养基的流动路径连通。例如,图1b的流动路径314提供了用于气体交换的两模块系统(309a和309b)。图1b中显示了一个实施方案。图1b显示了本文公开的生物反应器的一个实施方案的示意图。在该实施方案中,改进的生物反应器300包括一个或多个位于外部的膜气体转移模块309,其通过泵312沿流动路径314来/往串联的生物反应器供给细胞培养物。第一膜气体转移模块309b具有进气口310b和排气口311b。第二膜气体转移模块309a也具有进气口310a和排气口311a。泵312使细胞培养物从生物反应器300沿流动路径314(即,再循环回路)移动通过第一膜气体转移模块309b,然后通过第二膜气体转移模块309a,允许细胞培养物与流经膜模块的气体相互作用,所述气体在进气口处引入并从排气口离开。气体通过穿过模块中的透气膜的通道与细胞培养物相互作用,所述膜将气体流动区带与细胞培养物流动路径分开。模块允许添加某些气体(例如氧)和/或从生物反应器细胞培养物中去除其它气体(例如co2),而无气泡的生成。一旦通过沿流动路径314的模块处理,细胞培养物就返回生物反应器300。图1b中所示的确切配置并不预期限制本文考虑的其它可能的配置。可以包括计算机控制器,以调节对于膜的o2和co2气流,以使溶解的o2和co2维持在生物反应器中的优选浓度下。在操作期间,温度也可能是维持细胞培养物健康中的重要因素。温度取决于培养物和待表达产物的性质,因为不同的生物材料在不同的温度下表现最佳。在生物反应器的操作过程中,温度可能略有变化。温度可以为约-5至120℃、或-5至0℃、或约0至100℃、或约0至50℃、或约0至20℃、或约20至120℃、或约50至120℃、或约90至120℃、或约10至45℃、或约10至35℃、或约10至25℃、或约20至55℃、或约30至55℃、或约40至55℃、或约15至45℃、或约17至42℃、或约20至40℃、或约20至30℃、或约30至40℃,并且可以为约-5°、0°、5°、10°、15°、17°、20°、25°、28°、30°、35°、37°、40°、42°、45°、50°、60°、70°、80°、90°、100°、110°或120℃。生物反应器的细胞可以生长至合适的细胞密度。如本文使用的,“细胞密度”指给定体积的培养基中的细胞数目。“活细胞密度”指给定体积的培养基中的活细胞数目,如通过标准活力测定(例如锥虫蓝染料排斥法)确定的。锥虫蓝染料排斥测试用于确定细胞悬浮液中存在的活细胞数目。它基于以下原理:活细胞具有完整的细胞膜,其排斥某些染料例如锥虫蓝,而死细胞则并非如此。在这个测试中,将细胞悬浮液简单地与染料混合,然后进行目视检查(或基于自动化成像的设备),以确定细胞是吸收还是排斥染料。”在生长阶段和生产阶段之间的过渡处并且在生产阶段过程中维持的所需活细胞密度是这样的,其提供了等于或小于35%的压实细胞体积。在一个实施方案中,活细胞密度为至少约10x106个活细胞/ml。在其它实施方案中,活细胞密度可以达到20x106、30x106、40x106、50x106、60x106、70x106、80x106、90x106、100x106、110x106、120x106、130x106、140x106、150x106、160x106、170x106、180x106、190x106、200x106、210x106、220x106、230x106、240x106或250x106个活细胞/ml。在一个实施方案中,活细胞密度为至少约10x106个活细胞/ml至70x106个活细胞/ml。在一个实施方案中,活细胞密度为至少约10x106个活细胞/ml至60x106个活细胞/ml。在一个实施方案中,活细胞密度为至少约10x106个活细胞/ml至50x106个活细胞/ml。在一个实施方案中,活细胞密度为至少约10x106个活细胞/ml至40x106个活细胞/ml。在一个优选的实施方案中,活细胞密度为至少约10x106个活细胞/ml至30x106个活细胞/ml。在另一个优选的实施方案中,活细胞密度为至少约10x106个活细胞/ml至20x106个活细胞/ml。在另一个优选的实施方案中,活细胞密度为至少约20x106个活细胞/ml至30x106个活细胞/ml。在另一个优选的实施方案中,活细胞密度为至少约20x106个活细胞/ml到至少约25x106个活细胞/ml,更优选至少约20x106个活细胞/ml。在另外一个实施方案中,活细胞密度为至少约20x106至120x106活细胞/ml、或至少约40x106至140x106活细胞/ml、或至少约60x106至160x106活细胞/ml、或至少约80x106至180x106活细胞/ml、或至少约100x106至200x106活细胞/ml。膜模块本发明涉及生物反应器,其包括一个或多个膜气体转移模块,以调控、控制或以其它方式进行气体交换过程,所述气体交换过程是在生物反应器例如灌注或分批补料生物反应器的操作过程中所涉及或需要的。优选地,由于基于膜的质量转移过程,生物反应器并不将气泡引入细胞培养基内。生物反应器适合于高密度培养物的生长,例如细胞密度为至少约20x106至120x106个活细胞/ml、或至少约40x106至140x106个活细胞/ml、或至少约60x106至160x106个活细胞/ml、或至少约80x106至180x106个活细胞/ml、或至少约100x106至200x106个活细胞/ml的那些培养物。气体交换过程包括向细胞培养物中添加气体(例如,添加o2),以及从细胞培养物中去除气体(例如,co2脱除),优选不伴随将气泡引入培养基内。另外,本发明涉及高密度细胞培养的方法,其包括使用一个或多个膜气体转移模块,以调控、控制或以其它方式进行气体交换过程,所述气体交换过程是在高密度细胞培养的生物反应器,例如灌注或分批补料生物反应器的操作过程中所涉及或需要的。优选地,由于基于膜的质量转移过程,生物反应器并不将气泡引入细胞培养基内。细胞培养方法适合于生长高密度培养物,例如细胞密度为至少约20x106至120x106个活细胞/ml、或至少约40x106至140x106个活细胞/ml、或至少约60x106至160x106个活细胞/ml、或至少约80x106至180x106个活细胞/ml、或至少约100x106至200x106个活细胞/ml的那些培养物。气体交换过程包括向细胞培养物中添加气体(例如,添加o2),以及从细胞培养物中去除气体(例如,co2脱除),优选不伴随将气泡引入培养基内。如本文使用的,术语“膜气体转移模块”指这样的装置,其包括具有第一入口和第一出口并限定第一流动路径的密封外壳,以及容纳在外壳内的至少一个膜,其连接到至少一个第二入口和第二出口,并限定第二流动路径,并且其中所述第一流动路径和第二流动路径通过膜分开。在图1e中描绘了示例性的膜气体转移模块,其显示了可以与本发明的改进的生物反应器结合使用的膜气体转移模块600的一般示意图。作为一般但非限制性的配置,膜模块可以包括具有透气性中空纤维管602的中空纤维束601,所述中空纤维束601由灌封件或密封件603固定在一起。然后封装在外壳或壳体605内,并且在每一端处装配有入口帽604,以允许一种或多种气流通过每根中空纤维的内部引入。外壳还可以包括用于细胞培养物的流动路径的一个或多个入口/出口端口(606、607),所述细胞培养物在一个端口中进入,在中空纤维周围的空间中流经外壳,然后离开出口端口。在实践中,细胞培养物的流动路径被泵入外壳上的一个入口内,并且通过围绕中空纤维束的每根中空纤维的外部空间流经外壳,并且通过出口端口离开。虽然在外壳内部,但细胞培养物与中空纤维束的透气膜的外部接触。在一个实施方案中,膜模块可以包括可以用于细胞培养基的第一流动路径,所述细胞培养基进入第一入口,穿过第一流动路径并从第一出口离开。膜模块可以包括用于一种或多种气体或气体混合物的第二流动路径。气体将进入第二入口,穿过第二流动路径,然后从第二出口离开。在气体穿过第二流动路径的时间期间,气体可以从第二流动路径穿过膜渗透到第一流动路径中的细胞培养物内。另外,第一流动路径的细胞培养物中的溶解气体可以渗透膜,从而进入到第二流动路径内。第二流动路径的出口也可以被称为气体“排出”端口。图2显示了本文使用的膜模块的流动路径的另一个实施方案。该图显示了可以与本文所述的改进的生物反应器结合使用的膜气体转移模块800的一个实施方案。该模块包括用于接受细胞培养基的“壳体侧面向内的”入口801,所述细胞培养基然后在中空纤维束的每根中空纤维周围的空间中,穿过外壳或壳体各处。培养基最终通过“壳体侧面向外的”出口端口802离开外壳。在这个实例中,存在两个出口端口;然而,可以使用任何数目的出口端口。该模块还包括一个或多个“管(腔)侧面向内的”入口端口804,用于接受一种或多种气体或气体混合物,并且其进入中空纤维束的每根中空纤维的腔或内部空间内。然后,气体穿过中空纤维的长度,并且从一个或多个“管(腔)侧面向外的”出口端口803离开。这种配置建立了在中空纤维腔的内部空间中的“气体流动区带”,以及“培养基或细胞培养物流动区带”,其是局限在壳体或外壳内但在中空纤维外部的空间。气体流动区带中的气体可能渗透膜,从而转移到培养基流动区带内。可替代地,溶解的气体(例如,co2)可能渗透中空纤维膜,从而转移到气体流动区带内,并且通过气体出口端口作为“废气”离开模块。图3还提供了用于气体转移模块的流动路径的示例性形式。特别地,该图显示了在配置a、b和c中,典型的膜气体转移模块中的气体(用“*”标记的箭头)和细胞培养基(用“**”标记的箭头)的流动路径的各种配置。用“x”标记的端口被阻断。如本文使用的,术语“膜”指材料层,其允许一种物质(例如,气体)穿过其,同时阻挡另一种物质(例如,液体)。这种选择性可以基于粒度、材料的相(液体相对于气体)或溶解度。另外,分开在驱动力的存在下发生,例如膜的一侧和另一侧之间的压力、温度或浓度中的差异。膜包括“致密或无孔膜”和“多孔膜”。如本文使用的,术语“致密膜”或“无孔膜”指没有孔或空隙的固体材料。实例包括聚合物(例如硅酮或聚二甲基硅氧烷(pdms))、金属(例如钯)和陶瓷。致密膜允许物质通过溶解和扩散的过程穿过,在所述过程中,物质溶解到膜内并穿过膜到另一侧。例如,硅酮可以形成致密膜。由于硅酮是致密的(而不是多孔的),液体无法通过膜显著转移,因此无论表面张力如何,都使得其能够与所有相容液体一起用于液体接触应用。此外,由于硅酮中气体之间的渗透率差异,致密膜还提供了用于分开气体的手段。如本文使用的,术语“多孔膜”是具有特定尺寸或尺寸范围的孔或洞、在其它方面为固体的材料。这些膜基于尺寸排阻分开:大于孔的物质不穿过,而小于孔的物质则穿过。如本文使用的,术语“不对称膜”由经常为多孔的单一材料组成,所述单一材料具有从一侧到另一侧不同的特性(例如,孔径)。这个特征允许在表面处发生“更紧密”的选择性,并且当材料穿过膜基质时较少的限制。如本文使用的,术语“复合膜”由多于一种材料构成,经常是施加到多孔支持层上的致密材料的薄选择层。如本文使用的,与膜有关的术语“渗透系数”是定义为每单位跨膜驱动力,每单位膜厚度的气体转运通量(每单位面积的气体渗透速率)的参数。在各个实施方案中,膜气体转移模块包括一个或多个硅酮膜。硅酮,也称为聚二甲基硅氧烷(pdms),在可用的最透气性的致密聚合物膜材料中。气体通过溶解/扩散机制渗透硅酮,由此气体渗透速率与气体的溶解度和溶解气体在硅酮中的扩散率的乘积成正比。渗透系数是定义为每单位跨膜驱动力,每单位膜厚度的气体转运通量(每单位面积的气体渗透速率)的参数。下表中呈现了各种气体和蒸气在硅酮中的渗透系数。表1.关于各种示例性气体的硅酮渗透系数气体硅酮渗透系数(barrer*)氮280氧600氢650甲烷950一氧化碳340二氧化碳3250*1barrer=10-10cm3(stp)·cm/cm2·s·cm-hg。除非另有说明,否则渗透率以25℃(rtp)而不是(stp)进行测量且报告。根据:thinsiliconemembranes-theirpermeationpropertiesandsomeapplications,annalsofthenewyorkacademyofsciences,第146卷,第1期,materials于,第119-137页w.l.robb应了解,跨越膜的气体转移速率与气体渗透系数、膜表面积、跨膜气体分压差成比例,并且与膜厚度成反比。因此,随着气体渗透系数的增加、表面积的增加、跨膜气体分压的增加和膜厚度的减少,跨越膜的气体转移增加。在某些实施方案中,本文使用的膜可以是多孔的,例如,纳米孔、中孔或微孔,或者它可以具有纳米尺度和/或中尺度和/或微尺度孔的组合。纳米孔固体或凝胶的孔隙率可以为约40至90%、或约40至75%、或约40至60%、或约50至90%、或约60至90%、或约70至90%、或约50至80%、或约60至70%,并且可以为约40、45、50、55、60、65、70、75、80、85或90%。孔可以具有约1nm至10微米,、或约1nm至1微米、或约1至500nm、或约1至100nm、或约1至50nm、或约1至10nm、或约100nm至10微米、或约500nm至10微米、或约1至10微米、或约10nm至1微米、或约50至500nm、或约100至200nm的平均直径,并且可以具有约1、5、10、15、20、25、30、35、40、45、50、75、100、150、200、250、300、350、400、450、500、600、700、800或900nm,或者约1、2、3、4、5、6、7、8、9或10微米的平均直径。本文使用的膜的厚度可以是任何合适的厚度。在各个实施方案中,厚度可以为约0.1至10mm厚,并且可以为约0.1至5mm厚、约0.1至2mm厚、或约0.1至1mm厚、或约1至10mm厚、或约5至1.0mm厚、或约0.5至5mm厚、或约1至5mm厚、或约1至2mm厚,并且可以为约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、2.5、3、3.5、4、4.5、5、6、7、8、9或10mm厚。当制造膜时,纳米孔材料内的细胞分布可以是大致均匀的,或者它们可以是异质的。另外,膜可以含有具有不同尺寸的孔的混合物。在一个实施方案中,本发明的生物反应器可以被配置为中空纤维气体转移模块,例如,硅酮中空纤维膜模块或者具有类似或等价性质的模块。中空纤维构成了自支持的、固有地稳定的膜结构,其可以耐受中空纤维膜的内部和外部之间的高压力差。中空纤维膜通常在膜模块中包装,在其中数千根中空纤维以非常紧凑的体积捆扎在一起,然后密封或灌封在外壳内,如下图中所示。示例性的中空纤维模块显示于图1e和图2中。因而,每个个别的中空纤维膜的表面积之和构成模块的膜总面积,并且变得明显的是,如何能够用中空纤维膜来实现高膜表面密度。膜模块通常具有与所有中空纤维的内部(也称为管侧)流体连通的入口端口和出口端口,所述中空纤维在纤维束的两端处被歧管化。例如,参见图1e。类似地,膜模块具有与中空纤维的外部或壳体侧流体连通的一个或多个端口。在操作中,如图2中所例示的,气体或液体应该在其中流动的中空纤维膜(壳体或管)一侧取决于膜模块的具体应用,并且被选择为使膜模块性能达到最大。例如,如图2中所示,在膜气体分离中,气体的进料混合物通过入口端口进入膜模块到管侧,并且流过中空纤维膜的内部。具有较高渗透率的混合物中的气体种类以更大的速率跨越中空纤维膜壁转移,留下渗透性较差的种类。转移的气体被称为渗透物。在壳体侧,可以施加真空,或者吹扫气体(或液体)可以在其中流动,以带走渗透物。从管侧出口离开的是渗余物,其构成具有较高浓度的渗透性较差的气体种类的气体混合物。在各个实施方案中,模块可以用于进入/来自液体添加和/或去除溶解的气体。在操作中,液体流在膜的一侧上流动,并且气体的混合物在膜的另一侧上流动(或施加真空)。每个气体种类从具有较高分压的膜一侧流到具有较低分压的一侧,从而使两侧趋于平衡。因此,能够通过控制所施加的气体混合物(或真空)来控制流过模块的液流中的溶解气体。该原理可以用于调控细胞培养物中的溶解氧和二氧化碳水平。细胞本文所述的改进的生物反应器可以用于利用各种微生物和细胞类型的微生物发酵和/或细胞培养生物过程中。可以使用的细胞原则上是本领域技术人员已知的所有细胞,其具有产生生物产物的能力。细胞可以是真核的,例如丝状真菌,例如黑曲霉(aspergillusniger)、米曲霉(aspergillusoryzae)、里氏木霉(trichodermareesei)、产黄青霉(penicilliumichrysogenum),酵母例如酿酒酵母(saccharomycescerevisiae)、乳酸克鲁维酵母(kluyveromyceslactis)、红发夫酵母(phaffiarhodozyma)、来自毕赤酵母属(pichia)的酵母例如巴斯德毕赤酵母(pichiapastoris),或原核生物,例如大肠杆菌(escherichiacoli),芽孢杆菌属(bacillus)物种,例如地衣芽孢杆菌(b.licheniformis)、枯草芽孢杆菌(b.subtilis)、解淀粉芽孢杆菌(b.amyloliquefaciens)、嗜碱芽孢杆菌(b.aikalophilus),链霉菌属(streptomyces)物种,谷氨酸棒状杆菌(corynebacteriumglutamicum),假单胞菌属(pseudomonas)物种。真核细胞的实例例如还在chu,l.,robinson,d.k.,(2001)curr.opinionbiotechn.,第12卷,第180-187页中进行描述。优选地,用于本发明的方法中的细胞是动物细胞,特别是哺乳动物细胞。哺乳动物细胞的实例包括cho(中国仓鼠卵巢)细胞、杂交瘤、bhk(幼仓鼠肾)细胞、骨髓瘤细胞、人细胞例如hek-293细胞、人淋巴母细胞样细胞、e1永生化her细胞、小鼠细胞例如ns0细胞。使用本发明的生物反应器用于培养和收获的细胞类型的实例包括但不限于衍生自小鼠、大鼠、兔或人的分泌单克隆抗体的杂交瘤细胞,真核细胞、生物化学标记物、目的重组肽或核苷酸序列、蛋白质、酵母、昆虫细胞、稳定的或病毒感染的、禽细胞或哺乳动物细胞例如cho细胞、猴细胞,用于医学、研究或商业目的的裂解产物等等。培养基本文所述的改进的生物反应器可以与任何合适的细胞培养或微生物生长培养基结合使用。用于选择且优化适当的细胞培养基或微生物培养基的方法是本领域普通技术人员众所周知的,并且可以根据很多因素而变,所述因素包括生物处理器的类型(例如,补料分批、灌注、连续流)、使用的细胞系或微生物细胞的类型、以及尝试表达的特定生物产物。细胞培养中的重要步骤是选择适当的生长培养基用于体外培养。生长培养基或培养基是设计为支持微生物、细胞或小植物生长的液体或凝胶。细胞培养基一般包含适当的能量源和调控细胞周期的化合物。典型的培养基由作为生长因子、激素和附着因子源的氨基酸、维生素、无机盐、葡萄糖和血清的补充组成。除营养素之外,培养基还帮助维持ph和渗透压。生物工艺一般在水性生长培养基中进行,所述水性生长培养基可以含有氮源或其它营养素源,例如尿素,连同维生素以及微量矿物质和金属。一般优选生长培养基是无菌的,或至少具有低微生物负荷,例如细菌计数。生长培养基的灭菌可以以任何所需方式完成。然而,在优选的实施方式中,灭菌通过在混合之前照射生长培养基或生长培养基的各个组分来完成。辐射的剂量一般尽可能低,同时仍获得足够的结果,以便使能量消耗和产生的成本降到最低。可以使用完全天然的培养基或人工/合成培养基连同一些天然产物来培养动物细胞。天然培养基仅由天然存在的生物流体组成。天然培养基对于广泛范围的动物细胞培养是非常有用且方便的。天然培养基的主要缺点是其由于缺乏这些天然培养基的确切组成的了解的弱再现性。通过添加营养素(有机和无机)、维生素、盐、o2和co2气相、血清蛋白质、碳水化合物、辅因子,来制备人工或合成培养基。已设计了不同的人工培养基,以达到下述目的中的一个或多个:1)立即存活(平衡盐溶液,具有特异性ph和渗透压);2)延长存活(用有机化合物和/或血清的各种制剂补充的平衡盐溶液);3)无限增长;4)专门功能。人工培养基一般分成四个范畴:(1)含血清培养基;(2)无血清培养基;(3)化学成分确定的培养基;以及(4)无蛋白质培养基。在含血清培养基中,胎牛血清是动物细胞培养基中最常见的补充剂。它被用作提供最佳培养基的低成本补充剂。血清提供了用于不稳定或水不溶性营养素、激素和生长因子的载体或螯合剂,蛋白酶抑制剂,并且结合且中和毒性部分。对于无血清培养基,培养基中血清的存在可能与许多缺点相关,并且可能导致免疫学研究中的严重误解。已开发了许多无血清培养基。这些培养基一般专门配制为支持单细胞类型的培养,例如用于干细胞的来自thermofisherscientific的knockoutserumreplacementandknockoutdmem,并且掺入确定数量的纯化的生长因子、脂蛋白和其它蛋白质,其否则通常由血清提供。这些培养基也被称为‘成分确定的培养基’,因为这些培养基中的组分是已知的。在化学成分确定的培养基中,这些培养基含有无污染的超纯无机和有机成分,并且还可以含有纯蛋白质添加剂,如生长因子。它们的组成成分通过基因工程在细菌或酵母中产生,伴随维生素、胆固醇、特异性氨基酸和脂肪酸的添加。对于无蛋白质培养基,不存在蛋白质。与补充血清的培养基相比,使用无蛋白质培养基在一些情况下可以促进优异的细胞生长和蛋白质表达,并且促进任何表达产物的下游纯化。制剂如mem、rpmi-1640是无蛋白质的,并且在需要时提供蛋白质补充剂。还应了解,培养基含有氨基酸、葡萄糖、盐、维生素和其它营养素的混合物,并且可作为粉末或液体形式从商业供应商获得。这些组分的要求在细胞系中不同,并且这些差异部分负责广泛数目的培养基制剂。每种组分执行特异性功能,其包括:缓冲系统:调控ph对于最佳培养条件是关键的,并且一般通过使用天然缓冲系统或化学缓冲系统来实现。在天然缓冲系统中,气态co2与培养基的co3/hco3含量达到平衡。需要将具有天然缓冲系统的培养物维持在具有5-10%co2的空气大气中,通常由co2温箱维持。天然缓冲系统是低成本且无毒的。也使用化学缓冲系统。使用两性离子的化学缓冲hepes,具有在ph范围7.2-7.4内优异的缓冲能力,并且不需要受控的气态大气。hepes相对昂贵,并且对于某些细胞类型,在较高浓度下是有毒的。hepes还已显示极大地增加培养基对通过暴露于荧光灯诱导的光毒效应的敏感性。细胞培养物还可以包括ph指示剂,例如酚红。大多数商购可得的培养基都包括酚红作为ph指示剂,其允许ph的持续监测。在细胞生长过程中,当ph由于通过细胞释放的代谢产物而改变时,培养基改变颜色。在低ph水平下,酚红使培养基变黄,而在较高的ph水平下,它使培养基变紫。培养基对于ph7.4(用于细胞培养的最佳ph值)为鲜红色。本文使用的细胞培养基也可以含有无机盐。培养基中的无机盐通过提供钠、钾和钙离子,帮助保持渗透平衡,并且帮助调控膜电位。培养还可以获益于氨基酸的存在。特别地,必需氨基酸必须包括在培养基中,因为细胞无法自行合成这些氨基酸。它们是细胞增殖所需的,并且其浓度决定了可达到的最大细胞密度。l-谷氨酰胺,一种必需氨基酸,是特别重要的。l-谷氨酰胺对于nad、nadph和核苷酸提供氮,并且充当代谢的二次能源。l-谷氨酰胺是不稳定的氨基酸,在一段时间内,其转变成无法由细胞使用的形式,并且因此可以紧在使用前加入培养基中。当添加的l-谷氨酰胺多于原始培养基制剂中所要求的时,应谨慎行事,因为其降解导致氨的积累,并且氨对一些细胞系可能具有有害作用。哺乳动物细胞培养基的l-谷氨酰胺浓度可以从培养基199中的0.68mm到达尔贝科改良伊格尔培养基中的4mm不等。无脊椎动物细胞培养基可以含有多达12.3mml-谷氨酰胺。补充剂如glutamax是更稳定的,并且可以替换谷氨酰胺用于缓慢细胞的长期培养。非必需氨基酸也可以加入培养基中,以替换在生长过程中已耗尽的氨基酸。用非必需氨基酸补充培养基刺激细胞生长并延长细胞活力。碳水化合物也可以加入细胞培养基中。以糖形式的碳水化合物是主要的能源。大多数培养基含有葡萄糖和半乳糖,然而,一些培养基含有麦芽糖和果糖。本文使用的细胞培养基也可以包括蛋白质和肽。最常用的蛋白质和肽是白蛋白、转铁蛋白和纤连蛋白。它们在无血清培养基中是特别重要的。血清是蛋白质的丰富来源,并且包括白蛋白、转铁蛋白、抑肽酶、胎球蛋白和纤连蛋白。白蛋白是血液中的主要蛋白质,其作用于结合水、盐、游离脂肪酸、激素和维生素,并且在组织和细胞之间转运它们。白蛋白的结合能力使其成为来自细胞培养基的有毒物质的合适去除剂。本文使用的细胞培养基还可以包括保护剂,例如抑酶肽。抑肽酶在中性和酸性ph下是稳定的,并且对高温和通过蛋白水解酶的降解是抗性的。它具有抑制几种丝氨酸蛋白酶如胰蛋白酶的能力。胎球蛋白是在胎儿和新生儿血清中,以高于成人血清中的浓度发现的糖蛋白。它也是丝氨酸蛋白酶的抑制剂。纤连蛋白是细胞附着中的关键参与者。转铁蛋白是铁转运蛋白,其作用于对细胞膜供应铁。本文使用的细胞培养基还可以包括维生素和微量元素。许多维生素对于细胞的生长和增殖是必需的。维生素不能以足够的数量由细胞合成,并且因此是组织培养中所需的重要补充剂。再次,血清是细胞培养中维生素的主要来源,然而,培养基也富含不同的维生素,使其适合于特定细胞系。b族维生素最常添加用于生长刺激。微量元素经常被补充到无血清培养基中,以替换通常在血清中发现的那些。微量元素,如铜、锌、硒和三羧酸中间产物,是以微小量需要用于适当细胞生长的化学元素。这些微量营养素对于许多生物过程,例如酶功能性的维持是必需的。对于某些细胞系推荐的完全生长培养基还可能需要基础培养基和血清中不存在的另外组分。这些组分,补充剂,帮助维持增殖并维持正常的细胞代谢,例如激素、生长因子和信号传导物质。生长培养基也可以包括抗生素。抗生素不是细胞生长所需的,但经常用于控制细菌和真菌污染物的生长。不建议对于细胞培养常规使用抗生素,因为抗生素可以掩盖被支原体和抗性细菌的污染。此外,抗生素还可以干扰敏感细胞的代谢。培养基的选择可以取决于待培养的细胞类型以及培养目的和实验室中可用的资源。不同的细胞类型具有高度特异性的生长要求,因此,必须通过实验确定对于每种细胞类型最合适的培养基。一般而言,对于贴壁细胞,最好用mem起始,且对于悬浮细胞,用rpmi-1640起始。常见的细胞培养基的实例可以在商业上发现(life),并且如下:伊格尔最低基础培养基(emem):emem在最早广泛使用的培养基中,并且通过harryeagle从较简单的基础培养基(bme)进行配制。emem含有平衡盐溶液、非必需氨基酸和丙酮酸钠。它用降低的碳酸氢钠浓度(1500mg/l)进行配制,用于与5%co2一起使用。由于emem是非复杂培养基,因此它一般用另外的补充剂或更高水平的血清进行加强,使其适合于广泛范围的哺乳动物细胞。达尔贝科改良伊格尔培养基(dmem)。dmem具有几乎为emem两倍的氨基酸浓度,四倍的维生素量,以及硝酸铁、丙酮酸钠和一些补充氨基酸。最初的制剂含有1,000mg/l葡萄糖,并且首次报告了用于培养胚胎小鼠细胞。具有4500mg/l葡萄糖的进一步变动,已证明对于培养各种类型的细胞是最佳的。dmem是基础培养基,并且不含蛋白质或生长促进剂。因此,它需要补充以成为“完全”培养基。它最常见地补充有5-10%胎牛血清(fbs)。dmem利用碳酸氢钠缓冲系统(3.7g/l),并且因此需要人工水平的co2来维持所需的ph。粉状培养基不含碳酸氢钠进行配制,因为所述碳酸氢钠在粉末状态下趋于气化。粉状培养基在将其溶解于水中后,需要添加3.7g/l碳酸氢钠。dmem最初用于培养小鼠胚胎干细胞。它已发现可广泛应用于原代小鼠和鸡细胞、病毒噬斑形成和接触抑制研究。rpmi-1640。rpmi-1640是通用培养基,具有用于哺乳动物细胞,尤其是造血细胞的广泛范围的应用。rpmi-1640在buffalo,newyork的roswellparkmemorialinstitute(rpmi)处开发。rpmi-1640是mccoy的5a的修改,并且开发用于外周血淋巴细胞的长期培养。rpmi-1640使用碳酸氢盐缓冲系统,并且与大多数哺乳动物细胞培养基的不同之处在于其典型的ph8制剂。rpmi-1640支持广泛各种细胞的悬浮生长,并且作为单层生长。如果适当补充有血清或足够的血清替代物,rpmi-1640具有用于哺乳动物细胞的广泛范围的应用,包括新鲜人淋巴细胞的培养、融合方案和杂交细胞的生长。上述细胞培养和微生物生长培养基并不预期限制可以与本发明一起使用的可能培养基的广度和范围。技术人员能够基于情况的整体来考虑适当的培养基选项,并且做出适当的选择。另外,取决于类型,生物过程系统还可以包括其它组分,以促进生物过程。例如,可以添加各种酶和表面活性剂。例如,在一些生物过程中使用酶如纤维二糖酶和纤维素酶。纤维二糖酶包括以商品名novozyme188tm出售的来自黑曲霉的纤维二糖酶。纤维素酶可以具有真菌或细菌起源。纤维素酶包括来自以下属的那些:芽孢杆菌属、假单胞菌属、腐质霉属(humicola)、镰刀菌属(fusarium)、梭孢壳菌属(thielavia)、枝顶孢属(acremonium)、金孢子菌属(chrysosporium)和木霉属(trichoderma),并且包括以下的物种:腐质霉属、鬼伞属(coprinus)、梭孢壳菌属、镰刀菌属、毁丝霉属(myceliophthora)、枝顶孢属、头孢霉属(cephalosporium)、柱霉属(scytalidium)、青霉属(penicillium)或曲霉菌属(aspergillus)(参见例如,ep458162),尤其是通过选自以下物种的菌株产生的那些:特异腐质霉(humicolainsolens)(再分类为嗜热色串孢菌(scytalidiumthermophilum),参见例如美国专利号4,435,307)、灰盖鬼伞(coprinuscinereus)、尖孢镰刀菌(fusariumoxysporum)、嗜热毁丝霉(myceliophthorathermophila)、巨多孔菌(meripilusgiganteus)、土生梭孢壳霉(thielaviaterrestris)、枝顶孢属物种、桃色顶孢霉(acremoniumpersicinum)、acremoniumacremonium、acremoniumbrachypenium、acremoniumdichromosporum、acremoniumobclavatum、acremoniumpinkertoniae、粉灰顶孢霉(acremoniumroseogriseum)、acremoniumincoloratum和棕色枝顶孢(acremoniumfuratum);优选选自物种特异腐质霉dsm1800、尖孢镰刀菌dsm2672、嗜热毁丝霉cbs117.65、头孢霉属物种rym-202、枝顶孢属物种cbs478.94、枝顶孢属物种cbs265.95、桃色顶孢霉cbs169.65、acremoniumacremoniumahu9519、cephalosporiumsp.cbs535.71、acremoniumbrachypeniumcbs866.73、acremoniumdichromosporumcbs683.73、acremoniumobclavatumcbs311.74、acremoniumpinkertoniaecbs157.70、粉灰顶孢霉cbs134.56、acremoniumincoloratumcbs146.62和棕色枝顶孢cbs299.70h。纤维素分解酶也可以得自金孢子菌属,优选chrysosporiumlucknowense的菌株。另外,可以使用木霉属(特别是绿色木霉(trichodermaviride)、里氏木霉和康宁木霉(trichodermakoningii))、嗜碱芽孢杆菌(参见例如,美国专利号3,844,890和ep458162)和链霉菌属(参见例如,ep458162)。可以利用酶复合物,例如可以商品名从genencore获得的那些,例如1500酶复合物。accellerase1500酶复合物含有多重酶活性,主要是外切葡聚糖酶、内切葡聚糖酶(2200-2800cmcu/g)、半纤维素酶和β-葡糖苷酶(525-775pnpgu/g),并且具有4.6至5.0的ph。酶复合物的内切葡聚糖酶活性以羧甲基纤维素活性单位(cmcu)表示,而β-葡糖苷酶活性以pnp-葡糖苷活性单位(pnpgu)报告。在一个实施方案中,使用1500酶复合物和novozymetm188纤维二糖酶的共混物。表面活性剂的添加可以增强某些生物过程的速率。表面活性剂的实例包括非离子表面活性剂,例如20或80聚乙二醇表面活性剂、离子表面活性剂或两性表面活性剂。其它合适的表面活性剂包括辛基苯酚乙氧基化物,例如从dowchemical商购可得的tritontmx系列非离子表面活性剂。还可以添加表面活性剂,以保持在溶液中,特别是在高浓度溶液中生产的产物。生物反应器产物和纯化本文所述的生物反应器可以用于生产任何类型的生物产物,包括疫苗、血液和血液组分、过敏原、基因治疗组分、组织和重组治疗性蛋白质。生物制品可以由糖、蛋白质或核酸或这些物质的复杂组合组成,或者可以是活实体,例如细胞和组织。治疗性蛋白质包括但不限于单克隆抗体、双特异性抗体、酶、细胞因子、激素和融合蛋白。蛋白质的大规模的经济纯化对于生物技术工业是日益重要的问题。一般地,蛋白质通过细胞培养而产生,使用通过插入含有该蛋白质的基因的重组质粒,被改造为产生目的蛋白质的哺乳动物或细菌细胞系。由于使用的细胞系是活生物,因此必须向它们供给复杂的生长培养基,其含有糖、氨基酸和生长因子,通常由动物血清的制剂供应。所需蛋白质与供给细胞的化合物混合物和细胞本身的副产物分开至足以用作人治疗目的的纯度,提出了巨大的挑战。在各个实施方案中,本文所述的生物反应器可以用于产生抗体治疗剂。在本发明的范围内的抗体包括但不限于:抗her2抗体,包括曲妥珠单抗(carter等人,proc.natl.acad.sci.usa,89:4285-4289(1992),美国专利号5,725,856);抗cd20抗体,例如如美国专利号5,736,137中的嵌合抗cd20“c2b8”,如美国专利号5,721,108,b1中的2h7抗体的嵌合或人源化变体,或托西莫单抗);抗il-8(stjohn等人,chest,103:932(1993)和国际公开号wo95/23865);抗vegf抗体,包括人源化和/或亲和力成熟的抗vegf抗体,例如人源化的抗vegf抗体hua4.6.1(kim等人,growthfactors,7:53-64(1992),国际公开号wo96/30046以及1998年10月15日公开的wo98/45331);抗psca抗体(wo01/40309);抗cd40抗体,包括s2c6及其人源化变体(wo00/75348);抗cd11a(美国专利号5,622,700,wo98/23761,steppe等人,transplantintl.4:3-7(1991),以及hourmant等人,transplantation58:377-380(1994));抗ige(presta等人,j.immunol.151:2623-2632(1993),以及国际公开号wo95/19181);抗cd18(1997年4月22日授权的美国专利号5,622,700,或者如1997年7月31日公开的wo97/26912中);抗ige(包括e25、e26和e27;1998年2月3日授权的美国专利号5,714,338,或1992年2月25日授权的美国专利号5,091,313,1993年3月4日公开的wo93/04173,或1998年6月30日提交的国际申请号pct/us98/13410,美国专利号5,714,338);抗apo-2受体抗体(1998年11月19日公开的wo98/51793);抗tnf-α抗体包括ca2cdp571和mak-195(参见1997年9月30日授权的美国专利号5,672,347,lorenz等人j.immunol.156(4):1646-1653(1996),以及dhainaut等人crit.caremed.23(9):1461-1469(1995));抗组织因子(tf)(1994年11月9日授予的欧洲专利号0420937b1);抗人α4β7整联蛋白(1998年2月19日公开的wo98/06248);抗egfr(如1996年12月19日公开的wo96/40210中的嵌合或人源化225抗体);抗cd3抗体,例如okt3(1985年5月7日授权的美国专利号4,515,893);抗cd25或抗tac抗体,例如chi-621和(参见1997年12月2日授权的美国专利号5,693,762);抗cd4抗体,例如cm-7412抗体(choy等人arthritisrheum39(1):52-56(1996));抗cd52抗体,例如campath-1h(riechmann等人nature332:323-337(1988));抗fc受体抗体,例如如graziano等人j.immunol.155(10):4996-5002(1995)中的针对fcγri的m22抗体;抗癌胚抗原(cea)抗体,例如hmn-14(sharkey等人cancerres.55(23suppl):5935s-5945s(1995);针对乳腺上皮细胞的抗体,包括hubre-3、hu-mc3和chl6(ceriani等人cancerres.55(23):5852s-5856s(1995);以及richman等人cancerres.55(23supp):5916s-5920s(1995));与结肠癌细胞结合的抗体例如c242(litton等人eurj.immunol.26(1):1-9(1996));抗cd38抗体,例如at13/5(ellis等人j.immunol.155(2):925-937(1995));抗cd33抗体,例如hum195(jurcic等人cancerres55(23suppl):5908s-5910s(1995)和cma-676或cdp771;抗cd22抗体,例如ll2或lymphocide(juweid等人cancerres55(23suppl):5899s-5907s(1995));抗epcam抗体,例如17-1a抗gpiib/iiia抗体,例如阿昔单抗或c7e3fab抗rsv抗体,例如medi-493抗cmv抗体,例如抗hiv抗体,例如pro542;抗肝炎抗体,例如抗hepb抗体抗ca125抗体ovarex;抗独特型gd3表位抗体bec2;抗αvβ3抗体抗人肾细胞癌抗体,例如ch-g250;ing-1;抗人17-1a抗体(3622w94);抗人结肠直肠肿瘤抗体(a33);针对gd3神经节苷脂的抗人黑素瘤抗体r24;抗人鳞状细胞癌(sf-25);以及抗人白细胞抗原(hla)抗体,例如smartid10和抗hladr抗体oncolym(lym-1)。用于本文抗体的优选靶抗原是:her2受体、vegf、ige、cd20、cd11a和cd40。考虑了用于纯化生物反应器产物的任何合适方法。一些蛋白质可能被促使直接从细胞分泌到周围的生长培养基内;其它蛋白质在细胞内制备。对于后一种蛋白质,纯化过程的第一步涉及细胞的裂解,其可以通过各种方法包括机械剪切、渗透压休克或酶促处理来完成。此类破坏将细胞的全部内容物释放到匀浆物内,并且另外产生由于其小尺寸而难以去除的亚细胞片段。这些一般通过差速离心或过滤而去除。由于细胞的自然死亡、以及在蛋白质生产运行过程中细胞内宿主细胞蛋白质的释放,对于直接分泌的蛋白质出现同样的问题,尽管规模较小。一旦已获得含有目的蛋白质的澄清溶液,通常就使用不同层析技术的组合,尝试将其与通过细胞产生的其它蛋白质分开。这些技术基于其抗体/抗原亲和力、电荷、疏水度或大小来分开蛋白质的混合物。几种不同的层析树脂对于这些技术各自是可获得的,允许针对所涉及的特定蛋白质准确定制纯化方案。这些分离方法各自的本质在于,可以促使蛋白质以不同的速率沿长柱向下移动,实现随着它们进一步向下通过柱而增加的物理分离,或者选择性地附着至分离培养基,随后通过不同的溶剂差异地洗脱。在一些情况下,当杂质特异性地附着至柱,而目的蛋白质并非如此时,所需蛋白质与杂质分开,即,目的蛋白质存在于“流通物”中。亲和层析也可以是用于一些蛋白质的选项,所述亲和层析利用待纯化的蛋白与固定化的捕获剂之间的特异性相互作用。蛋白a是用于含有fc区的蛋白质例如抗体的亲和层析的有用吸附剂。蛋白a是来自金黄色葡萄球菌(staphylococcusaureas)的41kd细胞壁蛋白,其以高亲和力(针对人igg约10-8m)与抗体的fc区结合。可以使用受控孔玻璃(sulkowski,e.proteinpurification:microtomacro,第177-195页(1987);chadha等人preparativebiochemistry11(4):467-482(1981))、或未衍生的二氧化硅(reifsnyder等人j.chromatography753:73-80(1996)),来纯化蛋白质。待使用本文描述的方法纯化的蛋白质一般使用重组技术产生。用于产生重组蛋白质的方法例如在美国专利号5,534,615和4,816,567中进行描述,所述美国专利特异性地引入本文作为参考。在优选的实施方案中,目的蛋白质在cho细胞中产生(参见例如,wo94/11026)。上文已描述了可以使用本文所述的方法纯化的蛋白质的实例。在某些实施方案中(例如,抗体产生),可以使用基于蛋白a的手段来实现纯化。固定在固相上的蛋白a用于纯化含ch2/ch3区的蛋白质。固相优选是包含用于固定蛋白a的玻璃、二氧化硅、琼脂糖或聚苯乙烯表面的柱。优选地,固相是受控孔玻璃柱或硅酸柱。有时,在防止非特异性地附着至柱的尝试中,柱已用试剂例如甘油进行包被。从bioprocessinglimited商购可得的prosepatm柱是用甘油包被的蛋白a受控孔玻璃柱的实例。本文考虑的柱的其它实例包括poros50atm(聚苯乙烯)柱或rproteinasepharosefastflowtm(琼脂糖)柱。用于蛋白a层析的固相用合适的缓冲液进行平衡。例如,平衡缓冲液可以是25mmtris、25mmnacl、5mmedta,ph7.1。使用可以与平衡缓冲液相同的加载缓冲液,将衍生自重组宿主细胞的受污染的制剂加载至平衡的固相上。当受污染的制剂流过固相时,蛋白质吸附至固定化的蛋白a,并且其它污染物(例如中国仓鼠卵巢蛋白质chop,当该蛋白质在cho细胞中产生时)可能与固相非特异性地结合。序贯执行的下一步可能需要通过在中间洗涤步骤中洗涤固相,去除与固相、抗体和/或蛋白a结合的污染物。在加载后,可以在开始中间洗涤步骤前用平衡缓冲液来平衡固相。中间洗涤缓冲液可以包含盐和进一步的化合物,其中所述进一步的化合物是(a)去污剂(优选聚山梨醇酯,例如聚山梨醇酯20或聚山梨醇酯80);(b)溶剂(优选己二醇);以及(c)聚合物(优选peg)。所采用的盐可以基于目的蛋白质来选择,但优选乙酸盐(例如乙酸钠),尤其当抗体是抗her2抗体例如曲妥珠单抗时;或柠檬酸盐(例如柠檬酸钠),尤其当抗体是抗ige抗体例如e26时。组合物中的盐和进一步的化合物的量是这样的,使得组合的量洗脱污染物,而基本上不去除目的蛋白质。在此类洗涤缓冲液中优选的盐浓度为约0.1至约2m,且更优选约0.2m至约0.6m。有用的洗涤剂浓度为约0.01%至约5%,更优选约0.1%至1%,且最优选约0.5%,例如当洗涤剂是聚山梨醇酯时。示例性的溶剂浓度为约1%至40%,优选约5%至约25%。例如,在本文的实例中,对于e26,溶剂(己二醇)的优选浓度为约20%,而对于曲妥珠单抗,溶剂(再次为己二醇)的优选浓度为约10%。当进一步的化合物是聚合物(例如peg400或peg8000)时,其浓度可以例如为约1%至约20%,优选约5%至约15%。可以在蛋白a层析步骤之前或之后,使洗脱的蛋白质制剂经受另外的纯化步骤。示例性的进一步纯化步骤包括羟磷灰石层析;透析;使用抗体来捕获蛋白质的亲和层析;疏水作用层析(hic);硫酸铵沉淀;阴离子或阳离子交换层析;乙醇沉淀;反相hplc;在硅胶上的层析;层析聚焦;和凝胶过滤。在本文的实例中,蛋白a层析步骤随后为下游阳离子交换(sp-sepharose)和阴离子交换(q-sepharose)纯化步骤。因此回收的蛋白质可以在药学上可接受的载体中进行配制,并且用于对于此类分子已知的各种诊断、治疗或其它用途。生物反应器产物的药物组合物由本发明的生物反应器产生的产物可以与药学上可接受的载体(赋形剂),包括缓冲剂混合,以形成用于减轻疾病或病症的药物组合物。“可接受的”意指载体必须与组合物的活性成分相容(并且优选能够稳定活性成分),并且对于待治疗的受试者无害。药学上可接受的赋形剂(载体)的实例,包括缓冲剂,对于本领域技术人员是显而易见的,并且先前已进行描述。参见例如,remington:thescienceandpracticeofpharmacy,第20版(2000)lippincottwilliams和wilkins,编辑,k.e.hoover。在一个实例中,本文所述的药物组合物含有识别靶抗原的不同表位/残基的多于一种抗hla-dq8抗体。药物组合物可以包含以冻干制剂或水溶液形式的药学上可接受的载体、赋形剂或稳定剂。(remington:thescienceandpracticeofpharmacy,第20版(2000)lippincottwilliams和wilkins,编辑,k.e.hoover)。可接受的载体、赋形剂或稳定剂在使用的剂量和浓度下对接受者是无毒的,并且可以包含缓冲剂,例如磷酸盐、柠檬酸盐和其它有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(例如十八烷基二甲基苄基氯化铵;氯化六甲双铵;苯扎氯铵、苄索氯铵;苯酚、丁醇或苄醇;对羟基苯甲酸烷基酯,例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,例如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其它碳水化合物,包括葡萄糖、甘露糖或右旋糖酐;螯合剂,例如edta;糖,例如蔗糖、甘露糖醇、海藻糖或山梨糖醇;成盐抗衡离子,例如钠;金属络合物(例如zn蛋白络合物);和/或非离子表面活性剂,例如tweentm、pluronicstm或聚乙二醇(peg)。药学上可接受的赋形剂在本文中进一步描述。在一些实例中,本文所述的药物组合物包含含有生物反应器产物的脂质体,其可以通过任何合适的方法进行制备,所述方法例如在epstein等人,proc.natl.acad.sci.usa82:3688(1985);hwang等人,proc.natl.acad.sci.usa77:4030(1980);以及美国专利号4,485,045和4,544,545中描述的。具有延长循环时间的脂质体公开于美国专利号5,013,556中。可以通过反相蒸发法,用包含磷脂酰胆碱、胆固醇和peg衍生的磷脂酰乙醇胺(peg-pe)的脂质组合物,来生成特别有用的脂质体。脂质体通过确定孔径的过滤器挤出,以得到具有所需直径的脂质体。生物反应器产物也可以被诱陷在例如通过凝聚技术或界面聚合制备的微胶囊中,所述微胶囊例如分别在胶体药物递送系统(例如脂质体、白蛋白微球体、微乳剂、纳米颗粒和纳米胶囊)或粗乳剂中的羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊。示例性技术先前已进行描述,参见例如,remington,thescienceandpracticeofpharmacy,第20版,mackpublishing(2000)。在其它实例中,本文所述的药物组合物可以以缓释形式配制。缓释制剂的合适实例包括含有抗体的固体疏水性聚合物的半透性基质,所述基质以成型制品的形式,例如薄膜或微胶囊。缓释基质的实例包括聚酯,水凝胶(例如,聚(甲基丙烯酸2-羟乙酯)或聚(乙烯醇)),聚丙交酯(美国专利号3,773,919),l-谷氨酸和7-乙基-l-谷氨酸盐的共聚物,不可降解的乙烯-乙酸乙烯酯,可降解的乳酸-乙醇酸共聚物,如luprondepottm(由乳酸-乙醇酸共聚物和乙酸亮丙瑞林组成的可注射微球体),蔗糖乙酸异丁酸酯和聚-d-(-)-3-羟基丁酸。待用于体内施用的药物组合物必须是无菌的。这容易地经由例如通过无菌滤膜的过滤来完成。一般将治疗性抗体组合物放入具有无菌接入口的容器内,所述容器例如具有可通过皮下注射针刺穿的塞子的静脉内溶液袋或小瓶。本文所述的药物组合物可以是单位剂型,例如片剂、丸剂、胶囊、粉末、颗粒、溶液或悬浮液或栓剂,用于经口、肠胃外或直肠施用,或者通过吸入或吹入施用。为了制备固体组合物例如片剂,可以将主要活性成分与药物载体和其它药物稀释剂例如水混合,所述药物载体例如常规的片剂化成分,例如玉米淀粉、乳糖、蔗糖、山梨糖醇、滑石、硬脂酸、硬脂酸镁、磷酸二钙或树胶,以形成含有本公开内容的化合物、或其无毒的药学上可接受的盐的同质混合物的固体预配制组合物。当将这些预配制组合物称为同质的时,意指活性成分均匀地分散在组合物各处,使得可以容易地将组合物再分成同等有效的单位剂型,例如片剂、丸剂和胶囊。然后将这种固体预配制组合物再分成含有0.1mg至约500mg本公开内容的活性成分的上述类型的单位剂型。新型组合物的片剂或丸剂可以进行包被或以其它方式化合,以提供具有延长作用的优点的剂型。例如,片剂或丸剂可以包含内部剂量和外部剂量组分,后者为在前者上的包封的形式。这两种组分可以由肠溶层分开,所述肠溶层作用于抵抗胃中的崩解,并且允许内部组分完整地进入到十二指肠内或在释放中被延迟。各种材料可以用于此类肠溶层或包衣,此类材料包括多种聚合酸,以及聚合酸与此类材料如虫胶、鲸蜡醇和乙酸纤维素的混合物。合适的表面活性试剂特别包括非离子试剂,例如聚氧乙烯脱水山梨糖醇(例如tweentm20、40、60、80或85)和其它脱水山梨糖醇(例如spantm20、40、60、80或85)。具有表面活性试剂的组合物方便地包含0.05至5%的表面活性试剂,并且可以为0.1至2.5%。应了解,需要时,可以添加其它成分,例如甘露糖醇或其它药学上可接受的媒介物。合适的乳剂可以使用商购可得的脂肪乳剂,例如intralipidtm、liposyntm、infonutroltm、lipofundintm和lipiphysantm来制备。活性成分可以溶解在预混合的乳剂组合物中,或者可替代地它可以溶解在油(例如大豆油、红花油、棉籽油、芝麻油、玉米油或杏仁油)中,并且在与磷脂(例如卵磷脂、大豆磷脂或大豆卵磷脂)和水混合后形成乳剂。应了解,可以添加其它成分,例如甘油或葡萄糖,以调整乳剂的张度。合适的乳剂通常含有至多20%,例如5%至20%的油。乳剂组合物可以是通过将生物反应器产物(例如抗体)与intralipidtm或其组分(大豆油、卵磷脂、甘油和水)混合而制备的那些。用于吸入或吹入的药物组合物包括在药学上可接受的、水性或有机溶剂或其混合物中的溶液和悬浮液,以及粉末。液体或固体组合物可以含有如上文阐述的合适的药学上可接受的赋形剂。在一些实施方案中,通过经口或鼻呼吸途径施用组合物用于局部或全身效应。在优选无菌的药学上可接受的溶剂中的组合物可以通过气体的使用得到雾化。雾化的溶液可以直接从雾化装置中呼吸,或者雾化装置可以附着至面罩、帐篷或间歇性正压呼吸机。溶液、悬浮液或粉末组合物可以优选从装置经口或鼻进行施用,所述装置以适当的方式递送制剂。实施例实施例1.用于高密度生物反应器培养中的无气泡气体转移的硅酮基膜最近的技术发展已允许细胞培养达到非常高的细胞密度,其导致单克隆抗体的高生产率。[1]然而,由于需要高水平的氧和二氧化碳转移来支持高密度培养,因此在这些生物工艺中的溶解氧(do)控制仍然是挑战性的。为了实现高转移,采用了方法如微量喷射,其中将微米级的气泡释放到反应器内。[2]然而,微量喷射的使用可以增加气泡破裂相关的细胞死亡和生物反应器起泡的风险,其可能导致运行提前终止和产物损失。[3,4]进一步地,在极端情况下需要以可能对细胞有毒的水平添加消泡剂和剪切保护剂的添加,以防止起泡以及气泡破裂的细胞死亡。[5]为了消除与气泡喷射相关的挑战,对具有多孔膜和无孔膜的无气泡通气在细胞培养中的应用进行研究。具有微米级孔的聚合物膜已在无气泡通气中进行描述,其中培养物和气体之间的压力平衡允许通过膜中的孔,在气液界面处的无气泡转移。[6-8]另外,预防孔润湿的疏水膜的使用已证实了与亲水膜相比增强的转移,因为截留在孔内的液体对于向培养物的气体转移产生了另外的障碍。[9]无孔硅酮聚合物基膜(例如,聚二甲基硅氧烷,pdms)也已用于无气泡气体转移,其中气体分子扩散通过致密聚合物,并且在膜-培养物接触表面处转移至培养物。[10-12]尽管多孔膜和无孔膜已应用于细胞培养中,但由于膜设计中的局限性以及与膜操作相关的挑战,所以仅实现了低密度(即,<20e6个细胞/ml)。[13]具体地,如果气体和培养物的压力在多孔膜中不适当地平衡,可以形成微米级的气泡,并且具有气泡破裂的细胞死亡和生物反应器起泡的风险。在无孔膜中,使用的硅酮基配管很厚,因此气体分子通过聚合物的转移很慢,阻止了足够的气体交换来支持高密度培养。为了克服与气泡喷射相关的挑战并支持高密度培养,需要用于无气泡气体交换的替代方法和材料。已开发了新型膜,其性质可以允许增强的气体转移以支持高密度培养。[14]这些膜含有成束填充并灌封在单元内部的小(id190um,od300um)的薄壁(55um)pdms中空纤维,所述单元可以经由外部再循环回路附着至生物反应器用于气体转移。气体通过中空纤维腔运送,培养液穿过膜单元的壳体侧,并且在pdms-液体接触表面处发生气体转移。此处,描述了这些膜用于高密度灌注培养(>20e6个细胞/ml)中的气体转移的用途。确定kla(质量转移系数)的研究证实了,在2升(l)生物反应器中,具有2500cm2表面积的膜和微量喷射器之间可比较的氧(o2)质量转移效率。通过增加再循环流速实现了增强的质量转移,提示了可以进行优化工作以进一步阐明这种膜的潜力。除o2转移之外,穿过膜腔的空气以与钻孔喷射可比较的速率去除二氧化碳(co2),指示了膜消除生物反应器中的所有喷射的潜在用途。为了确定这些膜是否提供足够的do来维持高密度cho细胞培养,进行了几个细胞培养实验。在第一个实验中,将单个膜附着至生物反应器,以替换用于o2添加的微量喷射(钻孔喷射用于脱除co2)。在数周的过程中,do维持在60%下,并且支持40e6-120e6个细胞/ml的培养密度。在后续实验中,测试了无气泡生物反应器设置,其中串联放置了两个膜,一个用于co2脱除,而另一个用于氧合。在培养的数周过程期间,维持了20-30e6个细胞/ml的细胞密度,具有足够的氧递送和低于120mmhg的pco2。使用这项技术,可以通过消除对于所添加的剪切保护剂和消泡剂的需要,来改善高细胞密度生物反应器的培养物,所述剪切保护剂和消泡剂可能对培养物具有不利影响。进一步地,如果认为成功替换喷射,则这些膜将是在灌注和补料分批系统两者中允许高细胞密度培养的革命性方式。方法/实验在100lsub上进行用硅酮膜的气体交换的初始测试。使用装有65l水的生物反应器袋(sub)。将2.1m2pdms膜(硅酮中空纤维模块)附着至sub的再循环回路。使5lpm的水再循环通过膜壳体侧。将do探针插入sub内,以监测氧转移。在测量o2添加之前,使n2流过膜腔,以从反应器中去除o2(%do<20%)。然后,o2以不同的速率(0.1lpm、1lpm)流过膜。为了比较,0.1和1lpm的o2也流过sub中的多孔喷射器(15μm)。对于kla研究,将2500cm2pdms膜(硅酮中空纤维模块)附着至2l玻璃生物反应器的再循环回路。将具有1g/l泊洛沙姆188(pluronic)的2l磷酸盐缓冲盐水(pbs)加热至37,并且用离心泵(levitronix)以不同的流速再循环通过膜的壳体侧(表1)。将do探针(hamiltonvisiferm)和co2探针(mettlertoledo)附着至生物反应器,以监测气体转移。在测量o2添加之前,使n2流过膜,以从反应器中去除o2(%do<10%)。对于o2添加,空气以不同的速率流过膜,直到饱和(%do平稳,~100%)。为了将膜气体交换与传统喷射进行比较,空气还以不同的流速流过钻孔喷射器和微孔喷射器(15um孔)。在co2去除之前,使与空气混合的10%co2流过膜(pco2>55mmhg)。对于co2脱除,使空气以不同的速率流过膜,直到达到co2的稳定(pco2平稳,~1-2mmhg)。为了与传统的co2脱除方法进行比较,使空气以不同的速率流过钻孔喷射器,以确定kla。对于如下测试的不同条件确定了kla:在不存在细胞的情况下然后,因此,斜率其中c*是在饱和时的气体浓度(%do或mmhg)(在饱和时的最后10个测量点的平均值),c0是初始气体浓度,且ct是在时间t的气体浓度。稳态至非稳态操作为了确定硅酮基膜是否可以用作微量喷射的替代物,将2500cm2膜(硅酮中空纤维模块)在中空纤维之后附着至灌注培养生物反应器的再循环回路(图1c)。以10e6个细胞/ml接种的有专利权的cho细胞系(cho1)生长至40e6个细胞/ml(3天),并且起始细胞流出,以将密度维持在40e6个细胞/ml。膜的y-off在上升至密度期间以及在稳态操作的前4天期间保持关闭,并且%do用微量喷射和钻孔喷射维持在60%下。在稳态操作4天后,将50%的再循环(总共0.8lpm,0.4lpm=50%)运送通过膜。另外,关闭微量喷射器,并且将o2管线切换至膜,以提供0-0.1lpm的氧,以将%do维持在60%下。最终,钻孔喷射器(用于co2脱除)仍然打开,但将气体混合物从0.5lpmo2切换到0.25lpmo2+0.25lpm空气。细胞用这种设置在40x106个细胞/ml下用膜培养3天,以确定是否能够在培养过程中维持do并对细胞具有最低限度的影响。在稳态操作3天后,将细胞流出降低,并且将细胞密度增加至120x106个细胞/ml,以确定膜是否可以支持更高密度的培养。监测活力和ldh,以确定在操作过程中的培养物健康。监测%do(溶解氧),以确定是否经由膜气体交换将足够的o2供应给细胞。在高细胞密度下的上升和操作作为确定膜在升至高细胞密度期间对培养物的作用的第二个测试,将2500cm2膜(硅酮中空纤维模块)在中空纤维之后附着至灌注培养生物反应器的再循环回路。从培养的第0天开始,将全部再循环的一半(总共0.8lpm,0.4lpm=50%)引导通过膜。以10e6接种的cho1在非稳态操作中生长,以确定在升至密度以及由膜支持的最大密度期间膜的效应。通过钻孔喷射器运送0.25lpm空气+0.25lpmo2的混合物(用于co2脱除)。通过培养膜运送0-0.1lpmo2来供应o2,以将培养过程中的%do维持在60%下。监测活力和ldh,以确定在操作过程中的培养物健康。监测%do,以确定是否经由膜气体交换将足够的o2供应给细胞。高密度灌注培养中的无气泡通气基于关于在高密度培养中的o2添加和co2脱除并替换微量喷射器的kla实验,测试了无气泡的设置(图1d),以确定是否能够无需喷射而操作。将两个2500cm2膜(硅酮中空纤维模块)在中空纤维之后附着至灌注培养生物反应器的再循环回路。第一个膜用于co2脱除和ph控制,其中在低密度培养过程中,空气、o2和co2的混合物流过以控制ph,随后在高密度培养过程中,切换至空气和o2的混合物以脱除co2。第二个膜用于补充性o2添加,以在培养过程中支持在60%下的do。使0.1lpm空气流到反应器的顶部空间,以向生物反应器提供正压。表4含有每个膜在培养过程中每天使用的气体流量列表。在2l生物反应器中以1e6个细胞/ml接种的有专利权的cho细胞系(cho2)生长至30e6个细胞/ml,并且伴随细胞流出维持在25e6-30e6个细胞/ml下。在升至密度的过程中,对于前6天,将一半的再循环流量(总共0.8lpm,0.4lpm=50%)引导通过膜。在第7天时,do不通过0.4lpm再循环流量进行维持,因此将100%的再循环(0.8lpm)运送通过膜,以脱除co2并添加o2。监测活力和ldh,以确定在操作过程中的培养物健康。监测%do,以确定是否经由膜气体交换将足够的o2供应给细胞。结果和讨论用膜气体交换的o2添加的确定为了最初使用无孔pdms膜测试气体转移,将具有2.1m2转移表面积的膜附着至100lsub的再循环回路。sub充满65l的水,所述水以5lpm再循环通过膜。与内置的喷射器相比,对于膜观察到更快速的气体转移(图10),并且可能归于膜单元内的纤维的较大表面积(2.1m2)。这些结果鼓励与传统的喷射方法相比,使用膜的o2添加的进一步研究和气体转移系数(kla)的确定。在高密度培养中通常采用钻孔和微孔喷射以提供足够的do,然而,气泡破裂相关的细胞死亡和反应器起泡可以引起运行提前终止和产物损失。为了确定是否无气泡的膜气体交换可匹配这些喷射方法,设置了小规模的2l生物反应器,其具有模型流体(pbs+1g/lpluronic),且就通过流动路径“b”的不同空气流速和恒定的再循环流速(0.8lpm)监测氧添加(图3)。kla对于微量喷射是最高的,然而,膜气体转移达到了在微量喷射的相同数目级上的转移系数。钻孔喷射与最慢的o2添加和最低的kla相关。然而,重要的是要注意,尽管钻孔喷射可以用于添加氧,但其功能主要是用于co2脱除,如下一节中讨论的。表1:关于不同空气流速的钻孔喷射、微量喷射和膜气体交换的kla。测试喷射类型空气流量(lpm)kla(小时-1)1钻孔0.11.92钻孔0.252.83微量喷射器0.130.04微量喷射器0.2535.35膜0.111.66膜0.2519.3使用单个再循环流速(0.8lpm)和流动路径,来执行膜气体转移与喷射的初始比较。进行了另外的研究,以确定不同的流动路径(图3)和再循环速率是否可以增强膜气体转移,以与先前描述的2l模型生物反应器设置(2500cm2膜)中的微量喷射可比较。对于流动路径“a”,在kla中没有观察到随再循环速率中的变化的差异。这可能起因于液体无法流动到单元中心处的pdms膜纤维的密集包装束内,因此发生了较少的转移(表2)。在流动路径“b”中,kla随着流速增加而增加,指示了更快的流动允许更快速的气体交换。另外,在高流速下,观察到与微量喷射可比较的kla。最后,与流动路径“b”相比,对于流动路径“c”中的较低流量达到了更高的kla。这些结果指示了,“b”中的大部分壳体侧流量可能离开第一出口端口,降低了液体与纤维接触的时间并降低了气体转移。尽管流动路径“c”似乎对于膜中的气体交换是最佳的,但再循环流量在路径“a”和“c”两者中是受限的。对于大于0.5lpm的再循环流量,观察到由于增加的泵速度和压力降的膜损害和破裂(图11)。如果待通过膜改善转移,则应该研究可替代的膜设计和流动路径,以使压力降和膜破裂的机会降到最低。进一步地,高流速可能引起对培养中的细胞的剪切,因此需要确定在提供高kla的同时降低剪切的另外设计。表2:测试了o2添加的2l离线模型的条件和kla。空气流量对于所有测试都是0.25lpm(还参见图3d)测试编号再循环(lpm)流动路径kla(小时-1)10.2a5.0220.4a4.6630.5a5.0640.2b7.5250.4b13.1660.5b15.970.8b18.7281b20.3791.2b24.19101.4b25.73111.6b27.31121.8b28.6130.2c12.69140.4c18.67150.5c19.53用膜气体交换的co2脱除的确定为了在高细胞密度下操作具有无气泡气体交换的生物反应器,需要通过膜的co2去除。此处,将通过膜用以不同流速的空气的co2脱除与用钻孔喷射的脱除进行比较(表3)。在2l模型生物反应器系统中,在脱除之前,将与空气混合的10%co2加入生物反应器中。随后,通过在保持再循环速率恒定(0.4lpm)的同时,以不同的流速通过膜或钻孔喷射器喷射100%空气,来去除co2。与钻孔喷射相比,在膜中观察到更快速的co2脱除。这可能归于膜增强的n2转移(空气中的~78%n2)和用于转移的较大表面积。这些结果对于在无气泡生物反应器操作中的未来应用是有希望的。与o2转移一样,需要确定最佳的膜设计,以允许增加的再循环流速来改善气体转移,同时具有较低的剪切。表3:对于co2脱除的2l离线模型测试的条件和kla。注意,流动路径“b”(图3)用于co2脱除测试。测试喷射类型空气流量(l/分钟)kla(h-1)1膜0.251.892膜0.42.193钻孔喷射器0.251.354钻孔喷射器0.41.77用膜气体交换替换微量喷射器气泡喷射可以负面影响培养物健康,同时还增加起泡和生物反应器损失的风险。特别地,由微孔喷射器形成的微米级的气泡被视为细胞死亡的主要原因,其中在气泡破裂期间释放的能量裂解周围的细胞。进一步地,由这些气泡生成的泡沫难以去除,并且在培养过程中经常需要向生物反应器中添加大量的消泡剂。另外,在高密度下,需要更多的微量喷射,导致更多的裂解和泡沫。从培养中去除微量喷射可能帮助改善培养并延长生物反应器操作。此处,描述了在稳态生物反应器操作的过程中以及在升至高细胞密度的过程中,使用硅酮基膜代替微量喷射的研究。稳态至非稳态操作。对以高细胞密度的稳态培养物进行初始测试,以确定用硅酮膜替换微量喷射器用于气体交换的可行性。有专利权的cho细胞系(cho1)在灌注生物反应器中培养至40e6个细胞/ml的密度,具有钻孔喷射(co2脱除+o2添加)和微量喷射(补充性o2添加),以将%do维持在60%下(图4a和5a-5c)。一旦密度达到40e6,就用标准喷射将培养物维持在60%do下四天,以建立基线%do概况(图5a)。在4天后,将0.8lpm培养物再循环流量的一半(0.4lpm)再引导通过膜,将来自微量喷射器的o2附着至膜气体交换器,并且通过钻孔喷射器运送具有0.25lpmo2混合物的0.25lpm空气(图5b)。通过增加或减少通过膜的o2流量(0-0.1lpm)来控制do,以维持60%do。在膜启动期间,与微气泡形成对比,do由于使用膜在响应时间中的变化而波动,因此增益减少且积分增加,以改善对波动的控制(图5b)。在用膜稳态操作3天后,降低细胞流出以增加密度,并确定膜是否可以在较高密度下维持do。达到了120e6的密度,然而,在升至更高密度的过程中,存在do中的波动(图4a和4c)。假设也能够穿过这些膜的水可能在操作期间阻塞纤维和在气体出口处的过滤器,并且降低气体转移,直到更高的气体流量将水从纤维中推出。需要另外的研究,以确定是气体流动路径的水阻塞在操作期间引起这些转移降低的时期,还是膜在非稳态操作期间无法控制。除在操作期间维持%do之外,不存在膜对培养物健康的明显作用,具有与对照可比较的活力百分比和乳酸脱氢酶(ldh)(图4b,4c)。注意当细胞密度增加时ldh增加,这被认为主要是由于更高细胞密度的存在而不是膜对培养物的作用。这些结果对于膜替换高密度培养中的微量喷射是有希望的。展望未来,执行另外的研究以理解膜在升至高密度过程中的效应,以更好地理解膜对培养物的作用。在高细胞密度下的上升和操作。为了确定在升至高细胞密度过程中是否可以使用膜来控制do,将膜放置在培养物再循环回路中的中空纤维的下游。另外,为了防止在操作过程中纤维和气体出口过滤器由水的阻塞,将无菌通风口瓶附着至膜单元的气体出口。在用细胞接种之前,将0.8lpm再循环流量的一半(0.4lpm)引导通过膜。细胞以10e6细胞/ml接种,并且培养至高密度而无细胞流出。使用膜的活力与具有传统喷射的对照反应器可比较(图6b)。然而,与传统喷射的~130e6个细胞/ml相比,密度仅达到~100e6个细胞/ml,指示了膜可能在升至密度的过程中对细胞具有一些作用(图6a)。虽然较高的细胞密度与较高的ldh相关,但生物反应器的ldh是可比较的,其可能指示了膜在操作过程中对培养物健康的一些负面作用(图6c)。假设含有密集包装纤维的目前的膜设计可能引起对细胞膜的剪切或损害,这可能减慢其生长。如果实施具有改善的流动路径和更大的纤维间距的替代膜设计,则可能能够降低在膜操作过程中的剪切和细胞损害,并且达到更高的密度。在培养期间,用钻孔喷射和膜气体交换将do控制在60%下。最初,将通过钻孔喷射器的0.25lpm空气替换为至0.5lpm的o2。一旦通过钻孔喷射器的o2达到最大值(0.5lpm),就根据需要,通过膜供应从0到0.1lpm的另外o2。在do控制要求通过膜交换添加另外的o2后,do在60%的设定点附近波动(图7)。对pid控制回路增益和积分的改变并未降低这些波动,指示了膜最初对于较低的密度是尺寸偏大的。随着密度增加,o2需求增加,并且波动在第5天时稳定图7a)。可以实施替代控制参数,以降低在低密度下的这些波动。重要的是要注意,在运行过程中,发生了质量流量控制器(mfc)故障,影响了do概况和控制。具体地,从第2-4天开始,通过钻孔喷射器的氧定期关闭,促使膜成为唯一的o2源。在第3天时,通过钻孔喷射器的o2供应关闭并且do降至0%,因此将放气暂时切换至另一mfc(手动do控制),以固定原始mfc(图7a,红色)。在第4-5天时,将控制返回到原始mfc;然而,由于mfc在操作期间短暂关闭,在运行中发生了几次另外的波动(图7b,红色)。需要进一步的研究,以评估如先前讨论的来自膜的剪切或用故障mfc在do控制中的丧失是否可能已负面影响培养物健康,并且导致与对照相比更低的密度。还需要另外的测试,以确定在膜气体出口处的通风口瓶是否通过允许水从纤维中流出,同时防止过滤器润湿来帮助防止do波动。尽管伴随mfc故障的挑战,但通过膜的o2流量从未达到最大流量(0.1lpm),并且足以维持非常高的细胞密度(在峰值时的~100e6个细胞/ml),其对于在高密度培养中应用膜来替换微量喷射是有希望的。无气泡生物反应器操作从生物反应器中去除喷射可以改善高密度培养,其中气泡的去除降低气泡破裂相关的细胞死亡并去除消泡剂添加的需要。此处,将两个膜放置在中空纤维的下游(例如,在灌注生物反应器的再循环回路中,图1d中的“tff(切向流过滤)模块”(例如,如图1d中所描绘的)。第一个膜用于替换钻孔喷射器用于co2脱除和一些氧添加,其中将氧和空气的混合物运送通过膜单元的腔。另外,第一个膜在培养开始时的低密度操作期间供应co2,以控制ph。如先前证实的,第二个膜仅用于氧添加以替换微量喷射器。为了对于无气泡生物反应器的操作来挑战膜,使用第二种有专利权的cho细胞系(cho2),其具有更高的剪切敏感性和更高的氧需求。细胞以1e6个细胞/ml接种,并且培养至30e6个细胞/ml的密度,此时施加细胞流出,以维持25e6-30e6个细胞/ml的稳态操作。反应器无气泡操作17天,其中在操作过程中不添加消泡剂。另外,do在整个操作期过程中保持接近于60%,且从未达到0%,指示了膜提供了足够的o2来维持培养。在无气泡反应器中升至密度比对照反应器(具有钻孔喷射+微量喷射的atf)慢1天,并且ldh更高,指示了来自膜的剪切可能影响培养物健康(图8)。尽管do在很大程度上维持在60%下,但控制不是最佳的,并且波动在培养期间的不同阶段发生(图9)。cho2细胞系的o2需求基本上高于cho1,并且在操作过程中需要添加大流量的o2以维持do(表4)。具体地,尽管稳态操作,o2需求仍继续增加,并且在操作过程自始至终必须施加更高的o2流量。因此,在mfc和氧流量的调整过程中引起do中的波动。另外,在启动时,将一半的再循环流量(0.4lpm)引导通过膜。然而,在第7天时,将所有的再循环流量(0.8lpm)引导通过膜,以支持高氧需求。最后,重要的是要注意,需要空气来脱除co2。在第5天和第6天之间关闭空气,以在培养期间一次供应足够的o2,然而,co2响应地增加。假设空气中n2的存在使得其在脱除时更有效,因此在无气泡操作过程中需要空气或n2用于co2去除。在未来的无气泡运行中,将研究允许更高氧流量的mfc,以优化膜单元的操作。表4:在无气泡生物反应器操作期间通过膜的再循环流速和气体流速。将0.1lpm空气供应到顶部空间,以在操作过程中提供正压。“→”表示增加或减少流速,控制在60%do设定点附近。从第6天到第7天,所有mfc使气体流速达到最大值(0.25lpm空气+0.5lpmo2;膜2=0.25lpmo2),因此再循环流量增加至0.8lpm。在第9天时,由于建立对do的控制的问题以及需要从其它mfc添加另外的o2,控制切换为手动。结论描述了使用含有薄壁中空纤维的填充束的硅酮基膜单元,用于无气泡气体转移的方法。o2通过这些膜的转移足以维持在高细胞密度(100-120e6个细胞/ml)下的60%do,而无在操作过程中对培养物健康的严重作用。用两个膜单元实现了无气泡气体转移,第一个单元用于脱除co2,而第二个单元用于o2添加。在高细胞密度(25-30e6个细胞/ml)下,细胞在培养中保持存活数周,并且对于无气泡培养的持续时间,do维持接近于60%。另外,在无气泡培养中不需要消泡剂,在培养过程中,所述消泡剂经常在器皿壁和中空纤维上粘附并形成层。在未来的研究中,do控制将进行优化,以降低和防止在操作过程中的波动。另外,需要进一步研究这些膜的剪切效应,并且将鉴定降低剪切的另外设计。这些研究是硅酮基膜用于在高细胞密度培养(>20e6个细胞/ml)中的气体转移的初步研究,并且具有在补料分批和灌注工艺两者中应用的潜力。这些膜的实施将减轻与传统喷射相关的许多问题,降低了在以高密度操作时运行提前终止的可能性。参考文献在本申请内引用了下述参考文献。各自整体引入本文作为参考。1.kunert,r.和d.reinhart,advancesinrecombinantantibodymanufacturing.applmicrobiolbiotechnol,2016.100(8):第3451-61页。2.qi,h.等人,theart&scienceofmicro-sparginginhigh-densityperfusionculturesofanimalcells,inanimalcelltechnology:fromtargettomarket.2001,springer.第412-415页。3.liu,y.等人,effectsofbubble-liquidtwo-phaseturbulenthydrodynamicsoncelldamageinspargedbioreactor.biotechnolprog,2014.30(1):第48-58页。4.godoy-silva,r.,c.berdugo和j.j.chalmers,aeration,mixing,andhydrodynamics,animalcellbiroeactors,inencyclopediaofindustrialbiotechnology:bioprocess,bioseparation,andcelltechnology,m.c.flickinger,editor.2010,johnwiley&sons,inc.5.velugula-yellela,s.r.等人,impactofmediaandantifoamselectiononmonoclonalantibodyproductionandqualityusingahighthroughputmicro-bioreactorsystem.biotechnolprog,2018.34(1):第262-270页。6.wagner,r.和j.lehmann,thegrowthandproductivityofrecombinantanimalcellsinabubble-freeaerationsystem.tibtech,1988.6.7.buntemeyer,h.,b.g.d.bodeker和j.lehmann,membrane-stirrer-reactorforbubblefreeaerationandperfusion.1987:第411-419页。8.lehmann,j.,j.vorlop和h.buntemeyer,bubble-freereactorsandtheirdevelopmentforcontinuousculturewithcellrecycle.animalcellbiotechnology,1988.3:第221-237页。9.balgobin,r.和d.karamanev,bubble-freeoxygenandcarbondioxidemasstransferinbioreactorsusingmicroporousmembranes.2012.10.velez-suberbie,m.l.等人,impactofaerationstrategyonchocellperformanceduringantibodyproduction.biotechnolprog,2013.29(1):第116-26页。11.emery,a.n.,d.c.h.jan和m.al-rubeai,oxygenationofintensivecell-culturesystem.applmicrobiolbiotechnol,1995.43:第1028-1033页。12.qi,h.n.等人,experimentalandtheoreticalanalysisoftubularmembraneaerationformammaliancellbioreactors.biotechnolprog,2003.19:第1183-1189页。13.zhang,s.,a.handa-corrigan和r.e.spier,acomparisonofoxygenationmethodsforhigh-densityperfusionculturesofanimalcells.biotechnologyandbioengineering,1993.41:第685-692页。14.orgill,j.j.等人,acomparisonofmasstransfercoefficientsbetweentrickle-bed,hollowfibermembraneandstirredtankreactors.bioresourtechnol,2013.133:第340-6页。其它实施方案本说明书中公开的所有特征都可以以任何组合进行组合。本说明书中公开的每个特征可以由发挥相同、等价或相似目的的替代特征替换。因此,除非另有明确说明,否则所公开的每个特征仅是一系列等价或相似特征的示例。根据上文描述,本领域技术人员可以容易地确定本公开内容的本质特点,并且可以对本公开内容进行各种改变和修改以使其适应各种用途和条件,而不脱离其精神和范围。因此,其它实施方案也在权利要求内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1