用于原位核酸数字多路复用的方法与流程
发明背景
本申请要求2018年11月1日提交的美国临时申请号62/754,427的权益,所述临时申请的全部内容通过引用并入本文。
本发明一般涉及核酸的检测,更具体地涉及核酸的多路复用检测。
rna原位杂交(ish)是广泛用于测量和定位细胞如循环肿瘤细胞(ctc)或组织切片内的特定rna序列(例如信使rna(mrna)、长非编码rna(lncrna)和微rna(mirna)),同时保留细胞和组织背景的分子生物学技术。因此,rnaish提供了细胞和组织内基因表达的时空可视化以及定量。它在研究和诊断中具有广泛的应用(hu等人,biomark.res.2(1):1-13,doi:10.1186/2050-7771-2-3(2014);ratan等人,cureus9(6):e1325.doi:10.7759/cureus.1325(2017);weier等人,expertrev.mol.diagn.2(2):109-119(2002)))。荧光rnaish分别利用荧光染料和荧光显微镜进行rna标记和检测。荧光rnaish通常提供四至五个靶序列的有限多路复用。有限的多路复用能力主要是由于可由荧光显微镜的光学系统区分的少量光谱上不同的荧光染料。在诸如产生细胞和组织图以理解复杂生物系统的领域中,特别是在人类健康和疾病中,高度期望更高水平的多路复用。
因此,需要用于核酸的多路复用检测的原位检测方法。本发明满足了这种需要并且也提供了相关的优点。
技术实现要素:
本发明提供了一种用于细胞中多个靶核酸的多路复用检测的方法。在一个实施方案中,本发明提供了一种用于细胞中多个靶核酸的多路复用检测的方法,其包括使包含含有多个靶核酸的细胞的样品与一组探针接触,其中所述探针组包含探针亚组,所述探针亚组包含提供对每个靶核酸的独特标记的多个可检测标记,其中每个探针亚组包含一个或多个不同的标记,其中不同标记的数目和/或组合对于每个靶核酸是独特的;以及检测与相应靶核酸结合的可检测标记。
附图说明
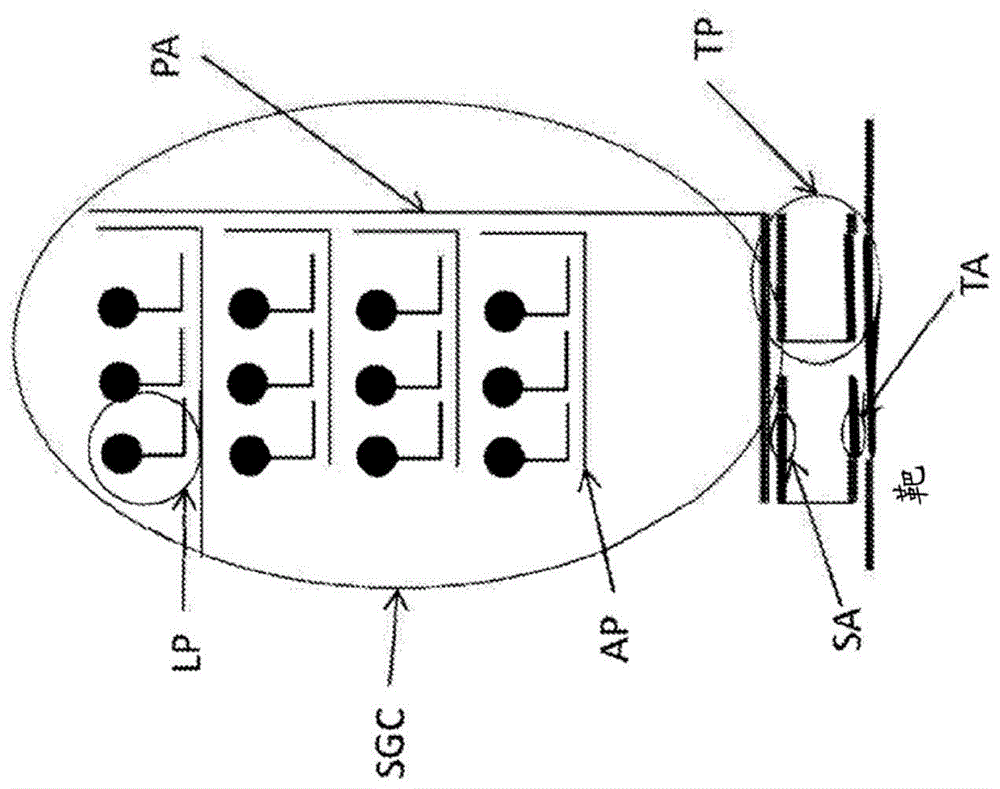
图1a和1b显示用于检测靶核酸的探针的示例性配置。在图1a所示的配置中,每个单独的靶探针具有与靶核酸互补的靶锚定区段(ta)(即,可与靶核酸杂交的靶探针区段)和与信号产生复合物(sgc)的组分互补的信号锚定区段(sa)(即,可与sgc的组分杂交的靶探针区段)。每个sgc包含多层组分,例如扩增子(ap)和前置扩增子(pa),它们组装成树状结构,该树状结构能够在其“分支”上携带许多标记探针(lp)。如图1b所示,如果靶序列足够长,许多tp组和相关的sgc可以组装在靶核酸上以产生在成像系统中作为离散“点”出现的可检测信号。
图2a和2b显示了用于检测靶核酸的探针的两种示例性配置。如图1所示,配置利用包含lp、ap、pa、tp的sgc,除了sgc的组装利用协作扩增子(collaborationamplifier,com)。com结合到两个前置扩增子(pa)和扩增子(ap)以组装sgc。图2a和2b显示结合靶核酸的靶探针的两种不同配置。这些配置允许将更多的lp合并到一个sgc中。这些配置更适合于检测短靶序列,因为可以用单个sgc生成可检测信号。
图3显示用于靶核酸的多路复用检测的配置。如图3所示,对于具有2n-1个多路复用通道(即,n个独特标记)的多路复用测定,可以制备n个独特的、标记特异性sgc。每个sgc携带具有特定标记的相同lp,其中不同的sgc携带不同的标记。每个sgc的组分(例如pa、ap、lp等)与sgc独特地相关。设计sgc使得靶特异性sgc的组分彼此杂交以组装sgc,但不能与任何其他sgc的任何组分交叉杂交。在图3中,显示两个靶核酸与相应的sgc结合。对于一个靶核酸(图3中的上部靶),靶核酸的代码是1111,其中靶的sgc包含四个标记(4、3、2和1)。对于第二靶(图3中的下部靶),靶核酸的代码是1010,其中靶核酸的sgc包含两个标记(4和2)。
图4a-4h说明用于靶核酸的多路复用检测的各种示例性实施方案。图4a示出了子sgc实现的一个实施方案,其中在扩增子(ap)分子上实现sgcid代码。如图4a所示,ap具有一个设计为结合pa分子上的扩增子锚(aa)的区域(即,用于前置扩增子上扩增子的结合位点)和另一个包含标记探针锚(la)的多个区段的区域(即,用于标记探针的结合位点)。在此实施方案中,根据sgc的独特识别代码来设计不同la的混合物。例如,如果sgc的id代码是l4、l3、l2、l1=1110,则在ap分子上产生用于lp类型4、3、2的相等数目的la,其将结合设计数目的所需lp以在测定中产生id代码。在图4a中,使用标记4、3和1示出的sgc的代码是1101。
图4b示出了子sgc实现的另一实施方案,其中在前置扩增子(pa)分子上实现sgcid代码。如图4b所示,制备n个“纯”ap分子,每个携带相同类型的lp。pa分子具有一个设计为结合tp组的sa的区域(即用于tp上pa的结合位点;参见图1a),和另一个包含多个aa区段的区域(即,用于前置扩增子上扩增子的结合位点)。在此实施方案中,根据sgc的独特识别代码来设计不同aa的混合物。例如,如果sgc的id代码是l4、l3、l2、l1=1010,则在pa分子上产生用于携带lp类型4、2的ap的相等数目的aa,其将结合设计数目的所需lp以在测定中产生id代码。在图4b中,使用标记4、3和1示出的sgc的代码是1101。
图4c示出了子sgc实现的另一实施方案,其中在lp分子上实现sgcid代码。在此实施方案中,与相同sgc结合的lp分子可以是lp的混合物,每个lp均根据预定义的代码薄缀合至不同的标记。例如,如图4c所示,sgc5lp是与三种不同标记缀合的lp的混合物,产生对应于标记4、3和1的id代码1101。此实施方案的优点是lp对sgc复合物的“着色”将被完全随机化,这可以进一步帮助减少编码误差。在图4c的右侧示出了部分lp混合代码薄,其中使用4个标记示出了7个不同的示例性sgc代码。
图4d更详细地示出了图4c的实施方案。对于每个sgc,指定特定的标记锚(la,用于标记探针的扩增子上的结合位点),使得用于特定靶核酸的每个sgc在扩增子上具有多个相同的la。可以用标记探针(lp)提供组合标记的水平。在这种情况下,图示的sgc5显示扩增子包含多个相同的la,标记为“e”。如图4d所示,sgc5用对应于3个不同的标记探针(4、3和1)的3个id代码(1101)来编码,所有这些标记探针具有用于相应扩增子上的多个“e”la的相同的结合位点。因此,所有三个标记探针(4、3和1)都结合到sgc5的扩增子上,从而用标记代码1101标记sgc5靶核酸。
图4e更详细地示出了图4c的实施方案。示出了图4d的sgc5与其相应的靶核酸结合,其中标记探针具有与sgc5扩增子的相应“e”la结合的“e”结合位点。还示出了与它们相应的靶核酸结合的两个另外的示例性sgc。如图4d所示编码的sgc1包含多个相同的la,标记为“a”。sgc1用对应于标记探针(1)的1个id代码(0001)编码,所述探针具有用于sgc1扩增子的多个“a”la的结合位点。因此,标记探针“1”与sgc1的扩增子结合,从而用标记代码0001标记sgc1靶核酸。如图4d所示编码的sgc3包含多个相同的la,标记为“c”。sgc3用对应于2个不同标记探针(2和1)的2个id探针(0011)编码,这两个探针具有用于对应的sgc3扩增子上的多个“c”la的相同结合位点。因此,标记探针(2和1)都与sgc3的扩增子结合,从而用标记代码0011标记sgc3靶核酸。
图4f更详细地示出了图4c的实施方案。图4f说明,一旦设计了特定靶核酸的sgc,就可以简单地通过改变与特定sgc的扩增子结合的标记探针上的标记来容易地修饰靶核酸的实际编码。例如,在图4d中,sgc2包含具有“b”la的扩增子,并使用标记2编码为0010。在图4f中,可以相对于靶探针、前置扩增子和具有“b”la的扩增子使用相同的sgc组装,而不是使用如图4d所示仅具有标记2的“b”la结合标记探针,可以使用具有标记3和2的混合物的“b”la结合标记探针,使得现在用两种标记编码sgc2(0110)。因此,标记3和2(0110)结合到sgc2扩增子上的“b”la。类似地,现在通过使用具有“e”la-结合标记探针的标记探针(其具有标记4、3和2的混合物)(1110)而不是如图4d所示的标记4、3和1(1101),在图4f中将包含具有“e”la的扩增子的sgc5编码为1110。
图4g更详细地示出了图4c的实施方案。在图4g中,可以通过使用不同比率的标记探针来实现额外的“编码”。如图4g所示,不是以等量结合不同标记探针,而是可以改变结合相应扩增子的不同标记探针的比率,使得不仅特定标记的存在,而且特定标记的相对量可以用作提供不同标记的另一种方式。如图4g所示,sgc2用标记3和2编码为0110,而sgc2′可用代码011′0和相同标记3和2编码不同的靶核酸,但其中与sgc2′结合的标记2与标记3的比率不同于与sgc2结合的标记2与标记3的比率。两种靶核酸用相同的标记探针标记,但靶核酸可基于与相应靶核酸结合的两个标记探针的相对量来区分。
图4h更详细地示出了图4c的实施方案。如图4h所示,两个靶核酸显示具有两个结合的sgc、sgc2和sgc5。sgc2用标记3和2被编码为0110,并且sgc5用标记4、3和2被编码为1110。在这种情况下,其中所有的标记探针与相应的la结合,在sgc2的情况下是“b”la,在sgc5的情况下是“e”la,并且假定sgc2和sgc5在相应的sgc中具有大约相同数目的la,则可以与sgc2结合的相应标记的数目将高于与sgc5结合的相应标记的数目(即,sgc2的2个不同标记(标记3和2)和sgc5的3个不同标记(标记4、3和2)将与相同数量的位点结合,导致与sgc5相比,更多数目的标记3和2与sgc2结合,因为一些sgc5位点被标记4占据)。如果需要,可以通过包括“空白”标记探针,即具有用于相应la的结合位点(在这种情况下,对于sgc2为“b”,对于sgc5为“e”)但没有标记的探针来标准化标记的数目(因此标准化信号强度)。例如,如果需要将sgc2和sgc5与相应标记的相同强度信号进行比较,则可在“b”la特异性探针的混合物中包括1/3“空白”标记探针,使得标记3和2的强度在两个sgc上相同(即,1/3的sgc2被“空白”标记探针占据,1/3的sgc5被标记4占据)。在另一个实施例中,如果进行其中一些sgc包括4个标记的多路复用测定,则可以进行所述测定,使得使用少于4个标记的标记探针组中包括相同比例的“空白”标记探针,例如,sg2特异性标记探针可以包括1/2“空白”标记探针,sgc5特异性标记探针包括1/4“空白”标记探针,使得与相应sgc结合的每个不同标记探针4、3、2和1的量在各个sgc上相同。
图5显示sgc在靶核酸上组装的两种配置。在图5的下图中,提供相同标记的sgc显示为在彼此相邻的组中结合。在图5的上图中,提供不同标记的sgc显示为靶核酸上的结合位点是混杂的或缠绕的。针对不同标记的靶核酸上的靶探针结合位点的混杂是有利的,因为如果不同的sgc类型分开放置,在分开的组中,靶的某一部分可以被阻断或掩蔽,从而防止一种特定sgc类型的连接,这将导致错误编码。
图6a和6b显示了用于减少靶核酸多路复用检测的错误编码的配置。如图6a所示,特定sgc被从“1001”错误编码为“0001”,因为pa被截短,这可能发生在pa的制造期间。在图6a中的这种情况下,标记4由于截短而未结合。如图6b所示,如果标记在pa上缠绕或混杂,则相同的截短不会引起错误编码。将不同的标记排列到交替的位置减少了错误编码的机会。
图7a和7b示出了通过随机化ap或pa上的不同标记的位置来最小化由截短引起的潜在错误编码的方法。如图7所示,多路复用信道id被编码在ap分子上。在图7a中,不同的标记探针以完全相同的方式定位在每个ap上,即,sgc中的每个扩增子是相同的。与ap的不同位置上的其他标记相比,一些ap的截短可导致与靶核酸结合的某些标记的显著减少。这种不平衡增加了错误编码的机会。在最严重的情况下,截短可能导致某个标记的所有拷贝的丢失,导致完全的错误编码。在图7b中,ap上不同标记的位置被随机化。ap作为多个扩增子提供,其中包括不同扩增子的混合,其中针对特定标记探针的la的位置被不同地分布并且可以在不同扩增子上随机化。因此,截短不会导致sgc中标记数量的大偏差。
图8a-8f示出了图4c所示的多路复用检测策略的实现。使用三种荧光染料(alexa488、atto550和atto647n)检测四种靶mrna,5-羟色胺受体7(htr7)、原钙粘蛋白8(pcdh8)、酪氨酸羟化酶(th)和叉头盒p1(foxp1)。使用
图9a-9c显示了使用信号产生复合物(sgc)检测核酸靶的前述方法的示意图。ppa,前置前置扩增子;pa,前置扩增子;amp,扩增子;lp,标记探针。
图10a-10c显示了靶核酸的正交标记的示意图。图10a显示了基于rnascopetm测定的靶核酸的正交标记。图10a显示了用相应的信号生成复合物(sgc)标记三个示例性靶核酸。图10a显示靶探针对1(tp1a和tp1b)与靶核酸1的结合。显示了前置扩增子(pa1)与靶探针对(tp1a和tp1b)结合。显示了多个扩增子(amp1)与pa1结合。显示了多个标记探针(lp1)与扩增子结合。图10a示出了靶2和3的类似配置,其中sgc的组分(靶探针、前置扩增子、扩增子、标记探针)对于相应靶中的每一个是特定的。图10b示出了图10a中所示配置的修改。图10b示出了用相应的信号生成复合物(sgc)标记两个示例性靶核酸。图10b显示靶探针对1(tp1a和tp1b)与靶核酸1的结合。显示了前置前置扩增子(ppa1)与靶探针对(tp1a和tp1b)结合。显示了多个前置扩增子(pa1)与ppa1结合。显示了多个扩增子(amp1)与pa1结合。为了简单起见,显示了扩增子与一个前置扩增子结合,但是应当理解,扩增子可以结合所有前置扩增子。显示了多个标记探针(lp1)与扩增子结合。图10b示出了靶2的类似配置,其中sgc的组分(靶探针、前置前置扩增子、前置扩增子、扩增子、标记探针)对于相应靶中的每一个是特定的。图10c中显示了基于basescopetm测定法的靶核酸的正交标记。图10c中显示了用相应的信号生成复合物(sgc)标记两个示例性靶核酸。图10c显示靶探针对1(tp1a和tp1b)与靶核酸1的结合。显示了一对前置前置扩增子(ppa1a和ppa1b)与相应的靶探针对(tp1a和tp1b)结合。显示了前置扩增子(pa1)与前置前置扩增子对(ppa1a和ppa1b)结合。显示了多个扩增子(amp1)与pa1结合。为了简单起见,显示了扩增子与一个前置扩增子结合,但是应当理解,扩增子可以结合所有前置扩增子。显示了多个标记探针(lp1)与扩增子结合。图10c示出了靶2的类似配置,其中sgc的组分(靶探针、前置前置扩增子、前置扩增子、扩增子、标记探针)对于相应靶中的每一个是特定的。
具体实施方式
本发明涉及例如通过原位杂交来多路复用分析核酸的方法。本发明的方法允许检测同一样品内和同一细胞内的多个靶核酸。本发明的方法利用独特鉴定靶核酸的标记组合来标记靶核酸。
如本文所用,术语“标记探针”是指直接或间接,通常间接地结合靶分子并允许靶被检测的实体。标记探针(或“lp”)含有通常为单链多核苷酸或寡核苷酸的核酸结合部分,其包含一个或多个直接或间接提供可检测信号的标记。标记可以与多核苷酸共价连接,或者多核苷酸可以被配置成与标记结合。例如,生物素化的多核苷酸可以结合与链霉亲和素结合的标记。标记探针可例如与靶核酸直接杂交。通常,标记探针可与核酸杂交,该核酸又与靶核酸杂交或与一种或多种与靶核酸杂交的其他核酸杂交。因此,标记探针可包含与靶核酸的多核苷酸序列,特别是一部分互补的多核苷酸序列。或者,标记探针可包含至少一个与本文所述的扩增子、前置扩增子、前置前置扩增子、信号产生复合物(sgc)等中的多核苷酸序列互补的多核苷酸序列。通常,在本发明的实施方案中,标记探针与扩增子结合。如本文所用,包含酶标记的标记探针是指包含核酸结合部分如寡核苷酸和与核酸结合部分偶联的酶的标记探针。如本文所公开的,酶与核酸结合部分的偶联可以是共价的或通过高亲和力结合相互作用,如生物素/抗生物素蛋白或其他类似的高亲和力结合分子。
如本文所用,“靶探针”是能够与靶核酸杂交并捕获或结合标记探针或信号产生复合物(sgc)组分(例如扩增子,前置扩增子或前置前置扩增子)至该靶核酸的多核苷酸。靶探针可与标记探针直接杂交,或其可与一个或多个核酸杂交,所述核酸又与标记探针杂交;例如,靶探针可与sgc中的扩增子,前置扩增子或前置前置扩增子杂交。因此,靶探针包括与靶核酸的多核苷酸序列互补的第一多核苷酸序列和与标记探针,扩增子,前置扩增子,前置前置扩增子等的多核苷酸序列互补的第二多核苷酸序列。通常,在本发明的实施方案中,靶探针结合到前置扩增子,如图9a和10a所示,或结合到前置前置扩增子,如图9b、9c、10b和10c所示。靶探针通常是单链的,使得互补序列可用于与相应的靶核酸、标记探针、扩增子、前置扩增子或前置前置扩增子杂交。在本发明的实施方案中,靶探针成对提供。
如本文所用,“扩增子”是能够与多个标记探针杂交的分子,通常是多核苷酸。通常,扩增子与多个相同的标记探针杂交。扩增子还可与靶核酸杂交,与一对靶探针中的至少一个靶探针杂交,与一对靶探针中的两个靶探针杂交,或与结合靶探针的核酸杂交,如扩增子、前置扩增子或前置前置扩增子。例如,扩增子可与至少一个靶探针和多个标记探针杂交,或与前置扩增子和多个标记探针杂交。通常,在本发明的实施方案中,扩增子可以与前置扩增子杂交。扩增子可以是例如线性、叉状、梳状或分支核酸。如本文对所有多核苷酸所述,扩增子可包括修饰的核苷酸和/或非标准核苷酸间连接以及标准脱氧核糖核苷酸,核糖核苷酸和/或磷酸二酯键。例如,在美国专利号5,635,352、5,124,246、5,710,264、5,849,481和7,709,198以及美国公开案2008/0038725和2009/0081688中描述了合适的扩增子,所述专利中的每一个以引用的方式并入。通常在本发明的实施方案中,扩增子结合到前置放大器和标记探针(参见图9和10)。
如本文所用,“前置扩增子”是用作一个或多个靶探针和一个或多个扩增至之间的中间结合组分的分子,通常是多核苷酸。通常,前置扩增子同时与一个或多个靶探针和多个扩增子杂交。例如在美国专利号5,635,352、5,681,697和7,709,198以及美国公开案2008/0038725、2009/0081688和2017/0101672中描述了示例性前置扩增子,其各自以引用的方式并入。通常,在本发明的实施方案中,前置扩增子结合到靶探针对的两个成员(见图9a和10a),结合到可结合到靶探针对的前置前置扩增子(见图9b和10b),或结合到可结合到靶探针对的前置前置扩增子对的两个成员(见图9c和10c)。前置扩增子也与扩增子结合(见图9和10)。
如本文所用,“前置前置扩增子”是用作一个或多个靶探针和一个或多个前置扩增子之间的中间结合组分的分子,通常是多核苷酸。通常,前置前置扩增子同时与一个或多个靶探针和多个前置扩增子杂交。例如,在2017/0101672中描述了示例性前置前置扩增子,其通过引用并入本文。通常,在本发明的实施方案中,前置前置扩增子结合到靶探针对(见图9b和10b)或结合到靶探针对的成员(见图9c和10c)和结合到前置扩增子。
如本文所用,术语“多个”应理解为意指两个或更多个。因此,多个可以指例如2个或更多、3个或更多、4个或更多、5个或更多、6个或更多、7个或更多、8个或更多、9个或更多、10个或更多、11个或更多、12个或更多、13个或更多、14个或更多、15个或更多、16个或更多、17个或更多、18个或更多、19个或更多、20个或更多、21个或更多、22个或更多、23个或更多、24个或更多、25个或更多、26个或更多、27个或更多、28个或更多、29个或更多、30个或更多、31个或更多、32个或更多、33个或更多、34个或更多、35个或更多、36个或更多、37个或更多、38个或更多、39个或更多、40个或更多、41个或更多、42个或更多、43个或更多、44个或更多、45个或更多、46个或更多、47个或更多、48个或更多、49个或更多、50个或更多、55个或更多、60个或更多、65个或更多、70个或更多、75个或更多、80个或更多、85个或更多、90个或更多、95个或更多、100个或更多、110个或更多、120个或更多、130个或更多、140个或更多、150个或更多、160个或更多、170个或更多、180个或更多、190个或更多、200个或更多、300个或更多、400个或更多、500个或更多、600个或更多、700个或更多、800个或更多、900个或更多、或1000个或更多、或甚至更大的数量,如果需要用于特定用途。
如本文所述,本发明涉及靶核酸的多路复用检测,其中所述方法提供比先前所述的原位杂交方法更高数目的靶核酸的检测。所述方法可以使用正交扩增系统来清楚地检测多个靶核酸。
在一个实施方案中,本发明提供了用于多个靶核酸的多路复用检测的方法,其包括使包含多个靶核酸的样品与一组探针接触,其中所述探针组包含探针亚组,所述探针亚组包含一种或多种对每个靶核酸特异的探针,其中每个探针亚组包含提供可检测标记的组合的多个可检测标记,其中所述可检测标记的组合提供对每个靶核酸的独特标记,以及检测与相应靶核酸结合的可检测标记的组合。在这种方法的一个实施方案中,可检测标记的组合选自图3-7中任一个或本文所述的标记配置的组合。
在一个实施方案中,本发明提供用于细胞中多个靶核酸的多路复用检测的方法,其包括(a)使包含含有多个靶核酸的细胞的样品与一组探针接触,其中所述探针组包含探针亚组,所述探针亚组包含提供对每个靶核酸的独特标记的多个可检测标记,其中每个探针亚组包含一个或多个不同的标记,其中不同标记的数目和/或组合对于每个靶核酸是独特的;和(b)检测与相应靶核酸结合的可检测标记。
先前公开的检测靶核酸的方法描述于美国专利号7,709,198和欧洲专利号2500439中,其描述了原位检测核酸靶的方法,其中靶探针(tp)在与靶杂交时以彼此相邻的两个或更多个短探针的组排列。如图1a所示,每个单独的靶探针具有与靶互补的靶锚定区段(ta)和与信号产生复合物(sgc)的组分互补的信号锚定区段(sa)。每个sgc包含多层组分,例如扩增子(ap)和前置扩增子(pa),它们组装成树状结构,该树状结构能够在其“分支”上携带许多标记探针(lp)。如图1b所示,如果靶序列足够长,许多tp组和相关的sgc可以组装在靶上以产生在成像系统中作为离散“点”出现的可检测信号。可以进行手动或计算机化的点计数以量化样品中特定细胞中的靶的数目。图2示出了sgc的两个额外的不同配置,其中并入了例如协作扩增子(com)的扩增分子的额外层,以在一个sgc中携带更多的lp。这样的配置更适合于检测短靶序列,因为可用单个sgc产生可检测信号(参见例如wo2017/066211,其通过引用并入本文)。协作扩增子(com)也在图5c和6c中示出,其中com被示为前置扩增子,其在多个位置处结合到两个前置前置扩增子并结合到多个扩增子。
在许多应用中,在同一测定中检测许多靶是非常有价值的。先前公开的方法通过“汇集”或“多路复用”方法满足了这一需求。在汇集方法中,每个靶具有独特的tp组,但是所有tp组具有相同的sa,因此可以结合到相同的sgc。这样,当存在多个靶中的任一个时,检测到信号。当一组靶具有相同的临床效用或生物功能时,汇集方法是有用的。在多路复用方法中,每个靶具有其独特的不交叉杂交的sgc,当存在时为每个靶生成独特可识别的信号。当组中的每个靶单独或组合提供不同的临床或生物指征时,多路复用方法是有用的。在前述方法中,每个独特信号由携带相同标记的大量lp生成。这种方法的问题是通常存在有限数量的独特可识别的标记。在荧光检测模式中,例如,通常使用不同波长的四个荧光团。在基于成像的多路复用系统中多于六个荧光团是可能的,但是由于带宽限制和波长之间的串扰而变得困难。此限制对可在测定中多路复用的靶的数目施加了限制。文中公开的本发明打破了这种限制,从而实现更高水平的多路复用能力。
在文中公开的本发明中,每个lp具有独特的标记,但是与靶相关的lp不必相同。相反,它们可以是形成独特可识别的组合的几种不同lp的混合物。一个实例示于表1中,其中使用四种不同标记(l1、l2、l3和l4)的多路复用测定可产生15种独特的组合或识别代码以检测15个靶。
表1.基于四个不同标记的可区分标记的组合。
这样,可以使用n个独特标记来创建多达2n-1个独特多路复用信道。由于特定靶的每个分子在图像中表现为离散点,并且点的标记组成决定了靶的身份,这种“数字”多路复用方案不影响靶的量化,并且能够容忍高水平的噪音。
如果靶序列足够长,则可以在sgc水平上实现上述数字多路复用方案。如图3所示,对于具有2n-1个多路复用通道(即,n个独特标记)的多路复用测定,可以制备n个独特的、标记特异性sgc。每个sgc携带具有特定标记的相同lp。每个sgc的组分(例如pa、ap、lp等)与sgc独特地相关。它们被专门设计为彼此杂交以组装sgc,但不能与任何其他sgc的任何组分交叉杂交。在图3所示的示例性实施方案中,显示两个靶核酸与相应的sgc结合。对于一个靶核酸(图3中的上部靶),靶核酸的代码是1111,其中靶的sgc包含四个标记(4、3、2和1)。对于第二靶(图3中的下部靶),靶核酸的代码是1010,其中靶核酸的sgc包含两个标记(4和2)。当靶序列长时,可以设计许多tp组以特异性结合靶。每个tp组可以通过它们的sa耦合到所选择的sgc(见图1)。这样,将许多sgc捕获到每个靶。在测定中通过其sgc的独特组合可独特地鉴定每个靶。sgc水平实现的优点是只需要开发相对少量的不同sgc。因为每个sgc的组分不与其他sgc交叉杂交是至关重要的,所以开发大量sgc所涉及的工作量是相当大的。此实施方案的缺点是靶序列的长度必须足够长以容纳许多sgc。此外,由于靶序列的可及性,因此一些sgc可能不能在靶上成功组装。这可能导致编码错误,其可以如下所述加以解决。
在一个实施方案中,本发明提供用于细胞中多个靶核酸的多路复用检测的方法,其包括(a)使包含含有多个靶核酸的细胞的样品与一组探针接触,其中所述探针组包含探针亚组,所述探针亚组包含提供对每个靶核酸的独特标记的多个可检测标记,其中每个探针亚组包含一个或多个不同的标记,其中不同标记的数目和/或组合对于每个靶核酸是独特的;和(b)检测与相应靶核酸结合的可检测标记;并且其中每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含一个或多个靶探针亚组,其中每个靶探针亚组包含与靶核酸特异性杂交的多对靶探针;(b)一组前置扩增子,其中所述前置扩增子组包含一个或多个前置扩增子亚组,其中所述一个或多个前置扩增子亚组包含对所述一个或多个靶探针亚组中的每个靶探针对具有特异性的前置扩增子,其中每个前置扩增子包含用于所述靶探针亚组中的一个的靶探针对的结合位点和用于扩增子的多个结合位点;(c)一组扩增子,其中所述扩增子组包含对每个前置扩增子亚组具有特异性的一个或多个扩增子亚组,其中每个扩增子亚组包含多个扩增子,其中所述扩增子亚组中的一个的扩增子包含用于所述前置扩增子亚组中的一个的前置扩增子的结合位点和用于标记探针的多个结合位点;和(d)一组标记探针,其中所述标记探针组包含一个或多个标记探针亚组,其中每个标记探针亚组对所述扩增子亚组中的一个具有特异性,其中每个标记探针亚组包含多个标记探针,其中每个标记探针亚组中的标记探针包含标记和用于所述扩增子亚组中的一个的扩增子的结合位点,其中每个标记探针亚组中的标记在标记探针亚组之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述一个或多个标记探针亚组包含对于每个探针亚组不同的至少一个标记或标记组合(参见图3)。
在上述实施方案中,在sgc水平上实现靶标记,如图3所示。对应的靶探针,前置扩增子,扩增子和标记探针的每个亚组对应于sgc的特定“颜色”。在单个标记用于特定靶核酸的情况下(例如,在四个不同标记1000,0100,0010或0001的情况下),亚组对应于不同标记中的一种。在一组仅具有一个亚组的情况下,应理解所述组对应于所述一个亚组。
在一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含两个或更多个亚组。在另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含三个或更多个亚组。在另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含四个或更多个亚组。在一个实施方案中,用于所述两个或更多个亚组的靶探针结合位点在所述靶核酸上是混杂的(参见图5,上图)。如下文更详细地描述,此实施方案可用于减少错误编码。
数字多路复用方案也可以在sgc内的组分水平上(即,子sgc水平)实现。这种多路复用测定系统包含n个不同的标记特异性lp和2n-1个独特的靶特异性sgc。每个lp具有设计为与sgc中ap分子上的标记探针锚(la)杂交的区段(即,la是用于标记探针的扩增子上的结合位点)。设计并制备不同la的混合物以结合一组预定的不同lp,产生用于鉴定靶的可检测信号的独特组合。当靶序列非常短时,子sgc水平实现是有利的。此外,如下所述,降低了错误编码的概率。所述方法可用于检测靶序列中的单碱基变体或独特连接(参见例如wo2017/066211)。其缺点是需要开发相对大量的独特sgc(2n-1)。
图4a示出了子sgc实现的一个实施方案,其中上述sgcid代码在ap分子上实现。如图4a所示,ap具有一个设计为结合pa分子上的扩增子锚(aa)的区域(即,aa是用于扩增子的前置扩增子上的结合位点)和另一个包含多个la区段的区域(即,用于标记探针的扩增子上的结合位点)。在前述方法中,扩增子使用相同la的重复,即扩增子具有用于相同标记探针的多个结合位点。图3示出了使用相同la的重复将多个相同lp结合到扩增子的本发明的实施方案。然而,在图4a所示的实施方案中,根据sgc的独特识别代码来设计不同la的混合物。例如,如果sgc的id代码是l4、l3、l2、l1=1110,则在ap分子上产生用于lp类型4、3、2的相等数目的la,其将结合设计数目的所需lp以在测定中产生id代码。在图4a所示的示例性实施方案中,使用标记4、3和1示出的sgc的代码是1101。
在一个实施方案中,本发明提供用于细胞中多个靶核酸的多路复用检测的方法,其包括(a)使包含含有多个靶核酸的细胞的样品与一组探针接触,其中所述探针组包含探针亚组,所述探针亚组包含提供对每个靶核酸的独特标记的多个可检测标记,其中每个探针亚组包含一个或多个不同的标记,其中不同标记的数目和/或组合对于每个靶核酸是独特的;和(b)检测与相应靶核酸结合的可检测标记;并且其中每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针;(b)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点;(c)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于一个标记探针或两个或更多个不同标记探针的多个结合位点;和(d)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记或两个或更多个不同标记的组合的结合位点(参见图4a)。
在这种方法的一个实施方案中,标记探针组包含两个或更多个不同的标记探针,其中所述扩增子组包含多个不同的扩增子,并且其中在每个不同的扩增子上用于所述两个或更多个不同的标记探针的所述结合位点在每个不同的扩增子上具有不同的顺序(参见图7b)。此实施方案可用于减少错误编码,如下文更详细描述。
图4b示出了子sgc实现的另一个实施方案,其中sgcid代码在pa分子上实现。如图4b所示,制备n个“纯”ap分子,每个携带相同类型lp的相同la。pa分子具有一个设计为结合tp组的sa(信号锚定区段,即结合前置扩增子的tp区段;参见图1a)的区域,和另一个包含多个aa区段的区域(扩增子锚,即前置扩增子上结合到扩增子的区段)。在先前公开的方法中,这些是相同aa的重复。然而,在图1b所示的实施方案中,根据sgc的独特识别代码来设计不同aa的混合物。例如,如果sgc的id代码是l4、l3、l2、l1=1010,则在pa分子上产生用于携带lp类型4、2的ap的相等数目的aa,其将结合设计数目的所需lp以在测定中产生id代码。在图4b中所示的示例性实施方案中,使用标记4、3和1示出的sgc的代码是1101。
在一个实施方案中,本发明提供用于细胞中多个靶核酸的多路复用检测的方法,其包括(a)使包含含有多个靶核酸的细胞的样品与一组探针接触,其中所述探针组包含探针亚组,所述探针亚组包含提供对每个靶核酸的独特标记的多个可检测标记,其中每个探针亚组包含一个或多个不同的标记,其中不同标记的数目和/或组合对于每个靶核酸是独特的;和(b)检测与相应靶核酸结合的可检测标记;并且其中每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针;(b)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点;(c)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述多个扩增子包含含有用于所述前置扩增子的结合位点和用于标记探针的多个结合位点的扩增子,或其中所述多个扩增子包含两个或更多个不同扩增子,其中每个不同扩增子包含用于所述前置扩增子的结合位点和用于不同标记探针的多个结合位点;和(d)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中所述标记探针包含标记和用于所述扩增子的结合位点,或两个或更多个不同标记探针包含标记和用于两个或更多个不同扩增子的结合位点,其中每个不同标记探针上的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述前置扩增子包含用于包含用于所述标记探针的结合位点的所述扩增子的多个结合位点或用于包含用于所述两个或更多个不同标记探针的结合位点的所述两个或更多个不同扩增子的多个结合位点,并且其中所述标记探针的标记或所述两个或更多个不同标记探针的两个或更多个不同标记的组合对于每个探针亚组是不同的(参见图4b)。
在这种方法的一个实施方案中,多个扩增子包含两个或更多个不同的扩增子,并且其中用于所述不同扩增子的所述前置扩增子上的所述结合位点是混杂的(见图6b)。如下文更详细地描述,此实施方案可用于减少错误编码。
图4c示出了子sgc实现的又一实施方案,其中sgcid代码在lp分子上实现。在前述方法中,与单个sgc结合的lp序列都携带相同的标记。图3的实施方案也在给定的sgc上使用相同的标记。在图4c所示的实施方案中,与相同sgc结合的lp分子可以是lp的混合物,每个lp均根据预定义的代码薄缀合至不同的标记。例如,如图4c所示,sgc5lp是与三种不同标记缀合的lp的混合物,产生id代码1011。此实施方案的优点是lp对sgc复合物的“着色”将被完全随机化,这可以进一步帮助减少编码误差。由于sgcid代码不是在sgc中硬编码的,因此此方案提供了简单地通过即时设计不同的代码簿来将不同的id代码分配给不同测定配置中的不同sgc的灵活性。此外,lp的混合可以以不相等的量进行,以标准化n个标记之间的标记强度,这又有助于减少编码/解码错误。此外,可以根据不同标记的预定比率进行lp的混合,使得每个标记可以编码>1位信息。例如,1010id代码可以区别于101′0id代码,其中1′是指以高于或低于1的浓度存在的特定标记(因此提供不同的相对信号强度)。每种颜色可以以高达m个相对浓度提供,例如1、1′、1″、1″′等,这将受限于可以通过信号检测系统可靠检测的不同水平的数目和每个sgc中可用la位点的数目(la位点的总数越高,可以检测的不同水平的数目越大)。此实施方案的缺点是将需要mn-1lp和la序列来独特地编码和解码每个sgc。相比之下,在图4a所示的实施方案中,只需要n个独特的lp和la。
如图4c所示,sgcid代码在lp分子上实现。在此实施方案中,与相同sgc结合的lp分子可以是lp的混合物,每个lp均根据预定义的代码薄缀合至不同的标记。例如,如图4c所示,sgc5lp是与三种不同标记缀合的lp的混合物,产生对应于标记4、3和1的id代码1101。此实施方案的优点是lp对sgc复合物的“着色”将被完全随机化,这可以进一步帮助减少编码误差。在图4c的右侧示出了部分lp混合代码薄,其中使用4个标记示出了7个不同的示例性sgc代码。
图4d更详细地示出了图4c的实施方案。如图4d中所述,对于每个sgc,指定特定的标记锚(la,用于标记探针的扩增子上的结合位点),使得用于特定靶核酸的每个sgc在扩增子上具有多个相同的la。可以用标记探针(lp)提供组合标记的水平。在这种情况下,图示的sgc5显示扩增子包含多个相同的la,标记为“e”。如图4d所示,sgc5用对应于3个不同的标记探针(4、3和1)的3个id代码(1101)来编码,所有这些标记探针具有用于相应扩增子上的多个“e”la的相同的结合位点。因此,所有三个标记探针(4、3和1)都结合到sgc5的扩增子上,从而用标记代码1101标记sgc5靶核酸。
图4e更详细地示出了图4c的实施方案。示出了图4d的sgc5与其相应的靶核酸结合,其中标记探针具有与sgc5扩增子的相应“e”la结合的“e”结合位点(如图4d中)。还示出了与它们相应的靶核酸结合的两个另外的示例性sgc。如图4d所示编码的sgc1包含多个相同的la,标记为“a”。sgc1用对应于标记探针(1)的1个id代码(0001)编码,所述探针具有用于sgc1扩增子的多个“a”la的结合位点。因此,标记探针“1”与sgc1的扩增子结合,从而用标记代码0001标记sgc1靶核酸。如图4d所示编码的sgc3包含多个相同的la,标记为“c”。sgc3用对应于2个不同标记探针(2和1)的2个id探针(0011)编码,这两个探针具有用于对应的sgc3扩增子上的多个“c”la的相同结合位点。因此,标记探针(2和1)都与sgc3的扩增子结合,从而用标记代码0011标记sgc3靶核酸。
图4f更详细地示出了图4c的实施方案。图4f说明,一旦设计了特定靶核酸的sgc,就可以简单地通过改变与特定sgc的扩增子结合的标记探针上的标记来容易地修饰靶核酸的实际编码。例如,在图4d中,sgc2包含具有“b”la的扩增子,并使用标记2编码为0010。在图4f中,可以相对于靶探针、前置扩增子和具有“b”la的扩增子使用相同的sgc组装,而不是使用如图4b所示仅具有标记2的“b”la结合标记探针,可以使用具有标记3和2的混合物的“b”la结合标记探针,使得现在用两种标记编码sgc2(0110)。因此,标记3和2(0110)结合到sgc2扩增子上的“b”la。类似地,现在通过使用具有“e”la-结合标记探针的标记探针(其具有标记4、3和2的混合物)(1110)而不是如图4d所示的标记4、3和1(1101),在图4f中将包含具有“e”la的扩增子的sgc5编码为1110。
图4g更详细地示出了图4c的实施方案。在图4g中,可以通过使用不同比率的标记探针来实现额外的“编码”。如图4g所示,不是以等量结合不同标记探针,而是可以改变结合相应扩增子的不同标记探针的比率,使得不仅特定标记的存在,而且特定标记的相对量可以用作提供不同标记的另一种方式。如图4g所示,sgc2用标记3和2编码为0110,而sgc2′可用代码011′0和相同标记3和2编码不同的靶核酸,但其中与sgc2′结合的标记2与标记3的比率不同于与sgc2结合的标记2与标记3的比率。两种靶核酸用相同的标记探针标记,但靶核酸可基于与相应靶核酸结合的两个标记探针的相对量来区分。
如本文所述,可以通过使用不同比率的标记探针来实施额外的“编码”。可以改变不同标记探针的比例,而不是以相等的量添加不同标记探针,使得不仅特定标记的存在而且特定标记的相对量可以用作提供不同标记的另一种方式,如本文所述。一种获得不同比率的标记的方法是通过提供与相同la结合的不同相对比例的标记。例如,在一个实验中,提供给sgc用于结合一种靶核酸的两种不同标记探针的比例可以是1:1的比率。在单独的实验中,可以使用相同标记探针以两种不同探针的不同比率(例如2:1)标记不同靶核酸。在这种情况下,两种靶核酸用相同的标记探针标记,但靶核酸可基于与相应靶核酸结合的两种标记探针的相对量来区分。
可以实现用不同比率的相同标记探针标记两种靶核酸的相似类型进行并行检测,例如,通过使用两组标记探针检测两种靶核酸,其中每个靶的sgc在相应的扩增子上含有不同的la。在这种情况下,使具有相应扩增子结合位点的标记探针组与细胞接触,使得各组中的相同标记在两组之间具有不同的比率。在这种情况下,两种靶核酸用相同的标记探针标记,但靶核酸可基于与相应靶核酸结合的两种标记探针的相对量来区分。
利用不同比率的标记检测不同靶核酸的另一种方法可以在图4a和4b所示的实施方案中实现。例如,在与图4a相似的实施方案中,不是每个相应标记探针包括相同数目的la,而是可以将每个不同lp的la掺入到扩增子中以提供不同lp之间的特定比率,从而用一种比率标记靶核酸。不同比率的对相同lp特异的la可用于标记不同的靶核酸。在图4b所示的实施方案中可以使用类似的方法,其中与用于另一靶核酸的sgc相比,用于一种靶核酸的sgc上的不同比率包括用于前置扩增子上的扩增子(aa)的结合位点的比率。这些实施方案提供了基于标记的组合和不同标记的比率的额外“代码”,其中额外“代码”可以用相同的标记来实现。
如本文所述,在一些实施方案中,用于不同靶核酸的sgc在代码(例如,1000、1100、1110和1111)中将具有不同数目的标记(参见图4c和4d)。在这种情况下和在相应sgc上的la的数目相同的情况下,如果将标记探针的数目被添加到sgc,则编码1000的sgc将具有比结合到编码1111的sgc的标记4探针的数目更高数目的结合标记(标记4探针),因为标记探针4可以结合sgc中一个上的所有位点,但结合另一个sgc上的1/4位点。在本发明的一些实施方案中,可能需要标准化与由不同数目的不同标记编码的不同sgc结合的标记的量。在图4h所示的示例性实施方案中,两个靶核酸显示具有两个结合的sgc、sgc2和sgc5。sgc2用标记3和2被编码为0110,并且sgc5用标记4、3和2被编码为1110。在这种情况下,其中所有的标记探针与相应的la结合,在sgc2的情况下是“b”la,在sgc5的情况下是“e”la,并且假定sgc2和sgc5在相应的sgc中具有大约相同数目的la,则可以与sgc2结合的相应标记的数目将高于与sgc5结合的相应标记的数目(即,sgc2的2个不同标记(标记3和2)和sgc5的3个不同标记(标记4、3和2)将与相同数量的位点结合,导致与sgc5相比,更多数目的标记3和2与sgc2结合,因为一些sgc5位点被标记4占据)。如果需要,可以通过包括“空白”标记探针,即具有用于相应la的结合位点(在这种情况下,对于sgc2为“b”,对于sgc5为“e”)但没有标记的探针来标准化标记的数目(因此标准化信号强度)。例如,如果需要将sgc2和sgc5与相应标记的相同强度信号进行比较,则可在“b”la特异性探针的混合物中包括1/3“空白”标记探针,使得标记3和2的强度在两个sgc上相同(即,1/3的sgc2被“空白”标记探针占据,1/3的sgc5被标记4占据)。在另一个实施例中,如果进行其中一些sgc包括4个标记的多路复用测定,则可以进行所述测定,使得使用少于4个标记的标记探针组中包括相同比例的“空白”标记探针,例如,由2个不同标记(0110)编码的sg2特异性标记探针可以包括1/2“空白”标记探针,由3个不同标记(1110)编码的sgc5特异性标记探针包括1/4“空白”标记探针,使得与相应sgc结合的每个不同标记探针4、3、2和1的量在每个sgc上相同。使用这种“空白”标记探针也可与不同标记探针组合使用,以提供所需比例的相应标记,如sgc上所需比率的标记探针。
在一个实施方案中,本发明提供用于细胞中多个靶核酸的多路复用检测的方法,其包括(a)使包含含有多个靶核酸的细胞的样品与一组探针接触,其中所述探针组包含探针亚组,所述探针亚组包含提供对每个靶核酸的独特标记的多个可检测标记,其中每个探针亚组包含一个或多个不同的标记,其中不同标记的数目和/或组合对于每个靶核酸是独特的;和(b)检测与相应靶核酸结合的可检测标记;并且其中每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针;(b)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点;(c)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于标记探针的多个相同结合位点;和(d)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中用于所述扩增子的所述结合位点对于每个标记探针是相同的,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记或两个或更多个不同标记的组合的结合位点(参见图4c)。
在所述方法的一个实施方案中,两个或更多个不同标记探针的不同标记在用于两个靶核酸的两个探针亚组中是相同的,并且其中一个探针亚组中的标记探针的比率不同于第二探针亚组中的标记探针的比率,其中所述第一探针亚组和所述第二探针亚组中不同标记探针的比率差异区分所述两个靶核酸(参见图4g)。
类似的方法可以在sgc的其他组分上实现,并且图4a和图4b中所示的两个实施方案可以组合使用以确保预定的lp混合物可以组装到sgc上以生成id代码。
在本文所述的实施方案中,每个lp上的标记可以是间接标记,例如酶(例如辣根过氧化物酶(hrp))或半抗原(例如地高辛),其可以在随后的步骤中检测,以及本文公开的另外的标记。实施方案的一个实例是使用hrp作为lp中的标记,其可以通过使用缀合到酪酰胺的荧光染料提供额外的信号放大,如下文更详细描述的。增强的信号对于信号检测和降低次优样品如福尔马林固定石蜡包埋的组织或具有显著自发荧光的组织中的编码误差都是有利的。
在本发明的一些实施方案中,可以修改本发明的方法以减少错误编码。当来自被设计为与特定靶一起存在的lp类型的信号不可检测(即,错误“0”),或者背景噪声被误解为来自特定lp的信号(即,错误“1”)时,可能发生错误编码。错误的“1”型错误编码可以通过设置适当的阈值而在很大程度上消除。来自图像点周围区域的信号电平以及全局背景电平可用于参考背景。本文描述了用于减少错误的“0”型错误编码的方法。
当使用先前描述的sgc水平代码实现方法时,当特定lp类型的sgc由于tp对靶的有限可及性或靶降级而未连接到靶时,可能发生错误的“0”型错误编码。因此重要的是,每个标记特异性sgc在设计为结合相同靶的组中具有许多拷贝,使得从统计学上讲,每个所需lp存在于检测到的信号中存在很多机会。这意指为了降低错误编码率,靶序列必须非常长。例如,假设使用4个不同的lp,则每个lp特异性sgc都需要20个拷贝以确保可靠的检测,并且每个sgc都与占据50个核苷酸(50nt)的tp组结合,因此在这种情况下总靶长度必须是4×20×50=4000个核苷酸。而且,如图5所示,沿靶缠绕不同的sgc是有利的。如果不同的sgc类型被分开地定位在不同的组中,如图5下图所示,靶的特定部分可以被阻挡或屏蔽,从而防止一个特定sgc类型的连接,这将导致错误编码。当使用多于一种类型的sgc时,在相同类型的sgc中设计靶探针以在混杂或缠绕的位点结合靶核酸,如图5上图所示,减少了错误编码的机会。
从减少错误编码的观点来看,在子sgc水平上实现id代码是有利的,因为一旦tp组成功地与靶杂交,就有更多的机会让不同的lp成功地连接到sgc而没有偏差。将不同的标记排列到交替的位置仍然是减少错误编码的可能性的非常重要的策略。如图6a所示,此特定sgc被从“1001”错误编码为“0001”,因为pa被截短,这可能发生在pa的制造期间。然而,如果如图6b所示实现图4b所示的实施方案,如果标记在pa上缠绕或混杂,则相同的截短不会引起错误编码。在具有ap水平编码的配置中可以使用类似的策略,如图4a所示。使由截短引起的潜在错误编码最小化的另一种方法是随机化编码靶特异性代码的ap或pa上不同标记的位置,如图7所示,其中多路复用通道id被编码在ap分子上。在图7a中,不同的标记探针以完全相同的方式定位在每个ap上,即,每个扩增子是相同的。例如,在制造期间,ap的截短可能导致某些标记与其他标记相比显著减少。这种不平衡增加了错误编码的机会。在最严重的情况下,截短可能导致某个标记的所有拷贝的丢失,导致完全的错误编码。在图7b中,ap上不同标记的位置被有意随机化。因此,截短不会导致sgc中标记数量和类型的大偏差。ap作为多个扩增子提供,其中包括不同扩增子的混合,其中针对特定标记探针的la的位置被不同地分布并且可以在不同扩增子上随机化。sgc中不同标记的随机化可通过使用本文所述实施方案的一种或组合来实现。
当错误的“0”型错误编码发生时,在其id代码中具有更多“1”的靶被误识别为在id代码中具有更少“1”的另一个靶。在大多数情况下,错误编码的概率低(例如,<5%)。当靶的数量处于相似的水平时,这种错误编码不会显著影响结果。如果一个靶以比其被错误编码的另一靶显著更高的量存在,则错误编码可具有显著影响(即,由于两个靶的量的差异,因此一个靶被错误编码为被误读为另一个靶)。因此,减少错误编码影响的一种重要方法是,如果已知靶的相对数量,则将具有较少“1”的id代码分配给较高数量的靶。例如,表1中的t1、t2、t4和t8的多路复用通道分别由单个标记编码。可以为具有最高数量的靶保留这些代码,因为如果在这些通道中发生任何错误的“0”错误编码,则它们将不会被错误解释为来自其他多路复用通道的信号。
可以采用在数字通信领域中使用的许多错误检测方案来检测错误编码。例如,奇偶校验可以确保通信期间的准确数据传输。将奇偶位附加到原始数据位以使总数据位为偶数或奇数。例如,来自n个标记之一的信号可用作“奇偶校验”位(表2中的示例代码簿中的l1)。将使位为“1”(存在)或“0”(不存在)以使n标记系统中的“1”的总数为奇数(即,奇数奇偶校验)或偶数(即,偶数奇偶校验)。根据奇偶校验的结果,可以计数或不计数检测到的靶。此奇偶校验方案可以检测单个或奇数个位错误,但是不能检测双个或偶数个位错误。这可以显著降低错误编码的概率。例如,如果单个位错误的机会是5%,则双位错误的机会理论上是0.25%。使用这种奇偶校验的代价是,如果分别采用偶数或奇数奇偶校验方案,则多路复用通道的数量减少到2n-1-1或2n-1(例如,与表1中的15个sgc代码相比,表2中的7或8个sgc代码)。代码簿可以被设计成包括奇数(或偶数)数量的标记。在表1所示的实施例中,对于奇数,来自表1的允许通道将是t1、t2、t4、t7、t8、t11、t13和t14。如果检测到其他通道之一,则它必须是错误的。
表2.具有奇偶校验的代码簿
如本文所述,可用多于一个不同的标记来标记特定的靶核酸。在这种情况下,单个“点”将由两个或更多个不同的标记组成。包括多于一个标记的点可以使用公知的方法去卷积以识别点中的各个标记。这些公知的方法包括如前所述的richardson-lucy去卷积算法(参见实施例i)(biggs等人,appliedoptics,vol.36,no.8,(1997);hanisch等人,“deconvolutionsofhubblespacetelescopeimagesandspectra,deconvolutionofimagesandspectra,”ed.p.a.jansson,第2版,academicpressca,(1997))。去卷积的其他方法包括但不限于wiener去卷积,正则化滤波器去卷积等(gonzalez等人,“digitalimageprocessing,”addison-wesleypublishingcompany,inc.(1992))。
上述和图3-7所示的实施方案示出了具有前置扩增子、扩增子和标记探针的sgc。应当理解,相同的原理可以应用于sgc,其中如本文所公开的,在sgc中包括前置前置扩增子组分(例如,对于具有前置前置扩增子层的sgc的实例,参见图5b、5c、6b和6c)。
在一个实施方案中,本发明提供用于细胞中多个靶核酸的多路复用检测的方法,其包括(a)使包含含有多个靶核酸的细胞的样品与一组探针接触,其中所述探针组包含探针亚组,所述探针亚组包含提供对每个靶核酸的独特标记的多个可检测标记,其中每个探针亚组包含一个或多个不同的标记,其中不同标记的数目和/或组合对于每个靶核酸是独特的;和(b)检测与相应靶核酸结合的可检测标记;并且其中每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含一个或多个靶探针亚组,其中每个靶探针亚组包含与靶核酸特异性杂交的多对靶探针;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含一个或多个前置前置扩增子亚组,其中所述一个或多个前置前置扩增子亚组包含对所述一个或多个靶探针亚组中每个靶探针对具有特异性的前置前置扩增子,其中每个前置前置扩增子包含用于所述靶探针亚组中的一个的靶探针对的结合位点和用于前置扩增子的多个结合位点;(c)一组前置扩增子,其中所述前置扩增子组包含一个或多个前置扩增子亚组,其中所述一个或多个前置扩增子亚组包含对所述一个或多个前置前置扩增子亚组中的前置前置扩增子具有特异性的前置扩增子,其中每个前置扩增子包含用于所述前置前置扩增子亚组中的一个的前置前置扩增子的结合位点和用于扩增子的多个结合位点;(d)一组扩增子,其中所述扩增子组包含对每个前置扩增子亚组具有特异性的一个或多个扩增子亚组,其中每个扩增子亚组包含多个扩增子,其中所述扩增子亚组中的一个的扩增子包含用于所述前置扩增子亚组中的一个的前置扩增子的结合位点和用于标记探针的多个结合位点;和(e)一组标记探针,其中所述标记探针组包含一个或多个标记探针亚组,其中每个标记探针亚组对所述扩增子亚组中的一个具有特异性,其中每个标记探针亚组包含多个标记探针,其中每个标记探针亚组中的标记探针包含标记和用于所述扩增子亚组中的一个的扩增子的结合位点,其中每个标记探针亚组中的标记在标记探针亚组之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述一个或多个标记探针亚组包含对于每个探针亚组不同的至少一个标记或标记组合。此实施方案类似于图3,除了在sgc中包括前置前置扩增子。
在一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含两个或更多个亚组。在这种方法的另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含三个或更多个亚组。在另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含四个或更多个亚组。
在一个实施方案中,用于所述两个或更多个亚组的靶探针结合位点在所述靶核酸上是混杂的(参见图5,上图,在sgc中包括前置前置扩增子)。
在一个实施方案中,本发明提供用于细胞中多个靶核酸的多路复用检测的方法,其包括(a)使包含含有多个靶核酸的细胞的样品与一组探针接触,其中所述探针组包含探针亚组,所述探针亚组包含提供对每个靶核酸的独特标记的多个可检测标记,其中每个探针亚组包含一个或多个不同的标记,其中不同标记的数目和/或组合对于每个靶核酸是独特的;和(b)检测与相应靶核酸结合的可检测标记;并且其中每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中所述前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子的多个结合位点;(c)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述前置前置扩增子的结合位点和用于扩增子的多个结合位点;(d)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于一个标记探针或两个或更多个不同标记探针的多个结合位点;和(e)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记或两个或更多个不同标记的组合的结合位点。此实施方案类似于图4a,除了在sgc中包括前置前置扩增子。
在一个实施方案中,标记探针组包含两个或更多个不同的标记探针,其中所述扩增子组包含多个不同的扩增子,并且其中在每个不同的扩增子上用于所述两个或更多个不同的标记探针的所述结合位点在每个不同的扩增子上具有不同的顺序(类似于图7b,除了在sgc中具有前置前置扩增子)。
在一个实施方案中,本发明提供用于细胞中多个靶核酸的多路复用检测的方法,其包括(a)使包含含有多个靶核酸的细胞的样品与一组探针接触,其中所述探针组包含探针亚组,所述探针亚组包含提供对每个靶核酸的独特标记的多个可检测标记,其中每个探针亚组包含一个或多个不同的标记,其中不同标记的数目和/或组合对于每个靶核酸是独特的;和(b)检测与相应靶核酸结合的可检测标记;并且其中每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中每个前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子的多个结合位点;(c)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述前置前置扩增子的结合位点和用于扩增子的多个结合位点;(d)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述多个扩增子包含含有用于所述前置扩增子的结合位点和用于标记探针的多个结合位点的扩增子,或其中所述多个扩增子包含两个或更多个不同扩增子,其中每个不同扩增子包含用于所述前置扩增子的结合位点和用于不同标记探针的多个结合位点;和(e)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中所述标记探针包含标记和用于所述扩增子的结合位点,或其中所述两个或更多个不同标记探针包含标记和用于所述两个或更多个不同扩增子的结合位点,其中每个不同标记探针上的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述前置扩增子包含用于包含用于所述标记探针的结合位点的所述扩增子的多个结合位点或用于包含用于所述两个或更多个不同标记探针的结合位点的所述两个或更多个不同扩增子的多个结合位点,并且其中所述标记探针的标记或所述两个或更多个不同标记探针的两个或更多个不同标记的组合对于每个探针亚组是不同的。此实施方案类似于图4b,除了在sgc中包括前置前置扩增子。
在一个实施方案中,多个扩增子包含两个或更多个不同扩增子,并且其中用于所述不同扩增子的所述前置扩增子上的所述结合位点是混杂的(类似于图6b,除了在sgc中具有前置前置扩增子层)。
在一个实施方案中,本发明提供用于细胞中多个靶核酸的多路复用检测的方法,其包括(a)使包含含有多个靶核酸的细胞的样品与一组探针接触,其中所述探针组包含探针亚组,所述探针亚组包含提供对每个靶核酸的独特标记的多个可检测标记,其中每个探针亚组包含一个或多个不同的标记,其中不同标记的数目和/或组合对于每个靶核酸是独特的;和(b)检测与相应靶核酸结合的可检测标记;并且其中每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中所述前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子或用于两个或更多个不同前置扩增子的多个结合位点;(c)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述多个前置扩增子包含含有用于所述前置前置扩增子的结合位点和用于扩增子的多个结合位点的前置扩增子;或其中所述多个前置扩增子包含两个或更多个不同前置扩增子,其中每个不同前置扩增子包含用于所述前置前置扩增子的结合位点和用于不同扩增子的多个结合位点;(d)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述多个扩增子包含含有用于所述前置扩增子的结合位点和用于标记探针的多个结合位点的扩增子,或其中所述多个扩增子包含两个或更多个不同扩增子,其中每个不同扩增子包含用于所述不同前置扩增子中的一个的结合位点和用于不同标记探针的多个结合位点;和(e)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中所述标记探针包含标记和用于所述扩增子的结合位点,或其中所述两个或更多个不同标记探针包含标记和用于所述两个或更多个不同扩增子的结合位点,其中每个不同标记探针上的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述前置前置扩增子包含用于包含用于包含用于所述标记探针的结合位点的所述扩增子的多个结合位点的所述前置扩增子的多个结合位点,或用于各自包含用于包含用于所述两个或更多个不同标记探针中一个的结合位点的所述两个或更多个不同扩增子中一个的多个结合位点的所述两个或更多个不同前置扩增子的多个结合位点,并且其中所述标记探针的标记或所述两个或更多个不同标记探针的两个或更多个不同标记的组合对于每个探针亚组是不同的。此实施方案类似于图4b,除了组合标记是在结合到前置前置扩增子的一个或多个不同前置扩增子的水平上实现的,而不是在结合到前置扩增子的一个或多个不同扩增子的水平上实现的,如图4b所示。
在一个实施方案中,多个前置扩增子包含两个或更多个不同的前置扩增子,其中用于不同前置扩增子的前置前置扩增子上的结合位点是混杂的。此实施方案类似于图6b,除了组合标记是在结合到前置前置扩增子的一个或多个不同前置扩增子的水平上实现的,而不是在结合到前置扩增子的一个或多个不同扩增子的水平上实现的,如图6b所示。
在一个实施方案中,本发明提供用于细胞中多个靶核酸的多路复用检测的方法,其包括(a)使包含含有多个靶核酸的细胞的样品与一组探针接触,其中所述探针组包含探针亚组,所述探针亚组包含提供对每个靶核酸的独特标记的多个可检测标记,其中每个探针亚组包含一个或多个不同的标记,其中不同标记的数目和/或组合对于每个靶核酸是独特的;和(b)检测与相应靶核酸结合的可检测标记;并且其中每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中所述前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子的多个结合位点;(c)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点;(d)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于标记探针的多个相同结合位点;和(e)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中用于所述扩增子的所述结合位点对于每个标记探针是相同的,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记探针或两个或更多个不同标记探针的组合的结合位点。此实施方案类似于图4c,除了在sgc中包括前置前置扩增子。
在所述方法的一个实施方案中,两个或更多个不同标记探针的不同标记在用于两个靶核酸的两个探针亚组中是相同的,并且其中一个探针亚组中的标记探针的比率不同于第二探针亚组中的标记探针的比率,其中所述第一探针亚组和所述第二探针亚组中的不同标记探针的比率差异区分所述两个靶核酸。
通常,当使用不同的和可区分的标记用于靶核酸的多路复用检测时,对可并行区分的不同标记的数目存在限制。例如,在荧光标记的情况下,为了同时检测多个标记,应该对荧光团的发射进行光谱分离,以便荧光显微镜可以并行区分荧光团。需要对荧光团的发射进行分离光谱,这限制了可以同时可视化的荧光团的数量。本发明通过迭代地检测标记来避免这种限制,使得相同的荧光团可以用于连续回合以检测不同的靶核酸。
图10描述了可用于本发明方法的检测系统的正交特性。图10a显示了一个实施方案,其使用三个示例性靶核酸和相应的正交检测系统,在本文中也称为信号产生复合物(sgc)。如图10a所示,每个靶核酸与特异性靶探针对(tp1a和tp1b,tp2a和tp2b,tp3a和tp3b)杂交,再与相应特异性前置扩增子(pa1,pa2,pa3)杂交,再与相应特异性多个扩增子(amp1,amp2,amp3)杂交,再与相应特异性多个标记探针(lp1,lp2,lp3)杂交。图10b显示了另一个实施方案,其利用两个示例性靶核酸和相应的正交检测系统。如图10b所示,每个靶核酸与特异性靶探针对(tp1a和tp1b,tp2a和tp2b)杂交,再与相应的特异性前置前置扩增子(ppa1,ppa2)杂交,再与相应的特异性多个前置扩增子(pa1,pa2)杂交,再与相应的特异性多个扩增子(amp1,amp2)杂交,再与相应的特异性多个标记探针(lp1,lp2)杂交。图10c显示另一个实施方案,其利用两个示例性靶核酸和相应的正交检测系统。如图10c所示,每个靶核酸与特异性靶探针对(tp1a和tp1b,tp2a和tp2b)杂交,再与相应特异性前置前置扩增子对(ppa1a和ppa1b,ppa2a和ppa2b)杂交,再与相应特异性前置扩增子(pa1和pa2)杂交,再与相应特异性扩增子(amp1和amp2)杂交,再与相应特异性标记探针(lp1和lp2)杂交。为简单起见,描述了多个扩增子与前置扩增子中的一个结合,但应了解,扩增子可结合到前置扩增子中的每一个。如图10所示,每个核酸靶具有特异性检测系统,其组分的结合由独特的结合位点介导,所述独特结合位点提供与一种特异性复合物的结合而不提供与另一种的结合。用于sgc组分与特定靶核酸杂交的这种独特结合位点可以通过设计结合位点(核酸序列)以提供所需的特异性来实现,如本领域所熟知的和本文所描述的。这种其中每个靶被独特标记的正交检测系统允许检测同一样品中的多个靶核酸。
在本文所述的一些实施方案中,所述方法利用正交扩增系统来独特地标记靶核酸,使得可以在同一样品中甚至在同一细胞中分析多个靶核酸。本发明利用对特定靶核酸具有特异性的信号产生复合物(sgc)的构建,使得每个靶核酸可以被独特地鉴定。在一个实施方案中,使样品与包含可与靶核酸特异性杂交的一对靶探针的靶探针组接触。还将样品与一组前置扩增子接触,所述前置扩增子组包括对每个靶探针组具有特异性的前置扩增子,并且可与和相应靶核酸杂交的靶探针对杂交。这种实施方案在图10a中示意性地示出。还将样品与扩增子接触,其中扩增子包括对每个前置扩增子具有特异性的扩增子亚组,该前置扩增子对靶探针对具有特异性,该靶探针对对靶核酸具有特异性。因此,每个靶核酸具有提供靶核酸之间区别的sgc的独特组分,靶探针对、前置扩增子和扩增子的组装。在另一个实施方案中,前置前置扩增子可以作为靶探针对和前置扩增子之间的额外扩增层结合到靶探针对(见图9b和10b)。
在另一个实施方案中,将样品与包含可与靶核酸特异性杂交的一对靶探针的靶探针组接触。还将样品与一组前置前置扩增子接触,所述前置前置扩增子组包括对每个靶探针组具有特异性的一对前置前置扩增子,并且可与和相应靶核酸杂交的靶探针对杂交。这种实施方案在图10c中示意性地示出。还将样品与一组前置扩增子接触,该前置扩增子组包括可特异性结合两对前置前置扩增子的前置扩增子,该前置前置扩增子对靶探针对具有特异性,该靶探针对对靶具有特异性。还将样品与扩增子接触,其中扩增子包括对每个前置扩增子具有特异性的扩增子亚组,该前置扩增子对前置前置扩增子对具有特异性,该前置前置扩增子对对靶探针对具有特异性,该靶探针对对靶核酸具有特异性。因此,每个靶核酸具有提供靶核酸之间区别的sgc的独特组分,靶探针对、前置前置扩增子、前置扩增子和扩增子的组装。
为了检测靶核酸,将标记探针组与样品接触。不是将样品与可检测所有靶核酸的标记探针接触,而是将样品与一组可检测靶核酸亚组的标记探针接触。因此,不是一次检测所有靶核酸,而是在迭代的检测回合中检测靶核酸。在一个回合中,对相应靶核酸具有特异性的标记探针可彼此区分,使得与第一回合的施加的标记探针相关的所有靶核酸可被并行检测到。
可在单个回合中并行检测到的靶核酸的数目将取决于标记探针中使用的标记的类型和如何区分这些标记。例如,在使用荧光标记的情况下,在单个回合中使用的荧光团需要是可区分的,因此应该对荧光团的发射进行光谱分离。根据检测系统和可用于区分具有重叠发射的荧光团的滤波器和/或软件的可用性,可并行区分的荧光团的数量高达10个,如果它们可被区分,则认为它们具有光谱分离,这是本领域公知的。用于检测多个荧光标记的成像系统是本领域公知的(例如,vectrapolaris、perkinelmer、walthamma)。
在又另一个实施方案中,本发明的方法可用于同时检测双链核酸和单链核酸,例如检测同一样品中的dna和rna。在这种情况下,可以设计探针以检测单链核酸,例如rna(参见,例如,美国专利号7,709,198、美国公开2008/0038725和2009/0081688,和2017/0101672)和双链核酸,使得可以在同一样品中检测双链核酸和单链核酸,例如dna和rna。
在一些实施方案中,对靶核酸具有特异性的每个靶探针组包含两对或更多对与相同靶核酸特异性杂交的靶探针。在这种情况下,对靶核酸具有特异性的靶探针组中的靶探针对与靶核酸的不同和非重叠序列结合。当使用具有两对或更多对可与相同靶核酸特异性杂交的靶探针的靶探针组时,结合靶探针对的分子,无论是前置扩增子(见图9a和10a),还是前置前置扩增子(见图9b、9c、10b和10c),对于相同靶探针组中的靶探针对通常是相同的。因此,结合相同靶核酸的靶探针对可被设计成包含用于sgc中结合靶探针对的分子(即前置扩增子或前置前置扩增子)的相同结合位点。使用多个靶探针对检测靶核酸提供了与多个sgc在相同靶核酸上的组装相关的更高信号。在一些实施方案中,用于结合相同靶核酸的靶探针对的数目为每个靶1-10、1-20、1-30、1-40、1-50、1-60、1-70、1-80、1-90、1-100、1-110、1-120、1-130、1-140、1-150、1-160、1-170、1-180、1-190或1-200对,或更大数目的对,或其间的任何整数数目的对,例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200等。
本发明的方法可用于实现所需靶核酸的检测。在一个实施方案中,用多个靶探针对检测靶核酸。在这种情况下,靶探针对被设计成结合靶核酸的多于一个区域以允许多个sgc组装到靶核酸上。应当理解,如果多个靶探针对用于结合相同的靶核酸,则一个靶探针对的靶结合位点不与另一个靶探针对的靶结合位点重叠。
在本发明的实施方案中,通过本发明的方法检测的靶核酸可以是存在于细胞样品中的任何核酸,包括但不限于rna,包括信使rna(mrna)、微小rna(mirna)、核糖体rna(rrna)、线粒体rna、非编码rna等,或dna等。在一个特定实施方案中,核酸是rna。在用于核酸多路复用检测的本发明方法中,应当理解,靶核酸可以独立地是dna或rna。换句话说,待检测的靶核酸可以是但不一定是相同类型的核酸。因此,在本发明的测定中待检测的靶核酸可以是dna和rna。在靶核酸是rna的情况下,应理解,靶核酸可独立地选自由信使rna(mrna)、微小rna(mirna)、核糖体rna(rrna)、线粒体rna和非编码rna组成的群组。因此,靶核酸可以独立地是dna或任何类型的rna。
如本文所述,本发明的方法一般涉及靶核酸的原位检测。用于核酸的原位检测的方法是本领域技术人员熟知的(参见例如us2008/0038725;us2009/0081688;hicks等人,j.mol.histol.35:595-601(2004))。如本文所用,“原位杂交”或“ish”是指使用直接或间接标记的互补dna或rna链(例如探针)(原位)结合并定位样品(特别是组织或细胞的一部分或切片)中的特定核酸(例如dna或rna),的杂交类型。探针类型可以是双链dna(dsdna)、单链dna(ssdna)、单链互补rna(sscrna)、信使rna(mrna)、微小rna(mirna)、核糖体rna、线粒体rna和/或合成的寡核苷酸。术语“荧光原位杂交”或“fish”是指利用荧光标记的ish类型。术语“发色原位杂交”或“cish”是指具有发色标记的ish类型。ish,fish和cish方法是本领域技术人员熟知的(参见例如stoler,clinicsinlaboratorymedicine10(1):215-236(1990);insituhybridization.apracticalapproach,wilkinson,ed.,irlpress,oxford(1992);schwarzacherandheslop-harrison,practicalinsituhybridization,biosscientificpublishersltd,oxford(2000))。
对于用于原位检测细胞中核酸靶的本发明的方法,包括但不限于原位杂交或流式细胞术,任选地在靶探针杂交之前固定和/或透化细胞。将细胞固定和透化可促进核酸靶保留在细胞中并允许靶探针、标记探针、扩增子、前置扩增子、前置前置扩增子等进入细胞并到达靶核酸分子。任选地洗涤细胞以除去未被捕获到核酸靶上的物质。细胞可以在多个步骤中任一个之后洗涤,例如,在靶探针与核酸靶杂交以除去未结合的靶探针之后,在前置前置扩增子、前置扩增子、扩增子和/或标记探针与靶探针杂交之后,等等。用于固定和透化细胞以原位检测核酸的方法,以及用于杂交,洗涤和检测靶核酸的方法也是本领域公知的(参见例如us2008/0038725;us2009/0081688;hicks等人,j.mol.histol.35:595-601(2004);stoler,clinicsinlaboratorymedicine10(1):215-236(1990);insituhybridization.apracticalapproach,wilkinson,编,irlpress,oxford(1992);schwarzacherandheslop-harrison,practicalinsituhybridization,biosscientificpublishersltd,oxford(2000);shapiro,practicalflowcytometry第3版,wiley-liss,newyork(1995);ormerod,flowcytometry,第2版,springer(1999))。示例性固定剂包括但不限于醛(甲醛、戊二醛等)、丙酮、醇(甲醇、乙醇等)。示例性透化剂包括但不限于醇(甲醇、乙醇等)、酸(冰醋酸等)、去污剂(triton、np-40、tweentm20等)、皂苷、洋地黄皂苷、leucopermtm(biorad,hercules,ca)和酶(例如溶菌酶、脂肪酶、蛋白酶和肽酶)。透化也可以通过机械破裂发生,例如在组织切片中。
对于双链核酸的原位检测,通常处理样品以使样品中的双链核酸变性,以使靶探针通过杂交与靶双链核酸的链结合。使双链核酸变性的条件是本领域熟知的,包括热和化学变性,例如用碱(naoh)、甲酰胺、二甲亚砜等(参见wang等人,environ.healthtoxicol.29:e2014007(doi:10.5620/eht.2014.29.e2014007)2014;sambrook等人,molecularcloning:alaboratorymanual,第三版,coldspringharborlaboratory,newyork(2001);ausubel等人,currentprotocolsinmolecularbiology,johnwileyandsons,baltimore,md(1999))。例如,naoh、lioh或koh或其他高ph缓冲液(ph>11)可用于使双链核酸如dna变性。另外,热和化学变性方法可以组合使用。
这种原位检测方法可用于固定在载玻片上的组织标本,用于悬浮液中的单细胞,例如从血样中分离的外周血单核细胞(pbmc)等。组织标本包括例如组织活检样品。血样包括例如为诊断目的而采集的血样。在血样的情况下,可以直接分析血液,例如在血涂片中,或者可以处理血液,例如裂解红细胞,分离pbmc或白细胞,分离靶细胞等,使得通过本发明方法分析的样品中的细胞在血样中或来源于血样。类似地,可处理组织标本,例如,切碎并物理或酶处理组织标本以将组织破碎成单个细胞或细胞簇。另外,如果需要,可处理细胞学样品以分离细胞或破坏细胞簇。因此,可以使用本领域公知的方法获得和处理组织、血液和细胞学样品。本发明的方法可用于诊断应用以基于作为指示病理的生物标记的核酸靶的存在或不存在来鉴定病理细胞的存在或不存在。
本领域技术人员应理解,许多合适的样品中的任一种可用于使用本发明的方法检测靶核酸。用于本发明方法的样品通常是生物样品或组织样品。这样的样品可以从生物受试者获得,包括生物组织或流体来源的样品,其收集自个体或生物材料的一些其他来源,例如活检、尸检或法医材料。生物样品还包括来自含有或疑似含有癌前或癌细胞或组织的生物受试者区域的样品,例如组织活检,包括细针抽吸物、血液样品或细胞学标本。这样的样品可以是,但不限于,从生物体如哺乳动物分离的器官、组织、组织级分和/或细胞。示例性生物样品包括但不限于细胞培养物,包括原代细胞培养物、细胞系、组织、器官、细胞器、生物流体等。另外的生物样品包括但不限于皮肤样品、组织活检(包括细针抽吸物)、细胞学样品、粪便、体液(包括血液和/或血清样品)、唾液、精液等。这些样品可用于医学或兽医诊断目的。样品也可以从其他来源获得,例如食物、土壤、物体表面等,以及需要检测靶核酸的其他材料。因此,本发明的方法可用于从得自个体或其他来源的生物样品中检测一种或多种病原体,如病毒、细菌、真菌、单细胞生物体如寄生虫等。
用于通过本发明的方法分析的细胞学样品的收集是本领域公知的(参见例如,dey,“cytologysampleprocurement,fixationandprocessing”inbasicandadvancedlaboratorytechniquesinhistopathologyandcytology第121-132页,springer,singapore(2018);“non-gynecologicalcytologypracticeguideline”americansocietyofcytopathology,asc执行委员会于2004年3月2日通过)。处理用于分析宫颈组织的样品(包括组织活检和细胞学样品)的方法是本领域公知的(参见例如,ceciltextbookofmedicine,bennettandplum,编,第20版,wbsaunders,philadelphia(1996);colposcopyandtreatmentofcervicalintraepithelialneoplasia:abeginner’smanual,sellorsandsankaranarayanan,编,internationalagencyforresearchoncancer,lyon,france(2003);kalafandcooper,j.clin.pathol.60:449-455(2007);brownandtrimble,bestpract.res.clin.obstet.gynaecol.26:233-242(2012);waxman等人,obstet.gynecol.120:1465-1471(2012);cervicalcytologypracticeguidelinestoc,美国细胞病理学会(asc)执行委员会批准,2000年11月10日))。在一个实施方案中,细胞学样品是宫颈样品,例如巴氏涂片。在一个实施方案中,样品是细针抽吸物。
在本发明的特定实施方案中,样品是组织标本或来源于组织标本。在本发明的其他特定实施方案中,样品是血液样品或来源于血液样品。在本发明的另其他特定实施方案中,样品是细胞学样品或来源于细胞学样品。
本发明基于在靶核酸之间构建复合物以用可检测标记来标记靶核酸。这种复合物有时被称为信号生成复合物(sgc;参见例如us20170101672)。这种复合物或sgc通过构建允许大量标记连接到靶核酸的分子层来实现。
本发明的方法可以使用信号生成复合物(sgc),其中sgc包含多个分子而不是单个分子。这种sgc特别适用于放大可检测信号,提供对靶核酸的更高敏感性检测。此类用于放大信号的方法描述于例如美国专利号5,635,352、5,124,246、5,710,264、5,849,481和7,709,198,以及美国公开案2008/0038725和2009/0081688,以及wo2007/001986和wo2012/054795中,其各自通过引用并入本文。sgc的生成是rnascopetm测定的原理(参见美国专利号7,709,198、8,658,361和9,315,854,美国公开案2008/0038725、2009/0081688和2016/0201117,以及wo2007/001986和wo2012/054795,其各自通过引用并入本文)。
基本信号生成复合物(sgc)在图9a中示出(也参见us2009/0081688,其通过引用并入本文)。图9中描述为一对“z”的一对靶探针与标记为“靶”的互补分子序列杂交。每个靶探针含有与前置扩增子分子(pa,以绿色示出)互补的附加序列,其必须同时与靶探针对的两个成员杂交以便稳定结合。前置扩增子分子由两个结构域组成:一个结构域具有与每个靶探针杂交的区域,一个结构域含有一系列核苷酸序列重复,每个与扩增子分子(amp,以黑色表示)上的序列互补。此序列的多个重复的存在允许多个扩增子分子与一个前置扩增子杂交,这增加了整体信号放大。每个扩增子分子由两个结构域组成,一个结构域具有与前置扩增子杂交的区域,一个结构域含有一系列核苷酸序列重复,每个与标记探针(lp,以黄色表示)上的序列互补,允许多个标记探针与每个扩增子分子杂交,这进一步增加了整体信号放大。每个标记探针含有两个组分。一个组分由与扩增子分子上的重复序列互补以允许标记探针杂交的核苷酸序列组成。此核苷酸序列与第二组分连接,所述第二组分可以是任何信号生成实体,包括用于直接可视化的荧光或发色标记,可直接检测的金属同位素,或能够促进化学反应产生荧光、发色或其他可检测信号的酶或其他化学品,如本文所述。在图9a中,标记探针被描绘为代表核酸组分的线和代表信号生成组分的星号。从靶探针到标记探针的组装一起被称为信号生成复合物(sgc)。
图9b示出了通过添加扩增分子层(在这种情况下为前置前置扩增子分子(ppa,以红色示出))而放大的sgc。ppa结合一个结构域中的靶探针和另一个结构域中的多个前置扩增子(pa)。
图9c示出了在前置扩增子水平上使用协同杂交的不同sgc结构(参见us2017/0101672,其通过引用并入本文)。与图9a和9b中形成的sgc类似,一对靶探针与靶分子序列杂交。每个靶探针含有与独特的前置前置扩增子分子(ppa-1,以紫色示出;ppa-2,以红色示出)互补的另一序列。使用两个独立的分子建立了需要协同杂交的基础。每个前置前置扩增子分子由两个结构域组成,一个结构域具有与靶探针中一个杂交的区域,一个结构域含有一系列核苷酸序列重复,每个包含与前置扩增子分子(pa,以绿色表示)内的序列互补的序列,以及促进ppa-pa结合效率的间隔序列。为了稳定地连接到生长的sgc上,每个pa必须同时与两个ppa分子杂交。每个前置扩增子分子由两个结构域组成,一个结构域含有与两个前置前置扩增子互补以允许杂交的序列,一个结构域含有一系列核苷酸序列重复,每个与扩增子分子(amp,以黑色表示)上的序列互补。扩增子杂交序列的多个重复允许多个扩增子分子与每个前置扩增子杂交,进一步增加信号放大。为了简化说明,扩增子分子被示为与一个前置扩增子分子杂交,但是应当理解,扩增子可以与每个前置扩增子结合。每个扩增子分子含有与标记探针(lp,以黄色表示)内的序列互补的一系列核苷酸序列重复,允许几个标记探针与每个扩增子分子杂交。每个标记探针包含信号生成元件以提供信号检测。
如上所述,无论使用图9a、9b、10a或10b所示的配置,还是图9c和10c所示的配置,设计sgc的组分使得需要结合两个靶探针以构建sgc。在图9a、9b、10a或10b的配置的情况下,前置扩增子(或图9b和10b中的前置前置扩增子)必须结合靶探针对的两个成员以发生稳定结合。这通过设计靶探针和前置扩增子(或前置前置扩增子)之间的结合位点来实现,使得两个靶探针与前置扩增子(或前置前置扩增子)的结合具有比单个靶探针与前置扩增子(或前置前置扩增子)的结合更高的解链温度(tm),并且其中单个靶探针的结合在测定条件下是不稳定的。此设计先前已描述于例如美国专利号7,709,198、美国公开2008/0038725和2009/0081688、wo2007/001986、wo2007/002006,wang等人,同上,2012,anderson等人,同上,2016)中。通过以这种方式配置sgc组分,当两个靶探针都结合到靶核酸和前置扩增子时实现了sgc的组装,从而由于最小化作为假阳性的sgc的组装而降低了背景噪声。
在图9c和10c的配置的情况下,仅在靶探针对的两个成员都结合到靶核酸时才形成sgc的要求是通过要求前置扩增子结合到两个前置前置扩增子来实现的,这两个前置前置扩增子又分别结合到靶探针对的两个成员。此要求通过以下来实现:设计前置前置扩增子和前置扩增子之间的结合位点,使得两个前置前置扩增子与前置扩增子的结合之间的解链温度(tm)高于任一单独的前置前置扩增子的解链温度,并且其中一个前置前置扩增子与前置扩增子的结合在测定条件下是不稳定的。这种设计先前已经描述于例如us20170101672、wo2017/066211和baker等人,同上,2017)中。除非前置扩增子与两个前置前置扩增子结合,否则扩增子和标记探针不能组装成与靶核酸结合的sgc,从而由于最小化作为假阳性的sgc的组装而降低了背景噪声。
如本文所公开的,所述方法可基于构建与靶核酸结合的信号生成复合物(sgc)以检测细胞中靶核酸的存在。用于构建sgc的组分通常包含核酸,使得核酸杂交反应用于将sgc的组分结合至靶核酸。选择合适区域并设计与靶核酸结合的特异性和选择性试剂的方法,特别是与靶核酸或sgc的其他组分特异性和选择性结合的寡核苷酸或探针,是本领域技术人员众所周知的(参见sambrook等人,molecularcloning:alaboratorymanual,第三版,coldspringharborlaboratory,newyork(2001);ausubel等人,currentprotocolsinmolecularbiology,johnwileyandsons,baltimore,md(1999))。设计靶探针使得探针与靶核酸特异性杂交。可以使用对靶核酸区域以及适当长度的结合剂如寡核苷酸或探针的适当选择来实现期望的特异性,并且这种选择方法是本领域技术人员公知的。因此,本领域技术人员将容易理解并且可以容易地确定合适的试剂,例如寡核苷酸或探针,其可以用于靶向一种特定靶核酸而不是另一种靶核酸,或者提供与sgc组分的结合。可以通过使用对独特序列的适当选择,使得靶特异性sgc的给定组分(例如,靶探针、前置前置扩增子、前置扩增子、扩增子、标记探针)将与相应的组分结合,使得sgc与特异性靶结合来实现靶特异性sgc的类似特异性(参见图10)。
如本文所述,本发明的实施方案包括使用靶探针对。在一对靶探针结合到同一前置扩增子(图9a和10a)或前置前置扩增子(图9b和10b)的情况下,可以使用探针配置,有时称为“z”配置。这种配置及其用于增加敏感性和减少背景的优点例如在美国专利号7,709,198、美国公开2008/0038725和2009/0081688,以及wo2007/001986和wo2007/002006中进行了描述,其各自通过引用并入本文。美国专利号7,709,198和美国公开2008/0038725和2009/0081688另外描述了用于选择靶探针(例如靶探针对)的特征的细节,包括长度、取向、杂交条件等。本领域技术人员可以基于本文的教导和例如美国专利号7,709,198、美国公开2008/0038725和2009/0081688以及wo2007/001986和wo2007/002006中的教导容易地确定合适的配置。
如本文所述,靶探针对中的靶探针的靶结合位点可以是任何期望的取向和组合。例如,靶探针对的一个成员的靶结合位点相对于前置扩增子或前置前置扩增子结合位点可以是5′或3′,并且该对的另一个成员可以独立地将靶结合位点相对于前置扩增子或前置前置扩增子结合位点定位于5′或3′。
在另一个实施方案中,用于检测靶核酸存在的sgc是基于sgc的一个或多个组分的协同杂交(参见us20170101672和wo2017/066211,其各自通过引用并入本文)。这种协同杂交在本文中也称为basescopetm。在协同杂交效应中,sgc的两个组分之间的结合通过两个结合位点介导,并且同时与两个位点结合的解链温度高于单独一个位点结合的解链温度(参见us20170101672和wo2017/066211)。协同杂交效应可通过如us20170101672和wo2017/066211中所述的靶探针组配置来增强。
本发明的方法和相关组合物可利用协同杂交来增加特异性并降低核酸靶的原位检测中的背景,其中复杂的生理化学环境和大量非靶分子的存在可产生高噪音。使用这种协同杂交方法,标记探针的结合仅在sgc与靶核酸结合时发生。如us20170101672和wo2017/066211中所述及其图1中所示,通过增加sgc的一个或多个组分中协同杂交的数目,可以容易地修改所述方法以提供所需的信噪比。
在另一个实施方案中,协同杂交可应用于sgc的各种组分。例如,如本文所述,sgc的组分之间的结合可以是稳定的反应,或者也如本文所述,结合可以被配置成需要协同杂交。在这种情况下,设计用于协同杂交的结合组分,使得所述组分含有与另一组分结合的两个区段。
因此,用于检测靶核酸的方法可利用协同杂交用于检测系统中提供与靶核酸特异性结合的sgc的任一个或所有组分之间的结合反应。可以基于所需的测定条件、被测定的样品类型、所需的测定敏感性等选择应用协同杂交的组分的数目和哪些组分。协同杂交结合反应的任一种或组合可用于增加测定的敏感性和特异性。在本发明的实施方案中,协同杂交可以在前置前置扩增子和前置扩增子之间、在前置扩增子和扩增子之间、在扩增子和标记探针之间,或其组合(参见例如us20170101672和wo2017/066211)。
如本文所公开的,组分通常彼此直接结合。在含有核酸的组分的情况下,结合反应通常通过杂交进行。在杂交反应的情况下,组分之间的结合是直接的。如果需要,可以包括中间组分,使得一种组分与另一种组分的结合是间接的,例如,中间组分含有互补结合位点以桥接两个其他组分。
如本文所述,可选择各种组分的配置以提供所需的稳定或协同杂交结合反应(参见例如us20170101672)。应理解,即使结合反应在本文中示例为稳定的或不稳定的反应,例如对于协同杂交,任何结合反应可根据需要进行修饰,只要检测到靶核酸。还应当理解,可以根据所用的测定和杂交条件改变和选择配置。通常,如果期望结合反应是稳定的,则组分之间的互补核酸序列的区段通常在10至50个核苷酸或更多的范围内,例如16至30个核苷酸,如10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50个核苷酸或更多。如果期望结合反应相对不稳定,例如当使用协同杂交结合反应时,组分之间的互补核酸序列的区段通常在5至18个核苷酸的范围内,例如5、6、7、8、9、10、11、12、13、14、15、16、17或18个核苷酸。应当理解,对于稳定或不稳定杂交,核苷酸长度可以稍短或稍长,这取决于测定中使用的序列(例如gc含量)和条件。还应当理解,如本文所公开的,修饰的核苷酸如锁核酸(lna)或桥核酸(bna)可用于增加修饰碱基处的结合强度,从而允许减少结合区段的长度。因此,应理解,关于与其他核酸区段互补的核酸区段的长度,如果需要,可进一步减少本文所述的长度。本领域技术人员可以容易地确定合适的探针设计,包括长度、修饰核苷酸的存在等,以实现核酸组分之间所需的相互作用。
在设计包含互补序列的两个核酸序列之间的结合位点时,可以任选地设计互补序列以最大化解链温度的差异(dtm)。这可以通过使用本领域已知的解链温度计算算法来完成(参见例如santalucia,proc.natl.acad.sci.u.s.a.95:1460–1465(1998))。此外,已知人工修饰的碱基如锁核酸(lna)或桥核酸(bna)和天然存在的2′-o-甲基rna增强互补对之间的结合强度(petersen和wengel,trendsbiotechnol.21:74–81(2003);majlessi等人,nucl.acidsres.26:2224–2229(1998))。这些修饰的碱基可以根据需要策略性地引入到sgc组分之间的结合位点中。
一种方法是利用修饰的核苷酸(lna、bna或2′-o-甲基rna)。因为每个修饰的碱基可以增加解链温度,所以两个核酸序列(即互补序列)之间的结合区的长度可以显著缩短。修饰的碱基与其补体的结合强度更强,并且解链温度的差异(dtm)增加。又另一个实施方案是在待杂交的核酸组分的互补序列中或在例如信号生成复合物(sgc)的两个核酸组分之间使用三个修饰碱基(例如三个lna,bna或2′-o-甲基rna碱基,或两个或三个不同修饰碱基的组合)。这样的组分可以是例如前置前置扩增子、前置扩增子、扩增子、标记探针或靶探针对。
修饰的碱基,如lna或bna,可用于sgc选定组分的区段中,特别是介导核酸组分之间结合的那些,这增加了碱基与其互补碱基的结合强度,使得互补区段的长度减少(参见例如petersen和wengel,trendsbiotechnol.21:74–81(2003);美国专利号7,399,845)。扩展天然4字母表如人工扩展的遗传信息系统(aegis;yang等人,nucl.acidsres.34(21):6095-6101(2006))的人工碱基可以掺入sgc的相互作用组分之间的结合位点中。这些人工碱基可增加相互作用组分的特异性,这又可允许较低严格性杂交反应产生较高信号。
关于靶探针对,可以将靶探针对设计成结合靶核酸的紧邻区段或在靶探针对的靶探针结合位点之间具有一至多个碱基的区段上。通常,靶探针对被设计成结合靶核酸,使得在靶核酸上的结合位点之间通常存在0至500个碱基,例如5、10、15、20、25、30、35、40、45、50、60、70、80、90、100、120、140、160、180、200、220、240、260、280、300、320、340、360、380、400、420、440、460、480或500个碱基,或其间的任何整数长度。在特定的实施方案中,靶探针对的结合位点为0-100、0-200、或0-300个碱基,或其间的任何整数长度。在靶探针组中使用多于一个靶探针对以结合相同靶核酸(rna或单链dna)的情况下,并且在一对靶探针之间的结合位点中存在间隙的情况下,应理解不同靶探针对的结合位点不重叠。在检测双链核酸如dna的情况下,不同靶探针对之间可发生一些重叠,只要靶探针对能够并行地结合双链靶核酸的相应结合位点。
sgc还包含多个标记探针(lp)。每个lp包括可检测的区段。可检测组分可直接连接到lp,或lp可与包含可检测组分即标记的另一核酸杂交。如本文所用,“标记”是促进分子检测的部分。本发明上下文中的常见标记包括荧光、发光、光散射和/或比色标记。合适的标记包括酶、荧光和发色部分、以及放射性核素、底物、辅因子、抑制剂、化学发光部分、磁性颗粒、稀土金属、金属同位素等。在本发明的一个特定实施方案中,标记是酶。示例性酶标记包括但不限于辣根过氧化物酶(hrp)、碱性磷酸酶(ap)、-半乳糖苷酶、葡萄糖氧化酶等以及各种蛋白酶。其他标记包括但不限于荧光团、二硝基苯基(dnp)等。标记是本领域技术人员熟知的,例如描述于hermanson,bioconjugatetechniques,academicpress,sandiego(1996),以及美国专利号3,817,837;3,850,752;3,939,350;3,996,345;4,277,437;4,275,149;和4,366,241。许多标记是可商购的并且可用于本发明的方法和测定中,包括可检测的酶/底物组合(pierce,rockfordil;santacruzbiotechnology,dallastx;lifetechnologies,carlsbadca)。在本发明的一个特定实施方案中,酶可利用发色或荧光底物以产生可检测信号,如本文所述。本文描述了示例性标记。
可以使用多种酶或非酶标记中的任一种,只要可以分别检测到酶活性或非酶标记。酶由此产生可检测信号,其可用于检测靶核酸。特别有用的可检测信号是发色或荧光信号。因此,用作标记的特别有用的酶包括可获得发色或荧光底物的酶。这样的发色或荧光底物可以通过酶促反应转化为容易检测的发色或荧光产物,其可以使用显微镜或光谱法容易地检测和/或定量。这些酶是本领域技术人员熟知的,包括但不限于辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶、葡萄糖氧化酶等(参见hermanson,bioconjugatetechniques,academicpress,sandiego(1996))。具有众所周知的发色或荧光底物的其他酶包括各种肽酶,其中发色或荧光肽底物可用于检测蛋白水解裂解反应。发色和荧光底物的使用在细菌诊断学中也是众所周知的,包括但不限于使用-和-半乳糖苷酶、-葡糖醛酸糖苷酶、6-磷酸--d-半乳糖苷6-磷酸半乳糖苷水解酶、-葡糖苷酶、-葡糖苷酶、淀粉酶、神经氨酸酶、酯酶、脂肪酶等(manafi等人,microbiol.rev.55:335-348(1991)),这些具有已知发色或荧光底物的酶可容易地适用于本发明的方法。
产生可检测信号的各种发色或荧光底物是本领域技术人员熟知的并且是可商购的。可用于产生可检测信号的示例性底物包括但不限于用于辣根过氧化物酶的3,3'-二氨基联苯胺(dab)、3,3’,5,5’-四甲基联苯胺(tmb)、氯萘酚(4-cn)(4-氯-1-萘酚)、2,2'-连氮基-双(3-乙基苯并噻唑啉-6-磺酸)(abts)、邻苯二胺二盐酸盐(opd)和3-氨基-9-乙基咔唑(aec);用于碱性磷酸酶的5-溴-4-氯-3-吲哚基-1-磷酸(bcip)、氮蓝四唑(nbt)、固红(固红tr/as-mx)和对硝基苯基磷酸酯(pnpp);用于-半乳糖苷酶的1-甲基-3-吲哚基-β-d-吡喃半乳糖苷和2-甲氧基-4-(2-硝基乙烯基)苯基β-d-吡喃半乳糖苷;用于-葡糖苷酶的2-甲氧基-4-(2-硝基乙烯基)苯基β-d-吡喃葡萄糖苷等。示例性荧光底物包括但不限于用于碱性磷酸酶的4-(三氟甲基)伞形基磷酸酯;用于磷酸酶的4-甲基伞形基磷酸酯双(2-氨基-2-甲基-1,3-丙二醇)、4-甲基伞形基磷酸酯双(环己基铵)和4-甲基伞形基磷酸酯;用于辣根过氧化物酶的quantablutm和quantaredtm;用于β-半乳糖苷酶的4-甲基伞形基β-d-吡喃半乳糖苷、荧光素二(β-d-吡喃半乳糖苷)和萘荧光素二(β-d-吡喃半乳糖苷);用于β-葡糖苷酶的3-乙酰基伞形基β-d-吡喃葡糖苷和4-甲基伞形基-β-d-吡喃葡糖苷;和用于α-半乳糖苷酶的4-甲基伞形基-α-d-吡喃半乳糖苷。用于产生可检测信号的示例性酶和底物也描述于例如美国公开案2012/0100540中。各种可检测的酶底物(包括发色或荧光底物)是熟知的且可商购的(pierce,rockfordil;santacruzbiotechnology,dallastx;invitrogen,carlsbadca;42lifescience;biocare)。通常,将底物转化为形成沉淀的产物,沉淀沉积在靶核酸的位点。其他示例性底物包括但不限于hrp-green(42lifescience)、betazoiddab、cardassiandab、romulinaec、bajoran紫、vina绿、deepspaceblacktm、warpredtm、vulcan固红和来自biocare的ferangi蓝(concordca;biocare.net/products/detection/chromogens)。
适合作为可检测标记的示例性稀土金属和金属同位素包括但不限于镧系元素(iii)同位素,例如141pr、142nd、143nd、144nd、145nd、146nd、147sm、148nd、149sm、150nd、151eu、152sm、153eu、154sm、155gd、156gd、158gd、159tb、160gd、161dy、162dy、163dy、164dy、165ho、166er、167er、168er、169tm、170er、171yb、172yb、173yb、174yb、175lu和176yb。金属同位素可以例如使用飞行时间质谱法(tof-ms)(例如,fluidigmhelios和hyperionsystems,fluidigm.com/systems;southsanfrancisco,ca)测量。
生物素-抗生物素蛋白(或生物素-链霉抗生物素蛋白)是众所周知的信号放大系统,其基于以下事实:两个分子彼此具有特别高的亲和力且一个抗生物素蛋白/链霉抗生物素蛋白分子可结合四个生物素分子。抗体被广泛用于免疫组织化学和ish中的信号放大。酪酰胺信号放大(tsa)是基于因过氧化物酶活性导致大量半抗原化的酪酰胺分子沉积。酪胺是酚类化合物。在少量过氧化氢存在下,固定的辣根过氧化物酶(hrp)将标记的底物转化成短寿命、极具反应性的中间体。然后活化的底物分子在过氧化物酶结合位点处或附近与蛋白质的富电子部分如酪氨酸非常迅速地反应并共价结合。这样,可以在杂交位点原位引入许多与酪酰胺缀合的半抗原分子。随后,沉积的酪酰胺-半抗原分子可以直接或间接可视化。例如在美国公开2012/0100540中更详细地描述了这种检测系统。
本文所述的实施方案可利用酶使用合适的发色或荧光底物产生可检测信号。可以理解,替代地,标记探针可以具有直接偶联到标记探针的核酸部分的可检测标记。示例性可检测标记是本领域技术人员熟知的,包括但不限于发色或荧光标记(参见hermanson,bioconjugatetechniques,academicpress,sandiego(1996))。可用作标记的示例性荧光团包括但不限于罗丹明衍生物,例如四甲基罗丹明、罗丹明b、罗丹明6g、磺基罗丹明b、德克萨斯红(磺基罗丹明101)、罗丹明110及其衍生物,如四甲基罗丹明-5-(或6)、丽丝胺罗丹明b等;7-硝基苯-2-氧杂-1,3-二唑(nbd);荧光素及其衍生物;萘如丹磺酰(5-二甲基氨基萘-1-磺酰基);香豆素衍生物,例如7-氨基-4-甲基香豆素-3-乙酸(amca)、7-二乙基氨基-3-[(4'-(碘乙酰基)氨基)苯基]-4-甲基香豆素(dcia)、alexa荧光染料(molecularprobes)等;4,4-二氟-4-硼杂-3a,4a-二氮杂-s-引达省(bodipytm)及其衍生物(molecularprobes;eugene,or);芘和磺化芘,例如cascadebluetm及其衍生物,包括8-甲氧基芘-1,3,6-三磺酸等;吡啶基恶唑衍生物和达巴氧基衍生物(molecularprobes);荧光黄(3,6-二磺酸-4-氨基-萘二酰亚胺)及其衍生物;cydyetm荧光染料(amersham/gehealthcarelifesciences;piscatawaynj);atto390、dylight395xl、atto425、atto465、atto488、atto490ls、atto495、atto514、atto520、atto532、attorho6g、atto542、atto550、atto565、attorho3b、attorho11、attorho12、attothio12、attorho101、atto590、atto594、attorho13、atto610、atto620、attorho14、atto633、atto643、atto647、atto647n、atto655、attooxa12、atto665、atto680、atto700、atto725、atto740、cyan500nhs-酯(atto-tech,siegen,德国)等。示例性发色团包括但不限于酚酞、孔雀石绿、硝基芳族化合物如硝基苯基、重氮染料、dabsyl(4-二甲基氨基偶氮苯-4'-磺酰基)等。
如本文所公开的,所述方法可利用多个靶核酸的并行检测。在使用荧光团作为标记的情况下,选择用于检测多个靶核酸的荧光团,使得每种荧光团是可区分的,并且在并行检测靶核酸的情况下可以在荧光显微镜中被并行地检测。选择这样的荧光团以使发射光谱分离,使得可以并行检测靶核酸的不同标记。选择用于本发明方法的合适的可区分荧光团的方法是本领域熟知的(参见例如johnson和spence,“molecularprobeshandbook,aguidetofluorescentprobesandlabelingtechnologies,第11版,lifetechnologies(2010))。
可以利用熟知的方法如显微镜法、细胞计数法(例如,质量细胞计数法,通过飞行时间的细胞计数法(cytof),流式细胞术)或光谱法来可视化与相应靶核酸相关的发色、荧光或金属可检测信号。通常,如果在同一测定中使用不同的标记,则将发色底物或荧光底物,或发色或荧光标记,或稀土或金属同位素用于特定测定,使得可以使用单一类型的仪器来检测同一样品中的核酸靶。
本文所述的本发明一般涉及检测样品中的多个靶核酸。应当理解,本发明的方法还可用于检测样品中的多个靶核酸和任选的其他分子,特别是在与靶核酸相同的细胞中。例如,除了检测多个靶核酸外,细胞中表达的蛋白质也可使用本文所述用于检测靶核酸的类似原理并行地检测。在这种情况下,在多个靶核酸的一轮或多轮检测中,可以任选地检测细胞中表达的一种或多种蛋白质,例如,通过使用可检测的标记来检测蛋白质。如果在较早轮次的靶核酸检测中检测到蛋白质,则可以使用可裂解标记来检测蛋白质,所述可裂解标记类似于用于检测靶核酸的标记。如果在最后一轮检测中检测到蛋白质,则标记不需要是可裂解的。细胞中蛋白质的检测是本领域技术人员熟知的,例如,通过使用任何熟知的检测系统(包括本文描述的用于检测靶核酸的那些)检测蛋白质特异性抗体的结合。已经描述了在同一细胞中检测靶核酸和蛋白质(也参见schulz等人,cellsyst.6(1):25-36(2018))。
应当理解,本发明可以以任何期望的顺序进行,只要检测到靶核酸。因此,在本发明的方法中,使细胞与用于组装sgc的任何组分接触的步骤可以按任何所需顺序进行,可以按顺序进行,或可以同时进行,或一些步骤可以按顺序进行,而其他步骤可以按所需同时进行,只要检测到靶核酸。还应当理解,本文公开的实施方案可以根据需要独立地与本文公开的其他实施方案组合,以利用各种配置、组分大小、测定条件、测定敏感性等。
应当理解,本发明可以以提供靶核酸检测的任何形式进行。尽管本文已经使用原位杂交一般性地描述了本发明的实施,但是应当理解,如本领域所熟知的,本发明可以用于以其他形式检测靶核酸,特别是用于检测细胞中的靶核酸。可用于检测细胞中的靶核酸的一种方法是流式细胞术,如本领域熟知的(参见例如shapiro,practicalflowcytometry第三版.,wiley-liss,newyork(1995);ormerod,flowcytometry,第2版,springer(1999))。因此,本发明的方法,样品和试剂盒可用于原位杂交测定形式或其他形式,如流式细胞术。核酸检测方法(包括原位杂交)对流式细胞术的应用先前已有描述(参见例如hanley等人,plosone,8(2):e57002.doi:10.1371/journal.pone.0057002(2013);baxter等人,natureprotocols12(10):2029-2049(2017))。
在一些情况下,可能需要减少测定步骤的数目,例如减少杂交和洗涤步骤的数目。减少测定步骤数目的一种方式是在与细胞接触之前预组装sgc的一些或全部组分。这种预组装可以通过在接触靶核酸之前将sgc的一些或全部组分杂交在一起来进行。
本发明还提供了包含一个或多个细胞的样品。细胞可任选地被固定。细胞可任选地被透化。将细胞固定和/或透化特别适用于原位杂交测定。
在一个实施方案中,本发明提供了包含细胞的样品,其包含(a)至少一个含有多个靶核酸的细胞;和(b)一组探针,其中所述探针组包含探针亚组,所述探针亚组包含提供对每个靶核酸的独特标记的多个可检测标记,其中每个探针亚组包含一个或多个不同标记,其中不同标记的数目和/或组合对于每个靶核酸是独特的,并且其中至少一个探针亚组与靶核酸特异性杂交。
在本发明样品的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含一个或多个靶探针亚组,其中每个靶探针亚组包含与靶核酸特异性杂交的多对靶探针,其中亚组中的靶探针与所述靶核酸杂交;(b)一组前置扩增子,其中所述前置扩增子组包含一个或多个前置扩增子亚组,其中所述一个或多个前置扩增子亚组包含对所述一个或多个靶探针亚组中的每个靶探针对具有特异性的前置扩增子,其中每个前置扩增子包含用于所述靶探针亚组中的一个的靶探针对的结合位点和用于扩增子的多个结合位点,其中亚组中的前置扩增子与相应的靶探针亚组杂交;(c)一组扩增子,其中所述扩增子组包含对每个前置扩增子亚组具有特异性的一个或多个扩增子亚组,其中每个扩增子亚组包含多个扩增子,其中所述扩增子亚组中的一个的扩增子包含用于所述前置扩增子亚组中的一个的前置扩增子的结合位点和用于标记探针的多个结合位点,其中亚组中的扩增子与相应的前置扩增子亚组杂交;和(d)一组标记探针,其中所述标记探针组包含一个或多个标记探针亚组,其中每个标记探针亚组对所述扩增子亚组中的一个具有特异性,其中每个标记探针亚组包含多个标记探针,其中每个标记探针亚组中的标记探针包含标记和用于所述扩增子亚组中的一个的扩增子的结合位点,其中每个标记探针亚组中的标记在标记探针亚组之间是可区分的,其中亚组中的标记探针与相应的扩增子亚组杂交;其中对靶核酸具有特异性的每个探针亚组中的所述一个或多个标记探针亚组包含对于每个探针亚组不同的至少一个标记或标记组合。
在样品的一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含两个或更多个亚组。在另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含三个或更多个亚组。在另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含四个或更多个亚组。在一个实施方案中,用于所述两个或更多个亚组的靶探针结合位点在所述靶核酸上是混杂的。
在本发明样品的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针,其中所述靶探针与所述靶核酸杂交;(b)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点,其中所述前置扩增子与所述靶探针杂交;(c)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于一个标记探针或两个或更多个不同标记探针的多个结合位点,其中所述扩增子与所述前置扩增子杂交;和(d)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的,其中所述标记探针与所述扩增子杂交;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记或两个或更多个不同标记的组合的结合位点。
在样品的一个实施方案中,标记探针组包含两个或更多个不同的标记探针,其中所述扩增子组包含多个不同的扩增子,并且其中在每个不同的扩增子上用于所述两个或更多个不同的标记探针的所述结合位点在每个不同的扩增子上具有不同的顺序。
在本发明样品的一些实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针,其中所述靶探针与所述靶核酸杂交;(b)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点,其中所述前置扩增子与所述靶探针杂交;(c)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述多个扩增子包含含有用于所述前置扩增子的结合位点和用于标记探针的多个结合位点的扩增子,或其中所述多个扩增子包含两个或更多个不同扩增子,其中每个不同扩增子包含用于所述前置扩增子的结合位点和用于不同标记探针的多个结合位点,其中所述扩增子与所述前置扩增子杂交;和(d)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中所述标记探针包含标记和用于所述扩增子的结合位点,或其中所述两个或更多个不同标记探针包含标记和用于所述两个或更多个不同扩增子的结合位点,其中每个不同标记探针上的标记在所述不同标记探针之间是可区分的,其中所述标记探针与所述扩增子杂交;其中对靶核酸具有特异性的每个探针亚组中的所述前置扩增子包含用于包含用于所述标记探针的结合位点的所述扩增子的多个结合位点或用于包含用于所述两个或更多个不同标记探针的结合位点的所述两个或更多个不同扩增子的多个结合位点,并且其中所述标记探针的标记或所述两个或更多个不同标记探针的两个或更多个不同标记的组合对于每个探针亚组是不同的。
在样品的一个实施方案中,多个扩增子包含两个或更多个不同的扩增子,并且其中用于所述不同扩增子的所述前置扩增子上的所述结合位点是混杂的。
在本发明样品的一些实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针,其中所述靶探针与所述靶核酸杂交;(b)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点,其中所述前置扩增子与所述靶探针杂交;(c)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于标记探针的多个相同结合位点,其中所述扩增子与所述前置扩增子杂交;和(d)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中用于所述扩增子的所述结合位点对于每个标记探针是相同的,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记或两个或更多个不同标记的组合的结合位点。
在样品的一个实施方案中,两个或更多个不同标记探针的不同标记在用于两个靶核酸的两个探针亚组中是相同的,并且其中与一个靶核酸结合的标记探针的比率不同于与第二个靶核酸结合的标记探针的比率,其中所述第一探针亚组和所述第二探针亚组中不同标记探针的比率差异区分所述两个靶核酸。
在本发明样品的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针,其中所述靶探针与所述靶核酸杂交;(b)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点,其中所述前置扩增子与所述靶探针杂交;(c)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于标记探针的多个相同结合位点,其中所述扩增子与所述前置扩增子杂交;和(d)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中用于所述扩增子的所述结合位点对于每个标记探针是相同的,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的,其中所述标记探针与所述扩增子杂交;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记探针或两个或更多个不同标记探针的组合的结合位点。
在本发明样品的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含一个或多个靶探针亚组,其中每个靶探针亚组包含与靶核酸特异性杂交的多对靶探针,其中亚组中的靶探针与所述靶核酸杂交;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含一个或多个前置前置扩增子亚组,其中所述一个或多个前置前置扩增子亚组包含对所述一个或多个靶探针亚组中每个靶探针对具有特异性的前置前置扩增子,其中每个前置前置扩增子包含用于所述靶探针亚组中的一个的靶探针对的结合位点和用于前置扩增子的多个结合位点,其中亚组中的前置前置扩增子与相应的靶探针亚组杂交;(c)一组前置扩增子,其中所述前置扩增子组包含一个或多个前置扩增子亚组,其中所述一个或多个前置扩增子亚组包含对所述一个或多个前置前置扩增子亚组中的前置前置扩增子具有特异性的前置扩增子,其中每个前置扩增子包含用于所述前置前置扩增子亚组中的一个的前置前置扩增子的结合位点和用于扩增子的多个结合位点,其中亚组中的前置扩增子与相应的前置前置扩增子亚组杂交;(d)一组扩增子,其中所述扩增子组包含对每个前置扩增子亚组具有特异性的一个或多个扩增子亚组,其中每个扩增子亚组包含多个扩增子,其中所述扩增子亚组中的一个的扩增子包含用于所述前置扩增子亚组中的一个的前置扩增子的结合位点和用于标记探针的多个结合位点,其中亚组中的扩增子与相应的前置扩增子亚组杂交;和(e)一组标记探针,其中所述标记探针组包含一个或多个标记探针亚组,其中每个标记探针亚组对所述扩增子亚组中的一个具有特异性,其中每个标记探针亚组包含多个标记探针,其中每个标记探针亚组中的标记探针包含标记和用于所述扩增子亚组中的一个的扩增子的结合位点,其中每个标记探针亚组中的标记在标记探针亚组之间是可区分的,其中亚组中的标记探针与相应的扩增子亚组杂交;其中对靶核酸具有特异性的每个探针亚组中的所述一个或多个标记探针亚组包含对于每个探针亚组不同的至少一个标记或标记组合。
在样品的一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含两个或更多个亚组。在另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含三个或更多个亚组。在另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含四个或更多个亚组。在样品的一个实施方案中,用于所述两个或更多个亚组的靶探针结合位点在所述靶核酸上是混杂的。
在本发明样品的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针,其中所述靶探针与所述靶核酸杂交;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中所述前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子的多个结合位点,其中所述前置前置扩增子与所述靶探针杂交;(c)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述前置前置扩增子的结合位点和用于扩增子的多个结合位点,其中所述前置扩增子与所述前置前置扩增子杂交;(d)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于一个标记探针或两个或更多个不同标记探针的多个结合位点,其中所述扩增子与所述前置扩增子杂交;和(e)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的,其中所述标记探针与所述扩增子杂交;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记或两个或更多个不同标记的组合的结合位点。
在样品的一个实施方案中,标记探针组包含两个或更多个不同的标记探针,其中所述扩增子组包含多个不同的扩增子,并且其中在每个不同的扩增子上用于所述两个或更多个不同的标记探针的所述结合位点在每个不同的扩增子上具有不同的顺序。
在本发明样品的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针,其中所述靶探针与所述靶核酸杂交;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中每个前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子的多个结合位点,其中所述前置前置扩增子与所述靶探针杂交;(c)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述前置前置扩增子的结合位点和用于扩增子的多个结合位点,其中所述前置扩增子与所述前置前置扩增子杂交;(d)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述多个扩增子包含含有用于所述前置扩增子的结合位点和用于标记探针的多个结合位点的扩增子,或其中所述多个扩增子包含两个或更多个不同扩增子,其中每个不同扩增子包含用于所述前置扩增子的结合位点和用于不同标记探针的多个结合位点,其中所述扩增子与所述前置扩增子杂交;和(e)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中所述标记探针包含标记和用于所述扩增子的结合位点,或其中所述两个或更多个不同标记探针包含标记和用于所述两个或更多个不同扩增子的结合位点,其中每个不同标记探针上的标记在所述不同标记探针之间是可区分的,其中所述标记探针与所述扩增子杂交;其中对靶核酸具有特异性的每个探针亚组中的所述前置扩增子包含用于包含用于所述标记探针的结合位点的所述扩增子的多个结合位点或用于包含用于所述两个或更多个不同标记探针的结合位点的所述两个或更多个不同扩增子的多个结合位点,并且其中所述标记探针的标记或所述两个或更多个不同标记探针的两个或更多个不同标记的组合对于每个探针亚组是不同的。
在样品的一个实施方案中,多个扩增子包含两个或更多个不同的扩增子,并且其中用于所述不同扩增子的所述前置扩增子上的所述结合位点是混杂的。
在本发明样品的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针,其中所述靶探针与所述靶核酸杂交;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中所述前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子或用于两个或更多个不同前置扩增子的多个结合位点,其中所述前置前置扩增子与所述靶探针杂交;(c)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述多个前置扩增子包含含有用于所述前置前置扩增子的结合位点和用于扩增子的多个结合位点的前置扩增子,或其中所述多个前置扩增子包含两个或更多个不同前置扩增子,其中每个不同前置扩增子包含用于所述前置前置扩增子的结合位点和用于不同扩增子的多个结合位点,其中所述前置扩增子与所述前置前置扩增子杂交;(d)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述多个扩增子包含含有用于所述前置扩增子的结合位点和用于标记探针的多个结合位点的扩增子,或其中所述多个扩增子包含两个或更多个不同扩增子,其中每个不同扩增子包含用于所述不同前置扩增子中的一个的结合位点和用于不同标记探针的多个结合位点,其中所述扩增子与所述前置扩增子杂交;和(e)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中所述标记探针包含标记和用于所述扩增子的结合位点,或其中所述两个或更多个不同标记探针包含标记和用于所述两个或更多个不同扩增子的结合位点,其中每个不同标记探针上的标记在所述不同标记探针之间是可区分的,其中所述标记探针与所述扩增子杂交;其中对靶核酸具有特异性的每个探针亚组中的所述前置前置扩增子包含用于包含用于包含用于所述标记探针的结合位点的所述扩增子的多个结合位点的所述前置扩增子的多个结合位点,或用于各自包含用于包含用于所述两个或更多个不同标记探针中一个的结合位点的所述两个或更多个不同扩增子中一个的多个结合位点的所述两个或更多个不同前置扩增子的多个结合位点,并且其中所述标记探针的标记或所述两个或更多个不同标记探针的两个或更多个不同标记的组合对于每个探针亚组是不同的。
在样品的一个实施方案中,多个前置扩增子包含两个或更多个不同的前置扩增子,其中用于不同前置扩增子的前置前置扩增子上的结合位点是混杂的。
在本发明样品的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中所述前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子的多个结合位点;(c)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点;(d)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于标记探针的多个相同结合位点;和(e)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中用于所述扩增子的所述结合位点对于每个标记探针是相同的,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记探针或两个或更多个不同标记探针的组合的结合位点。
在样品的一个实施方案中,两个或更多个不同标记探针的不同标记在用于两个靶核酸的两个探针亚组中是相同的,并且其中一个探针亚组中的标记探针的比率不同于第二探针亚组中的标记探针的比率,其中所述第一探针亚组和所述第二探针亚组中的不同标记探针的比率差异区分所述两个靶核酸。
本发明另外提供了包含一个或多个细胞的载玻片。任选地,将一个或多个细胞固定在载玻片上。任选地,将一个或多个细胞透化。在特定的实施方案中,将载玻片上的细胞固定和/或透化用于原位测定。
在一个实施方案中,本发明提供载玻片,其包含(a)其上固定有至少一个含有多个靶核酸的细胞的载玻片;和(b)一组探针,其中所述探针组包含探针亚组,所述探针亚组包含提供对每个靶核酸的独特标记的多个可检测标记,其中每个探针亚组包含一个或多个不同标记,其中不同标记的数目和/或组合对于每个靶核酸是独特的,并且其中至少一个探针亚组与靶核酸特异性杂交。
在本发明载玻片的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含一个或多个靶探针亚组,其中每个靶探针亚组包含与靶核酸特异性杂交的多对靶探针,其中亚组中的靶探针与所述靶核酸杂交;(b)一组前置扩增子,其中所述前置扩增子组包含一个或多个前置扩增子亚组,其中所述一个或多个前置扩增子亚组包含对所述一个或多个靶探针亚组中的每个靶探针对具有特异性的前置扩增子,其中每个前置扩增子包含用于所述靶探针亚组中的一个的靶探针对的结合位点和用于扩增子的多个结合位点,其中亚组中的前置扩增子与相应的靶探针亚组杂交;(c)一组扩增子,其中所述扩增子组包含对每个前置扩增子亚组具有特异性的一个或多个扩增子亚组,其中每个扩增子亚组包含多个扩增子,其中所述扩增子亚组中的一个的扩增子包含用于所述前置扩增子亚组中的一个的前置扩增子的结合位点和用于标记探针的多个结合位点,其中亚组中的扩增子与相应的前置扩增子亚组杂交;和(d)一组标记探针,其中所述标记探针组包含一个或多个标记探针亚组,其中每个标记探针亚组对所述扩增子亚组中的一个具有特异性,其中每个标记探针亚组包含多个标记探针,其中每个标记探针亚组中的标记探针包含标记和用于所述扩增子亚组中的一个的扩增子的结合位点,其中每个标记探针亚组中的标记在标记探针亚组之间是可区分的,其中亚组中的标记探针与相应的扩增子亚组杂交;其中对靶核酸具有特异性的每个探针亚组中的所述一个或多个标记探针亚组包含对于每个探针亚组不同的至少一个标记或标记组合。
在载玻片的一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含两个或更多个亚组。在另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含三个或更多个亚组。在另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含四个或更多个亚组。在载玻片的一个实施方案中,用于所述两个或更多个亚组的靶探针结合位点在所述靶核酸上是混杂的。
在本发明载玻片的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针,其中所述靶探针与所述靶核酸杂交;(b)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点,其中所述前置扩增子与所述靶探针杂交;(c)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于一个标记探针或两个或更多个不同标记探针的多个结合位点,其中所述扩增子与所述前置扩增子杂交;和(d)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的,其中所述标记探针与所述扩增子杂交;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记或两个或更多个不同标记的组合的结合位点。
在载玻片的一个实施方案中,标记探针组包含两个或更多个不同的标记探针,其中所述扩增子组包含多个不同的扩增子,并且其中在每个不同的扩增子上用于所述两个或更多个不同的标记探针的所述结合位点在每个不同的扩增子上具有不同的顺序。
在本发明载玻片的一些实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针,其中所述靶探针与所述靶核酸杂交;(b)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点,其中所述前置扩增子与所述靶探针杂交;(c)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述多个扩增子包含含有用于所述前置扩增子的结合位点和用于标记探针的多个结合位点的扩增子,或其中所述多个扩增子包含两个或更多个不同扩增子,其中每个不同扩增子包含用于所述前置扩增子的结合位点和用于不同标记探针的多个结合位点,其中所述扩增子与所述前置扩增子杂交;和(d)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中所述标记探针包含标记和用于所述扩增子的结合位点,或其中所述两个或更多个不同标记探针包含标记和用于所述两个或更多个不同扩增子的结合位点,其中每个不同标记探针上的标记在所述不同标记探针之间是可区分的,其中所述标记探针与所述扩增子杂交;其中对靶核酸具有特异性的每个探针亚组中的所述前置扩增子包含用于包含用于所述标记探针的结合位点的所述扩增子的多个结合位点或用于包含用于所述两个或更多个不同标记探针的结合位点的所述两个或更多个不同扩增子的多个结合位点,并且其中所述标记探针的标记或所述两个或更多个不同标记探针的两个或更多个不同标记的组合对于每个探针亚组是不同的。
在载玻片的一个实施方案中,多个扩增子包含两个或更多个不同的扩增子,并且其中用于所述不同扩增子的所述前置扩增子上的所述结合位点是混杂的。
在本发明载玻片的一些实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针,其中所述靶探针与所述靶核酸杂交;(b)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点,其中所述前置扩增子与所述靶探针杂交;(c)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于标记探针的多个相同结合位点,其中所述扩增子与所述前置扩增子杂交;和(d)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中用于所述扩增子的所述结合位点对于每个标记探针是相同的,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的,其中所述标记探针与所述扩增子杂交;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记探针或两个或更多个不同标记探针的组合的结合位点。
在载玻片的一个实施方案中,两个或更多个不同标记探针的不同标记在用于两个靶核酸的两个探针亚组中是相同的,并且其中与一个靶核酸结合的标记探针的比率不同于与第二个靶核酸结合的标记探针的比率,其中所述第一探针亚组和所述第二探针亚组中不同标记探针的比率差异区分所述两个靶核酸。
在本发明载玻片的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针,其中所述靶探针与所述靶核酸杂交;(b)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点,其中所述前置扩增子与所述靶探针杂交;(c)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于标记探针的多个相同结合位点,其中所述扩增子与所述前置扩增子杂交;和(d)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中用于所述扩增子的所述结合位点对于每个标记探针是相同的,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的,其中所述标记探针与所述扩增子杂交;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记探针或两个或更多个不同标记探针的组合的结合位点。
在载玻片的一个实施方案中,两个或更多个不同标记探针的不同标记在用于两个靶核酸的两个探针亚组中是相同的,并且其中一个探针亚组中的标记探针的比率不同于第二探针亚组中的标记探针的比率,其中所述第一探针亚组和所述第二探针亚组中的不同标记探针的比率差异区分所述两个靶核酸。
在本发明载玻片的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含一个或多个靶探针亚组,其中每个靶探针亚组包含与靶核酸特异性杂交的多对靶探针,其中亚组中的靶探针与所述靶核酸杂交;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含一个或多个前置前置扩增子亚组,其中所述一个或多个前置前置扩增子亚组包含对所述一个或多个靶探针亚组中每个靶探针对具有特异性的前置前置扩增子,其中每个前置前置扩增子包含用于所述靶探针亚组中的一个的靶探针对的结合位点和用于前置扩增子的多个结合位点,其中亚组中的前置前置扩增子与相应的靶探针亚组杂交;(c)一组前置扩增子,其中所述前置扩增子组包含一个或多个前置扩增子亚组,其中所述一个或多个前置扩增子亚组包含对所述一个或多个前置前置扩增子亚组中的前置前置扩增子具有特异性的前置扩增子,其中每个前置扩增子包含用于所述前置前置扩增子亚组中的一个的前置前置扩增子的结合位点和用于扩增子的多个结合位点,其中亚组中的前置扩增子与相应的前置前置扩增子亚组杂交;(d)一组扩增子,其中所述扩增子组包含对每个前置扩增子亚组具有特异性的一个或多个扩增子亚组,其中每个扩增子亚组包含多个扩增子,其中所述扩增子亚组中的一个的扩增子包含用于所述前置扩增子亚组中的一个的前置扩增子的结合位点和用于标记探针的多个结合位点,其中亚组中的扩增子与相应的前置扩增子亚组杂交;以及(e)一组标记探针,其中所述标记探针组包含一个或多个标记探针亚组,其中每个标记探针亚组对所述扩增子亚组中的一个具有特异性,其中每个标记探针亚组包含多个标记探针,其中每个标记探针亚组中的标记探针包含标记和用于所述扩增子亚组中的一个的扩增子的结合位点,其中每个标记探针亚组中的标记在标记探针亚组之间是可区分的,其中亚组中的标记探针与相应的扩增子亚组杂交;其中对靶核酸具有特异性的每个探针亚组中的所述一个或多个标记探针亚组包含对于每个探针亚组不同的至少一个标记或标记组合。
在载玻片的一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含两个或更多个亚组。在另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含三个或更多个亚组。在另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含四个或更多个亚组。在载玻片的另一个实施方案中,用于所述两个或更多个亚组的靶探针结合位点在所述靶核酸上是混杂的。
在本发明载玻片的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针,其中所述靶探针与所述靶核酸杂交;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中所述前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子的多个结合位点,其中所述前置前置扩增子与所述靶探针杂交;(c)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述前置前置扩增子的结合位点和用于扩增子的多个结合位点,其中所述前置扩增子与所述前置前置扩增子杂交;(d)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于一个标记探针或两个或更多个不同标记探针的多个结合位点,其中所述扩增子与所述前置扩增子杂交;和(e)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的,其中所述标记探针与所述扩增子杂交;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记或两个或更多个不同标记的组合的结合位点。
在载玻片的一个实施方案中,标记探针组包含两个或更多个不同的标记探针,其中所述扩增子组包含多个不同的扩增子,并且其中在每个不同的扩增子上用于所述两个或更多个不同的标记探针的所述结合位点在每个不同的扩增子上具有不同的顺序。
在本发明载玻片的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针,其中所述靶探针与所述靶核酸杂交;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中每个前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子的多个结合位点,其中所述前置前置扩增子与所述靶探针杂交;(c)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述前置前置扩增子的结合位点和用于扩增子的多个结合位点,其中所述前置扩增子与所述前置前置扩增子杂交;(d)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述多个扩增子包含含有用于所述前置扩增子的结合位点和用于标记探针的多个结合位点的扩增子,或其中所述多个扩增子包含两个或更多个不同扩增子,其中每个不同扩增子包含用于所述前置扩增子的结合位点和用于不同标记探针的多个结合位点,其中所述扩增子与所述前置扩增子杂交;和(e)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中所述标记探针包含标记和用于所述扩增子的结合位点,或其中所述两个或更多个不同标记探针包含标记和用于所述两个或更多个不同扩增子的结合位点,其中每个不同标记探针上的标记在所述不同标记探针之间是可区分的,其中所述标记探针与所述扩增子杂交;其中对靶核酸具有特异性的每个探针亚组中的所述前置扩增子包含用于包含用于所述标记探针的结合位点的所述扩增子的多个结合位点或用于包含用于所述两个或更多个不同标记探针的结合位点的所述两个或更多个不同扩增子的多个结合位点,并且其中所述标记探针的标记或所述两个或更多个不同标记探针的两个或更多个不同标记的组合对于每个探针亚组是不同的。
在载玻片的一个实施方案中,多个扩增子包含两个或更多个不同的扩增子,并且其中用于所述不同扩增子的所述前置扩增子上的所述结合位点是混杂的。
在本发明载玻片的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针,其中所述靶探针与所述靶核酸杂交;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中所述前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子或用于两个或更多个不同前置扩增子的多个结合位点,其中所述前置前置扩增子与所述靶探针杂交;(c)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述多个前置扩增子包含含有用于所述前置前置扩增子的结合位点和用于扩增子的多个结合位点的前置扩增子,或其中所述多个前置扩增子包含两个或更多个不同前置扩增子,其中每个不同前置扩增子包含用于所述前置前置扩增子的结合位点和用于不同扩增子的多个结合位点,其中所述前置扩增子与所述前置前置扩增子杂交;(d)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述多个扩增子包含含有用于所述前置扩增子的结合位点和用于标记探针的多个结合位点的扩增子,或其中所述多个扩增子包含两个或更多个不同扩增子,其中每个不同扩增子包含用于所述不同前置扩增子中的一个的结合位点和用于不同标记探针的多个结合位点,其中所述扩增子与所述前置扩增子杂交;和(e)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中所述标记探针包含标记和用于所述扩增子的结合位点,或其中所述两个或更多个不同标记探针包含标记和用于所述两个或更多个不同扩增子的结合位点,其中每个不同标记探针上的标记在所述不同标记探针之间是可区分的,其中所述标记探针与所述扩增子杂交;其中对靶核酸具有特异性的每个探针亚组中的所述前置前置扩增子包含用于包含用于包含用于所述标记探针的结合位点的所述扩增子的多个结合位点的所述前置扩增子的多个结合位点,或用于各自包含用于包含用于所述两个或更多个不同标记探针中一个的结合位点的所述两个或更多个不同扩增子中一个的多个结合位点的所述两个或更多个不同前置扩增子的多个结合位点,并且其中所述标记探针的标记或所述两个或更多个不同标记探针的两个或更多个不同标记的组合对于每个探针亚组是不同的。
在载玻片的一个实施方案中,多个前置扩增子包含两个或更多个不同的前置扩增子,其中用于不同前置扩增子的前置前置扩增子上的结合位点是混杂的。
在本发明载玻片的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中所述前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子的多个结合位点;(c)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点;(d)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于标记探针的多个相同结合位点;和(e)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中用于所述扩增子的所述结合位点对于每个标记探针是相同的,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记探针或两个或更多个不同标记探针的组合的结合位点。
在载玻片的一个实施方案中,两个或更多个不同标记探针的不同标记在用于两个靶核酸的两个探针亚组中是相同的,并且其中一个探针亚组中的标记探针的比率不同于第二探针亚组中的标记探针的比率,其中所述第一探针亚组和所述第二探针亚组中的不同标记探针的比率差异区分所述两个靶核酸。
本发明还提供了包含如本文所述的sgc组分的试剂盒,用于靶核酸的多路复用标记。本发明试剂盒的组分可以任选地在容器中,并且可以任选地提供使用试剂盒的说明书。任选地,试剂盒可包含如本文所述的sgc的一种或多种组分,其中试剂盒不包括靶核酸。如本文所公开的,这样的试剂盒可以包含前置扩增子(pa)、扩增子(amp)和标记探针(lp),以及任选的前置前置扩增子(ppa)。任选地,试剂盒可包含针对特定靶核酸或多种靶核酸的靶探针(tp)。
在一个实施方案中,本发明提供了用于细胞中多个靶核酸的多路复用检测的试剂盒,其包含探针组,其中所述探针组包含探针亚组,所述探针亚组包含提供对每个靶核酸的独特标记的多个可检测标记,其中每个探针亚组包含一个或多个不同的标记,其中不同标记的数目和/或组合对于每个靶核酸是独特的。
在本发明试剂盒的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组前置扩增子,其中所述前置扩增子组包含一个或多个前置扩增子亚组,其中所述一个或多个前置扩增子亚组包含对所述一个或多个靶探针亚组中的每个靶探针对具有特异性的前置扩增子,其中每个前置扩增子包含用于所述靶探针亚组中的一个的靶探针对的结合位点和用于扩增子的多个结合位点;(b)一组扩增子,其中所述扩增子组包含对每个前置扩增子亚组具有特异性的一个或多个扩增子亚组,其中每个扩增子亚组包含多个扩增子,其中所述扩增子亚组中的一个的扩增子包含用于所述前置扩增子亚组中的一个的前置扩增子的结合位点和用于标记探针的多个结合位点;和(c)一组标记探针,其中所述标记探针组包含一个或多个标记探针亚组,其中每个标记探针亚组对所述扩增子亚组中的一个具有特异性,其中每个标记探针亚组包含多个标记探针,其中每个标记探针亚组中的标记探针包含标记和用于所述扩增子亚组中的一个的扩增子的结合位点,其中每个标记探针亚组中的标记在标记探针亚组之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述一个或多个标记探针亚组包含对于每个探针亚组不同的至少一个标记或标记组合。
在一个实施方案中,试剂盒包含一组靶探针,其中所述靶探针组包含一个或多个靶探针亚组,其中每个靶探针亚组包含与靶核酸特异性杂交的多对靶探针。在试剂盒的一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含两个或更多个亚组。在另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含三个或更多个亚组。在另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含四个或更多个亚组。在试剂盒的一个实施方案中,用于所述两个或更多个亚组的靶探针结合位点在所述靶核酸上是混杂的。
在本发明试剂盒的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点;(b)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于一个标记探针或两个或更多个不同标记探针的多个结合位点;和(c)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记或两个或更多个不同标记的组合的结合位点。
在一个实施方案中,试剂盒包含一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针。在试剂盒的一个实施方案中,标记探针组包含两个或更多个不同的标记探针,其中所述扩增子组包含多个不同的扩增子,并且其中在每个不同的扩增子上用于所述两个或更多个不同的标记探针的所述结合位点在每个不同的扩增子上具有不同的顺序。
在本发明试剂盒的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点;(b)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述多个扩增子包含含有用于所述前置扩增子的结合位点和用于标记探针的多个结合位点的扩增子,或其中所述多个扩增子包含两个或更多个不同扩增子,其中每个不同扩增子包含用于所述前置扩增子的结合位点和用于不同标记探针的多个结合位点;和(c)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中所述标记探针包含标记和用于所述扩增子的结合位点,或其中所述两个或更多个不同标记探针包含标记和用于所述两个或更多个不同扩增子的结合位点,其中每个不同标记探针上的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述前置扩增子包含用于包含用于所述标记探针的结合位点的所述扩增子的多个结合位点或用于包含用于所述两个或更多个不同标记探针的结合位点的所述两个或更多个不同扩增子的多个结合位点,并且其中所述标记探针的标记或所述两个或更多个不同标记探针的两个或更多个不同标记的组合对于每个探针亚组是不同的。
在一个实施方案中,试剂盒包含一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针。在试剂盒的一个实施方案中,多个扩增子包含两个或更多个不同的扩增子,并且其中用于所述不同扩增子的所述前置扩增子上的所述结合位点是混杂的。
在本发明试剂盒的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点;(b)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于标记探针的多个相同结合位点;和(c)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中用于所述扩增子的所述结合位点对于每个标记探针是相同的,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记探针或两个或更多个不同标记探针的组合的结合位点。
在试剂盒的一个实施方案中,两个或更多个不同标记探针的不同标记在用于两个靶核酸的两个探针亚组中是相同的,并且其中一个探针亚组中的标记探针的比率不同于第二探针亚组中的标记探针的比率,其中所述第一探针亚组和所述第二探针亚组中的不同标记探针的比率差异区分所述两个靶核酸。
在一个实施方案中,试剂盒包含一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针。
在本发明试剂盒的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点;(b)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于标记探针的多个相同结合位点;和(c)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中用于所述扩增子的所述结合位点对于每个标记探针是相同的,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的;并且其中每个标记探针亚组中的标记不同于另一个标记探针亚组中的标记;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记探针或两个或更多个不同标记探针的组合的结合位点。
在试剂盒的一个实施方案中,两个或更多个不同标记探针的不同标记在用于两个靶核酸的两个探针亚组中是相同的,并且其中一个探针亚组中的标记探针的比率不同于第二探针亚组中的标记探针的比率,其中所述第一探针亚组和所述第二探针亚组中的不同标记探针的比率差异区分所述两个靶核酸。
在本发明试剂盒的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组前置前置扩增子,其中所述前置前置扩增子组包含一个或多个前置前置扩增子亚组,其中所述一个或多个前置前置扩增子亚组包含对所述一个或多个靶探针亚组中每个靶探针对具有特异性的前置前置扩增子,其中每个前置前置扩增子包含用于所述靶探针亚组中的一个的靶探针对的结合位点和用于前置扩增子的多个结合位点;(b)一组前置扩增子,其中所述前置扩增子组包含一个或多个前置扩增子亚组,其中所述一个或多个前置扩增子亚组包含对所述一个或多个前置前置扩增子亚组中的前置前置扩增子具有特异性的前置扩增子,其中每个前置扩增子包含用于所述前置前置扩增子亚组中的一个的前置前置扩增子的结合位点和用于扩增子的多个结合位点;(c)一组扩增子,其中所述扩增子组包含对每个前置扩增子亚组具有特异性的一个或多个扩增子亚组,其中每个扩增子亚组包含多个扩增子,其中所述扩增子亚组中的一个的扩增子包含用于所述前置扩增子亚组中的一个的前置扩增子的结合位点和用于标记探针的多个结合位点;和(d)一组标记探针,其中所述标记探针组包含一个或多个标记探针亚组,其中每个标记探针亚组对所述扩增子亚组中的一个具有特异性,其中每个标记探针亚组包含多个标记探针,其中每个标记探针亚组中的标记探针包含标记和用于所述扩增子亚组中的一个的扩增子的结合位点,其中每个标记探针亚组中的标记在标记探针亚组之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述一个或多个标记探针亚组包含对于每个探针亚组不同的至少一个标记或标记组合。
在一个实施方案中,试剂盒包含一组靶探针,其中所述靶探针组包含一个或多个靶探针亚组,其中每个靶探针亚组包含与靶核酸特异性杂交的多对靶探针。在试剂盒的一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含两个或更多个亚组。在另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含三个或更多个亚组。在另一个实施方案中,所述靶探针组、前置扩增子组、扩增子组和标记探针组各自包含四个或更多个亚组。在试剂盒的一个实施方案中,用于所述两个或更多个亚组的靶探针结合位点在所述靶核酸上是混杂的。
在本发明试剂盒的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中所述前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子的多个结合位点;(b)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述前置前置扩增子的结合位点和用于扩增子的多个结合位点;(c)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于一个标记探针或两个或更多个不同标记探针的多个结合位点;和(d)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记或两个或更多个不同标记的组合的结合位点。
在一个实施方案中,试剂盒包含一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针。在试剂盒的一个实施方案中,标记探针组包含两个或更多个不同的标记探针,其中所述扩增子组包含多个不同的扩增子,并且其中在每个不同的扩增子上用于所述两个或更多个不同的标记探针的所述结合位点在每个不同的扩增子上具有不同的顺序。
在本发明试剂盒的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中每个前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子的多个结合位点;(b)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述前置前置扩增子的结合位点和用于扩增子的多个结合位点;(c)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述多个扩增子包含含有用于所述前置扩增子的结合位点和用于标记探针的多个结合位点的扩增子,或其中所述多个扩增子包含两个或更多个不同扩增子,其中每个不同扩增子包含用于所述前置扩增子的结合位点和用于不同标记探针的多个结合位点;和(d)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中所述标记探针包含标记和用于所述扩增子的结合位点,或其中所述两个或更多个不同标记探针包含标记和用于所述两个或更多个不同扩增子的结合位点,其中每个不同标记探针上的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述前置扩增子包含用于包含用于所述标记探针的结合位点的所述扩增子的多个结合位点或用于包含用于所述两个或更多个不同标记探针的结合位点的所述两个或更多个不同扩增子的多个结合位点,并且其中所述标记探针的标记或所述两个或更多个不同标记探针的两个或更多个不同标记的组合对于每个探针亚组是不同的。
在一个实施方案中,试剂盒包含一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针。在试剂盒的一个实施方案中,多个扩增子包含两个或更多个不同的扩增子,并且其中用于所述不同扩增子的所述前置扩增子上的所述结合位点是混杂的。
在本发明试剂盒的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中所述前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子或用于两个或更多个不同前置扩增子的多个结合位点;(b)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述多个前置扩增子包含含有用于所述前置前置扩增子的结合位点和用于扩增子的多个结合位点的前置扩增子;或其中所述多个前置扩增子包含两个或更多个不同前置扩增子,其中每个不同前置扩增子包含用于所述前置前置扩增子的结合位点和用于不同扩增子的多个结合位点;(c)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述多个扩增子包含含有用于所述前置扩增子的结合位点和用于标记探针的多个结合位点的扩增子,或其中所述多个扩增子包含两个或更多个不同扩增子,其中每个不同扩增子包含用于所述不同前置扩增子中的一个的结合位点和用于不同标记探针的多个结合位点;和(d)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中所述标记探针包含标记和用于所述扩增子的结合位点,或其中所述两个或更多个不同标记探针包含标记和用于所述两个或更多个不同扩增子的结合位点,其中每个不同标记探针上的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述前置前置扩增子包含用于包含用于包含用于所述标记探针的结合位点的所述扩增子的多个结合位点的所述前置扩增子的多个结合位点,或用于各自包含用于包含用于所述两个或更多个不同标记探针中一个的结合位点的所述两个或更多个不同扩增子中一个的多个结合位点的所述两个或更多个不同前置扩增子的多个结合位点,并且其中所述标记探针的标记或所述两个或更多个不同标记探针的两个或更多个不同标记的组合对于每个探针亚组是不同的。
在一个实施方案中,试剂盒包含一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针。在试剂盒的一个实施方案中,多个前置扩增子包含两个或更多个不同的前置扩增子,其中用于不同前置扩增子的前置前置扩增子上的结合位点是混杂的。
在本发明试剂盒的一个实施方案中,每个所述探针亚组中的每个探针包含(a)一组靶探针,其中所述靶探针组包含与靶核酸特异性杂交的多对靶探针;(b)一组前置前置扩增子,其中所述前置前置扩增子组包含多个前置前置扩增子,其中所述前置前置扩增子包含用于所述靶探针对的结合位点和用于前置扩增子的多个结合位点;(c)一组前置扩增子,其中所述前置扩增子组包含多个前置扩增子,其中所述前置扩增子包含用于所述靶探针对的结合位点和用于扩增子的多个结合位点;(d)一组扩增子,其中所述扩增子组包含多个扩增子,其中所述扩增子包含用于所述前置扩增子的结合位点和用于标记探针的多个相同结合位点;和(e)一组标记探针,其中所述标记探针组包含一个标记探针或两个或更多个不同标记探针,其中每个标记探针包含标记和用于所述扩增子的结合位点,其中用于所述扩增子的所述结合位点对于每个标记探针是相同的,其中每个不同标记探针中的标记在所述不同标记探针之间是可区分的;其中对靶核酸具有特异性的每个探针亚组中的所述扩增子包含用于对于每个探针亚组不同的一个标记探针或两个或更多个不同标记探针的组合的结合位点。
在试剂盒的一个实施方案中,两个或更多个不同标记探针的不同标记在用于两个靶核酸的两个探针亚组中是相同的,并且其中一个探针亚组中的标记探针的比率不同于第二探针亚组中的标记探针的比率,其中所述第一探针亚组和所述第二探针亚组中的不同标记探针的比率差异区分所述两个靶核酸。
在一个实施方案中,试剂盒包含用于固定和/或透化细胞的试剂。
应当理解,在本文提供的本发明的定义内还提供了基本上不影响本发明的各种实施方案的活性的修改。因此,以下实施例旨在说明而非限制本发明。
实施例i
靶核酸的多路复用检测
此实施例描述了四个靶核酸的多路复用检测。
使用三种荧光染料(alexa488、atto550和atto647n)检测四种靶mrna,5-羟色胺受体7(htr7)、原钙粘蛋白8(pcdh8)、酪氨酸羟化酶(th)和叉头盒p1(foxp1)。使用
图8a显示了染色的小鼠脑切片的概况。图8a中的方框区域在图8b中以40x的放大倍数示出。在matlab(mathworks;natick,ma)中用richardson-lucy空间去卷积算法处理缩放图像,检测信号点(示例性信号点用标记为801-804的箭头示出),并将颜色解码为各个靶并示于图8c-8f中。细胞核用dapi染色(示例性染色标记为805)。
这些结果表明三个荧光“颜色”代码可用于清楚地标记和检测四个靶核酸。
在整个申请中,引用了各种公布。这些公布的公开内容全部特此以引用的方式并入本申请,以便更全面地描述本发明所涉及的技术现状。尽管已参考以上提供的实施例描述本发明,但应理解在不脱离本发明精神的情况下可做出各种修改。
- 还没有人留言评论。精彩留言会获得点赞!