吉卡宾、其药学上可接受的盐、其组合物和其使用方法与流程
吉卡宾、其药学上可接受的盐、其组合物和其使用方法
1.相关申请的交叉引用
2.本技术要求于2018年10月18日提交的美国临时申请no.62/747,375的权益,所述临时申请的公开内容通过引用整体并入本文。
3.电子提交的文本文件描述
4.与本文一起电子提交的文本文件的内容通过引用整体并入本文:计算机可读格式的序列表拷贝(文件名:gmph_013_01wo_seqlist_st25.txt;记录日期:2019年10月17日;文件大小约12,254字节)。
技术领域
5.本发明提供了包含吉卡宾钙盐水合物晶型2或吉卡宾钙盐水合物晶型c3的片剂,所述晶型各自具有如通过激光衍射测得在35μm至90μm的范围内的psd90,并且其中所述片剂具有以在37℃
±
0.5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%的溶出%曲线为特征的吉卡宾溶出曲线,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量。本发明进一步提供了吉卡宾钙盐水合物晶型4、5和6。所述片剂和吉卡宾钙盐水合物晶型4、5和6可用于治疗或预防肝脏疾病或异常肝脏疾患、脂蛋白或葡萄糖代谢障碍、心血管或相关血管病症、由纤维化引起的疾病(例如肝纤维化)或与炎症相关的疾病(例如肝脏炎症)。
背景技术:
6.升高的低密度脂蛋白胆固醇(ldl
‑
c)和甘油三酯水平与混合性血脂异常(mixed lipidemia)(包括iib型高脂血症)相关。除了ldl
‑
c和甘油三酯水平升高以外,iib型还以载脂蛋白b、极低密度脂蛋白胆固醇(vldl
‑
c)、中密度脂蛋白胆固醇(idl)和小而密的低密度脂蛋白(ldl)水平的升高为特征。
7.患有混合性血脂异常的个体(包括患有iib型高脂血症的个体)具有增加的心血管疾病发展率,并且患有家族性混合型高脂血症(fchl)的那些个体具有早发性冠状动脉疾病的高发病率。家族性高脂血症可根据基于在电泳或超离心中的脂蛋白迁移模式的弗瑞迪克森(fredrickson)分类法分类。此外,iib型患者具有发展出非酒精性脂肪肝疾病(nafld)和非酒精性脂肪变性肝炎(nash)的高风险,其为可由于肝甘油三酯过度生产和累积而发展的脂肪肝的形式。nafld与代谢综合征的特征高度相关,包括肥胖症、胰岛素抗性、2型糖尿病和血脂异常。nash可引起肝肿胀并受到损伤。nash倾向于在超重或肥胖、或患有糖尿病或混合性血脂异常、或高胆固醇或高甘油三酯或炎症疾患的人中发展。nash是以肝细胞气球样变(ballooning)和肝脏炎症为特征,其可导致肝损伤并进展成疤痕和不可逆的变化,类似于由酗酒所引起的损伤。
8.nafld、nash或脂肪肝可导致代谢并发症,所述代谢并发症包括肝酶升高、纤维化、肝硬化、肝细胞癌和肝衰竭。肝衰竭是威胁生命的并因此存在开发延迟脂肪肝发展、预防脂肪肝形成或逆转脂肪肝状况的需求,例如在iib型患者和正处于脂肪肝疾病的风险或表现
为具有脂肪肝疾病的其他患者中。
9.目前用于iib型高脂血症的治疗选择有限。虽然他汀类药物在降低ldl
‑
c方面非常有效,但是它们通常在还降低甘油三酯浓度方面不是非常有效。此外,高剂量他汀疗法往往不具有良好的耐受性,因为其可引起肌肉疼痛(肌痛)并增加患者的严重肌肉毒性(例如横纹肌溶解症)的风险。与他汀类药物组合给出的常用的降甘油三酯药剂也不具有良好的耐受性。已知贝特类药物(fibrates)当与他汀类药物一起给出时具有药物
‑
药物相互作用,导致增加的他汀血液药物水平并呈现增加的安全性风险。事实上,他汀类(baychol(西立伐他汀(cerivastatin)))与贝特类(吉非罗齐(gemfibrozil))的相互作用导致严重的肌肉毒性和死亡,并且引起导致baychol从市场移除的安全性担忧。贝特类药物与肌痛和增加的肌肉毒性风险相关,鱼油需要每日服用多次,并且与鱼油余味、打嗝或回流相关,而烟酸引起脸红,特别当与他汀类药物组合施用时。
10.因此,存在如下需求:以最小的风险或副作用,安全且有效地治疗iib型高脂血症(其可降低ldl
‑
c浓度和甘油三酯浓度中的一者或两者),治疗或预防肝脏疾病或异常肝脏疾患、脂蛋白或葡萄糖代谢障碍、心血管或相关血管病症、由增加的纤维化水平所引起的疾病或与增加的炎症相关的疾病。
11.此外,具有小于30μm的psd90的吉卡宾的药学上可接受的盐可由于其低密度和/或增加的静电性质而难以操作。不受任何理论的束缚,具有低密度和/或高静电性质的粒子使得难以将这些粒子压片,特别是在制造过程中。
技术实现要素:
12.本发明提供了包含吉卡宾钙盐的片剂,所述钙盐的粒度分布特征在于如通过激光衍射测得在35μm至90μm的范围内的psd90,其中所述吉卡宾钙盐是吉卡宾钙盐水合物晶型2或吉卡宾钙盐水合物晶型c3,并且其中所述片剂具有以在37℃
±
0.5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%的溶出%曲线为特征的吉卡宾溶出曲线,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量(每个片剂是“本发明的片剂”)。
13.本发明还进一步提供了用于治疗或预防肝脏疾病或异常肝脏疾患的方法,包括向有需要的受试者施用有效量的本发明片剂。
14.本发明还进一步提供了用于治疗或预防脂蛋白代谢障碍的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
15.本发明还进一步提供了用于降低受试者的血浆或血清中受试者的总胆固醇浓度、低密度脂蛋白胆固醇浓度、低密度脂蛋白浓度、极低密度脂蛋白胆固醇浓度、极低密度脂蛋白浓度、非hdl胆固醇浓度、非hdl浓度、载脂蛋白b浓度、甘油三酯浓度、载脂蛋白c
‑
iii浓度、c反应蛋白浓度、血纤维蛋白原浓度、脂蛋白(a)浓度、白介素
‑
6浓度、血管生成素样蛋白3浓度、血管生成素样蛋白4浓度、pcsk9浓度或血清淀粉样蛋白a浓度的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
16.本发明还进一步提供了用于升高受试者的血浆或血清中受试者的高密度脂蛋白胆固醇浓度、高密度脂蛋白浓度、高密度胆固醇甘油三酯浓度、脂联素浓度或载脂蛋白a
‑
i浓度的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
17.本发明还进一步提供了用于治疗或预防血栓形成、血凝块、原发性心血管事件、继
发性心血管事件、进展成非酒精性脂肪肝疾病、非酒精性脂肪肝炎、肝硬化、肝细胞癌、肝衰竭、胰腺炎、肺纤维化或iib型高脂蛋白血症的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
18.本发明还进一步提供了用于降低受试者发展出血栓形成、血凝块、原发性心血管事件、继发性心血管事件、进展成非酒精性脂肪肝疾病、非酒精性脂肪肝炎、肝硬化、肝细胞癌、肝衰竭、胰腺炎、肺纤维化或iib型高脂蛋白血症的风险的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
19.本发明还进一步提供了用于降低或抑制受试者肝脏中的纤维化、脂肪变性、气球样变或炎症进展的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
20.本发明还进一步提供了用于降低餐后脂血症或预防延长的餐后脂血症的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
21.本发明还进一步提供了用于降低受试者的纤维化评分或非酒精性脂肪肝疾病活性评分的方法,包括向有需要的受试者施用有效量的本发明片剂。
22.本发明还进一步提供了用于稳定、减退或维持受试者的纤维化评分或非酒精性脂肪肝疾病活性评分的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
23.本发明还进一步提供了用于减慢受试者的纤维化评分或非酒精性脂肪肝疾病活性评分进展的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
24.本发明还进一步提供了用于降低受试者肝脏中的脂肪含量的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
25.本发明还进一步提供了用于治疗或预防葡萄糖代谢障碍的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
26.本发明还进一步提供了用于治疗或预防心血管病症或相关血管病症的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
27.本发明还进一步提供了用于治疗或预防炎症的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
28.本发明还进一步提供了用于预防或降低发展出胰腺炎的风险的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
29.本发明还进一步提供了用于治疗或预防肺部病症的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
30.本发明还进一步提供了用于治疗或预防肌肉骨骼不适的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
31.本发明还进一步提供了用于降低受试者的ldl
‑
c浓度的方法,包括向有需要的受试者经口施用有效量的本发明片剂。
32.本发明还进一步提供了具有基本上如图65a描绘的x射线粉末衍射图的吉卡宾钙盐水合物晶型4。
33.本发明还进一步提供了具有基本上如图66描绘的x射线粉末衍射图的吉卡宾钙盐水合物晶型5。
34.本发明还进一步提供了具有基本上如图67a描绘的x射线粉末衍射图的吉卡宾钙盐水合物晶型6。
35.本发明还进一步提供了组合物,所述组合物包含(i)有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6,和(ii)药学上可接受的载体或媒介物。
36.本发明还进一步提供了含有组合物的胶囊,所述组合物包含(i)有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6,和(ii)药学上的可接受的载体或媒介物。
37.本发明还进一步提供了用于治疗或预防肝脏疾病或异常肝脏疾患的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
38.本发明还进一步提供了用于治疗或预防脂蛋白代谢障碍的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
39.本发明还进一步提供了用于降低受试者的血浆或血清中受试者的总胆固醇浓度、低密度脂蛋白胆固醇浓度、低密度脂蛋白浓度、极低密度脂蛋白胆固醇浓度、极低密度脂蛋白浓度、非hdl胆固醇浓度、非hdl浓度、载脂蛋白b浓度、甘油三酯浓度、载脂蛋白c
‑
iii浓度、c反应蛋白浓度、血纤维蛋白原浓度、脂蛋白(a)浓度、白介素
‑
6浓度、血管生成素样蛋白3浓度、血管生成素样蛋白4浓度、pcsk9浓度或血清淀粉样蛋白a浓度的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
40.本发明还进一步提供了用于升高受试者的血浆或血清中受试者的高密度脂蛋白胆固醇浓度、高密度脂蛋白浓度、高密度胆固醇甘油三酯浓度、脂联素浓度或载脂蛋白a
‑
i浓度的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
41.本发明还进一步提供了用于治疗或预防血栓形成、血凝块、原发性心血管事件、继发性心血管事件、进展成非酒精性脂肪肝疾病、非酒精性脂肪肝炎、肝硬化、肝细胞癌、肝衰竭、胰腺炎、肺纤维化或iib型高脂蛋白血症的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
42.本发明还进一步提供了用于降低受试者发展出血栓形成、血凝块、原发性心血管事件、继发性心血管事件、进展成非酒精性脂肪肝疾病、非酒精性脂肪肝炎、肝硬化、肝细胞癌、肝衰竭、胰腺炎、肺纤维化或iib型高脂蛋白血症的风险的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
43.本发明还进一步提供了降低或抑制受试者肝脏中的纤维化、脂肪变性、气球样变或炎症进展的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
44.本发明还进一步提供了用于降低餐后脂血症或预防延长的餐后脂血症的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
45.本发明还进一步提供了用于降低受试者的纤维化评分或非酒精性脂肪肝疾病活
性评分的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
46.本发明还进一步提供了用于稳定、减退或维持受试者的纤维化评分或非酒精性脂肪肝疾病活性评分的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
47.本发明还进一步提供了用于减慢受试者的纤维化评分或非酒精性脂肪肝疾病活性评分进展的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
48.本发明还进一步提供了用于降低受试者肝脏中的脂肪含量的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
49.本发明还进一步提供了用于治疗或预防葡萄糖代谢障碍的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
50.本发明还进一步提供了用于治疗或预防心血管病症或相关血管病症的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
51.本发明还提供了用于治疗或预防炎症的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
52.本发明还进一步提供了用于预防或降低发展出胰腺炎的风险的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
53.本发明还进一步提供了用于治疗或预防肺部病症的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
54.本发明还进一步提供了用于治疗或预防肌肉骨骼不适的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
55.本发明还进一步提供了用于降低受试者的ldl
‑
c浓度的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
附图说明
56.图1a是示出来自包含吉卡宾钙盐水合物晶型1的薄膜包衣片剂的吉卡宾溶出曲线的线形图。
57.图1b是示出来自包含吉卡宾钙盐水合物晶型1的薄膜包衣片剂的吉卡宾溶出曲线的线形图。
58.图2是具有以通过激光衍射测量的约58μm的psd90为特征的粒度分布的吉卡宾钙盐水合物晶型1的扫描电子显微照片。
59.图3是示出三位家族性高胆固醇血症患者(1f、2m和3m)的ldl
‑
c浓度的线形图,所述浓度在这些患者用具有以通过激光衍射测量的52μm的psd90为特征的粒度分布的吉卡宾钙盐水合物晶型1(吉卡宾钙盐水合物晶型1,300mg薄膜包衣片剂,片剂d)治疗过程期间测量。
60.图4是示出在图3所示的三位家族性高胆固醇血症患者(1f、2m和3m)的ldl
‑
c浓度自基线的变化百分比值的线形图,所述变化百分比值在这些患者用具有以通过激光衍射测量的52μm的psd90为特征的粒度分布的吉卡宾钙盐水合物晶型1(吉卡宾钙盐水合物晶型1,300mg薄膜包衣片剂,片剂d)治疗过程期间测量。
61.图5a示出用具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(id:306)或用媒介物(id:208)治疗的stam
tm
模型小鼠的经苏木素和伊红染色的肝切片的显微照片,以及用媒介物(id:103)治疗的正常小鼠的经苏木素和伊红染色的肝切片的显微照片。
62.图5b示出用具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(id:402和508)治疗的stam
tm
模型小鼠的经苏木素和伊红染色的肝切片的显微照片,以及用参照化合物替米沙坦(telmisartan)治疗的stam
tm
模型小鼠的经苏木素和伊红染色的肝切片的显微照片。
63.图6示出用媒介物(id:208)治疗,用具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(id:303、403、501)治疗或用参照化合物替米沙坦(id:606)治疗的stam
tm
模型小鼠的经天狼星红染色的肝切片的显微照片,以及用媒介物(id:102)治疗的正常小鼠的经天狼星红染色的肝切片的显微照片。
64.图7示出用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1、或参照化合物替米沙坦治疗的stam
tm
模型小鼠,以及用媒介物治疗的正常小鼠的nafld活性评分(nas)的组成部分的图。
65.图8a示出在用(a)媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1或参照化合物替米沙坦治疗的stam
tm
模型小鼠中的nas的图。图8b示出在用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1或参照化合物替米沙坦治疗的stam
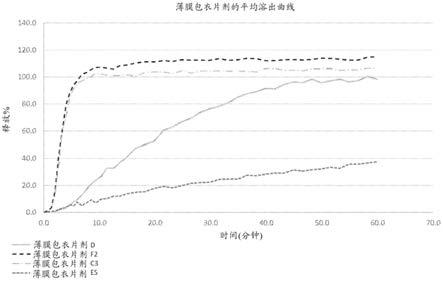
tm
模型小鼠中的肝天狼星红阳性区域(纤维化区域)的图。
66.图9是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的非空腹血浆甘油三酯浓度的图。
67.图10是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的肝的硫酸酯酶2(sulf
‑
2)的基因表达水平的图。
68.图11是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的肝的载脂蛋白c
‑
iii(apoc
‑
iii)的基因表达水平的图。
69.图12是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/
kg)治疗三周的经nash诱导的小鼠中的肝的固醇调节元件结合转录因子1(srebp
‑
1)的基因表达水平的图。
70.图13是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的肝的趋化因子(c
‑
c基序)配体4(mip
‑
1β)的基因表达水平的图。
71.图14是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的肝的趋化因子(c
‑
c基序)受体5(ccr5)的基因表达水平的图。
72.图15是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的趋化因子(c
‑
c基序)受体2(ccr2)的基因表达水平的图。
73.图16是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的肝的b细胞1中的κ轻链多肽基因增强子的核因子(nf
‑
κb)的基因表达水平的图。
74.图17是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的肝的正五聚蛋白相关的c反应蛋白(crp)的基因表达水平的图。
75.图18是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的肝的低密度脂蛋白受体(ldl
‑
受体)的基因表达水平的图。
76.图19是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的肝的乙酰基
‑
辅酶a羧化酶α(acc1)的基因表达水平的图。
77.图20是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的肝的乙酰基
‑
辅酶a羧化酶β(acc2)的基因表达水平的图。
78.图21是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的肝的含patatin样磷脂酶结构域蛋白3(pnpla3)的基因表达水平的图。
79.图22是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52
μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的肝的基质金属蛋白酶2(mmp
‑
2)的基因表达水平的图。
80.图23是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的肝的醇脱氢酶4(类别ii)、π多肽(adh4)的基因表达水平的图。
81.图24是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的肿瘤坏死因子α(tnf
‑
α)的肝的基因表达水平的图。
82.图25是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的肝的趋化因子(c
‑
c基序)配体2(mcp
‑
1)的基因表达水平的图。
83.图26是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的肝的肌动蛋白、α
‑
平滑肌肌动蛋白(α
‑
sma)的基因表达水平的图。
84.图27是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的金属蛋白酶的肝组织抑制剂1(timp
‑
1)的基因表达水平的图。
85.图28是具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1的粉末x射线衍射图(表2中的样品4)。
86.图29是具有通过激光衍射测量的62μm的psd90的吉卡宾钙盐水合物晶型1的粉末x射线衍射图(表2中的样品7)。
87.图30示出无定形的吉卡宾钙粒度分布的测量。
88.图31示出具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1对糖尿病小鼠模型中的肝的apoc
‑
iii或肝的sulf
‑
2与血浆甘油三酯之间的相关性的效果。
89.图32是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的白介素
‑
6(il
‑
6)的肝的基因表达水平的图。
90.图33是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的白介素1β(il
‑
1β)的肝的基因表达水平的图。
91.图34是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的趋化因子(c
‑
x
‑
c基序)配体1(cxcl1/kc)的肝的基因表达水平的图。
92.图35是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的硬脂酰基
‑
辅酶a去饱和酶(scd)的肝的基因表达水平的图。
93.图36是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的脂蛋白脂酶(lpl)的肝的基因表达水平的图。
94.图37是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的血管生成素样蛋白3(angptl3)的肝的基因表达水平的图。
95.图38是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的血管生成素样蛋白4(angptl4)的肝的基因表达水平的图。
96.图39是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的血管生成素样蛋白8(angptl8)的肝的基因表达水平的图。
97.图40是示出用媒介物治疗的正常小鼠以及用媒介物、具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1(30、100或300mg/kg)或参照化合物替米沙坦(10mg/kg)治疗三周的经nash诱导的小鼠中的胎球蛋白
‑
a的肝的基因表达水平的图。
98.图41a示出在线性轴上显示在给药后0至24小时时间点所收集的以剂量覆盖的吉卡宾相对于时间的算数平均浓度(
±
sd)。
99.图41b示出在半对数轴上显示在给药后0至24小时时间点所收集的以剂量覆盖的吉卡宾相对于时间的算数平均浓度(
±
sd)。
100.图42a示出以剂量覆盖的吉卡宾相对于时间的算数平均给药前(c
谷
)浓度(
±
sd)。
101.图42b示出以剂量覆盖的吉卡宾相对于时间的算数平均给药前(c
谷
)浓度(
±
sd),其中来自患者006
‑
003的900mg第28天的波谷浓度被排除。
102.图43是示出在实施例22中的八位家族性高胆固醇血症患者的ldl
‑
c浓度自基线的变化百分比值的线形图,所述变化百分比值在这些患者用具有以通过激光衍射测量的52μm的psd90为特征的粒度分布的吉卡宾钙盐水合物晶型1(吉卡宾钙盐水合物晶型1的300mg薄膜包衣片剂,片剂d)治疗过程期间测量。
103.图44是示出基于试验后基因评定而确定患有纯合子家族性高胆固醇血症(hofh)基因型的三位家族性高胆固醇血症患者的ldl
‑
c浓度自基线的变化百分比值的线形图,所述变化百分比值在这些患者用具有以通过激光衍射测量的52μm的psd90为特征的粒度分布的吉卡宾钙盐水合物晶型1(吉卡宾钙盐水合物晶型1的300mg薄膜包衣片剂,片剂d)治疗过程期间测量。
104.图45是示出基于试验后基因评定而确定患有杂合子家族性高胆固醇血症(hefh)
基因型的三位家族性高胆固醇血症患者的ldl
‑
c浓度自基线的变化百分比值的线形图,所述变化百分比值在这些患者用具有以通过激光衍射测量的52μm的psd90为特征的粒度分布的吉卡宾钙盐水合物晶型1(吉卡宾钙盐水合物晶型1的300mg薄膜包衣片剂,片剂d)治疗过程期间测量。
105.图46示出在接受吉卡宾钙盐水合物晶型1(psd90=52μm)的正处于稳定的中等和高强度他汀类药物的高胆固醇血症受试者中自基线的致动脉粥样化生物标记物的最小二乘(ls)平均值变化%。
106.图47示出在接受吉卡宾钙盐水合物晶型1(psd90=52μm)的正处于稳定的中等和高强度他汀类药物的高胆固醇血症受试者中相比于安慰剂的致动脉粥样化生物标记物的最小二乘(ls)平均值变化%。
107.图48示出在接受吉卡宾钙盐水合物晶型1(psd90=52μm)的正处于稳定的中等和高强度他汀类药物的混合性血脂异常受试者(ldl
‑
c≥100mg/dl和甘油三酯≥200且<500mg/dl)中相比于安慰剂的致动脉粥样化生物标记物的最小二乘(ls)平均值变化%。
108.图49示出在接受吉卡宾钙盐水合物晶型1(psd90=52μm)的正处于稳定的中等和高强度他汀类药物的高胆固醇血症受试者中自基线的炎症标记物的最小二乘(ls)平均值变化%。
109.图50示出在接受吉卡宾钙盐水合物晶型1(psd90=52μm)的正处于稳定的中等和高强度他汀类药物的高胆固醇血症受试者中相比于安慰剂的炎症标记物的最小二乘(ls)平均值变化%。
110.图51示出在接受吉卡宾钙盐水合物晶型1(psd90=52μm)的正处于稳定的中等和高强度他汀类药物的混合性血脂异常受试者(ldl
‑
c≥100mg/dl和甘油三酯≥200且<500mg/dl)中相比于安慰剂的炎症标记物最小二乘(ls)平均值变化%。
111.图52a是无定形的吉卡宾钙盐的x射线粉末衍射图。
112.图52b是无定形的吉卡宾钙盐的热重分析(tga)热谱图和差热分析(dta)热谱图的覆盖图。
113.图52c是无定形的吉卡宾钙盐的示差扫描量热法(dsc)热谱图。
114.图53a是吉卡宾钙盐水合物晶型2的x射线粉末衍射图。
115.图53b是吉卡宾钙盐水合物晶型2的热重分析(tga)热谱图和差热分析(dta)热谱图的覆盖图。
116.图54a是吉卡宾钙盐水合物晶型c3的x射线粉末衍射图。
117.图54b是吉卡宾钙盐水合物晶型c3的热重分析(tga)热谱图和差热分析(dta)热谱图的覆盖图。
118.图54c是吉卡宾钙盐水合物晶型c3的示差扫描量热法(dsc)热谱图。
119.图55a是结晶吉卡宾钙盐乙醇溶剂化物的x射线粉末衍射图。
120.图55b是结晶吉卡宾钙盐乙醇溶剂化物的热重分析(tga)热谱图和差热分析(dta)热谱图的覆盖图。
121.图56是示出使用uv/可见光分析和hplc分析的薄膜包衣片剂d的吉卡宾溶出曲线的线形图。
122.图57a是示出薄膜包衣片剂d、薄膜包衣片剂f2、薄膜包衣片剂c3和薄膜包衣片剂
es的吉卡宾溶出曲线的线形图。
123.图57b是示出薄膜包衣片剂a、薄膜包衣片剂b、薄膜包衣片剂c、薄膜包衣片剂d、薄膜包衣片剂g、薄膜包衣片剂h、薄膜包衣片剂f2、薄膜包衣片剂c3和薄膜包衣片剂es的吉卡宾溶出曲线的线形图。
124.图58是示出薄膜包衣片剂f2、薄膜包衣片剂c3、薄膜包衣片剂es、未包衣片剂f2、未包衣片剂c3和未包衣片剂es的吉卡宾溶出曲线的线形图。
125.图59是示出薄膜包衣和未包衣的片剂f2的吉卡宾溶出曲线的线形图。
126.图60是示出薄膜包衣和未包衣的片剂c3的吉卡宾溶出曲线的线形图。
127.图61是示出薄膜包衣和未包衣的片剂es的吉卡宾溶出曲线的线形图。
128.图62是吉卡宾钙盐水合物晶型2、样品f2
‑
fb和未包衣片剂f2的x射线粉末衍射图。
129.图63是吉卡宾钙盐水合物晶型c3、样品c3
‑
fb和未包衣片剂c3的x射线粉末衍射图。
130.图64是吉卡宾钙盐乙醇溶剂化物、样品es
‑
fb和未包衣片剂es的x射线粉末衍射图。
131.图65a是吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型1、吉卡宾钙盐水合物晶型2和吉卡宾钙盐水合物晶型c3的x射线粉末衍射图。
132.图65b是吉卡宾钙盐水合物晶型4的热重分析(tga)热分析图和差热分析(dta)热分析图的覆盖图。
133.图66是吉卡宾钙盐水合物晶型5的x射线粉末衍射图。
134.图67a是潮湿的吉卡宾钙盐水合物晶型6、干燥的吉卡宾钙盐水合物晶型6、吉卡宾钙盐水合物晶型1、吉卡宾钙盐水合物晶型c3、吉卡宾钙盐水合物晶型2、无定形的吉卡宾钙盐和吉卡宾钙盐乙醇溶剂化物的x射线粉末衍射图。
135.图67b是吉卡宾钙盐水合物晶型6的热重分析(tga)热分析图和差热分析(dta)热分析图的覆盖图。
具体实施方式
136.本发明提供了本发明片剂。吉卡宾已于先前描述于例如美国专利no.5,648,387中,所述专利通过引用整体并入本文。各种吉卡宾钙盐水合物已于先前描述于例如美国专利no.6,861,555中,所述专利通过引用整体并入本文。
137.在一些实施方案中,本发明片剂还包含额外的药物活性剂。在其他实施方案中,本发明片剂还包含两种或更多种额外的药物活性剂。本发明片剂可用于治疗或预防各种疾病,包括肝脏疾病或异常肝脏疾患、脂蛋白或葡萄糖代谢障碍、心血管或相关血管病症、由增加的纤维化水平所引起的疾病或与增加的炎症相关的疾病。本发明进一步提供了用于治疗或预防肝脏疾病或异常肝脏疾患、脂蛋白或葡萄糖代谢障碍、心血管或相关血管病症、由增加的纤维化水平所引起的疾病或与增加的炎症相关的疾病的方法,包括向有需要的受试者施用有效量的本发明片剂。
138.本文公开的治疗或预防方法中的每一种是“本发明的治疗或预防方法”。
139.本发明片剂包含吉卡宾钙盐水合物晶型2或吉卡宾钙盐水合物晶型c3,各自具有35μm至90μm的范围内的psd90。在一些实施方案中,吉卡宾钙盐水合物晶型2或吉卡宾钙盐
水合物晶型c3具有35μm至约85μm的范围内的psd90。在一些实施方案中,吉卡宾钙盐水合物晶型2或吉卡宾钙盐水合物晶型c3具有35μm至约80μm的范围内的psd90。在一些实施方案中,吉卡宾钙盐水合物晶型2或吉卡宾钙盐水合物晶型c3具有35μm至约75μm的范围内的psd90。在一些实施方案中,吉卡宾钙盐水合物晶型2或吉卡宾钙盐水合物晶型c3具有40μm至约75μm的范围内的psd90。在一些实施方案中,吉卡宾钙盐水合物晶型2或吉卡宾钙盐水合物晶型c3具有45μm至约75μm的范围内的psd90。在一些实施方案中,吉卡宾钙盐水合物晶型2或吉卡宾钙盐水合物晶型c3具有45μm至75μm的范围内的psd90。在一些实施方案中,吉卡宾钙盐水合物晶型2或吉卡宾钙盐水合物晶型c3具有50μm至约75μm的范围内的psd90。在一些实施方案中,吉卡宾钙盐水合物晶型2或吉卡宾钙盐水合物晶型c3具有45μm至75μm的范围内的psd90。在一些实施方案中,吉卡宾钙盐水合物晶型2或吉卡宾钙盐水合物晶型c3具有50μm至75μm的范围内的psd90。
140.在一些实施方案中,本发明片剂在37℃
±
0.5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内具有至少80%的吉卡宾溶出曲线,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量。在一些实施方案中,本发明片剂在37℃
±
0.5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内具有至少80%的吉卡宾溶出曲线,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量。在一些实施方案中,本发明片剂在37℃
±
0.5℃于ph 5.0乙酸钾缓冲液中在不超过20分钟内具有至少80%的吉卡宾溶出曲线,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量。在一些实施方案中,本发明片剂在37℃
±
0.5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内具有至少80%、至少85%或至少90%的吉卡宾溶出曲线,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量。
141.在一些实施方案中,本发明片剂具有在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%的吉卡宾溶出曲线,如通过使用210nm的检测波长的高效液相色谱法所测量。在一些实施方案中,本发明片剂在不超过45分钟内具有至少85%的吉卡宾溶出曲线。在一些实施方案中,本发明片剂在不超过45分钟内具有至少90%的吉卡宾溶出曲线。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
142.在一些实施方案中,本发明片剂具有在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%的吉卡宾溶出曲线,如通过使用210nm的检测波长的高效液相色谱法所测量。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
143.在一些实施方案中,本发明片剂在37℃
±
0.5℃于ph 5.0乙酸钾缓冲液中在不超过10分钟内具有至少85%的吉卡宾溶出曲线,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量。在一些实施方案中,本发明片剂在37℃
±
0.5℃于ph 5.0乙酸钾缓冲液中在不超过10分钟内具有至少90%的吉卡宾溶出曲线,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量。在一些实施方案中,本发明片剂在37℃
±
0.5℃于ph 5.0乙酸钾缓冲液中在不超过10分钟内具有至少95%的吉卡宾溶出曲线,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量。
144.本发明片剂包含通过激光衍射测得的35μm至90μm的范围内的psd90的吉卡宾钙盐,其中所述吉卡宾钙盐是吉卡宾钙盐水合物晶型2或吉卡宾钙盐水合物晶型c3。
145.吉卡宾钙盐水合物晶型2、吉卡宾钙盐水合物晶型c3、吉卡宾钙盐水合物晶型4、吉
卡宾钙盐水合物晶型5和吉卡宾钙盐水合物晶型6中的每一者是“本发明化合物”。
146.在一些实施方案中,本发明化合物具有以本发明化合物计约2%w/w至约5%w/w的水含量。在其他实施方案中,本发明化合物具有约2%w/w至约4%w/w的水含量。在一些实施方案中,水含量为约3%w/w至约5%w/w。在其他实施方案中,水含量为约3%w/w至约4%w/w。
147.在一些实施方案中,本发明片剂是压缩片剂。在一些实施方案中,本发明片剂是未包衣的。在一些实施方案中,本发明片剂包含外包衣。在一些实施方案中,外包衣包含羟丙基甲基纤维素(羟丙甲纤维素,hpmc)。在一些实施方案中,外包衣还包含聚乙二醇、二氧化钛或滑石。
148.在一些实施方案中,本发明片剂包含摩尔当量相当于约50mg至约900mg的吉卡宾的本发明化合物。在一些实施方案中,片剂包含摩尔当量相当于约50mg至约600mg的吉卡宾的本发明化合物。在一些实施方案中,片剂包含摩尔当量相当于约300mg吉卡宾的本发明化合物。
149.在一些实施方案中,本发明片剂还包含有效量的额外的药物活性剂。在其他实施方案中,本发明片剂还包含有效量的两种或更多种额外的药物活性剂。
150.在一些实施方案中,额外的药物活性剂是他汀类药物。在一些实施方案中,他汀类药物是阿托伐他汀(atorvastatin)、辛伐他汀(simvastatin)、普伐他汀(pravastatin)、瑞舒伐他汀(rosuvastatin)、氟伐他汀(fluvastatin)、洛伐他汀(lovastatin)、匹伐他汀(pitavastatin)、美伐他汀(mevastatin)、达伐他汀(dalvastatin)、二氢康帕汀(dihydrocompactin)或西利伐他汀(cerivastatin)或其药学上可接受的盐。在一些实施方案中,他汀类药物的药学上可接受的盐是钙盐。在一些实施方案中,他汀类药物是阿托伐他汀钙。
151.其他说明性的额外药物活性剂包括但不限于降脂剂,pcsk9(前蛋白转化酶枯草杆菌蛋白酶/kexin 9型)抑制剂,胆固醇吸收抑制剂,acc(乙酰辅酶a羧化酶)抑制剂,apoc
‑
iii(载脂蛋白c
‑
iii)抑制剂,apob(载脂蛋白b)合成抑制剂,angptl 3(血管生成素样蛋白3)抑制剂,angptl 4(血管生成素样蛋白4)抑制剂,angptl 8(血管生成素样蛋白8)抑制剂,acl(柠檬酸三磷酸腺苷裂解酶)抑制剂,微粒体转移蛋白抑制剂,非诺贝特酸(fenofibric acid),鱼油,贝特类药物,甲状腺激素β受体激动剂,类法尼醇x受体(fxr),ccr2/ccr5(c
‑
c趋化因子受体类型2(ccr2)和5(ccr5))抑制剂或拮抗剂,半胱天冬酶蛋白酶抑制剂,ask
‑
1(细胞凋亡信号调节激酶1)抑制剂,半乳糖凝集素
‑
3蛋白,nox(烟酰胺腺嘌呤二核苷酸磷酸氧化酶)抑制剂,回肠胆汁酸转运蛋白,ppar(过氧化物酶体增殖因子激活受体)激动剂,ppar双重激动剂,pan
‑
ppar激动剂,钠
‑
葡萄糖协同转运蛋白1或2(sglt1或sglt2)抑制剂,二肽基肽酶4(dpp4)抑制剂,脂肪酸合酶(fas)抑制剂,toll样受体拮抗剂,甲状腺激素受体β(thr
‑
β)激动剂,肝脏定向的选择性thr
‑
β激动剂,aco1调节剂,1
‑
髓过氧化酶(1
‑
mieloperoxidase)抑制剂,1
‑
己酮糖激酶(1
‑
khk)抑制剂,氧化应激抑制剂,成纤维细胞生长因子21(fgf21)或19(fgf19)抑制剂,转化生长因子β
‑
1(tgf
‑
β1)激动剂,肝脂质新生(dnl)抑制剂,烯酰基coa水合酶抑制剂,胆固醇7
‑
α羟化酶(cyp7a1)激动剂,3型胶原蛋白抑制剂和cetp(胆固醇酯转移蛋白)抑制剂。在一些实施方案中,额外的药物活性剂是依泽替米贝(ezetimibe)。
152.在一些实施方案中,额外的药物活性剂是避孕剂。如本文所用,“避孕剂”是指促进预防怀孕、受孕、或植入或者预防或降低怀孕可能性的任何药物活性剂。在一些实施方案中,避孕剂是炔雌醇和炔诺酮中的一种或两种。在一些实施方案中,避孕剂是炔雌醇和炔诺酮的组合。在一些实施方案中,避孕剂是雌激素、雌激素衍生物、孕激素或孕激素衍生物。
153.在一些实施方案中,本发明片剂还包含药学上可接受的赋形剂或载体。在一些实施方案中,本发明片剂还包含稀释剂。在一些实施方案中,稀释剂是甘露糖醇、乳糖、山梨糖醇、蔗糖或肌醇。在一些实施方案中,稀释剂是乳糖单水合物。
154.在一些实施方案中,本发明片剂还包含粘合剂或造粒剂。在一些实施方案中,粘合剂或造粒剂是淀粉、明胶、糖、天然或合成胶、纤维素或其混合物。在一些实施方案中,纤维素是微晶纤维素、乙基纤维素、乙酸纤维素、羧甲基纤维素钙、羧甲基纤维素钠、甲基纤维素、羟乙基纤维素(hec)、羟丙基纤维素(hpc)或羟丙基甲基纤维素(hpmc)。在一些实施方案中,纤维素是羟丙基纤维素。
155.在一些实施方案中,本发明片剂还包含崩解剂。在一些实施方案中,崩解剂是琼脂、膨润土、木质产品、天然海绵、阳离子交换树脂、藻酸、树胶、柑橘果肉、纤维素、交联纤维素、交联聚合物、交联淀粉、微晶纤维素、波拉克林钾(polacrilin potassium)、淀粉、粘土、海藻胶(align)或其混合物。在一些实施方案中,纤维素是交联羧甲基纤维素。
156.在一些实施方案中,本发明片剂还包含润滑剂。在一些实施方案中,润滑剂是硬脂酸钙、硬脂酸镁、矿物油、轻矿物油、甘油、山梨糖醇、甘露糖醇、二醇、硬脂酸、月桂基硫酸钠、滑石、氢化植物油、硬脂酸锌、油酸乙酯、月桂酸乙酯、琼脂、淀粉、石松子(lycopodium)、二氧化硅、硅胶或其混合物。在一些实施方案中,润滑剂是硬脂酸镁。
157.本发明提供了用于治疗或预防肝脏疾病或异常肝脏疾患的方法,包括向有需要的受试者施用有效量的本发明片剂。说明性的肝脏疾病或异常肝脏疾患包括但不限于非酒精性脂肪肝疾病、非酒精性脂肪肝炎、酒精性脂肪性肝炎、肝硬化、炎症、纤维化、部分纤维化、原发性胆汁性肝硬化、原发性硬化性胆道炎、肝衰竭、肝细胞癌、肝癌、肝脂肪变性、肝细胞气球样变、肝小叶炎症和肝甘油三酯累积。在一些实施方案中,肝脏疾病或肝脏疾患是非酒精性脂肪肝疾病或非酒精性脂肪肝炎。
158.本发明提供了用于治疗或预防受试者内脏器官异常纤维化的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,内脏器官异常纤维化是在人类受试者中。在一些实施方案中,内脏器官包括但不限于肺、乳房、心脏、脑、肠、肾脏或皮肤。
159.本发明提供了用于治疗或预防由受试者的器官炎性反应所产生的疾病或异常疾患的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,炎性反应是在内脏器官中。在一些实施方案中,受试者是人类。
160.本发明提供了用于治疗或预防脂蛋白代谢障碍的方法,包括向有需要的受试者施用有效量的本发明片剂。说明性的脂蛋白代谢障碍包括但不限于血脂异常、异常脂蛋白血症、混合性血脂异常、动脉粥样硬化性心血管疾病(ascvd)、iib型高脂血症、家族性混合型高脂血症、家族性高胆固醇血症、家族性乳糜微粒血症综合征(familial chylomicronemia syndrome)、高甘油三酯血症、异常β
‑
脂蛋白血症、脂蛋白过度产生、脂蛋白缺乏症、总胆固醇升高、低密度脂蛋白胆固醇浓度升高、极低密度脂蛋白胆固醇浓度升高、非hdl胆固醇浓度升高、载脂蛋白b浓度升高、载脂蛋白c
‑
iii浓度升高、c反应蛋白浓度升高、血纤维蛋白原
浓度升高、脂蛋白(a)浓度升高、白介素
‑
6浓度升高、血管生成素样蛋白3浓度升高、血管生成素样蛋白4浓度升高、血清淀粉样蛋白a浓度升高、pcsk9升高、增加的血栓形成风险、增加的血凝块风险、低的hdl
‑
胆固醇浓度、低密度脂蛋白浓度升高、极低密度脂蛋白浓度升高、甘油三酯浓度升高、延长的餐后脂血症、胆汁中脂质消除、代谢障碍、胆汁中磷脂消除、胆汁中氧甾酮消除、异常胆汁产生、过氧化物酶体增殖因子激活受体相关病症、高胆固醇血症、高脂血症和内脏性肥胖。在一些实施方案中,脂蛋白代谢障碍是混合性血脂异常、动脉粥样硬化性心血管疾病(ascvd)、iib型高脂血症或家族性混合型高脂血症。在一些实施方案中,脂蛋白代谢障碍是家族性高胆固醇血症。
161.本发明提供了用于降低受试者的总胆固醇、低密度脂蛋白胆固醇浓度、极低密度脂蛋白胆固醇浓度、非hdl胆固醇浓度、载脂蛋白b浓度、载脂蛋白c
‑
iii浓度、c反应蛋白浓度、血纤维蛋白原浓度、脂蛋白(a)浓度、白介素
‑
6浓度、血管生成素样蛋白3浓度、血管生成素样蛋白4浓度、血清淀粉样蛋白a浓度、pcsk9浓度、低密度脂蛋白浓度、极低密度脂蛋白浓度或甘油三酯浓度的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,本发明提供了用于降低受试者的甘油三酯浓度或ldl
‑
胆固醇的方法,包括向有需要的受试者施用有效量的本发明片剂。
162.本发明提供了用于降低受试者的血清或血浆中受试者的富含胆固醇的残余的apob
‑
脂蛋白或富含甘油三酯的残余的apob
‑
脂蛋白浓度的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,本发明提供了用于降低受试者的血浆中受试者的富含胆固醇和富含甘油三酯的残余的apob
‑
脂蛋白(c
‑
trl)的方法,包括向有需要的受试者施用有效量的本发明片剂。
163.本发明提供了用于增加受试者的富含胆固醇的残余的apob
‑
脂蛋白或富含甘油三酯的残余的apob
‑
脂蛋白的肝清除率的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,本发明提供了用于提高或增加受试者的c
‑
trl的肝清除率的方法,包括向有需要的受试者施用有效量的本发明片剂。不受任何理论的束缚,c
‑
trl的快速的肝清除率导致动脉中更少的胆固醇沉积(更少的斑块构建)。因此,增加富含胆固醇的残余的apob
‑
脂蛋白、富含甘油三酯的残余的apob
‑
脂蛋白或c
‑
trl的肝清除率可用于治疗或预防心血管疾病(包括动脉粥样硬化症)。
164.本发明提供了用于降低受试者的血栓形成或血凝块风险的方法,包括向有需要的受试者施用有效量的本发明片剂。
165.本发明提供了用于治疗或预防葡萄糖代谢障碍的方法,包括向有需要的受试者施用有效量的本发明片剂。说明性的葡萄糖代谢障碍包括但不限于胰岛素抗性、葡萄糖耐量减低、空腹血糖受损(血液中的浓度)、糖尿病、家族性局部脂肪代谢障碍、脂肪代谢障碍、肥胖症、周边脂肪萎缩、糖尿病肾病变、糖尿病视网膜病变、肾病和败血症。在一些实施方案中,肥胖症是中央型肥胖症。
166.本发明提供了用于治疗或预防动脉粥样代谢综合征的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,本发明提供了降低受试者发展出动脉粥样代谢综合征的风险的方法,包括向有需要的受试者施用有效量的本发明片剂。动脉粥样代谢综合征(如2型糖尿病)增加富含胆固醇和富含甘油三酯的残余的apob
‑
脂蛋白(c
‑
trl)的血浆水平。在一些实施方案中,动脉粥样代谢综合征包括代谢综合征,其可定义为包括腹
部肥胖症、葡萄糖耐量减低、血脂异常和上升的血压的一系列症状。在一些实施方案中,动脉粥样代谢综合征包括与增加的心血管疾病风险相关联的一种或多种疾患或与上升的血压、增加的ldl
‑
c、降低的hdl
‑
c和/或增加的血糖水平相关联的一种或多种疾患。
167.本发明提供了用于治疗或预防心血管病症或相关血管病症的方法,包括向有需要的受试者施用有效量的本发明片剂。说明性的心血管病症或相关血管病症包括但不限于动脉硬化症、动脉粥样硬化症、高血压、冠状动脉疾病、心肌梗塞、心律失常、心房颤动、心瓣膜疾病、心力衰竭、心肌病、肌病变、心包炎、阳萎和血栓性疾病。
168.本发明提供了用于治疗或预防c反应蛋白相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,c反应蛋白相关病症是炎症、缺血性坏死或血栓性病症。
169.本发明提供了用于治疗或预防与调节炎症标记物或c反应蛋白相关的病症的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,与调节炎症标记物或c反应蛋白相关的病症是炎症、缺血性坏死或血栓性病症。
170.本发明提供了用于治疗或预防阿尔茨海默病的方法,包括向有需要的受试者施用有效量的本发明片剂。
171.本发明提供了用于治疗或预防帕金森氏病的方法,包括向有需要的受试者施用有效量的本发明片剂。
172.本发明提供了用于治疗或预防胰腺炎的方法,包括向有需要的受试者施用有效量的本发明片剂。本发明提供了用于预防或降低发展出胰腺炎的风险的方法,包括向有需要的受试者施用有效量的本发明片剂。
173.本发明提供了用于治疗或预防肺部病症的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,肺部病症是慢性阻塞性肺病或特发性肺纤维化。
174.本发明提供了用于治疗或预防肌肉骨骼不适的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,肌肉骨骼不适是肌痛。在另一个实施方案中,肌肉骨骼不适是肌炎。
175.本发明提供了用于治疗或预防硫酸酯酶
‑
2相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,硫酸酯酶
‑
2相关病症是肝的硫酸酯酶
‑
2相关病症。在一些实施方案中,硫酸酯酶
‑
2相关病症是脂质生成障碍或脂质调节障碍。
176.脂质生成障碍的实例包括但不限于糖尿病和相关疾患、肥胖症、肝脂肪变性、非酒精性脂肪性肝炎、癌症、心血管疾病(高甘油三酯血症)和皮肤病症。
177.脂质调节障碍的实例包括但不限于升高的总胆固醇、升高的低密度脂蛋白胆固醇(ldl
‑
c)、升高的载脂蛋白b(apo b)、升高的甘油三酯和升高的非高密度脂蛋白胆固醇。
178.本发明提供了用于下调受试者中的肝的硫酸酯酶
‑
2表达的方法,包括向有需要的受试者施用有效量的本发明片剂。
179.本发明提供了用于治疗或预防apoc
‑
iii相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,apoc
‑
iii相关病症是本文所述的脂质生成障碍或脂质调节障碍。
180.本发明提供了用于治疗或预防acc1相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,acc1相关病症是本文所述的脂质生成障碍或脂
质调节障碍。
181.本发明提供了用于治疗或预防adh
‑
4相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,adh
‑
4相关病症是本文所述的脂质生成障碍或脂质调节障碍。
182.本发明提供了用于治疗或预防tnf
‑
α相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,tnf
‑
α相关病症是炎症。
183.本发明提供了用于治疗或预防mcp
‑
1相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,mcp
‑
1相关病症是炎症。
184.本发明提供了用于治疗或预防mip
‑
1β相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,mip
‑
1β相关病症是炎症。
185.本发明提供了用于治疗或预防ccr5相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,ccr5相关病症是炎症。
186.本发明提供了用于治疗或预防ccr2相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,ccr
‑
2相关病症是炎症。
187.本发明提供了用于治疗或预防nf
‑
κb相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,nf
‑
κb相关病症是炎症。
188.本发明提供了用于治疗或预防timp
‑
1相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,timp
‑
1相关病症是纤维化。在一些实施方案中,纤维化是肝纤维化。
189.本发明提供了用于治疗或预防mmp
‑
2相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,mmp
‑
2相关病症是肝肿瘤发生或癌症。
190.在一些实施方案中,本发明的治疗或预防方法还包括施用有效量的额外的药物活性剂。在一些实施方案中,本发明的治疗或预防方法还包括施用有效量的两种或更多种额外的药物活性剂。在一些实施方案中,额外的药物活性剂是他汀类药物。在一些实施方案中,他汀类药物是阿托伐他汀、辛伐他汀、普伐他汀、瑞舒伐他汀、氟伐他汀、洛伐他汀、匹伐他汀、美伐他汀、达伐他汀、二氢康帕汀或西利伐他汀或其药学上可接受的盐。在一些实施方案中,他汀类药物是阿托伐他汀钙。
191.说明性的额外的药物活性剂如本文所公开。在一些实施方案中,额外的药物活性剂是人激素fgf19。
192.本发明提供了吉卡宾钙盐水合物晶型4、晶型5和晶型6。
193.本发明提供了具有基本上如图65a描绘的x射线粉末衍射图的吉卡宾钙盐水合物晶型4。
194.本发明提供了具有基本上如图66描绘的x射线粉末衍射图的吉卡宾钙盐水合物晶型5。
195.本发明提供了具有基本上如图67a描绘的x射线粉末衍射图的吉卡宾钙盐水合物晶型6。
196.本发明提供了组合物,所述组合物包含(i)有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6,和(ii)药学上可接受的载体或媒介物。
197.本发明提供了一种含有组合物的胶囊,所述组合物包含(i)有效量的吉卡宾钙盐
水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6,和(ii)药学上可接受的载体或媒介物。
198.本发明提供了用于治疗或预防肝脏疾病或异常肝脏疾患的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
199.本发明还进一步提供了用于治疗或预防脂蛋白代谢障碍的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,脂蛋白代谢障碍是血脂异常、异常脂蛋白血症、混合性血脂异常、动脉粥样硬化性心血管疾病(ascvd)、iib型高脂血症、家族性混合型高脂血症、家族性高胆固醇血症、家族性乳糜微粒血症综合征、高甘油三酯血症、异常β
‑
脂蛋白血症、代谢综合征、脂蛋白过度产生、脂蛋白缺乏症、非胰岛素依赖性糖尿病、胆汁中异常脂质消除、代谢障碍、胆汁中异常磷脂消除、胆汁中异常氧甾酮消除、异常胆汁产生、高胆固醇血症、高脂血症或内脏性肥胖。
200.本发明还进一步提供了用于降低受试者的血浆或血清中受试者的总胆固醇浓度、低密度脂蛋白胆固醇浓度、低密度脂蛋白浓度、极低密度脂蛋白胆固醇浓度、极低密度脂蛋白浓度、非hdl胆固醇浓度、非hdl浓度、载脂蛋白b浓度、甘油三酯浓度、载脂蛋白c
‑
iii浓度、c反应蛋白浓度、血纤维蛋白原浓度、脂蛋白(a)浓度、白介素
‑
6浓度、血管生成素样蛋白3浓度、血管生成素样蛋白4浓度、pcsk9浓度或血清淀粉样蛋白a浓度的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
201.本发明还进一步提供了用于升高受试者的血浆或血清中受试者的高密度脂蛋白胆固醇浓度、高密度脂蛋白浓度、高密度胆固醇甘油三酯浓度、脂联素浓度或载脂蛋白a
‑
i浓度的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
202.本发明还进一步提供了用于治疗或预防血栓形成、血凝块、原发性心血管事件、继发性心血管事件、进展成非酒精性脂肪肝疾病、非酒精性脂肪肝炎、肝硬化、肝细胞癌、肝衰竭、胰腺炎、肺纤维化或iib型高脂蛋白血症的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
203.本发明还进一步提供了用于降低受试者发展出血栓形成、血凝块、原发性心血管事件、继发性心血管事件、进展成非酒精性脂肪肝疾病、非酒精性脂肪肝炎、肝硬化、肝细胞癌、肝衰竭、胰腺炎、肺纤维化或iib型高脂蛋白血症的风险的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
204.本发明还进一步提供了降低或抑制受试者肝脏中的纤维化、脂肪变性、气球样变或炎症进展的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
205.本发明还进一步提供了用于降低餐后脂血症或预防延长的餐后脂血症的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
206.本发明还进一步提供了用于降低受试者的纤维化评分或非酒精性脂肪肝疾病活性评分的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
207.本发明还进一步提供了用于稳定、减退或维持受试者的纤维化评分或非酒精性脂肪肝疾病活性评分的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
208.本发明还进一步提供了用于减慢受试者的纤维化评分或非酒精性脂肪肝疾病活性评分进展的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
209.本发明还进一步提供了用于降低受试者肝脏中的脂肪含量的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
210.本发明还进一步提供了用于治疗或预防葡萄糖代谢障碍的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
211.本发明还进一步提供了用于治疗或预防心血管病症或相关血管病症的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
212.本发明还进一步提供了用于治疗或预防炎症的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,炎症通过患者血浆或血清中c反应蛋白浓度的增加来指示。
213.本发明还进一步提供了用于预防或降低发展出胰腺炎的风险的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
214.本发明还进一步提供了用于治疗或预防肺部病症的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,肺部病症是慢性阻塞性肺病或特发性肺纤维化。
215.本发明还进一步提供了用于治疗或预防肌肉骨骼不适的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
216.本发明还进一步提供了用于降低受试者的ldl
‑
c浓度的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
217.定义
218.术语“约”当紧接于数值前时,其意指数值的多达
±
20%。例如,“约”数值意指数值的多达
±
20%,在一些实施方案中,多达
±
19%、多达
±
18%、多达
±
17%、多达
±
16%、多达
±
15%、多达
±
14%、多达
±
13%、多达
±
12%、多达
±
11%、多达
±
10%、多达
±
9%、多达
±
8%、多达
±
7%、多达
±
6%、多达
±
5%、多达
±
4%、多达
±
3%、多达
±
2%、多达
±
1%、多达少于
±
1%或其中的任何其他值或值的范围。
[0219]“受试者”是人或非人哺乳动物,例如牛科动物、马科动物、猫科动物、犬科动物、啮齿动物或非人灵长类动物。人可为男性或女性、儿童、青少年或成年人。女性可为初潮前的或初潮后的。
[0220]
如本文所用,“吉卡宾”(美国采用的名称)具有化学名称6
‑
(5
‑
羧基
‑5‑
甲基己氧基)
‑
2,2
‑
二甲基己酸,其也称为6
‑
(5
‑
羧基
‑5‑
甲基己氧基)
‑
2,2
‑
二甲基己酸或6,6'
‑
氧基双(2,2
‑
二甲基己酸),并且具有结构:
[0221][0222]
如本文所用,“吉卡宾钙盐”具有结构:
[0223][0224]
说明性的碱性化合物的药学上可接受的盐包括无机酸或有机酸的那些盐,例如下列酸的盐:盐酸、硫酸、磷酸、甲磺酸、樟脑磺酸、草酸、马来酸、琥珀酸、柠檬酸、甲酸、氢溴酸、苯甲酸、酒石酸、富马酸、水杨酸、扁桃酸或碳酸。在一些实施方案中,适合形成酸加成盐的无机酸或有机酸的实例包括但不限于盐酸、硫酸、磷酸、甲磺酸、樟脑磺酸、草酸、马来酸、琥珀酸、柠檬酸、甲酸、氢溴酸、苯甲酸、酒石酸、富马酸、水杨酸、扁桃酸、碳酸等。
[0225]
说明性的酸性化合物(例如吉卡宾)的药学上可接受的盐包括碱金属盐(例如锂、钠和钾盐)、碱土金属盐(例如钙和镁盐)、铝盐、铵盐;以及与有机胺(例如苄星(benzathine)(n,n'
‑
二苯甲基乙二胺)、胆碱、二乙醇胺、乙二胺、葡甲胺(meglumine)(n
‑
甲基葡糖胺)、苯乙苄胺(benethamine)(n
‑
苯甲基苯乙胺)、二乙胺、哌嗪、氨丁三醇(2
‑
氨基
‑2‑
羟基甲基
‑
1,3
‑
丙二醇)和普鲁卡因)的盐。在一些实施方案中,衍生自无机碱的药学上可接受的盐包括但不限于钠、钾、锂、铵、钙、镁、铁、锌、铜、锰、铝盐等。衍生自有机碱的药学上可接受的盐包括但不限于下列碱的盐:伯胺、仲胺和叔胺、取代的胺(包括天然生成的取代的胺)、环状胺和碱性离子交换树脂,例如氨、异丙基胺、三甲基胺、二乙基胺、三乙基胺、三丙基胺、二乙醇胺、乙醇胺、丹醇(deanol)、2
‑
二甲基氨基乙醇、2
‑
二乙基氨基乙醇、二环己基胺、赖氨酸、精氨酸、组氨酸、咖啡因、普鲁卡因、海巴明(hydrabamine)、胆碱、甜菜碱、苯乙苄胺、苄星、乙二胺、葡糖胺、甲基葡糖胺、可可碱、三乙醇胺、氨丁三醇、嘌呤、哌嗪、哌啶、n
‑
乙基哌啶、多胺树脂等。
[0226]“有效量”当与本发明组合物、本发明片剂或本发明化合物结合使用时,意指当本发明组合物、本发明片剂或本发明化合物单独或与额外的药物活性剂组合施用于受试者以治疗或预防病症或异常疾患时,所述量可有效治疗或预防所述病症或异常疾患。
[0227]“有效量”当与额外的药物活性剂结合使用时,意指当额外的药物活性剂单独或与本发明组合物、本发明片剂或本发明化合物组合施用于受试者以治疗或预防病症或异常疾患时,所述额外的药物活性剂的量可有效治疗或预防所述病症或异常疾患。
[0228]
除非另有指示,否则本文所提及的所有的重量百分比(即“重量%”和“wt.%”和w/w)是相对于混合物或组合物的总重量,视情况而定。
[0229]
如本文所用,“d
90”或“psd90”意指90%的吉卡宾钙盐(例如本发明化合物)的粒子
具有小于所指示的直径的直径。例如,75μm的d
90
或psd90意指90%累积体积的所指示吉卡宾钙盐的粒子具有小于75μm的直径。类似地,如本文所用,“d
50”或“psd50”意指50%累积体积的吉卡宾钙盐的粒子具有小于所指示的直径的直径。此外,如本文所用,“d
10”或“psd10”意指10%累积体积的吉卡宾钙盐的粒子具有小于所指示的直径的直径。
[0230]
如本文所用,“立即释放”组合物是指在施用于受试者一小时内释放至少75%(以重量计)的吉卡宾的本发明片剂。在一些实施方案中,本发明的立即释放片剂在施用于受试者45分钟内释放至少75重量%、至少80重量%、至少85重量%或至少90重量%的吉卡宾。
[0231]
如本文所用,“auc
(0
‑
24)”是指在化合物施用后从时间0至24小时的血浆浓度
‑
时间曲线下面积。
[0232]
如本文所用,与“auc
(0
‑
tldc)”、“auc
(0
‑
tlqc)”、“auc
(0
‑
tc)”和“auc
(0
‑
t)”同义的“auc
最后”是指在化合物或其药学上可接受的盐施用后从时间0至化合物或其药学上可接受的盐的最后可检测浓度的血浆浓度
‑
时间曲线下的面积。如本文所用,“基线血浆或血清ldl
‑
c”是指如在施用本发明片剂或本发明化合物之前所测量的受试者的血浆或血清ldl
‑
c。
[0233]
如本文所用,受试者“正处于稳定剂量”(正处于降脂剂、药物或药剂(例如他汀类药物)的稳定剂量)指已服用相同剂量的降脂剂(例如他汀类药物)一段时期的受试者,其中受试者的ldl
‑
c血清或血浆浓度已稳定。如本文所用,“稳定的”意指在受试者血清或血浆浓度中的ldl
‑
c的新稳态水平已在开始降脂剂后的某一时间实现,并且从当天起以相对恒定维持在新稳态水平的合理边界(
±
15%)内。
[0234]
如本文所用,“他汀类药物疗法”是指对受试者施用他汀类药物的治疗。在一些实施方案中,受试者“正经历他汀类药物疗法”,即正被施用他汀类药物。在一些实施方案中,他汀类药物疗法是最大耐受的他汀类药物疗法。在一些实施方案中,他汀类药物疗法对治疗或预防如本文所公开的疾病或疾患无效。在一些实施方案中,他汀类药物疗法对降低受试者的ldl
‑
c浓度、降低受试者的甘油三酯浓度或提高受试者的hdl
‑
c浓度至标准值或受试者的目标值无效。如本文所用,“最大耐受的他汀类药物疗法”是指包含施用对特定受试者是最大耐受剂量的他汀类药物每日剂量的治疗方案。“最大耐受剂量”意指可施用于受试者而不在受试者中引起不可接受的不良副作用的最高的他汀类药物剂量。
[0235]
如本文所用,“患有纯合子家族性高胆固醇血症(hofh)的受试者”或“hofh受试者”是通过基因确认或临床诊断而确定患有hofh的受试者。患有hofh的受试者(1)在ldl
‑
受体、载脂蛋白b、pcsk9或ldl
‑
rap1(ldl
‑
受体转接蛋白1)基因座上具有两个突变的对偶基因的基因确认。例如,受试者可在ldl
‑
受体、载脂蛋白b、pcsk9或ldl
‑
rap1基因座上具有配对或相同的(纯合子)或两个未配对或不同的(复合纯合子或复合杂合子)对偶基因突变;或(2)经临床上确定具有(a)未经治疗的ldl
‑
c>500mg/dl(12.92mmol/l)或经治疗的ldl
‑
c≥300mg/dl(7.76mmol/l)、并且同时或在10岁前出现皮肤的或腱的黄色瘤、或父母双方都有杂合子家族性高胆固醇血症的证据,或(b)正处于最大耐受的降脂药物疗法的ldl
‑
c>300mg/dl(7.76mmol/l)。临床诊断(表型)仅指示为hofh,但是有一些不符合临床的ldl
‑
c限制的受试者(例如受试者具有ldl
‑
c≤500mg/dl或ldl
‑
c<300mg/dl)也通过基因确认患有hofh。类似地,受试者可经临床诊断为患有hofh,但通过基因确认却并非如此。
[0236]
如本文所用,“患有杂合子家族性高胆固醇血症(hefh)的受试者”或“hefh受试者”是通过基因确认或临床诊断而确定患有hefh的受试者。患有hefh的受试者经临床确定具有
ldl
‑
c≥190mg/dl。
[0237]
通常不对四种基因中的每一者进行基因型分析,因为所述分析冗长、昂贵并且结果的解释存在争议。例如,导致单一氨基酸或小变化的dna多形性变化可能导致蛋白很少的或没有任何功能的变化,但是此基因变异被认为是群体中的主要基因的“突变”或“变异”。功能活性的不明确解释使得不能进行精确的基因分类。此外,其他的基因和环境因素导致表型变异。出于上述原因,在医学实践中,家族性高胆固醇血症、并且更具体是纯合子家族性高胆固醇血症的分类通常基于临床解释。临床解释有时通过受试者以及如果可行时通过父母、兄弟姐妹和其他亲属的ldl
‑
受体、载脂蛋白b、pcsk9和ldl
‑
rap1的两个对偶基因后续的基因序列分析支持。
[0238]
表a.家族性高胆固醇血症的基因遗传和术语的实例
[0239][0240][0241]
粒度分布
[0242]
在一些实施方案中,吉卡宾钙盐(例如本发明化合物)的psd90通过减小粒子尺寸而实现,例如通过微粉化或研磨。在一些实施方案中,微粉化或研磨使用针磨机(pinmill)实现。在一些实施方案中,微粉化或研磨使用fitzmill实现。
[0243]
在一些实施方案中,本发明化合物具有35μm至约90μm的范围内的psd90。在一些实施方案中,本发明化合物具有36μm至约90μm的范围内的psd90。在一些实施方案中,本发明化合物具有37μm至约90μm的范围内的psd90。在一些实施方案中,本发明化合物具有38μm至约90μm的范围内的psd90。在一些实施方案中,本发明化合物具有39μm至约90μm的范围内的psd90。在一些实施方案中,本发明化合物具有40μm至约90μm的范围内的psd90。在一些实施方案中,本发明化合物具有35μm至90μm的范围内的psd90。
[0244]
在一些实施方案中,本发明片剂包含具有35μm至90μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有36μm至90μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有37μm至90μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有38μm至90μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有39μm至90μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有40μm至90μm的范围内的psd90的本发明化合
物。
[0245]
在一些实施方案中,本发明化合物具有35μm至约85μm的范围内的psd90。在一些实施方案中,本发明化合物具有36μm至约85μm的范围内的psd90。在一些实施方案中,本发明化合物具有37μm至约85μm的范围内的psd90。在一些实施方案中,本发明化合物具有38μm至约85μm的范围内的psd90。在一些实施方案中,本发明化合物具有39μm至约85μm的范围内的psd90。在一些实施方案中,本发明化合物具有40μm至约85μm的范围内的psd90。
[0246]
在一些实施方案中,本发明片剂包含具有35μm至85μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有36μm至85μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有37μm至85μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有38μm至85μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有39μm至85μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有40μm至85μm的范围内的psd90的本发明化合物。
[0247]
在一些实施方案中,本发明化合物具有35μm至约80μm的范围内的psd90。在一些实施方案中,本发明化合物具有36μm至约80μm的范围内的psd90。在一些实施方案中,本发明化合物具有37μm至约80μm的范围内的psd90。在一些实施方案中,本发明化合物具有38μm至约80μm的范围内的psd90。在一些实施方案中,本发明化合物具有39μm至约80μm的范围内的psd90。在一些实施方案中,本发明化合物具有40μm至约80μm的范围内的psd90。
[0248]
在一些实施方案中,本发明片剂包含具有35μm至80μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有36μm至80μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有37μm至80μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有38μm至80μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有39μm至80μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有40μm至80μm的范围内的psd90的本发明化合物。
[0249]
在一些实施方案中,本发明化合物具有35μm至约75μm的范围内的psd90。在一些实施方案中,本发明化合物具有36μm至约75μm的范围内的psd90。在一些实施方案中,本发明化合物具有37μm至约75μm的范围内的psd90。在一些实施方案中,本发明化合物具有38μm至约75μm的范围内的psd90。在一些实施方案中,本发明化合物具有39μm至约75μm的范围内的psd90。在一些实施方案中,本发明化合物具有40μm至约75μm的范围内的psd90。
[0250]
在一些实施方案中,本发明片剂包含具有35μm至75μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有36μm至75μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有37μm至75μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有38μm至75μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有39μm至75μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有40μm至75μm的范围内的psd90的本发明化合物。
[0251]
在其他实施方案中,本发明化合物具有45μm至约90μm的范围内的psd90。在其他实施方案中,本发明化合物具有45μm至约85μm的范围内的psd90。在其他实施方案中,本发明
化合物具有45μm至约80μm的范围内的psd90。在其他实施方案中,本发明化合物具有45μm至约75μm的范围内的psd90。
[0252]
在一些实施方案中,本发明片剂包含具有45μm至90μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有45μm至85μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有45μm至80μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有45μm至75μm的范围内的psd90的本发明化合物。
[0253]
在一些实施方案中,本发明化合物具有50μm至约90μm的范围内的psd90。在一些实施方案中,本发明化合物具有50μm至约85μm的范围内的psd90。在一些实施方案中,本发明化合物具有50μm至约80μm的范围内的psd90。在一些实施方案中,本发明化合物具有50μm至约75μm的范围内的psd90。
[0254]
在一些实施方案中,本发明片剂包含具有50μm至90μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有50μm至85μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有50μm至80μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明片剂包含具有50μm至75μm的范围内的psd90的本发明化合物。在一些实施方案中,本发明化合物具有35μm、36μm、37μm、38μm、39μm、40μm、41μm、42μm、43μm、44μm、45μm、46μm、47μm、48μm、49μm、50μm、51μm、52μm、53μm、54μm、55μm、56μm、57μm、58μm、59μm、60μm、61μm、62μm、63μm、64μm、65μm、66μm、67μm、68μm、69μm、70μm、71μm、72μm、73μm、74μm、75μm、76μm、77μm、78μm、79μm、80μm、81μm、82μm、83μm、84μm、85μm、86μm、87μm、88μm、89μm、90μm或起止于这些直径中任一者的范围内的值的psd90。
[0255]
在一些实施方案中,本发明化合物具有约44μm、约45μm、约46μm、约47μm、约48μm、约49μm、约50μm、约51μm、约52μm、约53μm、约54μm、约55μm、约56μm、约57μm、约58μm、约59μm、约60μm、约61μm、约62μm、约63μm、约64μm、约65μm、约66μm、约67μm、约68μm、约69μm、约70μm、约71μm、约72μm、约73μm、约74μm、约75μm、约76μm、约77μm、约78μm、约79μm、约80μm、约81μm、约82μm、约83μm、约84μm、约85μm、约86μm、约87μm、约88μm、约89μm、约90μm或起止于这些直径中任一者的范围内的值的psd90。
[0256]
不受任何理论的束缚,具有35μm至90μm的psd90的本发明化合物尤其能使得压缩片剂制剂具有期望的性质,例如高的载药量、良好的压缩性、快速的吉卡宾溶出曲线以及最小的破裂至无破裂。
[0257]
在一些实施方案中,吉卡宾钙盐(例如本发明化合物)的粒度分布和psd90通过激光衍射粒度分布分析确定。粒度分布依照fraunhofer光衍射方法确定。在这种方法中,相干激光束穿过样品并且所得衍射图案被聚焦在多元件检测器上。因为衍射图案尤其取决于参数中的粒度,所以粒度分布可基于所测量的样品的衍射图案计算。所述方法更详细描述于usp38
‑
nf33,<429>light diffraction measurement of particle size中。
[0258]
溶出曲线
[0259]
经由使用210nm的检测波长的高效液相色谱法和使用216nm至230nm的检测波长范围的紫外/可见光吸收获得的溶出曲线具有可比性并且可互换,其中所述测量是在相同的缓冲条件下在相同时间点进行的。
[0260]
在一些实施方案中,本发明片剂具有以随时间的(溶出%)为特征的吉卡宾溶出曲
线。例如,溶出曲线可具有在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在45分钟或更短的时间内至少80%的(溶出%)值,如通过使用210nm的检测波长的高效液相色谱法所测量。在一些实施方案中,本发明片剂具有以随时间的(溶出%)为特征的吉卡宾溶出曲线。例如,溶出曲线可具有在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在45分钟或更短的时间内至少80%的(溶出%)值,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。在一些实施方案中,本发明化合物是吉卡宾钙盐水合物晶型2。在其他实施方案中,本发明化合物是吉卡宾钙盐水合物晶型c3。
[0261]
在一些实施方案中,本发明片剂具有这样的吉卡宾溶出曲线,其特征在于在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在45分钟或更短的时间内至少85%吉卡宾的溶出%曲线,并且如通过使用210nm的检测波长的高效液相色谱法所测量。在一些实施方案中,本发明片剂具有这样的吉卡宾溶出曲线,其特征在于在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在45分钟或更短的时间内至少90%吉卡宾的溶出%曲线,并且如通过使用210nm的检测波长的高效液相色谱法所测量。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。关于测定溶出%曲线的详细方法,参见实施例13。
[0262]
在一些实施方案中,本发明片剂具有这样的吉卡宾溶出曲线,其特征在于在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在45分钟或更短的时间内至少80%、至少81%、至少82%、至少83%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%或至少95%或这些百分比范围内的任何值(例如,85%
‑
90%溶出)的吉卡宾溶出%曲线,并且如通过使用210nm的检测波长的高效液相色谱法所测量。在一些实施方案中,本发明片剂具有这样的吉卡宾溶出曲线,其特征在于在37℃
±
5℃于ph5.0乙酸钾缓冲液中在45分钟或更短的时间内至少80%、至少81%、至少82%、至少83%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%或至少95%或这些百分比范围内的任何值(例如,85%
‑
90%溶出)的吉卡宾溶出%曲线,并且如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0263]
在一些实施方案中,本发明片剂具有这样的吉卡宾溶出曲线,其特征在于在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在30分钟或更短的时间内至少70%的吉卡宾溶出%曲线,如通过使用210nm的检测波长的高效液相色谱法所测量或通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0264]
在一些实施方案中,本发明片剂包含吉卡宾钙盐水合物晶型c3。在一些实施方案中,本发明片剂包含吉卡宾钙盐水合物晶型c2。
[0265]
在一些实施方案中,本发明片剂具有如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过10分钟内至少85%吉卡宾的吉卡宾溶出曲线。
[0266]
在一些实施方案中,本发明片剂具有如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过10分钟内至少90%吉卡宾的吉卡宾溶出曲线。在一些实施方案中,本发明片剂具有如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过10分钟内至少95%吉卡宾的吉卡宾溶出曲线。在一些实施方案中,在37℃
±
0.5℃下
测量溶出度。
[0267]
表b.吉卡宾钙盐的说明性多晶型形式的总结
[0268][0269][0270]1%吉卡宾表明归属于吉卡宾共轭碱组分的重量百分比,其排除了钙或水含量的重量:
[0271]
tga=热重分析:dta=差热分析:dsc=差示扫描量热:gc=气相色谱;kf=karl
‑
fisher:hplc/cad=带有电雾式检测器的高效液相色谱;psd=粒度分布
[0272]
在一些实施方案中,本发明片剂具有这样的吉卡宾溶出曲线,其特征在于如通过使用210nm的检测波长的高效液相色谱法所测量在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在
45分钟或更短的时间内至少85%的吉卡宾溶出%曲线。在一些实施方案中,本发明片剂具有这样的吉卡宾溶出曲线,其特征在于如通过使用210nm的检测波长的高效液相色谱法所测量在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在45分钟或更短的时间内至少90%的吉卡宾溶出%曲线。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0273]
在一些实施方案中,本发明片剂具有这样的吉卡宾溶出曲线,其特征在于如通过使用210nm的检测波长的高效液相色谱法所测量或通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在30分钟或更短的时间内至少70%、至少71%、至少72%、至少73%、至少74%或至少75%或起止于这些百分比中任一者的范围内的值的吉卡宾溶出%曲线。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0274]
在一些实施方案中,本发明片剂具有这样的吉卡宾溶出曲线,其包含以下值:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,和(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0275]
本发明进一步提供了本发明片剂,其(a)包含具有如通过激光衍射测得的40μm至约75μm的范围内的psd90的本发明化合物,并且(b)具有这样的吉卡宾溶出曲线,其特征在于(1)如通过使用210nm的检测波长的高效液相色谱法所测量在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,或(2)如通过使用210nm的检测波长的高效液相色谱法所测量在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%的吉卡宾溶出%曲线。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0276]
在一些实施方案中,使用本发明片剂测量吉卡宾溶出曲线。在一些实施方案中,片剂是压缩片剂。在一些实施方案中,片剂是压缩片剂或具有外包衣。在一些实施方案中,片剂是压缩片剂并且具有外包衣。在一些实施方案中,外包衣是薄膜包衣。在一些实施方案中,片剂是压缩片剂或是未包衣的。在一些实施方案中,片剂是压缩片剂并且是未包衣的。
[0277]
在一些实施方案中,使用含有本发明片剂的胶囊来测量本发明片剂的溶出曲线。
[0278]
水和乙醇含量
[0279]
在一些实施方案中,本发明化合物具有以本发明化合物计约1%w/w至约6%w/w的水含量。在一些实施方案中,本发明化合物具有以本发明化合物计约2%w/w至约5%w/w的水含量。在一些实施方案中,本发明化合物的水含量是以本发明化合物计约2%w/w至约5%w/w、约2%w/w至约4%w/w、约3%w/w至约5%w/w、或约3%w/w至约4%w/w、或起止于这些重量百分比值中任一者的范围内的值。在一些实施方案中,本发明化合物的水含量是以本发明化合物重量计约2.0%、约2.1%、约2.2%、约2.3%、约2.4%、约2.5%、约2.6%、约2.7%、约2.8%、约2.9%、约3.0%、约3.1%、约3.2%、约3.3%、约3.4%、约3.5%、约3.6%、约3.7%、约3.8%、约3.9%、约4.0%、约4.1%、约4.2%、约4.3%、约4.4%、约4.5%、约4.6%、约4.7%、约4.8%、约4.9%、或约5.0%。在其他实施方案中,本发明化合物的水含量是以本发明化合物重量计约3.4%、约3.5%、约3.6%、或约3.7%。
[0280]
在一些实施方案中,本发明化合物具有以本发明化合物计约0%w/w至约0.5%w/w的乙醇含量。在一些实施方案中,本发明化合物的乙醇含量是以本发明化合物重量计约
0.0%、约0.1%、约0.2%、约0.3%、约0.4%、或约0.5%。
[0281]
在一些实施方案中,本发明化合物具有以本发明化合物计约0.5%w/w至约8%w/w的乙醇含量。
[0282]
在一些实施方案中,本发明化合物具有以本发明化合物计少于约5000ppm的乙醇含量。在一些实施方案中,本发明化合物具有以本发明化合物计少于约4000ppm的乙醇含量。在一些实施方案中,本发明化合物具有以本发明化合物计少于约3000ppm的乙醇含量。在一些实施方案中,本发明化合物具有以本发明化合物计少于约2000ppm的乙醇含量。在一些实施方案中,乙醇含量以本发明化合物计少于约500ppm、少于约600ppm、少于约700ppm、少于约800ppm、少于约900ppm、少于约1000ppm、少于约1100ppm、少于约1200ppm、少于约1300ppm、少于约1400ppm、少于约1500ppm、少于约1600ppm、少于约1700ppm、少于约1800ppm、少于约1900ppm、或少于约2000ppm。
[0283]
在一些实施方案中,本发明化合物具有以本发明化合物计约0.5%w/w至约8%w/w的乙醇含量。在一些实施方案中,本发明化合物是乙醇溶剂化物,其具有以本发明化合物计约0.5%w/w至约8%w/w的乙醇含量。在一些实施方案中,本发明化合物的乙醇含量以本发明化合物重量计为约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1.0%、约1.1%、约1.2%、约1.3%、约1.4%、约1.5%、约1.6%、约1.7%、约1.8%、约1.9%、2.0%、约2.1%、约2.2%、约2.3%、约2.4%、约2.5%、约2.6%、约2.7%、约2.8%、约2.9%、约3.0%、约3.1%、约3.2%、约3.3%、约3.4%、约3.5%、约3.6%、约3.7%、约3.8%、约3.9%、约4.0%、约4.1%、约4.2%、约4.3%、约4.4%、约4.5%、约4.6%、约4.7%、约4.8%、约4.9%、约5.0%、约5.1%、约5.2%、约5.3%、约5.4%、约5.5%、约5.6%、约5.7%、约5.8%、约5.9%、约6.0%、约6.1%、约6.2%、约6.3%、约6.4%、约6.5%、约6.6%、约6.7%、约6.8%、约6.9%、约7.0%、约7.1%、约7.2%、约7.3%、约7.4%、约7.5%、约7.6%、约7.7%、约7.8%、约7.9%、或约8.0%。
[0284]
在一些实施方案中,本发明化合物具有以本发明化合物计约20,000ppm至约40,000ppm的乙醇含量。在一些实施方案中,本发明化合物是乙醇溶剂化物,其具有以本发明化合物计约20,000ppm至约40,000ppm的乙醇含量。在一些实施方案中,本发明化合物具有以本发明化合物计约20,000ppm、约21,000ppm、约22,000ppm、约23,000ppm、约24,000ppm、约25,000ppm、约26,000ppm、约27,000ppm、约28,000ppm、约29,000ppm、约30,000ppm、约31,000ppm、约32,000ppm、约33,000ppm、约34,000ppm、约35,000ppm、约36,000ppm、约37,000ppm、约38,000ppm、约39,000ppm、约40,000ppm的乙醇含量。在一些实施方案中,本发明化合物具有以本发明化合物计约28,000ppm、约28,100ppm、约28,200ppm、约28,300ppm、约28.400ppm、约28,500ppm、约28,600ppm、约28,700ppm、约28,800ppm、或约28,900ppm的乙醇含量。
[0285]
在一些实施方案中,本发明化合物具有约5:1至1:5的范围内的乙醇:水含量比。在一些实施方案中,本发明化合物具有约1:1至1:5的范围内的乙醇:水含量比。在一些实施方案中,本发明化合物具有约1:3至1:5的范围内的乙醇:水含量比。在一些实施方案中,本发明化合物具有约1:4的乙醇:水含量比。
[0286]
在一些实施方案中,(本发明化合物):(乙醇):(水)的含量比为约2:4:1。
[0287]
药代动力学
[0288]
在一些实施方案中,受试者中的吉卡宾的稳态血浆浓度是在开始以重复剂量施用本发明片剂后或在增加本发明片剂的每日给药剂量后约5
‑
20天内实现。在一些实施方案中,受试者中的吉卡宾的稳态血浆浓度是在开始以重复剂量施用本发明片剂后或在增加本发明片剂的每日给药剂量后约14天内实现。在一些实施方案中,稳态是在开始以约50毫克/天至约900毫克/天的剂量每日施用本发明片剂后或在增加本发明片剂的每日给药剂量至约50毫克/天至约900毫克/天的剂量后5、6、7、8、9、10、11、12、13、14或15天内实现。
[0289]
本发明提供了具有如下吉卡宾溶出曲线的本发明片剂:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态约200μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。本发明提供了具有如下吉卡宾溶出曲线的本发明片剂:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态约200μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0290]
本发明提供了本发明片剂,其(a)包含本发明化合物,本发明化合物的粒度分布的特征在于如通过激光衍射测得的35μm至90μm的范围内的psd90,并且(b)具有这样的吉卡宾溶出曲线,其特征在于如下的溶出%曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量或如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量或如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量;并且当以约50mg至约900mg的剂量施用于人类受试者时,提供在稳态约200μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0291]
本发明提供了本发明片剂,其(a)包含本发明化合物,本发明化合物的粒度分布的特征在于如通过激光衍射测得的40μm至约75μm的范围内的psd90,并且(b)具有这样的吉卡宾溶出曲线,其特征在于如下的溶出%曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量;并且当以约50mg至约900mg的剂量施用于人类受试者时,提供在稳态约200μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0292]
本发明提供了本发明片剂,其(a)包含本发明化合物,本发明化合物的粒度分布的特征在于如通过激光衍射测得的40μm至约75μm的范围内的psd90,并且(b)具有这样的吉卡宾溶出曲线,其特征在于如下的吉卡宾溶出%曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲
液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量;并且当以约50mg至约900mg的剂量施用于人类受试者时,提供在稳态约200μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0293]
在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约200μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约250μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约250μg
·
hr/ml至在稳态约5750μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约300μg
·
hr/ml至在稳态约5500μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0294]
在一些实施方案中,当以相当于每天约50mg吉卡宾至每天约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态200μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,当以相当于每天约50mg吉卡宾至每天约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态250μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,当以相当于每天约50mg吉卡宾至每天约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态250μg
·
hr/ml至在稳态5750μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,当以相当于每天约50mg吉卡宾至每天约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态300μg
·
hr/ml至在稳态5500μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0295]
在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时或当以相当于每天约50mg吉卡宾至每天约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约200μg
·
hr/ml、约250μg
·
hr/ml、约300μg
·
hr/ml、约350μg
·
hr/ml、约400μg
·
hr/ml、约450μg
·
hr/ml、约500μg
·
hr/ml、约550μg
·
hr/ml、约600μg
·
hr/ml、约650μg
·
hr/ml、约700μg
·
hr/ml、约750μg
·
hr/ml、约800μg
·
hr/ml、约850μg
·
hr/ml、约900μg
·
hr/ml、约950μg
·
hr/ml、约1000μg
·
hr/ml、约1100μg
·
hr/ml、约1200μg
·
hr/ml、约1300μg
·
hr/ml、约1400μg
·
hr/ml、约1500μg
·
hr/ml、约1600μg
·
hr/ml、约1700μg
·
hr/ml、约1800μg
·
hr/ml、约1900μg
·
hr/ml、约2000μg
·
hr/ml、约2100μg
·
hr/ml、约2200μg
·
hr/ml、约2300μg
·
hr/ml、约2400μg
·
hr/ml、约2500μg
·
hr/ml、约2600μg
·
hr/ml、约2700μg
·
hr/ml、约2800μg
·
hr/ml、约2900μg
·
hr/ml、约3000μg
·
hr/ml、约3100μg
·
hr/ml、约3200μg
·
hr/ml、约3300μg
·
hr/ml、约3400μg
·
hr/ml、约3500μg
·
hr/ml、约3600μg
·
hr/ml、约3700μg
·
hr/ml、约3800μg
·
hr/ml、约3900μg
·
hr/ml、约4000μg
·
hr/ml、约4100μg
·
hr/ml、约4200μg
·
hr/ml、约4300μg
·
hr/ml、约4400μg
·
hr/ml、约4500μg
·
hr/ml、约4600μg
·
hr/ml、约4700μg
·
hr/ml、约4800μg
·
hr/ml、约4900μg
·
hr/ml、约5000μg
·
hr/ml、约5100μg
·
hr/ml、约5200μg
·
hr/ml、约5300μg
·
hr/ml、约5400μ
g
·
hr/ml、约5500μg
·
hr/ml、约5600μg
·
hr/ml、约5700μg
·
hr/ml、约5800μg
·
hr/ml、约5900μg
·
hr/ml、或约6000μg
·
hr/ml的血浆吉卡宾auc
(0
‑
24)
。
[0296]
在一些实施方案中,当以约50毫克/天、约60毫克/天、约70毫克/天、约80毫克/天、约90毫克/天、约100毫克/天、约110毫克/天、约120毫克/天、约130毫克/天、约140毫克/天、约150毫克/天、约160毫克/天、约170毫克/天、约180毫克/天、约190毫克/天、约200毫克/天、约210毫克/天、约220毫克/天、约230毫克/天、约240毫克/天、约250毫克/天、约260毫克/天、约270毫克/天、约280毫克/天、约290毫克/天、300毫克/天、约310毫克/天、约320毫克/天、约330毫克/天、约340毫克/天、约350毫克/天、约360毫克/天、约370毫克/天、约380毫克/天、约390毫克/天、400毫克/天、约410毫克/天、约420毫克/天、约430毫克/天、约440毫克/天、约450毫克/天、约460毫克/天、约470毫克/天、约480毫克/天、约490毫克/天、500毫克/天、约510毫克/天、约520毫克/天、约530毫克/天、约540毫克/天、约550毫克/天、约560毫克/天、约570毫克/天、约580毫克/天、约590毫克/天、600毫克/天、约610毫克/天、约620毫克/天、约630毫克/天、约640毫克/天、约650毫克/天、约660毫克/天、约670毫克/天、约680毫克/天、约690毫克/天、700毫克/天、约710毫克/天、约720毫克/天、约730毫克/天、约740毫克/天、约750毫克/天、约760毫克/天、约770毫克/天、约780毫克/天、约790毫克/天、800毫克/天、约810毫克/天、约820毫克/天、约830毫克/天、约840毫克/天、约850毫克/天、约860毫克/天、约870毫克/天、约880毫克/天、约890毫克/天、或约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约200μg
·
hr/ml至在稳态约6000μg
·
hr/ml或在稳态约250μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0297]
在一些实施方案中,当以相当于每天约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、400mg、约410mg、约420mg、约430mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg、600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、700mg、约710mg、约720mg、约730mg、约740mg、约750mg、约760mg、约770mg、约780mg、约790mg、800mg、约810mg、约820mg、约830mg、约840mg、约850mg、约860mg、约870mg、约880mg、约890mg、或约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态200μg
·
hr/ml至在稳态6000μg
·
hr/ml或在稳态250μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0298]
在一些实施方案中,当以约50毫克/天的剂量或以相当于每天约50mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约200μg
·
hr/ml至在稳态约1000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,当以约50毫克/天的剂量或以相当于每天约50mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约200μg
·
hr/ml至在稳态约500μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0299]
在一些实施方案中,当以约150毫克/天的剂量或以相当于每天约150mg吉卡宾的
摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约300μg
·
hr/ml至在稳态约1500μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,当以约150毫克/天的剂量或以相当于每天约150mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约500μg
·
hr/ml至在稳态约1200μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0300]
在一些实施方案中,当以约300毫克/天的剂量或以相当于每天约300mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约500μg
·
hr/ml至在稳态约2500μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,当以约300毫克/天的剂量或以相当于每天约300mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约1000μg
·
hr/ml至在稳态约2000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0301]
在一些实施方案中,当以约450毫克/天的剂量或以相当于每天约450mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约750μg
·
hr/ml至在稳态约3250μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,当以约450毫克/天的剂量或以相当于每天约450mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约1250μg
·
hr/ml至在稳态约3000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0302]
在一些实施方案中,当以约600毫克/天的剂量或以相当于每天约600mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约1500μg
·
hr/ml至在稳态约5000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,当以约600毫克/天的剂量或以相当于每天约600mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约1500μg
·
hr/ml至在稳态约4500μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,当以约600毫克/天的剂量或以相当于每天约600mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态2000μg
·
hr/ml至在稳态4000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0303]
在一些实施方案中,当以约900毫克/天的剂量或以相当于每天约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约3000μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,当以约900毫克/天的剂量或以相当于每天约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态3250μg
·
hr/ml至在稳态约5750μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0304]
在一些实施方案中,当以约300毫克/天至约900毫克/天范围内的剂量或以相当于每天约300mg至约900mg吉卡宾的范围内的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约500μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,当以约450毫克/天至约750毫克/天范围内的剂量或以相当于每天约450mg至约750mg吉卡宾的范围内的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供在稳态约1500μg
·
hr/ml至在稳态约5250μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,当以约500毫克/天至约700毫克/天范围内的剂量或以相当于每天约500mg至约700mg吉卡宾的范围内的摩尔当量施用于人类受试者时,本发明化合物
或本发明片剂提供在稳态约1500μg
·
hr/ml至在稳态约5250μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0305]
本发明提供了本发明片剂,其具有如下吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量或如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量或如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且在以约50mg至约900mg的单一剂量施用于人类受试者后,其提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0306]
本发明提供了本发明片剂,其(a)包含如通过激光衍射测得的具有35μm至90μm的范围内的psd90的本发明化合物,并且(b)具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且在以约50mg至约900mg的单一剂量施用于人类受试者后,其提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0307]
本发明提供了本发明片剂,其(a)包含如通过激光衍射测得的具有40μm至约75μm的范围内的psd90的本发明化合物,并且(b)具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量,并且在以约50mg至约900mg的单一剂量施用于人类受试者后,其提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0308]
本发明提供了本发明片剂,其(a)包含如通过激光衍射测得的具有40μm至约75μm的范围内的psd90的本发明化合物,并且(b)具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且在以约50mg至约900mg的单一剂量施用于人类受试者后,其提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0309]
在一些实施方案中,在以约50mg至约900mg的单一剂量施用后,本发明化合物或本发明片剂提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在以约50mg至约900mg的单一剂量施用后,本发明化合物或本发明片剂提供约150μg
·
hr/ml至约5750μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在以约50mg至约900mg的单一剂量施用后,本发明化合物或本发明片剂提供约400μg
·
hr/ml至约5500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在以约50mg至约900mg
的单一剂量施用后,本发明化合物或本发明片剂提供约500μg
·
hr/ml至约5250μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。
[0310]
在另一个实施方案中,在本发明化合物或本发明片剂以相当于约50mg吉卡宾至约900mg吉卡宾的摩尔当量的单一剂量施用后,本发明化合物或本发明片剂提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在另一个实施方案中,在本发明化合物或本发明片剂以相当于约50mg吉卡宾至约900mg吉卡宾的摩尔当量的单一剂量施用后,本发明化合物或本发明片剂提供约150μg
·
hr/ml至约5750μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在另一个实施方案中,在本发明化合物或本发明片剂以相当于约50mg吉卡宾至约900mg吉卡宾的摩尔当量的单一剂量施用后,本发明化合物或本发明片剂提供约400μg
·
hr/ml至约5500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在另一个实施方案中,在本发明化合物或本发明片剂以相当于约50mg吉卡宾至约900mg吉卡宾的摩尔当量的单一剂量施用后,本发明化合物或本发明片剂提供约500μg
·
hr/ml至约5250μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在另一个实施方案中,在本发明化合物或本发明片剂以相当于约50mg吉卡宾至约900mg吉卡宾的摩尔当量的单一剂量施用后,本发明化合物或本发明片剂提供约500μg
·
hr/ml至约5500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。
[0311]
在一些实施方案中,在以约50mg至约900mg的单一剂量施用后或在本发明化合物或本发明片剂以相当于约50mg吉卡宾至约900mg吉卡宾的摩尔当量的单一剂量施用后,本发明化合物或本发明片剂提供约50μg
·
hr/ml、约100μg
·
hr/ml、约150μg
·
hr/ml、约200μg
·
hr/ml、约250μg
·
hr/ml、约300μg
·
hr/ml、约350μg
·
hr/ml、约400μg
·
hr/ml、约450μg
·
hr/ml、约500μg
·
hr/ml、约550μg
·
hr/ml、约600μg
·
hr/ml、约650μg
·
hr/ml、约700μg
·
hr/ml、约750μg
·
hr/ml、约800μg
·
hr/ml、约850μg
·
hr/ml、约900μg
·
hr/ml、约950μg
·
hr/ml、约1000μg
·
hr/ml、约1100μg
·
hr/ml、约1200μg
·
hr/ml、约1300μg
·
hr/ml、约1400μg
·
hr/ml、约1500μg
·
hr/ml、约1600μg
·
hr/ml、约1700μg
·
hr/ml、约1800μg
·
hr/ml、约1900μg
·
hr/ml、约2000μg
·
hr/ml、约2100μg
·
hr/ml、约2200μg
·
hr/ml、约2300μg
·
hr/ml、约2400μg
·
hr/ml、约2500μg
·
hr/ml、约2600μg
·
hr/ml、约2700μg
·
hr/ml、约2800μg
·
hr/ml、约2900μg
·
hr/ml、约3000μg
·
hr/ml、约3100μg
·
hr/ml、约3200μg
·
hr/ml、约3300μg
·
hr/ml、约3400μg
·
hr/ml、约3500μg
·
hr/ml、约3600μg
·
hr/ml、约3700μg
·
hr/ml、约3800μg
·
hr/ml、约3900μg
·
hr/ml、约4000μg
·
hr/ml、约4100μg
·
hr/ml、约4200μg
·
hr/ml、约4300μg
·
hr/ml、约4400μg
·
hr/ml、约4500μg
·
hr/ml、约4600μg
·
hr/ml、约4700μg
·
hr/ml、约4800μg
·
hr/ml、约4900μg
·
hr/ml、约5000μg
·
hr/ml、约5100μg
·
hr/ml、约5200μg
·
hr/ml、约5300μg
·
hr/ml、约5400μg
·
hr/ml、约5500μg
·
hr/ml、约5600μg
·
hr/ml、约5700μg
·
hr/ml、约5800μg
·
hr/ml、约5900μg
·
hr/ml、约6000μg
·
hr/ml、约6100μg
·
hr/ml、约6200μg
·
hr/ml、约6300μg
·
hr/ml、约6400μg
·
hr/ml、约6500μg
·
hr/ml、约6600μg
·
hr/ml、约6700μg
·
hr/ml、约6800μg
·
hr/ml、约8900μg
·
hr/ml、约7000μg
·
hr/ml、约7100μg
·
hr/ml、约7200μg
·
hr/ml、约7300μg
·
hr/ml、约7400μg
·
hr/ml、约7500μg
·
hr/ml的血浆吉卡宾auc
最后
。
[0312]
在一些实施方案中,在以约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约
290mg、300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、400mg、约410mg、约420mg、约430mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg、600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、700mg、约710mg、约720mg、约730mg、约740mg、约750mg、约760mg、约770mg、约780mg、约790mg、800mg、约810mg、约820mg、约830mg、约840mg、约850mg、约860mg、约870mg、约880mg、约890mg、或约900mg的单次施用后,本发明化合物或本发明片剂提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。
[0313]
在一些实施方案中,在本发明化合物或本发明片剂以相当于约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、400mg、约410mg、约420mg、约430mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg、600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、700mg、约710mg、约720mg、约730mg、约740mg、约750mg、约760mg、约770mg、约780mg、约790mg、800mg、约810mg、约820mg、约830mg、约840mg、约850mg、约860mg、约870mg、约880mg、约890mg、或约900mg吉卡宾的摩尔当量单次施用后,本发明化合物或本发明片剂提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。
[0314]
在一些实施方案中,在以约50mg的剂量或以相当于约50mg吉卡宾的摩尔当量单次施用于人类受试者后,本发明化合物或本发明片剂提供约50μg
·
hr/ml至约750μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在以约50mg的剂量或以相当于约50mg吉卡宾的摩尔当量单次施用于人类受试者后,本发明化合物或本发明片剂提供约100μg
·
hr/ml至约500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。
[0315]
在一些实施方案中,在以约150mg的剂量或以相当于约150mg吉卡宾的摩尔当量的单一剂量施用于人类受试者后,本发明化合物或本发明片剂提供约100μg
·
hr/ml至约1250μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在以约150mg的剂量或以相当于约150mg吉卡宾的摩尔当量的单一剂量施用于人类受试者后,本发明化合物或本发明片剂提供约200μg
·
hr/ml至约1000μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。
[0316]
在一些实施方案中,在以约300mg的剂量或以相当于约300mg吉卡宾的摩尔当量的单一剂量施用于人类受试者后,本发明化合物或本发明片剂提供约500μg
·
hr/ml至约2250μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在以约300mg的剂量或以相当于约300mg吉卡宾的摩尔当量的单一剂量施用于人类受试者后,本发明化合物或本发明片剂提供约750μg
·
hr/ml至约2000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0317]
在一些实施方案中,在以约600mg的剂量或以相当于约600mg吉卡宾的摩尔当量的单一剂量施用于人类受试者后,本发明化合物或本发明片剂提供约1000μg
·
hr/ml至约4000μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在以约600mg的剂量或以相当于约600mg吉卡宾的摩尔当量的单一剂量施用于人类受试者后,本发明化合物或本发
明片剂提供约1500μg
·
hr/ml至约3500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在以约600mg的剂量或以相当于约600mg吉卡宾的摩尔当量单次施用于人类受试者后,本发明化合物或本发明片剂提供约1750μg
·
hr/ml至约3750μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。
[0318]
在一些实施方案中,在以约900mg的剂量或以相当于约900mg吉卡宾的摩尔当量的单一剂量施用于人类受试者后,本发明化合物或本发明片剂提供约2500μg
·
hr/ml至约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在以约900mg的剂量或以相当于约900mg吉卡宾的摩尔当量的单一剂量施用于人类受试者后,本发明化合物或本发明片剂提供约2750μg
·
hr/ml至约5500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。
[0319]
在一些实施方案中,在以约300mg至约900mg的剂量或以相当于约300mg至约900mg吉卡宾的摩尔当量的单一剂量施用于人类受试者后,本发明化合物或本发明片剂提供约500μg
·
hr/ml至约5500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在以约450mg至约750mg的剂量或以相当于约450mg至约750mg吉卡宾的摩尔当量的单一剂量施用于人类受试者后,本发明化合物或本发明片剂提供约750μg
·
hr/ml至约5000μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在以约500mg至约700mg的剂量或以相当于约500mg至约700mg吉卡宾的摩尔当量的单一剂量施用于人类受试者后,本发明化合物或本发明片剂提供约1000μg
·
hr/ml至约4500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。
[0320]
在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清低密度脂蛋白胆固醇(ldl
‑
c)的约1%至约80%的降低。在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清ldl
‑
c的约5%至约75%的降低。在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清ldl
‑
c的约10%至约75%的降低。在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清ldl
‑
c的约15%至约70%的降低。在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清ldl
‑
c的约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%、约71%、约72%、约73%、约74%、约75%、约76%、约77%、约78%、约79%、或约80%的降低。
[0321]
在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清ldl
‑
c的至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约11%、至少约12%、至少约13%、至少约14%、至少约15%、至少约
16%、至少约17%、至少约18%、至少约19%、至少约20%、至少约21%、至少约22%、至少约23%、至少约24%、至少约25%、至少约26%、至少约27%、至少约28%、至少约29%、至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、至少约35%、至少约36%、至少约37%、至少约38%、至少约39%、至少约40%、至少约41%、至少约42%、至少约43%、至少约44%、至少约45%、至少约46%、至少约47%、至少约48%、至少约49%、至少约50%、至少约51%、至少约52%、至少约53%、至少约54%、至少约55%、至少约56%、至少约57%、至少约58%、至少约59%、至少约60%、至少约61%、至少约62%、至少约63%、至少约64%、至少约65%、至少约66%、至少约67%、至少约68%、至少约69%、至少约70%、至少约71%、至少约72%、至少约73%、至少约74%、至少约75%、至少约76%、至少约77%、至少约78%、至少约79%、或至少约80%的降低。
[0322]
在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清总胆固醇的约1%至约80%的降低,包括其中所有的子范围。
[0323]
在一些实施方案中,当以相当于每天约50mg至约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清ldl
‑
c的约1%至约80%的降低。在一些实施方案中,当以相当于每天约50mg至约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清ldl
‑
c的约5%至约75%、约10%至约75%、或约15%至约70%的降低。在一些实施方案中,当以相当于每天约50mg至约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清ldl
‑
c的约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%、约71%、约72%、约73%、约74%、约75%、约76%、约77%、约78%、约79%、或约80%的降低。
[0324]
在一些实施方案中,当以相当于每天约50mg至约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清ldl
‑
c的至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约11%、至少约12%、至少约13%、至少约14%、至少约15%、至少约16%、至少约17%、至少约18%、至少约19%、至少约20%、至少约21%、至少约22%、至少约23%、至少约24%、至少约25%、至少约26%、至少约27%、至少约28%、至少约29%、至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、至少约35%、至少约36%、至少约37%、至少约38%、至少约39%、至少约40%、至少约41%、至少约42%、至少约43%、至少约44%、至少约45%、至少约46%、至少约47%、至少约48%、至少约49%、至少约50%、至少约51%、至少约52%、至少约53%、至少约54%、至少约55%、至少约56%、至少约57%、至少约58%、至少约59%、至少约60%、至少约61%、至少约62%、至少约63%、至少约64%、至少约65%、至少约66%、至少约67%、至少约68%、至少约69%、至少约70%、至少约
71%、至少约72%、至少约73%、至少约74%、至少约75%、至少约76%、至少约77%、至少约78%、至少约79%、或至少约80%的降低。
[0325]
在一些实施方案中,当以相当于每天约50mg至约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清总胆固醇的约1%至约80%的降低,包括其中所有的子范围。
[0326]
在一些实施方案中,当以相当于每天约20mg、约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、400mg、约410mg、约420mg、约430mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg、600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、700mg、约710mg、约720mg、约730mg、约740mg、约750mg、约760mg、约770mg、约780mg、约790mg、800mg、约810mg、约820mg、约830mg、约840mg、约850mg、约860mg、约870mg、约880mg、约890mg、900mg、约910mg、约920mg、约930mg、约940mg、约950mg、约960mg、约970mg、约980mg、约990mg、或约1000mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清ldl
‑
c的约1%至约80%或约1%至约75%的降低。
[0327]
在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清载脂蛋白b(apo b)的约1%至约50%的降低。在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清apo b的约1%至约40%的降低。在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清apo b的约1%至约30%的降低。在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清apo b的约5%至约30%的降低。在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清apo b的约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、或约60%的降低。在一些实施方案中,当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清apo b的至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约11%、至少约12%、至少约13%、至少约14%、至少约15%、至少约16%、至少约17%、至少约18%、至少约19%、至少约20%、至少约21%、至少约22%、至少约23%、至少约24%、至少约25%、至少约26%、至少约27%、至少
约28%、至少约29%、至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、至少约35%、至少约36%、至少约37%、至少约38%、至少约39%、至少约40%、至少约41%、至少约42%、至少约43%、至少约44%、至少约45%、至少约46%、至少约47%、至少约48%、至少约49%、至少约50%、至少约51%、至少约52%、至少约53%、至少约54%、至少约55%、至少约56%、至少约57%、至少约58%、至少约59%、或至少约60%的降低。
[0328]
在一些实施方案中,当以相当于每天约50mg至约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清apo b的约1%至约50%的降低。在一些实施方案中,当以相当于每天约50mg至约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清apo b的约1%至约40%、约1%至约30%、或约5%至约30%的降低。在一些实施方案中,当以相当于每天约50mg至约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清apob的约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、或约60%的降低。在一些实施方案中,当以相当于每天约50mg至约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清apo b的至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约11%、至少约12%、至少约13%、至少约14%、至少约15%、至少约16%、至少约17%、至少约18%、至少约19%、至少约20%、至少约21%、至少约22%、至少约23%、至少约24%、至少约25%、至少约26%、至少约27%、至少约28%、至少约29%、至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、至少约35%、至少约36%、至少约37%、至少约38%、至少约39%、至少约40%、至少约41%、至少约42%、至少约43%、至少约44%、至少约45%、至少约46%、至少约47%、至少约48%、至少约49%、至少约50%、至少约51%、至少约52%、至少约53%、至少约54%、至少约55%、至少约56%、至少约57%、至少约58%、至少约59%、或至少约60%的降低。
[0329]
在一些实施方案中,当以相当于每天约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、400mg、约410mg、约420mg、约430mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg、600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、700mg、约710mg、约720mg、约730mg、约740mg、约750mg、约760mg、约770mg、约780mg、约790mg、800mg、约810mg、约820mg、约830mg、约840mg、约850mg、约860mg、约870mg、约880mg、约890mg、或约900mg吉卡宾的摩尔当量施用于人类受试者时,本发明化合物或本发明片剂提供人类受试者的基线血浆或血清apo b的约1%至约
50%的降低。
[0330]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物,所述化合物具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态约250μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0331]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态约250μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0332]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态约250μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0333]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态约250μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0334]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态250μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0335]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态250μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0336]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态250μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0337]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态250μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0338]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态约200μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态200μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0339]
在一些实施方案中,本发明片剂包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态约200μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,本发明片剂包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态200μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0340]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态约200μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态200μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0341]
在一些实施方案中,本发明片剂包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态约200μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,本发明片剂包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态200μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0342]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态250μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,本发明片剂包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态250μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0343]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态250μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,本发明片剂包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态250μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0344]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态约250μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,本发明片剂包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态约250μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0345]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态约250μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,本发明片剂包含本发明化合物,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,提供在稳态约250μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。
[0346]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态约200μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0347]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态约200μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0348]
在一些实施方案中,本发明提供了药物组合物,其包含无定形形式或结晶形式的本发明化合物,其具有具如下值的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用
210nm的检测波长的高效液相色谱法所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态约200μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0349]
在一些实施方案中,本发明提供了片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态约200μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0350]
在一些实施方案中,本发明提供了无定形或结晶的本发明化合物,其具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态200μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0351]
在一些实施方案中,本发明提供了一种片剂,其包含结晶形式的吉卡宾钙盐,并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态200μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0352]
在一些实施方案中,本发明提供了药物组合物,其包含无定形形式或结晶形式的本发明化合物,其具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态200μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0353]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态200μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0354]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下
的溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态250μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0355]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态250μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0356]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态250μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0357]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态250μg
·
hr/ml至在稳态6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0358]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态约250μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0359]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且当以约50毫克/天至约900毫克/天的剂量施
用于人类受试者时,其提供在稳态约250μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0360]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态约250μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0361]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且当以约50毫克/天至约900毫克/天的剂量施用于人类受试者时,其提供在稳态约250μg
·
hr/ml至在稳态约6000μg
·
hr/ml的范围内的血浆吉卡宾auc
(0
‑
24)
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0362]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量,并且在以约50mg至约900mg的单次剂量施用于人类受试者后,其提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0363]
在一些实施方案中,本发明提供了片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且在以约50mg至约900mg的单次剂量施用于人类受试者后,其提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0364]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少80%,如通过使用210nm的检测波长的高效液相色谱法所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用210nm的检测波长的高效液相色谱法所测量,并且在以约50mg至约900mg的单次剂量施用于人类受试者后,其提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0365]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物并具有如下的吉卡宾溶出曲线:(1)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过45分钟内至少
80%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,或(2)在37℃
±
5℃于ph 5.0乙酸钾缓冲液中在不超过30分钟内至少70%,如通过使用216nm至230nm的检测波长范围的紫外/可见光吸收所测量,并且在以约50mg至约900mg的单次剂量施用于人类受试者后,其提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,在37℃
±
0.5℃下测量溶出度。
[0366]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物,并且在以约50mg至约900mg的单次剂量施用于人类受试者后提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物,并且在以约50mg至约900mg的单次剂量施用于人类受试者后提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。
[0367]
在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物,并且在以约50mg至约900mg的单次剂量施用于人类受试者后提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。在一些实施方案中,本发明提供了本发明片剂,其包含本发明化合物,并且在以约50mg至约900mg的单次剂量施用于人类受试者后提供约50μg
·
hr/ml至约7500μg
·
hr/ml的范围内的血浆吉卡宾auc
最后
。
[0368]
在一些实施方案中,本发明化合物或本发明片剂的有效剂量可为如下剂量:在4周治疗后实现低密度脂蛋白胆固醇(ldl
‑
c)的≥10%的平均降低。在一些实施方案中,本发明化合物或本发明片剂的有效剂量可为如下剂量:在4周治疗后实现ldl
‑
c的≥15%的平均降低。在一些实施方案中,本发明化合物或本发明片剂的有效剂量可为如下剂量:在4周治疗后实现ldl
‑
c的≥5%、≥6%、≥7%、≥8%、≥9%、≥10%、≥11%、≥12%、≥13%、≥14%、或15%的平均降低。在一些实施方案中,本发明化合物或本发明片剂的有效剂量可为如下剂量:在以每天约50mg至约900mg每日施用本发明化合物或本发明片剂4周后实现ldl
‑
c的≥5%、≥6%、≥7%、≥8%、≥9%、≥10%、≥11%、≥12%、≥13%、≥14%、或15%的平均降低。
[0369]
在一些实施方案中,使用本发明片剂测量本发明化合物或本发明片剂的药代动力学值和特性。在一些实施方案中,片剂是压缩片剂。在一些实施方案中,片剂是压缩片剂或具有外包衣。在一些实施方案中,片剂是压缩片剂并且具有外包衣。在一些实施方案中,外包衣是薄膜包衣。在一些实施方案中,片剂是压缩片剂或未包衣的。在一些实施方案中,片剂是压缩片剂并且是未包衣的。
[0370]
在一些实施方案中,当化合物或片剂包含在胶囊中时,测量本发明化合物或本发明片剂的药代动力学值和特性。
[0371]
在一些实施方案中,使用本发明片剂测量本发明化合物或本发明片剂的auc
(0
‑
24)
或auc
最后
。在一些实施方案中,片剂是压缩片剂。在一些实施方案中,片剂是压缩片剂或具有外包衣。在一些实施方案中,片剂是压缩片剂并且具有外包衣。在一些实施方案中,外包衣是薄膜包衣。在一些实施方案中,片剂是压缩片剂或未包衣的。在一些实施方案中,片剂是压缩片剂并且是未包衣的。在一些实施方案中,当化合物或片剂包含在胶囊中时,测量本发明化合物或本发明片剂的auc
(0
‑
24)
或auc
最后
。
[0372]
在一些实施方案中,本文公开的药代动力学值和特性与人类受试者有关。
[0373]
制造吉卡宾的方法
[0374]
本发明进一步提供了用于制造吉卡宾的方法。吉卡宾可用于制造本发明化合物。吉卡宾或其药学上可接受的盐可如方案1所示的合成方法制备。
[0375]
方案1.吉卡宾或吉卡宾钙的合成
[0376][0377]
将异丁酸转化成碱金属盐。在一些实施方案中,使用碱金属氢氧化物将异丁酸转化成碱金属盐。在一些实施方案中,碱金属氢氧化物是氢氧化锂、氢氧化钠或氢氧化钾。在一些实施方案中,碱金属氢氧化物是氢氧化钠。
[0378]
在一些实施方案中,碱金属氢氧化物是氢氧化锂,其将异丁酸转化成异丁酸锂。在一些实施方案中,碱金属氢氧化物是氢氧化钠,其将异丁酸转化成异丁酸钠。在一些实施方案中,碱金属氢氧化物是氢氧化钾,其将异丁酸转化成异丁酸钾。
[0379]
在一些实施方案中,碱金属氢氧化物存在于水性溶液或悬浮液中。在一些实施方案中,碱金属氢氧化物以约30%(w/w)存在于水性溶液中。
[0380]
在一些实施方案中,碱金属盐是氢氧化钠。在一些实施方案中,氢氧化钠存在于水性溶液中。在一些实施方案中,氢氧化钠的水性溶液是30%(w/w)。
[0381]
在一些实施方案中,在有机溶剂的存在下将异丁酸转化成碱金属盐。在一些实施方案中,有机溶剂是烃溶剂。在一些实施方案中,烃溶剂是苯、甲苯、二甲苯或烷烃。在一些实施方案中,烷烃是c5
‑
c12烷烃。在一些实施方案中,烷烃是戊烷、己烷或庚烷。在一些实施方案中,烷烃是正戊烷、正己烷或正庚烷。在一些实施方案中,烷烃是正庚烷。
[0382]
重要的是在进行添加形成烯醇盐的碱前从包含异丁酸碱金属盐的反应混合物去除基本上所有的水,因为形成烯醇盐的碱可与残余水反应。在一些实施方案中,在添加形成烯醇盐的碱前以异相共沸蒸馏(在共沸物中的组合物:12.9%的水和87.1%的庚烷;沸点79.2℃)去除水。在一些实施方案中,水的异相共沸蒸馏在约100℃至约110℃进行。在一些实施方案中,水的异相共沸蒸馏在约105℃进行。在一些实施方案中,水的异相共沸蒸馏在约900毫巴至约1100毫巴进行。在一些实施方案中,水的异相共沸蒸馏在约1000毫巴进行。
[0383]
在添加形成烯醇盐的碱前,为了从反应混合物有效地去除基本上所有的水,例如用异相共沸蒸馏去除的水可以通过体积测量。在其他实施方案中,可进行karl
‑
fisher分析。在一些实施方案中,在添加形成烯醇盐的碱前存在于反应混合物中的水(如果存在)为反应混合物的≤0.05%w/w,如通过karl
‑
fisher分析所确定。在一些实施方案中,在添加形
成烯醇盐的碱前存在于反应混合物中的水(如果存在)为反应混合物的0.05%w/w或更少、0.04%w/w或更少、0.03%w/w或更少、0.02%w/w或更少、0.015%w/w或更少、0.0125%w/w或更少、或0.01%w/w或更少,如通过karl
‑
fisher分析所确定。在一些实施方案中,在添加形成烯醇盐的碱前存在于反应混合物中的水(如果存在)为反应混合物的小于0.05%w/w、小于0.04%w/w、小于0.03%w/w、小于0.02%w/w、小于0.015%w/w、小于0.0125%w/w、或小于0.01%w/w,如通过karl
‑
fisher分析所确定。
[0384]
在一些实施方案中,使用形成烯醇盐的碱将异丁酸的碱金属盐转化成烯醇盐。在一些实施方案中,形成烯醇盐的碱是六甲基二硅基叠氮化锂(lithium hexamethyldisilazide)、二异丙基胺基锂(lda)、四甲基哌啶锂(litmp)或二乙基胺基锂(linet2)。在一些实施方案中,形成烯醇盐的碱是lda,并且使用二异丙基胺和有机锂试剂(例如正丁基锂、正己基锂或正庚基锂)原位制备。在一些实施方案中,形成烯醇盐的碱在非质子性溶剂中产生。在一些实施方案中,形成烯醇盐的碱商购获得且存在于非质子性溶剂中。在一些实施方案中,形成烯醇盐的碱在thf或包含thf的溶剂混合物中产生。在一些实施方案中,形成烯醇盐的碱在thf或包含thf的溶剂混合物中。
[0385]
在一些实施方案中,lda是预先制造且商购获得的,尤其是考虑到有机锂试剂的高度热解性质。在一些实施方案中,lda是预先制造的。在一些实施方案中,预先制造的lda存在于溶液中。在一些实施方案中,预先制造的lda溶液是约25%w/w至约30%w/w的lda。在一些实施方案中,lda是28%w/w于庚烷/thf/乙基苯中。在一些实施方案中,预先制造的lda存在于溶液中。在一些实施方案中,预先制造的lda溶液是约1.5m至约2.5m。在一些实施方案中,lda是2.0m至2.2m于庚烷/thf/乙基苯中。在一些实施方案中,形成烯醇盐的碱的添加是在无水条件下进行。在一些实施方案中,形成烯醇盐的碱的添加是在基本上无水的条件下进行。在一些实施方案中,形成烯醇盐的碱的添加是在其中水含量为反应混合物的≤0.05%w/w(如通过karl
‑
fisher分析所确定)的条件下进行。
[0386]
在一些实施方案中,将形成烯醇盐的碱与异丁酸的碱金属盐混合以提供异丁酸的碱金属盐的烯醇盐。形成烯醇盐的碱可添加至异丁酸的碱金属盐中,或反之亦然。在一些实施方案中,形成烯醇盐的碱是lda,异丁酸的碱金属盐是异丁酸钠,并且将lda添加至异丁酸钠中。在一些实施方案中,形成烯醇盐的碱与异丁酸的碱金属盐在约10℃至约15℃的范围内的温度下混合。在一些实施方案中,在形成烯醇盐的碱与异丁酸的碱金属盐混合后,将反应混合物在42℃
±
2℃加热。在一些实施方案中,将反应混合物在42℃
±
2℃加热约30分钟至2小时。在一些实施方案中,将反应混合物在42℃
±
2℃加热约1小时。在一些实施方案中,形成烯醇盐的碱与异丁酸的碱金属盐在庚烷、四氢呋喃(thf)或其组合的存在下混合。在一些实施方案中,形成烯醇盐的碱与异丁酸的碱金属盐在正庚烷、四氢呋喃(thf)或其组合的存在下混合。
[0387]
将异丁酸的碱金属盐的烯醇盐与双(4
‑
卤丁基)醚混合。烯醇盐可添加至双(4
‑
卤丁基)醚,或反之亦然。在一些实施方案中,双(4
‑
卤丁基)醚是双(4
‑
氯丁基)醚;在一些实施方案中,双(4
‑
卤丁基)醚是双(4
‑
溴丁基)醚;并且在一些实施方案中,双(4
‑
卤丁基)醚是双(4
‑
碘丁基)醚。
[0388]
在一些实施方案中,将约两当量异丁酸的碱金属盐的烯醇盐与双(4
‑
卤丁基)醚混合。在一些实施方案中,将约两至约三当量异丁酸的碱金属盐的烯醇盐与双(4
‑
卤丁基)醚
混合。在一些实施方案中,将2.2至2.5当量异丁酸的碱金属盐的烯醇盐与双(4
‑
卤丁基)醚混合。
[0389]
在一些实施方案中,双(4
‑
卤丁基)醚逐滴添加至烯醇盐中。在一些实施方案中,双(4
‑
卤丁基)醚经约1小时至约5小时逐滴添加至烯醇盐中。在一些实施方案中,双(4
‑
卤丁基)醚经约1小时至约4小时逐滴添加至烯醇盐中。在一些实施方案中,双(4
‑
卤丁基)醚在约40℃至约45℃的范围内的温度添加至烯醇盐中。在一些实施方案中,双(4
‑
卤丁基)醚在40℃至44℃的范围内的温度添加至烯醇盐中。在一些实施方案中,双(4
‑
卤丁基)醚作为在thf中的溶液添加至烯醇盐中。在一些实施方案中,双(4
‑
卤丁基)醚是双(4
‑
氯丁基)醚,烯醇盐是异丁酸钠的烯醇化锂,双(4
‑
氯丁基)醚作为在thf中的溶液在40℃至44℃的范围内的温度添加至异丁酸钠的烯醇化锂中。
[0390]
在一些实施方案中,在添加双(4
‑
卤丁基)醚后,允许反应混合物在约40℃至约45℃的范围内的温度搅拌。在一些实施方案中,在添加双(4
‑
卤丁基)醚后,允许反应混合物在40℃至44℃的范围内的温度搅拌。在一些实施方案中,在添加双(4
‑
卤丁基)醚后,允许反应混合物搅拌约8小时至约30小时。在一些实施方案中,在添加双(4
‑
卤丁基)醚后,允许反应混合物搅拌至少10小时。在一些实施方案中,在添加双(4
‑
卤丁基)醚后,允许反应混合物搅拌约10小时至约24小时。在一些实施方案中,在添加双(4
‑
卤丁基)醚后,允许反应混合物搅拌约14小时至约24小时。
[0391]
在一些实施方案中,在添加双(4
‑
卤丁基)醚后,允许反应混合物在40℃至44℃范围的温度搅拌且直到定量1h nmr分析指示反应混合物中≤5%的双(4
‑
卤丁基)醚(例如≥95%的双(4
‑
卤丁基)醚转化)为止。在一些实施方案中,在添加双(4
‑
卤丁基)醚后,允许反应混合物在40℃至44℃的范围内的温度搅拌且直到1h nmr分析指示反应混合物中5%或更少、4%或更少、3%或更少、2%或更少、或1.5%或更少的双(4
‑
卤丁基)醚为止。在一些实施方案中,在添加双(4
‑
卤丁基)醚后,允许反应混合物在40℃至44℃的范围内的温度搅拌且直到1h nmr分析指示反应混合物中小于5%、小于4%、小于3%、小于2%、或小于1.5%的双(4
‑
卤丁基)醚为止。
[0392]
一旦双(4
‑
卤丁基)醚反应基本上完成时(例如定量1h nmr分析指示≤5%的双(4
‑
卤丁基)醚),可进行水性后处理以将吉卡宾盐产物萃取至水相中。一旦吉卡宾盐包含在水相中时,可将水相酸化,例如用无机酸,例如盐酸。一旦水相酸化和吉卡宾盐转化成吉卡宾时,可将吉卡宾以有机溶剂萃取。有用的有机溶剂包括庚烷、己烷、甲基四氢呋喃、甲苯、乙酸乙酯、乙酸丁酯、环己烷、2
‑
丁酮和二异丙基醚。在一些实施方案中,有机溶剂是庚烷。在一些实施方案中,有机溶剂是正庚烷。在一些实施方案中,水相以有机溶剂萃取多次。在一些实施方案中,在双(4
‑
卤丁基)醚反应完成或基本上完成后,萃取中所使用的有机溶剂具有约40℃至约60℃的范围内的温度。在一些实施方案中,在双(4
‑
卤丁基)醚反应完成或基本上完成后,萃取中所使用的有机溶剂具有约48℃至约54℃的范围内的温度。在一些实施方案中,萃取在约40℃至约60℃的范围内的温度进行(温度表示萃取中所使用的溶剂的温度)。
[0393]
含有吉卡宾的有机层可蒸发至基本上干燥。所得粗制吉卡宾可与水混合,可接着将其蒸发。在一些实施方案中,在≤60℃蒸发水。可将进一步所得粗制吉卡宾溶解在有机溶剂(例如庚烷)中,并且可将有机溶液以水洗涤且蒸发至基本上干燥。此过程可重复一或多
次。在一些实施方案中,此过程重复两次。在一些实施方案中,此过程重复至少两次。
[0394]
在一些实施方案中,例如由每当量双(4
‑
卤丁基)醚使用大于两当量异丁酸的碱金属盐的烯醇盐所生成的异丁酸杂质可通过与水共蒸馏而去除。不受任何理论的束缚,据信异丁酸作为与水的共沸物被去除。粗制吉卡宾中异丁酸杂质的存在可不利地影响其结晶和结晶吉卡宾的纯度。
[0395]
在一些实施方案中,水的共蒸馏在约100℃至约110℃的范围内的温度进行。在一些实施方案中,水的共蒸馏在约100℃至约105℃的范围内的温度进行。在一些实施方案中,水的共蒸馏在环境温度进行。在一些实施方案中,水的共蒸馏在减压下进行。在一些实施方案中,水的共蒸馏在减压下进行,以便水的共蒸馏在约35℃至约70℃的范围内的温度进行。在一些实施方案中,水的共蒸馏在减压下进行,以便水的共蒸馏在约40℃至约60℃的范围内的温度进行。在一些实施方案中,水的共蒸馏在约10毫巴至约100毫巴进行。
[0396]
在一些实施方案中,与水的第一共蒸馏提供粗制吉卡宾,其包含粗制吉卡宾的5%w/w或更少的异丁酸杂质,如通过离子色谱所确定。在一些实施方案中,与水的第一共蒸馏提供粗制吉卡宾,其包含粗制吉卡宾的5%w/w或更少、4%w/w或更少、3%w/w或更少、2%w/w或更少、或1%w/w或更少的异丁酸杂质,如通过离子色谱所确定。在一些实施方案中,与水的第一共蒸馏提供粗制吉卡宾,其包含粗制吉卡宾的小于5%w/w、小于4%w/w、小于3%w/w、小于2%w/w、或小于1%w/w的异丁酸杂质,如通过离子色谱所确定。在一些实施方案中,与水的第一共蒸馏提供粗制吉卡宾,其包含粗制吉卡宾的0.9%w/w或更少、0.8%w/w或更少、0.7%w/w或更少、0.6%w/w或更少、或0.5%w/w或更少的异丁酸杂质,如通过离子色谱所确定。在一些实施方案中,与水的第一共蒸馏提供粗制吉卡宾,其包含粗制吉卡宾的小于0.9%w/w、小于0.8%w/w、小于0.7%w/w、小于0.6%w/w、或小于0.5%w/w的异丁酸杂质,如通过离子色谱所确定。在一些实施方案中,与水的第一共蒸馏提供粗制吉卡宾,其包含粗制吉卡宾的0.8%w/w或更少的异丁酸杂质,如通过离子色谱所确定。
[0397]
在一些实施方案中,与水的第二共蒸馏提供粗制吉卡宾,其包含粗制吉卡宾的1%w/w或更少的异丁酸杂质,如通过离子色谱所确定。在一些实施方案中,与水的第二共蒸馏提供粗制吉卡宾,其包含粗制吉卡宾的1.0%w/w或更少、0.9%w/w或更少、0.8%w/w或更少、0.7%w/w或更少、0.6%w/w或更少、0.5%w/w或更少、0.4%w/w或更少、0.3%w/w或更少、或0.2%w/w或更少的异丁酸杂质,如通过离子色谱所确定。在一些实施方案中,与水的第二共蒸馏提供粗制吉卡宾,其包含粗制吉卡宾的小于1.0%w/w、小于0.9%w/w、小于0.8%w/w、小于0.7%w/w、小于0.6%w/w、小于0.5%w/w、小于0.4%w/w、小于0.3%w/w、或小于0.2%w/w的异丁酸杂质,如通过离子色谱所确定。在一些实施方案中,与水的第二共蒸馏提供粗制吉卡宾,其包含粗制吉卡宾的0.5%w/w或更少、0.4%w/w或更少、0.3%w/w或更少、或0.2%w/w或更少的异丁酸杂质,如通过离子色谱所确定。在一些实施方案中,与水的第二共蒸馏提供粗制吉卡宾,其包含粗制吉卡宾的0.3%w/w或更少的异丁酸杂质,如通过离子色谱所确定。
[0398]
在水蒸馏和/或蒸发和去除异丁酸杂质后,可进行水/庚烷异相共沸蒸馏以去除基本上所有的水含量,如通过karl
‑
fisher分析所确定。在一些实施方案中,水含量(如果存在)为反应混合物的≤0.05%w/w,如通过karl
‑
fisher分析所确定。在一些实施方案中,水含量(如果存在)为反应混合物的0.05%w/w或更少、或0.04%w/w或更少,如通过karl
‑
fisher分析所确定。在一些实施方案中,水含量(如果存在)为反应混合物的小于0.05%w/w、或小于0.04%w/w,如通过karl
‑
fisher分析所确定。
[0399]
在一些实施方案中,在吉卡宾结晶前,将粗制吉卡宾通过硅胶以去除杂质,例如任何有色或极性杂质。在一些实施方案中,硅胶过滤使用作为洗脱剂的庚烷中的5%(v/v)thf进行。在一些实施方案中,在硅胶过滤后仅以庚烷洗涤硅胶。在一些实施方案中,庚烷是正庚烷。
[0400]
来自硅胶过滤的含吉卡宾的级分可蒸发至基本上干燥并且所得残余物可从有机溶剂或有机溶剂的混合物结晶。在一些实施方案中,有机溶剂是庚烷或庚烷与thf的混合物。在一些实施方案中,有机溶剂是没有thf存在的庚烷。在一些实施方案中,庚烷是正庚烷。
[0401]
在一些实施方案中,将粗制吉卡宾在约20℃至约50℃的范围内的温度溶解在有机溶剂中。在一些实施方案中,将粗制吉卡宾在35℃至50℃的范围内的温度溶解在有机溶剂中。
[0402]
在一些实施方案中,一旦粗制吉卡宾溶解在有机溶剂中时,将有机溶液冷却到15℃
±
2℃。在一些实施方案中,将有机溶液冷却到15℃
±
2℃且接着以一或多个吉卡宾晶体接种。在一些实施方案中,有机溶剂是庚烷。在一些实施方案中,有机溶剂是正庚烷。
[0403]
在一些实施方案中,允许吉卡宾在9℃至16℃的范围内的温度结晶。在一些实施方案中,允许吉卡宾在10℃至15℃的范围内的温度结晶。在一些实施方案中,允许吉卡宾在10℃至14℃的范围内的温度结晶。在一些实施方案中,允许吉卡宾在10℃、11℃、12℃、13℃、14℃或15℃的温度结晶。在一些实施方案中,允许吉卡宾在12℃的温度结晶。
[0404]
在一些实施方案中,重结晶前的粗制吉卡宾包含2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸杂质。允许吉卡宾在10℃至15℃的范围内的温度从庚烷结晶,得到比被允许在小于10℃的温度从庚烷结晶的吉卡宾含有基本上更少的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸杂质的吉卡宾。而且,如表c中所示,被允许维持在12
‑
14℃而不进一步冷却下从庚烷结晶的条目4的吉卡宾含有比其他条目的吉卡宾显著更少的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸。在一些实施方案中,庚烷是正庚烷。
[0405]
表c.采用不同的温度和时间的结晶实验的总结
[0406]
[0407]
tmoda=2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸;hplc
‑
cad=配备有电雾式检测器的高效液相色谱;结晶的吉卡宾的%w/w。
[0408]
在一些实施方案中,在9℃至16℃的范围内的温度由庚烷的第一次吉卡宾结晶生成吉卡宾,其包含以结晶的吉卡宾计≤0.5%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸杂质,如通过高效液相色谱(hplc)所确定。在一些实施方案中,在10℃至15℃的范围内的温度由庚烷的第二次吉卡宾结晶一次生成吉卡宾,其包含以结晶的吉卡宾计≤0.5%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸杂质,如通过高效液相色谱(hplc)所确定。在一些实施方案中,在10℃至15℃的范围内的温度由正庚烷的第一次吉卡宾结晶生成吉卡宾,其包含以结晶的吉卡宾计0.5%w/w或更少、0.4%w/w或更少、0.3%w/w或更少、0.2%w/w或更少、0.15%w/w或更少、0.1%w/w或更少、或0.05%w/w或更少的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸杂质(如果存在),如通过hplc所确定。在一些实施方案中,在10℃至15℃的范围内的温度由庚烷的第一次吉卡宾结晶生成吉卡宾,其包含以结晶的吉卡宾计小于0.5%w/w、小于0.4%w/w、小于0.3%w/w、小于0.2%w/w、小于0.15%w/w、小于0.1%w/w、或小于0.05%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸杂质,如通过hplc所确定。在一些实施方案中,在12℃的温度由庚烷的第一次吉卡宾结晶生成吉卡宾,其包含以结晶的吉卡宾计小于0.2%w/w、小于0.15%w/w、小于0.1%w/w、或小于0.05%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸杂质,如通过hplc所确定。在一些实施方案中,hplc配备有电雾式检测器(cad)。在一些实施方案中,hplc配备有紫外线检测器(uv)。在一些实施方案中,庚烷是正庚烷。
[0409]
在一些实施方案中,在介于10℃至14℃的范围内的温度由庚烷的第一次吉卡宾结晶生成吉卡宾,其包含以结晶的吉卡宾计0.5%w/w至0.1%w/w、0.4%w/w至0.1%w/w、0.3%w/w至0.1%w/w、或0.2%w/w至0.1%w/w的范围内的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸,如通过hplc所确定。在一些实施方案中,在介于10℃与14℃的范围内的温度由庚烷的第一次吉卡宾结晶生成吉卡宾,其包含以结晶的吉卡宾计0.5%w/w至0.01%w/w、0.4%w/w至0.01%w/w、0.3%w/w至0.01%w/w、或0.2%w/w至0.01%w/w的范围内的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸,如通过hplc所确定。在一些实施方案中,在介于10℃与14℃的范围的温度由庚烷的第一次吉卡宾结晶生成吉卡宾,其包含以结晶的吉卡宾计0.5%w/w至0.001%w/w、0.4%w/w至0.001%w/w、0.3%w/w至0.001%w/w、或0.2%w/w至0.001%w/w的范围内的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸,如通过hplc所确定。在一些实施方案中,庚烷是正庚烷。
[0410]
在一些实施方案中,结晶溶液的浓度影响吉卡宾的回收。在一些实施方案中,结晶溶液具有大于0.3g/ml的粗制吉卡宾在有机溶剂或有机溶剂的混合物中的浓度。在一些实施方案中,结晶溶液具有≥0.4g/ml、≥0.5g/ml或≥0.6g/ml的粗制吉卡宾在有机溶剂或有机溶剂的混合物中的浓度。在一些实施方案中,结晶溶液具有0.3g粗制吉卡宾/ml庚烷至0.9g粗制吉卡宾/ml庚烷的范围内的浓度。在一些实施方案中,结晶溶液具有0.5g粗制吉卡宾/ml庚烷至0.8g粗制吉卡宾/ml庚烷范围的浓度。在一些实施方案中,结晶溶液具有从0.5g粗制吉卡宾/ml庚烷至0.7g粗制吉卡宾/ml庚烷范围的浓度。在一些实施方案中,结晶溶液具有0.6g粗制吉卡宾/ml庚烷的浓度。在一些实施方案中,庚烷是正庚烷。
[0411]
吉卡宾的收率可受到涉及双(4
‑
卤丁基)醚的异丁酸、碱金属氢氧化物或形成烯醇盐的碱的当量数的影响。在一些实施方案中,使用与1.00摩尔当量的双(4
‑
卤丁基)醚相比从2.05至3.00摩尔当量范围的异丁酸、碱金属氢氧化物和形成烯醇盐的碱中的每一者。在
一些实施方案中,使用与1.0摩尔当量的双(4
‑
卤丁基)醚相比从2.15至2.50摩尔当量范围的异丁酸、碱金属氢氧化物和形成烯醇盐的碱中的每一者。在一些实施方案中,使用与1.0摩尔当量的双(4
‑
卤丁基)醚相比从2.20至2.40摩尔当量范围的异丁酸、碱金属氢氧化物和形成烯醇盐的碱中的每一者。在一些实施方案中,使用与1.0摩尔当量的双(4
‑
氯丁基)醚相比2.20当量的异丁酸、碱金属氢氧化物和形成烯醇盐的碱中的每一者。在一些实施方案中,碱金属氢氧化物是氢氧化钠,并且形成烯醇盐的碱是lda。在一些实施方案中,碱金属氢氧化物是氢氧化钠,形成烯醇盐的碱是lda,并且双(4
‑
卤丁基)醚是双(4
‑
碘丁基)醚。
[0412]
在一些实施方案中,根据本文公开的方法中任一者制造的吉卡宾具有约85%w/w至100%w/w的范围内的纯度,如通过高效液相色谱(hplc)所确定。在一些实施方案中,吉卡宾具有约90%w/w至100%w/w的范围内的纯度,如通过hplc所确定。在一些实施方案中,吉卡宾具有约95%w/w至100%w/w的范围内的纯度,如通过hplc所确定。在一些实施方案中,吉卡宾具有约98%w/w至100%w/w的范围内的纯度,如通过hplc所确定。在一些实施方案中,吉卡宾具有约99%w/w至100%w/w的范围内的纯度,如通过hplc所确定。在一些实施方案中,吉卡宾具有99.0%至100%的范围内的纯度,如通过hplc所确定。在一些实施方案中,吉卡宾具有约99.5%w/w至100%w/w的范围内的纯度,如通过hplc所确定。在一些实施方案中,hplc配备有电雾式检测器(cad)或紫外线检测器(uv)。
[0413]
在一些实施方案中,根据本文公开的方法中任一者制造的吉卡宾包含以吉卡宾计≤0.5%w/w的异丁酸杂质,如通过离子色谱(ic)所确定。在一些实施方案中,吉卡宾包含以吉卡宾计0.5%w/w或更少、0.4%w/w或更少、0.3%w/w或更少、0.2%w/w或更少、0.15%w/w或更少、0.1%w/w或更少、或0.05%w/w或更少的异丁酸杂质(如果存在),如通过ic所确定。在一些实施方案中,吉卡宾包含以吉卡宾计小于0.5%、小于0.4%w/w、小于0.3%w/w、小于0.2%w/w、小于0.15%w/w、小于0.1%w/w、或小于0.05%w/w的异丁酸杂质,如通过ic所确定。在一些实施方案中,吉卡宾包含以吉卡宾计0.05%w/w或更少的异丁酸杂质,如通过ic所确定。在一些实施方案中,吉卡宾基本上没有异丁酸杂质。在一些实施方案中,在吉卡宾中的异丁酸杂质低于ic的定量限。在一些实施方案中,使用ic的异丁酸定量限为0.05%w/w。
[0414]
在一些实施方案中,根据本文公开的方法中任一者制造的吉卡宾包含以吉卡宾计≤0.5%w/w的6
‑
(4
‑
羟基丁氧基)
‑
2,2
‑
二甲基己酸杂质,如通过高效液相色谱(hplc)所确定。在一些实施方案中,吉卡宾包含以吉卡宾计0.5%w/w或更少、0.4%w/w或更少、0.3%w/w或更少、0.2%w/w或更少、0.15%w/w或更少、0.1%w/w或更少、或0.05%w/w或更少的6
‑
(4
‑
羟基丁氧基)
‑
2,2
‑
二甲基己酸杂质,如通过hplc所确定。在一些实施方案中,吉卡宾包含以吉卡宾计小于0.5%w/w、小于0.4%w/w、小于0.3%w/w、小于0.2%w/w、小于0.15%w/w、小于0.1%w/w、或小于0.05%w/w的6
‑
(4
‑
羟基丁氧基)
‑
2,2
‑
二甲基己酸杂质(如果存在),如通过hplc所确定。在一些实施方案中,hplc配备有电雾式检测器(cad)或紫外线检测器(uv)。
[0415]
在一些实施方案中,根据本文公开的方法中任一者制造的吉卡宾包含以吉卡宾计≤0.5%w/w的(z)
‑
2,2
‑
二甲基
‑
己
‑4‑
烯酸杂质,如通过高效液相色谱(hplc)所确定。在一些实施方案中,吉卡宾包含以吉卡宾计小于0.5%w/w、小于0.4%w/w、小于0.3%w/w、小于0.2%w/w、小于0.15%w/w、小于0.1%w/w、或小于0.05%w/w的(z)
‑
2,2
‑
二甲基
‑
己
‑4‑
烯酸
杂质,如通过hplc所确定。在一些实施方案中,吉卡宾包含以吉卡宾计0.5%w/w或更少、0.4%w/w或更少、0.3%w/w或更少、0.2%w/w或更少、0.15%w/w或更少、0.1%w/w或更少、或0.05%w/w或更少的(z)
‑
2,2
‑
二甲基
‑
己
‑4‑
烯酸杂质(如果存在),如通过hplc所确定。在一些实施方案中,hplc配备有电雾式检测器(cad)或紫外线检测器(uv)。
[0416]
在一些实施方案中,根据本文公开的方法中任一者制造的吉卡宾包含以吉卡宾计≤1.0%w/w的(e)
‑
2,2
‑
二甲基
‑
己
‑4‑
烯酸杂质,如通过高效液相色谱(hplc)所确定。在一些实施方案中,吉卡宾包含以吉卡宾计≤0.5%的(e)
‑
2,2
‑
二甲基
‑
己
‑4‑
烯酸杂质,如通过hplc所确定。在一些实施方案中,吉卡宾包含以吉卡宾计小于1.0%w/w、小于0.9%w/w、小于0.8%w/w、小于0.7%w/w、小于0.6%w/w、小于0.5%w/w、小于0.4%w/w、小于0.3%w/w、小于0.2%w/w、小于0.15%w/w、小于0.1%w/w、或小于0.05%w/w的(e)
‑
2,2
‑
二甲基
‑
己
‑4‑
烯酸杂质,如通过hplc所确定。在一些实施方案中,吉卡宾包含以吉卡宾计1.0%w/w或更少、0.9%w/w或更少、0.8%w/w或更少、0.7%w/w或更少、0.6%w/w或更少、0.5%w/w或更少、0.4%w/w或更少、0.3%w/w或更少、0.2%w/w或更少、0.15%w/w或更少、0.1%w/w或更少、或0.05%w/w或更少的(e)
‑
2,2
‑
二甲基
‑
己
‑4‑
烯酸杂质(如果存在),如通过hplc所确定。在一些实施方案中,hplc配备有电雾式检测器(cad)或紫外线检测器(uv)。
[0417]
本发明进一步提供根据本文公开的方法中任一者制造的吉卡宾。本发明进一步提供根据本文公开的方法中任一者纯化的吉卡宾。本发明进一步提供通过将粗制吉卡宾溶解在庚烷中并将庚烷溶液冷却到10℃至15℃的范围内的温度以沉淀吉卡宾而纯化的吉卡宾。在一些实施方案中,庚烷是正庚烷。
[0418]
本发明进一步提供吉卡宾的药学上可接受的盐,其中吉卡宾根据本文公开的方法中任一者合成。本发明进一步提供吉卡宾的药学上可接受的盐,其中吉卡宾根据本文公开的方法中任一者纯化。本发明进一步提供吉卡宾的药学上可接受的盐,其中吉卡宾通过将粗制吉卡宾溶解在庚烷中并将庚烷溶液冷却到10℃至15℃的范围内的温度以沉淀吉卡宾而纯化。在一些实施方案中,庚烷是正庚烷。
[0419]
在一些实施方案中,根据本文公开的方法中任一者合成的吉卡宾可转化成吉卡宾钙。在一些实施方案中,允许吉卡宾与氧化钙反应。在一些实施方案中,允许吉卡宾与氧化钙在乙醇中反应。在一些实施方案中,允许吉卡宾与氧化钙在乙醇中于回流条件下反应。在允许吉卡宾与氧化钙反应后,可将反应混合物在22℃
±
2℃搅拌约1小时,并且然后可过滤。然后可将过滤的产物在真空下干燥。在一些实施方案中,干燥在氮气气流下在真空下进行。
[0420]
在一些实施方案中,将纯化水添加至干燥的吉卡宾钙中并加热。在一些实施方案中,将纯化水在大气压力下添加至干燥的吉卡宾钙中并加热至约80至约110℃的范围内的温度。在一些实施方案中,将纯化水在大气压力下添加至干燥的吉卡宾钙中并加热至约85℃至约95℃的范围内的温度持续约5小时至约10小时。在一些实施方案中,将纯化水在大气压力下添加至干燥的吉卡宾钙中并加热至90℃持续约6小时。加热具有纯化水的吉卡宾钙以提供吉卡宾钙盐水合物。
[0421]
在一些实施方案中,将吉卡宾钙盐水合物在真空下干燥。在一些实施方案中,将吉卡宾钙盐水合物在真空下在约80℃至约110℃的范围内的温度干燥。在一些实施方案中,将吉卡宾钙盐水合物在真空下在约85℃至约95℃的范围内的温度干燥至少5小时、至少10小时或至少15小时。在一些实施方案中,将吉卡宾钙盐水合物在真空下在90℃的温度干燥至
少16小时,以生成吉卡宾钙盐水合物晶型1。同样地,吉卡宾钙盐溶剂化物可以用醇溶剂(例如乙醇)获得。
[0422]
在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾所制备的吉卡宾钙盐水合物或溶剂化物具有约85%w/w至100%w/w的范围内的纯度,如通过高效液相色谱(hplc)所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物具有约90%w/w至100%w/w的范围内的纯度,如通过hplc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物具有约95%w/w至100%w/w的范围内的纯度,如通过hplc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物具有约98%w/w至100%w/w的范围内的纯度,如通过hplc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物具有约99%w/w至100%w/w的范围内的纯度,如通过hplc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物具有约99.5%w/w至100%w/w的范围内的纯度,如通过hplc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物具有99.5%w/w至100%w/w的范围内的纯度,如通过hplc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物具有99.7%w/w至100%w/w的范围内的纯度,如通过hplc所确定。在一些实施方案中,hplc配备有电雾式检测器(cad)或紫外线检测器(uv)。
[0423]
在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾所制备的吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计≤0.5%w/w的6
‑
(4
‑
羟基丁氧基)
‑
2,2
‑
二甲基己酸杂质,如通过高效液相色谱(hplc)所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计小于0.5%、小于0.4%w/w、小于0.3%w/w、小于0.2%w/w、小于0.15%w/w、小于0.1%w/w、或小于0.05%w/w的6
‑
(4
‑
羟基丁氧基)
‑
2,2
‑
二甲基己酸杂质(如果存在),如通过hplc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计0.5%w/w或更少、0.4%w/w或更少、0.3%w/w或更少、0.2%w/w或更少、0.15%w/w或更少、0.1%w/w或更少、或0.05%w/w或更少的6
‑
(4
‑
羟基丁氧基)
‑
2,2
‑
二甲基己酸杂质,如通过hplc所确定。在一些实施方案中,hplc配备有电雾式检测器(cad)或紫外线检测器(uv)。
[0424]
在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾所制备的吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计≤0.5%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸杂质,如通过高效液相色谱(hplc)所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计小于0.5%w/w、小于0.4%w/w、小于0.3%w/w、小于0.2%w/w、小于0.15%w/w、小于0.1%w/w、或小于0.05%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸杂质,如通过hplc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计0.5%w/w或更少、0.4%w/w或更少、0.3%w/w或更少、0.2%w/w或更少、0.15%w/w或更少、0.1%w/w或更少、或0.05%w/w或更少的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸杂质(如果存在),如通过hplc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计小于0.2%w/w、小于0.15%w/w、小于0.1%w/w、或小于0.05%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸杂质,如通过hplc所确定。在一些实施方案中,hplc配备有电雾式检测器(cad)或紫外线检测器(uv)。
[0425]
在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾所制备的吉卡
宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计≤0.5%w/w的异丁酸杂质,如通过离子色谱(ic)所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计小于0.5%w/w、小于0.4%w/w、小于0.3%w/w、小于0.2%w/w、小于0.15%w/w、小于0.1%w/w、或小于0.05%w/w的异丁酸杂质,如通过ic所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计0.5%w/w或更少、0.4%w/w或更少、0.3%w/w或更少、0.2%w/w或更少、0.15%w/w或更少、0.1%w/w或更少、或0.05%w/w或更少的异丁酸杂质(如果存在),如通过ic所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计0.07%w/w或更少的异丁酸杂质,如通过ic所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计0.05%w/w或更少的异丁酸杂质,如通过ic所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物基本上没有异丁酸杂质。在一些实施方案中,在吉卡宾钙盐水合物或溶剂化物中的异丁酸杂质小于ic的定量限。在一个实施方案中,使用ic的异丁酸定量限为0.05%w/w。
[0426]
在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾制造的吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计≤0.5%w/w的(z)
‑
2,2
‑
二甲基
‑
己
‑4‑
烯酸杂质,如通过高效液相色谱(hplc)所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计小于0.5%w/w、小于0.4%w/w、小于0.3%w/w、小于0.2%w/w、小于0.15%w/w、小于0.1%w/w、或小于0.05%w/w的(z)
‑
2,2
‑
二甲基
‑
己
‑4‑
烯酸杂质,如通过hplc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计0.5%w/w或更少、0.4%w/w或更少、0.3%w/w或更少、0.2%w/w或更少、0.15%w/w或更少、0.1%w/w或更少、或0.05%w/w或更少的(z)
‑
2,2
‑
二甲基
‑
己
‑4‑
烯酸杂质(如果存在),如通过hplc所确定。在一些实施方案中,hplc配备有电雾式检测器(cad)或紫外线检测器(uv)。
[0427]
在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾制造的吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计≤0.5%w/w的(e)
‑
2,2
‑
二甲基
‑
己
‑4‑
烯酸杂质,如通过hplc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计小于0.5%w/w、小于0.4%w/w、小于0.3%w/w、小于0.2%w/w、小于0.15%w/w、小于0.1%w/w、或小于0.05%w/w的(e)
‑
2,2
‑
二甲基
‑
己
‑4‑
烯酸杂质,如通过hplc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计0.5%w/w或更少、0.4%w/w或更少、0.3%w/w或更少、0.2%w/w或更少、0.15%w/w或更少、0.1%w/w或更少、或0.05%w/w或更少的(e)
‑
2,2
‑
二甲基
‑
己
‑4‑
烯酸杂质(如果存在),如通过hplc所确定。在一些实施方案中,hplc配备有电雾式检测器(cad)或紫外线检测器(uv)。
[0428]
在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾制造的吉卡宾钙盐水合物或溶剂化物包含≤2.5ppm的(双(4
‑
氯丁基)醚杂质,如通过气相色谱(gc)所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物包含小于2.5ppm、小于2.0ppm、小于1.5ppm、或小于1.0ppm的(双(4
‑
氯丁基)醚杂质,如通过gc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物包含2.5ppm或更少、2.0ppm或更少、1.5ppm或更少、或1.0ppm或更少的(双(4
‑
氯丁基)醚杂质,如通过gc所确定。
[0429]
在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾所制备的吉卡宾钙盐水合物或溶剂化物含有≤2.5ppm的6
‑
(4
‑
氯丁氧基)
‑
2,2
‑
二甲基
‑
己酸杂质,如通过气相色谱(gc)所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物含有小于2.5ppm,小于2.0ppm,小于1.5ppm、或小于1.0ppm的6
‑
(4
‑
氯丁氧基)
‑
2,2
‑
二甲基
‑
己酸杂质,如通过gc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物含有2.5ppm或更少、2.0ppm或更少、1.5ppm或更少、或1.0ppm或更少的6
‑
(4
‑
氯丁氧基)
‑
2,2
‑
二甲基
‑
己酸杂质,如通过gc所确定。
[0430]
在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾所制备的吉卡宾钙盐水合物或溶剂化物含有≤2.5ppm的1
‑
氯
‑4‑
羟基丁烷杂质,如通过气相色谱(gc)所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物含有小于2.5ppm、小于2.0ppm、小于1.5ppm、或小于1.0ppm的1
‑
氯
‑4‑
羟基丁烷杂质,如通过gc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物含有2.5ppm或更少、2.0ppm或更少、1.5ppm或更少、或1.0ppm或更少的1
‑
氯
‑4‑
羟基丁烷杂质,如通过gc所确定。
[0431]
在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾所制备的吉卡宾钙盐水合物或溶剂化物含有总计≤8ppm的1
‑
氯
‑4‑
羟基丁烷、6
‑
(4
‑
氯丁氧基)
‑
2,2
‑
二甲基
‑
己酸与(双(4
‑
氯丁基)醚杂质,如通过气相色谱(gc)所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物含有总计小于8ppm、小于7.0ppm、小于6ppm或小于5.0ppm的1
‑
氯
‑4‑
羟基丁烷、6
‑
(4
‑
氯丁氧基)
‑
2,2
‑
二甲基
‑
己酸与(双(4
‑
氯丁基)醚杂质,如通过gc所确定。在一些实施方案中,吉卡宾钙盐水合物或溶剂化物含有8ppm或更少、7.5ppm或更少、7.0ppm或更少、或6.5ppm或更少的1
‑
氯
‑4‑
羟基丁烷杂质,如通过gc所确定。
[0432]
在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾制造的吉卡宾钙盐水合物包含以吉卡宾钙盐水合物计约2.0%w/w至约5.0%w/w的范围内的水,如通过karl
‑
fisher分析所确定。在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾所制备的吉卡宾钙盐水合物包含以吉卡宾钙盐水合物计2.0%w/w至5.0%w/w的范围内的水,如通过karl
‑
fisher分析所确定。
[0433]
在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾制造的吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计约10%m/m至约15%m/m的范围内的钙,如通过电感耦合等离子体发射光谱法(icp
‑
oes)所确定。在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾所制备的吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计约10%m/m至约14%m/m的范围内的钙,如通过icp
‑
oes所确定。在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾所制备的吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计9.8%m/m至13.8%m/m的范围内的钙,如通过icp
‑
oes所确定。在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾所制备的吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计11.5%m/m至12.5%m/m的范围内的钙,如通过icp
‑
oes所确定。在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾所制备的吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计约11.77%m/m的钙,如通过icp
‑
oes所确定。
[0434]
在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾制造的吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计约82%w/w至约92%w/w的
范围内的吉卡宾共轭碱组分,如通过高效液相色谱(hplc)所确定,其中所述吉卡宾共轭碱具有结构:在一些实施方案中,由根据本文公开的方法中任一者制造的吉卡宾制造的吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计82%w/w至92%w/w的范围内的吉卡宾共轭碱组分,如通过高效液相色谱(hplc)所确定。吉卡宾共轭碱组分是未计算水、溶剂和钙含量的吉卡宾钙盐水合物或溶剂化物的百分比。在一些实施方案中,hplc配备有紫外线检测器(uv)。
[0435]
在一些实施方案中,由根据本文公开的方法中任一者制造的吉卡宾制造的吉卡宾钙盐水合物或溶剂化物具有以吉卡宾钙盐水合物或溶剂化物计约98%w/w至约105%w/w的无水吉卡宾钙含量,如通过高效液相色谱(hplc)所确定。在一些实施方案中,由根据本文公开的方法中任一者制造的吉卡宾制造的吉卡宾钙盐水合物或溶剂化物具有以吉卡宾钙盐水合物或溶剂化物计98%w/w至105%w/w的无水吉卡宾钙含量,如通过高效液相色谱(hplc)所确定;
[0436]
·
无水吉卡宾钙含量=(%原样的吉卡宾钙)/(100%
‑
通过karl
‑
fisher分析的%水)
[0437]
·
原样的吉卡宾钙=(%吉卡宾)*[(吉卡宾钙分子量)/(吉卡宾分子量)]。
[0438]
在一些实施方案中,由根据本文公开的方法中任一者制造的吉卡宾制造的吉卡宾钙盐水合物或溶剂化物包含2.0%或更少的总杂质,如通过高效液相色谱所确定。在一些实施方案中,由根据本文公开的方法中任一者合成的吉卡宾所制备的吉卡宾钙盐水合物或溶剂化物包含以吉卡宾钙盐水合物或溶剂化物计小于2.0%w/w的总杂质,如通过高效液相色谱所确定。在一些实施方案中,hplc配备有电雾式检测器(cad)或紫外线检测器(uv)。可加入不同的hplc仪器的杂质分析以提供杂质总和。如本文所用,“杂质”是指通过hplc可检测的不是吉卡宾或吉卡宾的药学上可接受的盐的任何有机化合物。例如,异丁酸及双(4
‑
卤丁基)醚是杂质的实例。相关物质的其他实例呈示于表d中。
[0439]
表d.相关物质的实例
[0440][0441]
本发明进一步提供用于纯化粗制吉卡宾的方法,其中所述粗制吉卡宾包含以粗制吉卡宾计不超过5%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸,如通过高效液相色谱(hplc)所
确定,所述方法包括:将粗制吉卡宾溶解在庚烷中以提供粗制吉卡宾的庚烷溶液;以及将所述庚烷溶液冷却到10℃至15℃的范围内的温度以沉淀吉卡宾,其中所述吉卡宾包含以吉卡宾计0.5%w/w或更少的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸,如通过高效液相色谱所确定。
[0442]
本发明进一步提供用于纯化粗制吉卡宾的方法,其中所述粗制吉卡宾包含以粗制吉卡宾计不超过3%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸,如通过高效液相色谱(hplc)所确定,所述方法包括:将粗制吉卡宾溶解在庚烷中以提供粗制吉卡宾的庚烷溶液;以及将所述庚烷溶液冷却到10℃至15℃的范围内的温度以沉淀吉卡宾,其中所述吉卡宾包含以吉卡宾计0.5%w/w或更少的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸,如通过高效液相色谱所确定。在一些实施方案中,粗制吉卡宾包含以粗制吉卡宾计不超过2.5%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸,如通过hplc所确定。在一些实施方案中,粗制吉卡宾包含以粗制吉卡宾计不超过2%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸,如通过hplc所确定。在一些实施方案中,粗制吉卡宾包含以粗制吉卡宾计不超过1.5%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸,如通过hplc所确定。在一些实施方案中,粗制吉卡宾包含以粗制吉卡宾计不超过1%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸,如通过hplc所确定。
[0443]
本发明进一步提供用于纯化粗制吉卡宾的方法,其中所述粗制吉卡宾包含以粗制吉卡宾计不超过1%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸,如通过高效液相色谱所确定,所述方法包括:将所述粗制吉卡宾溶解在庚烷中以提供粗制吉卡宾的庚烷溶液;以及将庚烷溶液冷却到10℃至15℃的范围内的温度以沉淀吉卡宾,其中所述吉卡宾包含以吉卡宾计0.5%w/w或更少的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸,如通过高效液相色谱所确定。
[0444]
在一些实施方案中,粗制吉卡宾在纯化前包含以粗制吉卡宾计大于0.7%w/w且不超过1%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸杂质,如通过高效液相色谱(hplc)所确定。在一些实施方案中,粗制吉卡宾在纯化前包含以粗制吉卡宾计大于0.5%w/w且不超过1%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸杂质,如通过hplc所确定。在一些实施方案中,粗制吉卡宾在纯化前包含以粗制吉卡宾计1.0%w/w至0.5%w/w的范围内的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸杂质,如通过hplc所确定。
[0445]
在一些实施方案中,吉卡宾在纯化后包含以吉卡宾计0.01%w/w至0.5%w/w的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸,如通过高效液相色谱所确定。
[0446]
在一些实施方案中,用于纯化的庚烷溶液的温度是10℃至14℃的范围。在一些实施方案中,用于纯化的庚烷溶液的温度是12℃。在一些实施方案中,庚烷溶液在结晶期间的温度是10℃至14℃的范围。在一些实施方案中,庚烷溶液在结晶期间的温度是12℃。
[0447]
在一些实施方案中,粗制吉卡宾还包含以粗制吉卡宾计0.5%w/w或更少的异丁酸,如通过离子色谱所确定。在一些实施方案中,粗制吉卡宾包含以粗制吉卡宾计0.3%或更少的异丁酸,如通过离子色谱所确定。
[0448]
在一些实施方案中,粗制吉卡宾在庚烷溶液中的浓度是0.3g粗制吉卡宾/ml庚烷至0.8g粗制吉卡宾/ml庚烷的范围。在一些实施方案中,粗制吉卡宾在庚烷溶液中的浓度是0.5g粗制吉卡宾/ml庚烷至0.7g粗制吉卡宾/ml庚烷的范围。在一些实施方案中,粗制吉卡宾在庚烷溶液中的浓度是0.6g粗制吉卡宾/ml庚烷。
[0449]
在一些实施方案中,纯化粗制吉卡宾的方法还包括:将吉卡宾溶解在庚烷中以提供吉卡宾的庚烷溶液;以及将所述庚烷溶液冷却到10℃至15℃的范围内的温度以沉淀重结
晶的吉卡宾。
[0450]
在纯化粗制吉卡宾的方法的一些实施方案中,庚烷是正庚烷。
[0451]
在一些实施方案中,纯化粗制吉卡宾的方法还包括:允许异丁酸的碱金属盐的烯醇盐与双(4
‑
卤丁基)醚反应以提供粗制吉卡宾盐,以及酸化所述粗制吉卡宾盐以提供粗制吉卡宾。在一些实施方案中,允许异丁酸的碱金属盐的烯醇盐与双(4
‑
卤丁基)醚在基本上没有水的条件下反应。在一些实施方案中,所述方法还包括允许异丁酸钠与形成烯醇盐的碱反应以提供异丁酸钠烯醇盐。在一些实施方案中,所述方法还包括允许异丁酸与氢氧化钠反应以提供异丁酸钠。
[0452]
在一些实施方案中,双(4
‑
卤丁基)醚是双(4
‑
氯丁基)醚。
[0453]
在一些实施方案中,异丁酸的碱金属盐的烯醇盐是异丁酸钠烯醇盐。
[0454]
在一些实施方案中,形成烯醇盐的碱是六甲基二硅基叠氮化锂、二异丙基胺基锂、四甲基哌啶锂或二乙基胺基锂。
[0455]
在一些实施方案中,氢氧化钠呈水溶液,并且还包括在允许异丁酸与氢氧化钠反应后且允许异丁酸钠与形成烯醇盐的碱反应前经由蒸发去除水。在一些实施方案中,异丁酸钠具有以包含异丁酸钠的反应混合物计0.05%w/w或更少的水含量,如通过karl
‑
fisher分析所确定。在一些实施方案中,异丁酸钠具有以包含异丁酸钠的反应混合物计约0.05%w/w或更少的水含量,如通过karl
‑
fisher分析所确定。
[0456]
在一些实施方案中,异丁酸的碱金属盐的烯醇盐以二或更多摩尔当量的量存在,并且双(4
‑
卤丁基)醚以一摩尔当量的量存在。在一些实施方案中,异丁酸的碱金属盐的烯醇盐以2.1至2.4摩尔当量的量存在,并且双(4
‑
卤丁基)醚以一摩尔当量的量存在。
[0457]
在一些实施方案中,粗制吉卡宾还包含异丁酸。
[0458]
在一些实施方案中,至少一些异丁酸在酸化粗制吉卡宾盐后并且在吉卡宾在10℃至15℃的范围内的温度从庚烷溶液中沉淀前经由蒸馏而从粗制吉卡宾中去除。在一些实施方案中,去除异丁酸还包括将粗制吉卡宾与水在去除至少一些异丁酸前混合。在一些实施方案中,蒸馏去除水和异丁酸。在一些实施方案中,混合粗制吉卡宾与水并且去除水与至少一些异丁酸进行至少两次。
[0459]
在一些实施方案中,粗制吉卡宾在蒸馏后包含以蒸馏的粗制吉卡宾计0.5%w/w或更少的异丁酸,如通过离子色谱所确定。在一些实施方案中,粗制吉卡宾在蒸馏后包含以蒸馏的粗制吉卡宾计0.3%或更少的异丁酸,如通过离子色谱所确定。
[0460]
吉卡宾可通过本文公开的方法中的任一者来制造或纯化。在一些实施方案中,吉卡宾包含以吉卡宾计0.10%w/w或更少的异丁酸,如通过离子色谱所确定。在一些实施方案中,吉卡宾包含以吉卡宾计0.05%w/w或更少的异丁酸,如通过离子色谱所确定。
[0461]
本发明进一步提供了通过本文公开的方法中的任一者制备或纯化的本发明化合物。在一些实施方案中,本发明化合物是吉卡宾钙盐水合物晶型2。在一些实施方案中,本发明化合物是吉卡宾钙盐水合物晶型c3。在一些实施方案中,本发明化合物是吉卡宾钙盐水合物晶型4。在一些实施方案中,本发明化合物是吉卡宾钙盐水合物晶型5。在一些实施方案中,本发明化合物是吉卡宾钙盐水合物晶型6。
[0462]
在一些实施方案中,吉卡宾的药学上可接受的盐包含以吉卡宾的药学上可接受的盐计0.5%w/w或更少的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸,如通过高效液相色谱所确定。在
一些实施方案中,吉卡宾的药学上可接受的盐包含以吉卡宾的药学上可接受的盐计2%w/w至5%w/w的水,如通过karl
‑
fisher分析所确定。在一些实施方案中,吉卡宾的药学上可接受的盐包含以吉卡宾的药学上可接受的盐计0.5%w/w或更少的异丁酸,如通过离子色谱所确定。在一些实施方案中,吉卡宾的药学上可接受的盐包含以吉卡宾的药学上可接受的盐计0.10%w/w或更少的异丁酸,如通过离子色谱所确定。在一些实施方案中,吉卡宾的药学上可接受的盐包含以吉卡宾的药学上可接受的盐计0.05%w/w或更少的异丁酸,如通过离子色谱所确定。
[0463]
在一些实施方案中,吉卡宾的药学上可接受的盐包含2.5ppm或更少的双(4
‑
氯丁基)醚,如通过气相色谱所确定。在一些实施方案中,吉卡宾的药学上可接受的盐包含2.5ppm或更少的6
‑
(4
‑
氯丁氧基)
‑
2,2
‑
二甲基
‑
己酸,如通过气相色谱所确定。在一些实施方案中,吉卡宾的药学上可接受的盐包含2.5ppm或更少的1
‑
氯
‑4‑
羟基丁烷,如通过气相色谱所确定。在一些实施方案中,吉卡宾的药学上可接受的盐包含8ppm或更少的所有基因毒性杂质总和,包括但不限于双(4
‑
氯丁基)醚、1
‑
氯
‑4‑
羟基丁烷和6
‑
(4
‑
氯丁氧基)
‑
2,2
‑
二甲基
‑
己酸,如通过气相色谱所确定。
[0464]
在一些实施方案中,吉卡宾的药学上可接受的盐包含以吉卡宾的药学上可接受的盐计2.0%w/w或更少的总杂质,如通过高效液相色谱所确定。
[0465]
在一些实施方案中,吉卡宾的药学上可接受的盐包含以吉卡宾的药学上可接受的计82%w/w至92%w/w的范围内的吉卡宾共轭碱组分,如通过高效液相色谱所确定,其中吉卡宾共轭碱组分具有结构:
[0466][0467]
在一些实施方案中,吉卡宾的药学上可接受的盐包含以吉卡宾的药学上可接受的盐计约10%m/m至约14%m/m的钙,其通过电感耦合等离子体发射光谱法确定。在一些实施方案中,吉卡宾的药学上可接受的盐包含以吉卡宾的药学上可接受的盐计约9.8%m/m至13.8%m/m的钙,其通过电感耦合等离子体发射光谱法确定。
[0468]
本发明进一步提供了本发明片剂,其中本发明化合物是根据本文公开的方法中的任一者合成或纯化的。本发明进一步提供了包含从吉卡宾获得的本发明化合物的本发明片剂,所述吉卡宾是根据所公开的任何一种方法通过将粗制吉卡宾溶解在庚烷中并将庚烷溶液冷却至10℃至15℃的范围内的温度而纯化的。在一些实施方案中,庚烷是正庚烷。
[0469]
治疗或预防方法
[0470]
本发明提供了用于治疗或预防如本文公开的各种疾病和疾患的方法,包括向有需要的受试者施用有效量的本发明片剂。在一些实施方案中,受试者是人类。
[0471]
本发明进一步提供了治疗或预防如本文所公开的各种疾病和疾患的方法,包括向有需要的受试者施用有效量的吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0472]
本发明提供了用于治疗或预防肝脏疾病或异常肝脏疾患的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0473]
肝脏疾病或肝脏疾患的实例包括但不限于非酒精性脂肪肝脏疾病(nafld)、非酒精性脂肪肝炎(nash)、酒精性脂肪性肝炎、肝硬化、炎症、肝纤维化、部分纤维化、原发性胆汁性肝硬化、原发性硬化胆道炎、肝衰竭、肝细胞癌(hcc)、肝癌、肝脂肪变性、肝细胞气球样变(也称为肝细胞气球样变(hepatocellular ballooning))、肝小叶炎症和肝甘油三酯累积。在一些实施方案中,肝脏疾病或肝脏疾患是nafld或nash。在一些实施方案中,肝脏疾病或肝脏疾患是nafld。在其他实施方案中,肝脏疾病或肝脏疾患是nash。在一些实施方案中,肝脏疾病或肝脏疾患是肝脂肪变性。在一些实施方案中,肝脏疾病或肝脏疾患是肝纤维化。
[0474]
在一些实施方案中,治疗或预防肝纤维化、nafld或nash包括减退、稳定或抑制肝纤维化、nafld或nash的进展。
[0475]
本发明进一步提供了用于降低肝脂肪(肝的脂肪含量)、稳定肝脂肪量或降低肝脂肪累积的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。本发明进一步提供了用于降低肝脂肪变性(肝的脂肪含量)、稳定肝甘油三酯量或降低肝甘油三酯累积的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0476]
本发明进一步提供了用于治疗或预防肝小叶炎症或肝细胞气球样变的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,治疗或预防肝小叶炎症或肝细胞气球样变是减慢肝小叶炎症或肝细胞气球样变的进展、稳定或降低肝小叶炎症或肝细胞气球样变。
[0477]
本发明进一步提供了用于治疗或预防脂蛋白代谢障碍的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0478]
脂蛋白代谢障碍的实例包括但不限于血脂异常、异常脂蛋白血症、混合性血脂异常、动脉粥样硬化性心血管疾病(ascvd)、iib型高脂血症或家族性混合型高脂血症、家族性高胆固醇血症、家族性乳糜微粒血症综合征、高甘油三酯血症、异常β
‑
脂蛋白血症、脂蛋白过度产生或缺乏症、总胆固醇升高、低密度脂蛋白胆固醇浓度升高、极低密度脂蛋白胆固醇浓度升高、非高密度脂蛋白(非hdl)胆固醇浓度升高、载脂蛋白b浓度升高、载脂蛋白c
‑
iii浓度升高、c反应蛋白浓度升高、血纤维蛋白原浓度升高、脂蛋白(a)浓度升高、白介素
‑
6浓度升高、血管生成素样蛋白3浓度升高、血管生成素样蛋白4浓度升高、血清淀粉样蛋白a浓度升高、pcsk9升高、增加的血栓形成风险、增加的血凝块风险、低的高密度脂蛋白(hdl)
‑
胆固醇浓度、低密度脂蛋白浓度升高、极低密度脂蛋白浓度升高、甘油三酯浓度升高、延长的餐后脂血症、胆汁中脂质消除、代谢障碍、胆汁中磷脂消除、胆汁中氧甾酮消除、异常胆汁产生、过氧化物酶体增殖因子激活受体相关病症、高胆固醇血症、高脂血症和内脏性肥胖。
[0479]
在一些实施方案中,脂蛋白代谢障碍是血脂异常、异常脂蛋白血症、混合性血脂异常、动脉粥样硬化性心血管疾病(ascvd)、iib型高脂血症、家族性混合型高脂血症、家族性高胆固醇血症、家族性乳糜微粒血症综合征、高甘油三酯血症、异常β
‑
脂蛋白血症、代谢综合征、脂蛋白过度产生、脂蛋白缺乏症、非胰岛素依赖性糖尿病、胆汁中异常脂质消除、代谢障碍、胆汁中异常磷脂消除、胆汁中异常氧甾酮消除、异常胆汁产生、高胆固醇血症、高脂血
症或内脏性肥胖。在其他实施方案中,脂蛋白代谢障碍是混合性血脂异常、动脉粥样硬化性心血管疾病(ascvd)、iib型高脂血症、家族性混合型高脂血症或家族性高胆固醇血症。在一些实施方案中,脂蛋白代谢障碍是高甘油三酯血症。在一些实施方案中,脂蛋白代谢障碍是高胆固醇血症。在其他实施方案中,高甘油三酯血症是严重的高甘油三酯血症。“严重的高甘油三酯血症”是其中受试者具有大于或等于500mg/dl的基线血浆甘油三酯浓度。在一些实施方案中,家族性高胆固醇血症(fh)是纯合子fh(hofh)或杂合子fh(hefh)。
[0480]
本发明进一步提供了用于治疗或预防过氧化物酶体增殖因子激活受体相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0481]
本发明进一步提供了用于降低受试者的血浆或血清甘油三酯浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0482]
本发明进一步提供了用于降低受试者的血浆或血清中总胆固醇浓度、低密度脂蛋白胆固醇浓度、低密度脂蛋白浓度、极低密度脂蛋白胆固醇浓度、极低密度脂蛋白浓度、非hdl胆固醇浓度、非hdl浓度、载脂蛋白b浓度、甘油三酯浓度、载脂蛋白c
‑
iii浓度、c反应蛋白浓度、血纤维蛋白原浓度、脂蛋白(a)浓度、白介素
‑
6浓度、血管生成素样蛋白3浓度、血管生成素样蛋白4浓度、pcsk9浓度或血清淀粉样蛋白a浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,本发明提供了用于降低受试者的血浆或血清总胆固醇浓度以及用于降低受试者的血浆或血清低密度脂蛋白胆固醇浓度、低密度脂蛋白浓度、极低密度脂蛋白胆固醇浓度、极低密度脂蛋白浓度、非hdl胆固醇浓度、非hdl浓度、载脂蛋白b浓度、甘油三酯浓度、载脂蛋白c
‑
iii浓度、c反应蛋白浓度、血纤维蛋白原浓度、脂蛋白(a)浓度、白介素
‑
6浓度、血管生成素样蛋白3浓度、血管生成素样蛋白4浓度、pcsk9浓度或血清淀粉样蛋白a浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,本发明提供了用于降低受试者的血浆或血清中受试者的甘油三酯浓度或低密度脂蛋白胆固醇浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0483]
本发明进一步提供了用于降低受试者的血浆或血清中受试者的低密度脂蛋白胆固醇(ldl
‑
c)浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6,其中所述受试者正在使用稳定剂量的他汀类药物。
[0484]
本发明提供了用于升高受试者的血浆或血清中受试者的高密度脂蛋白胆固醇浓度、高密度脂蛋白浓度、高密度胆固醇甘油三酯浓度、脂联素浓度或载脂蛋白a
‑
i浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0485]
本发明提供了用于使胆固醇或甘油三酯从受试者的内皮和表皮细胞转移至受试者的血浆或血清和转运以清除和分泌的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0486]
本发明提供了用于降低受试者发展出血栓形成、血凝块、原发性心血管事件、继发性心血管事件、进展成非酒精性脂肪肝脏疾病、非酒精性脂肪肝炎、肝硬化、肝细胞癌、肝衰竭、胰腺炎、肺纤维化或iib型高脂蛋白血症的风险的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,本发明提供了用于降低受试者发展出胰腺炎的风险的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0487]
本发明提供了用于降低受试者发展出apoc
‑
ii缺乏症的风险的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0488]
本发明提供了用于治疗或预防受试者的肝中纤维化、脂肪变性、气球样变或炎症的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,治疗或预防受试者的肝中气球样变或炎症是降低受试者的肝中气球样变或炎症。本发明进一步提供了降低或抑制受试者的肝中纤维化、脂肪变性、气球样变或炎症进展的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0489]
本发明提供了用于降低餐后脂血症或预防延长的餐后脂血症的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。本发明提供了用于降低餐后脂血症的程度和持续时间的方法,包括向有需要的受试者施用有效量的本发明片剂。本发明提供了用于降低餐后脂血症的程度和持续时间的方法,包括向有需要的受试者施用本发明组合物或本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0490]
本发明提供了用于治疗或预防低α
‑
脂蛋白血症的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0491]
本发明提供了用于降低餐后脂血症的量级或持续时间的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0492]
本发明提供了用于降低受试者的肝脂肪含量的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。本发明提供了用于降低受试者的肝脂肪变性的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0493]
本发明进一步提供了用于降低受试者的血栓形成或血凝块风险的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0494]
在一些实施方案中,本发明的治疗或预防方法有效降低受试者的血浆或血清甘油三酯浓度至低于约200mg/dl或至低于约150mg/dl。在一些实施方案中,本发明的治疗或预
防方法在施用本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6后约8至约12周内有效降低受试者的血浆或血清甘油三酯浓度至低于约200mg/dl或至低于约150mg/dl。
[0495]
在一些实施方案中,本发明的治疗或预防方法在基线血浆或血清甘油三酯浓度为500mg/dl或更高的受试者中将受试者的血浆或血清甘油三酯浓度有效降低至少10%,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,本发明的治疗或预防方法将受试者的血浆或血清甘油三酯浓度有效降低基线血浆或血清甘油三酯浓度的至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%或任何这些值之间的任何范围,其中所述受试者具有500mg/dl或更高的基线血浆或血清甘油三酯浓度。在一些实施方案中,本发明的治疗或预防方法在基线血浆或血清甘油三酯浓度为500mg/dl或更高的受试者中将受试者的血浆或血清甘油三酯浓度有效降低基线血浆或血清甘油三酯浓度的最多约60%,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0496]
在一些实施方案中,本发明的治疗或预防方法在基线血浆或血清甘油三酯浓度为200mg/dl或更高的受试者中将受试者的血浆或血清甘油三酯浓度有效降低至少10%,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,本发明的治疗或预防方法将受试者的血浆或血清甘油三酯浓度有效降低基线血浆或血清甘油三酯浓度的至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%或任何这些值之间的任何范围,其中所述受试者具有200mg/dl或更高的基线血浆或血清甘油三酯浓度。在一些实施方案中,本发明的治疗或预防方法在基线血浆或血清甘油三酯浓度为200mg/dl或更高的受试者中将受试者的血浆或血清甘油三酯浓度有效降低基线血浆或血清甘油三酯浓度的多达约35%、多达约36%、多达约37%、多达约38%、多达约39%或多达约40%,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0497]
本发明进一步提供了用于降低受试者的血浆或血清ldl胆固醇浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0498]
在一些实施方案中,本发明方法将受试者的血浆或血清ldl胆固醇浓度有效降低至低于约130mg/dl。在一些实施方案中,本发明方法在施用本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6约8至约12周内有效降低受试者的血浆或血清中ldl胆固醇浓度至低于约130mg/dl。
[0499]
本发明进一步提供了用于降低受试者的apob浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,所述方法有效降低受试者的apob浓度至低于约120mg/dl。在一些实施方案中,所述方法在施用本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6后约8至约12周内有效降低受试者的apob浓度至低于约120mg/dl。
[0500]
在一些实施方案中,受试者具有动脉粥样代谢综合征、代谢综合征、2型糖尿病、葡萄糖耐量减低、肥胖症、血脂异常、乙型肝炎、丙型肝炎、人免疫缺陷病毒(hiv)感染或代谢障碍(例如威尔森氏病)、糖原储存障碍、半乳糖血症、炎性疾患或高于正常的体重指数(就受试者的性别、年龄或身高而言)的升高的体重指数。不受任何理论的束缚,据信代谢综合征、2型糖尿病、葡萄糖耐量减低、肥胖症、血脂异常、乙型肝炎、丙型肝炎、hiv感染或代谢障碍(例如威尔森氏病)、糖原储存障碍或半乳糖血症是发展出脂肪肝(脂肪变性)的风险因子。
[0501]
在一些实施方案中,受试者患有hiv感染。在一些实施方案中,受试者患有hiv感染且受试者正被施用高活性抗逆转录病毒治疗(haart)剂,例如抗逆转录病毒抑制剂。不受任何理论的束缚,当治疗正经历抗逆转录病毒抑制剂治疗的hiv受试者时,据信本发明化合物以代谢抗逆转录病毒抑制剂的相同的p450酶被分解代谢至低得多的程度。
[0502]
在一些实施方案中,本发明进一步提供了用于治疗或预防hiv相关肝脏疾病或肝脏疾患的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,本发明进一步提供了用于治疗或预防hiv相关nafld的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,本发明进一步提供了用于治疗或预防hiv相关脂肪代谢障碍的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,本发明进一步提供了用于治疗或预防肝脏疾病或肝脏疾患的方法,包括向患有hiv感染的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,本发明进一步提供了用于治疗或预防nafld的方法,包括向患有hiv感染的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0503]
本发明进一步提供了用于治疗或预防葡萄糖代谢障碍的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0504]
葡萄糖代谢障碍的实例包括但不限于胰岛素抗性、葡萄糖耐量减低、空腹血糖不良(在血液中的浓度)、糖尿病、脂肪代谢障碍、家族性局部脂肪代谢障碍、肥胖症、周边脂肪萎缩、糖尿病肾病变、糖尿病视网膜病变、肾病和败血症。在一些实施方案中,肥胖症是中央型肥胖症。
[0505]
在一些实施方案中,本发明进一步提供了用于治疗或预防葡萄糖代谢障碍的方法,包括向患有hiv感染的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,本发明进一步提供了用于治疗或预防脂肪代谢障碍的方法,包括向患有hiv感染的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0506]
本发明进一步提供了用于治疗或预防心血管病症或相关血管病症的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0507]
心血管病症或相关血管病症的实例包括但不限于动脉硬化症、动脉粥样硬化症、高血压、冠状动脉疾病、心肌梗塞、心律失常、心房颤动、心瓣膜疾病、心力衰竭、心肌病、肌病变、心包炎、阳萎和血栓性疾病。
[0508]
本发明进一步提供了用于降低患有心血管或血管事件的受试者风险的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0509]
在一些实施方案中,心血管或血管事件是原发性心血管事件。在其他实施方案中,心血管事件是继发性心血管事件。心血管事件的实例包括但不限于心肌梗塞、中风、心绞痛、急性冠状动脉综合征、冠状动脉搭桥手术和心血管死亡。原发性心血管事件是受试者经历的第一心血管事件。如果相同的受试者经历第二次心血管事件,则第二次心血管事件是继发性心血管事件。
[0510]
本发明进一步提供了用于治疗或预防由增加的纤维化水平所引起的疾病的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,由增加的纤维化水平所引起的疾病是肺病。在一些实施方案中,由增加的纤维化水平所引起的疾病是心脏疾病。在一些实施方案中,由增加的纤维化水平所引起的疾病是皮肤疾病。由增加的纤维化水平所引起的疾病的实例包括但不限于慢性阻塞性肺病、囊性纤维化、特发性肺纤维化、肺气肿、肾性纤维化、子宫内膜纤维化、围神经纤维化、肝纤维化、心肌纤维化、急性肺损伤、在癌症治疗后经辐射诱导的肺损伤、进行性大块纤维化、煤工尘肺病(肺)的并发症、肝硬化(肝)、动脉纤维化、心内膜心肌纤维化、陈旧性心肌梗塞、动脉僵硬(心脏)、胶质瘢痕(脑)、关节纤维化(膝、肩、其他关节)、克罗恩病(肠)、杜普伊特伦(dupuytren)氏挛缩(手、指头)、蟹足肿(皮肤)、纵隔纤维化(纵隔的软组织)、骨髓纤维化(骨髓)、佩洛尼(peyronie)氏症(阴茎)、肾因性全身纤维化(皮肤)、腹膜后纤维化(腹膜后的软组织)、硬皮症/系统性硬化症(皮肤、肺)和一些黏连性关节囊炎形式(肩)。在一些实施方案中,由增加的纤维化水平所引起的疾病是慢性阻塞性肺病或特发性肺纤维化。
[0511]
本发明进一步提供了用于治疗或预防与增加的炎症相关联的疾病的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,与增加的炎症相关联的疾病是自身免疫性疾病。
[0512]
与增加的炎症相关联的疾病的实例包括但不限于多发性硬化症、炎性肠病、乳糜泻、克罗恩疾病、抗磷脂综合征、动脉粥样硬化症、自身免疫性脑脊髓炎、自身免疫性肝炎、格雷夫斯(graves)氏病、溃疡性结肠炎、多发性硬化症、重肌无力症、肌炎、多肌炎、雷诺(raynaud)氏现象、类风湿性关节炎、硬皮症、干燥综合征、系统性红斑狼疮、1型糖尿病和葡萄膜炎。在一些实施方案中,与增加的炎症相关联的疾病是多发性硬化症、炎性肠病、乳糜泻或克罗恩病。
[0513]
本发明进一步提供了用于预防由与增加的炎症相关联的疾病引起的死亡或增加的存活的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,与增加的炎症相关联的疾病是流行性感冒、败血症或病毒疾病。
[0514]
病毒疾病的实例包括但不限于流行性感冒、人免疫缺陷病毒感染、乙型肝炎和丙型肝炎。
[0515]
本发明进一步提供了用于治疗或预防炎症的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,炎症以患者血浆或血清中增加的c反应蛋白浓度指示。
[0516]
c反应蛋白相关病症的实例包括但不限于炎症、缺血性坏死和血栓性疾病。
[0517]
本发明进一步提供了用于治疗或预防硫酸酯酶
‑
2相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。硫酸酯酶
‑
2相关病症的实例包括但不限于脂质生成或脂质调节障碍、升高的血浆或血清甘油三酯或高脂血症、高胆固醇血症、糖尿病、脂肪肝脏疾病、肥胖症、动脉粥样硬化症和/或心血管疾病。
[0518]
本发明进一步提供了用于治疗或预防载脂蛋白c
‑
iii相关病症的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。载脂蛋白c
‑
iii相关病症的实例包括但不限于脂质生成或脂质调节障碍、升高的血浆或血清甘油三酯或高脂血症、高胆固醇血症、糖尿病、脂肪肝脏疾病、肥胖症、动脉粥样硬化症和/或心血管疾病。
[0519]
本发明进一步提供了用于治疗或预防阿尔茨海默病的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0520]
本发明进一步提供了用于治疗或预防帕金森氏病的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0521]
本发明进一步提供了用于治疗或预防胰腺炎的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0522]
本发明进一步提供了用于预防或降低发展出胰腺炎的风险的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0523]
本发明进一步提供了用于治疗或预防肺病的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,肺病是慢性阻塞性肺病或特发性肺纤维化。
[0524]
本发明进一步提供了用于治疗或预防肌肉骨骼不适的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0525]
本发明进一步提供了用于降低受试者的血浆或血清血纤维蛋白原浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0526]
在一些实施方案中,受试者的血浆或血清血纤维蛋白原浓度是大于300mg/dl。在一些实施方案中,受试者的血浆或血清血纤维蛋白原浓度是大于400mg/dl。
[0527]
本发明进一步提供了用于降低受试者的纤维化评分或非酒精性脂肪肝脏疾病活性评分的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。非酒精性脂肪肝脏疾病活性评分(nas或nafld评分)是测量在治疗试验期间的nafld变化的复合评分。nas是由三种组分所组成的复合评分,包括脂肪变性、肝小叶炎症与肝细胞气球样变的评分(表36)。nas是脂肪变性、肝小叶炎症与肝细胞气球样变的评分的未加权总和。脂肪变性等级经量化为含有脂肪小滴的肝细胞百分比。肝的纤维化阶段通过在肝小叶周围区域的胶原的天狼星红染色强度的组织学评估而从nas单独评估。
[0528]
本发明提供了用于减慢nas组分进展的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。本发明提供了用于减慢nas组分进展的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0529]
本发明提供了用于减慢脂肪变性、肝小叶炎症或肝细胞气球样变进展的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。本发明提供了用于减慢脂肪变性、肝小叶炎症或肝细胞气球样变进展的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0530]
本发明提供了用于减慢脂肪变性进展的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。本发明提供了用于减慢肝小叶炎症进展的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。本发明提供了用于减慢肝细胞气球样变进展的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。
[0531]
本发明进一步提供了用于降低受试者中升高的总胆固醇、低密度脂蛋白胆固醇(ldl
‑
c)、载脂蛋白b(apo b)、甘油三酯或非高密度脂蛋白胆固醇的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。本发明进一步提供了用于增加受试者中的高密度脂蛋白胆固醇的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有原发性高脂血症。在一些实施方案中,原发性高脂血症是杂合子家族性的。在一些实施方案中,原发性高脂血症是纯合子家族性的。在一些实施方案中,原发性高脂血症是非家族性的。在一些实施方案中,受试者患有混合性血脂异常。
[0532]
本发明进一步提供了用于治疗或预防与硫酸酯酶
‑
2(sulf
‑
2)mrna的肝过表达相关联的疾患或疾病的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。不受任何理论的束缚,据信sulf
‑
2抑制c
‑
trl的肝处置,由此增加受试者的血浆或血清甘油三酯浓度。与sulf
‑
2的肝过表达相关联的疾患或疾病包括但不限于升高的血浆或血清甘油三酯或高脂血症、高胆固醇血症、糖尿病、脂肪肝脏疾病、肥胖症、动脉粥样硬化症和/或心血管疾病。
[0533]
本发明进一步提供了用于治疗或预防与apoc
‑
iii mrna的肝过表达相关联的疾患或疾病的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。不受任何理论的束缚,据信apoc
‑
iii mrna的过表达导致受试者中增加的血浆或血清甘油三酯浓度。与apoc
‑
iii的肝过表达相关联的疾患或疾病包括但不限于升高的血清甘油三酯或高脂血症、高胆固醇血症、糖尿病、脂肪肝脏疾病、肥胖症、动脉粥样硬化症和/或心血管疾病。
[0534]
本发明进一步提供了用于治疗或预防与angptl3 mrna的肝过表达相关联的疾患或疾病的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。不受任何理论的束缚,据信angptl3mrna的过表达导致受试者中脂蛋白脂酶活性受阻和升高的血浆或血清甘油三酯浓度。与angptl3的肝过表达相关联的疾患或疾病包括但不限于升高的血清甘油三酯或高脂血症、高胆固醇血症、糖尿病、脂肪肝脏疾病、肥胖症、动脉粥样硬化症和/或心血管疾病。
[0535]
本发明进一步提供了用于治疗或预防与angptl4 mrna的肝过表达相关联的疾患或疾病的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。不受任何理论的束缚,据信angptl4mrna的过表达导致受试者中脂蛋白脂酶活性受阻和升高的血浆或血清甘油三酯浓度。与angptl4的肝过表达相关联的疾患或疾病包括但不限于升高的血清甘油三酯或高脂血症、高胆固醇血症、糖尿病、脂肪肝脏疾病、肥胖症、动脉粥样硬化症和/或心血管疾病。
[0536]
本发明进一步提供了用于治疗或预防与angptl8 mrna的肝过表达相关联的疾患或疾病的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。不受任何理论的束缚,据信angptl8mrna的过表达导致受试者中脂蛋白脂酶活性受阻和升高的血浆或血清甘油三酯浓度。与angptl8的肝过表达相关联的疾患或疾病包括但不限于升高的血清甘油三酯或高脂血症、高胆固醇血症、糖尿病、脂肪肝脏疾病、肥胖症、动脉粥样硬化症和/或心血管疾病。
[0537]
本发明提供了用于降低受试者的血浆或血清ldl
‑
c浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。本发明进一步提供了用于降低受试者的血浆或血清升高的总胆固醇或升高的ldl
‑
c的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有纯合子家族性高胆固醇血症(hofh)。在一些实施方案中,已知受试者患有hofh。在一些实施方案中,受试者患有杂合子家族性高胆固醇血症(hefh)。在一些实施方案中,已知受试者患有hefh。本发明的治疗或预防方法可还包含向受试者施用额外的药物活性剂。本发明的治疗或预防方法可还包含向受试者施用两种或更多种额外的药物活性剂。在一些实施方案中,受试者正在使用稳定剂量的他汀类药物。
[0538]
本发明提供了用于降低受试者的ldl
‑
c浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6,其中受试者正在使用稳定剂量的他汀类药物。
[0539]
在一些实施方案中,额外的药物活性剂是他汀类药物、降脂剂、pcsk9抑制剂、维生素e、angptl3抑制剂、angptl4抑制剂、angptl8抑制剂、胆固醇吸收抑制剂、acc抑制剂、
apoc
‑
iii抑制剂、acl抑制剂、鱼油、贝特类药物、甲状腺激素β受体激动剂、类法尼醇x受体(fxr)、ccr2/ccr5(c
‑
c趋化因子受体类型2(ccr2)和5(ccr5))抑制剂或拮抗剂、半胱天冬酶蛋白酶抑制剂、ask
‑
1(细胞凋亡信号调节激酶1)抑制剂、半乳糖凝集素
‑
3蛋白、nox(烟酰胺腺嘌呤二核苷酸磷酸氧化酶)抑制剂、回肠胆汁酸转运体、ppar(过氧化物酶体增殖因子激活受体)激动剂、ppar双重激动剂、pan
‑
ppar激动剂、钠
‑
葡萄糖协同转运蛋白1或2(sglt1或sglt2)抑制剂、二肽基肽酶4(dpp4)抑制剂、脂肪酸合酶(fas)抑制剂、toll样受体拮抗剂、甲状腺激素受体
‑
β(thr
‑
β)激动剂、肝脏导向的选择性thr
‑
β激动剂、aco1调节剂、1
‑
骨髓过氧化酶抑制剂、1
‑
己酮糖激酶(1
‑
khk)抑制剂、氧化应激抑制剂、成纤维细胞生长因子21(fgf21)或19(fgf19)抑制剂、转化生长因子β
‑
1(tgf
‑
β1)激动剂、肝的脂质新生(dnl)抑制剂、烯酰基coa水合酶抑制剂、胆固醇7
‑
α羟化酶(cyp7a1)激动剂、3型胶原蛋白抑制剂或cetp抑制剂。额外的治疗剂可为降脂治疗或药剂。降脂治疗或药剂可为依泽替米贝。
[0540]
本发明的治疗或预防方法可还包含施用他汀类药物和依泽替米贝。
[0541]
在一些实施方案中,受试者正经历胃旁路手术。
[0542]
本发明进一步提供了用于治疗或预防杂合子家族性高胆固醇血症(hefh)的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。本发明进一步提供了用于治疗或预防动脉粥样硬化性心血管疾病(ascvd)的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在另外的一些实施方案中,动脉粥样硬化性心血管疾病是临床的动脉粥样硬化性心血管疾病。在一些实施方案中,受试者是成年人。在一些实施方案中,受试者正进行他汀类药物疗法。在一些实施方案中,他汀类药物疗法是最大耐受的他汀类药物疗法。在一些实施方案中,所述方法还包括向受试者施用他汀类药物。在一些实施方案中,受试者具有异常的高血浆或血清ldl
‑
c。在一些实施方案中,最大耐受的他汀类药物疗法不足以降低受试者的血浆或血清ldl
‑
c。在一些实施方案中,最大耐受的他汀类药物疗法不足以降低受试者的血浆或血清ldl
‑
c至受试者的目标血浆或血清ldl
‑
c浓度。
[0543]
受试者的目标血浆或血清ldl
‑
c浓度随受试者的一种或多种风险因子、预存在的疾患和/或健康状态而改变。例如,所有人类受试者(包括患有chd(冠状动脉心脏疾病)和动脉粥样硬化疾病的其他临床形式的人类受试者)的ldl
‑
c目标浓度应小于100mg/dl。另外,患有chd和动脉粥样硬化疾病的其他临床形式的所有人类受试者的合理或期望的ldl
‑
c目标浓度可小于70mg/dl(smith等人,circulation.2006;113:2363
‑
2372)。
[0544]
本发明进一步提供了用于治疗或预防hofh的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者正进行一种或多种其他的降低密度脂蛋白(ldl)的疗法。在一些实施方案中,所述方法还包括向受试者施用降ldl疗法。降ldl疗法的非限制性实例包括他汀类药物、依泽替米贝和ldl单采术。在一些实施方案中,受试者具有异常高的ldl
‑
c。在一些实施方案中,其他的降ldl疗法不足以降低受试者的ldl
‑
c。在一些实施方案中,其他的降ldl疗法不足以降低受试者的ldl
‑
c至受试者的目标浓度。在一些实施方案中,本发明的治疗或预防方法还包括施用一种或多种如本文所公开的额外的药物活性剂。
[0545]
本发明进一步提供了降低心血管事件的风险的方法,包括向有需要的受试者施用
有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有冠状动脉心脏疾病(chd)。在一些实施方案中,受试者具有急性冠状动脉综合征(acs)病史。在一些实施方案中,受试者事先已经用他汀类药物治疗。在其他实施方案中,受试者事先未经他汀类药物治疗。
[0546]
本发明进一步提供了用于治疗或预防原发性高胆固醇血症的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。原发性高胆固醇血症可为hefh或非家族性高胆固醇血症。在一些实施方案中,本发明进一步提供了用于治疗或预防受试者的混合型高脂血症的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者或受试者的症状以他汀类药物疗法单独未有效地治疗。如本文所用,“以他汀类药物疗法单独未有效地治疗”意指受试者的血浆或血清ldl
‑
c以给出的治疗未降低至受试者的目标浓度。在一些实施方案中,在施用本发明化合物或本发明片剂前,受试者已经被施用他汀类药物和/或依泽替米贝。在一些实施方案中,在施用吉卡宾或其药学上可接受的盐例如本发明化合物或本发明片剂前,受试者事先经他汀类药物和/或依泽替米贝治疗。在一些实施方案中,本发明的治疗或预防方法还包括向受试者施用他汀类药物和依泽替米贝中的一种或两种。
[0547]
本发明进一步提供了用于治疗或预防hofh的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,所述方法还包括施用辅助治疗。辅助治疗可为他汀类药物、依泽替米贝和ldl单采术中的一种或多种。在一些实施方案中,辅助治疗是降ldl疗法。在一些实施方案中,辅助治疗可为他汀类药物、依泽替米贝、ldl单采术、pcsk9抑制剂和胆汁酸螯合剂中的一种或多种。在一些实施方案中,辅助治疗可为他汀类药物、依泽替米贝、ldl单采术、pcsk9抑制剂、胆汁酸螯合剂、洛美塔派(lomitapide)和米泊美生(mipomersen)中的一种或多种。在一些实施方案中,辅助治疗可为一种或多种如本文所公开的额外的药物活性剂。
[0548]
本发明进一步提供了用于降低患有心肌梗塞、患有中风、需要血管重建手术或患有心绞痛的风险的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者未患有冠状动脉心脏疾病(chd)。在一些实施方案中,受试者具有一或多个chd的风险因子。chd的风险因子的实例包括但不限于高血浆或血清胆固醇、高血浆或血清甘油三酯、高血压、糖尿病、糖尿病前期、超重或肥胖症、吸烟、缺乏体育活动、不健康的饮食、压力。另外,年龄、性别和早期chd家族病史可为chd的风险因子。
[0549]
本发明进一步提供了用于降低受试者的心肌梗塞或中风风险的方法,包括对需要其的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有2型糖尿病。在一些实施方案中,受试者患有2型糖尿病并且未患有chd。在一些实施方案中,受试者具有一或多个chd的风险因子。
[0550]
本发明进一步提供了用于降低受试者的非致命性心肌梗塞风险、致命性中风或非
致命性中风风险、需要血管重建手术、充血性心力衰竭(chf)风险或心绞痛风险的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有chd。
[0551]
本发明进一步提供了用于降低受试者的血浆或血清中总胆固醇升高、ldl
‑
c、apo b或甘油三酯浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。本发明进一步提供了用于增加受试者的高密度脂蛋白胆固醇的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者是成人。在一些实施方案中,受试者患有原发性高脂血症。原发性高脂血症可为杂合子家族性或非家族性。在一些实施方案中,受试者患有混合性血脂异常。
[0552]
本发明进一步提供了用于降低受试者的血浆或血清中升高的甘油三酯浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有高甘油三酯血症。在一些实施方案中,受试者患有原发性异常β
‑
脂蛋白血症。在又一些其他的实施方案中,受试者患有低α
‑
脂蛋白血症。
[0553]
本发明进一步提供了用于降低受试者的血浆或血清中总胆固醇或ldl
‑
c浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有hofh。
[0554]
本发明进一步提供了用于降低受试者的血浆或血清中升高的总胆固醇、ldl
‑
c或apo b浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者是10
‑
17岁的男人或女人(例如初潮后女性)。在一些实施方案中,受试者患有hefh。在一些实施方案中,受试者的饮食不足以降低受试者升高的总胆固醇、ldl
‑
c或apo b。在一些实施方案中,受试者的生活方式或饮食和生活方式不足以降低受试者升高的总胆固醇、ldl
‑
c或apo b。
[0555]
本发明进一步提供了用于降低受试者死亡率、chd死亡、非致命性心肌梗塞、中风或需要血管重建手术的风险的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者正处于冠状动脉事件的高风险。
[0556]
本发明进一步提供了用于降低受试者的血浆或血清中升高的总胆固醇、ldl
‑
c、apo b或甘油三酯浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。本发明进一步提供了用于增加受试者的血浆或血清中高密度脂蛋白胆固醇的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有原发性高脂血症。在一些实施方案中,原发性高脂血症是hefh。在一些实施方案中,原发性高脂血症是非家族性高脂血症。在一些实施方案中,受试者患有混合性血脂异常。
[0557]
本发明进一步提供了用于降低受试者的血浆或血清中升高的甘油三酯浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙
盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有高甘油三酯血症。本发明进一步提供了用于降低受试者的血浆或血清中甘油三酯或极低密度脂蛋白胆固醇(vldl
‑
c)的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有原发性异常β
‑
脂蛋白血症。
[0558]
本发明进一步提供了用于降低受试者的血浆或血清中升高的总胆固醇或ldl
‑
c浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者是成人。在一些实施方案中,受试者患有hofh。
[0559]
本发明进一步提供了用于治疗或预防高甘油三酯血症的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,所述方法还包括调整受试者的饮食。在一些实施方案中,所述方法还包括使受试者处于低脂饮食。
[0560]
本发明进一步提供了用于治疗或预防原发性异常β
‑
脂蛋白血症的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,原发性异常β
‑
脂蛋白血症是iii型高脂蛋白血症。在一些实施方案中,所述方法还包括调整受试者的饮食。在一些实施方案中,所述方法还包括使受试者处于低脂饮食。
[0561]
本发明进一步提供了用于降低受试者的血浆或血清中总胆固醇、ldl
‑
c或apo b浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有hofh。
[0562]
本发明进一步提供了用于降低受试者的血浆或血清中升高的ldl
‑
c、总胆固醇、apo b或甘油三酯浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。本发明进一步提供了用于增加受试者的血浆或血清中高密度脂蛋白胆固醇浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者是成人。在一些实施方案中,受试者患有原发性高胆固醇血症。在一些实施方案中,受试者患有混合性血脂异常。
[0563]
本发明进一步提供了用于治疗或预防严重的高甘油三酯血症的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者是成人。
[0564]
本发明进一步提供了用于降低心肌梗塞或中风的比率或发病率的方法,包括对需要其的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有急性冠状动脉综合征(acs)。在一些实施方案中,受试者患有非st段升高型acs(不稳定的心绞痛(ua)/非st
‑
升高型心肌梗塞(nstemi))。在一些实施方案中,受试者患有st
‑
升高型心肌梗塞(stemi)。在心电图中,st段连接qrs复合波和t波。在一些实施方案中,受试者先前曾心肌梗塞、先前曾中风或具有确立的周边动脉疾病。在一些实施方案中,受试者患有近期心肌梗塞或近期中风。在一些实施方案中,近期心肌梗塞或近期中风发生在一年以内。在一些实施方案中,近期心肌梗塞或
近期中风发生在三个月以内。
[0565]
本发明进一步提供了用于降低受试者的血浆或血清中总胆固醇、ldl
‑
c或apo b浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有原发性高胆固醇血症。原发性高胆固醇血症可为杂合子家族性或非家族性。在一些实施方案中,所述方法还包括向受试者施用hmg
‑
coa还原酶抑制剂。
[0566]
本发明进一步提供了用于降低受试者的血浆或血清中总胆固醇或ldl
‑
c浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有hofh。在一些实施方案中,所述方法还包括向受试者施用额外的降脂治疗。在一些实施方案中,额外的降脂治疗是施用他汀类药物(例如阿托伐他汀或辛伐他汀)或ldl单采术。
[0567]
本发明进一步提供了用于降低受试者的血浆或血清中升高的谷甾醇或菜油固醇浓度的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有纯合子家族性谷甾醇血症。
[0568]
本发明进一步提供了用于治疗或预防iv型或v型高脂血症的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者具有胰腺炎的风险。在一些实施方案中,受试者饮食的改变未充分地降低受试者的血浆或血清甘油三酯浓度。在一些实施方案中,根据血清甘油三酯的atp iii分类(national institute of health publication no.01
‑
3305;2001年5月;cholesterol guidelines),正常的血清甘油三酯浓度是小于150mg/dl。在一些实施方案中,受试者具有异常高的高血清甘油三酯浓度。在一些实施方案中,受试者具有大于2000mg/dl的血清甘油三酯浓度和任选具有vldl
‑
胆固醇的升高或患有空腹乳糜微粒血症。在一些实施方案中,受试者具有1000至2000mg/dl的甘油三酯和任选具有胰腺炎病史或胰腺炎典型的复发性腹痛。
[0569]
本发明进一步提供了用于降低发展出冠状动脉心脏疾病的风险的方法,包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,受试者患有iib型高脂血症。在一些实施方案中,受试者没有现有冠状动脉心脏疾病的病史或现有冠状动脉心脏疾病的症状。在一些实施方案中,受试者已经进行减重、饮食疗法、锻炼或施用未有效治疗受试者的高脂血症的另一药理剂(例如胆汁酸螯合剂或烟酸)。在一些实施方案中,受试者于受试者的血浆或血清中具有异常低的hdl
‑
胆固醇浓度、异常高的ldl
‑
胆固醇浓度和异常高的甘油三酯浓度中的一种或多种。
[0570]
在一些实施方案中,本发明的治疗或预防方法还包括施用有效量的额外的药物活性剂。在一些实施方案中,本发明的治疗或预防方法还包括施用有效量的两种或更多种额外的药物活性剂。
[0571]
在一些实施方案中,额外的药物活性剂是他汀类药物。在一些实施方案中,他汀类药物是阿托伐他汀、辛伐他汀、普伐他汀、瑞舒伐他汀、氟伐他汀、洛伐他汀、匹伐他汀、美伐他汀、达伐他汀、二氢康帕汀或西利伐他汀或其药学上可接受的盐。在一些实施方案中,他
汀类药物是阿托伐他汀钙。
[0572]
在一些实施方案中,额外的药物活性剂是他汀类药物。在一些实施方案中,额外的药物活性剂是hmg
‑
coa(3
‑
羟基
‑3‑
甲基
‑
戊二酰基
‑
辅酶a)还原酶抑制剂。
[0573]
在一些实施方案中,额外的药物活性剂是脂质修饰剂、降脂剂、抗纤维蛋白溶解剂或抗炎剂。在一些实施方案中,额外的药物活性剂是降胆固醇剂。在其他实施方案中,额外的药物活性剂是胆固醇吸收抑制剂。在其他实施方案中,胆固醇吸收抑制剂是依泽替米贝。
[0574]
在一些实施方案中,额外的药物活性剂是pcsk9(前蛋白转化酶枯草杆菌蛋白酶/kexin 9型)抑制剂、维生素e、angptl3抑制剂、angptl4抑制剂、angptl8抑制剂、胆固醇吸收抑制剂、acc(乙酰辅酶a羧化酶)抑制剂、apoc
‑
iii(载脂蛋白c
‑
iii)抑制剂、apob(载脂蛋白b)合成抑制剂、acl(柠檬酸三磷酸腺苷裂解酶)抑制剂、微粒体转移蛋白抑制剂、非诺贝特酸、鱼油、贝特类药物、甲状腺激素β受体激动剂、类法尼醇x受体(fxr)、ccr2/ccr5(c
‑
c趋化因子受体类型2(ccr2)和5(ccr5))抑制剂或拮抗剂、半胱天冬酶蛋白酶抑制剂、ask
‑
1(细胞凋亡信号调节激酶1)抑制剂、半乳糖凝集素
‑
3蛋白、nox(烟酰胺腺嘌呤二核苷酸磷酸氧化酶)抑制剂、回肠胆汁酸转运体、ppar(过氧化物酶体增殖因子激活受体)激动剂、ppar双重激动剂、pan
‑
ppar激动剂、钠
‑
葡萄糖协同转运蛋白1或2(sglt1或sglt2)抑制剂、二肽基肽酶4(dpp4)抑制剂、脂肪酸合酶(fas)抑制剂、toll样受体拮抗剂、甲状腺激素受体
‑
β(thr
‑
β)激动剂、肝脏导向的选择性thr
‑
β激动剂、aco1调节剂、1
‑
骨髓过氧化酶抑制剂、1
‑
己酮糖激酶(1
‑
khk)抑制剂、氧化应激抑制剂、成纤维细胞生长因子21(fgf21)或19(fgf19)抑制剂、转化生长因子β
‑
1(tgf
‑
β1)激动剂、肝的脂质新生(dnl)抑制剂、烯酰基coa水合酶抑制剂、胆固醇7
‑
α羟化酶(cyp7a1)激动剂、3型胶原蛋白抑制剂或cetp(胆固醇酯转移蛋白)抑制剂。在其他实施方案中,额外的降血脂剂是pcsk9抑制剂。在一些实施方案中,额外的降血脂剂是贝佩多酸(bempedoic acid)、烟酸、吉非罗齐、烟酸、胆汁酸树脂、纤维酸衍生物或胆固醇吸收抑制剂。在一些实施方案中,额外的降血脂剂是贝佩多酸、烟酸或吉非罗齐。在一些实施方案中,降血脂剂是吉非罗齐。在一些实施方案中,一种或多种药物活性剂是贝佩多酸。
[0575]
鱼油的实例包括但不限于鲑鱼油、沙丁鱼油、鱼肝油、金枪鱼油、鲱鱼油(herring oil)、鲱鱼油(menhaden oil)、鲭鱼油、精制鱼油和其混合物。鱼油包含ω
‑
3脂肪酸:二十碳五烯酸和二十二碳六烯酸。在一些实施方案中,鱼油是处方鱼油。在一些实施方案中,二十碳五烯酸经富集或酯化,例如但不限于乙酯。在一些实施方案中,二十碳五烯酸经富集且酯化。
[0576]
在一些实施方案中,cetp抑制剂是达塞曲匹(dalcetrapib)(cas211513
‑
37
‑
0)、托彻普(torcetrapib)(cas 262352
‑
17
‑
0)、安塞曲匹(anacetrapib)(cas 875446
‑
37
‑
0)、伊伐塞曲匹(evacetrapib)(cas1186486
‑
62
‑
3)、bay 60
‑
5521(cas893409
‑
49
‑
9)、欧必塞曲匹(obicetrapib)(866399
‑
87
‑
3)、ath
‑
03(affris)、drl
‑
17822(dr.reddy's)、dlbs
‑
1449(dexa medica)、硫代丙酸s
‑
[2
‑
[l
‑
(2
‑
乙基丁基)环己基羰基氨基]苯基]
‑2‑
甲酯、l
‑
(2
‑
乙基
‑
丁基)
‑
环己烷甲酸(2
‑
巯苯基)
‑
酰胺或双[2
‑
[l
‑
(2
‑
乙基丁基)环己基羰基氨基]苯基]二硫化物或其药学上可接受的盐。
[0577]
在一些实施方案中,额外的药物活性剂是针对cetp的抗体。在一些实施方案中,针对cetp的抗体是单克隆抗体。在其他实施方案中,针对cetp的抗体是cetp的单克隆抗体
(mab、tp1)。
[0578]
在一些实施方案中,额外的药物活性剂是针对cetp的抗体。在一些实施方案中,额外的药物活性剂诱导针对cetp的抗体并且是疫苗。在一些实施方案中,疫苗是tt/cetp(rittershaus,c.w.等人,arteriosclerosis,thrombosis,and vascular biology.2000;20:2106
‑
2112)。在其他实施方案中,额外的药物活性剂诱导针对cetp的抗体并且是ceti
‑
1(celldex therapeutics)。
[0579]
在一些实施方案中,额外的药物活性剂用cetp或cetp蛋白片段使受试者免疫。
[0580]
在一些实施方案中,额外的药物活性剂通过用sirna抑制cetp mrna而减少cetp。
[0581]
在一些实施方案中,额外的药物活性剂通过施用dnai至cetp基因而靶向cept转录。在其他实施方案中,额外的药物活性剂通过施用在适当的递送媒介物中的dnai(例如smarticle
tm
)而靶向cept转录。
[0582]
在一些实施方案中,额外的药物活性剂是抗凝血剂或脂质调节剂。在一些实施方案中,抗凝血剂是阿司匹林、达比加群(dabigatran)、利伐沙班、阿派沙班(apixaban)、氯吡格雷(clopidogrel)、clopnpt(氯吡格雷与3
‑
硝基吡啶
‑2‑
硫醇的缀合物)、普拉格雷(prasugrel)、替格瑞洛(ticagrelor)、坎格雷拉(cangrelor)、血小板p2y12受体抑制剂、噻吩并吡啶、华法林(warfarin)(coumadin)、醋硝香豆醇(acenocoumarol)、苯丙香豆醇(phenprocoumon)、阿托门丁(atromentin)、苯茚二酮(phenindione)、依度沙班(edoxaban)、贝曲沙班(betrixaban)、利塔沙班(letaxaban)、艾瑞巴沙班(eribaxaban)、水蛭素(hirudin)、莱匹卢定(lepirudin)、比伐卢定(bivalirudin)、阿加曲班(argatroban)、达比加群(dabigatran)、希美加群(ximelagatran)、巴曲酶(batroxobin)、吻蛭素(hementin)、肝素(heparin)或维生素e。
[0583]
在一些实施方案中,额外的药物活性剂是辛图珠单抗(simtuzumab)(cas 1318075
‑
13
‑
6)、西隆塞提(selonsertib)(cas 1448428
‑
04
‑
3)、gs
‑
9674(gilead sciences)、gs
‑
0976(gliead sciences)、奥贝胆酸(obeticholic acid)(cas 459789
‑
99
‑
2;intercept)或森韦诺克(cenicriviroc)(cas 497223
‑
25
‑
3;allergan
‑
takeda)或其药学上可接受的盐。在一些实施方案中,额外的药物活性剂是但不限于伊拉菲诺(elafibranor)(genfit)、希拉狄帕(seladelpar)(cymabay)或edp
‑
305(enanta pharmaceuticals)。
[0584]
在一些实施方案中,额外的药物活性剂是抗炎剂、抗高血压剂、抗糖尿病剂、抗肥胖剂、抗纤维化剂或抗凝血剂。在一些实施方案中,本文公开的额外的药物活性剂可为其药学上可接受的盐。药学上可接受的盐可为酸加成盐,其中药物活性剂是碱性,例如包括碱性氮原子,并且可为阳离子盐。药学上可接受的盐可为碱加成盐,其中药物活性剂是酸性。
[0585]
在一些实施方案中,本发明的治疗或预防方法不引起肝毒性或肌骨骼病症。
[0586]
在一些实施方案中,被施用本发明化合物或本发明组合物或本发明片剂的受试者正进行他汀类药物疗法。在一些实施方案中,他汀类药物是阿托伐他汀、辛伐他汀、普伐他汀、瑞舒伐他汀、氟伐他汀、洛伐他汀、匹伐他汀、美伐他汀、达伐他汀、二氢康帕汀或西利伐他汀或其药学上可接受的盐。在一些实施方案中,他汀类药物是阿托伐他汀钙。
[0587]
在一些实施方案中,本发明的治疗或预防方法包括向有需要的受试者施用有效量的本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6。在一些实施方案中,如本文所公开的治疗或预防方法中任一者可包括向有需要的受试
者施用含有本发明片剂、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6的胶囊。在一些实施方案中,所述胶囊还含有另一种本文所述的额外药物活性剂。在一些实施方案中,所述胶囊还含有他汀类药物或其药学上可接受的盐。
[0588]
本发明组合物
[0589]
本发明组合物的实例包括本发明片剂和含有本发明片剂的胶囊。在一些实施方案中,本发明组合物包含(i)有效量的本发明化合物和(ii)药学上可接受的载体或媒介物。
[0590]
在一些实施方案中,本发明组合物包含有效量的(i)吉卡宾钙盐水合物晶型2、吉卡宾钙盐水合物晶型c3、吉卡宾钙盐乙醇溶剂化物、无定形的吉卡宾钙盐、吉卡宾钙盐水合物晶型4、吉卡宾钙盐水合物晶型5或吉卡宾钙盐水合物晶型6,和(ii)药学上可接受的载体或媒介物。
[0591]
在一些实施方案中,本发明组合物还包含有效量的例如本文所公开的额外的药物活性剂。在其他实施方案中,本发明组合物还包含有效量的如本文所公开的两种或更多种额外的药物活性剂。
[0592]
在一些实施方案中,药上可接受的载体或媒介物包括但不限于粘合剂、填充剂、稀释剂、崩解剂、润湿剂、润滑剂、助流剂、着色剂、染料转移抑制剂、甜味剂或调味剂。
[0593]
粘合剂或造粒剂赋予片剂内聚性以确保片剂在压缩后保持完整。适合的粘合剂或造粒剂包括但不限于淀粉,例如玉米淀粉、马铃薯淀粉和预糊化淀粉(例如starch 1500);明胶;糖类,例如蔗糖、葡萄糖、右旋糖、糖蜜和乳糖;天然与合成树胶,例如阿拉伯胶、藻酸、藻酸盐、角叉菜提取物、潘瓦尔胶(panwar gum)、甘地胶(ghatti gum)、车前子壳(isabgol husk)粘胶、羧甲基纤维素、甲基纤维素、聚乙烯基吡咯烷酮(pvp)、硅酸镁铝(veegum)、落叶松阿拉伯半乳聚糖、粉状黄蓍胶和瓜尔胶(guar gum);纤维素,例如乙基纤维素、乙酸纤维素、羧甲基纤维素钙、羧甲基纤维素钠、甲基纤维素、羟乙基纤维素(hec)、羟丙基纤维素(hpc)、羟丙基甲基纤维素(hpmc);微晶纤维素,例如avicel
‑
ph
‑
101、avicel
‑
ph
‑
103、avicel rc
‑
581、avicel
‑
ph
‑
105(fmc corp.,marcus hook,pa);和其混合物。在一些实施方案中,粘合剂或造粒剂是淀粉、明胶、糖、天然或合成树胶、纤维素或其混合物。在一些实施方案中,纤维素是微晶纤维素、乙基纤维素、乙酸纤维素、羧甲基纤维素钙、羧甲基纤维素钠、甲基纤维素、羟乙基纤维素(hec)、羟丙基纤维素(hpc)或羟丙基甲基纤维素(hpmc)。在一些实施方案中,粘合剂或造粒剂是羟丙基纤维素。在一些实施方案中,粘合剂是羟丙基纤维素。
[0594]
适合的填充剂包括但不限于滑石、碳酸钙、微晶纤维素、粉状纤维素、葡萄糖结合剂(dextrates)、高岭土、甘露糖醇、硅酸、山梨糖醇、淀粉、预糊化淀粉和其混合物。
[0595]
粘合剂或填充剂可以本文所提供的本发明组合物重量计约2%至约49%或在任何这些值内的任何范围存在。在一些实施方案中,粘合剂或填充剂按以重量计约5%至约15%存在于本发明组合物中。在一些实施方案中,粘合剂或填充剂按以重量计约5%、6%、7%、8%、9%、8%、10%、11%、12%、13%、14%、或15%或在任何这些值内的任何范围存在于本发明组合物中。
[0596]
适合的稀释剂包括但不限于磷酸二钙、硫酸钙、乳糖、山梨糖醇、蔗糖、肌醇、纤维素、高岭土、甘露糖醇、氯化钠、干淀粉和糖粉。特定的稀释剂(例如甘露糖醇、乳糖、山梨糖醇、蔗糖和肌醇)当以足量存在时可赋予一些压缩片剂通过咀嚼而在口中崩解的性质。这些
压缩片剂可用作咀嚼片剂。在一些实施方案中,稀释剂是乳糖单水合物。在另一个实施方案中,稀释剂是乳糖单水合物fast
‑
flo 316nf。
[0597]
在一些实施方案中,稀释剂是甘露糖醇、乳糖、山梨糖醇、蔗糖或肌醇。在一些实施方案中,稀释剂是乳糖单水合物。
[0598]
本发明组合物可包含以组合物重量计约5%至约49%或在任何这些值之间的任何范围的稀释剂。在一些实施方案中,稀释剂按以重量计约15%至约30%存在于本发明组合物中。在一些实施方案中,稀释剂按以重量计约15%、16%、17%、18%、19%、18%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、或30%或在任何这些值内的任何范围存在于本发明组合物中。
[0599]
适合的崩解剂包括但不限于琼脂;膨润土;纤维素,例如甲基纤维素和羧甲基纤维素;木质产品;天然海绵;阳离子交换树脂;藻酸;树胶,例如瓜尔胶和硅酸镁铝hv(veegum hv);柑橘果肉;交联纤维素,例如交联羧甲基纤维素(croscarmellose);交联聚合物,例如交联聚维酮(crospovidone);交联淀粉;碳酸钙;微晶纤维素,例如淀粉乙醇酸钠;波拉克林钾;淀粉,例如玉米淀粉、马铃薯淀粉、木薯淀粉和预糊化淀粉;粘土;海藻胶;和其混合物。在本发明组合物中的崩解剂量可改变。在一些实施方案中,崩解剂是交联羧甲基纤维素钠。在一些实施方案中,崩解剂是交联羧甲基纤维素钠nf(ac
‑
di
‑
sol)。
[0600]
在一些实施方案中,崩解剂是琼脂、膨润土、木质产品、天然海绵、阳离子交换树脂、藻酸、树胶、柑橘果肉、纤维素、交联纤维素、交联聚合物、交联淀粉、微晶纤维素、波拉克林钾、淀粉、粘土、海藻胶或其混合物。在一些实施方案中,崩解剂是交联羧甲基纤维素。
[0601]
本发明组合物可包含以重量计约0.5%至约15%、或约1%至约10%的崩解剂。在一些实施方案中,本发明组合物包含以组合物重量计约5%、6%、7%、8%、9%、8%、10%、11%、12%、13%、14%、或15重量%或在任何这些值内的任何范围的崩解剂量。
[0602]
适合的润滑剂包括但不限于硬脂酸钙;硬脂酸镁;矿物油;轻矿物油;甘油;山梨糖醇;甘露糖醇;二醇类,例如甘油山嵛酸酯和聚乙二醇(peg);硬脂酸;十二烷基硫酸钠;滑石;氢化植物油,包括花生油、棉籽油、葵花籽油、芝麻油、橄榄油、玉米油和大豆油;硬脂酸锌;油酸乙酯;月桂酸乙酯;琼脂;淀粉;石松子;二氧化硅或硅胶,例如(evonik)和(cabot co.of boston,ma);和其混合物。在一些实施方案中,润滑剂是硬脂酸镁。
[0603]
在一些实施方案中,润滑剂是硬脂酸钙、硬脂酸镁、矿物油、轻矿物油、甘油、山梨糖醇、甘露糖醇、二醇、硬脂酸、月桂基硫酸钠、滑石、氢化植物油、硬脂酸锌、油酸乙酯、月桂酸乙酯、琼脂、淀粉、石松子、二氧化硅、硅胶或其混合物。在一些实施方案中,润滑剂是硬脂酸镁。
[0604]
本发明组合物可包含以重量计约0.1至约5%的润滑剂。在一些实施方案中,本发明组合物包含以组合物重量计约0.5%、0.6%、0.7%、0.8%、0.9%、0.8%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、或3.0%或在任何这些值内的任何范围的润滑剂。
[0605]
适合的助流剂包括胶态二氧化硅、(cabot co.of boston,ma)和
滑石,包括无石棉滑石。
[0606]
着色剂包括任何经核准证实的水溶性fd&c染料和悬浮于氧化铝水合物上的水不溶性fd&c染料,以及色淀和其混合物。
[0607]
调味剂包括从植物(例如果实)提取的天然香料,以及提供愉快的味觉的化合物的合成混合物,例如薄荷和水杨酸甲酯。
[0608]
甜味剂包括蔗糖、乳糖、甘露糖醇、糖浆、甘油、三氯蔗糖和人工甜味剂,例如糖精和阿斯巴甜(aspartame)。
[0609]
适合的乳化剂包括明胶、阿拉伯胶、黄蓍胶、膨润土和表面活性剂,例如聚氧乙烯山梨糖醇酐单油酸酯聚氧乙烯山梨糖醇酐单油酸酯80和三乙醇胺油酸酯。悬浮剂和分散剂包括羧基甲基纤维素钠、果胶、黄蓍胶、硅酸镁铝、阿拉伯胶、羧甲基纤维素钠、羟丙基甲基纤维素和聚乙烯基吡咯烷酮。防腐剂包括甘油、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯、苯甲酸、苯甲酸钠和醇。润湿剂包括丙二醇单硬脂酸酯、山梨糖醇酐单油酸酯、二甘醇单月桂酸酯和聚氧乙烯月桂醚。
[0610]
适合的溶剂包括甘油、山梨糖醇、乙醇和糖浆。
[0611]
在乳剂中使用的非水性液体的实例包括矿物油和棉籽油。有机酸包括柠檬酸和酒石酸。二氧化碳的来源包括碳酸氢钠和碳酸钠。
[0612]
应当理解,许多载体和赋形剂可提供多种功能,甚至在相同的制剂中。
[0613]
本发明化合物和本发明组合物可被配制为用于通过各种方式施用,包括以含有药学上可接受的载体、佐剂和媒介物的制剂口服、肠胃外、吸入喷雾、局部或直肠施用。如本文所用,术语“肠胃外”包括以各种输注技术经皮下、静脉内、肌内和动脉内注射。如本文所用,动脉内和静脉内注射包括通过导管施用。
[0614]
本发明化合物和本发明组合物可依照适合于期望施用途径的常规程序调配。因此,本发明组合物可呈如混悬剂、溶液或在油性或水性媒介物中的乳剂的形式,并且可含有配制剂,例如悬浮、稳定和/或分散剂。本发明化合物和本发明组合物可配制成适合于植入或注射的制剂。因此,例如吉卡宾的药学上可接受的盐和本发明组合物可以用适合的聚合性或疏水性材料(例如配制成在可接受的油中的乳剂)或离子交换树脂配制或配制成微溶性衍生物(例如配制成微溶性盐)。本发明化合物和本发明组合物可呈在使用前以适合的媒介物(例如无菌的无热源水)重构的粉末形式。适合于这些施用方法中的每一者的制剂可见于例如remington:the science and practice of pharmacy,a.gennaro,ed.,第20版,lippincott,williams&wilkins,philadelphia,pa中。
[0615]
在一些实施方案中,本发明组合物适合于口服施用。这些组合物可包含适合于口服施用的固体、半固体、凝胶基质或液体剂型。如本文所用,口服施用包括颊内、舌和舌下施用。适合的口服剂型包括而不限于片剂、胶囊、丸剂、锭剂、菱形锭、糖锭剂、扁囊剂、丸剂、含药咀嚼胶、颗粒剂、散装粉末、泡腾或非泡腾粉末或颗粒、溶液、乳剂、混悬剂、溶液、膜片剂(wafer)、散剂(sprinkle)、酏剂、糖浆剂或其任何组合。在一些实施方案中,适合于口服施用的本发明组合物呈片剂或胶囊形式。在一些实施方案中,本发明组合物呈片剂形式。在一些实施方案中,本发明组合物呈胶囊形式。在一些实施方案中,本发明化合物包含在胶囊内。
[0616]
在一些实施方案中,胶囊是立即释放胶囊。胶囊的非限制性实例是硬明胶胶囊。
[0617]
本发明组合物可呈压缩片剂、研制锭剂、可咀嚼的菱形锭、快速溶解片剂、多重压缩片剂或肠溶包衣片剂、糖衣或薄膜包衣片剂。肠溶包衣片剂是用抵抗胃酸作用但在肠中溶出或崩解,因此保护活性成分免于胃的酸性环境的物质包覆的压缩片剂。肠溶包衣包括但不限于脂肪酸、脂肪、水杨酸苯酯、蜡、虫胶、氨化虫胶(ammoniated shellac)和邻苯二甲酸乙酸纤维素。糖衣片剂是以糖衣包围的压缩片剂,所述糖衣对于掩盖另人不愉快的味道或气味和保护片剂免于氧化是有益的。薄膜包衣片剂是以水溶性材料的薄层或膜覆盖的压缩片剂。薄膜包衣包括但不限于羟乙基纤维素、羧甲基纤维素钠、聚乙二醇4000和邻苯二甲酸乙酸纤维素。薄膜包衣可赋予与糖包衣相同的一般特征。多重压缩片剂是通过一次以上的压缩循环制造的压缩片剂,包括分层片剂和压制包衣片剂或干式包衣片剂。
[0618]
在一些实施方案中,压缩片剂是未包衣的。
[0619]
在一些实施方案中,压缩片剂包含外包衣。在一些实施方案中,压缩片剂包含单层外包衣。在一些实施方案中,外包衣包含羟丙基甲基纤维素(羟丙甲纤维素,hpmc)。在一些实施方案中,外包衣还包含聚乙二醇、二氧化钛或滑石。在一些实施方案中,外包衣包含羟丙甲纤维素、聚乙二醇、二氧化钛或滑石。在一些实施方案中,外包衣包含羟丙甲纤维素、聚乙二醇、二氧化钛和滑石。
[0620]
在一些实施方案中,包衣是薄膜包衣。在一些实施方案中,薄膜包衣包含在一些实施方案中,薄膜包衣包含white和二甲基硅油乳剂30%usp。
[0621]
在一些实施方案中,本发明化合物包含在片剂内。在一些实施方案中,本发明化合物包含在压缩片剂内。在一些实施方案中,本发明化合物包含在薄膜包衣的压缩片剂内。在一些实施方案中,本发明组合物呈薄膜包衣的压缩片剂形式。
[0622]
在一些实施方案中,本发明组合物通过本发明化合物与一种或多种药学上可接受的载体、媒介物或赋形剂的流化床造粒法而制得。在一些实施方案中,以流化床造粒法所制得的本发明组合物可提供具有良好的流动性、良好的压缩性、快速溶出、良好的稳定性和/或最小的破裂至无破裂的片剂制剂。在一些实施方案中,流化床造粒法允许制备具有高载药量的制剂,例如70%以上或75%以上的本发明化合物。
[0623]
本发明组合物可呈软或硬胶囊形式,这些胶囊可由明胶、甲基纤维素、淀粉或藻酸钙制成。也称为干式填充胶囊(dfc)的硬明胶胶囊包括一节套于另一节上的两节,因此完全封入活性成分。软弹性胶囊(sec)是软的球形壳,例如明胶壳,其通过添加甘油、山梨糖醇或类似的多元醇而塑化。软明胶壳可含有防腐剂以防止微生物生长。适合的防腐剂如本文所描述的那些,包括对羟基苯甲酸甲酯和对羟基苯甲酸丙酯和山梨酸。本文所提供的液体、半固体和固体剂型可包封于胶囊中。适合的液体和半固体剂型包括在碳酸丙烯酯、植物油或甘油三酯中的溶液和混悬剂。含有这些溶液的胶囊可如美国专利no.4,328,245、4,409,239和4,410,545中所述制备。胶囊可如那些本领域技术人员已知的方式进行薄膜包衣以改良或维持活性成分的溶出。
[0624]
本发明组合物可呈液体或半固体剂型,包括乳剂、溶液、混悬剂、酏剂和糖浆剂。乳剂可为两相系统系统,其中一种液体是以小球形式分散于整体的另一种液体中,其可为水
包油型或油包水型。乳剂可包括药学上可接受的非水性液体或溶剂、乳化剂和防腐剂。混悬剂可包括药学上可接受的悬浮剂和防腐剂。水性醇溶液可包括医药学上可接受的缩醛,例如低级烷基醛的二(低级烷基)缩醛(术语“低级”意指具有介于1至6个碳原子之间的烷基),例如乙醛二乙缩醛;和具有一或多个羟基的水可混溶性溶剂,例如丙二醇和乙醇。酏剂可为透明、增甜和水醇的溶液。糖浆剂可为糖(例如蔗糖)的浓缩水溶液并且可包含防腐剂。对于液体剂型,例如聚乙二醇中的溶液可以用足够量的药学上可接受的液体载体(例如水)稀释以方便地测量用于施用。
[0625]
用于口服施用的本发明组合物也可呈脂质体、胶束、微球体或纳米系统的形式提供。胶束剂型可如美国专利no.6,350,458所述制备。
[0626]
本发明组合物可以经重构成液体剂型的非泡腾或泡腾颗粒和粉末提供。在非泡腾颗粒或粉末中所使用的药学上可接受的载体和赋形剂可包括稀释剂、甜味剂和润湿剂。在泡腾颗粒或粉末中所使用的药学上可接受的载体和赋形剂可包括有机酸和二氧化碳来源。
[0627]
着色剂和调味剂可用于所有的上述剂型。而且,调味剂和甜味剂尤其有用于可咀嚼的片剂和菱形锭的形成。
[0628]
本发明组合物可配制成立即或修饰释放剂型,包括延迟、延长、脉冲、控制、靶向和程序释放形式。
[0629]
在一些实施方案中,本发明组合物包含薄膜包衣。
[0630]
本发明组合物可包含不赋予组合物治疗或预防功效的另一活性成分或可包含扩大或补充组合物功效的物质。
[0631]
片剂剂型可包含呈粉状、结晶或颗粒形式的吉卡宾的药学上可接受的盐,并且还可包含本文所公开的载体或媒介物,包括粘合剂、崩解剂、控制释放聚合物、润滑剂、稀释剂或着色剂。
[0632]
在一些实施方案中,本发明组合物(包括本发明片剂)包含约50mg至约900mg、约150mg至约600mg、或约150mg至约300mg的本发明化合物。在一些实施方案中,本发明组合物(包括本发明片剂)包含本发明化合物,其量为约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg、约600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、约700mg、约710mg、约720mg、约730mg、约740mg、约750mg、约760mg、约770mg、约780mg、约790mg、约800mg、约810mg、约820mg、约830mg、约840mg、约850mg、约860mg、约870mg、约880mg、约890mg、约900mg、或起止于这些值中任一者的范围内的量。在一些实施方案中,本发明组合物包含约50mg的本发明化合物。在一些实施方案中,本发明组合物包含约150mg的本发明化合物。在一些实施方案中,本发明组合物包含约300mg的本发明化合物。在一些实施方案中,本发明组合物包含约600mg的本发明化合物。
[0633]
在一些实施方案中,本发明片剂包含相当于约50mg吉卡宾的摩尔当量的吉卡宾钙
盐。在一些实施方案中,本发明片剂包含相当于约150mg吉卡宾的摩尔当量的吉卡宾钙盐。在一些实施方案中,本发明片剂包含相当于约300mg吉卡宾的摩尔当量的吉卡宾钙盐。在一些实施方案中,本发明片剂包含相当于约600mg吉卡宾的摩尔当量的吉卡宾钙盐。
[0634]
在一些实施方案中,本发明组合物(包括本发明片剂)包含本发明化合物,其量为相当于50mg至约900mg、约150mg至约600mg、或约150mg至约300mg吉卡宾的摩尔当量。在一些实施方案中,本发明组合物包含本发明化合物,其量为相当于约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg、约600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、约700mg、约710mg、约720mg、约730mg、约740mg、约750mg、约760mg、约770mg、约780mg、约790mg、约800mg、约810mg、约820mg、约830mg、约840mg、约850mg、约860mg、约870mg、约880mg、约890mg、或约900mg吉卡宾的摩尔当量或起止于这些值中任一者的范围内的量。在一些实施方案中,本发明组合物包含吉卡宾的药学上可接受的盐,其量为相当于约50mg吉卡宾的摩尔当量。在一些实施方案中,本发明组合物包含本发明化合物,其量为相当于约150mg吉卡宾的摩尔当量。在一些实施方案中,本发明组合物包含本发明化合物,其量为相当于约300mg吉卡宾的摩尔当量。在一些实施方案中,本发明组合物包含本发明化合物,其量为相当于约600mg吉卡宾的摩尔当量。
[0635]
在其他实施方案中,本发明组合物包含本发明化合物,其量为约50mg、约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg、约300mg、约325mg、约350mg、约375mg、约400mg、约425mg、约450mg、约475mg、约500mg、约525mg、约550mg、约575mg、约600mg、约625mg、约650mg、约675mg、约700mg、约725mg、约750mg、约775mg、约800mg、约825mg、约850mg、约875mg、约900mg、或起止于这些值的范围内的任何量。在一些实施方案中,本发明化合物是吉卡宾钙盐水合物晶型2。在其他实施方案中,本发明化合物是吉卡宾钙盐水合物晶型c3。在一些实施方案中,本发明化合物是吉卡宾钙盐水合物晶型4。在一些实施方案中,本发明化合物是吉卡宾钙盐水合物晶型5。在一些实施方案中,本发明化合物是吉卡宾钙盐水合物晶型6。
[0636]
在其他实施方案中,本发明组合物(包括本发明片剂)包含本发明化合物,其量为相当于约50mg、约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg、约300mg、约325mg、约350mg、约375mg、约400mg、约425mg、约450mg、约475mg、约500mg、约525mg、约550mg、约575mg、约600mg、约625mg、约650mg、约675mg、约700mg、约725mg、约750mg、约775mg、约800mg、约825mg、约850mg、约875mg、或约900mg吉卡宾的摩尔当量、或起止于这些值的范围内的任何量。在一些实施方案中,本发明化合物是吉卡宾钙盐水合物晶型2。在其他实施方案中,本发明化合物是吉卡宾钙盐水合物晶型c3。
[0637]
在一些实施方案中,本发明组合物呈片剂或胶囊形式。在一些实施方案中,本发明组合物包含具有45μm至约75μm的范围内的psd90的本发明化合物且呈片剂或胶囊形式。在
一些实施方案中,本发明组合物包含具有50μm至约75μm的范围内的psd90的本发明化合物且呈片剂或胶囊形式。
[0638]
在一个方面中,片剂包含或胶囊含有约50mg的具有40μm至约75μm的范围内的psd90的本发明化合物。在一个方面中,片剂包含或胶囊含有约50mg的具有45μm至约75μm的范围内的psd90的本发明化合物。在一个方面中,片剂包含或胶囊含有约50mg的具有50μm至约75μm的范围内的psd90的本发明化合物。
[0639]
在一些实施方案中,片剂包含或胶囊含有具有40μm至约75μm的范围内的psd90的本发明化合物,所述化合物的量为相当于约50mg吉卡宾的摩尔当量。在一些实施方案中,片剂包含或胶囊含有具有45μm至约75μm的范围内的psd90的本发明化合物,所述化合物的量为相当于约50mg吉卡宾的摩尔当量。在一些实施方案中,片剂包含或胶囊含有具有50μm至约75μm的范围内的psd90的本发明化合物,所述化合物的量为相当于约50mg吉卡宾的摩尔当量。
[0640]
在一个方面中,片剂包含或胶囊含有约150mg的具有40μm至约75μm的范围内的psd90的本发明化合物。在一个方面中,片剂包含或胶囊含有约150mg的具有45μm至约75μm的范围内的psd90的本发明化合物。在一个方面中,片剂包含或胶囊含有约150mg的具有50μm至约75μm的范围内的psd90的本发明化合物。
[0641]
在一些实施方案中,片剂包含或胶囊含有具有40μm至约75μm的范围内的psd90的本发明化合物,所述化合物的量为相当于约150mg吉卡宾的摩尔当量。在一些实施方案中,片剂包含或胶囊含有具有45μm至约75μm的范围内的psd90的本发明化合物,所述化合物的量为相当于约150mg吉卡宾的摩尔当量。在一些实施方案中,片剂包含或胶囊含有具有50μm至约75μm的范围内的psd90的本发明化合物,所述化合物的量为相当于约150mg吉卡宾的摩尔当量。
[0642]
在一些实施方案中,片剂包含或胶囊含有约300mg的具有40μm至约75μm的范围内的psd90的本发明化合物。在一些实施方案中,片剂包含或胶囊含有约300mg的具有45μm至约75μm的范围内的psd90的本发明化合物。在一些实施方案中,片剂包含或胶囊含有约300mg的具有50μm至约75μm的范围内的psd90的本发明化合物。
[0643]
在一些实施方案中,片剂包含或胶囊含有具有40μm至约75μm的范围内的psd90的本发明化合物,所述化合物的量为相当于约300mg吉卡宾的摩尔当量。在一些实施方案中,片剂包含或胶囊含有具有45μm至约75μm的范围内的psd90的本发明化合物,所述化合物的量为相当于约300mg吉卡宾的摩尔当量。在一些实施方案中,片剂包含或胶囊含有具有50μm至约75μm的范围内的psd90的本发明化合物,所述化合物的量为相当于约300mg吉卡宾的摩尔当量。
[0644]
在一些实施方案中,片剂包含或胶囊含有约600mg的具有40μm至约75μm的范围内的psd90的本发明化合物。在一些实施方案中,片剂包含或胶囊含有约600mg的具有45μm至约75μm的范围内的psd90的本发明化合物。在一些实施方案中,片剂包含或胶囊含有约600mg的具有50μm至约75μm的范围内的psd90的本发明化合物。
[0645]
在一些实施方案中,片剂包含或胶囊含有具有40μm至约75μm的范围内的psd90的本发明化合物,所述化合物的量为相当于约600mg吉卡宾的摩尔当量。在一些实施方案中,片剂包含或胶囊含有具有45μm至约75μm的范围内的psd90的本发明化合物,所述化合物的
量为相当于约600mg吉卡宾的摩尔当量。在一些实施方案中,片剂包含或胶囊含有具有50μm至约75μm的范围内的psd90的本发明化合物,所述化合物的量为相当于约600mg吉卡宾的摩尔当量。
[0646]
在一些实施方案中,本发明组合物包含具有40μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1且呈片剂或胶囊形式。在一些实施方案中,本发明组合物包含具有45μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1且呈片剂或胶囊形式。在一些实施方案中,本发明组合物包含具有50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1且呈片剂或胶囊形式。
[0647]
在一些实施方案中,片剂或胶囊包含约150mg具有40μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1。在一些实施方案中,片剂或胶囊包含约150mg具有45μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1。在一些实施方案中,片剂或胶囊包含约150mg具有50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1。在一些实施方案中,片剂或胶囊包含具有40μm至约75μm、45μm至约75μm、或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1,其量为相当于约150mg吉卡宾的摩尔当量。
[0648]
在一些实施方案中,片剂或胶囊包含约300mg具有40μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1。在一些实施方案中,片剂或胶囊包含约300mg具有45μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1。在一些实施方案中,片剂或胶囊包含约300mg具有50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1。在一些实施方案中,片剂或胶囊包含具有40μm至约75μm、45μm至约75μm、或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1,其量为相当于约300mg吉卡宾的摩尔当量。
[0649]
在一些实施方案中,片剂或胶囊包含约600mg具有40μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1。在一些实施方案中,片剂或胶囊包含约600mg具有45μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1。在一些实施方案中,片剂或胶囊包含约600mg具有50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1。在一些实施方案中,片剂或胶囊包含具有40μm至约75μm、45μm至约75μm、或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1,其量为相当于约600mg吉卡宾的摩尔当量。
[0650]
在其他实施方案中,片剂或胶囊包含约900mg具有40μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1。在其他实施方案中,片剂或胶囊包含约900mg具有45μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1。在其他实施方案中,片剂或胶囊包含约900mg具有50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1。在一些实施方案中,片剂或胶囊包含具有40μm至约75μm、45μm至约75μm、或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型1,其量为相当于约900mg吉卡宾的摩尔当量。
[0651]
在一些实施方案中,本发明组合物包含具有40μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型2且呈片剂或胶囊形式。在一些实施方案中,本发明组合物包含具有45μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型2且呈片剂或胶囊形式。在一些实施方案中,本发明组合物包含具有50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型2且呈片剂或胶囊形式。
[0652]
在一些实施方案中,片剂包含或胶囊含有约150mg具有40μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型2。在一些实施方案中,片剂包含或胶囊含有约150mg具有45
μm至约75μm或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型2。在一些实施方案中,片剂包含或胶囊含有具有40μm至约75μm、45μm至约75μm、或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型2,其量为相当于约150mg吉卡宾的摩尔当量。
[0653]
在一些实施方案中,片剂包含或胶囊含有约300mg具有40μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型2。在一些实施方案中,片剂包含或胶囊含有约300mg具有45μm至约75μm或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型2。在一些实施方案中,片剂包含或胶囊含有具有40μm至约75μm、45μm至约75μm、或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型2,其量为相当于约300mg吉卡宾的摩尔当量。
[0654]
在一些实施方案中,片剂包含或胶囊含有约600mg具有40μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型2。在一些实施方案中,片剂包含或胶囊含有约600mg具有45μm至约75μm或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型2。在一些实施方案中,片剂包含或胶囊含有具有40μm至约75μm、45μm至约75μm、或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型2,其量为相当于约600mg吉卡宾的摩尔当量。
[0655]
在一些实施方案中,片剂包含或胶囊含有约900mg具有40μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型2。
[0656]
在一些实施方案中,片剂包含或胶囊含有约900mg具有45μm至约75μm或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型2。在一些实施方案中,片剂或胶囊含有具有40μm至约75μm、45μm至约75μm、或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型2,其量为相当于约900mg吉卡宾的摩尔当量。
[0657]
在一些实施方案中,本发明组合物包含具有40μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型c3且呈片剂或胶囊形式。在一些实施方案中,本发明组合物包含具有45μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型c3且呈片剂或胶囊形式。在一些实施方案中,本发明组合物包含具有50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型c3且呈片剂或胶囊形式。
[0658]
在一些实施方案中,片剂包含或胶囊含有约150mg具有40μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型c3。在一些实施方案中,片剂包含或胶囊含有约150mg具有45μm至约75μm或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型c3。在一些实施方案中,片剂包含或胶囊含有具有40μm至约75μm、45μm至约75μm、或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型c3,其量为相当于约150mg吉卡宾的摩尔当量。
[0659]
在一些实施方案中,片剂包含或胶囊含有约300mg具有40μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型c3。在一些实施方案中,片剂包含或胶囊含有约300mg具有45μm至约75μm或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型c3。在一些实施方案中,片剂包含或胶囊含有具有40μm至约75μm、45μm至约75μm、或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型c3,其量为相当于约300mg吉卡宾的摩尔当量。
[0660]
在一些实施方案中,片剂包含或胶囊含有约600mg具有40μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型c3。在一些实施方案中,片剂包含或胶囊含有约600mg具有45μm至约75μm或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型c3。在一些实施方案中,片剂包含或胶囊含有具有40μm至约75μm、45μm至约75μm、或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型c3,其量为相当于约600mg吉卡宾的摩尔当量。
[0661]
在一些实施方案中,片剂包含或胶囊含有约900mg具有40μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型c3。在一些实施方案中,片剂包含或胶囊含有约900mg具有45μm至约75μm或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型c3。在一些实施方案中,片剂包含或胶囊含有具有40μm至约75μm、45μm至约75μm、或50μm至约75μm的范围内的psd90的吉卡宾钙盐水合物晶型c3,其量为相当于约900mg吉卡宾的摩尔当量。
[0662]
在一些实施方案中,本发明组合物(包括本发明片剂)包含本发明化合物,其量为以药物组合物总重量计约38.5wt%至约99.9wt%、约79wt%至约98wt%、约65%至约98wt%、或约50wt%至约70wt%。在一些实施方案中,本发明组合物包含本发明化合物,其量为以组合物重量计约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%、约71%、约72%、约73%、约74%、约75%、约76%、约77%、约78%、约79%、约80%、约81%、约82%、约83%、约84%、约85%、约86%、约87%、约88%、约89%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%、约99.5%、或约99.9%,或起止于这些值中任一者的范围内的量。
[0663]
在一些实施方案中,本发明组合物包含吉卡宾钙盐水合物晶型2,其量为以药物组合物总重量计约38.5wt%至约99.9wt%、约79wt%至约98wt%、约65%至约98wt%、或约50wt%至约70wt%。在一些实施方案中,本发明组合物包含吉卡宾钙盐水合物晶型c3,其量为以药物组合物总重量计约38.5wt%至约99.9wt%、约79wt%至约98wt%、约65%至约98wt%、或约50wt%至约70wt%。
[0664]
在一些实施方案中,本发明组合物(包括本发明片剂)还包含另外的药物活性剂。在一些实施方案中,本发明组合物还包含约0.1mg至约100mg、约5mg至约80mg、约10mg至约60mg、或约10mg至约40mg他汀类药物或其药学上可接受的盐。在其他实施方案中,本发明组合物包含他汀类药物或其药学上可接受的盐,其量为约0.1mg、约0.2mg、约0.3mg、约0.4mg、约0.5mg、约0.6mg、约0.7mg、约0.8mg、约0.9mg、约1mg、约2mg、约3mg、约4mg、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg、约20mg、21mg、约22mg、约23mg、约24mg、约25mg、约26mg、约27mg、约28mg、约29mg、约30mg、31mg、约32mg、约33mg、约34mg、约35mg、约36mg、约37mg、约38mg、约39mg、约40mg、41mg、约42mg、约43mg、约44mg、约45mg、约46mg、约47mg、约48mg、约49mg、约50mg、51mg、约52mg、约53mg、约54mg、约55mg、约56mg、约57mg、约58mg、约59mg、约60mg、61mg、约62mg、约63mg、约64mg、约65mg、约66mg、约67mg、约68mg、约69mg、约70mg、71mg、约72mg、约73mg、约74mg、约75mg、约76mg、约77mg、约78mg、约79mg、约80mg、81mg、约82mg、约83mg、约84mg、约85mg、约86mg、约87mg、约88mg、约89mg、约90mg、91mg、约92mg、约93mg、约94mg、约95mg、约96mg、约97mg、约98mg、约99mg、约100mg、或起止于这些值的范围内的量。在一些实施方案中,他汀类药物是阿托伐他汀钙。
[0665]
在一些实施方案中,包含本发明化合物的本发明组合物(包括本发明片剂)还包含他汀类药物或其药学上可接受的盐,其量为组合物的约0.001wt%至约75wt%、约0.005wt%至约61.5wt%、约2wt%至约35wt%、或约2wt%至约21wt%。在本发明的一些实施方案中,本发明组合物包含他汀类药物或其药学上可接受的盐,其量为以组合物重量计
约0.001%、约0.002%、约0.003%、约0.004%、约0.005%、约0.006%、约0.007%、约0.008%、约0.009%、约0.01%、约0.02%、约0.03%、约0.04%、约0.05%、约0.06%、约0.07%、约0.08%、约0.09%、约0.1%、约0.2%、约0.3%、约0.4%、约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%、约71%、约72%、约73%、约74%、或约75%,或起止于这些值的范围内的量。在本发明的一些实施方案中,本发明组合物包含他汀类药物或其药学上可接受的盐,其量为以组合物重量计约61%、约61.1%、约61.2%、约61.3%、约61.4%、约61.5%、约61.6%、约61.7%、约61.8%、约61.9%、或约62.0%,或起止于这些值的范围内的量。
[0666]
在一些实施方案中,本发明组合物(包括本发明片剂)还包含约0.1mg至约50mg、约1mg至约30mg、约5mg至约20mg、或约10mg依泽替米贝或其药学上可接受的盐。在其他实施方案中,本发明组合物包含依泽替米贝或其药学上可接受的盐,其量为约0.1mg、约0.2mg、约0.3mg、约0.4mg、约0.5mg、约0.6mg、约0.7mg、约0.8mg、约0.9mg、约1mg、约2mg、约3mg、约4mg、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg、约20mg、21mg、约22mg、约23mg、约24mg、约25mg、约26mg、约27mg、约28mg、约29mg、约30mg、31mg、约32mg、约33mg、约34mg、约35mg、约36mg、约37mg、约38mg、约39mg、约40mg、41mg、约42mg、约43mg、约44mg、约45mg、约46mg、约47mg、约48mg、约49mg、或约50mg,或起止于这些值的范围内的量。在一些实施方案中,本发明组合物还包含两种药物活性剂。在一些实施方案中,本发明组合物还包含a)约0.1mg至约50mg、约1mg至约30mg、约5mg至约20mg、或约10mg依泽替米贝或其药学上可接受的盐,和b)约0.1mg至约100mg、约5mg至约80mg、约10mg至约60mg、或约10mg至约40mg他汀类药物或其药学上可接受的盐。在其他实施方案中,本发明组合物包含a)依泽替米贝或其药学上可接受的盐,其量为约0.1mg、约0.2mg、约0.3mg、约0.4mg、约0.5mg、约0.6mg、约0.7mg、约0.8mg、约0.9mg、约1mg、约2mg、约3mg、约4mg、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg、约20mg、21mg、约22mg、约23mg、约24mg、约25mg、约26mg、约27mg、约28mg、约29mg、约30mg、31mg、约32mg、约33mg、约34mg、约35mg、约36mg、约37mg、约38mg、约39mg、约40mg、41mg、约42mg、约43mg、约44mg、约45mg、约46mg、约47mg、约48mg、约49mg、或约50mg,或起止于这些值的范围内的量,和b)他汀类药物或其药学上可接受的盐,其量为约0.1mg、约0.2mg、约0.3mg、约0.4mg、约0.5mg、约0.6mg、约0.7mg、约0.8mg、约0.9mg、约1mg、约2mg、约3mg、约4mg、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg、约20mg、21mg、约22mg、约23mg、约24mg、约25mg、约26mg、约27mg、约28mg、约29mg、约30mg、31mg、约32mg、约33mg、约34mg、约35mg、约36mg、约37mg、约38mg、约39mg、约40mg、41mg、约42mg、约43mg、约44mg、约45mg、约46mg、约47mg、约48mg、约49mg、约50mg、51mg、约52mg、约53mg、约
54mg、约55mg、约56mg、约57mg、约58mg、约59mg、约60mg、61mg、约62mg、约63mg、约64mg、约65mg、约66mg、约67mg、约68mg、约69mg、约70mg、71mg、约72mg、约73mg、约74mg、约75mg、约76mg、约77mg、约78mg、约79mg、约80mg、81mg、约82mg、约83mg、约84mg、约85mg、约86mg、约87mg、约88mg、约89mg、约90mg、91mg、约92mg、约93mg、约94mg、约95mg、约96mg、约97mg、约98mg、约99mg、约100mg,或起止于这些值的范围内的量。在一些实施方案中,他汀类药物是阿托伐他汀钙。
[0667]
在一些实施方案中,包含吉卡宾钙盐水合物晶型2或吉卡宾钙盐水合物晶型c3的本发明组合物还包含他汀类药物或其药学上可接受的盐,其量为组合物的约0.001wt%至约75wt%、约0.005wt%至约61.5wt%、约2wt%至约35wt%、或约2wt%至约21wt%。在一些实施方案中,包含吉卡宾钙盐水合物晶型2或吉卡宾钙盐水合物晶型c3的本发明片剂还包含他汀类药物或其药学上可接受的盐,其量为组合物的约0.001wt%至约75wt%、约0.005wt%至约61.5wt%、约2wt%至约35wt%、或约2wt%至约21wt%。
[0668]
在一些实施方案中,本发明组合物(包括本发明片剂)包含本发明化合物(其量为约50mg至约900mg)和他汀类药物或其药学上可接受的盐(其量为约1mg至约80mg)。在一些实施方案中,本发明组合物包含本发明化合物(其量为约150mg至约600mg)和他汀类药物或其药学上可接受的盐(其量为约10mg至约40mg)。在一些实施方案中,本发明组合物包含本发明化合物(其量为约150mg至约300mg)和他汀类药物或其药学上可接受的盐(其量为约10mg至约40mg)。在一些实施方案中,本发明组合物包含本发明化合物(其量为约150mg至约900mg)和他汀类药物或其药学上可接受的盐(其量为约10mg至约60mg)。
[0669]
在一些实施方案中,本发明组合物包含本发明化合物(其量为组合物的约38.5wt%至约99.9wt%)和他汀类药物或其药学上可接受的盐(其量为组合物的约0.1wt%至约61.5wt%)。在其他实施方案中,本发明组合物包含本发明化合物(其量为组合物的约65wt%至约98wt%)和他汀类药物或其药学上可接受的盐(其量为组合物的约2wt%至约35wt%)。在一些实施方案中,本发明组合物包含本发明化合物(其量为组合物的约79wt%至约98wt%)和他汀类药物或其药学上可接受的盐(其量为组合物的约2wt%至约21wt%)。在一些实施方案中,药学上可接受的盐是钙盐。
[0670]
在一些实施方案中,额外的药物活性剂以约10mg至100mg或约5mg至50mg的量存在于本发明组合物中。在一些实施方案中,额外的药物活性剂以约10mg、约20mg、约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、或任何这些值之间的任何范围的量存在于本发明组合物中。
[0671]
在一些实施方案中,本发明组合物还可包含赋形剂,例如稀释剂、崩解剂、润湿剂、粘合剂、助流剂、润滑剂或其任何组合。在一些实施方案中,片剂包含粘合剂。而且,在一些实施方案中,粘合剂包含微晶纤维素、磷酸氢钙、蔗糖、玉米淀粉、聚乙烯基吡咯烷酮、羟丙基纤维素、羟甲基纤维素或其任何组合。在其他实施方案中,片剂包含崩解剂。在其他实施方案中,崩解剂包含交联羧甲基纤维素钠、淀粉乙醇酸钠或其任何组合。在其他实施方案中,片剂包含润滑剂。而且,在一些实施方案中,润滑剂包含硬脂酸镁、硬脂酸、氢化油、硬脂基富马酸钠或其任何组合。
[0672]
在一些实施方案中,本发明组合物呈片剂形式,其包含粘合剂,例如本文所述的粘合剂中任一者。
[0673]
在一些实施方案中,本发明组合物呈片剂形式,其包含崩解剂,例如本文所述的崩解剂中任一者。
[0674]
在一些实施方案中,本发明组合物呈片剂形式,其包含润滑剂,例如本文所述的润滑剂中任一者。
[0675]
在一些实施方案中,本发明组合物可呈修饰释放或控制释放剂型。在一些实施方案中,本发明组合物可包含展现特定的释放曲线的粒子。例如,本发明组合物可包含呈立即释放形式的本发明化合物,同时也包含呈修饰释放形式的他汀类药物或其药学上可接受的盐,两者压缩成单一片剂。如本领域技术人员所理解的,可实现释放曲线的其他组合和修饰。适合于本发明的药物组合物的修饰释放剂型的实例描述于但不限于:美国专利no.:3,845,770;3,916,899;3,536,809;3,598,123;4,008,719;5,674,533;5,059,595;5,591,767;5,120,548;5,073,543;5,639,476;5,354,556;5,639,480;5,733,566;5,739,108;5,891,474;5,922,356;5,972,891;5,980,945;5,993,855;6,045,830;6,087,324;6,113,943;6,197,350;6,248,363;6,264,970;6,267,981;6,376,461;6,419,961;6,589,548;6,613,358和6,699,500中。
[0676]
在一些实施方案中,本发明组合物是基质控制释放剂型。例如,本发明组合物可包含以基质控制释放形式提供的约300mg至约600mg的本发明化合物。在一些实施方案中,基质控制释放形式还可包含额外的药物活性剂。在一些实施方案中,本发明化合物和额外的药物活性剂的释放曲线相同或不同。适合的基质控制释放剂型描述于例如takada等人,“encyclopedia of controlled drug delivery,”第2卷,mathiowitz ed.,wiley,1999中。
[0677]
在一些实施方案中,本发明组合物包含约10mg至约40mg他汀类药物和约300mg至约600mg的本发明化合物,其中所述组合物呈基质控制的修饰释放剂型。
[0678]
在一些实施方案中,基质控制释放形式包含易蚀性基质,所述易蚀性基质包含水可溶胀性、易蚀性或可溶性聚合物,包括合成聚合物和天然生成聚合物和衍生物,例如多糖和蛋白。
[0679]
在一些实施方案中,基质控制释放形式的易蚀性基质包含甲壳素、壳聚糖、葡聚糖或普鲁兰多糖;琼脂、阿拉伯胶、刺梧桐胶、刺槐豆胶、黄蓍胶、角叉菜胶、印度胶、瓜尔胶、黄原胶或硬葡聚糖;淀粉,例如糊精或麦芽糊精;亲水性胶体,例如果胶;磷脂,例如卵磷脂;藻酸盐;丙二醇藻酸盐;明胶;胶原;纤维质,例如乙基纤维素(ec)、甲基乙基纤维素(mec)、羧甲基纤维素(cmc)、羧甲基乙基纤维素(cmec)、羟乙基纤维素(hec)、羟丙基纤维素(hpc)、乙酸纤维素(ca)、丙酸纤维素(cp)、丁酸纤维素(cb)、乙酸丁酸纤维素(cab)、邻苯二甲酸乙酸纤维素(cap)、偏苯三甲酸乙酸纤维素(cat)、羟丙基甲基纤维素(hpmc)、hpmcp、hpmcas、偏苯三甲酸乙酸羟丙基甲基纤维素(hpmcat)或乙基羟乙基纤维素(ehec);聚乙烯基吡咯烷酮;聚乙烯醇;聚乙酸乙烯酯;甘油脂肪酸酯;聚丙烯酰胺;聚丙烯酸;乙基丙烯酸或甲基丙烯酸的共聚物(rohm america,inc.,piscataway,nj);聚(甲基丙烯酸2
‑
羟乙酯);聚交酯;l
‑
谷氨酸与l
‑
谷氨酸乙酯的共聚物;可降解的乳酸
‑
乙醇酸共聚物;聚
‑
d
‑
(
‑
)
‑3‑
羟基丁酸;或其他的丙烯酸衍生物,例如甲基丙烯酸丁酯、甲基丙烯酸甲酯、甲基丙烯酸乙酯、丙烯酸乙酯、(2
‑
二甲基氨基乙基)甲基丙烯酸酯或(三甲基氨基乙基)甲基丙烯酸酯氯化物的均聚物和共聚物;或其任何组合。
[0680]
在其他实施方案中,本发明组合物呈基质控制的修饰释放形式,其包含非易蚀性
基质。在一些实施方案中,将他汀类药物、本发明化合物溶解或分散在惰性基质中,并且一旦施用时主要以扩散通过惰性基质释放。在一些实施方案中,基质控制释放形式的非易蚀性基质包含不溶性聚合物,例如聚乙烯、聚丙烯、聚异戊二烯、聚异丁烯、聚丁二烯、聚甲基丙烯酸甲酯、聚甲基丙烯酸丁酯、氯化聚乙烯、聚氯乙烯、丙烯酸甲酯
‑
甲基丙烯酸甲酯共聚物、乙烯
‑
乙酸乙烯酯共聚物、乙烯/丙烯共聚物、乙烯/丙烯酸乙酯共聚物,与乙酸乙烯酯、偏二氯乙烯、乙烯或丙烯的氯乙烯共聚物,聚对苯二甲酸乙二酯的离子聚合物、丁基橡胶、表氯醇橡胶、乙烯/乙烯醇共聚物、乙烯/乙酸乙烯酯/乙烯醇三聚物、乙烯/乙烯氧基乙醇共聚物、聚氯乙烯、塑化尼龙、塑化聚对苯二甲酸乙二酯、天然橡胶、硅酮橡胶、聚二甲基硅氧烷、硅酮碳酸酯共聚物或亲水性聚合物,例如乙基纤维素、乙酸纤维素、交联聚维酮或交联的部分水解的聚乙酸乙烯酯;脂肪化合物,例如巴西棕榈蜡、微晶蜡或甘油三酯;或其任何组合。
[0681]
呈修饰释放剂型的本发明组合物可通过本领域技术人员已知的方法制备,包括直接压缩、干法或湿法造粒后压缩、熔融造粒后压缩。
[0682]
在一些实施方案中,本发明组合物是包含于胶囊中的本发明片剂。该胶囊包片剂系统可为于硬明胶胶囊中包含多样性微型片剂的多功能和多单位系统。微型片剂可为快速释放、延长释放、脉冲式、延迟开始的延长释放微型片剂或其任何组合。在一些实施方案中,包含多种活性药剂的微型片剂的组合或微型片剂与微型珠的组合可各自具有释放倍增的脉冲式药物递送系统(dds)、位点特异性dds、慢速
‑
快速dds、快速/慢速dds和零阶dds的特定滞后时间。
[0683]
在一些实施方案中,本发明组合物呈渗透控制释放剂型。
[0684]
在一些实施方案中,渗透控制释放装置包含单室系统、双室系统、不对称膜技术(amt)、挤压核心系统(ecs)或其任何组合。在一些实施方案中,这些装置包含至少两种组分:(a)含有一种或多种活性药剂的核心;并且(b)具有至少一个输出口的半透膜,其囊封核心。半透膜控制水从使用的水性环境流入核心,以通过穿过一个或多个输出口挤出而引起药物释放。
[0685]
在一些实施方案中,渗透装置的核心任选包含渗透剂,其产生将水从使用环境运送至装置核心中的驱动力。一类有用于本发明的渗透剂包含水可溶胀的亲水性聚合物,其也称为“渗透聚合物”或“水凝胶”,包括但不限于亲水乙烯基和丙烯酸聚合物、多糖(例如藻酸钙)、聚氧化乙烯(peo)、聚乙二醇(peg)、聚丙二醇(ppg)、聚(甲基丙烯酸2
‑
羟乙酯)、聚(丙烯)酸、聚(甲基丙烯)酸、聚乙烯基吡咯烷酮(pvp)、交联pvp、聚乙烯醇(pva)、pva/pvp共聚物、具有疏水性单体(例如甲基丙烯酸甲酯和乙酸乙烯酯)的pva/pvp共聚物、含有大的peo嵌段的亲水性聚氨基甲酸酯、交联羧甲基纤维素钠、角叉菜胶、羟乙基纤维素(hec)、羟丙基纤维素(hpc)、羟丙基甲基纤维素(hpmc)、羧甲基纤维素(cmc)和羧乙基纤维素(cec)、藻酸钠、聚卡波非(polycarbophil)、明胶、黄原胶和淀粉乙醇酸钠。
[0686]
另一类渗透剂包含渗透原(osmogens),其能够吸收水以影响跨越周围包衣的屏障的渗透压梯度。适合的渗透原包括但不限于无机盐,例如硫酸镁、氯化镁、氯化钙、氯化钠、氯化锂、硫酸钾、磷酸钾、碳酸钠、亚硫酸钠、硫酸锂、氯化钾和硫酸钠;糖类,例如右旋糖、果糖、葡萄糖、肌醇、乳糖、麦芽糖、甘露糖醇、棉子糖、山梨糖醇、蔗糖、海藻糖和木糖醇;有机酸,例如抗坏血酸、苯甲酸、富马酸、柠檬酸、马来酸、癸二酸、山梨酸、己二酸、依地酸
(edetic acid)、谷氨酸、对甲苯磺酸、琥珀酸和酒石酸;尿素;和其混合物。
[0687]
可使用不同的溶出度的渗透剂以影响本发明化合物在施用后如何快速地溶出。例如,可包括无定形糖(例如mannogeme ez(spi pharma,lewes,de))以提供在最初几小时内(例如约1至约5小时)更快地递送从而迅速地产生预防或治疗功效,并且经延长的时期逐渐地和持续地释放残余物量以维持期望水平的治疗或预防效果。在一些实施方案中,吉卡宾或其药学上可接受的盐是以替代由受试者代谢或排泄的本发明化合物量的速率从本发明组合物释放。
[0688]
核心也可包括如本文所述的多种多样的其他赋形剂和载体以增强剂型的性能或促进稳定性或加工。
[0689]
可用于形成半透膜的材料包括各种等级的丙烯酸类、乙烯类、醚类、聚酰胺类、聚酯类和纤维质衍生物,其在生理相关ph下是水可渗透和水不溶性的,或易受化学改变(例如交联)影响而成为水不溶性的。有用于形成包衣的适合的聚合物的实例包括增塑的、未增塑的和强化的乙酸纤维素(ca)、二乙酸纤维素、三乙酸纤维素、丙酸ca、硝酸纤维素、乙酸丁酸纤维素(cab)、乙基氨基甲酸ca、cap、甲基氨基甲酸ca、琥珀酸ca、偏苯三甲酸乙酸纤维素(cat)、二甲基氨基乙酸ca、乙基碳酸ca、氯乙酸ca、乙基草酸ca、甲基磺酸ca、丁基磺酸ca、对甲苯磺酸ca、琼脂乙酸酯、直链淀粉三乙酸酯、β
‑
葡聚糖乙酸酯、β
‑
葡聚糖三乙酸酯、乙醛二甲基乙酸酯、刺槐豆胶三乙酸酯、羟基化乙烯
‑
乙酸乙烯酯、ec、peg、ppg、peg/ppg共聚物、pvp、hec、hpc、cmc、cmec、hpmc、hpmcp、hpmcas、hpmcat、聚(丙烯)酸和酯和聚(甲基丙烯)酸和酯与其共聚物、淀粉、葡聚糖、糊精、壳聚糖、胶原、明胶、聚烯烃、聚醚、聚砜、聚醚砜、聚苯乙烯、聚乙烯卤化物、聚乙烯酯和醚、天然蜡和合成蜡。
[0690]
半透膜也可为疏水性微孔膜,其中这些孔基本上经气体填充且未经水性介质润湿,但是水蒸气可渗透,如美国专利no.5,798,119中公开的。这些疏水性但水蒸气可渗透的膜通常由疏水性聚合物所组成,所述疏水性聚合物例如聚烯烃类、聚乙烯、聚丙烯、聚四氟乙烯、聚丙烯酸衍生物、聚醚、聚砜、聚醚砜、聚苯乙烯、聚乙烯卤化物、聚偏二氟乙烯、聚乙烯酯和醚、天然蜡和合成蜡。
[0691]
在半透膜上的一个或多个输出口可在包覆后通过机械或激光钻孔形成。一个或多个输出口也可通过侵蚀水溶性材料塞或通过在核心中的凹陷上膜的较薄的部分破裂而原位形成。另外,输出口可在包覆过程期间形成,如在美国专利no.5,612,059和5,698,220中公开的不对称膜包覆型式的情况下。
[0692]
本发明化合物的释放总量和释放速率基本上可经由半透膜的厚度和孔隙率、核心组成以及输出口的数量、大小和位置来调控。
[0693]
在一些实施方案中,呈渗透控制释放剂型的药物组合物还可包含如本文所述的额外的常规赋形剂,以促进制剂的性能或加工。
[0694]
渗透控制释放剂型可根据那些本领域技术人员已知的常规方法和技术制备(参见remington:the science and practice of pharmacy,如上所述;santus和baker,j.controlled release 1995,35,1
‑
21;verma等人,drug development and industrial pharmacy 2000,26,695
‑
708;verma等人,j.controlled release 2002,79,7
‑
27)。
[0695]
在一些实施方案中,本文所提供的药物组合物被配制为不对称膜技术(amt)控制释放剂型,其包含包覆核心的不对称渗透膜,所述核心包含一种或多种活性成份和其他的
药学上可接受的赋形剂。参见美国专利no.5,612,059和wo 2002/17918。amt控制释放剂型可根据那些本领域技术人员已知的常规方法和技术制备,包括直接压缩、干法造粒、湿法造粒和浸涂方法。
[0696]
在一些实施方案中,本文所提供的药物组合物被配制为esc控制释放剂型,其包含包覆核心的渗透膜,所述核心包含本发明化合物、羟乙基纤维素和其他的药学上可接受的赋形剂。
[0697]
在一些实施方案中,本发明组合物是修饰释放剂型,其经制造成多微粒
‑
控制释放剂型,所述剂型包含约10μm至约3mm、约50μm至约2.5mm、或约100μm至1mm直径范围的许多粒子、颗粒或小球、微粒、小珠、微胶囊和微片剂。
[0698]
多微粒控制释放剂型可提供具有改进的生物利用度的延长释放剂型。维持本发明化合物的释放速率的合适的载体包括而不限于乙基纤维素、hpmc、hpmc
‑
邻苯二甲酸酯、胶态二氧化硅和eudragit
‑
rspm。
[0699]
适用于本发明组合物和治疗或预防方法的小球包含50
‑
80%(w/w)的药物和20
‑
50%(w/w)的微晶纤维素或其他聚合物。适合的聚合物包括但不限于微晶蜡、预糊化淀粉和麦芽糊精。
[0700]
小珠可被制备入胶囊和片剂剂型。呈片剂剂型的小珠可展示比呈胶囊形式的微粒更缓慢的溶出曲线。适合于本发明组合物和治疗或预防方法的微粒填充剂包括而不限于山梨糖醇酐单油酸酯(span 80)、hpmc或其任何组合。用于控制释放乳液的适当的分散剂包括例如丙烯酸乙酯和丙烯酸甲酯。
[0701]
在一些实施方案中,本发明组合物呈微胶囊和/或微片剂形式。在一些实施方案中,微胶囊包含延长释放聚合物微胶囊,其含有他汀类药物和具有各种溶解度特征的本发明化合物。延长释放聚合物微胶囊可于水性环境中以胶态聚合物分散体制备。在其他实施方案中,适合于本文所提供的组合物和方法的微胶囊可使用常规的微囊封技术(bodmeier和wang,1993)制备。
[0702]
这样的多微粒可以那些本领域技术人员已知的方法制造,包括湿法和干法造粒、挤出/滚圆、碾压、熔体冻结(melt
‑
congealing)和喷涂种核。参见例如multiparticulate oral drug delivery;marcel dekker:1994;和pharmaceutical pelletization technology;marcel dekker:1989。用于这些技术的赋形剂商购可得并且描述于美国药典中,并且吉卡宾盐如美国专利no.6,861,555或国际申请公开wo 2016/077832中所述制备,例如吉卡宾钙盐单一多晶型。
[0703]
如本文所述的其他赋形剂可与本发明组合物混合以助于加工和形成多微粒。所得粒子本身可构成多微粒剂型或可以各种膜形成材料(例如肠溶聚合物、水可溶胀性或水溶性聚合物)包覆。多微粒可进一步加工成胶囊或片剂。
[0704]
在其他实施方案中,本发明组合物呈具有立即释放组分和至少一种延迟释放组分的剂型,并且能够给出化合物以在时间上分隔0.1小时至24小时的至少两个连续脉冲形式的不连续释放。
[0705]
本发明进一步提供了包含本发明组合物和其使用说明的套件。套件还可包含:包含额外的药物活性剂的组合物。在一些实施方案中,套件包含:包含约50mg至约900mg的本发明化合物的本发明组合物和包含约0.1mg至约80mg他汀类药物的另一组合物;以及其使
用说明。在一些实施方案中,套件包含:包含约50mg至约900mg的本发明化合物的本发明组合物和包含约10mg至约80mg他汀类药物的另一组合物;以及其使用说明。在一些实施方案中,套件包含:包含约150mg至约600mg的本发明化合物的本发明组合物和约10mg至约40mg他汀类药物的另一组合物;以及其使用说明。
[0706]
本发明进一步提供了包含本发明片剂和其使用说明的套件。套件还可包含:包含额外的药物活性剂的本发明片剂。在一些实施方案中,套件包含:包含约50mg至约900mg的吉卡宾钙盐的本发明片剂和包含约0.1mg至约80mg他汀类药物的另一组合物;以及其使用说明。在一些实施方案中,套件包含:包含约50mg至约900mg的吉卡宾钙盐的本发明片剂和包含约10mg至约80mg他汀类药物的另一组合物;以及其使用说明。在一些实施方案中,套件包含:包含约150mg至约600mg的吉卡宾钙盐的本发明片剂和约10mg至约40mg他汀类药物的另一组合物;以及其使用说明。
[0707]
在一些实施方案中,套件包含:包含约50mg至约900mg的本发明化合物的本发明组合物(包括本发明片剂)和包含约5mg至约80mg阿托伐他汀或其药学上可接受的盐的另一组合物;以及其使用说明。在一些实施方案中,套件包含:包含约50mg至约900mg的本发明化合物的本发明组合物和包含约10mg至约80mg阿托伐他汀或其药学上可接受的盐的另一组合物;以及其使用说明。在一些实施方案中,套件包含:包含约150mg至约600mg的本发明化合物的本发明组合物和包含约10mg至约40mg阿托伐他汀或其药学上可接受的盐的另一组合物;以及其使用说明。
[0708]
在一些实施方案中,套件包含:包含约50mg至约900mg的本发明化合物的本发明组合物(包括本发明片剂)和包含约5mg至约20mg依泽替米贝或其药学上可接受的盐的另一组合物;以及其使用说明。在一些实施方案中,套件包含:包含约50mg至约900mg的本发明化合物的本发明组合物和包含约10mg依泽替米贝或其药学上可接受的盐的另一组合物,以及其使用说明。在一些实施方案中,套件包含:包含约150mg至约600mg的本发明化合物的本发明组合物和包含约10mg依泽替米贝或其药学上可接受的盐的另一组合物;以及其使用说明。
[0709]
在一些实施方案中,套件包含a)包含约50mg至约900mg的本发明化合物的本发明组合物(包括本发明片剂),b)包含约5mg至约80mg他汀类药物或其药学上可接受的盐的组合物,c)包含约5mg至约20mg依泽替米贝或其药学上可接受的盐的组合物,以及d)其使用说明。在一些实施方案中,套件包含a)包含约50mg至约900mg的本发明化合物的本发明组合物,b)包含约10mg至约80mg他汀类药物或其药学上可接受的盐的组合物,c)包含约10mg依泽替米贝或其药学上可接受的盐的组合物,以及d)其使用说明。在一些实施方案中,套件包含a)包含约150mg至约600mg的本发明化合物的本发明组合物,b)包含约10mg至约40mg他汀类药物或其药学上可接受的盐的组合物,c)包含约10mg依泽替米贝或其药学上可接受的盐的组合物,以及d)其使用说明。
[0710]
在一些实施方案中,套件包含a)包含约50mg至约900mg的本发明化合物的本发明组合物(包括本发明片剂),b)包含约5mg至约80mg阿托伐他汀或其药学上可接受的盐的组合物,c)包含约5mg至约20mg依泽替米贝或其药学上可接受的盐的组合物,以及d)其使用说明。在一些实施方案中,套件包含a)包含约50mg至约900mg的本发明化合物的本发明组合物,b)包含约10mg至约80mg阿托伐他汀或其药学上可接受的盐的组合物,c)包含约10mg依泽替米贝或其药学上可接受的盐的组合物,以及d)其使用说明。在一些实施方案中,套件包
含a)包含约150mg至约600mg的本发明化合物的本发明组合物,b)包含约10mg至约40mg阿托伐他汀或其药学上可接受的盐的组合物,c)包含约10mg依泽替米贝或其药学上可接受的盐的组合物,以及d)其使用说明。
[0711]
在一些实施方案中,本发明组合物和其他组合物容纳在分开的容器中。在一些实施方案中,本发明组合物和其他组合物容纳在相同的容器中。
[0712]
在一些实施方案中,本发明片剂和其他组合物容纳在分开的容器中。在一些实施方案中,本发明片剂和其他组合物容纳在相同的容器中。
[0713]
在一些实施方案中,容器是瓶、小瓶、泡罩包装或其任何组合。在一些实施方案中,容器是具有闭合件(例如帽(cap)、顶(top)或密封的包装,以提供在封闭系统中的本发明组合物)的瓶、小瓶、泡罩包装或其任何组合。
[0714]
在一些实施方案中,他汀类药物是阿托伐他汀、辛伐他汀、普伐他汀、瑞舒伐他汀、氟伐他汀、洛伐他汀、匹伐他汀、美伐他汀、达伐他汀、二氢康帕汀或西利伐他汀或其任何药学上可接受的盐。在一些实施方案中,他汀类药物是阿托伐他汀或其药学上可接受的盐。
[0715]
在一些实施方案中,本发明组合物或其他组合物呈片剂形式。
[0716]
在一些实施方案中,片剂包含一种或多种选自稀释剂、崩解剂、润湿剂、粘合剂、助流剂、润滑剂或其任何组合的赋形剂。
[0717]
在一些实施方案中,本发明组合物被施用于有需要的受试者。在一些实施方案中,本发明组合物呈单位剂型。在一些实施方案中,如本文所用,“单位剂量(unit dose)”或“单位剂量(unit
‑
dose)”是指含有特定量的本发明化合物的特定制剂。在非限制性实例中,单位剂量可为包含约300mg的本发明化合物的片剂。在一些实施方案中,单位剂量包含约50mg、约150mg、约300mg或约600mg的本发明化合物。在另一个实施方案中,单位剂量包含本发明化合物,其量为相当于约150mg、约300mg或约600mg吉卡宾的摩尔当量。
[0718]
在一些实施方案中,本发明组合物被施用于有需要的受试者一天一次、两次、三次或四次。在一些实施方案中,本发明组合物被以允许约600mg至约900mg的本发明化合物的每日剂量的方式施用于有需要的受试者。在一些实施方案中,本发明组合物被以允许相当于约600mg至约900mg吉卡宾的摩尔当量的每日剂量的方式施用于有需要的受试者。在一些实施方案中,每日剂量是约600mg的本发明化合物。在另一个实施方案中,每日剂量是相当于600mg吉卡宾的摩尔当量。
[0719]
在一些实施方案中,本发明组合物包含约300mg的本发明化合物并且一天一次施用于有需要的受试者。在一些实施方案中,本发明组合物包含约300mg的本发明化合物并且一天两次施用于有需要的受试者。在一些实施方案中,本发明组合物包含约300mg的本发明化合物并且一天三次施用于有需要的受试者。
[0720]
在一些实施方案中,本发明组合物包含相当于约300mg吉卡宾的摩尔当量的本发明化合物,并且一天一次施用于有需要的受试者。在一些实施方案中,本发明组合物包含相当于约300mg吉卡宾的摩尔当量的本发明化合物,并且一天两次施用于有需要的受试者。在一些实施方案中,本发明组合物包含相当于约300mg吉卡宾的摩尔当量的本发明化合物,并且一天三次施用于有需要的受试者。
[0721]
在一些实施方案中,本发明组合物包含约600mg的本发明化合物并且一天一次施用于有需要的受试者。在一些实施方案中,本发明组合物包含本发明化合物,其量为相当于
约600mg吉卡宾的摩尔当量,并且一天一次施用于有需要的受试者。
[0722]
在一些实施方案中,本发明组合物包含约150mg的本发明化合物并且一天一次施用于有需要的受试者。在一些实施方案中,本发明组合物包含约150mg的本发明化合物并且一天两次施用于有需要的受试者。在一些实施方案中,本发明组合物包含约150mg的本发明化合物并且一天三次施用于有需要的受试者。在一些实施方案中,本发明组合物包含约150mg的本发明化合物并且一天四次施用于有需要的受试者。
[0723]
在一些实施方案中,两个各自含有约150mg的本发明化合物的单独的单位剂量被一天一次施用于有需要的受试者。在一些实施方案中,两个各自含有约150mg的本发明化合物的单独的单位剂量被一天两次施用于有需要的受试者(总共600毫克/天)。在一些实施方案中,两个各自含有约150mg的本发明化合物的单独的单位剂量被一天三次施用于有需要的受试者(总共900毫克/天)。
[0724]
在一些实施方案中,包含相当于约150mg吉卡宾的摩尔当量的本发明化合物的本发明组合物被一天一次施用于有需要的受试者。在一些实施方案中,包含相当于约150mg吉卡宾的摩尔当量的本发明化合物的本发明组合物被一天两次施用于有需要的受试者。在一些实施方案中,包含相当于约150mg吉卡宾的摩尔当量的本发明化合物的本发明组合物被一天三次施用于有需要的受试者。在一些实施方案中,包含相当于约150mg吉卡宾的摩尔当量的本发明化合物的本发明组合物被一天四次施用于有需要的受试者。
[0725]
在一些实施方案中,两个各自包含相当于约150mg吉卡宾的摩尔当量的本发明化合物的本发明组合物被一天一次施用于有需要的受试者。在一些实施方案中,两个各自包含相当于约150mg吉卡宾的摩尔当量的本发明化合物的本发明组合物被一天两次施用于有需要的受试者(总共600毫克/天=两个单独的单位剂量(150mg
×
2)
×
2(一天两次))。在一些实施方案中,两个各自包含相当于约150mg吉卡宾的摩尔当量的本发明化合物的本发明组合物被一天三次施用于有需要的受试者(总共900毫克/天)。
[0726]
实施例
[0727]
实施例1:吉卡宾钙盐水合物晶型1的化学合成
[0728]
方案2:6
‑
(5
‑
羧基
‑5‑
甲基
‑
己氧基)
‑
2,2
‑
二甲基己酸(吉卡宾)的合成
[0729][0730]
步骤1. 6
‑
(5
‑
羧基
‑5‑
甲基
‑
己氧基)
‑
2,2
‑
二甲基己酸(吉卡宾):将异丁酸(41.0kg,466mol,2.2当量)与庚烷(276kg)在反应器(st
‑
1005,玻璃加衬,1600l)中合并且在搅拌下加入1摩尔当量的30%氢氧化钠(62.1kg),接着加入水(1.1kg)和庚烷(126kg)。将混合物回流伴随去除水,直到水的去除速率有效地停止。接着进行水含量的karl
‑
fisher分析以确认水的去除(测出0.012%的水含量)。添加四氢呋喃(thf)(279kg),接着在10℃至15
℃添加二异丙基氨基锂溶液(在庚烷/thf/乙基苯中的28%w/w的二异丙基氨基锂,174.6kg,2.2当量)。在用thf(33.8kg)冲洗后,将混合物在42℃
±
2℃加热约1小时。在40℃至45℃下以4小时添加用thf(11.6kg)稀释的双(4
‑
氯丁基)醚(42.0kg,211mol,1.0当量,bcbe)。在用thf(11.4kg)冲洗后,将混合物在42℃
±
2℃加热14
‑
24小时。添加水(159kg)并且在52℃
±
2℃溶解所得沉淀物。接着将水层分离。将额外的水(159kg)在50℃
±
2℃添加至上层有机层中且分离各层。将水层与第一水层合并且弃置有机层。将水层与庚烷(177kg)合并且在25℃
‑
50℃添加过量的浓盐酸(299kg)。将含有产物的有机层分离,并将水层在50℃
±
2℃用庚烷(106kg)萃取。接着弃置水层。将合并的含有产物的庚烷层在50℃
±
2℃用水(64kg)洗涤两次且弃置水层。将庚烷层在≤60℃蒸发至干燥。将所得残余物与水(每次洗涤320kg)混合两次且在≤60℃蒸发至干燥。将残余的材料在22℃
±
2℃溶解在庚烷(286kg)中,用水(193kg)洗涤且弃置水层。将庚烷层在≤60℃蒸发至干燥且与庚烷(各109kg)共蒸发三次。karl
‑
fisher分析指示水含量是0.04%。将所得残余物在22℃
±
2℃溶解在庚烷(130kg)和thf(1.4kg)中,通过硅胶(64.0kg)过滤且将硅胶先用庚烷(246kg)/thf(16.0kg)混合物且接着仅用庚烷(492kg)洗涤。将收集的滤液在≤60℃浓缩至约150l的体积。将溶液用庚烷(44kg)转移至较小的容器(st
‑
164,玻璃加衬,160l),接着在≤60℃蒸发至干燥。粗制物的1h nmr分析指示96.7%纯度。将粗制吉卡宾在40℃
±
5℃溶解在庚烷(55.0kg)中且将庚烷溶液冷却到15℃
±
2℃。在用吉卡宾晶体(30g)接种后,将溶液冷却到12℃。在经18小时结晶后,将产物在过滤干燥器(ft
‑
1001,不锈钢,1000l)上分离,以冷庚烷分三部分(3
×
9.6kg)洗涤且在真空中于35℃
±
2℃干燥15小时,得到50.7kg(167摩尔)。所得收率为约79%。纯化的吉卡宾含有0.4%的2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸。
[0731]
方案3. 6
‑
(5
‑
羧基
‑5‑
甲基
‑
己氧基)
‑
2,2
‑
二甲基己酸钙(吉卡宾钙盐)水合物晶型1的合成
[0732][0733]
步骤2. 6
‑
(5
‑
羧基
‑5‑
甲基
‑
己氧基)
‑
2,2
‑
二甲基己酸钙(吉卡宾钙盐)水合物晶型1:将吉卡宾(50.5kg;167mol,1.00当量,来自步骤1)在反应容器(st
‑
1005,玻璃加衬,1600l)中溶解在乙醇(347kg,以1%环己烷变性)中并通过1.2μm过滤器过滤。将设备用额外的乙醇(38kg)冲洗。在22℃于搅拌下添加氧化钙(9.35kg,167mol,1.00当量)且将混合物加热回流20
‑
25小时。将所得混合物冷却到52℃
±
2℃且加入叔丁基甲基醚(125kg,通过1.2μm过滤器过滤)。在冷却到22℃
±
2℃后,将混合物再搅拌1小时。将结晶的乙醇溶剂化物在搅动式过滤干燥器(ft
‑
1001,不锈钢,1000l)中过滤分离,并且用叔丁基甲基醚分三部分洗涤(3
×
37kg,通过1.2μm过滤器过滤)。将结晶的乙醇溶剂化物在具有20l氮气气流/小时的真空中间隔搅动干燥(搅拌3分钟,不搅拌15分钟),在夹套温度30℃持续66分钟,50℃持续30分钟,70℃持续30分钟和90℃持续至少12小时。用氮气破坏真空且搅拌下添加纯化水(6.29kg,349mol,2.09当量),并且在大气压力下于90℃继续搅拌6小时。再建立真空且将结晶的水合物在90℃干燥至少16小时,以生成吉卡宾钙盐水合物晶型1(53.2kg,157摩尔)。所
得量为约94%收率并且将此样品称为“纯净的”或“获得为纯净的”样品(研磨前)。
[0734]
步骤3. 6
‑
(5
‑
羧基
‑5‑
甲基
‑
己氧基)
‑
2,2
‑
二甲基己酸钙(吉卡宾钙盐)水合物晶型1的研磨:将步骤2中所获得的吉卡宾钙盐水合物晶型1(53.2kg,157摩尔)使用具有配备4排针(n.699)的专用转子和定子的针磨机(mp160)在氮气气流下研磨。获得93%收率的49.3kg吉卡宾钙晶型1,具有40μm至75μm的范围内的psd90。
[0735]
方法
[0736]
除非另外指出,否则使用下列方法确定吉卡宾和吉卡宾的药学上可接受的盐的纯度和杂质。
[0737]
高效液相色谱(hplc)
‑
杂质
[0738]
操作参数:
[0739][0740][0741]
梯度:
[0742][0743]
样品溶液(10mg/ml):将100mg(
±
5mg)样品添加至10ml烧瓶中,并将样品溶剂添加
至标记处。
[0744]
参照混合储备溶液(0.5mg/ml的吉卡宾和0.25mg/l的其他物质):将10mg(
±
1mg)吉卡宾+5mg(
±
1mg)2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸+5mg(
±
1mg)6
‑
(4
‑
羟基丁氧基)
‑
2,2
‑
二甲基己酸+5mg(
±
1mg)2,2
‑
二甲基
‑
己
‑4‑
烯酸(约5:1的e/z比)添加至20ml烧瓶中,并将样品溶剂添加至标记处(参照混合储备液)。将2.0ml参照混合储备液添加至20ml烧瓶中,并将样品溶剂添加至标记处(稀释的参照储备液)。
[0745]
说明性的注射顺序
[0746][0747][0748]
系统适合性试验标准:
[0749]
·
在空白样品中无干扰峰
[0750]
·
校准标准:r2≥0.98。
[0751]
评估:
[0752]
uv:报告阈值:0.05%w/w
[0753]
·
(e)
‑
2,2
‑
二甲基
‑
己
‑4‑
烯酸的杂质含量针对参照材料的校准进行评估。
[0754]
·
(z)
‑
2,2
‑
二甲基
‑
己
‑4‑
烯酸的杂质含量针对参照材料的校准进行评估。
[0755]
·
未用cad检测的所有未知的杂质用标准物2,2
‑
二甲基
‑
己
‑4‑
烯酸(e/z混合物)校准。
[0756]
cad:报告阈值:0.05%w/w
[0757]
·6‑
(4
‑
羟基丁氧基)
‑
2,2
‑
二甲基己酸的杂质含量针对参照材料的校准进行评估。
[0758]
·
2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸的杂质含量针对参照材料的校准进行评估。
[0759]
·
任何未知的杂质针对2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸的校准进行评估。
[0760]
总hplc杂质(%w/w)=通过uv得到的杂质的总和以及通过cad得到的杂质的总和。
[0761]
高效液相色谱(hplc)
‑
吉卡宾钙纯度和吉卡宾的共轭碱的组分分析。
[0762]
操作参数:
[0763][0764]
梯度:
[0765][0766]
样品溶液(10mg/ml):将100mg(
±
5mg)样品添加至10ml烧瓶中,并将样品溶剂添加至标记处。
[0767]
参照吉卡宾溶液(10mg/ml):将100mg(
±
5mg)吉卡宾添加至10ml烧瓶中,并将样品溶剂添加至标记处(参照)。
[0768]
说明性的注射顺序
[0769]
注射编号注射体积样品12.0μl空白22.0μl空白32.0μl参照142.0μl参照2
52.0μl参照362.0μl参照472.0μl参照582.0μl参照692.0μl参照偏离检查102.0μl空白112.0μl样品1122.0μl样品1重复132.0μl空白142.0μl样品2152.0μl样品2重复162.0μl空白172.0μl参照偏离检查182.0μl空白
[0770]
系统适合性试验标准:
[0771]
·
在空白样品中没有干扰峰
[0772]
·
相对标准偏差(6个参照注射)≤2.0%
[0773]
·
回收率(各参照注射的)98.0
‑
102.0%w/w。
[0774]
评估:
[0775]
uv:吉卡宾纯度针对参照材料的校准进行评估。
[0776]
离子色谱(ic)
[0777]
操作参数:
[0778][0779]
梯度:
[0780][0781]
样品溶液(5mg/ml):将25mg(
±
1.0mg)样品添加至5ml烧瓶中,用水/乙腈1:1+0.05%三氟乙酸溶解且填充至标记处。将烧瓶放入超声浴10分钟,然后放置经约1小时冷却。接着观察溶液以确保其为澄清且没有粒子(没有沉积物)。如果存在粒子,则将样品经由注射器过滤器(例如过滤器0.45μm
‑
用于有机ptfe溶液)过滤至小瓶中(弃置预先使过滤器饱和的2至3ml滤液)。如果不存在粒子,则可以不过滤而分析样品。
[0782]
标准储备溶液(1000μg/ml):将50μl异丁酸添加至50ml烧瓶中,并将水添加至标记处(参照储备液)。
[0783]
标准储备溶液(100μg/ml):将1.0ml参照储备液以水稀释至10ml。其他的标准溶液如下文所示方式制备。
[0784][0785]
说明性的注射顺序
[0786][0787][0788]
系统适合性试验标准:
[0789]
·
r2≥0.99
[0790]
·
%偏离协定(drift agreement):97%
‑
103%
[0791]
·
下限计数标准25.0μg/ml≥2500
[0792]
·
不对称(靶)标准25.0μg/ml≤2.0
[0793]
·
s/n(信噪比)标准25.0μg/ml≥10。
[0794]
评估:定量限为2.50μg/ml,其相当于0.05%w/w。
[0795]
气相色谱(gc)
‑
双(4
‑
氯丁基)醚和残余溶剂
[0796]
操作参数:
[0797][0798][0799]
温度程序:
[0800][0801]
储备液双(4
‑
氯丁基)醚:将125mg(5ppm*)双(4
‑
氯丁基)醚精确地添加至含有10ml n
‑
甲基
‑2‑
吡咯烷酮(nmp)的20ml容量瓶中。用nmp填充至容量瓶的标记处。*以ppm计的值指100μl储备液增长和125mg标称重量。
[0802]
储备溶液:将125mg(1000ppm*)正己烷、250mg(2000ppm*)thf、125mg(1000ppm*)二异丙基胺、250mg(2000ppm*)乙基苯和125mg(1000ppm*)环己烷准确地测量至含有约10ml nmp的20ml容量瓶中。用nmp填充至容量瓶的标记处并将溶液混合,直到其变均匀为止。*以ppm计的值是指100μl储备液增长和125mg标称重量。
[0803]
加样溶液:将各250mg(10000ppm*)的正庚烷、叔丁基甲基醚和乙醇精确地称量至含有约10mlnmp的20ml容量瓶中。将20μl储备液双(4
‑
氯丁基)醚和4ml储备溶液添加至容量瓶中。接着用nmp填充至容量瓶的标记处并将溶液混合,直到其变均匀为止。*以ppm计的值指100μl储备液增长和125mg标称重量。
[0804]
样品制备:将约110
‑
140mg细粉状吉卡宾钙称量至gchs小瓶中,并记录准确的量。用滴管添加3ml水,并用微滴注射器添加100μlnmp,并立即密闭小瓶。将样品溶液经由超声混合约5分钟。
[0805]
加样样品的制备:将约110
‑
140mg细粉状吉卡宾钙称量至gchs小瓶中,并记录准确的量。用滴管添加3ml水。接着添加适量的加样溶液(10μl、20μl、30μl、40μl、50μl等)和nmp(与加样溶液一起应为100μl)。立即密闭小瓶。将样品溶液经由超声混合约5分钟。
[0806]
电感耦合等离子体发射光谱法(icp
‑
oes)
[0807]
所述方法基于ph.eur.,第2.2.57章“inductively coupled plasma
‑
atomic emission spectrometry”和usp
‑
nf,第<730>章“plasma spectrochemistry”。
[0808]
操作参数和试剂:
[0809][0810]
系统适合性试验:
[0811][0812][0813]
溶液:
[0814][0815]
测量:零溶液和校准溶液的发射使用适合的仪器参数(参见上文)测量。测量空白样品溶液、质量控制溶液和测试溶液的发射。若必要,将测试溶液用零溶液稀释(稀释因子f)以获得在校准范围内的读数。替代地,制备新的校准溶液以调整校准范围。
[0816]
计算:校准函数使用对应读数确定。分析物元素浓度在测试溶液中从用所述校准函数的测量发射减去零溶液的读数来计算。测试物质中的分析物元素浓度使用以下公式计算。这些计算通过仪器软件完成。
[0817][0818]
·
c=测试物质中的分析物元素浓度(%m/m)
[0819]
·
a=测试溶液中的分析物浓度(mg/l)
[0820]
·
v=测试溶液体积(ml)
[0821]
·
f=稀释因子,例如如果测试溶液未稀释,则f=1.0
[0822]
·
m=测试物质质量(g)
[0823]
·
10000是转换因子(mg/kg至%m/m)。
[0824]
报告一式两份测量值(以2位小数)和平均值(1位小数)两者。
[0825]
karl
‑
fisher分析
[0826]
karl
‑
fisher分析根据ph.eur.2.5.32进行。用于karl
‑
fisher分析的定量限为
0.05%w/w。
[0827]
实施例2:吉卡宾钙盐水合物晶型1的溶解度研究
[0828]
将约20mg吉卡宾钙晶型1添加至5
×
2ml小瓶中。在5种溶剂中的溶解度使用溶剂添加法测试。溶剂包括丙酮、乙醇、乙酸乙酯、叔丁基甲基醚(t
‑
bme)和水。溶剂是以5体积(100μl)等分试样添加,直到溶解或已添加总共2ml为止。在每次添加之间,将样品加热至60℃(对于丙酮和t
‑
bme为40℃)。将在环境温度下24小时后剩余的任何固体通过x射线粉末衍射法(xrpd)分析。水样品溶解并且甚至在<5℃下48小时后不沉淀。表1示出溶解度研究的结果。
[0829]
表1.吉卡宾钙盐水合物晶型1的溶解度
[0830][0831][0832]
实施例3:无定形吉卡宾钙盐
[0833]
吉卡宾钙盐水合物晶型1如实施例1所述制备。称量约40g吉卡宾钙盐水合物晶型1。将约800ml水添加至其中并且在环境温度下混合以溶解。在约4小时后,发现固体已溶解并将溶液转移至2l圆底烧瓶中。接着将溶液冷冻,然后放置在冷冻干燥器上约72小时。对合并的大量材料的x射线粉末衍射法(xrpd)分析示出衍射图与参照无定形数据一致(图52a)。偏振光显微镜(plm)图像示出具有有限双折射的玻璃样粒子。热重分析(tga)示出在高达150℃下3.1%的重量减少(图52b)。在差热分析(dta)中或在示差扫描量热法(dsc)中未发现热事件(图52b和52c)。材料的水分含量通过karl
‑
fisher滴定法确定为2.62%。无定形吉卡宾钙盐通过配备有电雾式检测器的高效液相色谱(hplc
‑
cad)确定具有基于%w/w的88.85%的吉卡宾含量(%吉卡宾)。粒度分布(psd)分析获得5.2μm的d10值、26.4μm的d50值和60.3μm的d90值。
[0834]
大规模(大于1kg规模)的情况下,无定形形式通过干燥吉卡宾钙乙醇溶剂化物而获得。无定形固体由于静电性质和<0.3g/ml的相对低的堆密度(振实)而难以处置。
[0835]
实施例4:吉卡宾钙盐水合物晶型2的合成
[0836]
方法1.吉卡宾钙盐水合物晶型1如实施例1所述制备。将约160g吉卡宾钙盐水合物晶型1与约2.4l乙醇:水(90:10v/v%)溶液一起添加至保持在70℃的5l玻璃限流反应器中。接着将浆液使用4节距叶片聚四氟乙烯(ptfe)叶轮以120rpm混合约2小时。在2小时后,将另外824ml水添加至具有(67:33v/v)的乙醇:水溶剂比的浆液中。接着将混合物静置浆化约18小时。在18小时后,接着将容器冷却到40℃,并将搅拌速率降低至100rpm。在后者条件下保持结晶2小时,将容器排空,并且通过真空过滤分离浆液。接着将固体转移至结晶盘并在80℃干燥约48小时。回收到约69%的分离收率。将湿和干材料的样品通过x射线粉末衍射
(xrpd)光谱法分析(图53a),并确认为吉卡宾钙盐水合物晶型2。干燥的固体的偏振光显微镜(plm)图像示出具有有限双折射的聚集粒子。热重分析示出在高达200℃的4.1%的重量减少,其与溶剂损失相关(图53b)。在差热分析(dta)中在141℃开始以及在154℃的峰处记录到单一吸热事件,其有可能与溶剂损失相关(图53b)。母液通过高效液相色谱(hplc)确定具有18.47mg/ml的浓度。吉卡宾钙盐水合物晶型2被确定为具有86.91%w/w的吉卡宾含量(%吉卡宾)。材料的气相色谱分析示出61ppm的残余乙醇含量。进行粒度分布(psd)分析,并给出5.0μm的d10值、14.4μm的d50值和38.2μm的d90值。
[0837]
方法2.如以下实施例5中所述制备吉卡宾钙盐水合物晶型c3。吉卡宾钙盐水合物晶型c3在暴露于环境温度和湿度条件下时转变为吉卡宾钙盐水合物晶型2。
[0838]
实施例5:吉卡宾钙盐水合物晶型c3的合成
[0839]
吉卡宾钙盐的无定形形式如实施例3所述制备。将约50g无定形吉卡宾钙盐添加至大型结晶盘中。将约250ml乙醇以50ml等分试样添加至结晶盘中,在添加之间进行材料混合以确保均匀的溶剂分布。混合物在干燥期间混合数次,以使大的聚集物形成减至最少。接着将材料在环境温度在真空下干燥约72小时。x射线粉末衍射(xrpd)光谱法分析示出干燥的材料与吉卡宾钙盐水合物晶型c3一致。偏振光显微镜(plm)图像示出具有有限双折射的聚集粒子。热重分析示出在高达160℃的5.5%的重量减少(图54b)。在差热分析(dta)中在121℃开始以及在129℃的峰处记录到单一吸热事件(图54b)。示差扫描量热法(dsc)分析示出在31℃开始、在35℃的峰处的放热事件,接着在150℃开始、在167℃的峰处的单一吸热事件(图53c)。材料的水分含量通过karl
‑
fisher滴定而确定为2.1%。吉卡宾钙盐水合物晶型c3通过配备有电雾式检测器的高效液相色谱(hplc
‑
cad)确定具有基于%w/w的83.98%的吉卡宾含量(%吉卡宾)。气相色谱分析示出76070ppm的残余乙醇含量。粒度分布(psd)分析获得8.8μm的d10值、20.4μm的d50值和44.3μm的d90值。
[0840]
实施例6:吉卡宾钙盐乙醇溶剂化物的合成
[0841]
在70℃的5l玻璃限流反应器中,使用4节距叶片聚四氟乙烯(ptfe)叶轮将约266克吉卡宾溶解于约1l乙醇中。将约1当量氧化钙(约49.3g)和额外的1.5l乙醇以整份添加至溶液中。接着将所得浆液使用4节距叶片ptfe叶轮以150rpm混合约18小时。接着将反应器中的溶液冷却到25℃,并将温度保持恒定约1小时。接着以0.84升/小时(3.2体积/小时)的速率添加总共840ml叔丁基甲基醚(t
‑
bme)作为反溶剂。在添加后,将混合速率降低至120rpm,并将容器在这些条件下保持约2小时。在2小时后,通过真空过滤分离容器中形成的浆液。使用t
‑
bme洗涤液冲洗容器,然后洗涤固体。接着将所得的潮湿固体放入结晶盘中,并在环境温度下真空干燥约90小时,直到达到恒定重量。从放大试验回收到约63%的分离收率。将湿和干的材料样品通过x射线粉末衍射(xrpd)光谱法分析(图55a),并确认为结晶吉卡宾钙盐乙醇溶剂化物。干燥的固体的偏振光显微镜(plm)图像示出具有有限双折射的聚集粒子。热重分析示出在高达200℃4.9%的重量减少,其与溶剂损失相关(图55b)。在差热分析(dta)中在110℃开始且在137℃的峰处记录到单一吸热事件,其有可能与溶剂损失相关(图55b)。母液通过高效液相色谱(hplc)确定具有21.59mg/ml的浓度。结晶吉卡宾钙盐乙醇溶剂化物经确定具有90.51%w/w的吉卡宾含量(%吉卡宾)。材料的气相色谱分析示出28628ppm的残余乙醇含量和511ppm的残余t
‑
bme含量。进行粒度分布(psd)分析,并给出3.3μm的d10值、31.8μm的d50值和85μm的d90值。
[0842]
实施例7:吉卡宾钙盐水合物晶型c1、c2和c3(统称为吉卡宾钙盐水合物晶型c)的合成
[0843]
吉卡宾钙盐水合物晶型c1
‑
c3通过延长的干燥的方式获得,所述延长的干燥是将湿的无定形形式的吉卡宾钙盐水合物产物投入在80℃的温度的搅动的盘式干燥器中至少24小时,接着在高达100℃的更高温度24小时或更久。各种形式的晶型c(包括晶型c1、晶型c2和晶型c3)取决于干燥温度和干燥的持续时间而获得。
[0844]
实施例8:通过激光衍射确定粒度分布
[0845]
材料和方法
[0846]
通过激光衍射的粒度分布:粒度分布依照fraunhofer光衍射方法确定。将相干激光束通过样品并且将所得衍射图案聚焦在多元件检测器上。因为衍射图案尤其取决于参数中的粒度,所以粒度分布(psd)基于所测量的样品的衍射图案而计算。
[0847]
储备分散溶液通过添加几滴分散助剂(例如在石油溶剂油(例如span 80,fluka(85548
‑
250ml))中的1%w/w的清洁剂溶液)至适量的物质中,并小心混合而制得。接着将分散液缓慢地稀释至约10ml最终体积,同时涡旋。将仪器(配备有hydro 2000s样品分散单元的malvern mastersizer 2000)的悬挂槽用分散介质填充,并进行背景测量。将储备分散液添加至悬挂槽中,直到实现5%至15%的光学浓度为止。一旦开始测量,最终的光学浓度在内部超声步骤后增加并且不超过25%。累积体积分布依照仪器的指导手册确定。
[0848]
psd10、psd50和psd90值由每次测量的累积体积分布确定。小于10μm的值报告至小数点后一位。大于10μm的结果以个位的数值报告。用于分析的样品参数示出于下:
[0849][0850]
扫描电子显微镜:扫描电子显微照片使用fei phenom sem(利用5kv的加速电压)获得。制备用于成像的样品:将少量(约1mg
‑
10mg)样品使用一片双面碳胶带载置在铝制样品短棒上。将导电性金/钯涂层施加至样品以防止带电效应干扰成像过程。接着收集电子显微照片。可在每张显微照片的底部发现放大倍数、图像高度和刻度的微米条。
[0851]
具有各种粒度的吉卡宾钙盐水合物晶型1使用不同的研磨技术制得。将总共9个吉卡宾钙盐水合物晶型1样品(样品1
‑
9,表2)进行激光衍射粒度分析。通过激光衍射所确定的各样品的psd90示出于表2中。
[0852]
样品1至3(表2):这些样品通过在不同的条件下研磨样品5(表2)而制得。样品1通过使用fitzpatrick粉碎机型号l1a在高速(8946rpm)通过80目筛研磨样品5而制得。在研磨后的所得粒度具有约150μm的psd90。样品2通过使用针磨机进一步研磨样品1而制得。样品2的psd90为约75μm。样品3通过使用fitzpatrick粉碎机型号l1a在高速进一步研磨样品1而
制得。样品3的psd90为约110μm。
[0853]
样品4、5、6和9(表2):这些样品通过直接重结晶而制得(纯净的)。样品4和6各具有52μm的psd90。样品5和9也通过直接重结晶而制得;然而这些样品分别具有431μm和996μm的psd90。与其他两种纯净的样品相比而异常高的psd90可以通过其更高的特定杂质含量(例如2,2,7,7
‑
四甲基
‑
辛烷
‑
1,8
‑
二酸)和更高的残余溶剂量(例如乙醇)而解释。
[0854]
样品7和8:这些样品由通过纯净地沉淀而结晶,接着用针磨机研磨的各批吉卡宾钙盐水合物晶型而制得。
[0855]
表2:吉卡宾钙盐水合物晶型1的批次的psd90
[0856]
样品psd90(μm)1151276311045254316527628489996
[0857]
样品4(表2)的扫描电子显微照片如图2中所示。
[0858]
如下文实施例6和7中所述,样品1至4和6至8(表2)的吉卡宾钙盐水合物晶型1用于在流化床中通过湿法造粒生产药物产品片剂。无法由样品5和9(表2)制造片剂,因为粒度分布太大且粒子在流化床造粒中不流化。进一步,具有psd90小于约30μm的吉卡宾钙盐水合物晶型1由于静电性质和低的松密度而在配制过程中示出难度。
[0859]
实施例9:吉卡宾钙盐水合物晶型1的粉末衍射研究以及水和乙醇含量
[0860]
粉末x射线衍射(pxrd)使用panalytical x'pert粉末衍射仪(使用cukα辐射)进行。将样品载置在平坦的样品支架上。在环境条件下以0.004178
°
的扫描步长和在5
‑
45
°
2θ范围内以每一步长5.08秒的时间收集数据。在相同条件下收集背景并减去背景,主要留下样品的衍射。
[0861]
各pxrd图案使用gsas ii结晶学数据分析软件程序分析,所述程序利用峰值拟合函数。选择峰,并允许峰位置、强度和半全高(“fwhm”)自由精修。小的残余背景使用允许自由精修的5项多项式函数拟合。
[0862]
样品4和7(表2)的pxrd结果证明两个样品都是吉卡宾钙盐水合物晶型1(图28和29)。因此,粒度最小地影响衍射图案,并在研磨过程期间保留晶型1。水含量表示样品4和6
‑
8(表2)是单水合物,具有约3.5%w/w的水含量,相当于每摩尔吉卡宾钙盐约0.78当量水(表3)。相当于单水合物的水含量规格是2%w/w至5%w/w。具有55μm的psd90(样品10)和47μm的psd90(样品11)的两个其他的吉卡宾钙盐水合物晶型1样品的水含量在各样品中被确定为约3.7%w/w,其相当于每摩尔吉卡宾钙盐约0.82当量水。因此,具有47μm至62μm的范围内的psd90的吉卡宾钙盐水合物晶型1具有约3.5%w/w至约3.7%w/w的水含量,相当于每摩尔吉
卡宾钙盐约0.78至约0.82当量水。
[0863]
乙醇含量规格是少于5000ppm。例如,在样品4和6
‑
10中的乙醇含量经确定为710ppm至1840ppm的范围。
[0864]
样品4和6
‑
10的松堆密度是0.25g/ml至0.30g/ml的范围并且样品4和6
‑
10的振实堆密度是0.33g/ml至0.49g/ml的范围(表3)。
[0865]
表3:水和乙醇含量以及堆密度
[0866][0867][0868]
实施例10:吉卡宾钙盐水合物晶型1造粒
[0869]
来自表2的样品1
‑
4和6
‑
8中的每一个的吉卡宾钙盐水合物晶型1使用流化床造粒方法用赋形剂造粒。用于吉卡宾钙盐水合物晶型1造粒的样品批次配方示出于表4中。
[0870]
混合制剂
‑
颗粒内
[0871]
粘合溶液通过称量41.06kg纯化水,添加至不锈钢混合机中并混合而制得。混合进行约1.5至2.5小时。将羟丙基纤维素缓慢地添加至水中,同时混合。维持混合机速度使羟丙基纤维素充分混合而不产生泡沫。继续混合,直到羟丙基纤维素完全溶解并获得澄清的均匀溶液为止。
[0872]
校验喷雾泵以便以100至350g/分钟的速率递送羟丙基纤维素溶液。
[0873]
设定glatt 30流化床造粒机具有每小时500m3的加工空气体积、70℃的入口空气温度和45℃
±
10℃的排气温度。
[0874]
将吉卡宾钙盐水合物晶型1和乳糖单水合物以45r目筛研磨以去结块,例如用配备有圆形叶轮(45r筛;0.045”开口尺寸;圆形)的quadro comil 197ultra,并将材料捕捉在衬有双层聚乙烯袋的容器内。
[0875]
在预加热后,将去结块的吉卡宾钙盐水合物晶型1和乳糖单水合物投入流化床造粒机中。一旦粉末流体化开始,将粘合溶液喷雾在粉末上。在湿润粉末后,降低喷雾速率并调节空气体积,直到所有的粘合剂溶液被喷雾为止。调节入口空气体积以确保颗粒流体化,并将目标温度保持在约28℃。在施用所有的粘合剂溶液后,继续用水造粒以实现可接受的视觉造粒终点。将颗粒干燥至不超过2.0%的干燥损失(lod)值。
[0876]
喷雾粘合溶液的速率可取决于造粒规模等而改变。例如,对于22l造粒机/干燥转鼓大小规模,粘合剂的喷雾速率在前30至45分钟可为75至90g/min,接着的剩余时间可为50至65g/min,直到喷雾上理论量为止。进一步,若需要,可添加水以继续造粒,直到在干燥前
实现视觉上可接受的造粒为止。
[0877]
将从实施例8,表2的样品1
‑
4和6
‑
8所制备的散装干燥的造粒样品分别称为样品1g、2g、3g、4g、6g、7g和8g。
[0878]
将散装干燥的造粒样品1g、2g、3g、4g、6g、7g和8g分别通过39r目筛研磨,并收集在衬有双层聚乙烯袋的容器内(例如配备有圆棒叶轮的quadro comil 197ultra),分别提供样品1m、2m、3m、4m、6m、7m和8m。
[0879]
表4:吉卡宾钙盐水合物晶型1造粒样品制剂
[0880]
组分%w/w颗粒内 吉卡宾钙盐水合物晶型163.8乳糖单水合物fast
‑
flo 316nf23.4羟丙基纤维素(klucel ef)8.0
ꢀꢀ
颗粒外 交联羧甲基纤维素钠nf4.0硬脂酸镁nf0.8 总计:100
[0881]
混合制剂
‑
颗粒外
[0882]
将研磨的样品1m
‑
4m和6m
‑
8m投入v混合机中。将交联羧甲基纤维素钠通过20目手筛并与造粒一起投入v混合机中,并混合10分钟。将容纳硬脂酸镁组分的袋用造粒混合物冲洗。将混合物过滤通过20目筛,添加至v混合机中,并混合约3分钟。将最终造粒混合物排放至衬有双层聚乙烯袋的滚筒中,并密封。
[0883]
在进行压缩过程前,排出并称量完成的最终混合物。将基于样品1m
‑
4m和6m
‑
8m的排出的最终混合物分别称为样品1fb、2fb、3fb、4fb、6fb、7fb和8fb。
[0884]
实施例11:吉卡宾钙盐水合物晶型1的薄膜包衣片剂制剂
[0885]
将样品1fb
‑
4fb和6fb
‑
8fb压缩成300mg薄膜包衣片剂。样品片剂配方示出于表5中。
[0886]
表5:吉卡宾钙盐水合物晶型1的薄膜包衣片剂制剂
[0887][0888]
将样品1fb
‑
4fb中的每一个单独添加至配备有强制进料机的压片机中。样品1fb
‑
4fb分别依照表6中的指定参数压缩。将片剂重量和硬度调整至目标片剂重量和硬度,并且
通过金属检测器和片剂除尘器,并收集至衬有双层聚乙烯的袋中。
[0889]
将样品1fb、2fb、3fb、4fb、6fb、7fb和8fb在旋转式压片机上使用0.2759”x 0.6285”椭圆形工具压缩成470mg的理论填充重量。参见以下表6的压缩参数、批次重量变化和片剂特性。所有的片剂压缩完好且具有以片剂重量变化而言低的相对标准偏差(rsd)。由样品1fb、2fb、3fb、4fb、6fb、7fb和8fb所制备的片剂分别称为片剂a、b、c、d、f、g和h。
[0890]
表6:吉卡宾钙盐水合物晶型1的300mg薄膜包衣片剂的压缩参数和片剂特性
[0891]
[0892]
各批次为在实验vector coater ldcs仪器(片剂a
‑
c,表6)或gmp compu
‑
lab 24(片剂d,表6)中薄膜包衣。薄膜包衣悬浮液由opadry white ys 1
‑
7040和聚二甲基硅氧烷乳液30%usp所组成。
[0893]
将纯化水称量至不锈钢容器中,并混合以产生涡旋。将聚二甲基硅氧烷乳液和opadry white ys 1
‑
7040添加至纯化水中,并混合最少50分钟或直到悬浮液在视觉上为均匀的为止。片剂a
‑
d分别地分成两个批次,并称量用于包衣。将片剂投入加热至42℃(
±
2℃)的出口温度的包衣盘中。将片剂薄膜包衣至3.0%的重量增加(
±
1.0%)。在各批次喷雾90%的薄膜包衣悬浮液理论量后,检查平均重量,并继续喷雾以实现2.0%至4.0%的重量增加。允许片剂干燥和冷却。将片剂包装在衬有双层聚乙烯袋的配衡容器中。
[0894]
薄膜包衣片剂f
‑
h通过用于制造片剂d的相同方法制备。
[0895]
实施例12:吉卡宾钙盐无定形形式的造粒
[0896]
利用吉卡宾钙盐的无定形形式制备实验室规模的造粒批次。实验室规模的流化床造粒设备为经配置用于顶喷雾工艺的freund
‑
vector mfl
‑
01实验室流化床加工器,其为用于临床批次造粒的缩小型glatt设备。表7a给出片剂制剂的定量理论组合物和实验室规模批次尺寸。
[0897]
表7a.吉卡宾未包衣片剂(300mg)的组成
[0898][0899]1吉卡宾钙和乳糖针对各片剂调整从而提供其量为相当于300mg吉卡宾的摩尔当量的吉卡宾钙盐的无定形形式;
[0900]2在加工过程中去除水,并且不计入批次重量或片剂重量中;
[0901]3颗粒外组分量基于预期的造粒收率而调整。
[0902]
高效液相色谱(hplc)指示无定形吉卡宾钙含有80.9%(w/w)摩尔当量的吉卡宾。因此,投入批次中的无定形吉卡宾钙的量通过所述因子调整,得到92.71g无定形吉卡宾钙,其配量使乳糖单水合物量相应减少至9.75g。将无定形吉卡宾钙使用#40目筛(425μm)过筛以形成用于造粒工艺的均匀的粉末,并将92.72g过筛材料分配至造粒器中。堆密度和振实密度测试、以及通过激光衍射的粒度分析使用过量的过筛材料进行。堆密度和振实密度测试依照usp<616>使用100ml量筒进行。激光衍射粒度分析使用cilas 1180ld激光衍射粒度分析仪,通过如实施例8所述用于吉卡宾钙盐水合物晶型1的干粉末分散方法进行(还参见
表7b的激光衍射粒度分析条件)。表7c报告物理测试结果。粒度结果报告为体积分布的三次重复测量的平均值,并且图30显示由所述三次测量所获得的粒度分布的覆盖图。
[0903]
表7b.使用cilas 1180ld的粒度分析条件
[0904]
分析参数值分析模式干粉末光学模型fraunhofer分散介质空气分散介质ri1.000粉末分配器频率(hz)50粉末分配器功率(%)90料斗间隙设定2分散空气压力(mb)3000背景测量(秒)10样品测量(秒)10样品尺寸(mg)500
[0905]
表7c.无定形吉卡宾钙的粒度和密度
[0906][0907]
将无定形吉卡宾钙和乳糖单水合物投入流化床膨胀室内,并允许使用每分钟50l(lpm)的工艺气流混合2分钟。接着将流化床进料通过添加由水和羟丙基纤维素(ef)所组成的造粒溶液造粒。将所述溶液从流化床空气雾化喷雾嘴通过雾化喷雾分配至造粒机中。目标造粒工艺参数由大规模造粒工艺按比例用于mfl
‑
01流化床。表7d报告目标加工参数。
[0908]
表7d.freund
‑
vector mfl
‑
01流化床的目标造粒参数
[0909][0910]
[0911]
添加造粒流体至无定形吉卡宾钙,导致无定形吉卡宾钙粒子的大量聚集。评估以原始的5g/min的目标速率的50%、37%和24%的造粒流体添加速率,以试图防止聚集。然而,聚集随着任何添加的造粒流体量而持续并恶化。当聚集量增加时,则工艺空气体积持续增加以维持粉末床流体化。更高的工艺空气体积与更慢的造粒流体添加速率似乎也没有减少聚集问题。在更高的气流和更低的喷雾速率下持续聚集可能起因于大量的已存在于粉末床中的大聚集物,或可能表明任何量的水性造粒流体都会引起过度聚集,即使粉末床快速干燥。低的喷雾速率与高的气流的组合通常导致造粒流体快速干燥、减少粉末表面暴露于溶剂的时间并影响聚合物粘合剂的快速沉积。这些条件降低聚集的可能性,然而由于极低密度的无定形吉卡宾钙,所以不可能在不强制所有的药物粒子从喷雾区排出且进入过滤器的情况下以高的工艺空气体积开始流化床造粒工艺。得出的结论是,本研究中评估的无定形吉卡宾钙的溶解度和密度特征不利于使用目前的配方和方法造粒。
[0912]
实施例13:从具有各种psd90值的吉卡宾钙盐水合物晶型1制备的吉卡宾薄膜包衣片剂(300mg)的溶出曲线
[0913]
溶解:吉卡宾钙盐水合物晶型1的300mg薄膜包衣片剂a
‑
d和f
‑
h的吉卡宾溶出曲线使用设定至50rpm的usp装置2(桨叶)在900ml ph 5.0乙酸钾(50mm)缓冲液中测量(usp<711>)。各溶出%时间点使用210nm检测波长通过hplc量化(图1a、图1b和表8)。示出平均溶出的图1a和1b证明吉卡宾钙盐水合物晶型1的粒度分布确实影响立即释放片剂的吉卡宾溶出曲线。从分别具有151μm和110μm的psd90的吉卡宾钙盐水合物晶型1制造的片剂(薄膜包衣片剂a和c)示出比分别具有76μm和52μm的psd90的吉卡宾钙盐水合物晶型1所制备的片剂(薄膜包衣片剂b和d)明显更低的释放曲线。特别地,当与薄膜包衣片剂b和d的溶出%相比时,用薄膜包衣片剂a和c在20、30和45分钟的平均%释放值更低。例如,用薄膜包衣片剂a和c在45分钟检测的吉卡宾的量比从具有更小的粒度的吉卡宾钙盐水合物晶型1制造的片剂(薄膜包衣片剂b和d)的所述吉卡宾的量低约8%至15%。从分别具有62μm和48μm的psd90的吉卡宾钙盐水合物晶型1制造的薄膜包衣片剂g和h示出更有利的吉卡宾溶出曲线,在10分钟具有几乎40%的平均释放,并且在30分钟具有基本上100%的平均释放。同时,当使用纯净的药物物质吉卡宾钙盐水合物晶型1时(仅重结晶),吉卡宾溶出曲线示出更低的释放曲线。
[0914]
表8.吉卡宾钙盐晶型1的psd90及其对应的立即释放300mg薄膜包衣片剂的吉卡宾溶出曲线
[0915][0916]
溶出介质(50mm乙酸钾):其通过将245g乙酸钾溶解至等分的去离子水中。将等分试样转移至50l大瓶中并稀释至体积。使用冰醋酸调整ph至5.0
±
0.05。溶出介质使用氦气喷雾或其他适合的方式脱气。
[0917]
标准物:一式两份将39mg吉卡宾准确地称量并转移至100ml容量瓶中,接着溶解在约10ml乙腈(acn)中。若必要,使用超声溶解吉卡宾。将吉卡宾溶液以溶出介质稀释至体积。
[0918]
溶出参数:
[0919][0920]
操作参数:
[0921]
a)将模具桨叶设定至50rpm的旋转速度;
[0922]
b)将各容器以900ml溶出介质填充;
[0923]
c)随机选择6个片剂,并记录各片剂的重量;
[0924]
d)将各片剂放在日式浸渍筐内部;
[0925]
e)当桨叶在桨叶的顶端与流体的顶端之间的中途以及在容器的轴与侧面之间的中途旋转时,使用校准的温度计测量在中心容器之一中的温度。温度应为37℃
±
5℃;
[0926]
f)将一个片剂以准确的定时间隔放入浸渍筐内,以允许适当的采样时间;
[0927]
g)将2ml等分样品使用适当的注射器和配备有45μm过滤针尖的不锈钢套管抽取至hplc小瓶中。在容器的侧面与桨叶之间的半途以及在桨叶的顶端与流体表面之间的半途抽采样品。采样时间为10、20、30、45、60和/或75分钟。
[0928]
色谱法程序:
[0929]
a)平衡hplc系统,直到实现稳定基线为止;
[0930]
b)注射一次溶出介质;
[0931]
c)注射至少5次重复的运行标准物;
[0932]
d)注射至少一次检查标准物;
[0933]
e)注射样品溶液;
[0934]
f)在整个运行期间穿插注射运行标准物,即每12个样品归成同一类样品;
[0935]
g)注射最终的运行标准物。
[0936]
用于溶出的hplc参数:
[0937]
柱:agilent zorbax sb
‑
cl8;4.6mm
×
150mm;3.5微米粒度。
[0938][0939]
计算:
[0940]
各时间点的样品溶液浓度(mg/ml)如下或通过使用经验证的软件(例如openlab或等同物)计算。
[0941][0942]
在溶出介质(ph 5.0乙酸钾)中检测的吉卡宾(mg)是“释放的吉卡宾”,各容器的所述量如下或使用经验证的软件(例如datacal、openlab或等同物)计算。
[0943]
释放的mg=un
×
[vdf
‑
(n
‑
1)va]+va
×
(来自先前的时间点的浓度总和)
[0944]
其中:
[0945]
n=采样时间点(抽样数量)
[0946]
un=在时间点n的样品溶液浓度
[0947]
va=在各时间点从溶出试验取得的等分样品(以ml计)
[0948]
vdf=最初的溶出流体体积
[0949]
释放百分比的计算如下确定:
[0950][0951]
*吉卡宾钙盐水合物晶型1的各300mg薄膜包衣片剂包含吉卡宾钙盐水合物晶型1,其量为相当于300mg吉卡宾的摩尔当量。
[0952]
未包衣片剂a以及薄膜包衣片剂a
‑
d和f
‑
h的溶出数据示出于下表中,分别为:表8a和8b、表9、表10、表11、表12、表13和表14,其中吉卡宾的释放通过以上述hplc方法所测量的吉卡宾量确定。片剂a
‑
d和f
‑
h的吉卡宾溶出曲线示出于图1a中并且薄膜包衣片剂b
‑
d的吉卡宾溶出曲线分别示出于图1b中。
[0953]
薄膜包衣片剂b、d和f
‑
h的吉卡宾溶出曲线比包含分别具有更高的psd90(151μm和110μm)的吉卡宾钙盐水合物晶型1的片剂a和c的吉卡宾溶出曲线更有利。不受任何理论的束缚,据信更有利(快速)的吉卡宾溶出曲线是具有良好的生物利用度的片剂的有用指标。进一步,不可预期的是包含具有110μm的psd90的吉卡宾钙盐水合物晶型1的片剂c具有明显更慢的吉卡宾溶出曲线。
[0954]
表8a:片剂a核心(无包衣)的溶出
[0955][0956]
表8b:片剂a(有薄膜包衣)的溶出
[0957][0958][0959]
表9:片剂b(有薄膜包衣)的溶出
[0960][0961]
表10:片剂c(有薄膜包衣)的溶出
[0962][0963]
表11:片剂d(有薄膜包衣)的溶出
[0964][0965][0966]
表12:片剂f(有薄膜包衣)的溶出
[0967][0968]
表13:片剂g(有薄膜包衣)的溶出
[0969][0970][0971]
表14:片剂h(有薄膜包衣)的溶出
[0972][0973]
实施例14:吉卡宾钙盐水合物晶型1薄膜包衣片剂的含量均匀度
[0974]
含量均匀度测定:依照usp<905>使用hplc测试片剂的含量均匀度。
[0975]
确定吉卡宾钙盐水合物晶型1的300mg薄膜包衣片剂(参见实施例13)的含量均匀度。单独称量10个片剂(例如来自片剂a的组)并记录重量。对于各测试,将1个片剂放入200ml容量瓶中。将烧瓶以水:乙腈:甲酸(60:40:0.1;流动相a)溶液填充约一半,通过超声溶解,并偶尔搅拌。使溶液涡旋,并平衡至室温。将溶液以流动相a稀释至体积并搅拌均匀。将约5ml溶液通过0.45μmptfe(聚四氟乙烯)25mm过滤器过滤,弃置前5ml并且将剩余物收集在hplc小瓶中。
[0976]
样品溶液通过hplc相对于灵敏度溶液、运行标准物、检查标准物、标记溶液和流动相a空白进行评估。使用经验证的hplc系统软件收集数据。含量均匀度结果在所有的批次中均一致,并且未出现受吉卡宾钙盐水合物晶型1的粒度分布的影响。
[0977]
操作参数:
[0978]
流速:1.0ml/min运行时间:60分钟自动采样器温度:环境柱温:40℃注射体积:50μl检测:214nm下uv流动相a:60:40:0.1水:乙腈:甲酸流动相b:10:90:0.1水:乙腈:甲酸
[0979]
用于溶解研究的hplc系统:
[0980]
柱:waters symmetry c18 3.5μm,4.6mm
×
150mm,部件编号(part no.)wat 200632或等同物。
[0981]
梯度:
[0982][0983]
吉卡宾运行/检查标准物:将一式两份的约60.0mg吉卡宾参照标准物称量至25ml容量瓶中,并用流动相a稀释至体积,得到2.4mg/ml的浓度(以游离二酸表示)。
[0984]
灵敏度溶液:将1.0ml吉卡宾工作或检查标准物转移至100ml容量瓶中,用流动相a稀释至体积,并搅拌均匀。将1.0ml此溶液转移至20ml容量瓶中。对于1.2μg/ml吉卡宾的标称浓度,用流动相a稀释至体积,并搅拌均匀。
[0985]
计算:含量均匀度基于以下公式计算:
[0986][0987]
其中:pasmp=吉卡宾的峰面积
[0988]
df=样品的稀释因子
[0989]
c=运行标准物浓度mg/ml(以吉卡宾表示)
[0990]
p=参照标准物的纯度因子
[0991]
pastd=在所有运行标准物注射液中的吉卡宾的平均峰面积
[0992]
n=添加至烧瓶中的片剂数量
[0993]
*各吉卡宾钙盐水合物晶型1的300mg薄膜包衣片剂包含吉卡宾钙盐水合物晶型1,其量为相当于300mg吉卡宾的摩尔当量,在各测试的300mg片剂中的吉卡宾钙盐的理论吉卡宾摩尔当量。
[0994]
表15:含量均匀度分析结果
[0995]
[0996][0997]
实施例10的每次造粒不会太湿或需要添加水来完成。每次造粒产出具有例外的流动性质的混合物和具有低的易碎性的适当硬度的片剂。因此,以更大的批量施行可能需要进一步的优化。
[0998]
含量均匀度测试对来自所有造粒的片剂示出低的rsd和可接受的允收值(av)(表15)。粒度的效果反映在片剂的吉卡宾溶出曲线中。例如,由具有110μm的psd90(片剂c)和151μm的psd90(片剂a)的吉卡宾钙盐水合物晶型1所制备的片剂在45分钟时间点示出比具有40μm至约75μm的psd90值的吉卡宾钙盐水合物晶型1所制备的片剂慢8%
‑
15%的释放。这是显著的降低并且提供与其他片剂不同的曲线。
[0999]
进一步,测量三个不同批号的用具有50
‑
65μm的psd90的吉卡宾钙盐水合物晶型1所制备的300mg片剂的含量均匀度和溶出性质,如表16中所示。
[1000]
表16.用吉卡宾钙盐水合物晶型1制备的300mg薄膜包衣片剂的含量均匀度和溶出特性
[1001][1002][1003]
实施例15:吉卡宾钙盐水合物晶型2、吉卡宾钙盐水合物晶型c3和吉卡宾钙盐乙醇溶剂化物造粒,未包衣片剂的形成以及未包衣片剂的包衣
[1004]
使用基于实施例10中公开的方案和实施例12中描述的设备序列的流化床造粒工艺,但具有如下所述的修改,将吉卡宾钙盐水合物晶型2(来自实施例4)、吉卡宾钙盐水合物晶型c3(来自实施例5)和吉卡宾钙盐乙醇溶剂化物(来自实施例6)与赋形剂一起造粒。表17示出了吉卡宾钙盐水合物晶型2造粒的样品批次配方。表18示出了吉卡宾钙盐水合物晶型c3造粒的样品批次配方。表19示出了吉卡宾钙盐乙醇水合物造粒的样品批次配方。
[1005]
造粒
[1006]
表17.吉卡宾钙盐水合物晶型2未包衣片剂(300mg)的组成
[1007][1008]
表18.吉卡宾钙盐水合物c3晶型未包衣片剂(300mg)的组成
[1009][1010]
表19.吉卡宾钙盐乙醇溶剂化物未包衣片剂(300mg)的组成
[1011][1012]1由于吉卡宾钙盐乙醇溶剂化物晶型的测定值为63.7%,因此将颗粒内乳糖量调整为零并且将每个片剂的造粒量调整为508.6mg,得到最终片剂重量为531.2mg。
[1013]
对于每种吉卡宾钙多晶型物(例如,晶型2、晶型c3和乙醇溶剂化物),根据其游离酸测定法调整分配给该批次的吉卡宾钙的量,以得到最终片剂的吉卡宾钙多晶型物的量为相当于300mg吉卡宾(二酸)的摩尔当量。通过穿过#40目筛使吉卡宾钙多晶型物去结块,并从筛分的材料中分配调节量。然后,通过理论吉卡宾钙量与调整后的分配的吉卡宾钙多晶型物量之间的差减少分配给该批次的乳糖单水合物nf的量。将分配量的乳糖单水合物nf穿过#20目筛,并在vector mfl.01micro
‑
flow包衣机流化床造粒机/干燥机的转鼓中与分配量的吉卡宾钙组合。表17
‑
19报告了分配给每个批次的材料的实际量。
[1014]
通过经由顶部喷雾喷嘴添加5%(w/w)羟丙基纤维素nf溶液来将每种吉卡宾钙多晶型物造粒。目标造粒参数列于表20,但是根据各种多晶型物的物理特性,每批的参数有所不同。表21总结了每批使用的实际参数。
[1015]
添加全部量的颗粒内材料后,取出颗粒样品进行干燥失重(lod)测量,并且使其余颗粒在产品温度为37℃下干燥,最终lod不超过(nmt)2%。表21中给出了每批在最终干燥后添加颗粒内材料之后获得的lod值。使用mettler toledo hb43
‑
s水分天平进行造粒的过程中lod测试。2.5g
‑
3.5g的样品在105℃下干燥10分钟。lod报告为重量损失除以初始样品重量。
[1016]
由吉卡宾钙盐水合物晶型2(来自实施例4)、吉卡宾钙盐水合物晶型c3(来自实施例5)和吉卡宾钙盐乙醇溶剂化物(来自实施例6)制备的干燥的颗粒状样品分别称为样品f2
‑
g、c3
‑
g和es
‑
g。
[1017]
表20.目标造粒参数
[1018]
参数目标值入口温度70℃产物温度30℃空气流量30
‑
50升/分钟溶液流速2
‑
5g/min
雾化压力10psi
[1019]
表21.造粒和干燥工艺参数
[1020]
参数晶型2晶型c3乙醇溶剂化物入口温度(℃)68.3
‑
70.169.9
‑
74.869.8
‑
74.9产物温度
‑
造粒(℃)22.3
‑
34.020.7
‑
30.822.0
‑
38.8空气流量(l/min)5043
‑
5145
‑
149平均1溶液流速(g/min)0.650.780.8雾化压力(psi)101010总造粒时间(h)9.66746流体添加后的lod0.98%1.40%4.13%产物温度
‑
干燥29.6
‑
37.033.036.3
‑
37.4总干燥时间(min)15740干燥后的最终lod0.49%0.48%2.38%
[1021]1平均溶液喷雾速率计算为喷雾的总造粒溶液除以总造粒时间。这不考虑处理过程中的工艺停机和喷涂周期的循环。将流体添加速率设置为30rpm泵速,相当于~1.5毫升/分钟,同时喷雾造粒流体。
[1022]
由于吉卡宾钙盐水合物晶型2、吉卡宾钙盐水合物晶型c3和吉卡宾钙盐乙醇溶剂化物(在本实施例中统称为“吉卡宾钙多晶型物”)的小批量和低密度,使用特别低的空气流量进行造粒工艺。这导致较低的干燥效率,并且要求将造粒溶液添加循环打开和关闭以维持目标产物温度并防止造粒基质过度润湿。改变造粒溶液添加的开启和关闭时间以维持目标产物温度,但是通常包括将造粒溶液喷雾2
‑
3分钟,然后在不喷雾的情况下进行1.5
‑
2分钟以使产物温度升高。
[1023]
vector mfl.01micro
‑
flo涂布机流化床造粒机由一个钢制产品转鼓和一个玻璃膨胀室组成。吉卡宾钙的低密度性质使得吉卡宾钙多晶型物在玻璃膨胀室壁上持续积累,需要每20
‑
30分钟进行常规工艺停机,以将壁上的粉末刷回到粉床中。
[1024]
在研磨之前,对每种干燥颗粒的堆密度、振实密度和粒度分布进行评估。经由筛分分析评估粒度分布。
[1025]
粒度分布筛分分析
[1026]
颗粒和最终压片共混物的粒度分布是通过根据usp<786>使用超声筛分器和由美国标准#20、#40、#60、#80、#100和#200目筛组成的筛子系列进行分析筛分来测量。
[1027]
表22报告了样品f2
‑
g、c3
‑
g和es
‑
g的密度数据。
[1028]
表22.研磨前样品f2
‑
g、c3
‑
g和es
‑
g的密度
[1029][1030]
样品es
‑
g形成了最粗糙的颗粒,其中78.8%的颗粒大于250μm。样品f2
‑
g的密度和
可压缩性/流动性与样品es
‑
g相似,但是样品f2
‑
g的粒度分布显著更细,其中77.2%的颗粒小于250μm。样品c3
‑
g显示出最低的密度、最高的可压缩性、最差的流动性和最细的粒度分布,其中69.5%的颗粒小于180μm。
[1031]
造粒之前,样品f2
‑
g的密度和流动特性与吉卡宾钙盐水合物晶型1和吉卡宾钙盐水合物晶型2相当。
[1032]
研磨
[1033]
将样品f2
‑
g、c3
‑
g和es
‑
g进行大小调整,然后再进行共混,以使用手工筛选过程压片。将样品f2
‑
g、c3
‑
g和es
‑
g中的每一者都通过一个#30目(600μm)筛子,以近似于使用配备032r筛网和1601叶轮的comil研磨材料所期望的粒度减小,分别提供样品f2
‑
m、c3
‑
m和es
‑
m。研磨操作后,对每个颗粒的堆密度、振实密度和粒度分布(经由筛分分析)进行评估。表23报告了样品f2
‑
m、c3
‑
m和es
‑
m的密度数据。
[1034]
表23.样品f2
‑
m、c3
‑
m和es
‑
m的密度
[1035][1036]
研磨后,样品es
‑
m的密度增加,而其可压缩性/流动性(基于卡尔指数)保持相对不变(将表23的样品es
‑
m与表22的样品es
‑
g进行比较)。研磨后样品f2
‑
g和c3
‑
g的密度和可压缩性/流动性在很大程度上保持不变(分别将表22的样品f2
‑
g与表23的样品f2
‑
m进行比较,并将表22的样品c3
‑
g与表23的样品c3
‑
m进行比较)。类似地,可见研磨后的粒度分布与研磨前存在相同的总体趋势。尽管粒度分布略有变化,但样品es
‑
m的大部分质量仍在>250μm的颗粒中,并且样品c3
‑
m的粒子最细,而样品f2
‑
m处于中间。
[1037]
共混
[1038]
通过将样品f2
‑
m、c3
‑
m和es
‑
m与颗粒外交联羧甲基纤维素钠共混,然后与硬脂酸镁进行润滑共混来制备压片共混物(参见表17
‑
19,“颗粒外材料”)。将交联羧甲基纤维素钠通过#20目筛子,并转移到含有样品f2
‑
m、c3
‑
m或es
‑
m的共混容器中。将容器密封并放置在t2c型turbula混合器(willy abachofen ag)上并共混20分钟。然后使硬脂酸镁通过#40目筛,并加入到共混容器中并再共混5分钟。
[1039]
用样品f2
‑
m、c3
‑
m和es
‑
m制备的压片共混物分别称为样品f2
‑
fb、c3
‑
fb和es
‑
fb。将颗粒外赋形剂的量调节至研磨造粒的最终收率,以提供每剂量单位18.8mg交联羧甲基纤维素钠和3.76mg硬脂酸镁(参见表17
‑
19)。对于样品f2
‑
fb和c3
‑
fb,每剂量单位交联羧甲基纤维素钠和硬脂酸镁的量转换为预期的4%(w/w)交联羧甲基纤维素钠和0.8%(w/w)硬脂酸镁的浓度。但是,由于吉卡宾钙盐乙醇溶剂化物的效能相对较低,鉴于其高乙醇含量,需要508.6mg的样品es
‑
fb才能达到目标效能(相当于300mg吉卡宾(二酸)的摩尔当量),其已经超过了470mg的目标片剂重量。在该实施例中,术语“效能”是指给定组合物中按重量%计的吉卡宾(二酸)的摩尔当量。吉卡宾钙盐乙醇溶剂化物具有较高的乙醇和水含量,因此吉卡宾钙盐乙醇溶剂化物的总重量中只有63.7%归因于吉卡宾。因此,吉卡宾钙盐乙醇溶剂
化物的效能低于吉卡宾钙盐水合物晶型2或晶型c3。因此,在从样品es
‑
fb制备的片剂中,每剂量单位18.8mg交联羧甲基纤维素钠和3.76mg硬脂酸镁分别等于3.54%和0.7%的浓度。
[1040]
通过筛分分析对样品f2
‑
fb、c3
‑
fb和es
‑
fb的堆密度、振实密度、flodex流动性和粒度分布进行了测量。表24报告了密度和流动性测试结果。样品f2
‑
fb、c3
‑
fb和es
‑
fb的密度、流动性和粒度分布与其对应的研磨颗粒、样品f2
‑
m、c3
‑
m和es
‑
m相比保持相对不变。
[1041]
表24.样品f2
‑
fb、c3
‑
fb和es
‑
fb的密度和流动性
[1042][1043]
片剂压缩
[1044]
样品f2
‑
fb、c3
‑
fb和es
‑
fb在用0.2756”x0.6250”改进的椭圆形工具加工的单平台flexitab压片机上进行压缩。以目标片剂重量470mg和目标硬度16kp压缩样品f2
‑
fb和c3
‑
fb。由于吉卡宾钙盐乙醇溶剂化物的低效能,鉴于其高乙醇含量,因此由样品es
‑
fb制备的片剂的目标片剂重量为531mg,同时保持了相同的16kp目标硬度。表25报告了平均压缩力和片剂物理测试(重量、厚度和硬度变化)的结果。由样品f2
‑
fb、c3
‑
fb和es
‑
fb制备的片剂分别称为片剂f2、c3和es。如实施例11所述,片剂c3(包含吉卡宾钙盐水合物晶型c3)不同于片剂c(包含吉卡宾钙盐水合物晶型1)。
[1045]
表25.未包衣片剂f2、c3和es的平均压缩力和物理测量
[1046][1047]
由于样品c3
‑
fb的低密度和次优流动特性,在压缩期间会经历维持目标片剂重量的一些困难。由样品c3
‑
fb压缩的片剂经过100%重量分选,并且仅保留447mg
‑
493mg的可接受重量范围内的片剂用于进一步处理和测试。表25中关于片剂c3报告的片剂物理数据是从可接受的片剂中产生的,因此并不代表在从样品c3
‑
fb进行片剂压缩期间经历的真实重量变化。
[1048]
片剂包衣
[1049]
未包衣片剂f2、c3和es用白色立即释放的基于羟丙甲纤维素的包衣材料
的单一包衣包覆至目标重量增加为3%。ys
‑1‑
7040white是由羟丙甲纤维素、聚乙二醇、二氧化钛和滑石组成的全配方涂料体系。将片剂在配备有2.5l完全穿孔包衣锅的vector ldcs片剂包衣机中进行包覆。由于每批生产的片剂量很少,因此将安慰剂片剂芯添加到包衣锅中,以使片剂床堆积至1l的总体积。使用了7/16”圆形标准凹面安慰剂芯,因此它们可容易地与活性片剂区分开。表26报告了每个批次的包衣参数,并且表27报告了薄膜包衣片剂f2、c3和es的理论定量片剂组成。
[1050]
表26.片剂包衣参数
[1051] 片剂f2片剂c3片剂es入口空气温度(℃)57.0
‑
59.358.0
‑
58.558.7
‑
59.1排出空气温度(℃)44.4
‑
46.445.3
‑
46.042.0
‑
46.1空气流量(cfm)858585锅速度(rpm)202020雾化空气(psi)252525模式空气(psi)303030溶液喷雾速率(g/min)6
‑
777总包衣时间(min)432121目标片剂重量增加(mg)141416实际最终重量增加(mg)151617.1实际最终重量增加(%)3.23.43.2
[1052]
表27.薄膜包衣片剂f2、c3和es的组成
[1053]
[1054]1对于片剂f2:吉卡宾钙盐水合物晶型2。对于片剂c3:吉卡宾钙盐水合物晶型c3。对于片剂es:吉卡宾钙盐乙醇溶剂化物
[1055]
实施例16:包含吉卡宾钙盐多晶型物的未包衣和包衣片剂(300mg)的吉卡宾溶出曲线
[1056]
使用紫外/可见(uv/vis)光吸收法评估了片剂的吉卡宾溶出曲线,所述方法中溶解介质中溶解的吉卡宾是直接在溶解容器内测量的。这种分析方法允许在多个紧密间隔的采样间隔中实时测量吉卡宾的溶出。与实施例13中使用的hplc分析方法获得的溶出曲线相比,该方法提供了更高分辨率的溶出曲线,并允许检测各种吉卡宾钙多晶型物之间的溶出特性差异。
[1057]
为了验证uv/vis分析方法与基于hplc的测试方法的可比性,比较了每种方法使用薄膜包衣片剂d产生的吉卡宾溶出曲线(参见实施例11)。图56比较了使用这两种方法生成的吉卡宾溶出曲线,并且表28报告了使用两种分析方法进行的n=6溶出度测试的吉卡宾溶出曲线和rsd%。
[1058]
使用usp装置2(桨叶)在50rpm下(usp<711>),在900ml的50mm乙酸钾(ph 5.0)中生成吉卡宾溶出曲线。使用路径长度为10mm的pion rainbow光纤溶解监测系统对溶解的吉卡宾进行定量。每10秒从六个溶出容器中的每一个收集吸收光谱。将光谱作为二阶导数进行处理,并在216nm至230nm的范围内积分,以相对于由吉卡宾钙盐水合物晶型1制备的标准曲线进行定量。
[1059]
表28.经由uv/vis分析和hplc分析的薄膜包衣片剂d的溶解测试结果(n=6)
[1060][1061][1062]
该比较结果证明了两种溶出定量方法之间的等效性,并表明可对两种方法产生的数据进行有效的比较。在通过uv/vis方法获得的溶出数据中,可见rsd%值略高。这是典型的,因为pion rainbow分光光度计对溶解介质中的未溶解颗粒敏感。如果在测量期间光路中有未溶解的粒子,则光会被阻挡或反射,从而使溶解的吉卡宾产生更高或更低的吸附外观。由于这些事件是随机的,因此得到准确的平均值,但存在较大的方差。
[1063]
在图57a中比较了薄膜包衣片剂d、f2、c3和es(平均n=6)的吉卡宾溶出曲线。各种吉卡宾钙多晶型物之间的吉卡宾溶出速率有明显差异。吉卡宾钙盐水合物晶型2和吉卡宾钙盐水合物晶型c3具有相似、几乎相同、非常快速的溶解速率。吉卡宾钙盐乙醇溶剂化物具有最慢的溶解速率,并且吉卡宾钙盐水合物晶型1显示出中间物分布。
[1064]
对于片剂f2、c3和es,评估了片剂包衣对溶出度的影响。图58绘制了薄膜包衣和未包衣的片剂f2、c3和es的吉卡宾溶出曲线。图59
‑
61分别比较了薄膜包衣和未包衣的片剂f2、c3和es的吉卡宾溶出曲线。表29报告了薄膜包衣和未包衣的片剂f2、c3和es在5、10、20、
30、45和60分钟的时间点的溶出结果。
[1065]
表29.经由uv/vis分析的溶出测试结果(n=6)
[1066][1067][1068]
薄膜包衣对缓慢溶解的片剂es的吉卡宾溶出曲线几乎没有影响。然而,薄膜包衣稍微延迟了溶解较快的片剂f2和c3的溶出。尽管片剂f2和c3中的薄膜包衣速率不影响溶出速率(通过大致平行的曲线证明),但与未包衣片剂f2和c3相比,薄膜包衣片剂f2和c3显示出吉卡宾溶出开始延迟1分钟和20秒。
[1069]
图57b叠加了图1a和图57a的溶出曲线图。与由具有介于35μm至约75μm之间的psd90的吉卡宾钙盐水合物晶型1制备的片剂相比,在这项研究中评估的吉卡宾钙多晶型物产生的溶解速率慢得多(在薄膜包衣片剂es的情况下)或快得多(薄膜包衣片剂f2和c3)。
[1070]
实施例17:由吉卡宾钙盐多晶型物制备的薄膜包衣吉卡宾片剂(300mg)的表征
[1071]
吉卡宾测定和相关化合物
[1072]
通过hplc测试了薄膜包衣片剂f2、c3和es的吉卡宾和相关化合物。测试结果提供于表30。
[1073]
操作参数:
[1074]
[1075][1076]
梯度:
[1077][1078]
表30.薄膜包衣片剂的hplc测定
[1079][1080]
水分含量
[1081]
通过karl fischer滴定分析了薄膜包衣片剂f2、c3和es的水分含量。水分含量结果提供于表31。
[1082]
使用mettler toledo c20库仑滴定仪通过根据usp<921>方法ic的karl fischer滴定(库仑滴定)测定最终包衣片剂的水分含量。
[1083]
表31.根据karl fischer(kf)的薄膜包衣片剂的水分含量
[1084][1085]
薄膜包衣片剂f2和c3显示出类似于用psd90介于35μm至约75μm之间的吉卡宾钙盐水合物晶型1制备的片剂的水分含量。鉴于干燥后的吉卡宾钙盐乙醇溶剂化物颗粒的检出限(lod)值(2.38%,表21),片剂es相对较高的水分含量表明,吉卡宾钙盐乙醇溶剂化物在晶格中含有乙醇和水分子。考虑到干燥颗粒的2.38%lod是未结合的水,并且吉卡宾钙盐乙醇溶剂化物结晶形式的报告乙醇含量被报告为2.86%(28,628ppm),因此认为片剂es的吉卡宾钙:水:乙醇比为约2:4:1。
[1086]
x射线粉末衍射分析
[1087]
将样品f2
‑
fb、c3
‑
fb和es
‑
fb以及未包衣片剂f2、c3和es的x射线粉末衍射(xrpd)分析与它们对应的吉卡宾钙多晶型物的x射线粉末衍射分析进行比较,以确定是否有任何制造工艺操作会影响吉卡宾钙多晶型物的晶型。图62
‑
64示出了吉卡宾钙多晶型物晶体中的每一者以及它们对应的样品f2
‑
fb、c3
‑
fb或es
‑
fb与未包衣片剂f2、c3或es的xrpd衍射图
的比较。
[1088]
xrpd分析是使用带有铜阳极x射线源的rigaku miniflex 600x射线衍射仪进行的。通过用研杵在研钵中湿磨,通过#40目筛筛分并通过样品架压入铝中来制备样品以进行分析。使用了样品旋转功能,并在下表中给出的参数下扫描样品。
[1089]
测量条件
[1090]
x射线40kv,15ma扫描速度/持续时间2.0000秒测角仪miniflex 300/600步宽0.0700度连接asc
‑
6扫描轴θ/2θ过滤器无扫描范围3.0000
‑
39.9600度cbo选择狭缝
‑
入射狭缝1.250度衍射束单无长度限制狭缝10.0mm检测器sc
‑
70接收狭缝#11.250度扫描模式step接收狭缝#20.3mm
[1091]
图62示出了具有38.2μm的psd90的吉卡宾钙盐水合物晶型2、样品f2
‑
fb和未包衣片剂f2的xrpd衍射图。样品f2
‑
fb和未包衣片剂f2衍射图显示在顶部并且彼此覆盖。底部显示了psd90为38.2μm的吉卡宾钙盐水合物晶型2的衍射图。已显示样品f2
‑
fb和未包衣片剂f2保持吉卡宾钙盐水合物晶型2并与吉卡宾钙盐水合物晶型2共有几个特征性2θ(
°
)峰(2θ=7.2、8.72、9.85、11.7和18.17)。峰位置和线形的分析揭示,在整个加工过程(例如造粒、研磨和压片)中均保持了吉卡宾钙盐水合物晶型2。
[1092]
图63显示了psd90为44.3μm的吉卡宾钙盐水合物晶型c3、样品c3
‑
fb和未包衣片剂c3的xrpd衍射图。样品c3
‑
fb和未包衣片剂c3衍射图显示在顶部并且彼此覆盖。底部显示了psd90为44.3μm的吉卡宾钙盐水合物晶型c3的衍射图。已显示样品c3
‑
fb和未包衣片剂c3保持吉卡宾钙盐水合物晶型c3,并与吉卡宾钙盐水合物晶型c3共有几个特征性2θ(
°
)峰(2θ=7.2、8.72、9.85、11.51、13.9、14.2、15.3、16.4、17.4、21.1、23.3和24.45)。峰位置和线形的分析表明,在整个加工过程(例如造粒、研磨和压片)中均保持了吉卡宾钙盐水合物晶型c3。
[1093]
图64显示了psd90为85.0μm的吉卡宾钙盐乙醇溶剂化物、样品es
‑
fb和未包衣片剂es的xrpd衍射图。样品es
‑
fb和未包衣片剂es衍射图显示在顶部并且彼此覆盖。底部显示了psd90为85.0μm的吉卡宾钙盐乙醇盐溶剂化物的衍射图。已显示样品es
‑
fb和未包衣片剂es维持吉卡宾钙盐乙醇溶剂化物并与吉卡宾钙盐乙醇溶剂化物共有几个特征性2θ(
°
)峰(2θ=6.96、8.16、8.97、12.25、15.5、18.1、28.62、29.36和34.04)。峰位置和线形的分析表明,在整个加工过程(例如,造粒、研磨和压片)中均保持了吉卡宾钙盐乙醇溶剂化物晶型。
[1094]
实施例18:各种形式的吉卡宾钙盐的稳定性和溶解性
[1095]
水溶性
[1096]
吉卡宾钙盐水合物晶型1(psd90=44.1μm)、吉卡宾钙盐水合物晶型2(psd90=38.2μm)、吉卡宾钙盐水合物晶型c3(psd90=44.3μm)、吉卡宾钙盐乙醇酸盐溶剂化物(psd90=85.0μm)和无定形的吉卡宾钙盐(psd90=60.3μm)的溶解度研究在约25℃的水中经24小时的时段完成。表32中所示的结果显示了在每个时间点根据hplc的每种吉卡宾形式的浓度。
[1097]
将约500mg的每种吉卡宾钙盐形式添加到分开的小瓶中。向每个小瓶中加入约3ml
至4ml水,并将样品在环境温度(约25℃)下混合约24小时。浆化1小时后,由于在小瓶中观察到稀浆液,因此将额外的吉卡宾钙盐乙醇溶剂化物添加到含有吉卡宾钙盐乙醇溶剂化物的小瓶中。同样,在浆化1小时之后,由于在小瓶中观察到稀浆液,因此将额外的无定形吉卡宾钙盐添加到含有无定形吉卡宾钙盐的小瓶中。在1、4和24小时后从每个小瓶中取出浆液样品,通过离心将其分离。通过离心分离固体,并通过xrpd分析固体形式以及通过hplc分析浓度。
[1098]
吉卡宾钙盐水合物晶型1、吉卡宾钙盐水合物晶型2和吉卡宾钙盐水合物晶型c3在测试期间未显示多晶型形式的变化。在实验过程中,所有3种形式(形式1、形式2和形式c3)的浓度结果也显示出很小的变化,其中吉卡宾钙盐水合物晶型1和吉卡宾钙盐水合物晶型2样品中注意到少量增加,而在吉卡宾钙盐水合物晶型c3中注意到略有下降。
[1099]
吉卡宾钙盐乙醇溶剂化物在24小时时段内显示出无定形的吉卡宾钙的形式变化(参见1小时采样结果),然后转化为吉卡宾钙盐水合物晶型2样物质。这种转化对应于1小时后浓度的增加(存在无定形物质),随后随着物质结晶为吉卡宾钙盐水合物晶型2样物质而浓度降低。
[1100]
如通过xrpd分析所确定,无定形的吉卡宾钙盐显示转化为新的多晶型物,即吉卡宾钙盐水合物晶型6(图67a)。无定形吉卡宾钙盐在4小时后显示出初始浓度增加,然后在24小时后出现了轻微的浓度下降。吉卡宾钙盐水合物晶型6表现出在水中的溶解度低于无定形的吉卡宾钙盐。对吉卡宾钙盐水合物晶型6进行热重分析(tga)和差热分析(dta)(图67b)。tga显示,吉卡宾钙晶型6在100℃附近具有拐点,这表明失水。
[1101]
表32.各种形式的吉卡宾钙盐的水溶性
[1102][1103]
稳定性研究
[1104]
如表b所概述,进行了各种吉卡宾钙盐形式的稳定性研究。经2周测定吉卡宾钙盐水合物晶型1(psd90=44.1μm)、吉卡宾钙盐水合物晶型2(psd90=38.2μm)、吉卡宾钙盐水合物晶型c3(psd90=44.3μm)、吉卡宾钙盐乙醇溶剂化物(psd90=85.0μm)和无定形的吉卡宾钙盐(psd90=44.1μm)的稳定性,时间点为7天和14天。使用以下储存条件进行稳定性研究:a)40℃和75%相对湿度(rh),b)80℃和c)在环境温度(约22℃)。
[1105]
在7天和14天后,将样品从相关的储存条件中取出,并通过xrpd进行初步分析,以鉴定任何形式变化。然后通过hplc/cad(配备带电气溶胶检测器的高效液相色谱)分析样品的纯度,其中所有固体纯度值均以w/w%计给出。结果示于表33。
[1106]
在两周的研究期内,未注意到吉卡宾钙盐水合物晶型1、吉卡宾钙盐水合物晶型2、吉卡宾钙盐水合物晶型c3或无定形吉卡宾钙盐的形式变化。在环境条件下储存的吉卡宾钙盐乙醇溶剂化物显示在储存期间其形式也没有变化。在升高的温度条件下,吉卡宾钙盐乙醇溶剂化物在2周的时期内改变了其形式。1周后,在40℃和75%相对湿度下储存的吉卡宾钙盐乙醇溶剂化物转化为吉卡宾钙盐形式1样物质(除形式1外,xrpd显示出额外的峰),然后在整个两周时期内进一步转变为部分结晶的物质。1周后,在80℃下储存的吉卡宾钙盐乙醇溶剂化物样品转化为吉卡宾钙盐水合物晶型c3物质,并在80℃下在第二周内保持为这种形式。
[1107]
储存2周后,与起始的吉卡宾钙盐形式相比,吉卡宾钙盐水合物晶型1、吉卡宾钙盐水合物晶型2、吉卡宾钙盐水合物晶型c3和无定形的吉卡宾钙盐在所有3种储存条件下均显示出纯度下降。对于所有三种储存条件,吉卡宾钙盐水合物晶型1、吉卡宾钙盐水合物晶型2和吉卡宾钙盐水合物晶型c3均显示相似的纯度值。与从其他两种储存条件获得的纯度值相比,无定形的吉卡宾钙盐在40℃/75%rh下储存后显示出更高的纯度值。在高温条件(80℃和40℃/75%rh)下,吉卡宾钙盐乙醇溶剂化物显示纯度下降,两种样品具有相似的纯度值。与起始的吉卡宾钙盐乙醇溶剂化物相比,在环境温度下储存的吉卡宾钙盐乙醇溶剂化物样品显示出纯度增加。
[1108]
在所有样品中,由于分析方法的变化或挥发性杂质的损失,与1周相比,在2周后观察到的通常更高的纯度值可能不受任何理论的束缚。通常,在研究期间的各个时间点,各种吉卡宾钙盐形式显示出相似的纯度值。
[1109]
表33.各种形式的吉卡宾钙盐的稳定性研究结果
[1110]
[1111][1112]
*与吉卡宾钙盐水合物晶型c1、c2和c3相比,额外的xrpd峰
[1113]
实施例19:吉卡宾钙盐水合物晶型1在stam
tm
小鼠、非酒精性脂肪变性肝炎(nash)
‑
肝细胞癌(hcc)的鼠类模型(nash
‑
hcc的鼠类stam
tm
模型)中的作用
[1114]
进行本研究以评估具有通过激光衍射测量的52μm的psd90的吉卡宾钙盐水合物晶型1在治疗nash
‑
hcc的鼠类stam
tm
模型中的非酒精性脂肪变性肝炎(nash)的功效。该研究公开于oniciu等人,plos one 13(5):e0194568中,其出于所有目的通过引用整体并入本文。nash
‑
hcc的鼠类stam
tm
模型是以高脂肪热量(hfc)喂食的小鼠模型,其中病理进展非常类似于如发展出肝脂肪变性、炎症和部分纤维化的人中的进展(kohli和feldstein,j hepatol,155,941
‑
943,doi:10.1016/j.jhep.2011.04.010(2011))。
[1115]
简而言之,对两天龄的新生c57bl/6雄性小鼠施用低剂量链脲佐菌素(streptozotocin)(stz),并且随后从4周龄起喂食hfc饮食。在此模型中,小鼠通常发展出肝脂肪变性和糖尿病,在3周内达到脂肪性肝炎,接着在8周内达到肝硬化并在16周内达到癌症。在目前的研究中,在6周龄开始对小鼠每日口服施用吉卡宾钙盐水合物晶型1并在9周龄处死。替米沙坦(在stam
tm
小鼠中具有抗脂肪变性、抗炎症和抗纤维化效果)用作阳性对照
物。基线参照组是在出生第2天时施用媒介物并且从6周龄起用媒介物治疗和喂给食物。5只stam
tm
组在出生第2天时以链脲佐菌素治疗并以4周龄开始喂食hfc饮食。这些stam
tm
组从第6周口服施用下列中的一者:水
‑
媒介物;每日30、100和300mg/kg的吉卡宾钙盐水合物晶型1;或每日10mg/kg的替米沙坦f替米沙坦购自boehringer ingelheim gmbh(德国)并溶解在纯水中。所有组均在9周龄处死。治疗计划总结于表34中。媒介物、吉卡宾钙盐水合物晶型1或替米沙坦口服管饲法(oral gavage)施用每日一次。
[1116]
表34:治疗计划
[1117][1118][1119]1po:口服
[1120]2qd:一天一次。
[1121]
分析在本研究中测试的小鼠的肝、全血和生化参数。生化小组(肝脂质、空腹血糖、转氨酶和其他参数)结果示出于表35中。
[1122]
表35.生物化学结果
[1123]
[1124][1125]1吉卡宾钙盐水合物晶型1(psd90=52μm)
[1126]
肝生物化学测量
[1127]
肝甘油三酯和游离脂肪酸含量的测量
[1128]
肝总脂质萃取物是根据folch j.等人,j.biol.chem.1957;226:497的方法获得。肝样品在20体积的氯仿
‑
甲醇(2:1,v/v)中均化并在室温下培养过夜。在用氯仿
‑
甲醇
‑
水(8:4:3,v/v/v)洗涤后,将下层氯仿相中的萃取物蒸发至干燥,并且溶解在异丙醇中。肝甘油三酯和游离脂肪酸含量分别用甘油三酯e试验和nefa c试验测量(wako pure chemical industries)。
[1129]
肝羟基脯氨酸含量的测量
[1130]
为定量肝羟基脯氨酸含量,将冷冻肝样品通过如下的碱
‑
酸水解方法处理。将肝样品用100%丙酮脱脂,在空气中干燥,在65℃溶解在2n naoh中并且在121℃经高压灭菌处理20分钟。将溶解的样品(400μl)在121℃以400μl6n hcl经20分钟酸水解,并用含有10mg/ml的活性碳的400μl4n naoh中和。将ac缓冲液(2.2m乙酸/0.48m柠檬酸,400μl)添加至样品中,接着离心以收集上清液。以16μg/ml开始的反式
‑4‑
羟基
‑
l
‑
脯氨酸(sigma
‑
aldrich)的连续稀释液构建羟基脯氨酸的标准曲线。将制备的样品和标准物(各400μl)与400μl氯胺t溶液(wako pure chemical industries,osaka,japan)混合并且在室温培育25分钟。接着将样品与ehrlich溶液(400μl)混合,并且在65℃加热20分钟以显色。在样品于冰上冷却并离心以去除沉淀物后,在560nm测量各上清液的光学密度。羟基脯氨酸的浓度由羟基脯氨酸标准曲线计算。肝样品的蛋白浓度使用bca蛋白测定试剂盒(thermo fisher scientific,usa)确定,并用于使计算的羟基脯氨酸值归一化。肝羟基脯氨酸含量以μg/mg蛋白表示。
[1131]
生物化学
[1132]
生物化学结果总结于表35中。
[1133]
终止前3天,空腹8小时后的血液分析
[1134]
空腹全血糖
[1135]
与用媒介物治疗的正常组相比,用媒介物治疗的stam
tm
小鼠示出空腹全血糖浓度的显著增加。与用媒介物治疗的stam
tm
小鼠相比,用替米沙坦治疗的小鼠示出空腹全血糖浓度的显著增加。在用媒介物治疗的stam
tm
小鼠与用吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的小鼠之间的空腹全血糖浓度没有显著差异。
[1136]
空腹血浆胰岛素
[1137]
与用媒介物治疗的正常小鼠相比,用媒介物治疗的stam
tm
小鼠示出空腹血浆胰岛素浓度的显著降低。在用媒介物治疗的stam
tm
小鼠与其他治疗组中任一者之间的空腹血浆胰岛素浓度没有显著差异。
[1138]
在终止时的血液分析(表35)
[1139]
全血糖
[1140]
与用媒介物治疗的正常小鼠相比,用媒介物治疗的stam
tm
小鼠示出全血糖含量的显著增加。与用媒介物治疗的stam
tm
小鼠相比,用替米沙坦治疗的小鼠示出全血糖含量的显著增加。在用媒介物治疗的stam
tm
小鼠与用吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的小鼠之间的全血糖含量没有显著差异。
[1141]
血浆丙氨酸转氨酶(alt)
[1142]
与用媒介物治疗的正常小鼠相比,用媒介物治疗的stam
tm
小鼠示出血浆alt含量的显著增加。与用媒介物治疗的stam
tm
小鼠相比,用100mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的小鼠示出血浆alt含量的显著降低。在用媒介物治疗的stam
tm
小鼠与其他治疗组中任一者之间的血浆alt浓度没有显著差异。
[1143]
血浆天门冬氨酸转氨酶(ast)
[1144]
在用媒介物治疗的stam
tm
小鼠与其他治疗组中任一者之间的血浆ast含量没有显著差异。
[1145]
血浆碱性磷酸酶(alp)
[1146]
与用媒介物治疗的nash组相比,用100和300mg/kg的吉卡宾钙盐水合物晶型1治疗的小鼠、以及用替米沙坦治疗的小鼠示出血浆alp含量的显著增加。在用媒介物治疗的stam
tm
小鼠与其他治疗组中任一者之间的血浆alp含量没有显著差异。
[1147]
血浆γ
‑
谷氨酰氨基转移酶(ggt)
[1148]
在用媒介物治疗的stam
tm
小鼠与治疗组中任一者之间的血浆ggt含量没有显著差异。
[1149]
血浆血尿素氮(bun)
[1150]
与用媒介物治疗的stam
tm
小鼠相比,用替米沙坦治疗的小鼠示出血浆bun含量的显著增加。在用媒介物治疗的stam
tm
小鼠与其他治疗组中任一者之间的血浆bun含量没有显著差异。
[1151]
血浆肌酐
[1152]
与用媒介物治疗的正常小鼠相比,用媒介物治疗的stam
tm
小鼠示出血浆肌酐含量的显著降低。与用媒介物治疗的stam
tm
组相比,用300mg/kg的吉卡宾钙盐水合物晶型1
(psd90=52μm)治疗的小鼠示出血浆肌酐含量的显著增加。在用媒介物治疗的stam
tm
小鼠与其他治疗组中任一者之间的血浆肌酐含量没有显著差异。
[1153]
血浆总胆红素
[1154]
在用媒介物治疗的stam
tm
小鼠与治疗组中任一者之间的血浆总胆红素含量没有显著差异。
[1155]
血浆酮体
[1156]
与用媒介物治疗的正常小鼠相比,用媒介物治疗的stam
tm
小鼠示出血浆酮体含量的显著增加。在用媒介物治疗的stam
tm
小鼠与其他治疗组中任一者之间的血浆酮体含量没有显著差异。
[1157]
肝甘油三酯
[1158]
与用媒介物治疗的正常小鼠相比,用媒介物治疗的stam
tm
小鼠示出肝甘油三酯含量的显著增加。与用媒介物治疗的stam
tm
小鼠相比,用替米沙坦治疗的小鼠示出肝甘油三酯含量的显著降低。在用媒介物治疗的stam
tm
小鼠与用吉卡宾钙盐水合物晶型1治疗的组之间的肝甘油三酯含量没有显著差异。
[1159]
肝羟基脯氨酸
[1160]
在用媒介物治疗的stam
tm
小鼠与治疗组中任一者之间的肝羟基脯氨酸含量没有显著差异。
[1161]
血浆甘油三酯
[1162]
与用媒介物治疗的正常小鼠相比,用媒介物治疗的stam
tm
小鼠示出血浆甘油三酯浓度的显著增加。与用媒介物治疗的stam
tm
小鼠相比,用吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的小鼠以剂量依赖方式示出血浆甘油三酯浓度的显著降低(参见图9)。在用媒介物治疗的stam
tm
小鼠与用替米沙坦治疗的小鼠之间的血浆甘油三酯浓度没有显著差异。
[1163]
血浆总胆固醇
[1164]
与用媒介物治疗的正常小鼠相比,用媒介物治疗的stam
tm
小鼠示出血浆总胆固醇浓度的显著增加。与用媒介物治疗的stam
tm
小鼠相比,用100和300mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的小鼠、以及用替米沙坦治疗的小鼠示出血浆总胆固醇浓度的显著增加。在用媒介物治疗的stam
tm
小鼠与用30mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的小鼠之间的血浆总胆固醇浓度没有显著差异。
[1165]
组织学分析
[1166]
对于苏木素和伊红(h&e)染色,将切片从预固定在bouin's溶液中的肝组织的石蜡块切下,并用lillie
‑
mayer's苏木素(muto pure chemicals co.,ltd.,japan)和伊红溶液(wako pure chemical industries)染色。nafld活性评分(nas)是根据kleiner,de.等人,hepatology,2005;41:1313
‑
1321的标准计算。为了将胶原沉积可视化,将bouin's固定的肝切片使用苦味酸
‑
天狼星红溶液(picro
‑
sirius red solution,waldeck,germany)染色。对于masson三色染色,将切片用masson's三色染色试剂盒(sigma,usa)根据制造商的说明染色。
[1167]
对于纤维化区域的定量分析,使用数码相机(dfc295;leica,germany)以200倍放大率在中央静脉周围捕获经天狼星红染色的切片的亮视野图像,并且使用imagej软件(national institute of health,usa)测量5个视野/切片的阳性区域。样品以盲方式分
析。
[1168]
结果
[1169]
在下文分析和总结吉卡宾钙盐水合物晶型1(psd90=52μm)对各种nash参数的效果。吉卡宾钙盐水合物晶型1(psd90=52μm)功效的相关参数与肝脏疾病有关,并且显示如下:肝病理学(图5和6)、nafld评分(nas,脂肪变性、肝小叶炎症和肝细胞气球样变的复合)(表36,图7和8a)和纤维化(图8b)。在图7中,评分是肝脂肪变性、肝小叶炎症与气球样变的评分的未加权总和。
[1170]
吉卡宾钙盐水合物晶型1(psd90=52μm)缩减小囊泡性和大囊泡性肝脂肪沉积、肝细胞气球样变和炎症细胞浸润。经苏木素和伊红(h&e)染色的肝切片的代表性显微照相图在图5a和图5b中呈现。与用媒介物治疗的正常小鼠相比,来自用媒介物治疗的stam
tm
小鼠的经h&e染色的肝切片展现小囊泡性和大囊泡性脂肪沉积、肝细胞气球样变(肝细胞与核的变性)和炎症细胞浸润。用吉卡宾钙盐水合物晶型1(psd90=52μm)治疗(30和300mg/kg)和用替米沙坦治疗的小鼠示出比用媒介物治疗的stam
tm
小鼠更少的脂肪变性(参见图5a和5b)。
[1171]
用吉卡宾钙盐水合物晶型1(psd90=52μm)治疗(30和300mg/kg)和用替米沙坦治疗的小鼠通常示出比用媒介物治疗的stam
tm
小鼠更低的肝小叶炎症与气球样变(肝细胞与核的变性)评分(图5a、图5b、图7、表36,上部),并且与用媒介物治疗的stam
tm
小鼠相比而示出nas的显著降低(图8a)。与用媒介物治疗的stam
tm
小鼠相比,在300mg/kg示出脂肪变性评分和气球样变评分的显著降低(图8a、表36,下部)。尽管趋向于更低,但是在吉卡宾钙盐水合物晶型1(psd90=52μm)治疗(100mg/kg)和用媒介物治疗的stam
tm
小鼠之间的nas没有显著差异。
[1172]
与用媒介物治疗的正常小鼠相比,吉卡宾钙盐水合物晶型1(psd90=52μm)显著地减少纤维化区域。来自用媒介物治疗的stam
tm
小鼠的经天狼星红染色的肝切片(图6)示出肝小叶周围区域增加的胶原沉积。与用媒介物治疗的stam
tm
小鼠相比,所有的用吉卡宾钙盐水合物晶型1和用替米沙坦治疗的组示出纤维化区域的显著减少(图6)。
[1173]
表36:nafld活性评分(nas)的概述
[1174][1175]1吉卡宾钙盐水合物晶型1(psd90=52μm)
[1176]
‑
无显著差异;
▲
显著增加;
▼
显著降低
[1177]
a
与媒介物正常相比;
b
与媒介物nash相比
[1178]
定量rt
‑
pcr
[1179]
肝代谢的各种基因表达标记物在所有的小鼠组中通过实时pcr(rt
‑
pcr)评估。总rna使用rnaiso(takara bio,japan)根据制造商的说明从肝样品萃取。1μgrna使用在20μl最终体积中含有4.4mm mgcl2(f.hoffmann
‑
la roche,switzerland)、40u rnase抑制剂(toyobo,japan)、0.5mm dntp(promega,usa)、6.28μm随机六聚物(promega)、5x第一链缓冲液(promega)、10mm二硫苏糖醇(invitrogen,usa)和200u mmlv
‑
rt(invitrogen)的反应混合物逆转录。反应在37℃进行1小时,接着在99℃进行5分钟。实时pcr使用实时pcr dice和sybr premix taq(takara bio)实行。为了计算相对mrna表达水平,将各基因的表达归一化
成参照基因36b4(基因符号:rplp0)的表达。pcr
‑
引物集的信息描述于表37a
‑
37c中。统计分析使用基于graphpad prism 6(graphpad software inc.,usa)的bonferroni多重比较检验(multiple comparison test)实行。<0.05的p值被认为是统计学上显著的。结果以平均值
±
sd表示。
[1180]
表37a.定量rt
‑
pcr引物
[1181]
[1182][1183]
表37b.定量rt
‑
pcr引物
[1184]
[1185][1186]
表37c.定量rt
‑
pcr引物
[1187]
[1188][1189]
为了计算相对mrna表达水平,将各基因的表达归一化成参照基因36b4(基因符号:rplp0)的表达。基因表达水平通过定量rt
‑
pcr测量。将结果以用媒介物治疗的正常组的值归一化。基因表达分析示出由吉卡宾钙盐水合物晶型1(psd90=52μm)治疗许多炎症、纤维
化、细胞信号传导和癌基因的下调。吉卡宾钙盐水合物晶型1(psd90=52μm)调节在肝稳态和损伤中扮演重要角色的许多肝基因的mrna表达。
[1190]
表38呈现归一化至非治疗组的基因表达rt
‑
pcr测量结果和基因功能的总结。表39总结基因表达结果。图10和11至27显示相对基因表达数据的绘图。
[1191]
炎症、纤维化、细胞信号传导和癌基因的基因表达。吉卡宾钙盐水合物晶型1(psd90=52μm)调节在肝稳态和损伤中扮演重要角色的许多肝基因的mrna表达(bertola,a.等人,plos one 5,e13577,doi:10.1371/journal.pone.0013577(2010))。表38呈现归一化至非治疗组的基因表达rt
‑
pcr测量的结果和基因功能的总结。
[1192]
与用媒介物治疗的正常小鼠相比,经100和300mg/kg的吉卡宾钙盐水合物晶型1治疗的组显著地抑制tnf
‑
αmrna表达(分别为2.0
±
0.8和1.9
±
0.7),而用媒介物治疗的stam
tm
小鼠示出tnf
‑
αmrna水平的显著上调(3.6
±
1.0)。在用媒介物治疗的stam
tm
小鼠与任何其他的治疗组之间的tnf
‑
αmrna水平没有显著差异。
[1193]
类似地,与用媒介物治疗的正常小鼠相比,nf
‑
κb mrna水平在用媒介物治疗的stam
tm
小鼠中略微地上调(1.1
±
0.1)。与用媒介物治疗的stam
tm
小鼠相比,100和300mg/kg的吉卡宾钙盐水合物晶型1下调nf
‑
κb mrna表达水平(分别为0.9
±
0.1和0.8
±
0.1)。
[1194]
与用媒介物治疗的stam
tm
组(1.0
±
0.2)相比,经100和300mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的组示出crp mrna水平的显著降低(分别为0.6
±
0.1和0.5
±
0.1),与以吉卡宾钙盐水合物晶型1片剂观察到的血浆的临床降低一致(stein,e.等人,j clin lipidol 10,1212
‑
1222,doi:10.1016/j.jacl.2016.08.002(2016))。其他的治疗组(特别是替米沙坦)未观察到crp mrna水平的显著差异。
[1195]
与用媒介物治疗的正常小鼠相比,在用媒介物治疗的stam
tm
小鼠中的单核细胞趋化蛋白
‑
1(mcp
‑
1/ccl2)mrna显著地上调。与用媒介物治疗的stam
tm
小鼠相比,经100和300mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的小鼠显著地下调mcp
‑
1mrna表达水平(分别为1.7
±
0.7和1.6
±
0.7,相对于3.6
±
1.7),并且比替米沙坦(2.1
±
1.0)更下调。
[1196]
纤维化基因的表达示出类似的图案。在肝星状细胞中的tnf
‑
α诱导引起平滑肌α
‑
肌动蛋白(α
‑
sma)的表达和沉积。与用媒介物治疗的正常小鼠(1.0
±
0.3)相比,在用媒介物治疗的stam
tm
小鼠中观察到α
‑
sma mrna表达的显著增加(3.1
±
0.9)。所有其他的治疗组的α
‑
sma mrna表达水平皆下调。
[1197]
srebp
‑
1基因与脂质生成相关联,并且其水平受胆固醇、胰岛素和其他的内源性分子的间接调节。在此实验中,在用媒介物治疗的stam
tm
小鼠与任何其他的治疗组之间的srebp
‑
1mrna水平没有显著差异。
[1198]
在用媒介物治疗的stam
tm
小鼠中的基质金属蛋白酶
‑
2(mmp
‑
2)mrna水平被上调(1.9
±
0.7),而经100和300mg/kg剂量的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的小鼠显著地下调了mmp
‑
2mrna表达水平(分别为0.5
±
0.2和0.9
±
0.2)。
[1199]
与用媒介物治疗的正常小鼠相比,在用媒介物治疗的stam
tm
小鼠中的金属蛋白酶组织抑制剂1(timp
‑
1)mrna水平显著地上调(12.9
±
9.0)。经100和300mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的组显著地下调timp
‑
1mrna表达(分别为3.8
±
1.6和4.4
±
2.1)。
[1200]
也称为巨噬细胞炎性蛋白
‑
1β(mip
‑
1β)的趋化因子(c
‑
c基序)配体4,ccl4已知在
nafld中升高。与用媒介物治疗的正常小鼠相比,用媒介物治疗的stam
tm
小鼠有显著较高的肝mip
‑
1βmrna水平(5.6
±
2.0)。经100和300mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)以及替米沙坦治疗的小鼠示出mip
‑
1βmrna水平的显著下调(分别为2.3
±
0.9、2.8
±
1.4和3.9
±
1.5)。
[1201]
sulf
‑
2是调节细胞外肝基质中的硫酸乙酰肝素蛋白多糖(hspg)(特别是多配体蛋白多糖(syndecan)
‑
1)的硫酸化状态和调节许多关键的信号传导路径的硫酸酯酶之一。其上调与肝致癌相关联,rosen,s.d.和lemjabbar
‑
alaoui,h.expert opin ther targets 14,935
‑
949,doi:10.1517/14728222.2010.504718(2010)。在目前的研究中,与用媒介物治疗的正常组相比,用媒介物治疗的stam
tm
小鼠示出sulf
‑
2mrna水平的显著上调(5.2
±
1.2)。经100和300mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的小鼠显著地下调sulf
‑
2mrna表达水平(分别为3.8
±
0.7和3.3
±
0.9)。
[1202]
ccr2和ccr5 mrna的表达。在c
‑
c趋化因子受体类型2(ccr2)与其配体ccl2之间的交互作用通过促进单核细胞/巨噬细胞聚集和组织浸润以及肝星状细胞活化而介导纤维生成(lefebvre,e.等人,plos one 11,e0158156,doi:10.1371/journal.pone.0158156(2016))。与用媒介物治疗的正常小鼠相比,用媒介物治疗的stam
tm
小鼠示出ccr2 mrna表达水平的显著上调(3.5
±
1.7)。当与替米沙坦(2.4
±
0.8)相比时,经100和300mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的组示出ccr2 mrna表达水平以更大的程度显著下调(分别为1.6
±
0.4和1.7
±
0.7)。
[1203]
趋化因子ccl5/rantes和其受体ccr5在肝炎症和纤维化进展中扮演重要的角色(lefebvre,e.等人,plos one 11,e0158156,doi:10.1371/journal.pone.0158156(2016))。用媒介物治疗的nash组示出ccr5 mrna水平的显著增加(2.3
±
0.)。经100和300mg/kg的吉卡宾钙盐水合物晶型1和用替米沙坦治疗的组显著地下调ccr5mrna表达水平(分别为1.4
±
0.3、1.3
±
0.3和1.5
±
0.3)。
[1204]
脂质生成和脂质代谢的基因:acc
‑
1、apoc
‑
iii和pnpla3。乙酰基coa羧化酶1和2两者(acc
‑
1和acc
‑
2)催化丙二酰基
‑
coa的合成,其为脂肪酸合成的底物和脂肪酸氧化的调节子,在nafld发病机制中的主要参与者(savage,d.b.等人,j clin invest 116,817
‑
824,doi:10.1172/jci27300(2006))。与用媒介物治疗的stam
tm
小鼠相比,经100mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)和用替米沙坦治疗的小鼠下调acc
‑
1mrna表达水平(与0.9
±
0.2相比的0.7
±
0.1)。
[1205]
与用媒介物治疗的正常小鼠相比,在用媒介物治疗的stam
tm
小鼠中的含patatin样磷脂酶结构域蛋白3(pnpla3)mrna表达(hazlehurst,j.m.等人,metabolism 65,1096
‑
1108,doi:10.1016/j.metabol.2016.01.001(2016)(speliotes,e.k.等人,hepatology 52,904
‑
912,doi:10.1002/hep.23768(2010))显著地下调。然而,在用媒介物治疗的stam
tm
小鼠与治疗组中任一者之间的pnpla3 mrna表达水平没有显著差异。
[1206]
在此模型中,吉卡宾钙盐水合物晶型1(psd90=52μm)和替米沙坦对ldl受体基因表达未示出效果。
[1207]
人醇脱氢酶4(adh
‑
4)基因的调节。与nafld相关联的adh
‑
4有助于中和高浓度的乙醇代谢(baker,s.s.等人,plos one 5,e9570,doi:10.1371/journal.pone.0009570(2010)。在stam
tm
小鼠中的nash诱导对adh
‑
4mrna水平没有显著的效果(用媒介物治疗的
nash组和用媒介物治疗的正常组具有类似的值)。然而,与用媒介物治疗的stam
tm
组相比,经100和300mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)和用替米沙坦治疗的组下调adh
‑
4mrna表达水平(与0.9
±
0.3相比分别为0.6
±
0.1、0.5
±
0.1和0.6
±
0.2)。
[1208]
[1209]
[1210]
[1211][1212]
表39:基因表达总结
[1213]
[1214][1215]
ns=无显著差异;
▲
显著增加;
▼
显著降低
[1216]1吉卡宾钙盐水合物晶型1(psd90=52μm)。
[1217]
吉卡宾钙盐水合物晶型1(psd90=52μm)对肝apoc
‑
iii或肝sulf
‑
2与血浆甘油三酯浓度之间相关性的效果示出于图31中。在糖尿病小鼠模型中,吉卡宾钙盐水合物晶型1示出sulf
‑
2mrna水平的降低。不受任何理论的束缚,以吉卡宾钙盐水合物晶型1的sulf
‑
2酶的降低是挽救或恢复调节许多关键性信号传导途径的多配体蛋白多糖
‑
1活性的指标。在健康受试者的肝中,多配体蛋白多糖
‑
1受体以高容量结合含有富含胆固醇的甘油三酯的残余物,具有经估计约60分钟的内化半衰期,而ldl
‑
受体是以低容量和经估计约10分钟的半衰期结合这些粒子。然而,在糖尿病受试者中,多配体蛋白多糖
‑
1受体受到高的sulf
‑
2的肝表达的阻碍。
[1218]
吉卡宾钙盐水合物晶型1(psd90=52μm)对残余物受体的挽救的效果类似于pcsk9抑制剂对ldl
‑
受体的挽救。因此,不受任何理论的束缚,吉卡宾钙盐水合物晶型1对降低c
‑
trl的效果可降低动脉粥样硬化性心血管疾病(ascvd)事件的残余风险。
[1219]
吉卡宾钙盐水合物晶型1显著地下调炎症(tnf
‑
α、mcp
‑
1、mip
‑
1β、ccr5、ccr2、nf
‑
κb)、脂质生成和脂质调节(apoc
‑
iii、acc1、adh
‑
4、sulf
‑
2)、纤维化(timp
‑
1)和肝致癌(mmp
‑
2)的肝mrna标记物。这些效果证明施用吉卡宾钙盐水合物晶型1在本发明的组合物和方法中特别有用于治疗和预防脂肪变性、炎症和肝细胞气球样变(即nas评分降低)和抑制纤维化进展。以吉卡宾钙盐水合物晶型1(psd90=52μm)治疗观察到纤维化进展的抑制。
[1220]
与在正常组中的媒介物相比,在nash组中的媒介物示出il
‑
6mrna表达水平的显著上调。与在nash组中的媒介物相比,经100和300mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的组和替米沙坦组示出il
‑
6mrna表达水平的显著下调。在nash组中的媒介物与经30mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的组之间的il
‑
6mrna表达水平没有显著差异。
[1221]
在正常组中的媒介物与在nash组中的媒介物之间的il
‑
1βmrna表达水平没有显著差异。在nash组中的媒介物与治疗组之间的il
‑
1βmrna表达水平没有显著差异。
[1222]
与在正常组中的媒介物相比,在nash组中的媒介物示出cxcl1/kc mrna表达水平的下调。与在nash组中的媒介物相比,经100和300mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的组示出cxcl1/kc mrna表达水平的显著下调。在来自stam小鼠或正常小鼠的肝样品中未检测到cxcl2/mip
‑
2mrna的扩增。参照基因36b4如预计在所述两种样品中都扩增。在来自经dss诱导的结肠炎模型的结肠样品中检测出cxcl2/mip
‑
2扩增,表明用于cxcl2/mip
‑
2的rt
‑
pcr系统和引物组已起作用。
[1223]
与在正常组中的媒介物相比,在nash组中的媒介物示出scd mrna表达水平的显著下调。与在nash组中的媒介物相比,经300mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的组示出scd mrna表达水平的显著上调。在nash组中的媒介物与其他的组疗组之间的scd mrna表达水平没有显著差异。
[1224]
与在正常组中的媒介物相比,在nash组中的媒介物示出肝lpl mrna表达水平的显著上调。与在nash组中的媒介物相比,经30、100和300mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的组示出肝lpl mrna表达水平的显著上调。在nash组中的媒介物与替米沙坦组之间的肝lpl mrna表达水平没有显著差异。
[1225]
与在正常组中的媒介物相比,在nash组中的媒介物示出angptl3 mrna表达水平的显著下调。与在nash组中的媒介物相比,经100和300mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的组示出angptl3 mrna表达水平的显著下调。在nash组中的媒介物与其他的组疗组之间的angptl3 mrna表达水平没有显著差异。
[1226]
与在正常组中的媒介物相比,在nash组中的媒介物示出angptl4 mrna表达水平的显著上调。与在nash组中的媒介物相比,经100和300mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的组和替米沙坦组示出angptl4 mrna表达水平的显著下调。在nash组中的媒介物与经300mg/kg的吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的组之间的angptl4 mrna表达水平没有显著差异。
[1227]
与在正常组中的媒介物相比,在nash组中的媒介物示出angptl8 mrna表达水平的显著下调。在nash组中的媒介物与治疗组之间的angptl8 mrna表达水平没有显著差异。
[1228]
在正常组中的媒介物与在nash组中的媒介物之间的胎球蛋白
‑
a mrna表达水平没有显著差异。与在nash组中的媒介物相比,经100mg/kg的吉卡宾钙盐水合物晶型1(psd90=
52μm)治疗的组示出胎球蛋白
‑
a mrna表达水平的显著下调。在nash组中的媒介物与其他的组疗组之间的胎球蛋白
‑
a mrna表达水平没有显著差异。升高的胎球蛋白
‑
a mrna表达与增加的胰岛素抗性和nash的发展相关联。
[1229]
吉卡宾钙盐水合物晶型1(psd90=52μm)对与炎症相关联的肝组织学和基因表达水平的效果支持吉卡宾的药学上可接受的盐作为用于nafld/nash治疗的临床评估。在目前的研究中,用吉卡宾钙盐水合物晶型1(psd90=52μm)治疗的stam
tm
小鼠证明在nas和纤维化进展两者中显著的组织学降低。进一步,炎症相关基因tnf
‑
α、mcp
‑
1、mip
‑
1β、ccr5、ccr2和nf
‑
κb的肝表达的分析表明吉卡宾的药学上可接受的盐击中多个标靶并且对肝病理学具有肝保护效果。而且,吉卡宾钙盐水合物晶型1降低代谢相关基因acc1、apoc
‑
iii、sulf
‑
2和adh4的mrna表达水平。除了下调crp基因表达以外,以吉卡宾钙盐水合物晶型1治疗也降低血浆crp水平,其与人的数据一致。来自先前的非临床和临床研究的数据示出吉卡宾钙盐水合物晶型1降低血浆tg、apoc
‑
iii mrna和血浆水平和增强vldl清除。
[1230]
stam
tm
模型是以stz诱导,基本上完全丧失胰脏的胰岛素生产,并且因此不预期药物对胰岛素致敏性的转译效果。然而,此模型证明多效性药物(例如吉卡宾的药学上可接受的盐)和/或多模型组合治疗方法可有效引导用于nash的治疗。目前的非临床数据证实早期的临床研究结果支持吉卡宾的药学上可接受的盐在解除人的nash中的评估。
[1231]
实施例20:以吉卡宾钙盐水合物晶型1治疗高胆固醇血症
[1232]
进行本研究以评估薄膜包衣片剂d治疗患有家族性高胆固醇血症(fh)且正处于稳定的降血脂疗法的患者的功效。经基因确认或基于下列的临床诊断诊断出患有fh的≥17岁的男性和女性患者入选所述研究:(1)未经治疗的ldl
‑
c浓度>500mg/dl(12.92mmol/l),伴有在10岁前出现黄色瘤,或在父母双方中都有家族性高胆固醇血症的证据的历史,或(2)在进行最大耐受的降脂药物疗法时的ldl
‑
c>300mg/dl(7.76mmol/l)。患者具有>130mg/dl(3.36mmol/l)的空腹ldl
‑
c值和≤400mg/dl(4.52mmol/l)的甘油三酯(tg)值,同时正处于稳定的低脂、低胆固醇饮食结合预先存在的降血脂疗法(即他汀类药物、pcsk9的单克隆抗体、胆固醇吸收抑制剂、胆汁酸螯合剂、或烟酸、或其任何组合)。
[1233]
本研究是使用300mg、600mg和900mg吉卡宾钙盐水合物晶型1(psd90=52μm)的连续递增剂量的3期、3种治疗研究。所有的患者每次以每一连续剂量服用4周。患者在整个研究期间仍维持其稳定的降血脂疗法。
[1234]
各患者口服qd(另外写成q.d.;意指“一天一次”)接受一片300mg吉卡宾钙盐水合物晶型1片剂(薄膜包衣片剂d),为期4周。相同的患者接着口服qd接受600mg吉卡宾钙盐水合物晶型1,为期4周。600mg剂量由两片300mg片剂(薄膜包衣片剂d x 2)所组成。最后,相同的患者口服qd接受900mg吉卡宾钙盐水合物晶型1,为期4周。900mg剂量是由三片300mg片剂(薄膜包衣片剂d x 3)所组成。当从300mg改变成600mg剂量时或当从600mg改变成900mg剂量时,不中断吉卡宾钙盐水合物晶型1的给药,除非有临床上重大的安全问题而导致吉卡宾的暂时或永久停止。
[1235]
ldl
‑
c值在患者已施用薄膜包衣片剂d的各给药量2周后并且在各剂量的最后一天测量。对于各递增剂量,自基线起的ldl
‑
c变化百分比使用基线ldl
‑
c值和以各剂量所测量的最终ldl
‑
c值计算。基线经定义为在第1天前达14天和第1天(给药前)进行的筛选访视所取得的测量平均值。ldl
‑
c含量的期中临床试验数据示出于图3和图4中。图3示出三位患者
(1f、2m和3m)在研究期间所测量的ldl
‑
c浓度。图4示出相同的三位患者自基线起的ldl
‑
c浓度变化百分比值。
[1236]
所有的患者在以薄膜包衣片剂d的上升剂量治疗前皆处于其最大耐受的降胆固醇疗法中。患者1f对他汀类药物不耐受,她的降胆固醇疗法包括艾泽庭(zetia)10mg、消胆胺(cholestyramine)4克和磷虾油(krill oil)350mg。患者2m的降胆固醇疗法包括冠脂妥(crestor)40mg。患者3m的降胆固醇疗法包括阿托伐他汀80mg和艾泽庭10mg。在薄膜包衣片剂d口服qd治疗的各4周剂量间隔后,三位患者中每一位与其个人的基线相比皆示出显著降低的ldl
‑
c。在以300mg、600mg和900mg口服qd吉卡宾钙盐水合物晶型1治疗后,患者1f分别示出55.2%(4周)、49.8%(8周)和54.5%(12周)的ldl
‑
c降低。在以300mg、600mg和900mg口服qd薄膜包衣片剂d治疗后,患者2m分别示出28.7%(4周)、32.4%(8周)和28.7%(12周)的ldl
‑
c降低。在以300mg、600mg和900mg口服qd薄膜包衣片剂d治疗后,患者3m分别示出18.3%(4周)、22.9%(8周)和32.7%(12周)的ldl
‑
c降低。在12周干预的持续时间内ldl
‑
c降低得以保持(图3和4)。
[1237]
实施例21:吉卡宾钙盐水合物晶型1的300mg薄膜包衣片剂的药代动力学和安全性研究
[1238]
用于评估口服吉卡宾在具有不同程度的肾损伤的患者和具有正常肾功能的健康匹配的对照受试者中的药代动力学、安全性和耐受性的开放标记的非随机研究用具有52μm的psd90的吉卡宾钙盐水合物晶型1制备的300mg薄膜包衣压缩片剂(薄膜包衣片剂f)进行。所述研究的基本原理通过评定单一600mg口服剂量(薄膜包衣片剂f x2)的药代动力学(pk)、和安全性和耐受性以探讨吉卡宾在具有正常肾功能的男性和女性受试者和那些具有不同程度的肾损伤(ri)受试者中的潜在用途。单一600mg剂量水平代表当在人类受试者中测试时低的吉卡宾暴露并且已基于所有可用数据而示出为安全且良好耐受的。
[1239]
pk评定可用于对患有ri的患者提供适当的给药建议。本研究的主要目的是评估吉卡宾在口服施用后用具有不同程度的ri的患者与具有正常肾功能的健康匹配的对照受试者相比的pk曲线。本研究的次要目的是评估口服吉卡宾在具有不同程度的肾功能的患者中的安全性和耐受性。
[1240]
在研究中的所有受试者是具有体重指数介于18与35kg/m2(包括端值在内)之间的介于18与75岁(包括端值在内)之间的男性或女性。组别1的八位受试者是基于医学和外科病史审查,经限定的完整的身体检查以及生命体征测量、ecg和实验室测试结果而为健康的,在筛选的时候具有经估计≥90ml/min的肌酸清除率(clcr),是非吸烟者并且在人口统计学上(性别、bmi
±
20%、年龄
±
10岁)与组别2的受试者(重度ri)匹配。组别2至4的患者具有轻度、中度或重度ri并且是非吸烟者或轻度吸烟者(每日吸少于10只香烟)。组别1的受试者在第天接受600mg吉卡宾的单一口服剂量和随后进行11天(240小时)的pk和安全性评定。对于高达并包括12小时的pk收集时间点(即0[给药前]、1、2、3、6、12小时),窗口是指示的标称时间
±
5分钟。对于在24、48、72和96小时的pk收集时间点,窗口是指示的标称时间
±
10分钟。对于更后的时间点(即给药后120、144、192、240和336小时),窗口是指示的标称时间
±
60分钟。
[1241]
组别2由患有重度肾损伤(ri)(基于同位素稀释质谱术(idms)可追溯的肾病饮食改良(mdrd)公式经估计<30ml/min/1.73m2的肾小球滤过率(egfr))的8位患者所组成。组别
2的患者在第1天接受600mg具有52μm的psd90的吉卡宾钙盐水合物晶型1(薄膜包衣片剂f x 2)的单一剂量并随后进行15天(336小时)的pk和安全性评定。
[1242]
组别3由患有轻度ri(基于idms可追溯的mdrd公式≥60至<90ml/min/1.73m2的egfr)的6位患者所组成。这些患者在第1天接受600mg具有52μm的psd90的吉卡宾钙盐水合物晶型1的单一口服剂量并随后进行15天(336小时)的pk和安全性评定。
[1243]
组别4由患有中度肾损伤(基于idms可追溯的mdrd公式≥30至<60ml/min/1.73m2的egfr)的6位患者所组成。这些患者在第1天接受600mg具有52μm的psd90的吉卡宾钙盐水合物晶型1的单一口服剂量并随后进行15天(336小时)的pk和安全性评定。
[1244]
吉卡宾钙盐水合物晶型1(psd90=52μm)是以两个300mg片剂(薄膜包衣片剂f)给出的600mg一剂量口服施用(与240ml水),接着空腹隔夜(≥8小时)。受试者在给药后维持4小时空腹(在给药前和后1小时禁水)。研究药物的各剂量的施用受到监督、验证和记录。
[1245]
在本研究所使用的300mg薄膜包衣的吉卡宾钙盐水合物晶型1(psd90=52μm)片剂在37℃
±
5℃于ph 5.0乙酸钾缓冲液中具有如表40中所示的吉卡宾溶出曲线,其通过使用210nm的检测波长的高效液相色谱测量(参见实施例13)。
[1246]
表40.用具有52μm的psd90的吉卡宾钙盐水合物晶型1制备的300mg薄膜包衣片剂(薄膜包衣片剂f)的溶出
[1247][1248][1249]
下列的药代动力学参数使用在可能时基于血浆吉卡宾浓度的非隔室方法计算:最大浓度(cmax)、达到最大浓度的时间(tmax)、给药后从时间0至48小时的浓度
‑
时间曲线下的面积auc(0
‑
48)、从时间0直到最后可量化浓度的时间的浓度
‑
时间曲线下的面积auc
最后
、外推至无限大的浓度
‑
时间曲线下的面积auc(0
‑
∞)、表观终速率常数(λz)、终末半衰期(t1/2)、表观全身清除率(cl/f)、表观分布体积(vz/f)、未结合的血浆浓度(cu)、在血浆中的未结合级分(fu)和在血浆中的结合级分(fb)。
[1250]
表41示出含有具有52μm的psd90的吉卡宾钙盐水合物晶型1(薄膜包衣片剂f)的2x 300mg薄膜包衣压缩片剂(600mg)的药代动力学变量。
[1251]
表41.组别1的药代动力学变量
[1252][1253]
实施例22:吉卡宾钙盐水合物晶型1在单一剂量的稳态效果
[1254]
用于评定吉卡宾钙在健康女性受试者中对口服避孕药片剂的单一剂量药代动力学(pk)的稳态效果的开放标记的、双序列的、交叉研究以含有具有52μm的psd90吉卡宾钙盐水合物晶型1的300mg片剂(薄膜包衣片剂f)进行。16位合格的女性受试者以1:1的比率随机分配成两个治疗序列之一,如表42中所呈示。
[1255]
表42.治疗序列
[1256][1257]
本研究的群体通常是健康的有生育可能性的成年女性受试者(≥18至≤35岁)。此群体支持研究的总体目标,以评估600mg具有52μm的psd90的吉卡宾钙盐水合物晶型1在稳态对单一剂量on1/35(ortho novum 1/35;组合的炔雌醇/炔诺酮口服避孕药)的pk的效果。本研究的主要目标为评定每日600mg具有52μm的psd90的吉卡宾钙盐水合物晶型1在稳态对on 1/35的药代动力学(pk)的效果。本研究的次要目标为评定每日600mg吉卡宾与单一剂量on 1/35的组合的安全性和耐受性,并且评定600mg具有52μm的psd90的吉卡宾钙盐水合物晶型1(薄膜包衣片剂f x 2)的稳态pk。
[1258]
具有52μm的psd90的吉卡宾钙盐水合物晶型1是以两个300mg片剂(300mg薄膜包衣片剂f x 2)给出的600mg单一剂量口服施用(用240ml水)。具有52μm的psd90的吉卡宾钙盐水合物晶型1(600mg)每日在相同的时间施用。
[1259]
获得非隔室pk单一剂量参数,包括炔雌醇与炔诺酮的cmax、达到所观察最大的血浆浓度的时间(tmax)、从时间0至最后可检测的浓度的时间的auc(auc
最后
),和在可能时外推至无限大的时间的auc(auc∞)、自正向外推所获得的auc∞百分比(aucextrap%)、表观终
速率常数(λz)、表观终半衰期(t
ó
)、表观全身清除率(cl/f)和终止期的表观分布体积(vz/f)。表43呈示每日效果的anova分析结果。
[1260]
表43.炔雌醇和炔诺酮的药代动力学参数
[1261][1262]
几何最小二乘(ls)平均值比指示对暴露于炔雌醇与炔诺酮的温和的药物
‑
药物相互作用在吉卡宾钙盐水合物晶型1存在下略微降低。6个参数中的5个的90%置信区间(ci)值的下限落在80%至125%的预定范围以下,支持在吉卡宾钙盐水合物晶型1的存在下降低暴露于炔雌醇与炔诺酮。在治疗b期间的第6、7和8天的平均血浆吉卡宾波谷浓度是98.77μg/ml、106.37μg/ml和104.27μg/ml。用于pk参数分析设定的稳态血浆吉卡宾pk参数指示177.73μg/ml的平均cmax,ss和102.68μg/ml的cmin。
[1263]
在整个研究期间,在治疗a中有2位受试者(12.5%)、在治疗b的吉卡宾单独治疗期间有4位受试者(26.7%)、和在治疗b的吉卡宾与on 1/35治疗期间有3位受试者(20%)具有治疗突发的不良事件(teae)。在只以吉卡宾治疗的治疗b中仅1位受试者具有便秘的胃肠疾病的药物相关teae。所有的teae的严重性被认为是轻度或中度。在研究期间没有严重的不良事件(sae)。总体而言,以吉卡宾与单一剂量on 1/3的治疗耐受良好。
[1264]
实施例23:用具有52μm的psd90的吉卡宾钙盐水合物晶型1在患有家族性高胆固醇血症(fh)而正处于稳定的降脂质疗法的患者中的治疗研究
[1265]
这是在临床上被诊断为家族性高胆固醇血症(fh)的患者中使用300mg、600mg和900mg具有52μm的psd90的吉卡宾钙盐水合物晶型1的连续递增剂量的开放标签、剂量探索、3期、3种治疗研究。治疗计划是使8位患者中的每一位在每日于每次接受连续剂量中的一者,为期4周,在剂量水平之间不中断吉卡宾钙盐水合物晶型1的给药。即,对8位fh患者在第1至28天施用300毫克/天、在第29至56天施用600毫克/天和在第57至84天施用900毫克/天的具有52μm的psd90的吉卡宾钙盐水合物晶型1的口服剂量。药代动力学血浆样品在第28天、第56天和第84天给药前和给药后0.5、1、2、3、5和12小时收集。额外的(波谷)样品在第14天、第42天、第70天给药前和提前终止返诊(early termination visit)(若适用时)时收集。以来自这些样品的血浆进行吉卡宾浓度分析并且数据用于pk分析。所有患者的血浆样品浓度可供用于药代动力学分析,除了1位以外(没有报告其在第84天以900mg给药后的结果)。由于在剂量水平之间没有休息日,因此600mg和900mg治疗期的起始血浆浓度分别为
300mg和600mg的稳态浓度。
[1266]
在第1至28天期间,患者每日接受一片含有具有52μm的psd90的吉卡宾钙盐水合物晶型1的300mg片剂(薄膜包衣片剂d);在第29至56天期间,患者每日接受两片300mg片剂(2x薄膜包衣片剂d);和在第57至84天期间,患者每日接受三片300mg片剂(3x薄膜包衣片剂d)。
[1267]
本研究的目标之一是确定如以功效、药代动力学(pk)和安全性数据所评定的用于临床研究的适当剂量;以及评估300mg、600mg和900mg剂量的具有52μm的psd90的吉卡宾钙盐水合物晶型1的吉卡宾的波谷血浆浓度。在一些实施方案中,有效的剂量经定义为在4周治疗后实现低密度脂蛋白胆固醇ldl
‑
c≥15%的平均降低的剂量。
[1268]
表44示出在本研究中的8位患者的人口统计。各患者伴随施用的稳定的降血脂疗法如表44中的指示。
[1269]
表44.患者的人口统计
[1270][1271]
药代动力学(pk)
[1272]
pk参数估计值使用经验证安装的6.4版的标准非隔室分析方法导出。以实际的采样时间用于pk参数计算。
[1273]
经报告为缺失的所有血浆浓度均被视为缺失。假定在qd施用28天后是稳态,并且因此在给药后24小时的血浆吉卡宾浓度被用作给药前浓度。
[1274]
下列的吉卡宾pk参数以各患者的血浆浓度
‑
时间数据计算:
[1275]
[1276][1277]
auc
最后
和auc
(0
‑
24)
使用具有线性上调和对数下调内插法的梯形规则的数值积分计算。不估计吉卡宾半衰期和表观分布体积,因为无法从这些数据准确地估计终止期。
[1278]
统计方法
[1279]
概括统计量使用winnonlin产生。所有缺失的血浆浓度均被视为缺失。
[1280]
剂量比例性使用graphpadv6.07(lajolla,ca)评定,其由log(cmax)、log(auc
最后
)和log(auc0
‑
24)相对于log(剂量)的线性回归估计斜率和95%置信区间(ci)。剂量比例性的标准是含有值“1”的斜率周围的95%ci。
[1281]
数据显示
[1282]
个体的患者和吉卡宾浓度
‑
时间数据使用以生物分析实验室所提供的有效数字或小数位和标称采样时间(nominal sample times)列出,并且通过剂量水平叙述性地总结在表列格式中,并观察(用于波谷样品)。将pk分析结果四舍五入至3个有效数字,除了tmax(其四舍五入至2个有效数字)以外,并且来自剂量比例性分析的结果显示至4个有效数字。将所有的概括统计量四舍五入至3个有效数字,除了tmax(2个有效数字)以外。
[1283]
吉卡宾血浆浓度相对于时间的绘图使用利用标称采样时间的graphpad prism产生,并且显示在线性和半对数轴两者上,除了仅示出在线性轴上的波谷浓度的绘图以外。
[1284]
结果
[1285]
根据患者的记录,在本研究中的八位患者具有平均98%的依从性,对所有患者在各剂量水平具有至少93%的依从性,除了患者006
‑
001以外,其在第84天返诊前停止服用900mg(薄膜包衣片剂d x 3)。此患者被900mg剂量研究分析中去除。以给药后0至24小时的时间点收集的剂量覆盖的吉卡宾的算数平均浓度(
±
sd)相对于时间的绘图显示于图41a和41b和对波谷样品的所述图显示于图42中。
[1286]
有一位患者(006
‑
001)没有报告第84天的血浆样品浓度。一个波谷样品缺失:患者004
‑
004,返诊3(第14天),300毫克/天的治疗期。忽略这些结果预计不会影响本研究的pk结果。有一位患者(006
‑
003)在第84天报告出乎意料低的吉卡宾血浆浓度,但是记录确认对此患者的每一方案的给药,所以在所有分析中保留此数据。
[1287]
对吉卡宾关键的pk参数以各剂量水平总结在表45中。在28个每日口服给药后,吉卡宾被快速吸收,第一个样品时间点(0.5h)出现在血浆中并且大多数的患者在给药后1至2h达到最大血浆浓度。300mg、600mg和900mg剂量水平的中值tmax(min
‑
max)分别为1.6h(1.0
‑
2.0h)、1.5h(0.93
‑
3.0h)和1.9h(0.98
‑
3.0h)。尽管中值在900毫克/天的剂量时略微增加,但在个体患者中没有tmax随剂量的一致性增加。可量化的吉卡宾血浆浓度通过对以各水平给药的所有患者24h给药后标称采样期间报告得出。用于auc0
‑
24和auc
最后
的计算不同,不同在于auc0
‑
24可在时间点之间外推或内插以估计在时间为给药后24h的浓度,因此在参数值之间产生略微的差异。
[1288]
表45.pk参数的总结
[1289][1290][1291]
a
中值和min
‑
max。
[1292]
平均吉卡宾波谷血浆浓度在300毫克/天和600毫克/天的治疗期内以及在300毫克/天与600毫克/天的剂量水平之间随薄膜包衣片剂d的14和28个每日剂量两者后增加。与较低剂量水平相比,以900毫克/天的平均波谷浓度也增加,但在900毫克/天的治疗期的第14天和第28天之间降低(图42a)。这主要是由于1位患者(006
‑
003)的第28天的波谷值自第14天的122μg/ml降低至第28天的43.5μg/ml(图42b)。
[1293]
个别患者的波谷吉卡宾血浆浓度的检查显示稳态通常在每日给药吉卡宾的14天内达到,但不是所有的患者自第14天至第28天皆示出浓度平稳。
[1294]
吉卡宾cmax和auc0
‑
24值通常随着增加的薄膜包衣片剂d每日剂量而增加(表46)。依照统计学标准,在logauc0
‑
24相对于log剂量的斜率周围的95%ci包括“1”。cmax增加略少于剂量比例性;logcmax和auc
最后
的95%ci的上限分别为0.9767和0.9993。
[1295]
表46.剂量比例性的评估
[1296]
参数斜率(
±
se)95%cic
max
0.7834
±
0.092920.5902至0.9767auc
最后
0.7468
±
0.12140.4944至0.9993auc
(0
‑
24)
0.7749
±
0.12650.5118至1.038
[1297]
本研究证明吉卡宾被快速吸收并且具有在1.5至1.9h范围内的中值t
max
,其与剂量水平无关。
[1298]
本研究也证明吉卡宾c
max
和auc
(0
‑
24)
随着增加的薄膜包衣片剂d每日剂量而增加。auc
(0
‑
24)
在300毫克/天至900毫克/天的剂量范围内随剂量比例性地增加。c
max
的增加略少于剂量比例性。
[1299]
在研究后,以基因确认评定8位患者,其确定出3位患者具有纯合子家族性高胆固醇血症(hofh)基因型和5位患者具有杂合子家族性高胆固醇血症(hefh)基因型(表44)。如其在治疗过程期间的测量,从分成hofh和hefh基因型组的8位患者的ldl
‑
c浓度的基线的变化百分比(图43)示出于图44和45中。
[1300]
实施例24.用具有52μm的psd90的吉卡宾钙盐水合物晶型1在正用稳定的中等和高强度他汀类药物治疗的患有高胆固醇血症的患者中的治疗研究
[1301]
将正处于适当的饮食和稳定的他汀类药物疗法至少12周并且ldl
‑
c≥100mg/dl
(2.59mmol/l)和甘油三酯<500mg/dl(5.65mmol/l)的高风险患者(包括一些但不是所有患有杂合子家族性高胆固醇血症(hefh)或动脉粥样硬化性心血管疾病(ascvd)者)随机分入12周、安慰剂对照、平行组,进行双盲研究,以评定600mg(300mg薄膜包衣片剂d x 2)qd的吉卡宾钙盐水合物晶型1(psd90=52μm)对ldl
‑
c和其他的脂蛋白和hscrp(高灵敏度c反应蛋白)的功效。也评估安全性和耐受性。患者以高或中等强度他汀类药物疗法连同或不连同依泽替米贝分层级治疗,在各层级的患者目标是52位(26位患者是以2x薄膜包衣片剂d施用600mg吉卡宾钙盐水合物晶型1和26位患者采用安慰剂(“安慰剂”))。本研究入选105位患者(53%妇女,77%白种人,平均61岁)。所有患者的平均基线ldl
‑
c是约134mg/dl(3.48mmol/l),处于高强度他汀类药物层级的大多数患者采用阿托伐他汀而中等强度他汀类药物层级的大多数患者采用辛伐他汀或阿托伐他汀。
[1302]
本研究的目标是表征吉卡宾钙盐水合物晶型1的安全性和耐受性并且确定吉卡宾钙盐水合物晶型1对他汀类药物就血清生物标记物的累加影响,所述生物标记物包括致动脉粥样化生物标记物(ldl
‑
c、非hdl
‑
c、apob、apoe和甘油三酯(tg))和炎症生物标记物(hscrp、血清淀粉样蛋白a(saa))。
[1303]
正处于基线高强度(hi)他汀类药物的50位患者(24位患者正采用600mg(片剂d x2);26位采用安慰剂)接受40mg或80mgqd阿托伐他汀;或20mg或40mgqd瑞舒伐他汀。正处于基线中等强度(mi)他汀类药物的55位患者(29位患者正采用600mggem;26位采用安慰剂)接受10mg或20mgqd阿托伐他汀;5mg或10mgqd瑞舒伐他汀;或20或40mgqd辛伐他汀。mi他汀类药物和hi他汀类药物层级的基线ldl
‑
c分别为127mg/dl和134mg/dl。
[1304]
总体而言,吉卡宾钙盐水合物晶型1被良好耐受。本研究没有报告严重的不良事件(ae)和死亡。在薄膜包衣片剂d组中的54位患者中有33位(61.1%)和在安慰剂组中的51位患者中有24位(47.1%)被报告在研究期间有至少一个ae。最普遍的ae是与感染相关联的ae。所报告的ae类似于mi和hi他汀类药物层级。在安慰剂组与片剂d组患者之间的肌痛没有差异。没有>3x uln的转氨酶上升和没有临床上显著的ck上升。
[1305]
接受吉卡宾的hi他汀类药物患者的38%正采用最高剂量的阿托伐他汀或瑞舒伐他汀和接受吉卡宾的mi他汀类药物患者的62%于正采用此层级最高的阿托伐他汀、瑞舒伐他汀或辛伐他汀剂量。患者的人口统计如表47中所示和患者的基线血浆脂质值如表48中所示。可在血浆或血清中获得患者的基线脂质值。
[1306]
表47.患者人口统计
[1307]
[1308]
表48.患者血浆基线特征
[1309][1310]
*87(83%)的受试者具有<200mg/dl的基线tg。在先前研究中,吉卡宾示出在大于200mg/dl时显著影响tg水平。
[1311]
吉卡宾钙盐水合物晶型1(薄膜包衣片剂d x 2)的施用证明影响多种致动脉粥样化生物标记物(图46和47)和炎症标记物(图49和50)。
[1312]
在研究的群体内,在患有混合性血脂异常(ldl
‑
c≥100mg/dl和甘油三酯≥200和<500mg/dl)的患者亚群中进行分析。分析十八位具有142mg/dl的基线平均ldl
‑
c水平、247mg/dl的基线平均甘油三酯水平和34kg/m2的bmi的患者(10位(薄膜包衣片剂d x 2)患者和8位安慰剂患者)(图48)。尽管未在此实施例的亚群中测量,但是一些心脏代谢患者可能具有升高的硫酸酯酶
‑
2(sulf
‑
2)水平,据信其引起经多配体蛋白多糖
‑
1(也称为“残余物受体”)介导的致动脉粥样化的残余物脂蛋白清除率降低。不受任何理论的束缚,在图48中所示的数据支持本发明者的看法:施用包含本发明化合物的薄膜包衣片剂d挽救残余物受体活性。
[1313]
本研究被设计为主要提出吉卡宾钙盐水合物晶型1在正采用最高剂量的他汀类药物的患者中的安全性。在患有高胆固醇血症的患者中,尽管正采用mi和hi他汀类药物,但是吉卡宾钙盐水合物晶型1引起致动脉粥样化和炎症标记物两者的显著降低(图46、47、49和50),没有增加肌肉或肝毒性的证据。
[1314]
由完成的临床研究,吉卡宾钙盐水合物晶型1功效(包括所有的背景疗法)的综合分析示出平均ldl
‑
c约21%的降低。采用最高的稳态他汀类药物下给出的吉卡宾钙盐水合物晶型1示出他汀类药物强度依赖效果。不受任何理论的束缚,他汀类药物强度依赖效果与三个与吉卡宾的药学上可接受的盐的作用机制有关的因子有关:1)吉卡宾的药学上可接受的盐增强vldl的残余物清除率,导致降低的血管内ldl
‑
c形成;2)降低血管内ldl
‑
c生产能允许基础ldl受体水平更有效地去除现有较小的ldl
‑
c池;和3)吉卡宾的药学上可接受的盐阻断肝胆固醇和甘油三酯合成,有可能降低肝vldl生产。他汀类药物抑制胆固醇合成和上调ldl受体表达以实现ldl
‑
c降低。他汀类药物越有效,则对这些过程的效果越大。
[1315]
不受任何理论的束缚,据信当他汀类药物强度增加时,ldl
‑
c降低的百分比减少可能由于吉卡宾的药学上可接受的盐对降低肝胆固醇生产的效果更小。低强度他汀类药物对肝胆固醇合成和ldl受体表达的效果未达最优化,并且因此吉卡宾的药学上可接受的盐通过经由残余物受体增强致动脉粥样化前驱体清除率以及添加额外的肝胆固醇合成抑制而
示出更大的ldl
‑
c降低。在最高的他汀类药物水平,如在此实施例中,胆固醇合成已受到显著的抑制,因此不受任何理论的束缚而使ldl受体高度表达和吉卡宾的药学上可接受的盐可能具有有限的额外肝胆固醇合成效果,但仍会维持降低血管内ldl
‑
c生产的能力。
[1316]
本研究支持除了ldl
‑
c以外的其他致动脉粥样化脂蛋白可影响患者的残留心血管(cv)风险并且apob和非hdl
‑
c的降低可与改进cv结果有更好的互相关联。最近的门德尔(mendelian)随机化分析表明降低ldl
‑
c的临床益处可能与降低含apob的脂蛋白粒子有关(ference等人,jama 2017;318(10)947
‑
956)。与吉卡宾的药学上可接受的盐的作用机制一致,患有混合性血脂异常的患者分别示出23%、19%、26%、34%和33%的ldl
‑
c、非hdl
‑
c、apob、apoe和tg的更多降低(图48)。
[1317]
cantos研究(novartis)报导当卡那单抗(canakinumab)添加至他汀类药物时进一步降低hscrp而不调节ldl
‑
c或其他的脂质,其提供以降低炎症而使cv风险降低的概念验证。因此,不受任何理论的束缚,降低致动脉粥样化脂蛋白和crp两者的药剂(例如吉卡宾的药学上可接受的盐)可具有比单独的降血脂可见的更大的cv风险益处。
[1318]
总之,作为最高剂量的背景他汀类药物的辅助性疗法的吉卡宾钙盐水合物晶型1被良好耐受并且示出ldl
‑
c的降低。没有观察到肌肉或肝相关毒性的证据。观察到以非hdl
‑
c、apob和apoe的降低反映的降低的致动脉粥样化负担。以降低的血清hscrp观察到降低的炎症。在患有具有特别高的致动脉粥样化粒子负担的混合性血脂异常的患者的心脏代谢群体中观察到更大的吉卡宾钙盐水合物晶型1效果。进一步,对致动脉粥样化脂蛋白和hscrp两者的安全性、耐受性和功效支持了持续的临床发展。
[1319]
实施例25.吉卡宾钙盐水合物晶型4的合成
[1320]
向20ml的闪烁小瓶中,加入约500mg的吉卡宾钙晶型1。向小瓶中加入约5ml的二甲基甲酰胺,并将所得的浆液在60℃下混合。在24、48和72小时后对混合物取样,其中通过xrpd分析每个样品。将小瓶转移至2℃下储存10天。10天后,将小瓶重新加热至60℃,并进一步浆化48小时。在24和48小时后取样并通过xrpd分析。然后通过离心分离该物质,并且随后将所得的潮湿固体在真空下于60℃干燥5小时。通过xrpd(图65a)、热重分析(tga)和差热分析(dta)(图65b)分析所得的干燥材料。tga显示,吉卡宾钙晶型4在100℃左右具有拐点,这表明失水。
[1321]
实施例26.吉卡宾钙盐水合物晶型5的合成
[1322]
将吉卡宾钙盐乙醇溶剂化物装入流化床干燥器中,并经受80℃空气约1小时。排出产物并取样以进行残留溶剂、水含量和xrpd分析。残留乙醇水平和水含量分别<0.02%和4.58%。不受任何理论的束缚,4.58%水含量可表明,在吉卡宾钙盐水合物晶型5中每摩尔吉卡宾钙盐存在一摩尔水。图66显示了吉卡宾钙盐水合物晶型5xrpd图,与先前分析的其他吉卡宾钙盐水合物多晶型物截然不同。还通过在摇床中于60℃下吉卡宾钙盐水合物晶型1的n,n
‑
二甲基甲酰胺消化(沉淀老化)持续6天而以小规模制备吉卡宾钙盐水合物晶型5。
[1323]
实施例27.吉卡宾钙盐水合物晶型6的合成
[1324]
将约500mg的无定形吉卡宾钙盐添加到小瓶中。向小瓶中加入约3ml至4ml水,并在环境温度(约25℃)混合样品以形成浆液。浆化1小时后,由于观察到稀浆液,将额外的无定形吉卡宾钙盐添加到小瓶中。将样品在环境温度(约25℃)混合约24小时。通过离心分离浆液,获得潮湿的吉卡宾钙盐水合物晶型6。将潮湿的吉卡宾钙盐水合物晶型6进一步干燥,获
得干燥的吉卡宾钙盐水合物晶型6。
[1325]
通过xrpd分析了潮湿的吉卡宾钙盐水合物晶型6和干燥的吉卡宾钙盐水合物晶型6(图67a)。还通过热重分析(tga)和差热分析(dta)分析了吉卡宾钙盐水合物晶型6(图67b)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1