通过发酵产生1,5-二氨基戊烷的经改造的生物合成途径的制作方法
相关申请的交叉引用
本申请要求2018年11月30日提交的美国临时申请62/774,016的优先权和权益,该临时申请以引用的方式全文纳入本文。
关于在联邦资助的研究和开发下进行的发明的权利的声明
本发明在由darpa授予的协议号为hr0011-15-9-0014下的政府支持下进行。政府对本发明拥有一定的权利。
以引用的方式纳入序列表
本申请包括序列表,该序列表以ascii格式电子提交并且以引用的方式全文纳入本文。该ascii副本于2019年11月20日生成,被命名为zmgnp026wo_sl.txt,大小为1,590,352字节。
本公开内容总体上涉及改造微生物用于通过发酵生产1,5-二氨基戊烷的领域。
背景技术:
1,5-二氨基戊烷是赖氨酸降解途径中的代谢物。具体而言,1,5-二氨基戊烷是通过赖氨酸的脱羧产生的。
在斑马鱼中,微量胺相关受体13c(或taar13c)已被鉴定为尸胺的高亲和力受体。[5]在人类中,分子建模和对接实验表明,尸胺契合人类taar6和taar8的结合口袋。
1,5-二氨基戊烷是血安定(pentolinium)的化学前体,它是一种神经节阻滞剂,其是通过抑制烟碱乙酰胆碱受体发挥作用。
技术实现要素:
本公开内容提供了经改造的微生物细胞、微生物细胞的培养物以及用于产生1,5-二氨基戊烷的方法,包括以下:
实施方案1:一种表达非天然的赖氨酸脱羧酶的经改造的微生物细胞,其中所述经改造的微生物细胞产生1,5-二氨基戊烷。
实施方案2:实施方案1的经改造的微生物细胞,其中所述经改造的微生物细胞也表达非天然的1,5-二氨基戊烷转运蛋白。
实施方案3:实施方案1或实施方案2的经改造的微生物细胞,其中所述经改造的微生物细胞表达一种或多种额外的酶,所述酶选自额外的非天然赖氨酸脱羧酶和/或额外的非天然1,5-二氨基戊烷转运蛋白。
实施方案4:实施方案3的经改造的微生物细胞,其中所述额外的酶来自与实施方案1或实施方案2中相应酶不同的生物体。
实施方案5:实施方案3或实施方案4的经改造的微生物细胞,其中所述额外的酶包含实施方案1或实施方案2中相应酶的一种或多种额外拷贝。
实施方案6:实施方案1-5中任一项的经改造的微生物细胞,其中所述经改造的微生物细胞包括一种或多种上游赖氨酸途径的酶的提高的活性,所述提高的活性为相对于对照细胞的提高。
实施方案7:实施方案1-6中任一项的经改造的微生物细胞,其中所述经改造的微生物细胞包括一种或多种酶的提高的活性,所述酶提高了还原形式的烟酰胺腺嘌呤二核苷酸磷酸(nadph)的供应,所述提高的活性为相对于对照细胞的提高。
实施方案8:实施方案7的经改造的微生物细胞,其中增加了还原形式的nadph的供应的一种或多种酶选自磷酸戊糖途径的酶、nadp+-依赖性甘油醛-3-磷酸脱氢酶(gapdh)和nadp+-依赖性谷氨酸脱氢酶。
实施方案9:实施方案1-8中任一项的经改造的微生物细胞,其中所述经改造的微生物细胞包括一种或多种消耗一种或多种赖氨酸途径前体的酶的降低的活性,所述降低的活性为相对于对照细胞的降低。
实施方案10:实施方案1-9中任一项的经改造的微生物细胞,其中所述经改造的微生物细胞包括天然赖氨酸输出蛋白的降低的活性,所述降低的活性为相对于对照细胞的降低。
实施方案11:实施方案10的经改造的微生物细胞,其中所述天然赖氨酸输出蛋白为谷氨酸棒状杆菌(corynebacteriumglutamicum)lyse或其直系同源物。
实施方案12:实施方案1-11中任一项经改造的微生物细胞,其中所述经改造的微生物细胞包括谷氨酸棒状杆菌ncgl0561基因或其直系同源物的降低的表达,所述降低的表达是相对于对照细胞的降低。
实施方案13:实施方案1-12中任一项的经改造的微生物细胞,其中所述经改造的微生物细胞包括谷氨酸棒状杆菌trpb基因或其直系同源物的降低的表达,所述降低的表达是相对于对照细胞的降低。
实施方案14:实施方案9-13中任一项的经改造的微生物细胞,其中所述降低的活性是通过一种或多种选自以下的方式实现的:基因缺失、基因破坏、改变基因调控、用活性较低的启动子替换天然启动子。
实施方案15:经改造的微生物细胞,其中所述经改造的微生物细胞包括用于表达非天然赖氨酸脱羧酶的工具(means),且其中所述经改造的微生物细胞产生1,5-二氨基戊烷。
实施方案16:实施方案15的经改造的微生物细胞,其中所述经改造的微生物细胞还包括用于表达非天然1,5-二氨基戊烷转运蛋白的工具。
实施方案17:实施方案15或实施方案16的经改造的微生物细胞,其中所述经改造的微生物细胞包括表达一种或多种额外的酶的工具,所述额外的酶选自额外的非天然赖氨酸脱羧酶和/或额外的非天然1,5-二氨基戊烷转运蛋白。
实施方案18:实施方案17的经改造的微生物细胞,其中所述额外的酶来自与实施方案15或实施方案16中的相应酶不同的生物体。
实施方案19:实施方案15-18中任一项的经改造的微生物细胞,其中所述经改造的微生物细胞包括用于提高一种或多种上游赖氨酸途径的酶的活性的工具,所述活性为相对于对照细胞的提高。
实施方案20:实施方案15-19中任一项的经改造的微生物细胞,其中所述经改造的微生物细胞包括用于提高一种或多种提高nadph供应的酶的活性的工具,所述活性为相对于对照细胞的提高。
实施方案21:实施方案20的经改造的微生物细胞,其中一种或多种提高还原形式的烟酰胺腺嘌呤二核苷酸磷酸(nadph)的供应的酶选自戊糖磷酸途径的酶、nadp+-依赖性甘油醛-3-磷酸脱氢酶(gapdh)和nadp+-依赖性谷氨酸脱氢酶。
实施方案22:实施方案15-21中任一项的经改造的微生物细胞,其中所述经改造的微生物细胞包括用于降低一种或多种消耗一种或多种赖氨酸途径前体的酶的活性的工具,所述活性为相对于对照细胞的降低。
实施方案23:实施方案15-22中任一项的经改造的微生物细胞,其中所述经改造的微生物细胞包括用于降低天然赖氨酸输出蛋白的活性的工具,所述活性为相对于对照细胞的降低。
实施方案24:实施方案23的经改造的微生物细胞,其中所述天然赖氨酸输出蛋白为谷氨酸棒状杆菌lyse或其直系同源物。
实施方案25:实施方案15-24中任一项的经改造的微生物细胞,其中所述经改造的微生物细胞包括用于降低谷氨酸棒状杆菌ncgl0561基因或其直系同源物的表达的工具,所述表达为相对于对照细胞的降低。
实施方案26:实施方案15-25中任一项的经改造的微生物细胞,其中所述经改造的微生物细胞包括用于降低谷氨酸棒状杆菌trpb基因或其直系同源物的表达的工具,所述表达是相对于对照细胞的降低。
实施方案27:实施方案1-26中任一项的经改造的微生物细胞,其中所述经改造的微生物细胞为细菌细胞。
实施方案28:实施方案27的经改造的微生物细胞,其中所述细菌细胞为棒状杆菌属的细胞。
实施方案29:实施方案28的经改造的微生物细胞,其中所述细菌细胞为谷氨酸(glutamicum)种的细胞。
实施方案30:实施方案29的经改造的微生物细胞,其中所述非天然赖氨酸脱羧酶包括与选自大肠杆菌(escherichiacoli)、霍乱弧菌(vibriocholerae)、暂定齿叶伯克氏菌(candidatusburkholderiacrenata)、产丁酸细菌及它们的任意组合的赖氨酸脱羧酶具有至少70%氨基酸序列同一性的赖氨酸脱羧酶。
实施方案31:实施方案30的经改造的微生物细胞,其中所述细胞包括至少三种不同的赖氨酸脱羧酶。
实施方案32:实施方案31的经改造的微生物细胞,其中所述经改造的微生物细胞包括与来自大肠杆菌、暂定齿叶伯克氏菌、产丁酸细菌的每一种赖氨酸脱羧酶具有至少70%氨基酸序列同一性的三种非天然赖氨酸脱羧酶。
实施方案33:实施方案32的经改造的微生物细胞,其中所述经改造的微生物细胞额外包括与来自矿山废水宏基因组的赖氨酸脱羧酶具有至少70%氨基酸序列同一性的非天然赖氨酸脱羧酶。
实施方案34:实施方案33的经改造的微生物细胞,其中所述来自大肠杆菌、暂定齿叶伯克氏菌、产丁酸细菌和矿山废水宏基因组的赖氨酸脱羧酶包含seqidno:87、97、30和93。
实施方案35:实施方案27的经改造的微生物细胞,其中所述细菌细胞为芽孢杆菌属(bacillus)的细胞。
实施方案36:实施方案35的经改造的微生物细胞,其中所述细菌细胞为枯草(subtilis)种的细胞。
实施方案37:实施方案36的经改造的微生物细胞,其中所述非天然赖氨酸脱羧酶包括与选自梭菌属(clostridium)种、金黄色葡萄球菌(staphylococcusaureus)及它们的任意组合的赖氨酸脱羧酶具有至少70%氨基酸序列同一性的赖氨酸脱羧酶。
实施方案38:实施方案37的经改造的微生物细胞,其中所述细胞包括至少三种不同的赖氨酸脱羧酶。
实施方案39:实施方案38的经改造的微生物细胞,其中所述经改造的微生物细胞包括与来自梭菌cag:221、梭菌cag:288和金黄色葡萄球菌的每一种赖氨酸脱羧酶具有至少70%氨基酸序列同一性的三种非天然赖氨酸脱羧酶。
实施方案40:实施方案1-26中任一项的经改造的微生物细胞,其中所述经改造的微生物细胞包括真菌细胞。
实施方案41:实施方案40的经改造的微生物细胞,其中所述经改造的微生物细胞包括酵母细胞。
实施方案42:实施方案41的经改造的微生物细胞,其中所述酵母细胞为酵母菌属(saccharomyces)的细胞。
实施方案43:实施方案42的经改造的微生物细胞,其中所述酵母细胞为酿酒(cerevisiae)种的细胞。
实施方案44:实施方案1-43中任一项的经改造的微生物细胞,其中所述非天然赖氨酸脱羧酶包括与选自小肠结肠炎耶尔森氏菌(yersiniaenterocolitica)、卡斯特兰尼氏菌(castellanielladetragans)、海洋原绿球藻(prochorococcusmarinus)及它们的任意组合的赖氨酸脱羧酶具有至少70%氨基酸序列同一性的赖氨酸脱羧酶。
实施方案45:实施方案44的经改造的微生物细胞,其中所述细胞包括至少三种不同的赖氨酸脱羧酶。
实施方案46:实施方案45的经改造的微生物细胞,其中所述经改造的微生物细胞包括与来自小肠结肠炎耶尔森氏菌、卡斯特兰尼氏菌和海洋原绿球藻的每一种赖氨酸脱羧酶具有至少70%氨基酸序列同一性的三种非天然赖氨酸脱羧酶。
实施方案47:实施方案1-46中任一项的经改造的微生物细胞,其中,在培养时,所述经改造的微生物细胞以至少5mg/l培养基的水平产生1,5-二氨基戊烷。
实施方案48:实施方案47的经改造的微生物细胞,其中,在培养时,所述经改造的微生物细胞以至少5gm/l培养基的水平产生1,5-二氨基戊烷。
实施方案49:实施方案48的经改造的微生物细胞,其中,在培养时,所述经改造的微生物细胞以至少25gm/l培养基的水平产生1,5-二氨基戊烷。
实施方案50:一种培养根据实施方案1-49中任一项的经改造的微生物细胞的方法,所述方法包括在适于产生1,5-二氨基戊烷的条件下培养细胞。
实施方案51:实施方案50的方法,其中所述方法包括分批补料培养,初始葡萄糖水平范围为1-100g/l,然后是受控的糖补料。
实施方案52:实施方案50或实施方案51的方法,其中所述发酵底物包括葡萄糖和选自尿素、铵盐、氨及它们的任意组合的氮源。
实施方案53:实施方案50-52中任一项的方法,其中在培养过程中所述培养物是ph受控的。
实施方案54:实施方案50-53中任一项的方法,其中在培养过程中给所述培养物充气。
实施方案55:实施方案50-54中任一项的方法,其中所述经改造的微生物细胞以至少5mg/l培养基的水平产生1,5-二氨基戊烷。
实施方案56:实施方案50-55中任一项的方法,其中所述方法还包括从培养物中回收1,5-二氨基戊烷。
实施方案57:使用经改造以产生1,5-二氨基戊烷的微生物细胞来制备1,5-二氨基戊烷的方法,所述方法包括:(a)在微生物细胞中表达非天然赖氨酸脱羧酶;(b)在适合的培养基中,在允许微生物细胞产生1,5-二氨基戊烷的条件下培养微生物细胞,其中所述1,5-二氨基戊烷被释放到培养基中;和(c)从培养基中分离1,5-二氨基戊烷。
附图说明
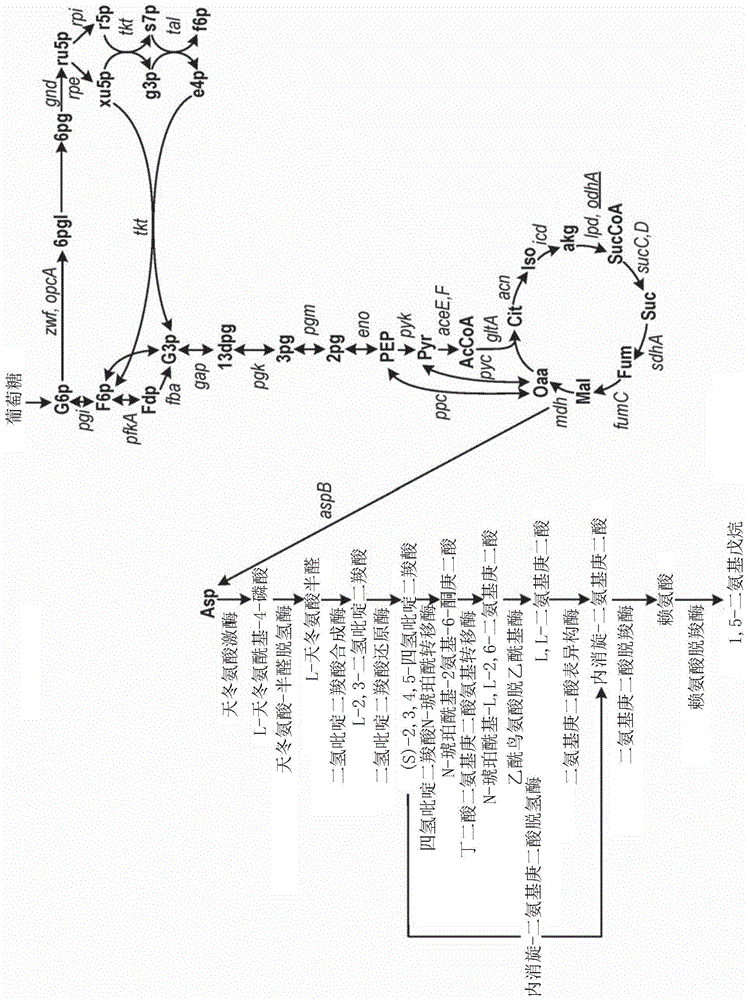
图1:1,5-二氨基戊烷的生物合成途径
图2:第一轮经改造的宿主谷氨酸棒状杆菌进行的发酵之后,在细胞外培养液中测定的1,5-二氨基戊烷效价(titer)。(另见实施例1)
图3:第一轮经改造的宿主酿酒酵母(saccharomycescerevisiae)进行的发酵之后,在细胞外培养液中测定的1,5-二氨基戊烷效价。(另见实施例1)
图4:第一轮经改造的宿主枯草芽孢杆菌(bacillussubtilis)进行的发酵之后,在细胞外培养液中测定的1,5-二氨基戊烷效价。(另见实施例1)
图5:第二轮经改造的宿主谷氨酸棒状杆菌进行的发酵之后,在细胞外培养液中测定的1,5-二氨基戊烷效价。(另见实施例1)
图6:在经改造而缺失ncgl0561基因(ncgl0561_del)或缺失ncgl2931基因的谷氨酸棒状杆菌(其编码色氨酸合酶的β亚基(ncgl2931_p3221))进行的发酵后,在细胞外培养液中测定的1,5-二氨基戊烷效价。
图7:将启动子-基因-终止子整合到酿酒酵母和解脂亚罗酵母(yarrowialipolytica)中。
图8:酿酒酵母和解脂亚罗酵母中的启动子替换。
图9:酿酒酵母和解脂亚罗酵母中的靶向基因缺失。
图10:将启动子-基因-终止子整合到谷氨酸棒状杆菌和枯草芽胞杆菌中。
图11:第三轮经改造的宿主谷氨酸棒状杆菌进行的发酵之后,在细胞外培养液中测定的1,5-二氨基戊烷效价。(另见实施例1)
图12:经改造的谷氨酸棒状杆菌菌株cgcadav_107的生物反应器生产运行,得到27g/l的1,5-二氨基戊烷效价。(参见实施例2)
具体实施方式
本公开内容描述了由微生物宿主分别从简单的碳源和氮源(如葡萄糖和尿素)通过发酵产生小分子1,5-二氨基戊烷的方法。这一目标可以通过将非天然的代谢途径引入到适合的微生物宿主中以用于化学产品的工业发酵来实现。示例性宿主包括酿酒酵母、解脂亚罗酵母、谷氨酸棒状杆菌和枯草芽孢杆菌。经改造的代谢途径将宿主的中心代谢与非天然的途径联系起来,从而能够产生1,5-二氨基戊烷。这种方法最简单的实施方案是在具有1,5-二氨基戊烷生产所必需的其他酶的微生物宿主菌株(参见图1;即,产生赖氨酸的任意菌株)中表达酶,如非天然赖氨酸脱羧酶,上文提到的所有示例性宿主均是如此。
以下公开内容描述了如何改造具有必要特征的微生物,以从简单的碳源和氮源产生工业上可行的1,5-二氨基戊烷的效价。已鉴定了活性赖氨酸脱羧酶,其能使谷氨酸棒状杆菌、酿酒酵母和枯草芽孢杆菌产生1,5-二氨基戊烷,并且已发现赖氨酸脱羧酶的额外拷贝的表达提高了1,5-二氨基戊烷的效价。例如,在本文记载的工作中,实现了在谷氨酸棒状杆菌中的约27gm/l1,5-二氨基戊烷的效价、在酿酒酵母中的约5mg/l1,5-二氨基戊烷的效价和在枯草芽孢杆菌中的约47mg/l1,5-二氨基戊烷的效价。
定义
除非另外具体说明,权利要求书和说明书中使用的术语如下文所定义。
术语“发酵”在本文中用于指这样的过程,即其中微生物细胞通过一个或多个生物转化步骤将一种或多种底物转化为所需产物(例如1,5-二氨基戊烷),而不需要任何化学转化步骤。
本文中使用的术语“经改造的(engineered)”与细胞有关,用于表示所述细胞包含至少一种人工引入的靶向遗传改变,该遗传改变使经改造的细胞区别于天然存在的细胞。
术语“天然的”在本文中用于指天然存在于特定细胞中的细胞组分,例如多核苷酸或多肽。天然多核苷酸或多肽是细胞内源性的。
当用于多核苷酸或多肽时,术语“非天然的”是指并非天然存在于特定细胞中的多核苷酸或多肽。
当用于其中表达基因的环境时,术语“非天然的”是指在不同于其天然表达的基因组和细胞环境的任何环境中表达的基因。以非天然方式表达的基因可能与宿主细胞中相应基因具有相同的核苷酸序列,但可能从载体表达或从基因组中与天然基因的基因座不同的整合点表达。
术语“异源的”在本文中用于描述被引入到宿主细胞中的多核苷酸或多肽。该术语包括分别来自不同于宿主细胞的生物体、菌种或菌株的多核苷酸或多肽。在这种情况下,异源的多核苷酸或多肽的序列不同于同一宿主细胞中存在的任何序列。然而,该术语还包括其序列与在宿主细胞中存在的序列相同的多核苷酸或多肽,其中所述多核苷酸或多肽存在于与天然序列不同的环境中(例如,异源多核苷酸可以连接到与天然序列不同的启动子上,并插入到不同的基因组位置)。因此,“异源表达”包括宿主细胞0非天然序列的表达,以及在非天然环境下宿主细胞天然序列的表达。
当用于多核苷酸或多肽时,术语“野生型”是指具有存在于来自天然存在的生物体的多核苷酸或多肽中的核苷酸序列的任何多核苷酸或具有存在于来自天然存在的生物体的多核苷酸或多肽中的氨基酸序列的任何多肽,无论分子来源如何;即,术语“野生型”是指序列特征,无论所述分子是从天然来源中纯化;重组表达,然后纯化;或合成的。术语“野生型”还用于指天然存在的细胞。
“对照细胞”是这样的细胞,其在其他方面与所测试的经改造的细胞相同,包括与经改造的细胞为相同属和种,但是缺少在经改造的细胞中所测试的特定遗传修饰。
在本文中,酶是通过它们催化的反应来鉴定,除非另外说明,酶是指能够催化所鉴定的反应的任何多肽。除非另外说明,酶可源自任何生物体,并且可具有天然的或突变的氨基酸序列。本领域中公知,酶可以具有多种功能和/或多个名称,有时取决于它们所源自的生物体。本文使用的酶名称涵盖了直系同源物,包括可具有一种或多种额外的功能或不同名称的酶。
本文中使用的术语“反馈失调的”与在特定细胞中通常被酶通路的下游产物负调控(即反馈抑制)的酶有关。在这种情况下,“反馈失调的”酶是这种形式的酶,其与细胞原生的酶或细胞原生的酶形式相比,对反馈抑制更加不敏感,但与所述酶的一种或多种其他天然形式相比,天然对反馈抑制更加不敏感。反馈失调的酶可以通过将一种或多种突变引入到天然酶中而产生。或者,反馈失调的酶可以仅仅为异源天然酶,当其被引入到特定微生物细胞中时,对反馈抑制的敏感度不如原生的天然酶。在一些实施方案中,反馈失调的酶在微生物细胞中不显示出反馈抑制。
术语“1,5-二氨基戊烷”是指还称为“戊烷-1,5-二胺”和“尸胺”(cas#cas462-94-2)的式c5h14n2的化合物。
在两个或多个氨基酸或核苷酸序列的情况下,术语“序列同一性”是指当进行比较并进行最大对应性的比对时,相同或具有特定的相同氨基酸残基或核苷酸百分比的两个或多个序列,如使用序列比较算法或通过目测来测量的。
对于序列比较以确定百分比核苷酸或氨基酸序列同一性,通常一个序列作为“参考序列”,将“测试”序列与之进行比较。当使用序列比较算法时,将测试序列和参考序列输入到计算机中,如果必要,指定子序列坐标,并且指定序列算法程序参数。然后基于指定的程序参数,序列比较算法计算测试序列相对于参考序列的百分比序列同一性。使用设置默认参数的blast,可以进行序列比对以进行比较。
本文使用的术语“效价”是指由微生物细胞培养物产生的产物(例如1,5-二氨基戊烷)的质量除以培养物体积。
关于从细胞培养物中回收1,5-二氨基戊烷,本文使用的“回收”是指从至少一种细胞培养基的其他组分中分离出1,5-二氨基戊烷。
改造微生物用于1,5-二氨基戊烷生产
1,5-二氨基戊烷生物合成途径
1,5-二氨基戊烷通常时通过一个酶促步骤(需要赖氨酸脱羧酶)由赖氨酸获得。1,5-二氨基戊烷生物合成途径示出于图1中。这种酶在谷氨酸棒状杆菌、酿酒酵母或枯草芽孢杆菌中不是天然表达的。通过添加至少一种非天然的赖氨酸脱羧酶,使得可以在这些宿主中的每一个中进行1,5-二氨基戊烷生产。
用于微生物1,5-二氨基戊烷生产的改造
可将在被改造的微生物细胞中具备活性的任何赖氨酸脱羧酶引入到细胞中,通常通过使用标准的基因工程技术引入和表达编码所述酶的基因。适合的赖氨酸脱羧酶可来自任何来源,包括植物、古细菌、真菌、革兰氏阳性细菌和革兰氏阴性细菌来源。示例性来源包括但不限于:大肠杆菌、霍乱弧菌、暂定齿叶伯克氏菌、产丁酸细菌、梭菌属种(如:梭菌cag:221、梭菌cag:288)、金黄色葡萄球菌、小肠结肠炎耶尔森氏菌、卡斯特兰尼氏菌和海洋原绿球藻。
可将任意这些基因的一个或多个拷贝引入所选微生物宿主细胞中。如果引入多于一个拷贝的基因,则所述拷贝可具有相同或不同核苷酸序列。在一些实施方案中,从强的组成型启动子表达一种或两种(或全部)异源基因。在一些实施方案中,从诱导型启动子表达异源基因。异源基因可以任选地进行密码子优化,以增强在所选微生物宿主细胞中的表达。
实施例1证明,在谷氨酸棒状杆菌中,在整合三种非天然酶后的第一轮改造中实现了约300mg/l1,5-二氨基戊烷的效价。(参见图2)。这种菌株表达来自大肠杆菌(菌株k12)、大肠杆菌o157:h7和霍乱弧菌血清型01(菌株atcc39315/eltorinaban16961)的赖氨酸脱羧酶。
实施例1证明,在酿酒酵母中,在整合来自小肠结肠炎耶尔森氏菌w22703、卡斯特兰尼氏菌65phen和海洋原绿球藻菌株it9314中的每一个的赖氨酸脱羧酶后的第一轮改造中实现了约5mg/l的效价。(参见图3)
实施例1证明,在枯草芽孢杆菌中,在整合来自梭菌cag:221、梭菌cag:288和金黄色葡萄球菌中的每一个的赖氨酸脱羧酶后的第一轮改造中实现了约47mg/l的效价。(参见图4)
在谷氨酸棒状杆菌中进行第二轮改造(实施例1)。在整合来自大肠杆菌ms117-3、暂定齿叶伯克氏菌和产丁酸细菌ss3/4中的每一个的赖氨酸脱羧酶后实现了约5.5gm/l的效价。(cgcadav_107;参见图5)。在谷氨酸棒状杆菌中的第三轮改造(实施例1),在这些酶中加入了来自矿山废水宏基因组(seqidno:93)的赖氨酸脱羧酶,将效价提高到7.0gm/l(cgcadav_306;参见图11)。
实施例2证明,使用cgcadav_107(表达来自大肠杆菌ms117-3、暂定齿叶伯克氏菌和产丁酸细菌ss3/4中的每一个的赖氨酸脱羧酶)的生物反应器生产运行实现了约27gm/l1,5-二氨基戊烷的效价。
提高上游酶的活性
在能够产生1,5-二氨基戊烷的微生物细胞中提高1,5-二氨基戊烷生产的一个方法是提高1,5-二氨基戊烷生物合成途径中的一种或多种上游酶的活性。上游途径的酶包括从进料直到最终天然代谢物的转化中涉及的所有酶。用于此目的的示例性酶包括但不限于图1中所示的在从天冬氨酸(“asp”)到赖氨酸的路径中的那些。适合的编码这些酶的上游途径基因可来自任何可获得的来源,包括例如,上文中作为赖氨酸脱羧酶的来源被讨论的那些。
在一些实施方案中,通过调节天然酶的表达或活性来提高一种或多种上游途径的酶的活性。例如,可以利用这些酶的表达或活性的天然调节因子来提高适合的酶的活性。
或者,或另外,使用例如图8所示的技术,一个或多个启动子可以置换天然启动子。在某些实施方案中,替换启动子比天然启动子更强,和/或为组成型启动子。
在一些实施方案中,一种或多种上游途径的酶的活性通过将一种或多种相应的基因引入到经改造的微生物宿主细胞中来补充。所引入的上游途径基因可能来自宿主细胞以外的生物体,或仅为天然基因的额外拷贝。在一些实施方案中,将一种或多种这样的基因引入到能够产生1,5-二氨基戊烷的微生物宿主细胞中,并从强的组成型启动子表达,和/或可任选地对所述基因进行密码子优化以增强在所选微生物宿主细胞中的表达。
在多个实施方案中,改造产生1,5-二氨基戊烷的微生物细胞以提高一种或多种上游途径的酶的活性,这将1,5-二氨基戊烷效价提高至少10%、20%、30%、40%、50%、60%、70%、80%或90%,或至少2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、5.5倍、6倍、6.5倍、7倍、7.5倍、8倍、8.5倍、9倍、9.5倍、10倍、11倍、12倍、13倍、14倍、15倍、16倍、17倍、18倍、19倍、20倍、21倍、22倍、23倍、24倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍、75倍、80倍、85倍、90倍、95倍、100倍、150倍、200倍、250倍、300倍、350倍、400倍、450倍、500倍、550倍、600倍、650倍、700倍、750倍、800倍、850倍、900倍、950倍或1000倍。在多个实施方案中,1,5-二氨基戊烷效价的提高在10倍至1000倍、20倍至500倍、50倍至400倍、10倍至300倍的范围内,或以上列出的任何数值界定的任何范围内。(本文的范围包括它们的端点)。这些提高是相对于在上游途径的酶活性没有任何提高的产1,5-二氨基戊烷微生物细胞中观察到的1,5-二氨基戊烷效价而确定。这种参考细胞可具有一种或多种旨在增加1,5-二氨基戊烷生产的其他遗传改变。
在多个实施方案中,通过提高一种或多种上游途径的酶的活性而实现的1,5-二氨基戊烷效价为至少10、20、30、40、50、75、100、200、300、400、500、600、700、800或900mg/l或至少1、1.5、2、2.5、3、3.5、4、4.5、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140或150gm/l。在多个实施方案中,所述效价在10mg/l至150gm/l、20mg/l至140gm/l、50mg/l至130gm/l、100mg/l至120gm/l、500mg/l至110gm/l的范围内,或以上列出的任何数值界定的任何范围内。
增加nadph供应
在能够产生1,5-二氨基戊烷的微生物细胞中提高1,5-二氨基戊烷产生的另一方法是提高还原形式的烟酰胺腺嘌呤二核苷酸磷酸(nadph)(其为生物合成反应提供还原等价物)的供应。例如,提高nadph供应的一种或多种酶的活性可通过与上文针对上游途径的酶记载的那些方式类似的方式来提高,例如,通过调节天然酶的表达或活性、用更强的和/或组成型启动子来替代天然启动子,和/或引入一种或多种编码增加nadph供应的酶的基因。用于此目标的示例性的酶包括但不限于磷酸戊糖途径的酶、nadp+-依赖性甘油醛-3-磷酸脱氢酶(gapdh)和nadp+-依赖性谷氨酸脱氢酶。这类酶可来自任何可获得的来源,包括例如,上文中作为赖氨酸脱羧酶的来源被讨论的那些。
在多个实施方案中,改造产生1,5-二氨基戊烷的微生物细胞以提高一种或多种这类酶的活性,这将1,5-二氨基戊烷效价提高至少10%、20%、30%、40%、50%、60%、70%、80%或90%,或至少2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、5.5倍、6倍、6.5倍、7倍、7.5倍、8倍、8.5倍、9倍、9.5倍、10倍、11倍、12倍、13倍、14倍、15倍、16倍、17倍、18倍、19倍、20倍、21倍、22倍、23倍、24倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍、75倍、80倍、85倍、90倍、95倍、100倍、150倍、200倍、250倍、300倍、350倍、400倍、450倍、500倍、550倍、600倍、650倍、700倍、750倍、800倍、850倍、900倍、950倍或1000倍。在多个实施方案中,1,5-二氨基戊烷效价的提高在10倍至1000倍、20倍至500倍、50倍至400倍、10倍至300倍的范围内,或以上列出的任何数值界定的任何范围内。(本文的范围包括它们的端点)。这些提高是相对于在这类酶活性没有任何提高的产1,5-二氨基戊烷微生物细胞中测定的1,5-二氨基戊烷效价而确定。这种参考细胞可具有一种或多种旨在增加1,5-二氨基戊烷生产的其他遗传改变。
在多个实施方案中,通过提高一种或多种增加nadph供应的酶的活性而实现的1,5-二氨基戊烷效价为至少10、20、30、40、50、75、100、200、300、400、500、600、700、800或900mg/l,或至少1、1.5、2、2.5、3、3.5、4、4.5、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140或150gm/l。在多个实施方案中,所述效价在10mg/l至150gm/l、20mg/l至140gm/l、50mg/l至130gm/l、100mg/l至120gm/l、500mg/l至110gm/l的范围内,或以上列出的任何数值界定的任何范围内。
反馈失调的酶
由于赖氨酸生物合成受到反馈抑制,在经改造以产生1,5-二氨基戊烷的微生物细胞中提高1,5-二氨基戊烷生产的另一方法是引入通常受到反馈调节的一种或多种酶的反馈失调形式。这种酶的实例包括葡萄糖-6-磷酸脱氢酶、atp磷酸核糖基转移酶和天冬氨酸激酶。反馈失调形式可以是异源的天然酶,其在特定微生物宿主细胞中与天然酶相比对反馈抑制更不敏感。或者,反馈失调形式可以是天然或异源酶的变体,其具有一个或多个突变或截短,使其与对应的天然酶相比对反馈抑制更不敏感。
在一些实施方案中,不需要传统意义上的“引入”反馈失调的酶。相反,所选用于改造的微生物宿主细胞可以是具有天然对反馈抑制不敏感的天然酶的细胞。
在多个实施方案中,改造产生1,5-二氨基戊烷的微生物细胞以包括一种或多种反馈调节酶,这将1,5-二氨基戊烷效价提高至少10%、20%、30%、40%、50%、60%、70%、80%或90%,或至少2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、5.5倍、6倍、6.5倍、7倍、7.5倍、8倍、8.5倍、9倍、9.5倍、10倍、11倍、12倍、13倍、14倍、15倍、16倍、17倍、18倍、19倍、20倍、21倍、22倍、23倍、24倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍、75倍、80倍、85倍、90倍、95倍、100倍、150倍、200倍、250倍、300倍、350倍、400倍、450倍、500倍、550倍、600倍、650倍、700倍、750倍、800倍、850倍、900倍、950倍或1000倍。在多个实施方案中,1,5-二氨基戊烷效价的提高在10倍至1000倍、20倍至500倍、50倍至400倍、10倍至300倍的范围内,或以上列出的任何数值界定的任何范围内。这些提高是相对于在不包括用于减少反馈调节的基因改变的产1,5-二氨基戊烷微生物细胞中观察的1,5-二氨基戊烷效价而确定。这种参考细胞可(但不需要)具有旨在增加1,5-二氨基戊烷生产的其他遗传改变,即,细胞可具有上游途径的酶的提高的活性。
在多个实施方案中,通过降低反馈失调而实现的1,5-二氨基戊烷效价为至少10、20、30、40、50、75、100、200、300、400、500、600、700、800或900mg/l,或至少1、1.5、2、2.5、3、3.5、4、4.5、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140或150gm/l。在多个实施方案中,所述效价在10mg/l至150gm/l、20mg/l至140gm/l、50mg/l至130gm/l、100mg/l至120gm/l、500mg/l至110gm/l的范围内,或以上列出的任何数值界定的任何范围内。
减少前体消耗
在能够产生1,5-二氨基戊烷的微生物细胞中增加1,5-二氨基戊烷生产的另一种方法是降低一种或多种消耗一种或多种1,5-二氨基戊烷途径前体的酶的活性。在一些实施方案中,通过调节天然酶的表达或活性来降低一种或多种这样的酶的活性。该类型的示例性酶包括高丝氨酸脱氢酶和细胞壁生物合成途径基因。例如,用活性较低或失活的启动子替换对应基因的天然启动子,或者通过缺失对应的基因,可以使这样的酶的活性降低。参见图8和图9,其分别为酿酒酵母和解脂亚罗酵母中启动子替换和靶向基因缺失的方案的实例。
在多个实施方案中,改造产生1,5-二氨基戊烷的微生物细胞以减少一个或多个旁路的前体消耗,这将1,5-二氨基戊烷效价提高至少10%、20%、30%、40%、50%、60%、70%、80%或90%,或至少2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、5.5倍、6倍、6.5倍、7倍、7.5倍、8倍、8.5倍、9倍、9.5倍、10倍、11倍、12倍、13倍、14倍、15倍、16倍、17倍、18倍、19倍、20倍、21倍、22倍、23倍、24倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍、75倍、80倍、85倍、90倍、95倍、100倍、150倍、200倍、250倍、300倍、350倍、400倍、450倍、500倍、550倍、600倍、650倍、700倍、750倍、800倍、850倍、900倍、950倍或1000倍。在多个实施方案中,1,5-二氨基戊烷效价的提高在10倍至1000倍、20倍至500倍、50倍至400倍、10倍至300倍的范围内,或以上列出的任何数值界定的任何范围内。这些提高是相对于在不包括用于减少前体消耗的基因改变的产1,5-二氨基戊烷微生物细胞中观察的1,5-二氨基戊烷效价而确定。这种参考细胞可(但不需要)具有旨在增加1,5-二氨基戊烷产生的其他遗传改变,即,细胞可具有上游途径的酶的提高的活性。
在多个实施方案中,通过减少前体消耗而实现的1,5-二氨基戊烷效价为至少10、20、30、40、50、75、100、200、300、400、500、600、700、800或900mg/l,或至少1、1.5、2、2.5、3、3.5、4、4.5、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140或150gm/l。在多个实施方案中,所述效价在10mg/l至150gm/l、20mg/l至140gm/l、50mg/l至130gm/l、100mg/l至120gm/l、500mg/l至110gm/l的范围内,或以上列出的任何数值界定的任何范围内。
上文所述的任何用于提高1,5-二氨基戊烷生产的方法可以任何组合方式进行组合以实现甚至更高的1,5-二氨基戊烷产生水平。
1,5-二氨基戊烷转运蛋白的表达
在一些实施方案中,有利的是从培养基中回收1,5-二氨基戊烷。为了提高该化合物从经改造的微生物细胞内部向培养基的转运,可以将在经改造的微生物细胞中具有活性的1,5-二氨基戊烷转运蛋白引入到细胞中,通常通过使用标准基因工程技术引入和表达编码所述酶的基因进行。合适的1,5-二氨基戊烷转运蛋白可以来自任何可获得的来源,包括例如大肠杆菌。
示例性的氨基酸和核苷酸序列
下表标识了实施例1中使用的氨基酸和核苷酸序列。相应的序列示出于序列表中。
微生物宿主细胞
可以改造任何可用于表达引入基因的微生物,用于如上文所述发酵产生1,5-二氨基戊烷。在某些实施方案中,微生物是天然无法发酵产生1,5-二氨基戊烷的微生物。在一些实施方案中,微生物是易于培养的微生物,例如,已知适用于作为目的化合物发酵生产中的宿主细胞的微生物。可以如上文所述,改造细菌细胞,包括革兰氏阳性细菌或革兰氏阴性细菌。除谷氨酸棒状杆菌细胞以外,实例还包括枯草芽孢杆菌、地衣芽孢杆菌(b.licheniformis)、迟缓芽孢杆菌(b.lentus)、短芽孢杆菌(b.brevis)、嗜热脂肪芽孢杆菌(b.stearothermophilus)、嗜碱芽孢杆菌(b.alkalophilus)、解淀粉芽孢杆菌(b.amyloliquefaciens)、克劳氏芽孢杆菌(b.clausii)、耐盐芽孢杆菌(b.halodurans)、巨大芽孢杆菌(b.megaterium)、凝结芽孢杆菌(b.coagulans)、环状芽孢杆菌(b.circulans)、灿烂芽孢杆菌(b.lautus)、苏云金芽孢杆菌(b.thuringiensis)、白色链霉菌(s.albus)、变铅青链霉菌(s.lividans)、天蓝色链霉菌(s.coelicolor)、灰色链霉菌(s.griseus)、假单胞菌属种、产碱假单胞菌(p.alcaligenes)、柑橘假单胞菌(p.citrea)、乳杆菌属种(lactobacilisspp.)(例如乳酸乳杆菌(l.lactis)、植物乳杆菌(l.plantarum))、灰色乳杆菌(l.grayi)、大肠杆菌、粪肠球菌(e.faecium)、鹑鸡肠球菌(e.gallinarum)、酪黄肠球菌(e.casseliflavus)和/或粪肠球菌(e.faecalis)细胞。
有多种类型的厌氧细胞可用作本文所述方法中的微生物宿主细胞。在一些实施方案中,微生物细胞是专性厌氧细胞。专性厌氧菌在存在氧的条件下通常无法良好生长(如果不是完全不生长的话)。应理解,可存在少量氧,即专性厌氧菌对低水平的氧具有一定的耐受水平。如上文所述改造的专性厌氧菌可生长在基本无氧的条件下,其中存在的氧的量对厌氧菌的生长、维持和/或发酵无害。
或者,用于本文所述方法的微生物宿主细胞可以是兼性厌氧细胞。如果存在氧,兼性厌氧菌可通过有氧呼吸(例如利用tca循环)产生细胞atp。但是,兼性厌氧菌还可在无氧情况下生长。如上文所述改造的兼性厌氧菌可以在基本无氧的条件下生长,其中存在的氧的量对厌氧菌的生长、维持和/或发酵无害,或者可以在存在较大量的氧的情况下生长。
在一些实施方案中,用于本文所述方法的微生物宿主细胞是丝状真菌细胞。(参见,例如berka&barnett,biotechnologyadvances,(1989),7(2):127-154)。实例包括长枝木霉(trichodermalongibrachiatum)、绿色木霉(t.viride)、康氏木霉(t.koningii)、哈茨木霉(t.harzianum)、青霉菌属种(penicilliumsp.)、特异腐质霉(humicolainsolens)、h.lanuginose、灰腐质霉(h.grisea)、金孢子菌属种(chrysosporiumsp.)、鲁克文金孢菌(c.lucknowense)、粘帚霉属种(gliocladiumsp.)、曲霉属种(aspergillussp.)(例如,米曲霉(a.oryzae)、黑曲霉(a.niger)、酱油曲霉(a.sojae)、日本曲霉(a.japonicus)、构巢曲霉(a.nidulans)或泡盛曲霉(a.awamori))、镰刀菌属种(fusariumsp.)(例如,粉红镰刀菌(f.roseum)、禾谷镰刀菌(f.graminum)、禾谷镰刀菌(f.cerealis)、f.oxysporuim或镶片镰孢霉(f.venenatum))、链孢霉属种(neurosporasp.)(例如,粗糙链孢霉(n.crassa)或肉座菌属种(hypocreasp.))、毛霉属种(mucorsp.)(例如,白色毛霉(m.miehei))、根霉属种(rhizopussp.)和裸胞壳属种(emericellasp.)细胞。在具体实施方案中,如上文所述改造的真菌细胞是构巢曲霉、泡盛曲霉、米曲霉、棘孢曲霉(a.aculeatus)、黑曲霉、日本曲霉、里氏木霉(t.reesei)、绿色木霉、f.oxysporum或腐皮镰刀菌(f.solani)。用于这样的宿主的示例性质粒或质粒组件包括美国专利公开2011/0045563中描述的那些。
酵母还可用作本文所述方法中的微生物宿主细胞。实例包括:酵母属种(saccharomycessp.)、裂殖酵母属种(schizosaccharomycessp.)、毕赤酵母属种(pichiasp.)、多形汉逊酵母(hansenulapolymorpha)、叶柄毕赤酵母(pichiastipites)、马克斯克鲁维酵母(kluyveromycesmarxianus)、克鲁维酵母属种(kluyveromycesspp.)、解脂亚罗酵母和假丝酵母属种(candidasp.)。在一些实施方案中,酵母属种是酿酒酵母(参见,例如romanosetal.,yeast,(1992),8(6):423-488)。用于这类宿主的示例性质粒或质粒组件包括美国专利7,659,097和美国专利公开2011/0045563中描述的那些。
在一些实施方案中,宿主细胞可以是藻类细胞,其来自绿藻、红藻、灰胞藻(glaucophyte)、绿蜘藻(chlorarachniophyte)、眼虫(euglenid)、假菌界(chromista)或鞭毛藻(dinoflagellate)。(参见例如,saunders&warmbrodt,“geneexpressioninalgae和fungi,includingyeast,”(1993),nationalagriculturallibrary,beltsville,md.)。用于藻类细胞的示例性质粒或质粒组件包括美国专利公开2011/0045563中描述的那些。
在其他实施方案中,宿主细胞是蓝细菌,例如根据形态学归类到以下组中任一组的蓝细菌:绿球藻目(chlorococcales)、宽球藻目(pleurocapsales)、颤藻目(oscillatoriales)、念珠藻目(nostocales)、synechosystic或真枝藻目(stigonematales)(参见,例如lindbergetal.,metab.eng.,(2010)12(1):70-79)。用于蓝细菌细胞的示例性质粒或质粒组件包括美国专利公开2010/0297749和2009/0282545以及国际专利公开wo2011/034863中描述的那些。
基因工程方法
使用本领域技术范围内的常规的分子生物学(包括重组技术)、微生物学、细胞生物学和生物化学技术,可以改造微生物细胞,用于发酵性1,5-二氨基戊烷生产。这类技术在文献中有充分解释,参见,例如“molecularcloning:alaboratorymanual,”fourthedition(sambrooketal.,2012);“oligonucleotidesynthesis”(m.j.gait,ed.,1984);“cultureofanimalcells:amanualofbasictechnique和specializedapplications”(r.i.freshney,ed.,6thedition,2010);“methodsinenzymology”(academicpress,inc.);“currentprotocolsinmolecularbiology”(f.m.ausubeletal.,eds.,1987,andperiodicupdates);“pcr:thepolymerasechainreaction,”(mullisetal.,eds.,1994);singletonetal.,dictionaryofmicrobiology和molecularbiology2nded.,j.wiley&sons(newyork,n.y.1994)。
载体是用于将遗传物质引入到细胞中的多核苷酸载体。适用于本文所述方法的载体可以是线性的或环状的。载体可整合到宿主细胞的靶基因组中或在宿主细胞中独立复制。对于许多应用而言,优选产生稳定转化体的整合载体。载体可包含,例如,复制起点、多克隆位点(mcs)和/或选择性标记物。表达载体通常包括含有调控元件的表达盒,所述调控元件促进多核苷酸序列(通常为编码序列)在特定宿主细胞中的表达。载体包括但不限于,整合载体、原核质粒、附加体(episome)、病毒载体、粘粒和人工染色体。
可用于表达盒的示例性调控元件包括启动子、增强子、内部核糖体进入位点(ires)和其他表达调控元件(例如转录终止信号,如多腺苷酸化信号和poly-u序列)。这类调控元件记载于,例如goeddel,geneexpressiontechnology:methodsinenzymology185,academicpress,sandiego,calif.(1990)。
在一些实施方案中,载体可用于引入能够进行基因组编辑的系统,例如crispr系统。参见2014年3月6日公布的美国专利公开2014/0068797;还可参见jinekm.,etal.,“aprogrammabledual-rna-guideddnaendonucleaseinadaptivebacterialimmunity,”science337:816–21,2012)。在ii型crispr-cas9系统中,cas9是定点核酸内切酶,即使用两个不同的核酸内切酶结构域(hnh和ruvc/类rnaseh结构域)可被定向以在特定靶序列切割多核苷酸的酶。可改造cas9以在任何所需位点切割dna,因为cas9是由rna定向到其切割位点。因此,cas9还被描述为“rna引导的核酸酶”。更具体而言,cas9与一个或多个rna分子连接,所述rna分子将cas9导向至特定的靶多核苷酸,这是基于所述rna分子的至少一部分与靶多核苷酸的特定序列杂交。ran,f.a.等人(“invivogenomeeditingusingstaphylococcusaureuscas9,”nature520(7546):186-91,2015,apr9],包括全部扩展数据)提供了crrna/tracrrna序列和八种ii型crispr-cas9系统的二级结构。类cas9合成蛋白也是本领域已知的(参见2014年10月23日公开的美国公开专利申请2014-0315985)。
实施例1描述了用于将多核苷酸和其他遗传改变引入到谷氨酸棒状杆菌、酿酒酵母和枯草芽孢杆菌细胞的基因组中的示例性整合方法。
通过多种标准方法的任一种可将载体或其他多核苷酸引入到微生物细胞中,所述方法为例如转化、接合、电穿孔、核微注射、转导、转染(例如,脂质转染介导的或deae-糊精介导的转染或使用重组噬菌体病毒的转染)、使用磷酸钙dna沉淀物孵育、使用dna包被的微粒高速轰击和原生质体融合。通过本领域已知的任何方法可选择转化体。适用于选择转化体的方法记载于美国专利公开2009/0203102、2010/0048964和2010/0003716,以及国际公开wo2009/076676、wo2010/003007和wo2009/132220。
经改造的微生物细胞
上述方法可用于产生经改造的微生物细胞,在某些实施方案中,所述经改造的微生物细胞过量产生1,5-二氨基戊烷。与天然微生物细胞(例如本文所述的任何微生物宿主细胞)相比,经改造的微生物细胞可具有至少1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100或更多个遗传改变,例如30-100个改变。下文实施例中记载的经改造的微生物细胞具有1、2或3个遗传改变,但是本领域技术人员按照本文的指导能够设计具有额外改变的微生物细胞。在一些实施方案中,与天然微生物细胞相比,经改造的微生物细胞具有不多于15、14、13、12、11、10、9、8、7、6、5或4个遗传改变。在多个实施方案中,经改造以产生1,5-二氨基戊烷的微生物细胞可具有落入任何以下示例性范围的多个遗传改变:1-10、1-9、1-8、2-7、2-6、2-5、2-4、2-3、3-7、3-6、3-5、3-4等。
在一些实施方案中,经改造的微生物细胞表达至少一种异源的赖氨酸脱羧酶,如在天然不产生1,5-二氨基戊烷的微生物宿主细胞的情况下。在多个实施方案中,微生物细胞可包含并表达,例如:(1)单一异源赖氨酸脱羧酶基因,(2)两种或多种异源赖氨酸脱羧酶基因,其可相同或不同(换言之,可引入相同的异源赖氨酸脱羧酶基因的多个拷贝,或者可引入多种不同的异源赖氨酸脱羧酶基因),(3)不是细胞原生的单一异源赖氨酸脱羧酶基因以及天然赖氨酸脱羧酶基因的一个或多个额外拷贝(如果可以的话),或(4)两种或多种非天然的赖氨酸脱羧酶基因,其可相同或不同,以及天然赖氨酸脱羧酶基因的一个或多个额外拷贝(如果可以的话)。
这种经改造的宿主细胞可包含至少一种其他遗传改变,其增加经由所述途径产生赖氨酸(1,5-二氨基戊烷的直接前体)的通量。如上所述,这可以通过一种或多种以下方式来完成:增加上游酶的活性、增加nadph供应、减少前体消耗。
此外,所述经改造的宿主细胞可以表达1,6-二氨基戊烷转运蛋白以提高该化合物从改造的微生物细胞内部向培养基的转运。
经改造的微生物细胞可包含引入的基因,其具有天然的核苷酸序列或不同于天然的核苷酸序列。例如,可对天然的核苷酸序列进行密码子优化,用于在特定宿主细胞中表达。由任何这些引入的基因编码的氨基酸序列可以是天然的或可以不同于天然的序列。在多个实施方案中,氨基酸序列与天然的氨基酸序列具有至少60%、70%、75%、80%、85%、90%、95%或100%氨基酸序列同一性。
本文所述方法在细菌细胞(即谷氨酸棒状杆菌和枯草芽孢杆菌(原核细胞))和在真菌细胞(即酿酒酵母(真核细胞))中进行。(参见实施例1)。其他特别感兴趣的微生物宿主包括解脂亚罗酵母。
示例性经改造的细菌细胞
在某些实施方案中,经改造的细菌(例如谷氨酸棒状杆菌)细胞表达一种或多种异源的赖氨酸脱羧酶,其与来自大肠杆菌(菌株k12)、大肠杆菌o157:h7、霍乱弧菌血清型01(菌株atcc39315/eltorinaban16961)、大肠杆菌ms117-3、暂定齿叶伯克氏菌和/或产丁酸细菌ss3/4的赖氨酸脱羧酶具有至少70%、75%、80%、85%、90%、95%或100%氨基酸序列同一性。在具体实施方案中,
大肠杆菌(菌株k12)的赖氨酸脱羧酶包括seqidno:44;
大肠杆菌o157:h7的赖氨酸脱羧酶包括seqidno:11;
霍乱弧菌血清型01(菌株atcc39315/eltorinaban16961)的赖氨酸脱羧酶包括seqidno:147;
大肠杆菌ms117-3的赖氨酸脱羧酶包括seqidno:87;
暂定齿叶伯克氏菌的赖氨酸脱羧酶包括seqidno:97;并且
产丁酸细菌ss3/4的赖氨酸脱羧酶包括seqidno:30。如上所述,通过在谷氨酸棒状杆菌中表达来自大肠杆菌ms117-3、暂定齿叶伯克氏菌、产丁酸细菌ss3/4中每一个的赖氨酸脱羧酶实现了约5.5gm/l的效价。(cgcadav_107,表达seqidno:87、97和30;参见表5)。通过额外地表达来自矿山废水宏基因组(seqidno:93)的赖氨酸脱羧酶以及这些酶,实现了约7.0gm/l的效价。
在某些实施方案中,经改造的细菌(例如,枯草芽孢杆菌)细胞表达一种或多种异源的赖氨酸脱羧酶,其与来自梭菌cag:221、梭菌cag:288和/或金黄色葡萄球菌的赖氨酸脱羧酶具有至少70%、75%、80%、85%、90%、95%或100%氨基酸序列同一性。在具体实施方案中,
梭菌cag:221的赖氨酸脱羧酶包括seqidno:22;
梭菌cag:288的赖氨酸脱羧酶包括seqidno:15;并且
金黄色葡萄球菌赖的氨酸脱羧酶包括seqidno:80。如上所述,通过在枯草芽孢杆菌中表达来自梭菌cag:221、梭菌cag:288和/或金黄色葡萄球菌中每一个的赖氨酸脱羧酶实现了约47mg/l的效价。(参见图4)
示例性经改造的酵母细胞
在某些实施方案中,经改造的酵母(例如酿酒酵母)细胞表达异源(如非天然)的赖氨酸脱羧酶,其与来自小肠结肠炎耶尔森氏菌w22703、卡斯特兰尼氏菌65phen,和/或海洋原绿球藻菌株it9314的赖氨酸脱羧酶具有至少70%、75%、80%、85%、90%、95%或100%氨基酸序列同一性。在具体的实施方案中:
小肠结肠炎耶尔森氏菌w22703的赖氨酸脱羧酶包括seqidno:6;卡斯特兰尼氏菌65phen的赖氨酸脱羧酶包括seqidno:24;并且
海洋原绿球藻菌株it9314包括seqidno:90。如上所述,通过在酿酒酵母中表达来自小肠结肠炎耶尔森氏菌w22703、卡斯特兰尼氏菌65phen,和/或海洋原绿球藻菌株it9314中的每一个的赖氨酸脱羧酶实现了约5mg/l的效价。(参见图3)
它们可能是经改造的酵母细胞的唯一的遗传改变,或者所述酵母细胞可以包括一种或多种额外的遗传改变,如上文中更一般地讨论的。
培养经改造的微生物细胞
可以培养本文所述的任何微生物细胞,例如用于维持、生长和/或产生1,5-二氨基戊烷。
在一些实施方案中,培养物生长到600nm下的光密度为10-500,例如光密度为50-150。
在多个实施方案中,培养物包括产生的1,5-二氨基戊烷,其效价为至少10、25、50、75、100、200、300、400、500、600、700、800或900μg/l,或至少1、10、50、75、100、200、300、400、500、600、700、800或900mg/l或至少1、1.5、2、2.5、3、3.5、4、4.5、5、10、20、50g/l。在多个实施方案中,效价范围为10μg/l至10g/l、25μg/l至20g/l、100μg/l至10g/l、200μg/l至5g/l、500μg/l至4g/l、1mg/l至3g/l、500mg/l至2g/l,或以上列出的任何数值界定的任何范围内。
培养基
微生物细胞可以在任何适合的培养基中培养,所述培养基包括但不限于基本培养基,即包含可用于细胞生长的最低营养成分的培养基。基本培养基通常包含:(1)用于微生物生长的碳源;(2)盐,其可取决于具体的微生物细胞和生长条件;和(3)水。适合的培养基还包含以下成分的任意组合:用于生长和产物形成的氮源,用于生长的硫源,用于生长的磷酸盐源,用于生长的金属盐,用于生长的维生素,以及用于生长的其他辅因子。
任何适合的碳源均可用于培养宿主细胞。术语“碳源”指一种或多种能够被微生物细胞代谢的含碳化合物。在多个实施方案中,碳源是碳水化合物(例如单糖、二糖、低聚糖或多糖)或转化糖(例如酶处理的蔗糖浆)。示例性单糖包括葡萄糖(右旋糖)、果糖(左旋糖)和半乳糖;示例性低聚糖包括葡聚糖(dextran或glucan);以及示例性多糖包括淀粉和纤维素。适合的糖包括c6糖(例如果糖、甘露糖、半乳糖或葡萄糖)和c5糖(例如木糖或阿拉伯糖)。其他较不昂贵的碳源包括甘蔗汁、甜菜汁、高粱汁等,任何这些都可以(但不需要)完全或部分去离子化。
培养基中的盐通常提供必需元素,例如镁、氮、磷和硫,以允许细胞合成蛋白质和核酸。
基本培养基可补充一种或多种选择性试剂,例如抗生素。
为了产生1,5-二氨基戊烷,培养基可包含和/或在培养中补充葡萄糖和/或氮源,例如尿素、铵盐、氨或它们的任意组合。
培养条件
适于微生物细胞的维持和生长的材料和方法是本领域公知的。参见,例如美国公开2009/0203102、2010/0003716和2010/0048964,以及国际公开wo2004/033646、wo2009/076676、wo2009/132220和wo2010/003007,manualofmethodsforgeneralbacteriology,gerhardtetal.,eds),americansocietyformicrobiology,washington,d.c.(1994)或brockinbiotechnology:atextbookofindustrialmicrobiology,secondedition(1989)sinauerassociates,inc.,sunderland,mass。
通常,细胞生长并维持在适当的温度、气体混合物和ph下(例如约20℃至约37℃,约6%至约84%co2,ph为约5至约9)。在一些方面中,细胞生长于35℃下。在某些实施方案中,例如当嗜热细菌用作宿主细胞时,可以使用更高的温度(例如50℃-75℃)。在一些方面中,用于发酵的ph范围为约ph5.0至约ph9.0(例如约ph6.0至约ph8.0或约6.5至约7.0)。根据具体细胞的需求,细胞可生长在有氧、缺氧或厌氧条件下。
可使用的标准培养条件和发酵模式,例如分批发酵、分批补料发酵或连续发酵记载于美国公开2009/0203102、2010/0003716和2010/0048964,以及国际公开wo2009/076676、wo2009/132220和wo2010/003007中。分批发酵和分批补料发酵是本领域中常见和公知的,实例可参见brock,biotechnology:atextbookofindustrialmicrobiology,secondedition(1989)sinauerassociates,inc.。
在一些实施方案中,将细胞在有限糖(例如葡萄糖)的条件下培养。在多个实施方案中,添加的糖的量少于或约为细胞可消耗的糖的量的105%(例如约100%、90%、80%、70%、60%、50%、40%、30%、20%或10%)。在具体实施方案中,添加到培养基的糖的量与特定时间段内被细胞消耗的糖的量大约相同。在一些实施方案中,通过限制添加的糖的量来控制细胞生长速率,从而使细胞以细胞培养基中糖的量能够支持的速率生长。在一些实施方案中,糖在培养细胞期间不积累。在多个实施方案中,在有限糖条件下培养细胞,培养时间长于或约为1、2、3、5、10、15、20、25、30、35、40、50、60或70小时,或甚至最长达约5-10天。在多个实施方案中,在有限糖的条件下培养细胞,培养时间长于或约为培养细胞的总时长的5、10、15、20、25、30、35、40、50、60、70、80、90、95或100%。尽管不意欲受限于任何具体理论,认为有限糖的条件可以更有利地调节细胞。
在一些方面中,细胞生长于分批培养物中。细胞还可以生长于分批补料培养物或连续培养物中。另外,细胞可培养于基本培养基中,包括但不限于上文所述的任何基本培养基。基本培养基可进一步补充1.0%(w/v)或更少的葡萄糖(或任何其他六碳糖)。特别地,基本培养基可补充1%(w/v)、0.9%(w/v)、0.8%(w/v)、0.7%(w/v)、0.6%(w/v)、0.5%(w/v)、0.4%(w/v)、0.3%(w/v)、0.2%(w/v)或0.1%(w/v)的葡萄糖。在一些培养中,使用显著更高水平的糖(例如葡萄糖),例如至少10%(w/v)、20%(w/v)、30%(w/v)、40%(w/v)、50%(w/v)、60%(w/v)、70%(w/v),或最高达所述糖在培养基中的溶解度极限。在一些实施方案中,糖水平落入以上数值中任意两个的范围内,例如0.1-10%(w/v)、1.0-20%(w/v)、10-70%(w/v)、20-60%(w/v)或30-50%(w/v)。此外,不同的糖水平可用于不同的培养阶段。对于(例如酿酒酵母或谷氨酸棒状杆菌的)分批补料培养,分批阶段的糖水平可以为约100-200g/l(10-20%(w/v)),之后最高达约500-700g/l(在补料中50-70%)。
另外,基本培养基可补充0.1%(w/v)或更少的酵母提取物。特别地,基本培养基可补充0.1%(w/v)、0.09%(w/v)、0.08%(w/v)、0.07%(w/v)、0.06%(w/v)、0.05%(w/v)、0.04%(w/v)、0.03%(w/v)、0.02%(w/v)或0.01%(w/v)的酵母提取物。或者,基本培养基可补充1%(w/v)、0.9%(w/v)、0.8%(w/v)、0.7%(w/v)、0.6%(w/v)、0.5%(w/v)、0.4%(w/v)、0.3%(w/v)、0.2%(w/v)或0.1%(w/v)的葡萄糖并补充0.1%(w/v)、0.09%(w/v)、0.08%(w/v)、0.07%(w/v)、0.06%(w/v)、0.05%(w/v)、0.04%(w/v)、0.03%(w/v)或0.02%(w/v)的酵母提取物。在一些培养中,可使用显著更高水平的酵母提取物,例如至少1.5%(w/v)、2.0%(w/v)、2.5%(w/v)或3%(w/v)。在(例如酿酒酵母或谷氨酸棒状杆菌的)一些培养中,酵母提取物水平落入以上数值中任意两个的范围内,例如0.5-3.0%(w/v)、1.0-2.5%(w/v)或1.5-2.0%(w/v)。
适用于本文所述的经改造的微生物细胞的维持和生长的示例性材料和方法可参见以下实施例1。
1,5-二氨基戊烷的生产和回收
本文所述的任何方法还包括回收1,5-二氨基戊烷的步骤。在一些实施方案中,从生产容器回收/收获包含于所谓的收获流(harveststream)中的所产生的1,5-二氨基戊烷。收获流可包括,例如从生产容器流出的无细胞或含细胞的水溶液,其包含由生产容器中的静息细胞(restingcell)转化生产底物而得到的1,5-二氨基戊烷。可通过本领域中已知的任何操作将仍存在于收获流中的细胞与1,5-二氨基戊烷分离,所述操作例如过滤、离心、倾析(decantation)、膜错流超滤或微滤、切向流超滤或微滤或死端过滤。在该细胞分离操作之后,收获流基本上不含细胞。
可任选地进行产生的1,5-二氨基戊烷从收获流中包含的其他组分中分离和/或纯化的其他步骤,即所谓的下游处理步骤。这些步骤可包括技术人员已知的任何方式,例如浓缩、萃取、结晶、沉淀、吸附、离子交换和/或色谱法。可单独或组合使用这些步骤中的任何步骤来纯化1,5-二氨基戊烷。其他纯化步骤可包括以下方法中的一种或多种:例如,浓缩、结晶、沉淀、清洗和干燥、用活性炭处理、离子交换、纳滤和/或重结晶。适合的纯化方案的设计可取决于细胞、培养基、培养规模、生产容器等,并且在本领域技术水平范围内。
提供以下实施例的目的在于说明本公开内容的多种实施方案,并且不意欲以任何方式限制本公开内容。本领域技术人员将能够识别其中的变化和其他用途,其涵盖于本公开内容的宗旨内,如由权利要求的范围限定的。
实施例1——经改造以产生1,5-二氨基戊烷的谷氨酸棒状杆菌、酿酒酵母和枯草芽孢杆菌菌株的构建和选择
质粒/dna设计
本研究中所有测试菌株用质粒dna转化,所述质粒dna是使用专用软件设计。质粒设计是特别针对本研究中改造的每一种宿主生物体的。通过标准dna组装方法物理构建质粒dna。然后,通过如下文所述的两种宿主特异性方法之一,将该质粒dna用于整合代谢途径插入。
谷氨酸棒状杆菌和枯草芽孢杆菌途径整合
“环入,单交换”基因组整合策略被开发用于改造谷氨酸棒状杆菌和枯草芽孢杆菌菌株。图10举例说明仅环入的构建体和环入/环出构建体的基因组整合以及通过菌落pcr确认正确的整合。仅环入的构建体(在标题“环入”下示出)包含单个2kb同源臂(标识为“整合基因座”)、正向选择标记物(标识为“标记物”)和目的基因(标识为“启动子-基因-终止子”)。单交换事件将质粒整合到谷氨酸棒状杆菌或枯草芽孢杆菌染色体中。通过在存在抗生素(例如25μg/ml卡那霉素)的情况下生长,整合事件在基因组中稳定维持。通过使用uf/ir和dr/ifpcr引物的菌落pcr,确定源自环入整合的菌落中正确的基因组整合。
环入、环出(loop-in,loop-out)构建体(在标题“环入、环出”下示出)包含两个2kb同源臂(5’和3’臂)、目的基因(箭头)、正向选择标记物(标识为“标记物”)和反向选择标记物。类似于仅“环入”的构建体,单交换事件将质粒整合到染色体中。注意:此处仅示出两个可能的整合之一。通过菌落pcr来确定正确的基因组整合,并且利用反向选择,使得可以切开质粒骨架和反向选择标记物。这导致两种可能性之一:回复至野生型(下左框)或所需的途径整合(下右框)。同样,通过菌落pcr来确定正确的基因组环出。(缩写:引物:uf=上游正向,dr=下游反向,ir=内部反向,if=内部正向。)
酿酒酵母途径整合
“分离标记物,双交换(split-marker,double-crossover)”基因组整合策略被开发用于改造酿酒酵母菌株。图7举例说明在酿酒酵母中,互补的分离标记物质粒的基因组整合以及通过菌落pcr确认正确的基因组整合。将具有互补的5’和3’同源臂和ura3选择性标记物的重叠部分(以斜线柱(hashedbar)表示直接重复)的两种质粒用大范围核酸酶(meganuclease)消化并作为线性片段转化。三重交换事件将所需的异源基因整合到靶基因座并重新构建完整的ura3基因。使用两个3-引物反应来测定源自该整合事件的菌落以确定5’和3’接合(uf/if/wt-r和dr/if/wt-f)。对于需要进一步改造的菌株,可将菌株铺在5-foa平板上以选择ura3去除,留下小的单拷贝的原始直接重复。该基因组整合策略可用于相同操作流程中的基因敲除、基因敲入和启动子滴定(promotertitration)。
细胞培养
为酿酒酵母建立的操作流程包括命中挑选(hit-picking)步骤,该步骤使用在平板上随机化菌株的自动化操作流程来强化成功构建的菌株。对于每种成功构建的菌株,从不同的菌落测试最多达4个重复,以测试菌落之间差异和其他过程差异。如果获得的菌落少于4个,则重复现有菌落,使得从每个需要的基因型测试至少4个孔。
将菌落合并到具有选择性培养基(用于酿酒酵母的sd-ura)的96孔板并培养两天直至饱和,然后用16.6%甘油在-80℃下冷冻保存。然后将冷冻的甘油原液用于在基本培养基中接种种子期(seedstage),所述基本培养基具有低水平氨基酸以有利于生长和从冷冻中恢复。种子平板在30℃下生长1-2天。然后将种子平板用于接种具有基本培养基的主要培养板并生长48-88小时。在需要的时间点移出平板并测试细胞密度(od600)、活力和葡萄糖,贮存的上清液样品用于目的产物的lc-ms分析。
细胞密度
使用分光光度测定法来测量细胞密度,所述测定检测600nm下各孔的吸光度。机器人技术用于将确定量的培养物从每个培养板转移到测定板,然后与175mm磷酸钠(ph7.0)混合以产生10倍稀释液。使用tecanm1000分光光度仪测量测定板,并将测定数据上传至lims数据库。未接种对照用于减去背景吸光度。通过以下方式来监测细胞生长:在每个时期接种多个平板,然后在每个时间点放弃(sacrifice)整个平板。
为了最小化细胞沉淀同时处理大量平板(这在测量期间可导致非代表性样品),在每次读数之前振荡每个平板10-15秒。平板内细胞密度的大幅度差异还可导致检测线性范围以外的吸光度测量值,导致对较高od培养物的低估。总体上,迄今为止测试的菌株的差异尚未显著到足以成为问题的程度。
液体-固体分离
为了收集胞外样品用于lc-ms分析,通过离心分离固相和液相。2000rpm离心培养板4分钟,使用机器人技术将上清液转移到目标板。将75μl上清液转移到每个板,其中一个贮存于4℃,第二个贮存于80℃以长期保存。
在谷氨酸棒状杆菌、酿酒酵母和枯草芽孢杆菌中的第一轮基因改造结果
采用文库方法筛选异源途径的酶以建立1,5-二氨基戊烷途径。将所测试的赖氨酸脱羧酶进行密码子优化,如上文seqidno交叉引用表中所示的,并在谷氨酸棒状杆菌、酿酒酵母和枯草芽孢杆菌宿主中表达。
第一轮基因改造结果示于图2(谷氨酸棒状杆菌)、图3(酿酒酵母)和图4(枯草芽孢杆菌)。在谷氨酸棒状杆菌中,在整合来自大肠杆菌(菌株k12)、大肠杆菌o157:h7和霍乱弧菌血清型01(菌株atcc39315/eltorinaban16961;分别为seqidno:44、11和147)的三种赖氨酸脱羧酶后的第一轮改造中实现了300mg/l的1,5-二氨基戊烷效价。(参见图2)
在酿酒酵母中,在整合了来自小肠结肠炎耶尔森氏菌w22703、卡斯特兰尼氏菌65phen和海洋原绿球藻菌株菌株it9314(分别为seqidno:6、24和90)的三种赖氨酸脱羧酶后的第一轮改造中实现了5mg/l的效价。(参见图3)
在枯草芽孢杆菌中,在整合来自梭菌cag:221、梭菌cag:288和金黄色葡萄球菌(分别为seqidno:22、15和80)中的每一个的赖氨酸脱羧酶后的第一轮改造中实现了约47mg/l的效价。(参见图4)
在谷氨酸棒状杆菌中的第二轮基因改造结果
在谷氨酸棒状杆菌中进行第二轮改造。在整合了来自大肠杆菌ms117-3、暂定齿叶伯克氏菌和产丁酸细菌ss3/4(分别为seqidno:87、97和30)中的每一个的赖氨酸脱羧酶后实现了约5.5gm/l的效价。(参见图5)
在谷氨酸棒状杆菌中的第三轮基因改造结果
在谷氨酸棒状杆菌中进行第二轮改造。在将来自矿山废水宏基因组(seqidno:93)的额外赖氨酸脱羧酶插入到来自第二轮的最佳生产菌株(cgcadav_107,包括seqidno:87、97和30)中后实现了约7.0gm/l的效价。(参见图11中的cgcadav_306)
实施例2–经改造以产生1,5-二氨基戊烷的谷氨酸棒状杆菌的生物反应器生产运行
在生物反应器生产运行中测试经改造的谷氨酸棒状杆菌菌株(cgcadav_107)中的1,5-二氨基戊烷生产,所述菌株表达来自大肠杆菌ms117-3、暂定齿叶伯克氏菌和产丁酸细菌ss3/4(分别为seqidno:87、97和30)中的每一个的赖氨酸脱羧酶。
如图12所示,使用cgcadav_107的生物反应器生产运行得到约27gm/的1,5-二氨基戊烷效价。
- 还没有人留言评论。精彩留言会获得点赞!