短合成肽及其治疗视网膜退化性疾病和/或组织损伤的用途的制作方法
1.本揭示内容是基于发现短合成肽具神经保护作用,和/或组织修复及再生作用,因此所述合成肽可用于治疗或预防视网膜退化性疾病或组织损伤的领域。
背景技术:
2.视网膜退化是由视网膜或视网膜色素上皮细胞(retinal pigment ephitelium,rpe)的进行性及最终死亡所造成。造成视网膜退化的原因很多,包含动脉或静脉阻塞、糖尿病视网膜病变、晶状体后纤维组织增生/早产儿视网膜病变或疾病(通常为遗传性疾病)。这些疾病可能以多种不同方式呈现,例如,视力受损、夜盲、视网膜剥离、光敏感、管状视觉以及周边视觉丧失至视觉完全丧失。视网膜退化存在于多种不同的疾病中,包含网膜色素病变(retinitis pigmentosa,rp)、老年黄斑部病变(age
‑
related macular degeneratiom,amd)、糖尿病视网膜病变、白内障、急性紫外线视网膜病变和青光眼。
3.软组织(例如,血管、皮肤、肌肉骨骼组织)损伤是非常常见的损伤,其包括例如皮肤性(如,缺血性伤口、糖尿病性伤口、创伤性伤口、烧伤、皮肤溃烂和外科伤口);血管性(如,血管疾病、血管损伤和血管发育不良);整形(如,涉及修复、增大或美体);肌肉疾病(如,发炎性、神经性和肌原性肌肉疾病;和肌肉营养不良);和结缔组织性(例如,肌腱和韧带)的损伤。其他软组织损伤症状还包括皮肤老化或暴露于压力(如,暴露于紫外光或污染等条件)中,进而减缓组织修复和细胞再生。皮肤衰老的征状非常明显,包含出现皱纹、皮肤色素沉淀的变化、弹性和紧致度丧失,以及组织松弛。
4.有鉴于此,本领域亟需一种用以治疗和/或预防视网膜退化性疾病和/或需要组织修复和再生状况的改良医药品和/或方法。
技术实现要素:
5.原则上,本揭示内容是关于发展新化合物和/或治疗视网膜退化性疾病和/或组织损伤的方法。
6.基于此,本揭示内容第一方面是关于提供一种能够治疗视网膜退化性疾病或组织损伤的短合成肽。所述短合成肽由氨基酸序列x1x2x3x4ex5(序列编号:1)所组成,其中,
7.x1是丝氨酸(s)或丙氨酸(a);
8.x2是亮氨酸(l)、丙氨酸(a)或异亮氨酸(i);
9.x3是甘氨酸(g)、丙氨酸(a)、缬氨酸(v)或天冬酰胺(n);
10.x4是丙氨酸(a)、甘氨酸(g)或谷氨酸(e);
11.x5是谷氨酰胺(q)、丙氨酸(a)或天冬酰胺(n);
12.x2、x3、x4和x5分别左旋氨基酸,而x1和e分别是左旋氨基酸或右旋氨基酸;以及
13.当序列编号:1具有slgaeq(序列编号:9)的序列时,所述丝氨酸(s)或所述谷氨酸(e)是右旋氨基酸。
14.依据可任选的实施方式,所述合成肽的氨基酸序列的n
‑
端被乙酰化,且c
‑
端被酰
li”)。在其他实施例中,所述合成肽具有序列编号:20的氨基酸序列(以下称为“6
‑
mer gv”)。在又一其他实施例中,所述合成肽具有序列编号:21的氨基酸序列(以下称为“6
‑
mer gn”)。在另一实施例中,所述合成肽具有序列编号:22的氨基酸序列(以下称为“6
‑
mer ae”)。在又一实施例中,所述合成肽具有序列编号:26的氨基酸序列(以下称为“6
‑
mer qn”)。
20.在某些实施方式中,所述6
‑
mer合成肽(序列编号:9)具有至少一右旋氨基酸残基。在较佳的实施方式中,所述6
‑
mer的第二、第三、第四和第六个氨基酸残基分别是左旋氨基酸,并且第一和第五个氨基酸残基是左旋氨基酸或右旋氨基酸。在一实施例中,6
‑
mer的第一个氨基酸残基是右旋丙氨酸(6
‑
mer ds)。在其他实施例中,6
‑
mer的第五个氨基酸残基是右旋谷氨酸(6
‑
mer de)。
21.本发明医药品或组合物治疗的视网膜退化性疾病可以是糖尿病视网膜病变(diabetic retinopathy)、糖尿黄斑水肿(diabetic macular edema)、老年黄斑部病变(age
‑
related macular degeneration,amd)、网膜色素病变(retinitis pigmentosa,rp)、白内障(cataracts)、青光眼(glaucoma)或急性紫外线视网膜病变(acute uv retinopathy)。
22.本发明医药品或组合物治疗的组织损伤可以是干眼症(drr eye disease,ded)或视网膜缺血/再灌流损伤。
23.本揭示内容的医药品或组合物,可经由下列方式施用至所述个体:血管传递(intravascular delivery)(例如,注射(injection)或灌注(infusion))、经口(oral)、肠内(enteral)、直肠(rectal)、肺(pulmonary(例如,吸入(inhalation))、经鼻(nasal)、局部施用(topical)(包含,经皮(transdermal)、经颊(buccal)以及舌下(sublingual))、膀胱内(intravesical)、玻璃体内(intravitreal)、腹膜内(intraperitoneal)、阴道(vaginal)、经脑传递(brain delivery)(例如,脑室注射(intracerebroventricular)和颅内注射(intracerebral))、经cns传递(例如,鞘内(intrathccal)、椎旁(perispinal)和椎内(intra
‑
spinal))或肠外(parenteral)(例如,皮下(subcutaneous)、肌肉内(intramuscular)、静脉内(intravenous)和皮内(intradermal))、黏膜给药(transmucosal administration),或通过移植(implant)或其他公知的给药途径施用。
24.本揭示内容的第三方面是关于一种治疗患有视网膜退化性疾病或组织损伤的个体的方法。所述方法包含以下步骤:施用本揭示内容任一实施方式所示的医药品或组合物至所述个体,以改善或减缓视网膜退化性疾病或组织损伤相关疾病和/或症状。
25.在上述所有实施方式中,所述个体是人类。
26.在较佳的实施方式中,本发明合成肽施用至个体的量为0.01
‑
100毫克/公斤。
27.在参阅下文实施方式后,本领域技术人员当可轻易了解本发明的基本精神及其他发明目的,以及本发明所采用的技术手段与实施方式。
附图说明
28.为让本发明的上述与其他目的、特征、优点与实施例能更明显易懂,所附图式的说明如下:
29.图1为分析本发明短合成肽对于谷氨酸诱导neuro
‑
2a细胞死亡的效果。细胞预先
以合成肽处理4小时。于暴露在谷氨酸(100mm)6小时后,测量ldh释放至neuro
‑
2a细胞培养基的量,结果以平均值
±
sd表示(n=6)。*p<0.05vs.溶剂/经谷氨酸处理的细胞。
30.图2为6
‑
mer ds通过stat3依赖方式诱导c2c12细胞中的生存素(survivin)表达。(a)免疫墨点法的结果显示6
‑
mer ds或5
‑
mer ds对于stat3磷酸化的影响。stat3作为上样对照组。(b)以不同长度的合成肽或stat3抑制剂诱导生存素基因表达的real
‑
time qpcr分析的结果。*p<0.002vs.经溶剂处理的细胞。
31.图3为利用丙氨酸扫瞄所创造出的6
‑
mer变异物对于诱导c2c12细胞中生存素mrna的结果。进行三次独立分析,结果以平均值
±
s.d.表是。*p<0.04vs.溶剂对照组。
32.图4为利用右旋氨基酸创造出的6
‑
mer变异物对于诱导c2c12细胞中生存素mrna的结果。进行三次独立分析,结果以平均值
±
s.d.*p<0.05vs.溶剂对照组。
33.图5为利用氨基酸置换创造出的6
‑
mer变异物对于诱导c2c12细胞中生存素mrna的结果。进行三次独立分析,结果以平均值
±
s.d.*p<0.05vs.溶剂对照组。
34.图6为6
‑
mer ds对于arpe
‑
19对抗4
‑
hne诱导细胞凋亡的保护效果。细胞去除血清24小时,再以6
‑
mer ds(20μm)或溶剂进行前处理,暴露于4
‑
hne(25μm)中24小时。以tunel(terminal deoxy
‑
nucleotidyl transferase
‑
mediated dutp nick end
‑
labeling)染色(绿点)测定细胞凋亡,并以hoechst 33258(蓝点)进行复染。(a)为三次独立试验的代表性结果。(b)以tunel阳性细胞的数量除以2000个计数细胞定量细胞死亡的百分率。a:p<0.00003vs.经溶剂处理的细胞。b:p<0.0006vs.经溶剂/4
‑
hne处理的细胞。
35.图7为i/r损伤经/未经6
‑
mer变异物治疗后20小时,大鼠眼睛视网膜tunel染色的代表性影像。视网膜切片以tunel(绿色)染色和hoechst 33258(蓝色)复染。gcl,神经节细胞层(ganglion cell layer);inl,内核层(inner nuclear layer);onl,外核层(outer nuclear layer)。
36.图8为i/r损伤经/未经6
‑
mer ds处理后14天,大鼠眼睛视网膜切片经苏木精和伊红(h&e)染色的代表性影像。在对照组和6
‑
mer ds+i/r组中,gcl和inl组织清晰且良好。原始倍率
×
200。
37.图9为未缺血(对照组)和i/r损伤后两周缺血性视网膜中微胶细胞和星状细胞免疫染色的代表性影像。视网膜切片经iba
‑
1(绿色;微胶细胞标记)、gfap(绿色;星状细胞标记)和hoechst 33258(蓝色)染色。所述影像是从三个独立试验并于400
×
放大倍率而得。
38.图10为i/r损伤后两周,对侧眼(假手术组(sham))和缺血性视网膜中的退化毛细管的代表性影像。大鼠视网膜微血管以异凝集素gs
‑
ib4(红色)染色并以hoechst 33258(蓝色;外被细胞核染色)复染。箭头为无核且管细的退化毛细管。本实验经三次独立试验。原始倍率
×
400。
39.图11为于stz注射后第二周以载体或6
‑
mer ds眼滴剂治疗的糖尿病小鼠视网膜平固式(flat mounted)视网膜的代表性荧光影像。利用腹腔注射fitc
‑
bsa测定血管通透性。箭头所指之处为视网膜中血管出血处,所述处有fitc
‑
bsa堆积。视网膜中出血区域的数量,以平均值
±
sd表示(每组n=6)。原始倍率
×
200。*p<0.007vs.载体/stz组。
40.图12为于stz注射后第二周以载体或6
‑
mer ds眼滴剂治疗的糖尿病小鼠和假手术组小鼠视网膜中gfap阳性星状细胞的代表性荧光影像。数据从三次独立试验而得(每组n=6)。原始倍率
×
400。*p<0.0002vs.载体/stz组。
41.图13为6
‑
mer变异肽对于角膜上皮细胞上皮损伤的影响。c57bl6小鼠饲养于人工环境室(cec)14天,诱导其眼球表面破坏产生(第0天),接着以6
‑
mer变异肽或载体治疗干眼症4天(第4天)。(a)第0天和第4天小鼠角膜荧光染色的代表性影像(b)通过荧光染色程度决定角膜上皮细胞受损的分数。数值每组以平均值
±
sd表示(n=10)。*p<0.000001vs.6
‑
mer ds组(第0天)。
42.图14为6
‑
mer变异肽对于兔子眼角膜上皮细胞中高渗透压诱导促发炎基因表达的影响。完成三次独立试验,数据以平均值
±
sd表示。*p<0.003vs.溶剂对照组。
具体实施方式
43.为了使本揭示内容的叙述更加详尽与完备,下文针对了本发明的实施方式与具体实施例提出了说明性的描述;但这并非实施或运用本发明具体实施例的唯一形式。实施方式中涵盖了多个具体实施例的特征以及用以建构与操作这些具体实施例的方法步骤与其顺序。然而,也可利用其他具体实施例来达成相同或均等的功能与步骤顺序。
44.1.定义
45.除非本说明书另有定义,此处所用的科学与技术词汇的含义与本领域技术人员所理解与惯用的意义相同。
46.在此处“肽”一词是指氨基酸残基所组成的聚合物。“合成肽”一词则代表此肽并未包含存在于自然界的完整蛋白质分子。此种肽之所以是“合成的”,表示其乃是由人类利用技术手段所得,譬如化学合成、重组遗传技术或将整个抗原切段。于本说明书中,任何氨基酸残基于一肽中的位置由所述肽的n端起算。当未具体指出氨基酸为右旋或左旋氨基酸,所述氨基酸可以是左旋氨基酸或者是左或右旋氨基酸,除非上下文明示所述氨基酸为特定异构物。本文中氨基酸的符号与相领域技术人士所使用的氨基酸缩写相同。
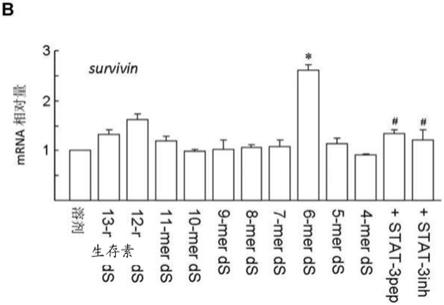
47.在此,蛋白质/肽氨基酸序列的些微变异皆为本发明权利范围所涵盖。举例来说,变异的氨基酸序列至少保留70%、71%、72%、73%、75%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%以及99%的相似度。本发明合成肽可经由修饰以改变肽特征且不影响其生理活性。举例而言,某些氨基酸经改变和/或删除后,不会影响本揭示内容所述肽的生理活性(即,治疗视网膜退化性疾病和/或组织损伤的功效)。具体而言,氨基酸的保守性置换是可被预期的。所述保守性置换是指氨基酸侧链被同一类的氨基酸所取代。一般而言,编码的氨基酸分类如下:(1)酸性氨基酸=天门冬氨酸(aspartate)、谷氨酸(glutamate);(2)碱性氨基酸=赖氨酸(lysine)、精氨酸(arginine)、组氨酸(histidine);(3)非极性氨基酸=丙氨酸(alanine)、缬氨酸(valine)、亮氨酸(leucine)、异亮氨酸(isoleucine)、脯氨酸(proline)、苯丙氨酸(phenylalanine)、甲硫氨酸(methionine)、色氨酸(tryptophan);以及(4)未带电极性氨基酸=甘氨酸(glycine)、天冬酰胺(asparagine)、谷氨酰胺(glutamine)、半胱氨酸(cysteine)、丝氨酸(serine)、苏氨酸、酪氨酸(tyrosine)。在较佳的实施例中、所述氨基酸的分类为:丝氨酸(s)和苏氨酸(t)为脂肪族羟基族(aliphatic
‑
hydroxy family);天冬酰胺(n)以及谷氨酰胺为含酰胺族(amide
‑
containing family);丙氨酸(a)、缬氨酸(v)、亮氨酸(l)以及异亮氨酸(i)为脂肪族(aliphatic family);以及苯丙氨酸(f)、色氨酸(w)和酪氨酸(y)为芳香族(aromatic family)。举例而
言,可以预期的是以异亮氨酸(i)或缬氨酸(v)取代亮氨酸(l)、以谷氨酸(e)取代天冬氨酸(d)、以丝氨酸(s)取代苏氨酸(t)、或以一结构相似的氨基酸取代一氨基酸,此一置换不会对氨基酸分子的结合或其特性产生重大影响,特别是所述置换并未包含氨基酸的框架区域(framework site)。可通过分析肽衍生物的专一性活性,确定氨基酸的修饰是否改变一功能性肽。本领域技术人员可制备蛋白质/肽的片段或类似物。较佳的片段或衍生物的氨端或羧端出现于功能区域附近。在一实施例中,本发明合成肽中的一个氨基酸残基(例如,天冬氨酸(d)、缬氨酸(v)或苯丙氨酸(f))被非极性氨基酸残基保守性置换(例如,被丙氨酸(a)置换)。在其他实施例中,本发明合成肽中的一氨基酸残基被其右旋氨基酸残基保守性置换,例如,左旋丝氨酸(s)和左旋谷氨酸(e)分别被相对应的右旋氨基酸残基所取代。
48.所述“治疗(treatment)”一词是指预防性(如,预防用药)、疗愈性或缓和性的处置,以达到所欲的药学和/或生理学效果;例如,神经保护作用或促进组织修复或再生。上述的效果是指能够部分或完全地治愈或预防个体出现所述疾病的症状。所述“治疗(treatment)”包含预防、治疗或减缓一哺乳类的疾病,尤其是人类。所述治疗包含:(1)预防(如,预防用药)、治疗或减缓一个体的疾病或症状,其中所述个体可能患有疾病但尚未被诊断;(2)抑制一疾病(即,降低疾病发展);或(3)治愈一疾病(即,减少与所述疾病相关的症状)。
49.所述“施用(administered)(administering)(administraion)”一词是指将本发明的制剂(即,化合物或组合物)提供给个体。所述传递方式包含,但不限于,静脉内、肌肉内、腹膜内、动脉内、颅内、结膜内或皮下传递方式。在某些实施方式中,本发明合成肽和/或其类似物可配制成直接施用于角膜表面的眼滴剂。在其他实施方式中,本发明合成肽和/或其类似物可配制成直接施用于皮肤的软膏或乳液。在又一实施方式中,本发明的合成肽和/或其类似物可配置成粉状,施用前与适合的载体混合(如,缓冲溶液),例如,静脉注射。
50.在此处,“有效量(effective amount)”一词是指一成分的用量足以招致欲求的反应或效果,即,能有效治疗疾病。以治疗视网膜退化性疾病为例,一制剂(如,化合物、合成肽、编码治疗肽的核酸),其能用以降低、预防、推迟或治愈视网膜退化性疾病的相关症状。相似地,以治疗需要组织修复或再生的症状为例,一制剂(如,化合物、合成肽、编码治疗肽的核酸),其能用以降低、预防、推迟病征。或能够有效促进组织修复或再生。一制剂的有效量不必然能够治愈一疾病或症状,但能推迟、阻碍或预防疾病或症状的发生,或推迟疾病或症状相关的病征。所述治疗有效量可分成一、二或更多剂量于单一施用剂量型式,且可于一指定期间内施用一次、二次或更多次。
51.所述“个体(subject)”或“患者(patient)”一词可交互使用,且在此是指可接受本揭示内容的合成肽和/或方法的动物(包含,人类)。所述“哺乳类(mammal)”一词涵盖哺乳纲的所有成员,包含:人类、灵长类动物、家畜和农畜。举例而言,所述家畜或农畜可以是兔子、猪、羊和牛。所述哺乳类也可涵盖动物园或竞赛用动物、宠物,以及啮齿类(如,小鼠和大鼠)。除非另有指明,“个体”或“患者”一般包含雄性与雌性。再者,所述“个体”或“患者”包含可从本揭示内容的治疗方法得到良好治疗效果的动物。举例而言,所述“个体”或“患者”包含,但不限于,人类、大鼠、小鼠、天竹鼠、猪、猴子、猪、羊、牛、马、狗、猫、鸟和禽类。在一实例中,所述患者为人类。
52.虽然用以界定本发明较广范围的数值范围与参数皆是约略的数值,此处已尽可能
精确地呈现具体实施例中的相关数值。然而,任何数值本质上不可避免地含有因个别测试方法所致的标准偏差。在此处,“约”通常是指实际数值在一特定数值或范围的正负10%、5%、1%或0.5%之内。或者是,“约”一词代表实际数值落在平均值的可接受标准误差之内,视本领域技术人员的考虑而定。除了实验例之外,或除非另有明确的说明,当可理解此处所用的所有范围、数量、数值与百分比(例如用以描述材料用量、时间长短、温度、操作条件、数量比例及其他相似者)均经过“约”的修饰。因此,除非另有相反的说明,本说明书与附随权利要求所揭示的数值参数皆为约略的数值,且可视需求而更动。至少应将这些数值参数理解为所指出的有效位数与套用一般进位法所得到的数值。
53.此外,在不和上下文冲突的情形下,本说明书所用的单数名词涵盖所述名词的复数型;而所用的复数名词时也涵盖所述名词的单数型。
54.2.较佳实施方式说明
55.本揭示内容部分基于发现短合成肽能够治疗和/或预防个体患有视网膜退化性疾病或组织损伤。因此,本发明提供一种含有新合成肽的方法和组合物,其能够用以治疗和/或预防视网膜退化性疾病或组织损伤。
56.2.1本发明合成肽
57.本揭示内容短合成肽由所述氨基酸序列x1x2x3x4ex5(序列编号:1)所组成,其中,
58.x1是丝氨酸(s)或丙氨酸(a);
59.x2是亮氨酸(l)、丙氨酸(a)或异亮氨酸(i);
60.x3是甘氨酸(g)、丙氨酸(a)、缬氨酸(v)或天冬酰胺(n);
61.x4是丙氨酸(a)、甘氨酸(g)或谷氨酸(e);
62.x5是谷氨酰胺(q)、丙氨酸(a)或天冬酰胺(n);
63.x2、x3、x4和x5分别左旋氨基酸,而x1和e分别是左旋氨基酸或右旋氨基酸。
64.在可任选或非必要地实施方式中,所述氨基酸序列的n
‑
端被乙酰化并且所述氨基酸序列的c
‑
端被酰胺化。
65.依据一较佳的实施方式,本揭示内容的合成肽具有氨基酸序列slgaeq(序列编号:9,6
‑
mer)。较佳地,所述6
‑
mer合成肽含至少一右旋氨基酸残基,因而产生其右旋类似物。在一较佳的实施方式中,所述6
‑
mer中的丝氨酸是右旋氨基酸(6
‑
mer ds)。在其他较佳的实施方式中,所述6
‑
mer中的谷氨酸是右旋氨基酸(6
‑
mer de)。
66.依据其他实施方式,所述6
‑
mer合成肽具有一保留性置换,因而产生一类似物其具有序列编号12、13、14、15、17、19、20、21、22或26中任一氨基酸序列。
67.本发明合成肽如表一所示:
68.表一:本发明合成肽
[0069][0070][0071]
以上序列中粗体字表示所述氨基酸是右旋氨基酸
[0072]
依据较佳实施方式,6
‑
mer(序列编号:9)的第六个氨基酸残基(即,谷氨酰胺(q))不可以被其他氨基酸残基所取代,否则所述合成肽将失去其神经保护活性。在一实施方式中,将6
‑
mer第六个氨基酸残基(q)删除后所产生的5
‑
mer合成肽(序列编号:10),已失去6
‑
mer肽所具有的显著神经保护活性。
[0073]
依据其他实施方式,6
‑
mer(序列编号:9)的第一、第二、第三、第四和第六个氨基酸残基可分别被保留性氨基酸残基所取代。在一实施方式中,所述6
‑
mer的第一个氨基酸残基(即,丝氨酸(s))被丙氨酸(a)取代,而产生具序列编号:12氨基酸序列的合成肽(以下称为“6
‑
mer sa”)。在其他实施方式中,所述6
‑
mer第二个氨基酸残基(即,亮氨酸(l))被丙氨酸(a)取代,而产生具序列编号:13氨基酸序列的合成肽(以下称为“6
‑
mer la”)。此外,6
‑
mer合成肽中的亮氨酸(l)被异亮氨酸(i)取代,而产生具序列编号:19氨基酸序列的合成肽(以下称为“6
‑
mer li”)。在其他实施方式中,所述6
‑
mer第三个氨基酸残基(即,甘氨酸(g))被丙氨酸(a)取代,而产生具序列编号:14氨基酸序列的合成肽(以下称为“6
‑
mer ga”)。此外,所述6
‑
mer的甘氨酸(g)被缬氨酸(v)所取代,而产生具序列编号:20氨基酸序列的合成肽(以下称为“6
‑
mer gv”)。在又一其他实施方式中,所述6
‑
mer第四个氨基酸残基(即,丙氨酸(a))被甘氨酸(g)取代,而产生具序列编号:15氨基酸序列的合成肽(以下称为“6
‑
mer ag”)。此外,所述6
‑
mer的丙氨酸(a)被谷氨酸(e)取代,而产生具序列编号:22氨基酸序列的合成肽(以下称为“6
‑
mer ae”)。在另一实施方式中,所述6
‑
mer第六个氨基酸残基(即,谷氨酰胺(q))被丙氨酸(a)取代,而产生具序列编号:17氨基酸序列的合成肽(以下称为“6
‑
mer qa”)。此外,所述6
‑
mer中的谷氨酰胺(q)被天冬酰胺(n)所取代,而产生具序列编号:26酸序列的合成肽(以下称为“6
‑
mer qn”)。
[0074]
依据其他实施方式,所述6
‑
mer合成肽具有至少一右旋氨基酸残基,特别是位于肽序列第2、3、4和6个位置上的氨基酸残基须为左旋氨基酸,而肽序列上第1和第5个位置上的氨基酸残基可以是左旋氨基酸或右旋氨基酸。在某些实施方式中,所述6
‑
mer的第1和5个位置上的氨基酸残基分别是右旋氨基酸,因而产生上表一所述6
‑
mer的右旋类似物。
[0075]
本发明合成肽可通过现有技术中任一标准肽合成方法来制造。在一实施方式中,本发明合成肽是依据操作手册以固相肽合成器(abi433a肽合成器;applied biosystems inc.;life technologies corp.;foster city,ca,usa)进行合成。
[0076]
此外,本发明合成肽可利用重组技术所制备。举例而言,可将编码本发明肽的核酸克隆于一表达载体中,其以可操作性地方式将一适合于宿主细胞内表达本发明肽的调控序列与本发明肽连接。将所述载体引入至合适的宿主细胞内,以表达所述肽。可利用硫酸铵沉淀和管柱层析等方法从宿主细胞中纯化所述经表达的重组肽。所制备而成的肽可依据以下实施例揭示的方法测试其活性。
[0077]
上述核酸或多核苷酸可利用已知的生物降解聚合物微粒或微囊传递装置传送。另外,也可利用常规方法以脂质体包复核酸,以供宿主吸收所述核酸。所述多核苷酸可单独加载或与其他组织专一性抗体共同加载至所述传递载体中。此外,也可制成一分子接合物(molecular conjugate),其由质体或其他载体以静电或共价力连结聚
‑
l
‑
赖氨酸。此外,本发明也可利用已知的组织专一性转录调节组件(tissue
‑
specific transcriptional regulatory elementst),进行组织专一性标定。也可在不使用传递载体的情形下将“裸dna(naked dna)”传递至肌肉内、皮内或皮下的位置,以进行胞内表达(in vivo expression)。
[0078]
本发明合成肽的n端或c端可以进行修饰。举例而言,n端修饰包含,但不限于,n
‑
醣基化(n
‑
glycated)、n
‑
烷基化(n
‑
alkylated)和n
‑
乙酰化(n
‑
acetylated)氨基酸。一终端修饰包含聚乙烯二醇化(pegylation)。在一实例中,c端修饰为一c端酰胺化氨基酸。在可任选
的实施方式中,一或多个肽键结可以被一非肽链所取代,个别的氨基酸基团的修饰,可通过试剂处理,以与特定的侧链或终端残基反应。
[0079]
于所述合成肽可经由化学修饰,于多个不同的部位加入不同的官能基。官能基可以被添加至所述合成肽的终端。在某些实施方式中,所述官能基能改善肽一或多个特性的活性,例如,改善合成肽的稳定性、效能或选择性;改善所述合成肽通过细胞膜和/或组织屏障的穿透效率;改善组织定位能力;降低毒性或清除率;以及改善抵抗细胞帮浦的排除,以及其他类似的活性。在非限制的实施例中,适当的官能基能用以传递肽黏附至细胞上。举例来说,降低肽的亲水性,以及增加其亲脂性,这些可任选地官能基于活体内裂解较佳,例如在胞内以水解或酵素分解的方式裂解皆可。水解保护基包含酯、碳酸酯以及氨基甲酸酯保护基。氨基保护基包含烷氧基以及芳氧羰基。羧酸保护基包含脂族(aliphatic)、苯基(benzylic)和芳酯(aryl esters)。
[0080]
可通过保守性或非保守性置换方式,以“拟肽有机基团(peptidomimetic organic moiety)”取代本发明合成肽中任一氨基酸残基。在可任选的较佳实例中,所述拟肽有机基团与取代的氨基酸于必要的部位具有类似的立体空间、电子或构型特性,且被视为保守性置换。可任选地以拟肽来抑制酵素造成肽降解或其他降解过程。在可任选和较佳的实例中,所述肽可通过有机合成技术产生。在非限制的实施例中,合适的拟肽包含酰胺的同电子排列体(isosteres of amide bonds)、3
‑
氨
‑2‑
丙二酮
‑6‑
羧酸(3
‑
amino
‑2‑
propenidone
‑6‑
carboxylic acid)、羟基
‑
1,2,3,4
‑
四氢异喹啉
‑3‑
羧酸酯(hydroxyl
‑
1,2,3,4
‑
tetrahydro
‑
isoquinoline
‑3‑
carboxylate),以及组氨酸异喹啉羧酸(histidine isoquinolone carboxylic acid)。
[0081]
合成肽的任一部分可非必要地经化学修饰,例如,添加官能基。所述修饰可任选地于合成本发明肽的期间完成。所述修饰包含,但不限于羧甲基化(carboxymethylation)、乙酰化(acylation)、磷酸化(phosphorylation)、醣基化(glycosylation)或脂酰化(fatty acylation)。
[0082]
2.2用以治疗视网膜退化性疾病和/或需组织修复或再生相关症状的组合物
[0083]
本发明合成肽适用于治疗罹患视网膜退化性疾病和/或组织损伤的个体,其中组织损伤需进行组织修复或再生。本发明另一方面是提供一种用于治疗视网膜退化性疾病和/或组织损伤的医药品,其中所述医药品含有本发明合成肽。
[0084]
在一实施方式中,所述医药品是用于治疗视网膜退化性疾病,特别是糖尿病视网膜病变、糖尿黄斑水肿、老年黄斑部病变(amd)、网膜色素病变(rp)、青光眼或急性紫外线视网膜病变。
[0085]
在其他实施方式中,所述医药品是用于治疗组织损伤,特别是干眼症(ded)或视网膜缺血)/再灌流损伤(retinal ischemia/reperfusion(i/r)injury)。
[0086]
在所述医药品的制备上,可将所属技术领域中已知的药学可接受载体、赋形剂或安定剂与适量的本发明的合成肽混合制成一组合物。在特定的实施方式中,所述合成肽选自于上述任一肽,包含但不限于6
‑
mer、6
‑
mersa、6
‑
merla、6
‑
merga、6
‑
merag、6
‑
merqa、6
‑
merli、6
‑
mergv、6
‑
mergn、6
‑
merae、6
‑
merqn、6
‑
merds、6
‑
merde及其组合。
[0087]
所述医药品或组合物中本发明肽的含量随着使用的肽而有所不同。所述组合物中的肽含量约为0.001%至10%(重量%);例如,约0.001、0.005、0.01、0.02、0.03、0.04、
0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2.、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.9、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9.0、9.1、9.2、9.3、9.4、9.5、9.6、9.7、9.8、9.9或10.0%。在一较佳的实施方式中,所述肽的含量约为0.001%至5%(重量%);例如,约0.001、0.005、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2.、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.9、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9或5.0%。
[0088]
所属技术领域中已知有多种药学可接受载体、赋形剂或安定剂能够适用于本发明的合成肽,包含但不限于,非毒性惰性固体、半固体或液体填充剂、稀释剂、包封剂或配方助剂。一般的药学可接受载体可以是水、或生理食盐水。举例而言,药学可接受载体包含,但不限于,糖类,例如,乳糖、葡萄糖或蔗糖;淀粉,例如,玉米淀粉;纤维素及其衍生物,例如,羧甲基纤维素(carboxymethyl cellulose)、乙基纤维素(ethyl cellulose)和醋酸织维素(cellulose acetate);黄蓍胶粉末(powdered tragacanth);麦芽(malt);明胶(gelatin);滑石(talc);赋形剂,例如,可可脂(cocoa butter)和栓剂蜡(suppository waxes);油类,例如,花生油(peanut oil)、棉籽油(cottonseed oil)、红花油(safflower oil)、芝麻油(sesame oil)、橄榄油(olive oil)、玉米油(corn oil)和大豆油(soybean oil);二醇类(glycols),例如,丙二醇(propylene glycol);酯类(esters),例如,油酸乙酯(ethyl oleate)和月桂酸乙酯(ethyl laurate);琼脂(agar);缓冲剂(buffering agents),例如,氢氧化镁(magnesium hydroxide)和氢氧化铝(aluminum hydroxide);藻酸(alginic acid);以及其它制剂,例如,非毒性润滑剂(toxic lubricants)(如,月桂基硫酸钠(lauryl sulfate)、硬脂酸镁(magnesium stearate))、着色剂(coloring agent)、释放剂(releasing agents)、调味剂(flavoring agents)、防腐剂(preservative)以及抗氧化剂(antioxidants)。所述组合物可包含抗生素或抗霉菌剂。
[0089]
本揭示内容的医药品或组合物的施用途径包括:经由血管传递(例如,注射或灌注)、经口、肠内、直肠、肺(例如,吸入)、经鼻、局部施用(包含经皮,经颊以及舌下)、膀胱内、玻璃体内、腹膜内、阴道、经脑传递(例如,脑室注射和颅内注射)、经cns传递(例如,鞘内、椎旁和椎内)或肠外(例如,皮下、肌肉内、静脉内和皮内)、黏膜给药或通过移植或其他公知的给药途径。
[0090]
适用于口服的药学组合物,可以是离散剂型,包含但不限于,丸剂、片剂、锭剂、硬式或软式胶囊;或制成一分散粉末或颗粒;或制成一溶液或悬浮液,例如,溶液或悬浮液。举例而言,水溶性或油性悬浮液、乳剂、糖浆、酏剂或肠内配方。所述组合物可以制成单一剂量或多剂量剂型,例如,密封瓶或安瓿,以冻干条件并添加无菌液体载体(例如,水或食盐水)储存。
[0091]
适用于肠外途径施用的药学组合物可以被制成液体或非液体无菌注射剂型,通过混合或分散本发明合成肽与一无菌溶液,例如,林格氏溶液、食盐水、1,3
‑
丁二醇以及乙醇等。在可任选地实施例中,非挥发油、脂肪酸、合成单一或双甘油酯皆可作为溶剂。所述组合
物可通过过滤器过滤使之无菌。
[0092]
适用于局部和皮肤途径施用的药学组合物,可以被制成软膏(ointments)、糊剂(pastes)、乳霜(creams)、乳液(lotions)、凝胶(gels)、贴片(patches)或喷雾剂(sprays)等剂型。眼部剂型、耳滴剂和眼滴剂皆属于本发明涵盖范畴。依据某些实施方式,本发明的组合物可局部施用至眼部。随着患者疾病的严重程度和类型不同,本发明合成肽的施用至患者的剂量为约1微克/公斤体重至约100毫克/公斤体重(如,0.1
‑
50毫克/公斤体重)例如,1、5、10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、450、460、470、480、490、500、510、520、530、540、550、560、570、580、590、600、610、620、630、640、650、660、670、680、690、700、710、720、730、740、750、760、770、780、790、800、810、820、830、840、850、860、870、880、900、910、920、930、940、950、960、970、980、990或1,000微克/公斤;或2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100毫克/公斤。每日或每周的施用剂量为约1毫克/公斤至约20毫克/公斤或更高,例如0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50毫克/公斤。为达到上述任一局部施用的目的,每日施用一次至数次(如,每日施用4、6、8或更多次)。
[0093]
药学组合物可以制成适用于肺部施用的剂型,例如,粉尘(dusts)或气雾(mists),譬如可利用压力定量(pressurized metered dose)装置来产生气溶胶、气雾或粉尘。
[0094]
本发明所提供的组合物可以是一试剂盒。可以理解的是本发明所述试剂盒是作为一产品,其包含本发明合成肽和/或其他治疗性化合物,经包装而形成所述组合物,以利组合物的运送、储存和同时或连续施用。因此,本发明试剂盒可包含一或多个含本发明的合成肽的安瓿,以将本发明肽制成单一剂量或多剂量形式。所述试剂盒更包含一载体,用以溶解本发明所述合成肽;例如,水溶液介质物,即生理食盐水、林格氏溶液(ringer's solution)、葡萄糖和氯化钠。水溶性介质,如,乙醇、聚乙二醇(polyethylene glycol)、丙基乙二醇(propylethylene glycol)。若有必要,非水溶性载体也可适用本发明。本试剂盒的其他对象为一包装盒,用以包装本发明的各组成物。适用于本发明的包装盒的材料可以是玻璃、塑料(聚乙烯,聚丙烯,聚碳酸酯极其类似物)、瓶子、小罐子、纸、束袋或其类似物。
[0095]
本发明试剂盒可更包含说明书,其中记载本发明各种配方的施用方式(如,同时施用、连续施用、个别施用)。因此,本发明的试剂盒可更包含如何施用(如,同时施用、连续施用、个别施用)本发明中不同成分的说明书。所述说明书可以是纸张或为可被读取的电子媒介物,例如,电子储存媒体(磁盘、磁带或其类似物)、光学媒体(cd
‑
rom,dvd)及其类似物。所述媒体可额外或非必要的附加网络页面,以提供上述说明信息。
[0096]
2.3治疗视网膜退化性疾病和/或需要组织修复或再生的疾病
[0097]
如上所述,本发明所揭示的内容能有效治疗和/或预防视网膜退化性疾病和/或组织损伤。
[0098]
因此,本发明是关于一种治疗和/或预防视网膜退化性疾病和/或组织损伤的方法,其包含施用一包含本发明的合成肽的一医药品或组合物至一有需要的个体,其中所述合成肽由氨基酸序列x1x2x3x4ex5(序列编号:1)所组成,且其中,
[0099]
x1是丝氨酸(s)或丙氨酸(a);
[0100]
x2是亮氨酸(l)、丙氨酸(a)或异亮氨酸(i);
[0101]
x3是甘氨酸(g)、丙氨酸(a)、缬氨酸(v)或天冬酰胺(n);
[0102]
x4是丙氨酸(a)、甘氨酸(g)或谷氨酸(e);
[0103]
x5是谷氨酰胺(q)、丙氨酸(a)或天冬酰胺(n);
[0104]
x2、x3、x4和x5分别左旋氨基酸,而x1和e分别是左旋氨基酸或右旋氨基酸;以及
[0105]
当序列编号:1具有slgaeq(序列编号:9)的序列时,所述丝氨酸(s)或所述谷氨酸(e)是右旋氨基酸;以及
[0106]
一药学上可接受载体。
[0107]
在可任选的实施方式中,合成肽氨基酸序列的n
‑
端被乙酰化并且所述氨基酸序列的c
‑
端被酰胺化。
[0108]
当施用本发明医药品和/或组合物至所述个体,能够减缓或减轻与所述视网膜退化性疾病和/或需要组织修复或再生疾病和/或症状相关的病征。
[0109]
在特定的实施方式中,所述合成肽是选自于上述肽的群组中,其包含但不限于6
‑
mer sa、6
‑
mer la、6
‑
mer ga、6
‑
mer ag、6
‑
mer qa、6
‑
mer li、6
‑
mer gv、6
‑
mer gn、6
‑
mer ae、6
‑
mer qn、6
‑
mer ds、6
‑
mer de及其组合。
[0110]
依据一实施方式,本发明是关于一种治疗视网膜退化性疾病的方法,特别是用于治疗糖尿病视网膜病变、老年黄斑部病变(amd)、网膜色素病变(rp)、青光眼或急性紫外线视网膜病变,并且所述方法包含施用施用本发明的医药品或组合物至有需要的个体。
[0111]
依据其他实施方式,本发明是关于一种治疗组织损伤的方法,其中所述组织损伤需经组织修复或再生。组织损伤特别是指干眼症(ded)、骨关节炎、急性肌腱断裂、皮肤创伤、皮肤老化、皱纹、脱发或视网膜缺血/再灌注(i/r)损伤。
[0112]
所述方法包含施用本发明的医药品或组合物至有需要的个体。
[0113]
在所有的实施方式中,适合接受治疗的个体为人类。
[0114]
下文提出多个实验例来说明本发明的某些实施方式,以利本领域技术人员操作本发明,且不应将这些实验例视为对本发明范围的限制。
[0115]
实施例
[0116]
材料和方法
[0117]
材料
[0118]
杜氏改良培养基(dulbecco's modified eagle's medium,dmem)和胎牛血清(fbs)购自invitrogen(carlsbad,ca)。磷酸化stat3(phospho
‑
stat3)(tyr705)抗体和stat3抗体购自cell signaling technology(danvers,ma)。stat3肽抑制剂(no.573096)和stat3抑制剂v(no.573099)购自calbiochem(la jolla,ca)。谷氨酸、二甲亚砜(dmso)、链佐霉素(stz;s0130)、异硫氰酸荧光素
‑
牛血清白蛋白(fitc
‑
bsa),以及本实验所有的化学品皆购自sigma
‑
aldrich(st.louis,mo)。短合成肽是以genscript(piscataway,nj)合成,并且每一肽的nh2端及cooh端分别经乙酰化和氨基化修饰,以改善其稳定性,接着以质谱仪定
性(纯度:>95%)。
[0119]
细胞培养
[0120]
c2c12小鼠肌纤维母细胞株和neuro
‑
2a小鼠神经母细胞株皆购自美国菌种中心(atcc,manassas,va)。细胞培养于dmem高葡萄糖培养基中。arpe
‑
19细胞(人类视网膜色素上皮细胞株)培养于dmem/f12(杜氏改良培养基和ham's f12;1:1混合)。所有的培养基额外添加10%fbs、4mm l
‑
谷氨酰胺、1mm丙酮酸盐、100u/ml盘林西林
‑
100μg/ml链霉素,培养环境为37℃,5%co2大气环境下。
[0121]
评估neuro
‑
2a细胞死亡的方法
[0122]
将neuro
‑
2a细胞接种于48孔培养盘(1.5
×
105细胞/孔),培养24小时,再以0.5ml的含本发明肽(20μm)的新鲜2%fbs
‑
dmem培养基(0.5ml培养基含7μg的6
‑
mer)继续培养4小时。接着,将100mm的谷氨酸(取自于1m储存液且pbs作为溶剂)添加至细胞中,再培养6小时。测量受损细胞释放至培养基中的乳酸脱氢酶(lactate dehydrogenase,ldh)活性,以评估谷氨酸诱导细胞死亡的定量结果。利用picoprobe
tm
ldh
‑
细胞毒性荧光分析试剂盒(catalog#k314
‑
500;biovision)及其操作手册测量ldh活性。以自动微量盘分析仪(uvmax;molecular devices,san francisco,ca)测量荧光产物(ex/em=535/587nm)评估ldh活性。
[0123]
西方墨点法分析
[0124]
依照公开文献(yang yc等,bmc cancer 2007;7:216)所示步骤进行细胞裂解、分划和sds
‑
page电泳。在此所使用的抗体为phospho
‑
stat3和stat3(1:1000倍稀释)的抗体。以合适的igg
‑
hrp次级抗体(santa cruz biotechnology)和ecl试剂(amersham biosciences)侦测目标蛋白。
[0125]
实时定量聚合酶连锁反应(quantitative real
‑
time pcr)
[0126]
利用trizol(invitrogen)从细胞中萃取总rna。利用oligo(dt)引物和反转录酶(superscript iii;invitrogen),以总rna(1μg)于50℃经50分钟进行cdna合成。简言之,cdna的定量是利用dna master sybr green i试剂盒(roche)于lightcycler(roche,mannheim,germany)中所完成,循环条件为:初始变性温度为95℃,10分钟,接着进行40个循环(95℃,10秒、60℃,10秒、和72℃,10秒),最终置于72℃温度下。数据以δδct计算。所述基因表达以gapdh(glyceraldehyde
‑3‑
phosphate dehydrogenase)的表达进行校正。pcr引物为小鼠生存素正向引物:5
′‑
tgccacgatggtgatgaaac
‑3′
(序列编号:27)、反向引物:5
′‑
tgacgggtagtctttgcagt
‑3′
(序列编号:28)(登录号:nm_001012273.1;pcr产物:136bp);小鼠gapdh正向引物:5
′‑
aacggatttggccgtattgg
‑3′
(序列编号:29)、反向引物:5
′‑
cattctcggccttgactgtg
‑3′
(序列编号:30)(nm_001289726.1;149bp)。为了分析兔子发炎性基因表达,pcr引物为兔子tnf
‑
α正向引物:5
′‑
cctgtgcctcccttcactta
‑3′
(序列编号:31)、反向引物:5
′‑
cccttagggagcagaggttc
‑3′
(序列编号:32)(登录号:nm_001082263.1);兔子il
‑
1β正向引物:5
′‑
cctgttctttgaggccgatg
‑3′
(序列编号:33)、反向引物:5
′‑
gccggaagctcttgttgtag
‑3′
(序列编号:34)(nm_001082201.1);兔子gapdh正向引物5
′‑
aggtcatccacgaccacttc
‑3′
(序列编号:35)、反向引物5
′‑
gtgagtttcccgttcagctc
‑3′
(序列编号:36)(登录号:nm_001082253.1)。pcr产物和gapdh mrna对照物的循环阈值用以计算mrna的相对量。
[0127]
动物实验
[0128]
在此所有实验过程经马偕纪念医院审查委员会同意并遵循视觉及眼科学学术研究会议(arvo)所订定的动物实验眼科和视觉研究相关规定。
[0129]
视网膜缺血
‑
再灌注(i/r)动物模型
[0130]
实验步骤经马偕纪念医院审查委员会同意。手术过程于无菌环境下完成。将sprague
‑
dawley成鼠(10周龄)(初始体重=312
±
11克)以腹腔注射的方式施用赛拉嗪(10毫克/公斤)进行牺牲。将肽溶于0.85%生理食盐水(1mm),在诱导i/r之前,利用微量注射器(31
‑
g)以结膜下注射(subconjunctival injection)方式施用肽。生理食盐水作为载体对照组。于注射肽或载体后4小时,完成i/r大鼠的制备。以0.5%托吡卡胺(tropicamide)和0.5%脱氧肾上腺素(phenylephrine)散瞳。利用加热毯使大鼠体温保持在37℃。瞳孔散大后,右眼前房以连接生理盐水的27号针进行插管。将储存袋(reservoir)置于眼睛上方150公分,使眼内压(intraocular pressure)(iop)升高至110mmhg,并且通过观察虹膜白化和视网膜红反射丧失确认视网膜缺血。于缺血90分钟后,移除插管,眼内压(iop)回复至正常值,进而恢复视网膜动脉血液供应,并诱导再灌注损伤产生。通过红反射确认再灌注。于术前和术后眼睛局部施用0.4%盐酸氧丁卡因(oxybuprocaine hydrochloride)(1或2滴)和氧氟沙星眼用凝胶(ofloxacin ophthalmic gel)(0.3%)以进行角膜麻醉。大鼠左眼进行假手术(sham procedure)作为动物内控制(intra
‑
animal control)。
[0131]
i/r诱导视网膜损伤的组织学评估
[0132]
于i/r损伤后14天,利用过量的戊巴比妥(pentobarbital)(静脉注射100毫克/公斤体重)牺牲大鼠(每组n=6),角膜12点钟位置以丝线缝合标记眼球,接着进行眼球摘除,并以4%多聚甲醛(paraformaldehyde(pfa)进行固定(4℃,24小时)。经固定后,移除前段,眼球含视盘的后方以连续梯度的乙醇进行脱水并以石蜡包埋。于苏木和伊红(h&e)染色,利用切片机沿纵向经线(vertical meridian)通过视神经头切取复数切片(5μm厚),于配有ccd照相机(200
×
)的光学显微镜下观察(leica,heidelberg,germany)。为了量化视网膜i/r损伤程度,本实验测量了视网膜中央总厚度(ot,在gcl至onl之间)、内核层(inl)和外核层(onl)。利用线性细胞密度(每200μm的细胞)计算神经节细胞层(gcl)中的细胞数。每只眼睛取三个部份平均,并取六只眼睛的平均值记录,作为每组的代表值。
[0133]
i/r损伤视网膜的tunel染色
[0134]
于i/r后20小时,以过量的戊巴比妥(pentobarbital)牺牲大鼠(每组n=6)。眼球经摘除后以4%pfa固定(4℃,24小时)。以石蜡包埋经固定的视网膜。为了鉴别视网膜细胞凋亡,去除切片(厚度5μm)(通过视盘)上的石蜡,复水,以蛋白酶k(20μg/ml)处理10分钟,利用tunel试剂盒(terminal deoxynucleotidyl transferase(tdt)
‑
mediated dutp nick
‑
end labeling
–
based kit)(roche molecular biochemicals,indianapolis,in)并依据其操作手册完成凋亡细胞的免疫荧光染色。以hoechst 33258复染7分钟来定位细胞核。于配备有ccd照相机(zeiss axiocam hrm,zeiss)(
×
400,6个视野/样本)的荧光显微镜(epifluorescence microscope)(zeiss axioplan 2imaging;zeiss,oberkochen,germany)下观察切片,并且以axiovert软件(zeiss axiovision release 4.8.2,zeiss)进行定量。每只眼睛取三个部份平均,并取六只眼睛的平均值记录,作为每组的代表值。
[0135]
免疫荧光染色
[0136]
经去除石蜡的视网膜切片以含10%羊血清和5%胎牛血清的pbst(0.5%tritonx
‑
100)于室温下处理20分钟,以阻断非特异性染色。利用对抗胶质纤维酸性蛋白(glial fibrillary acidic protein)(gfap)(1:100稀释)或iba
‑
1(1:100稀释)初级抗体于37℃培育3小时完成染色。接着以标记有适当荧光物的二级抗体(1:500稀释)于37℃培育1小时,接着以hoechst 33258复染6分钟。切片再经pbst润洗三次,以fluorsave
tm
试剂(calbiochem)固定,再以荧光显微镜(epifluorescence microscope)(zeiss axioplan 2imaging;zeiss,oberkochen,germany)下观察。每只眼睛取三个部份平均,并取六只眼睛的平均值记录,作为每组的代表值。
[0137]
视网膜脉管的制备与分析
[0138]
于i/r损伤后14天,以过量的戊巴比妥(pentobarbital)牺牲大鼠(每组n=6),以4%pfa固定眼球(4℃,隔夜),将视网膜分离,以pbst渗透5分钟,水洗至隔夜,将其置于玻片上并以2.5%胰蛋白酶(50μl,invitrogen,carlsbad,ca)于37℃培育30分钟,偶尔轻晃混合。将非血管细胞从脉管上刷掉,并用pbs冲洗。切片以异凝集素gs
‑
ib4(alexa fluor 568conjugate,1:200稀释,thermo fisher scientific)于37℃处理1小时进行染色,接着以hoechst 33258复染10分钟,以pbst润洗,再以fluorsave
tm
试剂固定,于荧光显微镜(epifluorescence microscope)(200
×
)下观察。长度方向上皆无外皮细胞的小血管被鉴定为退化的微血管,并以视网膜区域的每平方公厘记录。每只眼睛取十个部份平均,并取六只眼睛的平均值记录,作为每组的代表值。
[0139]
糖尿病小鼠视网膜中血管异常的测量
[0140]
于第1天和第3天腹腔注射链佐霉素(streptozotocin)(stz;200毫克/公斤体重)至糖尿病小鼠。stz以0.1m的柠檬酸缓冲液(citrate buffer)(ph 4.5)新鲜制备。于注射后,提供小鼠10%蔗糖至隔夜,避免突发性低血糖休克。于一周后(第7天),非空腹血糖>500毫克/dl的小鼠定义为糖尿病小鼠,供实验使用。以平衡盐溶液(balanced salt solution,bss)作为肽载体(alcon,novartis)。局部施用6
‑
mer类似物眼滴剂(溶于bss,200μm)至眼睛,施用方式为一日三次。于两周后(第14天),小鼠腹腔注射fitc
‑
bsa(100毫克/公斤)经30分钟测定视网膜的血管病灶(出血区域)处。接着实验动物以吸入co2的方式牺牲,摘除眼球并以4%pfa固定(4℃,隔夜),并将其平放固定于玻片上得到光学切片。视网膜中的血管病灶处的评分是通过荧光显微镜(epifluorescence microscopy)(200
×
)下观察玻片样本的四个视网膜象限。在视网膜中央处和周边处每一象限内采集三个显微镜视野,并且数据以病灶处/视网膜的平均数呈现。
[0141]
干眼症动物模型
[0142]
动物
[0143]
本实验采用七至八周龄的c57bl/6小鼠(每只体重约18至25克)。实验过程经马偕纪念医院审查委员会同意并遵循视觉及眼科学学术研究会议(arvo)所订定的动物实验眼科和视觉研究相关规定。
[0144]
诱导干眼症
[0145]
将小鼠置入于人工环境室(controlled environment chamber;cec)中14天,并依据barabino等人(ivos(2005)46(8),2766
‑
2771)所揭示的实验步骤,诱导小鼠产生干眼症。置入cec的小鼠暴露在一湿度相对较低的环境下,相对湿度(rh)<25%;温度为20至22℃;空气流量为15公升/分;每日12小时。对照组的小鼠置于正常的环境(rh>50%;空气流量为0;
温度为20
–
22℃)并经过相同的期间。
[0146]
治疗
[0147]
利用一般人工泪液制剂,即,1%羧甲基纤维素(carboxymethylcelllulose,cmc)溶于平衡盐溶液(balanced salt solution,bss)作为所述肽载体。局部施用肽(100μm,约0.7μg肽溶于10μl眼滴剂中以治疗单眼)或1%cmc载体至眼睛,一日三次。为了测试本发明合成肽对于干眼症是否会产生任何治疗作用,小鼠置于cec饲育14天且不接受局部治疗,接着再以本发明肽治疗4天。
[0148]
角膜荧光染色
[0149]
腹腔注射舒泰(zoletil)(6mg/kg)和赛拉嗪(3mg/kg)混合物麻醉动物。利用局部荧光素(fluor
‑
i
‑
strip,ayerst laboratories,philadelphia,pa)染色测定角膜上皮损伤。角膜荧光染色以裂隙灯显微镜(slit
‑
lamp biomicroscope),于钴蓝光(cobalt blue light)下观察,并以数字相机撷取影像。角膜染色以单盲方式计分,计分方式如下:无点状染色,分数为0;低于1/3角膜被染色,分数为1;2/3或低于2/3角膜被染色,分数为2;以及当高于2/3角膜被染色,分数为3(horwath
‑
winter j 2013)。
[0150]
角膜上皮细胞培养和治疗
[0151]
从新西兰白兔(6月龄)分离角膜轮部上皮干细胞(limbal stem epithelial cells,lsec),以dmem/f
‑
12基础培养基细胞悬浮培养连续培养14天使细胞分化成上述的角膜样上皮细胞(ho等人,stem cell.2013;31:1775)。lsec(2
×
105细胞/孔,6孔盘)以混合有6
‑
mer变异肽(20μm)的基础培养基(含2%fbs)处理6小时,接着直接以90mm nacl处理,使细胞处于高渗透(hop)环境下。经3小时后,以定量实时pcr(quantitative real
‑
time pcr)评估hop诱导肿瘤坏死因子(tnf)
‑
α和白介素
‑
1β(il
‑
1β)的表达。培养于dmem/f
‑
12基础培养基的细胞(309mosm)作为阴性对照。
[0152]
统计
[0153]
结果取自于三次独立试验。所用数值以mean
±
sd表示。利用mann
‑
whitney试验进行两组间的比较。p<0.05为具有显著性。
[0154]
实施例1神经保护肽的鉴定和特性
[0155]
1.1神经保护肽的鉴定
[0156]
在此实施例中,合成表二所示的系列短合成肽,并依据“材料与方法”一节所述方法于neuro
‑
2a神经母细胞中以谷氨酸诱导细胞死亡来评估神经保护效果。此外,每一个合成肽(序列编号:2
‑
11)的第一个氨基酸残基(即,丝氨酸)为右旋氨基酸,以增加其对于蛋白酶的抗性。
[0157]
简而言之,细胞以特定肽(即,序列编号:2至11任一序列)进行前处理(4小时),再以100mm谷氨酸处理6小时。以市售乳酸脱氢酶(lactate dehydrogenase,ldh)细胞毒性分析试剂盒侦测细胞死亡。结果示于图1。
[0158]
表二 短合成肽
[0159][0160][0161]
以上序列中粗体字表示所述氨基酸是右旋氨基酸
[0162]
如图1所示,谷氨酸随时间逐渐导致细胞死亡(7.6
±
0.8%;添加谷氨酸的肽溶剂dmso作为阳性对照组)。值得注意的是结果显示只有6
‑
mer
‑
ds肽(slgaeq;序列编号:9)对于neuro
‑
2a细胞展现保护效力,而氨基酸残基多于6个的肽(即,13
‑
mer ds至7
‑
mer ds(序列编号:2至8)和氨基酸残基少于6个的肽(即,5
‑
mer ds或4
‑
mer ds(序列编号:10或11)无任何细胞保护效力(1.5
±
0.5%vs.8.2
±
006%
‑
11.4
±
0.3%)。
[0163]
结果显示在6
‑
mer ds(slgaeq;序列编号:9)中第六个氨基酸残基是关键残基,其保留6
‑
mer的神经保护活性。结果也显示精氨酸(r)残基(7
‑
mer ds的最后一个氨基酸;序列
编号:8)可能对6
‑
mer的生物功能有抑制作用。
[0164]
1.2分析6
‑
mer ds肽的特性
[0165]
1.2.1 6
‑
mer ds肽诱导经stat3依赖方式表达生存素
[0166]
生存素(survivin)是stat3(信号转导子和转录激活子)的转录目标,其对于缺血过程中神经存活极为重要。因此,本实施例研究stat3讯号对于6
‑
mer ds的神经保护效力的影响。结果示于图2。
[0167]
西方墨点分析的结果显示通过6
‑
mer ds刺激c2c12肌母细胞,于刺激后5
‑
20分钟造成stat3磷酸化。相反地,5
‑
mer ds无展现相同或类似的效力(图2,(a))。
[0168]
再者,相较于经溶剂处理的c2c12细胞,经6
‑
mer ds刺激后3小时,c2c12细胞中生存素mrna的量显著上升2.6
‑
倍(图2,(b))。经其他肽(即,序列编号:2
‑
8或10
‑
11任一序列)处理的c2c12细胞的结果无此类诱导效果。
[0169]
本实施例还使用其他已知的药学抑制剂包含stat3pep和stat3抑制子v来探索生存素诱导的分子机制。real
‑
time qpcr分析结果显示经stat3抑制剂(即,stat3pep或stat3 inhibitor v)前处理的细胞中,通过6
‑
mer ds所诱导的生存素mrna表达被抑制,自2.6
‑
倍至1.3
‑
倍(图2,(b))。
[0170]
综上,本实施例的结果显示6
‑
mer ds肽是通过活化stat3讯号路径诱导生存素表达,以发挥神经保护作用。
[0171]
1.2.2谷氨酸残基对于6
‑
mer ds肽诱导生存素表达的重要性
[0172]
为了进一步研究6
‑
mer ds肽中氨基酸残基的重要性,分别利用丙氨酸扫瞄和氨基酸置换产生6
‑
mer变异物,其中6
‑
mer ds肽的氨基酸残基被丙氨酸或其右旋氨基酸系统性地取代,或者是被突变;所产生的6
‑
mer变异物示于表三至表五。
[0173]
表三 利用丙氨酸扫瞄所产生的6
‑
mer变异物
[0174]
[0175]
表四 利用右旋氨基酸取代所产生的6
‑
mer变异物
[0176][0177][0178]
以上序列中粗体字表示所述氨基酸是右旋氨基酸
[0179]
表五 利用突变所产生的6
‑
mer变异物
[0180][0181]
类似实施例1.2.1的方法,利用c2c12细胞生存素mrna的表达量作为评估表三至表五中6
‑
mer变异物的指标。简而言之,以6
‑
mer变异物(20μm)处理低血清培养基中的c2c12细胞6小时。依据real
‑
time qpcr分析的结果显示在生存素诱导方面,6
‑
mer sa(1.7
‑
倍)、6
‑
mer la(1.5
‑
倍)、6
‑
mer ga(1.6
‑
倍)、6
‑
mer ag(1.5
‑
倍)和6
‑
mer qa(1.6
‑
倍)能够保留部份6
‑
mer ds活性(*p<0.004vs.溶剂对造组;图3)。实验结果可以证实谷氨酸(e)残基被丙氨酸所取代,将严重损害6
‑
mer的活性。
[0182]
关于非天然氨基酸(右旋氨基酸)取代所产生的6
‑
mer变异物的功能,real
‑
time qpcr分析显示,相较于溶剂对照组,丝氨酸(s)被其右旋氨基酸残基所取代能够增加生存素mrna的量(图4,ds vs.溶剂),以6
‑
mer ds作为阳性对照组,而当亮氨酸(l)、丙氨酸(a)或谷氨酰胺(q)被其相对应的右旋氨基酸残基所取代时,将显著阻碍生存素基因诱导活性(图4,6
‑
mer
‑
dl、da或dq vs 6
‑
mer ds)。谷氨酸(e)经其右旋氨基酸残基所取代可中度诱导生存素mrna量(图4,de vs 6
‑
mer ds),其中所述量仍显著高于溶剂对照组。
[0183]
氨基酸通常以侧链(即,r基)的特性区分,因此,本实验例的突变是以在r基中展现类似特性的其他氨基酸置换6
‑
mer的氨基酸残基(参见表五)。real
‑
time qpcr分析的结果示于图5,结果显示相较于溶剂对照组,以异亮氨酸(i)取代亮氨酸(l)(6
‑
mer li)、以天冬
酰胺(n)取代甘氨酸(g)(6
‑
mer gn)、以缬氨酸(v)取代甘氨酸(g)(6
‑
mer gv),以谷氨酸(e)取代丙氨酸(a)(6
‑
mer ae),或以天冬酰胺(n)取代谷氨酰胺(q)(6
‑
mer qn)分别诱导生存素mrna的量为2.1、1.5、2.3、1.5
‑
和2.1
‑
倍(图5;*p<0.05)。相对地,以苏氨酸(t)取代丝氨酸(s)(6
‑
mer st)、以异亮氨酸(i)取代丙氨酸(a)(6
‑
mer ai)、以丝氨酸取代丙氨酸(a)(6
‑
mer as),或是以天门冬氨酸(d)取代谷氨酸(e)(6
‑
mer ed)会严重损害生存素mrna诱导作用(即,相同或低于基本量)。
[0184]
整体来说,实验结果显示6
‑
mer ds(序列编号:9)6个氨基酸残基中有5个残基对于氨基酸取代有耐受性,而谷氨酸残基(e)是6
‑
mer肽具神经保护活性的关键。
[0185]
实施例2 6
‑
mer ds、6
‑
mer sa、6
‑
mer li、6
‑
mer gv和6
‑
mer qn保护视网膜对抗视网膜缺血/再灌注损伤
[0186]
有多种眼疾例如,视网膜血管阻塞、急性青光眼、糖尿病视网膜病变、老年黄斑部病变(amd)、视网膜剥离和早产儿视网膜病变与视网膜缺血/再灌注(i/r)损伤有关,所述些疾病可能导致患者失明。视网膜缺血通常是由微血管所导致的,使得视网膜区域中的能量耗尽,接着自然再灌注会诱导强氧化压力产生。经i/r损伤数小时后,将发生发炎反应及细胞死亡。基本上,这些生理反应会导致视神经和视网膜血管退化。
[0187]
在此实施例中,利用“材料和方法”一节所述的i/r损伤大鼠模型研究6
‑
mer变异肽对于神经视网膜细胞和视网膜血管系统的神经保护效力。简而言之,于诱导i/r损伤前4小时,注射6
‑
mer变异肽(1mm,120μl)至sprague
‑
dawley鼠结膜下空间(subconjunctival space)。以增加眼内压(iop)至110mmhg(90分钟)诱导i/r损伤,接着进行再灌注(20小时)。再以tunel染色评估视网膜细胞凋亡量。此外,在i/r损伤后14天,以h&e染色分析视网膜形态。结果摘要于图6至图10,以及表六至九。
[0188]
请参见图6,其显示6
‑
mer ds或6
‑
mer de对于4
‑
羟基
‑2‑
壬烯醛(4
‑
hydroxy
‑2‑
nonenal,4
‑
hne)诱导arpe
‑
19细胞凋亡的保护效力。4
‑
羟基
‑2‑
壬烯醛(4
‑
hne)是脂质氧化的产物,被认为是最难以对付能够与多种细胞目标形成加成物的反应醛之一,特别是参与氧化还原讯号传递的蛋白。值得注意的是,已有研究证实4
‑
hne能够通过损害atpase活性影响线粒体(如,破坏耗氧量),甚至是触发早发凋亡。实验结果显示6
‑
mer ds能够抑制4
‑
hne诱导的凋亡,并且6
‑
mer ds的功效优于6
‑
mer(图6,(b))。
[0189]
i/r损伤经/未经6
‑
mer肽(6
‑
mer ds或6
‑
mer st)处理的眼睛视网膜影像示于图7。以载体(vehicle)处理的假手术组(sham group),经tunel染色的结果显示视网膜细胞核为阴性;以载体处里的i/r组中内核层(inl)、外核层(onl)和神经节细胞层(gcl)中观察到大量的荧光。相反地,以6
‑
mer ds处理的眼睛,于鼠视网膜tunel染色的结果中仅有少部份的绿色荧光核,而6
‑
mer st无相同的功效(即,阻断i/r诱导的视网膜细胞凋亡)。值得注意的是,参见表六所示,i/r损伤前结膜下注射6
‑
mer sa、6
‑
mer li、6
‑
mer gv或6
‑
mer qn肽能够降低i/r诱导的视网膜细胞凋亡。
[0190]
表六鼠眼发生i/r损伤后20小时视网膜内tunel
‑
阳性细胞数量的定量分析
[0191][0192]
数据以平均值
±
标准偏差表示(每组n=6只眼睛)。
[0193]
*p<0.0001vs.载体+i/r。
[0194]
请参见图8,所述图为i/r损伤后经/未经6
‑
mer ds处理的眼睛,其视网膜区域经h&e染色的照片。于i/r损伤后14天,h&e染色视网膜横切面结果显示,相较于假手术对照组,载体i/r组的视网膜厚度减少。再者,相较于假手术对照组,i/r损伤的眼睛经单一结膜下注射6
‑
mer ds能够改善整体视网膜厚度,由此可见经6
‑
mer ds处理能够有效预防i/r
‑
诱导的视网膜退化。在统计的结果而言,6
‑
mer ds+i/r组整体视网膜、inl和onl的厚度显著大于载体+i/r组和对照组的结果(p>0.05)(表七)。本实施例的结果可以证实6
‑
mer ds于i/r诱导的早期(20小时)能够避免视网膜细胞凋亡,藉此于i/r损伤发生后14天能保持整体视网膜的厚度。本实验例的结果也可证实6
‑
mer变异物有神经保护功效,能够推迟视网膜退化。
[0195]
表七 i/r损伤后第14天以h&e染色对视网膜萎缩进行组织学检查
[0196]
[0197]
数据以平均值
±
标准偏差表示(每组n=6)。
[0198]
发炎反应是i/r损伤延迟期的通常特征,导致视网膜细胞死亡,进而破坏血管
–
视网膜屏障(brb)。视网膜发炎与数个视网膜疾病相关,例如糖尿病视网膜病变和青光眼。微胶细胞和星状细胞为视觉系统(视网膜、视神经和大脑视觉中心)固有的免疫细胞,且为反应炎症压力的主要效应细胞。
[0199]
如图9所示,于i/r损伤后第14天,视网膜发炎的免疫荧光染色结果显示,相较于对照组,在经载体处理的i/r损伤眼睛中发现iba
‑1‑
阳性微胶细胞(microglia)和gfap
‑
阳性星状细胞(astrocyte)被显著活化,而经6
‑
mer ds处理的眼睛iba
‑1‑
阳性微胶细胞和gfap
‑
阳性星状细胞的活化较不显著。此外,在所有组别中,发现此二效应细胞位于靠近gcl和沿着内视网膜边缘处。平均而言,相较于6
‑
mer ds+i/r组,在载体+i/r组中所观察到的微胶细胞和星状细胞的量明显增加(表八)。综上,6
‑
mer ds能够有效抑制视网膜中通过i/r刺激微胶细胞和星状细胞的病理性活化作用。
[0200]
表八 于i/r损伤后第14天利用免疫荧光染色分析视网膜微胶细胞/星状细胞
[0201][0202]
数据以平均值
±
标准偏差表示(每组n=6)。
[0203]
在视网膜i/r损伤模型中,视网膜内皮细胞和外被细胞(pericyte)死亡将造成无细胞微血管产生。为了测定于i/r损伤后,经6
‑
mer ds处理是否能够有效保护视网膜血管系统,整个视网膜分别利用异凝集素gs
‑
ib4(结合至内皮细胞的荧光标记异凝集素)和hoechst 33258(标记细胞核的荧光染剂)染色。相较于对照组(经假试验的对侧眼),在经载体处理的i/r损伤的眼睛中无细胞微血管的数量上升(图10)。经6
‑
mer ds处理减少了退化的微血管数量。无细胞微血管的定量结果摘要于表九。此外,无论是以载体或6
‑
mer ds处理的对侧眼的假试验中,对于视网膜血管系统皆无细胞毒性。总言之,6
‑
mer ds肽能够防止i/r诱导的视网膜微血管损伤。
[0204]
表九 在缺血后第14天i/r
‑
损伤视网膜中无细胞微血管的数量
[0205][0206]
数据以平均值
±
标准偏差表示(每组n=6)。
[0207]
综合以上结果,i/r动物模型的研究显示6
‑
mer变异物(含6
‑
mer ds’、6
‑
mer sa、6
‑
mer li、6
‑
mer gv和6
‑
mer qn)可分别保护视网膜对抗i/r诱导的神经和血管损害,以及视网膜发炎反应。再者,动物研究结果指出结膜下注射6
‑
mer变异物,能够作为治疗i/r
‑
诱导视网膜损伤的潜在治疗方案。
[0208]
实施例3 6
‑
mer ds能够保护糖尿病小鼠视网膜血管系统
[0209]
经i/r诱导的视网膜于显微镜下的外观与糖尿病视网膜病变中无细胞微血管类似。为了评估6
‑
mer ds对于糖尿病视网膜病变潜在效益,局部施用6
‑
mer ds或载体眼滴剂至stz
‑
诱导的糖尿病小鼠的眼睛,每日施用三次,共14天。以侦测异硫氰酸荧光素
‑
牛血清白蛋白(fitc
‑
bsa)外渗,研究视网膜血管的异常。显微影像的结果显示以载体处理的糖尿病小鼠的视网膜中有数个出血区域(图11),而以6
‑
mer ds眼滴剂处理的眼睛,其血管病灶数减少(2.8
±
0.6,6
‑
mer ds vs.8.2
±
1.5,载体对照组)。
[0210]
在视网膜中,内皮细胞、外被细胞和星状细胞共同形成内视网膜微血管网络中的血管
‑
视网膜屏障。在糖尿病鼠中,星状细胞参与扩增发炎反应的过程,进而导致视网膜的血管渗漏。请参见图12,所述图为stz注射后第14天视网膜gfap免疫荧光染色的结果,其显示在载体/stz组(相较于对照组)中,gfap
‑
阳性星状细胞被大量活化,而在6
‑
mer ds/stz组中则较不明显(数量/400
×
视野:24.3
±
2.7vs.11.0
±
1.4)。由此可以证实,6
‑
mer ds能够有效抑制糖尿病小鼠视网膜中星状细胞病理性活化。
[0211]
非增殖性糖尿病视网膜病变(npdr)长久以来一直存在着缺乏适当治疗方法的问题,这对于防止患者进一步发展成增殖性糖尿病视网膜病变(pdr)和/或糖尿黄斑水肿(dme)极为重要。6
‑
mer ds眼滴剂在糖尿病视网膜病变的早期能够有效预防视网膜发炎和血管异常,并且能够将新疗法发展至临床应用。
[0212]
实施例4 6
‑
mer ds促进角膜伤口愈合
[0213]
重度干眼症(ded)是经常伴随角膜上皮细胞受损。在此实施例中,本实施例依照“材料和方法”所述的步骤建立鼠干眼症模型,以评估6
‑
mer变异肽对于受损角膜的治疗效果。
[0214]
简言之,小鼠置入可控环境室(controlled environment chamber,cec)中14天(设为第0天),诱导角膜表面角膜破裂。利用角膜荧光染色评估角膜表面的损伤,并且染色分数为2的动物(小鼠置于cec14天之后),以肽进行治疗。用以治疗干眼症的6
‑
mer变异肽的配方如材料与方法所述。于6
‑
mer ds治疗4天后,于角膜荧光染色的结果发现,相较于第0天的染色分数,经治疗的角膜荧光染色分数大幅降低(分数:经治疗:1.4
±
0.2vs.第0天:3
±
0;图13)。另外,施用载体、6
‑
mer da或6
‑
mer st治疗4天未产生治疗功效。
[0215]
众所皆知的是在干燥压力诱导的干眼动物中是通过发炎反应所诱导和/或促使眼
睛表面受损。在促发炎介质中,研究指出抑制il
‑
1β和tnf
‑
α有助于减轻动物干眼的症状。此外,在干眼症中泪液渗透压上升被认为是诱导发炎和眼部表面受损的核心机制。
[0216]
为了调查6
‑
mer变异物是否能够抑制角膜上皮细胞中高透压对于促发炎基因表达的影响,分离兔角膜上皮细胞并经培养扩增,接着在细胞培养于高渗透压培养基(463mosm;添加90mm nacl)前,先以6
‑
mer变异物肽(20μm)处理6小时。培养在基础培养基(309mosm)中的细胞作为阴性对照组。
[0217]
于细胞培养于高渗透压培养基3小时后,利用real
‑
time qpcr测定促发炎媒介物(包含tnf
‑
α和il
‑
1β的基因表达)的mrna量。结果显示,相较于基础培养基(仅含溶剂)中的细胞培养物,tnf
‑
α和il
‑
1βmrna显著向上调节12.8和4.5倍(图14)。然而,利用6
‑
mer ds、6
‑
mer sa或6
‑
mer gv前处理6小时的细胞,其tnf
‑
α和il
‑
1β被大幅度抑制。
[0218]
发炎是造成干眼症发生的主要因子。所述结果可以证实6
‑
mer ds、6
‑
mer sa和6
‑
mer gv确实可作为抗发炎制剂,改善角膜伤口愈合。
[0219]
综上,上述实施例的结果可以证实本揭示内容的肽与有神经保护功效,可用来治疗和/或预防与神经退化疾病(如,视网膜缺血/再灌流损伤、伤口愈合、干眼症等)相关的疾病或症状。
[0220]
虽然上文实施方式中揭露了本发明的具体实施例,然其并非用以限定本发明,本领域技术人员在不悖离本发明的原理与精神的情形下,当可对其进行各种更动与修饰,因此本发明的保护范围当以附随权利要求所界定者为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1