一种蛋白质的表达方法与流程
1.本发明名为分案申请,原案申请号为2019114049586。
2.本发明属于生物技术领域,具体地,本发明涉及一种蛋白质的表达方法,更具体地本发明涉及一种蛋白质药物的cho细胞表达方法,所表达的蛋白质药物不含有非人源糖基化。
背景技术:
3.在蛋白质翻译后的修饰中,糖基化修饰是最重要和最复杂的修饰之一,也是评价蛋白质类药物,如抗体药物质量的关键属性之一。
4.蛋白质药物的功能实现与其糖基化修饰密切相关,糖基化修饰会影响蛋白质药物的性能,如构象、稳定性、溶解度、药物代谢动力学、活性及免疫原性等等。
5.根据糖基化修饰的位点可以将糖基化分为n位糖基化和o位糖基化,n位糖基化位于asn-297,寡糖中的n-乙酰氨基葡萄糖与天冬酰胺残基上的酰胺氮连接修饰蛋白质;o位糖基化由寡糖中的n-乙酰半乳糖与丝氨酸或苏氨酸残基上的羟基连接修饰蛋白质。
6.动物细胞表达系统所表达的免疫球蛋白中n位的糖基化是最普遍的糖基化修饰,其糖基化修饰位点位于抗体的fc端,且根据其末端的结构的不同又可分为复合型、杂合型和高甘露糖型。复合型其糖基化以岩藻糖(fuc)为核心,再由n-乙酰氨基葡萄糖(n-glcnac)分出两条等长的分支,其分支上伴以甘露糖(man)、半乳糖(gal)和唾液酸(sia),由此构成抗体fc端n位糖基化。根据两条分支中的单糖不同,可将抗体糖基化修饰类型分为g0f、g1f、g2f、g1fs、g2s1f、g2s2f、g0、g1、g2(fcglycans of therapeutic antibodies as critical quality attributes)。
7.不同的糖基化修饰对蛋白质类药物的稳定性和半衰期、安全性及生物活性具有不同的影响。糖基化修饰可以增加蛋白质类药物的稳定性及溶解度。但是,糖基化的存在也会对蛋白质类药物的安全性造成影响,蛋白质类药物糖基化的存在,会影响其施用时的免疫原性,也会对蛋白质类药物的药物代谢动力学及药效动力学产生影响;抗体类药物的糖基化位点往往也是抗体fc受体(adcc机制)和c1q(cdc机制)的结合位点,也会影响抗体的生物活性(engineeredtherapeutic antibodies with improved effector functions)。
8.以单克隆抗体为例,糖基化修饰形成的糖链结构能够维持抗体的空间构象、稳定抗体的结构,抗体脱糖基化后对热的稳定性大大降低,糖链结构还能保护抗体不受某些蛋白酶水解。糖链中特别的糖型还与免疫相应功能密切相关,非人源的糖基化,其糖型并非在人体内生物合成,这些非人源的糖基化会具有一定的免疫原性,可加速单克隆抗体的血浆清除。
9.糖基化中的唾液酸化作用,在哺乳动物细胞表达系统中主要存在两种类型,分别是n-乙酰神经氨酸(neu5ac,nana),n-羟乙基神经氨酸(neu5gc,ngna)。正常情况下,人类的igg中含有的唾液酸化类型是neu5ac(nana),而小鼠的igg中含有的唾液酸化类型是neu5gc(ngna)。
10.在蛋白质大规模生产所使用的哺乳动物细胞表达系统中也会产生gal-α(1,3)-gal(α-gal)的糖基化结构,α-gal(α-半乳糖)是一种非人源的聚糖,具有极强的免疫原性,会引发异体移植中的组织排斥反应,nk细胞能够直接识别该聚糖,若存在高水平的抗α-gal ige抗体,使用含有α-gal聚糖结构的单克隆抗体进行治疗,则会引起严重的超敏反应。
11.目前现有蛋白质类药物的大规模生产多是采用动物细胞培养,使用动物细胞大规模培养单克隆抗体、免疫调节因子、特定肿瘤抗原以及各种基因重组的蛋白质类药物。动物细胞同微生物相比具有转录后修饰的功能,能够更高效地表达和生产各类高质量的蛋白质类药物。
12.中国仓鼠卵巢细胞(chinese hamster ovary, cho)是蛋白质类药物大规模生产中常用的培养宿主细胞,cho细胞表达系统可以表达出与人类蛋白质结构相近的蛋白质类药物,cho细胞的糖基化的机制同人类的糖基化机制相近,但是cho细胞的表达,还是会有非人源的糖基化表达,而这些非人源的糖基化会使所表达的蛋白质类药物产生免疫原性,对蛋白质类药物的应用产生副作用,影响其表达的蛋白质类药物的治疗效果。
技术实现要素:
13.为了解决上述问题,本发明提供了一种蛋白质的表达方法,更具体地本发明公开了一种蛋白质药物的cho细胞表达方法,使用该方法所表达的蛋白质药物不含有非人源糖基化。
14.本发明采用上海迈泰君奥生物技术有限公司所售的chom系列无血清无动物源性培养基,根据培养模式的不同,使用基础培养基和补充培养基进行蛋白质类药物的大规模生产表达,基础培养基适用于细胞扩增和灌流培养,补充培养基适用于补充批次培养。
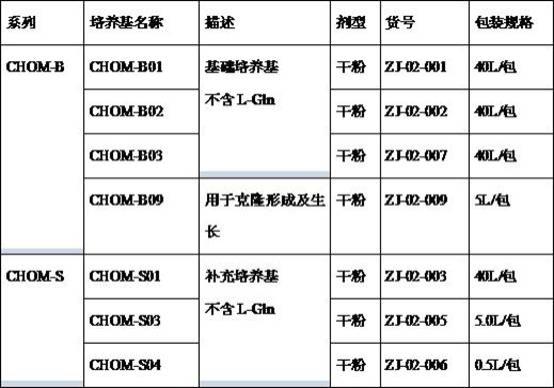
15.chom-b系列是一类无血清无蛋白无动物源成分培养基,专门应用于表达抗体等重组蛋白cho细胞的长期悬浮培养。由于不含l-谷氨酰胺,所以尤其适合与谷氨酰胺合成酶(gs)筛选系统联用。其中,chom-b01、chom-b02和chom-b03是化学成分限定培养基。chom-b09是一种无动物源成分培养基,不含l-谷氨酰胺,用于cho细胞克隆形成及生长。
16.chom-s系列是为chom-b系列量身定做的补充培养基,应用于表达抗体等重组蛋白cho细胞的批次培养后期添加。该系列补充不含动物源成分及蛋白水解产物,化学成分限定,在提高蛋白产量的同时方便后续纯化及蛋白质的结构解析。
17.表1、chom系列培养基产品简介
本发明提供了一种蛋白质的表达方法,通过该种方法表达的蛋白质类药物不含有非人源糖基化。
18.一种蛋白质的表达方法,所述方法包含表达宿主细胞的扩增和灌流培养阶段,及补充培养阶段,在所述细胞扩增和灌流培养阶段使用chom-b系列培养基培养,在补充培养阶段使用chom-s系列培养基培养。
19.一个优选实施例,在细胞扩增和灌流阶段使用chom-b系列的组合培养基培养,在补充培养阶段使用chom-s系列的组合培养基培养。
20.上述方法中所述细胞扩增和灌流培养阶段的组合培养基为chom-b01与chom-b02组合或chom-b01与chom-b03组合或chom-b01与chom-b02及chom-b03组合,优选chom-b01:chom-b02为1:1~1:5,chom-b01:chom-b03为1:1~1:0.1。
21.上述方法中所述补充培养阶段所使用的组合培养基为chom-s01与chom-s03组合或chom-s01与chom-s04的组合或chom-s01与chom-s03及chom-s04组合,优选chom-s01:chom-s03为1:1~1:0.3,chom-s01:chom-s04为1:1~1:7。
22.使用上述基础培养基及补充培养基进行cho细胞的培养表达,大规模生产表达蛋白质类药物,根据所要表达的不同的目标蛋白质,进行大规模生产表达的参数调节。
23.细胞扩增和灌流培养阶段:温度为30℃~39℃;基础培养基ph为6.6~7.1,以二氧化碳和碳酸钠溶液进行ph调节;溶氧量30%~60%;通气:表层空气,深层微泡通气包括空气、氧气和二氧化碳;每日补充葡萄糖3~5g/l;搅拌转速80~150rpm。
24.补充培养阶段:在细胞扩增和灌流培养阶段检测细胞密度,根据细胞密度在培养的第2~4天,降低温度至32℃~34℃,添加补充培养基,进行补充培养,每日添加补充培养基的量为上灌体积的1%~5%,经过补充培养8~18天后,终止培养,收取细胞培养液,通过深层过滤澄清去除细胞及碎片,在通过一级膜过滤降低生物负荷,获得含有目标蛋白的培养上清
液,进行分离、纯化,获得目标蛋白质,该蛋白质不含有非人源糖基化。
25.上述蛋白质的表达方法,用于培养表达单克隆抗体,双功能融合蛋白质等生物制品。上述蛋白质的表达方法表达的所述生物制品包含pan-p、抗pd-l1抗体、抗pd-1抗体、pd-l1/cd47双功能融合蛋白。
26.一种抗egfr抗体的制备方法,所述方法使用无血清、无动物源组分的基础培养基及补充培养基对含有抗egfr抗体pan-p基因序列的cho宿主细胞进行培养表达,所述基础培养基为chom-b系列的组合培养基,所述补充培养基为chom-s系列的组合培养基。优选灌流培养阶段的条件为:温度为35.5℃~36.5℃;基础培养基ph为6.6~6.8;溶氧量30%~40%;每日补充葡萄糖3~5g/l;搅拌转速80~150rpm。在灌流培养培养的第2~4天,降低温度至33℃,ph为7.0~7.1,添加补充培养基,进行补充培养,每日添加补充培养基的量为上灌体积的1%~5%,低温补充培养8~10天。基础培养基为chom-b01:chom-b02为1:1~1:3。补充培养基为chom-s01:chom-s03为1:1~1:0.3。
27.一种抗pd-l1抗体的制备方法,其特征在于,所述方法使用无血清、无动物源组分的基础培养基及补充培养基对含有抗pd-l1抗体基因序列的cho宿主细胞进行培养表达,所述基础培养基为chom-b系列的组合培养基,所述补充培养基为chom-s系列的组合培养基。优选灌流培养阶段的条件为:温度为35.5℃~36.5℃;基础培养基ph为6.8~6.9;溶氧量35%~45%;每日补充葡萄糖3~5g/l;搅拌转速80~150rpm。在灌流培养培养的第2~4天,降低温度至32.5℃~33.5℃,ph为7.1~7.2,添加补充培养基,进行补充培养,每日添加补充培养基的量为上灌体积的1%~5%,低温补充培养8~10天。所述基础培养基为chom-b01:chom-b02为1:1~1:3,补充培养基为chom-s01:chom-s04为1:1~1:4。
28.一种抗pd-1抗体的制备方法,其特征在于,所述方法使用无血清、无动物源组分的基础培养基及补充培养基对含有抗pd-1抗体基因序列的cho宿主细胞进行培养表达,所述基础培养基为chom-b系列的组合培养基,所述补充培养基为chom-s系列的组合培养基。优选灌流培养阶段的条件为:温度为36.5℃~37.5℃;基础培养基ph为6.9~7.0;溶氧量40%~50%;每日补充葡萄糖3~5g/l;搅拌转速80~150rpm。在灌流培养培养的第2~4天,降低温度至33℃,ph为7.0~7.1,添加补充培养基,进行补充培养,每日添加补充培养基的量为上灌体积的1%~5%,低温补充培养10~12天。所述基础培养基为chom-b01:chom-b03为1:1~1:0.1,补充培养基为chom-s01:chom-s04为1:1~1:4。
29.一种抗pd-l1/cd47双功能融合蛋白的制备方法,其特征在于,所述方法使用无血清、无动物源组分的基础培养基及补充培养基对含有抗pd-l1/cd47双功能融合蛋白基因序列的cho宿主细胞进行培养表达,所述基础培养基为chom-b系列的组合培养基,所述补充培养基为chom-s系列的组合培养基。优选灌流培养阶段的条件为:温度为36℃~37℃;基础培养基ph为6.9~7.0;溶氧量45%~55%;每日补充葡萄糖3~5g/l;搅拌转速80~150rpm。在灌流培养培养的第2~4天,降低温度至32.5℃~33.5℃,ph为7.0~7.1,添加补充培养基,进行补充培养,每日添加补充培养基的量为上灌体积的1%~5%,低温补充培养8~10天。所述基础培养基为chom-b01:chom-b03为1:1~1:0.5,补充培养基为chom-s01:chom-s04为1:1~1:4。
附图说明
30.图1、pan-p质谱检测图谱(不含非人源糖基化);
图2、抗pd-l1抗体质谱检测图谱(不含非人源糖基化);图3、抗pd-1抗体质谱检测图谱(不含非人源糖基化);图4、pd-l1/cd47双功能融合蛋白质谱检测图谱(不含非人源糖基化)。
具体实施例
31.实施例1、培养基种类的筛选购买上海迈泰君奥生物技术有限公司无血清、无动物蛋白、无动物源成分培养基chom-b系列产品及chom-s系列产品,选取chom-b01、chom-b02、chom-b03及chom-s01、chom-s03、 chom-s04产品。
32.根据前期使用chom-b系列培养基及chom-s系列培养基的试验结果,对基础培养基及补充培养基进行进一步筛选。根据基础培养基及补充培养的种类及各组分的比例,将基础培养基分为chom-b01:chom-b02为1:1、1:3、1:5及chom-b01:chom-b03为1:0.1、1:0.5、1:1,将补充培养基分为chom-s01:chom-s03为1:0.3、1:0.6、1:1及chom-s01:chom-s04为1:1、1:4、1:7 。
33.使用上述不同比例的培养基进行cho细胞培养,经过基础培养及补充培养后,对培养过程中的细胞活率、及细胞密度进行检测,其结果见表1、及表2。
34.表1、不同比例培养基培养cho细胞的细胞活率(%)检测结果表2、不同比例培养基培养cho细胞的细胞密度(
ꢀ×
106cell/ml)检测结果
经过多轮培养基组成成分筛选后,根据上述试验结果选择基础培养基为:chom-b01:chom-b02为1:3,chom-b01:chom-b03为1:1。
35.经过多轮培养基组成成分筛选后,根据上述试验结果选择补充培养基为:chom-s01:chom-s03为1:0.3,chom-s01:chom-s04为1:4。
36.实施例2、蛋白质表达方法选择经过实施例1筛选后的基础培养基及补充培养基chom-b01:chom-b02为1:3,chom-b01:chom-b03为1:1,补充培养基chom-s01:chom-s03为1:0.3,chom-s01:chom-s04为1:4,对目标蛋白质进行大规模生产表达。
37.蛋白质的大规模生产表达主要包含细胞扩增和灌流培养阶段,及补充培养阶段。
38.1、细胞扩增:1)、工作细胞复苏:工作细胞库取出工作细胞1支,置于37℃水浴,融化;使用复苏培养液5ml,离心换液,接种到100ml~150ml摇瓶,瓶内加入基础培养基10~15ml;摇瓶置于二氧化碳摇床中振荡培养,温度为37℃,70~170rpm,二氧化碳浓度2~10%。
39.2)、一级种子:一级种子扩增时使用的培养基及二氧化碳摇床参数与复苏时相同。上述复苏的细胞利用摇瓶培养逐级进行扩增,根据培养规模确定培养体积和种子细胞密度,细胞活率大于90%,将上述扩增摇瓶中的细胞悬液根据接种后密度确定部分或全部接种至二级种子进行下一步培养。
40.3)、二级种子:安装二级反应器,注入基础培养基,稳定设定为35~39℃,ph值为6.6~7.1,以二氧化碳和碳酸钠溶液调控ph,摇摆速度为20~30rpm,波浪摇动混匀,表面通气流量0.1~0.8l/min,溶氧设定为30~60%,葡萄糖每日补糖至3~5g/l。
41.接种后活细胞密度不低于0.3
×
106cell/ml,接种比例1:2~1:8,培养直至细胞密度和活率达到接种要求。根据培养规模确定培养体积和种子细胞密度,要求细胞活率大于90%,显微镜镜检无异常,按1:2~1:8比例转种下一级。
42.4)、三级种子:安装三级反应器,注入基础培养基,稳定设定为35~39℃,ph值为6.6~7.1,以二氧化碳和碳酸钠溶液调控ph,摇摆速度为15~25rpm,波浪摇动混匀,表面通气流量0.5~4l/min,溶氧设定为40%,接种后活细胞密度不低于0.3
×
106cell/ml,接种比例1:2~1:8,补充批次培养,直至细胞密度和活率达到接种要求。根据培养规模确定培养体积和种子细胞密度,细胞活率大于80%,按1:2~1:8比例转种至生产培养。
43.2、灌流培养:将经过上述细胞扩增后的细胞,转入500l细胞培养反应器中,使其初始细胞密度不低于0.3
×
106cell/ml。温度为35~39℃,根据培养工艺要求调整温度控制范围;ph至6.6~7.2,以co2和碳酸钠溶液调控ph;搅拌速度80~150rpm;表层空气,深层微泡通气包括空气、氧气、二氧化碳;溶解氧30~60%;每日补充葡萄糖3~5g/l。
44.3、补充培养:经过上述灌流培养48~72小时后,调节细胞培养反应器温度至32~34℃,调节ph至7.0~7.3,添加补充培养基、葡萄糖溶液;根据细胞密度添加补充培养基至收获,每日添加量为初始上罐体积的1%~5%,低温培养6~16天。
45.根据不同的目标蛋白质确定其生产培养周期,一般生产培养周期为8~18天,在正常的培养周期中,目标蛋白质表达和质量符合要求,即可以终止蛋白质表达的培养,进入后续处理程序。细胞培养液通过深层过滤澄清去除细胞及其碎片,再通过一级膜过滤降低生物负荷,获得含有目标蛋白质的培养上清液,将培养上清液进行纯化,获得目标蛋白质。
46.实施例3、pan-p抗体的表达以pan-p抗体为例,使用上述不同的基础培养基及补充培养基,对其进行cho细胞培养、表达,并对其培养表达所获得的pan-p抗体的糖型进行检测。
47.pan-p为专利申请号cn201410724477.4中所公开的全人源表皮生长因子受体egfr单克隆抗体,根据专利cn201410724477.4中所公开的方法获得含有pan-p基因序列的表达载体,并转入cho细胞进行培养表达。
48.大规模生产表达pan-p抗体,采用基础培养及补充培养的方法,对含有pan-p抗体基因序列的cho宿主细胞进行培养、表达。其中基础培养基为根据chom-b01:chom-b02为1:3或chom-b01:chom-b03为1:1;补充培养基为:chom-s01:chom-s03为1:0.3或chom-s01:chom-s04为1:4。
49.优选基础培养基chom-b01:chom-b02为1:3,补充培养基chom-s01:chom-s03为1:0.3。
50.细胞扩增:a)工作细胞复苏:工作细胞置于37℃水浴,融化;使用基础培养基5ml,离心换液,接种到100ml~150ml摇瓶,瓶内加入基础培养基10~15ml;摇瓶置于二氧化碳摇床中振荡培养,温度为37℃,70~170rpm,二氧化碳浓度2~10%。b)种子扩增:注入基础培养基,温度设定为35~39℃,ph值为6.6~7.1,以二氧化碳和碳酸钠溶液调控ph,摇摆速度为25~30rpm,波浪摇动混匀,表面通气流量0.1~0.8l/min,溶氧设定为30~60%,葡萄糖每日补糖至3~5g/l。接种后活细胞密度不低于0.3
×
106cell/ml,接种比例1:2~1:8,要求细胞活率大于90%,显微镜镜检无异常,按1:2~1:8比例转种下一级。
51.灌流培养:将经过上述细胞扩增后的细胞,转入500l细胞培养反应器中,使其初始细胞密度不低于0.3
×
106cell/ml。温度为35~39℃,根据培养工艺要求调整温度控制范围,
优选35.5~36.5℃;调ph至6.6~7.2,优选ph6.6~6.8,以co2和碳酸钠溶液调控ph;搅拌速度80~150rpm;表层空气,深层微泡通气包括空气、氧气、二氧化碳;溶解氧30~60%,优选30~40%;每日补充葡萄糖3~5g/l。
52.补充培养:经过上述灌流培养48~72小时后,调节细胞培养反应器温度至32~34℃,优选33℃,调节ph至7.0~7.3,优选ph7.0~7.1,添加补充培养基、葡萄糖溶液;根据细胞密度添加补充培养基至收获,每日添加量为初始上罐体积的1%~5%,低温培养8~10天。
53.培养表达8~10天后,收取细胞培养液,将细胞培养液通过深层过滤澄清去除细胞及其碎片,再通过一级膜过滤降低生物负荷,获得含有pan-p抗体的培养上清液,将培养上清液进行纯化,获得pan-p抗体,将获得的pan-p抗体进行质谱糖型检测,结果如图1所示,由检测的质谱图可以明显得知,使用上述基础培养基及补充培养基,经过上述培养方法培养后获得的pan-p抗体不含有小鼠的igg中含有的唾液酸化类型是neu5gc(ngna),也不含有α-1,3半乳糖。
54.实施例5、pd-l1单克隆抗体的表达以pd-l1单克隆抗体为例,使用上述不同的基础培养基及补充培养基,对含有pd-l1单克隆抗体基因的cho宿主细胞进行培养、表达,并对其培养表达出的pd-l1单克隆抗体的糖型进行检测。
55.pd-l1单克隆抗体为专利申请号cn201811035690.9中所公开的pd-l1单克隆抗体,根据专利cn201811035690.9中所公开的方法获得含有pd-l1单克隆抗体基因序列的表达载体,并转入cho宿主细胞进行培养表达。
56.大规模生产表达pd-l1单克隆抗体,采用基础培养及补充培养的方法,对含有pd-l1单克隆抗体基因序列的cho细胞进行培养、表达。其中基础培养基为根据chom-b01:chom-b02为1:3或chom-b01:chom-b03为1:1;补充培养基为:chom-s01:chom-s03为1:0.3或chom-s01:chom-s04为1:4。
57.优选基础培养基chom-b01:chom-b02为1:3,补充培养基chom-s01:chom-s04为1:4。
58.细胞扩增:a)工作细胞复苏:工作细胞置于37℃水浴,融化;使用基础培养基5ml,离心换液,接种到100ml~150ml摇瓶,瓶内加入基础培养基10~15ml;摇瓶置于二氧化碳摇床中振荡培养,温度为37℃,70~170rpm,二氧化碳浓度2~10%。b)种子扩增:注入基础培养基,温度设定为35~39℃,ph值为6.6~7.1,以二氧化碳和碳酸钠溶液调控ph,摇摆速度为25~30rpm,波浪摇动混匀,表面通气流量0.1~0.8l/min,溶氧设定为30~60%,葡萄糖每日补糖至3~5g/l。接种后活细胞密度不低于0.3
×
106cell/ml,接种比例1:2~1:8,要求细胞活率大于90%,显微镜镜检无异常,按1:2~1:8比例转种下一级。
59.灌流培养:将经过上述细胞扩增后的细胞,转入500l细胞培养反应器中,使其初始细胞密度不低于0.3
×
106cell/ml。温度为35~39℃,根据培养工艺要求调整温度控制范围,优选35.5~36.5℃;ph值6.6~7.2,优选ph值6.8~6.9,以co2和碳酸钠溶液调控ph;搅拌速度80~150rpm;表层空气,深层微泡通气包括空气、氧气、二氧化碳;溶解氧30~60%,优选35~45%;每日补充葡萄糖3~5g/l。
60.补充培养:经过上述灌流培养48~72小时后,调节细胞培养反应器温度至32~34℃,优选32.5~33.5℃,调节ph至7.0~7.3,优选ph至7.1~7.2,添加补充培养基、葡萄糖溶
液;根据细胞密度添加补充培养基至收获,每日添加量为初始上罐体积的1%~5%,低温培养8~10天。
61.培养表达8~10天后,收取细胞培养液,将细胞培养液通过深层过滤澄清去除细胞及其碎片,再通过一级膜过滤降低生物负荷,获得含有pd-l1单克隆抗体的培养上清液,将培养上清液进行纯化,获得pd-l1单克隆抗体,将获得的pd-l1单克隆抗体进行质谱糖型检测,结果如图2所示,由检测的质谱图可以明显得知,使用上述基础培养基及补充培养基,经过上述培养方法培养后获得的pd-l1单克隆抗体不含有小鼠的igg中含有的唾液酸化类型是neu5gc(ngna),也不含有α-1,3半乳糖。
62.实施例6、pd-1单克隆抗体的表达以pd-1单克隆抗体为例,使用上述不同的基础培养基及补充培养基,对其进行cho细胞培养、表达,并对其培养表达出的pd-1单克隆抗体的糖型进行检测。
63.pd-1单克隆抗体为专利申请号cn201680069571.8中所公开的pd-1单克隆抗体,根据专利cn201980069571.8中所公开的方法获得含有pd-1单克隆抗体基因序列的表达载体,并转入cho宿主细胞进行培养表达。
64.大规模生产表达pd-1单克隆抗体,采用基础培养及补充培养的方法,对含有pd-1单克隆抗体基因序列的cho细胞进行培养、表达。其中基础培养基为根据chom-b01:chom-b02为1:3或chom-b01:chom-b03为1:1;补充培养基为:chom-s01:chom-s03为1:0.3或chom-s01:chom-s04为1:4。
65.优选基础培养基chom-b01:chom-b03为1:1,补充培养基chom-s01:chom-s04为1:4。
66.细胞扩增:a)工作细胞复苏:工作细胞置于37℃水浴,融化;使用基础培养基5ml,离心换液,接种到100ml~150ml摇瓶,瓶内加入基础培养基10~15ml;摇瓶置于二氧化碳摇床中振荡培养,温度为37℃,70~170rpm,二氧化碳浓度2~10%。b)种子扩增:注入基础培养基,温度设定为35~39℃,ph值为6.6~7.1,以二氧化碳和碳酸钠溶液调控ph,摇摆速度为25~30rpm,波浪摇动混匀,表面通气流量0.1~0.8l/min,溶氧设定为30~60%,葡萄糖每日补糖至3~5g/l。接种后活细胞密度不低于0.3
×
106cell/ml,接种比例1:2~1:8,要求细胞活率大于90%,显微镜镜检无异常,按1:2~1:8比例转种下一级。
67.灌流培养:将经过上述细胞扩增后的细胞,转入500l细胞培养反应器中,使其初始细胞密度不低于0.3
×
106cell/ml。温度为35~39℃,根据培养工艺要求调整温度控制范围,优选温度为36.5~37.5℃;ph值6.6~7.2,优选ph值6.9~7.0,以co2和碳酸钠溶液调控ph;搅拌速度80~150rpm;表层空气,深层微泡通气包括空气、氧气、二氧化碳;溶解氧30~60%,优选40~50%;每日补充葡萄糖3~5g/l。
68.补充培养:经过上述灌流培养48~72小时后,调节细胞培养反应器温度至32~34℃,优选温度33℃;调节ph至7.0~7.3,优选ph至7.0~7.1;添加补充培养基、葡萄糖溶液;根据细胞密度添加补充培养基至收获,每日添加量为初始上罐体积的1%~5%,低温培养10~12天。
69.培养表达10~12天后,收取细胞培养液,将细胞培养液通过深层过滤澄清去除细胞及其碎片,再通过一级膜过滤降低生物负荷,获得含有pd-1单克隆抗体的培养上清液,将培养上清液进行纯化,获得pd-1单克隆抗体,将获得的pd-1单克隆抗体进行质谱糖型检测,结
果如图3所示,由检测的质谱图可以明显得知,使用上述基础培养基及补充培养基,经过上述培养方法培养后获得的pd-1单克隆抗体不含有小鼠的igg中含有的唾液酸化类型是neu5gc(ngna),也不含有α-1,3半乳糖。
70.实施例7、pd-l1/cd47双功能融合蛋白的表达以pd-l1/cd47双功能融合蛋白为例,使用上述不同的基础培养基及补充培养基,对其进行cho细胞培养、表达,并对其培养表达出的pd-l1/cd47双功能融合蛋白的糖型进行检测。
71.pd-l1/cd47双功能融合蛋白为专利申请号cn201610372954.4中所公开的pd-l1/cd47双功能融合蛋白,根据专利cn201610372954.4中所公开的方法获得含有pd-l1/cd47双功能融合蛋白基因序列的表达载体,并转入cho宿主细胞进行培养表达。
72.大规模生产表达pd-l1/cd47双功能融合蛋白,采用基础培养及补充培养的方法,对含有pd-l1/cd47双功能融合蛋白基因序列的cho细胞进行培养、表达。其中基础培养基为根据chom-b01:chom-b02为1:3或chom-b01:chom-b03为1:0.5;补充培养基为:chom-s01:chom-s03为1:0.3或chom-s01:chom-s04为1:4。
73.优选基础培养基chom-b01:chom-b03为1:0.5,补充培养基chom-s01:chom-s04为1:4。
74.细胞扩增:a)工作细胞复苏:工作细胞置于37℃水浴,融化;使用基础培养基5ml,离心换液,接种到100ml~150ml摇瓶,瓶内加入基础培养基10~15ml;摇瓶置于二氧化碳摇床中振荡培养,温度为37℃,70~170rpm,二氧化碳浓度2~10%。b)种子扩增:注入基础培养基,温度设定为35~39℃,ph值为6.6~7.1,以二氧化碳和碳酸钠溶液调控ph,摇摆速度为25~30rpm,波浪摇动混匀,表面通气流量0.1~0.8l/min,溶氧设定为30~60%,葡萄糖每日补糖至3~5g/l。接种后活细胞密度不低于0.3
×
106cell/ml,接种比例1:2~1:8,要求细胞活率大于90%,显微镜镜检无异常,按1:2~1:8比例转种下一级。
75.灌流培养:将经过上述细胞扩增后的细胞,转入500l细胞培养反应器中,使其初始细胞密度不低于0.3
×
106cell/ml。温度为35~39℃,根据培养工艺要求调整温度控制范围,优选温度为36~37℃;ph值6.6~7.2,优选ph值为6.9~7.0,以co2和碳酸钠溶液调控ph;搅拌速度80~150rpm;表层空气,深层微泡通气包括空气、氧气、二氧化碳;溶解氧30~60%,优选45~55%;每日补充葡萄糖3~5g/l。
76.补充培养:经过上述灌流培养48~72小时后,调节细胞培养反应器温度至32~34℃,优选温度为32.5℃~33.5℃;调节ph至7.0~7.3,优选ph至7.0~7.1;添加补充培养基、葡萄糖溶液;根据细胞密度添加补充培养基至收获,每日添加量为初始上罐体积的1%~5%,低温培养8~10天。
77.培养表达8~10天后,收取细胞培养液,将细胞培养液通过深层过滤澄清去除细胞及其碎片,再通过一级膜过滤降低生物负荷,获得含有pd-l1/cd47双功能融合蛋白的培养上清液,将培养上清液进行纯化,获得pd-l1/cd47双功能融合蛋白,将获得的pd-l1/cd47双功能融合蛋白进行质谱糖型检测,结果如图4所示,由检测的质谱图可以明显得知,使用上述基础培养基及补充培养基,经过上述培养方法培养后获得的pd-l1/cd47双功能融合蛋白不含有小鼠的igg中含有的唾液酸化类型是neu5gc(ngna),也不含有α-1,3半乳糖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1