一种基于黑猩猩ChAd63型腺病毒的表达载体及其构建方法与流程
一种基于黑猩猩chad63型腺病毒的表达载体及其构建方法
技术领域
1.本发明属于生物技术和病毒学领域;更具体而言,本发明涉及一种基于黑猩猩chad63型腺病毒的表达载体及其构建方法。
背景技术:
2.腺病毒隶属于腺病毒科,系中等大小(直径70-90nm)的非包膜双链dna病毒。上世纪五十年代,腺病毒在人腺体中首次被分离出来(rowe et al. 1953)。此后的四十年间,腺病毒载体被广泛应用于基因治疗、溶瘤病毒和疫苗研发中(chen et al. 2016)。截至2019年,全球共获批上市了四个腺病毒相关的产品,包括一个针对腺病毒4型和7型感染的减毒口服疫苗(adenovirus type 4 and type 7 vaccine, live, oral,美国),重组人5型腺病毒注射液(安柯瑞)、重组人p53腺病毒注射液(今又生)和重组埃博拉病毒腺病毒载体疫苗(pearson et al. 2004, wu et al. 2017)。此外,全球共有超过200个腺病毒载体相关的临床试验在进行。基于腺病毒的医药产品在基因治疗、肿瘤治疗和疫苗研发领域已经发挥了越来越重要的作用,开发基于腺病毒载体的产品具有重要的意义。
3.腺病毒的基因组约30-40kb大小,编码30-40个基因,分为早期基因和晚期基因。目前已分离和鉴定超过一百种腺病毒血清型 (alonso-padilla et al. 2016)。基于腺病毒开发的病毒载体具有以下优点:1)由于腺病毒感染细胞之后,其基因组可以进入细胞核,因此腺病毒载体的外源抗原可以通过内源蛋白加工途径刺激较强的cd8+ t细胞反应和抗体反应;2)改造后的复制缺陷型腺病毒具有很好的安全性;3)腺病毒基因组不整合到宿主基因组中;4)腺病毒对多种类型的细胞具有侵染性;4)腺病毒载体可以装载最大8kb的外源基因;5)腺病毒载体在体内表达外源基因的时效性更长;6)腺病毒的扩增纯化工艺成熟,可以获得较高滴度的病毒颗粒(vannucci et al. 2013)。
4.临床试验中使用最多的腺病毒载体类型为人腺病毒5型(huad5),包括在中国获批上市的三个腺病毒相关产品,也均以huad5型作为载体。但40-60%的人由于曾被huad5自然感染,体内已存在针对病毒载体的中和性抗体,而预存的抗体将极大抑制外源基因的表达效率和增加载体介导的细胞毒性(xiang et al. 2002, peruzzi et al. 2009)。目前普遍采用改造稀有人腺病毒血清型(26、35等)或使用非人灵长类来源的腺病毒血清型作为疫苗载体以克服人群中预存免疫对疫苗产品效果的影响。例如,由于人体中不含有针对黑猩猩腺病毒的中和抗体,基于黑猩猩腺病毒作为表达载体开发产品,其效果将可能显著优于人血清型腺病毒载体。而且,越来越多的基于黑猩猩腺病毒载体所开发的产品在临床上也显示出极好的安全性。
5.目前构建重组腺病毒载体的方法有两种:同源重组法和直接克隆法。同源重组法通常至少需要两个质粒,一个穿梭质粒携带目的基因,另一个骨架质粒包含病毒组装所需要的基因组序列。将两种质粒在真核细胞或大肠杆菌中通过反向重复序列或特定的重组酶系统完成同源重组获得重组病毒或重组腺病毒载体,如admax体系或adeasy体系。该方法的缺点是重组效率低,容易受到亲代病毒污染,步骤比较繁琐。目前虽然可较便捷使用基于人
huad5型的商用载体系统,但一方面由于专利限制无法进行很多产品开发,且由于很多新型腺病毒还未建立商业的骨架载体,十分耗时耗力(miravet et al. 2014)。直接克隆法是通过分子克隆手段将野生型腺病毒基因组改造并克隆至质粒载体上,再通过线性化转染至细胞系以拯救出病毒。该方法的缺点是由于腺病毒基因组较大(约36kb),分子克隆存在相当大的难度(zhou et al. 2010, yang et al. 2016)。而且,由于野生型腺病毒的获取通常具备相当大的难度(如,无法购买、分离困难等),也极大限制了该方法的使用。
6.相反,本发明所阐述的方法很好地解决了目前构建重组腺病毒载体所面临的以上问题。所述方法具有更加简单、精确、质量可控、成本可控、时间更短、序列无突变风险、无需先获得野生型菌株从而更具普遍适用性等优点。
技术实现要素:
7.本发明的目的在于提供一种基于黑猩猩chad63型腺病毒的表达载体及其构建方法。
8.在本发明的第一方面,提供一种构建基于黑猩猩chad63型腺病毒的表达载体的方法,所述方法包括将野生型黑猩猩chad63型腺病毒全基因组序列(genbank,# ms912777.1),即seq id no: 1所示序列中的e1、e3和e4区功能性删除。
9.在一个具体实施方案中,将e1区中对应于seq id no: 1所示序列576-3128位的核苷酸,即seq id no: 3所示序列删除;将e3区中对应于seq id no: 1所示序列27917-31786位的核苷酸,即seq id no: 4所示序列删除;和将e4区中对应于seq id no: 1所示序列33825-36215位的核苷酸,即seq id no: 5所示序列删除并替换为seq id no: 2所示的黑猩猩腺病毒chad68型全基因组序列的e4 orf6表达框序列。优选地,所述e4 orf6表达框序列为seq id no: 8所示序列。
10.在进一步的实施方案中,将含有酶切位点的序列插入被删除的e1区中。优选地,所述含有酶切位点的序列为包含一个或多个选自asisi、i-ceui、mlui、ecori、pi-scei的酶切位点的序列。更优选地,所述含有酶切位点的序列为seq id no: 6所示序列。
11.备选或另外地,将含有酶切位点的序列插入被删除的e3区中。优选地,所述含有酶切位点的序列为包含hpai和/或paci的酶切位点的序列。更优选地,所述含有酶切位点的序列为seq id no: 7所示序列。
12.在进一步的实施方案中,将外源基因插入被删除的e1、e3和e4区的一个或多个区中。优选地,所述外源基因为egfp或mcherry。优选地,将egfp插入被删除的e1区中;或者将egfp和mcherry分别插入被删除的e1和e3区中。
13.在进一步的实施方案中,所述方法还包括加入线性化酶切位点,并插入至原核复制质粒。优选地,所述线性化酶切位点为swai酶切位点。优选地,所述原核复制质粒的序列如seq id no: 9所示。
14.在本发明的第二方面,提供一种基于黑猩猩chad63型腺病毒的表达载体,其根据前述实施方案中任一个所述的方法构建。
15.在一个实施方案中,所述表达载体包含修饰的seq id no: 1所示序列,其中e1、e3和e4区被功能性删除。
16.在一个具体实施方案中,e1区中对应于seq id no: 1所示序列576-3128位的核苷
酸,即seq id no: 3所示序列被删除;e3区中对应于seq id no: 1所示序列27917-31786位的核苷酸,即seq id no: 4所示序列被删除;和e4区中对应于seq id no: 1所示序列33825-36215位的核苷酸,即seq id no: 5所示序列被删除并替换为seq id no: 2所示的黑猩猩腺病毒chad68型全基因组序列的e4 orf6表达框序列。优选地,所述e4 orf6表达框序列为seq id no: 8所示序列。
17.在进一步的实施方案中,所述表达载体还包含含有酶切位点的序列。
18.在一个具体实施方案中,将含有酶切位点的序列插入被删除的e1区中。优选地,所述含有酶切位点的序列为包含一个或多个选自asisi、i-ceui、mlui、ecori、pi-scei的酶切位点的序列。更优选地,所述含有酶切位点的序列为seq id no: 6所示序列。
19.备选或另外地,将含有酶切位点的序列插入被删除的e3区中。优选地,所述含有酶切位点的序列为包含hpai和/或paci的酶切位点的序列。更优选地,所述含有酶切位点的序列为seq id no: 7所示序列。
20.在进一步的实施方案中,所述载体还包含线性化酶切位点和原核复制质粒。优选地,所述线性化酶切位点为swai酶切位点。优选地,所述原核复制质粒的序列如seq id no: 9所示。
21.在一个实施方案中,所述表达载体包含seq id no: 12所示序列。在另一个实施方案中,所述表达载体的序列如seq id no: 12所示。
22.在进一步的实施方案中,所述表达载体还可包含外源基因。
23.在一个实施方案中,可将外源基因插入被删除的e1、e3和e4区的一个或多个区中。所述外源基因可为任何基因,并且可以相同或不同。优选地,所述外源基因为egfp或mcherry。优选地,将egfp插入被删除的e1区中;或者将egfp和mcherry分别插入被删除的e1和e3区中。优选地,含有外源基因的表达载体的序列如seq id no: 13或seq id no: 14所示。
24.在本发明的第三方面,提供一种宿主细胞,其包含前述实施方案中任一个所述的表达载体。
25.在一个实施方案中,所述宿主细胞为真核细胞。优选地,所述真核细胞为hek293细胞。
26.本发明的第四方面,提供一种使用宿主细胞包装和扩增重组腺病毒的方法。任选地,对收获的病毒原液进行纯化。在一个实施方案中,所述宿主细胞为真核细胞。优选地,所述真核细胞为hek293细胞。
27.由于本文的公开内容,本发明的其他方面对本领域的技术人员而言是显而易见的。
附图说明
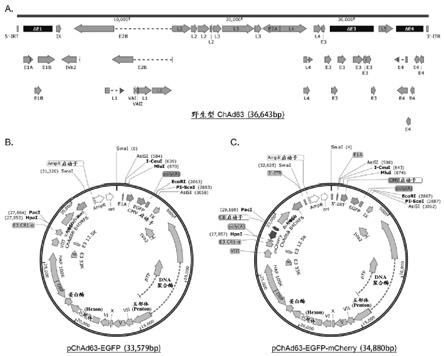
28.图1:野生型chad63腺病毒基因组图谱和搭载报告基因的重组黑猩猩腺病毒载体质粒图谱。a. 野生型腺病毒chad63基因组图谱。δe1,δe3,δe4分别表示基因组中三个删除的区域。b. 搭载单个报告基因egfp的重组黑猩猩腺病毒载体质粒pchad63-egfp序列图谱。c. 同时搭载两个报告基因egfp和mcherry的重组黑猩猩腺病毒载体质粒pchad63-egfp-mcherry序列图谱。
29.图2:酶切图谱验证搭载报告基因的重组黑猩猩腺病毒载体质粒全序列。
30.图3:搭载报告基因的重组黑猩猩腺病毒感染hek293细胞后出现的典型细胞病变现象。
31.图4:搭载报告基因的重组黑猩猩腺病毒感染hek293细胞后插入的荧光报告基因的表达检测。
32.图5:酶切图谱验证纯化的重组腺病毒chad63-egfp全基因组序列。
33.序列说明seq id no: 1:野生型黑猩猩chad63型腺病毒全序列(wt-chad63);seq id no: 2:野生型黑猩猩腺病毒chad68型全序列;seq id no: 3:被删除的e1区序列;seq id no: 4:被删除的e3区序列;seq id no: 5:被删除的e4区序列;seq id no: 6:被删除的e1区所插入的含有酶切位点的序列;seq id no: 7:被删除的e3区所插入的含有酶切位点的序列;seq id no: 8:被删除的e4区所插入的chad68 e4 orf6序列;seq id no: 9:改造的原核复制质粒空载体序列;seq id no: 10:被删除的e1区的酶切位点mlui和ecori之间插入的含有egfp的外源报告基因编码表达阅读框序列;seq id no: 11:被删除的e3区的酶切位点hpai和paci之间插入的含有mcherry的外源报告基因编码表达阅读框序列;seq id no: 12:重组黑猩猩chad63型腺病毒空载体质粒序列;seq id no: 13:重组表达egfp的黑猩猩chad63型腺病毒载体质粒序列(pchad63-egfp);seq id no: 14:重组表达egfp和mcherry的黑猩猩chad63型腺病毒载体质粒序列(pchad63-egfp-mcherry)。
具体实施方式
34.本发明人经过一系列深入的研究,设计了一种简洁有效的策略,成功地基于现有已发表的黑猩猩chad63型腺病毒野生型序列构建成了一种新型表达载体。所述的腺病毒表达载体可应用于制备预防性疫苗、治疗性疫苗、溶瘤病毒或基因治疗等产品。
35.本发明不仅解决了无法获得野生型病毒毒株的问题,设计方案也更加简单直接,可拥有完整的质量控制,且极大地避免了克隆构建过程中的序列突变,获得的携带报告基因的病毒载体质粒亦能在最短时间验证病毒的包装和外源基因的表达以验证载体构建的成功与否。
36.在本发明的第一方面,提供一种构建基于黑猩猩chad63型腺病毒的表达载体的方法,所述方法包括将野生型黑猩猩chad63型腺病毒全基因组序列(genbank,# ms912777.1),即seq id no: 1所示序列中的e1、e3和e4区功能性删除。
37.所述术语“功能性删除”是指具有使特定基因产物无功能的效果的修饰,从而产生复制缺陷型重组黑猩猩chad63型腺病毒表达载体。更具体地,优选删除大部分e1区、大部分
e3区并替换大部分e4区。
38.在一个具体实施方案中,将e1区中对应于seq id no: 1所示序列576-3128位的核苷酸,即seq id no: 3所示序列删除;将e3区中对应于seq id no: 1所示序列27917-31786位的核苷酸,即seq id no: 4所示序列删除;和将e4区中对应于seq id no: 1所示序列33825-36215位的核苷酸,即seq id no: 5所示序列删除并替换为seq id no: 2所示的黑猩猩腺病毒chad68型全基因组序列的e4 orf6表达框序列。优选地,所述e4 orf6表达框序列为seq id no: 8所示序列。
39.针对黑猩猩chad63型腺病毒野生型全序列,本发明人经过仔细研究公开发表的文献资料,为了使所改造的复制缺陷型重组黑猩猩chad63型腺病毒表达载体获得更大的插入片段的长度空间,也删除了大部分e4区,只保留了病毒复制所必须的orf6阅读表达框,且该编码框被替换成黑猩猩chad68型腺病毒e4 orf6表达框序列,有利于获得复制能力更强的载体腺病毒。
40.在进一步的实施方案中,将含有酶切位点的序列插入被删除的e1区中。优选地,所述含有酶切位点的序列为包含一个或多个选自asisi、i-ceui、mlui、ecori、pi-scei的酶切位点的序列。更优选地,所述含有酶切位点的序列为seq id no: 6所示序列。
41.备选或另外地,将含有酶切位点的序列插入被删除的e3区中。优选地,所述含有酶切位点的序列为包含hpai和/或paci的酶切位点的序列。更优选地,所述含有酶切位点的序列为seq id no: 7所示序列。
42.针对黑猩猩chad63型腺病毒野生型全序列,本发明人经过仔细的序列比对,最终确定了应用酶切位点asisi、i-ceui、mlui、ecori、pi-scei作为e1删除区外源基因的插入位点,不仅不会导致在腺病毒表达载体的其他位置造成错误剪切,多种位点选择也有利于后续更方便的选择。同时,hpai和paci作为e3删除区外源基因的插入位点,同样不会造成错误剪切,也为e3区外源基因的插入提供了简便的插入位点。
43.在进一步的实施方案中,将外源基因插入被删除的e1、e3和e4区的一个或多个区中。所述外源基因可为任何基因,并且可以相同或不同。优选地,所述外源基因为egfp或mcherry。优选地,将egfp插入被删除的e1区中;或者将egfp和mcherry分别插入被删除的e1和e3区中。
44.在进一步的实施方案中,所述方法还包括加入线性化酶切位点,并插入至原核复制质粒。优选地,所述线性化酶切位点为swai酶切位点,识别序列为:atttaaat。该位点不仅不会造成序列的错误剪切,且剪切后是平末端,可更有利于腺病毒全序列线性化后的稳定性。
45.优选地,所述原核复制质粒的序列如seq id no: 9所示。更具体而言,所述原核复制质粒由pcdna3.1质粒改造而来,包含基本的复制起始位点和氨苄抗性筛选基因以及单酶切位点swai,以方便腺病毒载体序列插入,如seq id no: 9所示序列。本发明人经过细致的序列比对,删除了pcdna3.1序列的绝大部分,如大量的酶切位点序列,以免造成内切酶的错误剪切。只保留了质粒最核心的复制起始位点序列和抗性筛选基因表达框序列,以用于后续质粒的扩增和筛选。
46.在一个具体实施方案中,所述方法包括将含有特定酶切位点的序列插入被删除的e1区(例如asisi、i-ceui、mlui、ecori、pi-scei)、e3区(例如hpai和paci);将被删除的e4区
替换为黑猩猩腺病毒chad68型(又名paniscus adenovirus 6或simian adenovirus 25,genbank,#ac_000011.1)(seq id no: 2)e4 orf6表达框序列,优选seq id no: 8所示序列;最后,在全序列的首尾加入线性化酶切位点(例如swai),并以此位点为界,插入至原核复制质粒上,以获得复制缺陷型重组黑猩猩chad63型腺病毒表达载体,其序列如seq id no: 12所示。所获得的全序列委托专业的基因合成公司进行序列全合成,最终获得涵盖精确序列信息和足量的转染级别纯化的质粒。
47.在本发明的第二方面,提供一种基于黑猩猩chad63型腺病毒的表达载体,其根据前述实施方案中任一个所述的方法构建。
48.在一个实施方案中,所述表达载体包含修饰的seq id no: 1所示序列,其中e1、e3和e4区被功能性删除。
49.在一个具体实施方案中,e1区中对应于seq id no: 1所示序列576-3128位的核苷酸,即seq id no: 3所示序列被删除;e3区中对应于seq id no: 1所示序列27917-31786位的核苷酸,即seq id no: 4所示序列被删除;和e4区中对应于seq id no: 1所示序列33825-36215位的核苷酸,即seq id no: 5所示序列被删除并替换为seq id no: 2所示的黑猩猩腺病毒chad68型全基因组序列的e4 orf6表达框序列。优选地,所述e4 orf6表达框序列为seq id no: 8所示序列。
50.在进一步的实施方案中,所述表达载体还包含含有酶切位点的序列。
51.在一个具体实施方案中,将含有酶切位点的序列插入被删除的e1区中。优选地,所述含有酶切位点的序列为包含一个或多个选自asisi、i-ceui、mlui、ecori、pi-sceii的酶切位点的序列。更优选地,所述含有酶切位点的序列为seq id no: 6所示序列。
52.备选或另外地,将含有酶切位点的序列插入被删除的e3区中。优选地,所述含有酶切位点的序列为包含hpai和/或paci的酶切位点的序列。更优选地,所述含有酶切位点的序列为seq id no: 7所示序列。
53.在进一步的实施方案中,所述载体还包含线性化酶切位点和原核复制质粒。优选地,所述线性化酶切位点为swai酶切位点。优选地,所述原核复制质粒的序列如seq id no: 9所示。
54.在一个实施方案中,所述表达载体包含seq id no: 12所示序列。在另一个实施方案中,所述表达载体的序列如seq id no: 12所示。
55.在进一步的实施方案中,所述表达载体还可包含一种或多种外源基因。
56.在一个实施方案中,可将外源基因插入被删除的e1、e3和e4区的一个或多个区中。所述外源基因可为任何基因,并且可以相同或不同。优选地,所述外源基因为egfp或mcherry。优选地,将egfp插入被删除的e1区中;或者将egfp和mcherry分别插入被删除的e1和e3区中。
57.在一个具体实施方案中,在被删除的e1区的插入位点mlui和ecori之间再插入含有egfp的外源报告基因编码表达阅读框,获得可表达一种外源基因的重组腺病毒载体,其序列如seq id no: 13所示。
58.优选地,所述含有egfp的外源报告基因编码表达阅读框是指cmv启动子起始的egfp表达框序列,如seq id no: 10所示。
59.另外优选地,将所述的序列在序列分析软件中全部构建完整后,直接通过全基因
组合成方式获得该可表达一种外源基因的重组腺病毒载体质粒pchad63-egfp。
60.在另一个具体实施方案中,在被删除的e1区的插入位点mlui和ecori之间再插入含有egfp的外源报告基因编码表达阅读框,同时在被删除的e3区插入的位点hpai和paci之间再插入含有mcherry的外源报告基因编码表达阅读框,获得可同时表达两种外源基因的重组腺病毒载体,其序列如seq id no: 14所示。
61.优选地,所述含有egfp的外源报告基因编码表达阅读框是指cmv启动子起始的egfp表达框序列,如seq id no: 10所示。
62.优选地,所述含有mcherry的外源报告基因编码表达阅读框是指cb启动子起始的egfp表达框序列,如seq id no: 11所示。
63.另外优选地,将所述的序列在序列分析软件中全部构建完整后,直接通过全基因组合成方式获得该可表达两种外源基因的重组腺病毒载体质粒pchad63-egfp-mcherry。
64.具体而言,为了验证所构建的腺病毒表达载体表达一种或两种外源基因的有效性,本发明人将荧光报告基因egfp插入被删除的e1区;以及将egfp和mcherry分别插入被删除的e1区和e3区。结果显示,所构建的携带报告基因的黑猩猩chad63型腺病毒能高效表达外源基因,证明本发明人成功获得了一种新型腺病毒表达载体,可用于生物产品的研发或生物医学基础研究。
65.在本发明的第三方面,提供一种宿主细胞,其包含前述实施方案中任一个所述的表达载体。
66.在一个实施方案中,所述宿主细胞为真核细胞。优选地,所述真核细胞为hek293细胞。
67.本发明的第四方面,提供一种使用宿主细胞包装和扩增重组腺病毒的方法。优选地,所收获的病毒可反复感染生产细胞,持续传代。任选地,可对收获的病毒原液进行纯化。病毒滴度的测定可根据本领域已知的常规方法进行。
68.本发明的腺病毒表达载体作为可表达外源基因的载体平台,适用于表达一种、两种,甚至多种外源基因,从而应用于制备预防性疫苗、治疗性疫苗、溶瘤病毒或基因治疗等产品。
69.本发明所述的方法,具有以下的突出优点:a. 本发明通过软件序列分析获得全序列后,通过腺病毒载体质粒全序列直接基因合成的方法,成功避开了传统通过同源重组方法构建腺病毒载体,极大程度降低了腺病毒载体序列发生突变的可能性。
70.b. 本发明方法相比于通过野生型腺病毒序列直接克隆的方法,操作更加简单、直接,没有直接克隆法的缺点。直接克隆法常常由于腺病毒基因组序列较大(约36kb),分子克隆实验失败率较高。且分子克隆通常依赖特定的酶切位点和pcr扩增序列进行拼接,存在酶切位点不好找;多次和长片段pcr扩增增加了序列的突变可能;对于高gc含量序列分子克隆失败率更高。
71.c. 本发明方法由于采用了更价工业化、标准化的基因合成,可以确保100%的序列精准度、纯化质粒的质量控制、质粒制备的成本控制和载体构建的时间控制。对于普通实验室操作人员来说,仅需掌握简单的序列分析比对即可。
72.d. 本发明方法不依赖野生型腺病毒毒株的获得,仅需采用已发表的野生型腺病
mcherry酶切产物,每天观察细胞的细胞病变(见图3)和荧光报告基因表达(见图4)。约4-6天后观察到明显的荧光表达和细胞病变,证明病毒包装成功。收获此转染后细胞产物,反复冻融三次后离心取上清,即可视为初始病毒原液。
80.2.4 携带报告基因的黑猩猩chad63型腺病毒扩增hek293细胞在含有10%胎牛血清的dmem培养基中培养至接近100%的细胞密度,将初始病毒原液加入细胞培养基中,继续培养细胞。当细胞出现细胞病变,导致几乎全部细胞由贴壁变为漂浮状态,即可收集全部被感染的细胞,离心收集细胞。用适量dmem重悬细胞,反复冻融三次使细胞裂解,离心取上清。此上清可进一步按照上述方法反复扩增,使病毒原液达到一定的量。
81.2.5 携带报告基因的黑猩猩chad63型腺病毒纯化将扩增后的病毒原液按照已发表文献(zhou et al. 2010)所述的氯化铯密度梯度离心法进行纯化和滴度测定,然后加入甘油置于-80℃冰箱长期保存。
82.2.6 携带报告基因的黑猩猩chad63型腺病毒基因组序列鉴定取滴度为0.5-1x10
12
个病毒颗粒(vps)的纯化病毒溶液,使用试剂盒dneasy blood & tissue kit (qiagen,#69504)进行病毒基因组提取。对于提取后的病毒基因组同样使用限制性内切酶进行标准化酶切消化后进行dna分析鉴定,包括hindiii & xbai双酶切、xhoi单酶切、noti & xbai双酶切、ndei & xbai双酶切和pvui单酶切。通过实际的酶切图谱和按照预期序列进行软件预测的酶切图谱对比,以验证序列的正确性。结果显示,所获得的两个质粒序列均完全符合预期,见图5。
83.3. 结论通过以上腺病毒基因组直接基因合成的方法,本发明人将野生型黑猩猩chad63型腺病毒构建成了能表达外源基因的载体。因此,本发明人为新型的腺病毒载体相关产品的研发及其生物医学基础研究提供了一种黑猩猩chad63型腺病毒载体,同时提供了一种新型的从头构建腺病毒载体的方法。
84.在本发明提及的所有参考文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解的是,在阅读了本申请之后,本领域的技术人员可以对本发明做出各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
85.参考文献1.rowe wp, huebner rj, gilmore lk, et al., isolation of a cytopathogenic agent from human adenoids undergoing spontaneous degeneration in tissue culture. proceedings of the society for experimental biology and medicine, 1953, 84(3): p570-573.2.chen w, molijn a, enqi w, et al., the variable clinicopathological categories and role of human papillomavirus in cervical adenocarcinoma: a hospital based nation-wide multi-center retrospective study across china. international journal of cancer, 2016, 139(12): p2687-2697.3.pearson s, jia h and kandachi k, china approves first gene therapy. nature biotechnology, 2004, 22(1): p3-4.
4.wu l, zhang z, gao h, et al., open-label phase i clinical trial of ad5-ebov in africans in china. human vaccines & immunotherapeutics, 2017, 13(9): p2078-2085.5.alonso-padilla j, papp t, kaj
á
n gl, et al., development of novel adenoviral vectors to overcome challenges observed with hadv-5
–
based constructs. molecular therapy, 2016, 24(1): p6-16.6.vannucci l, lai m, chiuppesi f, et al., viral vectors: a look back and ahead on gene transfer technology. new microbiologica, 2013, 36(1): p1-22.7.xiang z, gao g, reyes-sandoval a, et al., novel, chimpanzee serotype 68-based adenoviral vaccine carrier for induction of antibodies to a transgene product. journal of virology, 2002, 76(6): p2667-2675.8.peruzzi d, dharmapuri s, cirillo a, et al., a novel chimpanzee serotype-based adenoviral vector as delivery tool for cancer vaccines. vaccine, 2009, 27(9): p1293-1300.9.miravet s, ontiveros m, piedra j, et al., construction, production, and purification of recombinant adenovirus vectors. methods in molecular biology, 2014, 1089: p159-173.10.zhou d, zhou x, bian a, et al., an efficient method of directly cloning chimpanzee adenovirus as a vaccine vector. nature protocols, 2010, 5(11): p1775-1785.11.yong y, yudan c, xinying t, et al., rapid, efficient, and modular generation of adenoviral vectors via isothermal assembly. current protocols in molecular biology, 2016, 113(1): p16.26.1-16.26.18。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1