一种切伦科夫荧光成像探针及其制备方法与应用与流程
本发明属于领域,具体涉及一种切伦科夫荧光成像探针及其制备方法与应用。
背景技术:
分子成像方法已被广泛用于研究体内的发生的各种生物事件,因为分子成像方法使研究人员能够在分子水平上非侵入性地研究活体中的疾病发生、发展和转归。目前已经开发出了多种分子成像方式以了解在活的小动物和患者中疾病的功能和解剖信息。分子成像方法包括核医学成像(例如pet和spect)、光学成像(生物发光和荧光)、磁共振成像、超声和计算机断层扫描。其中,光学成像方法的优点是灵敏度高,成本低,易于使用,相对较高的通量和较短的采集时间。光学成像仪器和分子探针的最新进展使其成为小型动物研究的极佳工具,其中,切伦科夫发光成像(cerenkovluminescenceimaging,cli)一种新兴的光学成像(opticalimaging,oi),作为一种新的临床前成像工具来研究体内的许多病理情况。它基于对高能带电粒子(例如电子或正电子)在介质内高速运动,运动速度快于介电介质中的光速时,粒子可以使周围的分子极化,随后发出的一种以短波长为主的电磁辐射,其特征是蓝色辉光,这就是所谓的切伦科夫辐射(cerenkovradiation,cr)。cr由帕维尔·阿列克谢耶维奇·切连科夫于1932年发现,如果在生物组织传播的粒子的能量大于约220kev这一阈值,则会发生这种现象。cr光谱由紫外光、可见光和近红外范围内的连续波长组成,强度分布与波长的平方成反比。可以通过各种光敏检测器来检测发出的光子,例如光电倍增管,高灵敏度电荷耦合器件(ccd)等。由于微弱的发射,生物组织中的检测非常具有挑战性。伯奇在1971年进行了非常初步的尝试,他用光电倍增管在用32p治疗的人眼肿瘤中检测到cr,但此方法随后未采用,也没有进行成像。现在开发了cli的不同应用程序,并进行了许多努力以增加该技术的潜力。
尽管具有这些优点,但由于组织穿透能力差以及美国食品药品管理局批准的光学成像探针数量有限,因此cli成像在临床应用方面存在局限性。另一方面,核成像方式具有高灵敏度,良好的组织穿透性,出色的定量性和易于转化为临床应用的优势。虽然在过去的几十年中,核成像方式和放射性碘(radioiodine,ri)已广泛用于临床甲状腺病学和肿瘤研究。但是,核成像方式也有一些缺点,例如空间和时间分辨率低,以及购买和维护仪器的成本高。因此,它对基础研究人员的可及性受到限制。所以,我们针对cli成像这一新兴成像方法,进行了一些有益的发明研究。
crc是全世界最常见的癌症之一,占所有恶性肿瘤的10%。结直肠癌的早期诊断、精准治疗以及及时的预后评估是影响癌症治疗效果及患者结局的重要因素。而传统的癌症治疗和靶向治疗的患者通常会出现耐药性。癌症免疫疗法很可能成为癌症临床治疗的关键。免疫检查点阻断(immunecheckpointblockade,icb)已成为一种很有前途的癌症免疫治疗方法。针对pd-1/pd-l1的单克隆抗体的免疫疗法,通过结合配体或受体,阻断pd-1和pd-l1相互作用,在多种癌症中显示了显著的临床疗效,包括结直肠癌、黑色素瘤、非小细胞肺癌、霍奇金淋巴瘤。肿瘤中程序性死亡配体-1(pd-l1)的表达已被用作预测抗pd-l1免疫治疗反应的生物标记。pd-l1的无创性检测可作为指导和监测免疫治疗的一个重要的生物学标志物。因此本发明公开制备结直肠癌pd-l1表达的光学显像剂nir-pd-l1-mab,意在对crc患者进行pd-l1靶向免疫治疗选择和治疗反应的评估提供了有价值的诊断信息。
现有的技术有:免疫组织化学技术:应用免疫组化检测pd-l1表达是第一个临床认证的预测pd-1/pd-l1抑制剂反应的生物标志物,免疫组织化学测定pd-l1的表达水平能够直接反映患者对pd-l1抑制剂应答率。
正电子发射断层显像(pet)技术和单光子计算机断层扫描的pd-l1检测:靶向pd-1/pd-l1的pet显像常用于标记单克隆抗体的正电子核素包括64cu(半衰期12.7h)、68ga(半衰期68.1min)、89zr(半衰期3.7d)。靶向pd-1/pd-l1的spect显像,用于标记pd-1/pd-l1靶向显像剂的单光子核素包括111in(半衰期67.3h)和99mtc(半衰期6.02h)可以无创、全面显示pd-l1的表达。
流式细胞仪(flowcytometry):是将现代光电测量、电子计算机、电子物理和细胞荧光化学及抗体等技术融合为一体,经常应用于生命科学研究领域的仪器。它是利用该仪器对快速直线运动状态中的生物颗粒或单细胞进行多参数定性分析或定量分析。该仪器也可以从细胞群体中分选和富集具有相同荧光信号的某些特定亚群。使用流式细胞仪对细胞株进行pd-l1表达的检测是根据细胞表面的蛋白抗原与相应的带荧光的抗体结合后,流式细胞仪通过激发相应的荧光染料发出荧光,通过对比检测到的荧光幅度来衡对比细胞表面该蛋白的表达量。
可溶性pd-l1的检测:pd-l1表达阳性的细胞系上血清中可以检测到高浓度的spd-l1,而且spd-l1的含量与mpd-l1的表达强度有关,由此推测spd-l1是mpd-l1剪切形成的,并且两者的生物学功能相似,且都可以与t细胞表面pd-1受体结合,导致t细胞失活,负向调控免疫系统。近期的研究发现,与膜结合的pd1和pd-l1具有可溶性形式,这些可溶性形式增加了pd-1/pd-l1信号通路功能及构成的复杂性和多样性。对spd-l1的水平一般可采用酶联免疫吸附法进行检测,循环spd-l1水平同样可以作为nsclc患者接受抗pd-1/pd-l1治疗的生物标志物。
液态活检:是指对外周血中循环的游离成份进行分子基因信息的研究和分析。这些游离成份包括ctc(circulatingtumorcell,ctc),循环肿瘤dna,循环mirna以及肿瘤细胞释放的外泌体等。
循环肿瘤细胞ctc:是指从原发病灶脱落进入外周血的肿瘤细胞,在肿瘤的转移中扮演着非常重要的角色。它作为液态活检领域的主要成员,代表着部分原发肿瘤的细胞生物信息。ctc的出现提供了非侵入型、治疗相关的诊断以及判断预后的方法,作为携带有原始肿瘤病灶和转移病灶的生物学信息,能完整全面地反映肿瘤组织中pd-l1表达的情况。ctc连续的检测为耐药相关的基因突变的识别提供了机会,免除需要反复操作而病人获益。
但是,到目前为止,很少有用于直接快速检测结直肠癌pd-l1的切伦科夫荧光成像分子探针。因此合成一个基于结直肠癌pd-l1表达水平的高选择性、高灵敏度的切伦科夫荧光成像分子探针具有重大的意义。本申请人利用na131i与pd-l1mab通过氧化还原反应,成功制备光学显像剂131i-pd-l1mab,用来示踪pd-l1过度表达的肿瘤细胞。利用多种结直肠癌小鼠移植瘤模型,验证131i-pd-l1mab探针的特异性切伦科夫成像能力。在切伦科夫光成像实验中可以观察到,引入探针后,pd-l1过度表达的肿瘤有明显荧光信号,肿瘤区所发射的光子数明显高于对侧的正常组织,说明探针在肿瘤区特异性聚集。该技术是安全的,可为肿瘤pd-l1表达提供有价值的信息,展示了一种无创成像技术来监测和评估人crc中的动态pd-l1表达肿瘤微环境,以指导pd-l1靶向免疫治疗。它还支持将来使用pd-l1靶向分子显像剂与其他生物标志物的结合,以更好地指导pd-l1靶向治疗的个性化靶向免疫治疗策略以及crc患者抗pd-l1治疗的反应。我们的发现为将来在基于抗pd-l1-mab成像的临床实践中针对crc患者进行pd-l1靶向免疫治疗选择和治疗反应评估提供了有价值的诊断信息。
技术实现要素:
为解决现有技术中存在的问题,本发明提出一种切伦科夫荧光成像探针及其制备方法与应用,具体是通过以下技术方案来实现的:
一种切伦科夫荧光成像探针,所述探针为131i-pd-l1mab,其化学式为:
一种切伦科夫荧光成像探针的制备方法,具体包括以下步骤:
步骤a、将摩尔比为87:13的na2hpo4·12h2o与nah2po4·2h2o用ddh2o配置为磷酸盐缓冲液,调节ph值至7.6;
步骤b、将酪氨酸溶解于步骤a得到的磷酸盐缓冲液,配置成10mg/ml的酪氨酸磷酸盐溶液;
步骤c、将0.2mol/l的磷酸盐缓冲液加入到氧化剂涂布的微型离心管内,再加入抗pd-l1单克隆抗体,混匀后,加入na131i再次混匀,室温反应10-15min,期间每隔3min混匀一次;
步骤d、反应完成后加入酪氨酸磷酸溶液终止反应,室温静置10min;
步骤e、纯化:20mmol/l的磷酸盐缓冲液内加入含有复合氨基酸的蛋白作为蛋白质保护剂,混匀后调节ph到7.4,配置成0.3%牛血清白蛋白-磷酸盐洗脱液,反应所得产物加入pd-10预装脱盐柱纯化,0.5ml每等试样进行等分,测定每份的放射性计数,合并放射性计数高的峰管,得到131i-pd-l1mab。
进一步的,所述步骤c中混匀是通过涡旋振荡器进行的。
进一步的,所述氧化剂为1,3,4,6-四氯-3α,6α-二苯基甘脲,所述氧化剂具体须通过以下方式得到:用二氯甲烷溶解氧化剂后,使二氯甲烷溶剂挥发干,保持干燥,放入-20℃冰箱内保存备用。
进一步的,所述131i-pd-l1mab得到后须保存在真空瓶内,置于铅罐内,放于4℃冰箱内保存。
进一步的,所述步骤e中0.5ml每等试样进行等分的份数为20-30份。
进一步的,所述含有复合氨基酸的蛋白为牛血清白蛋白。
进一步的,所述抗体与氧化剂的质量比为1:1。
一种切伦科夫荧光成像探针可用于检测结直肠癌pd-l1表达水平的试剂盒方面的应用。
一种切伦科夫荧光成像探针可用于检测结直肠癌pd-l1表达水平的显影剂方面的应用。
本发明的有益效果是:
①在pd-l1检测时所采用的抗体单一;
②检测结果评定直观;
③无创,操作简单,定性、定量检测;实时检测肿瘤生物靶点,可重复。准确评估肿瘤生物靶点表达的动态变化情况;
④引入切伦科夫荧光成像这一新兴成像方式,具有一定前瞻性。
附图说明
图1为本发明实施例1中的体外细胞和探针结合示意图;
图2为本发明实施例1中的皮下瘤种植位置示意图;
图3为本发明实施例1中的体外131i-pd-l1mab与结直肠癌细胞亲和力示意图,其中,a为四种结直肠癌细胞ht29、sw620、lovo、rko细胞系对相同剂量的131i-pd-l1mab的摄取率,差异具有统计学意义(p<0.001);b为rko细胞对相同剂量的131i-pd-l1mab的摄取率,阻断组与正常组相比,摄取明显降低差异具有统计学意义(p<0.001);c为131i-pd-l1mab对rko细胞饱和结合试验,细胞数目不变情况下,逐步增加131i-pd-l1mab的量,求得结合常数kd=0.4494nmol/l,每个rko细胞上有132671±4183个pd-1;d为131i-pd-l1mab对rko细胞竞争性结合试验,细胞数目和131i-pd-l1mab的量不变情况下,逐步增加未标记的pd-l1抗体的量,求得ic50=252.1nmol/l;
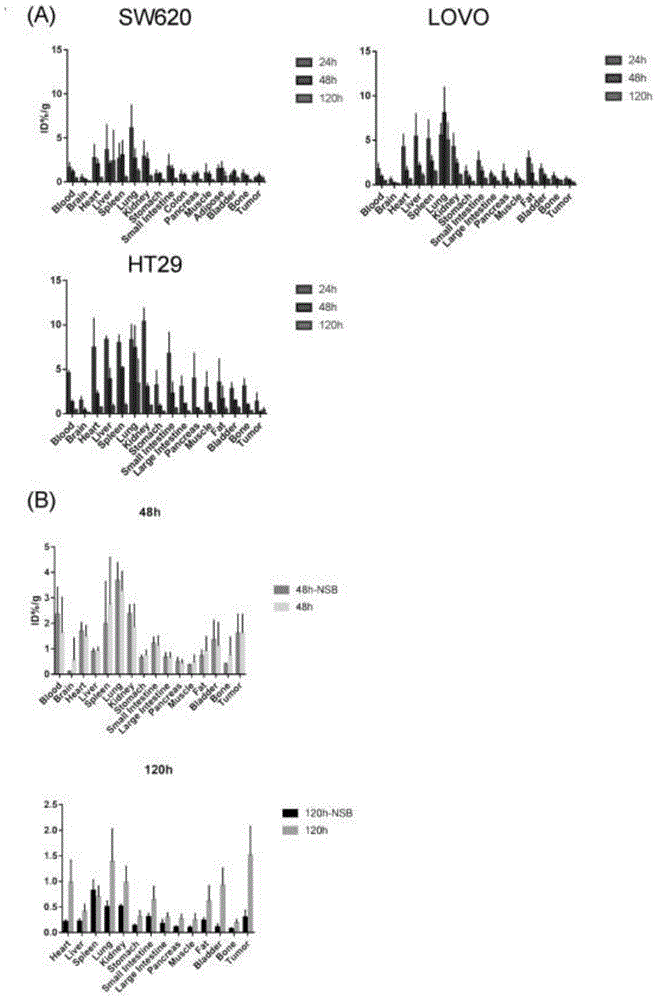
图4为本发明实施例1中的结直肠癌细胞模型鼠体内131i-pd-l1-mab分布荧光定量柱状图,其中,a为结直肠癌细胞ht29、sw620、lovo模型鼠体内131i-pd-l1mab每克组织百分注射剂量率定量柱状图;b为结直肠癌细胞rko模型鼠体内131i-pd-l1mab48h和120h正常组和阻断组的每克组织百分注射剂量定量柱状图,120h时,正常组和阻断组的肿瘤摄取差异具有统计学意义(p<0.001);
图5为本发明实施例1中的不同时间点切伦科夫成像示意图及其荧光强度柱状示意图;
具体实施方式
以下将结合附图对本发明的技术方案进行详细的介绍实施例1
1.pd-l1分子影像探针的制备与分析
1)iodogen涂布微型离心管
1,3,4,6-四氯-3α,6α-二苯基甘脲购自于sigma-aldrich公司,商品名为iodogen,分子式:c16h10cl4n4o2,casnumber:51592-06-4,其是一种氧化剂,可以将na13i溶液中的131i-氧化为131i2,使用前需要将其均匀涂布在小玻璃试管内壁。
称取1mgiodogen于小玻璃试管,吸取1ml二氯甲烷溶解iodogen后分装为50μliodogen溶液每份,每份iodogen溶液滴入1.5ml微型离心管的底部,在真空泵内负压抽吸30min,使二氯甲烷溶剂很快挥发干,此时微型离心管底部形成均匀的iodogen薄膜,塞上塞子,放入有干燥剂的塑料袋内,放入-20℃冰箱内保存备用。
2)na131i及pd-l1抗体的获得
抗pd-l1单克隆抗体,购自于medchemexpress公司,商品名:阿特珠单抗(atezolizumab),分子量:144590.50,抗体规格:100mg,浓度9.64mg/ml,casnumber:1380723-44-3,货号:hy-p9904,保存于pbs溶液中(ph7.2),不包含叠氮化钠,获得抗体后,分装为1ml每份的等份,放置于无菌微型离心管内,-80℃避光保存。
na131i溶液购自于成都中核高通同位素股份有限公司,质量检查依据cngt-js-001c1原辅料质量标准,e=0.365mev,放射性核纯度≥99.9%,核素浓度89.9gbq/ml,核素溶液总活度10.7gbq。na131i溶液保存保存在真空瓶中,真空瓶置于密闭铅罐内,4℃避光保存。
3)pd-l1切伦科夫显像分子探针131i-pd-l1mab的制备
步骤a、称取6.233gna2hpo4·12h2o和0.406gnah2po4·2h2o使用ddh2o配置为100ml磷酸盐缓冲液(pb,phosphatebuffer),ph仪测定ph,调节ph值至7.6;
步骤b、称取酪氨酸0.5g溶解于50mlpb缓冲液,配置成50ml10mg/ml的酪氨酸磷酸(tyr-pb)溶液;
步骤c、100μl0.2mol/l的pb缓冲液加入到iodogen涂布的微型离心管内,再加入50μg阿特珠单抗,涡旋振荡器混匀后,在加入5μlna131i(约22.2mbq),再次混匀,室温反应15min,期间每隔3min涡旋振荡器混匀一次,重复合成2次;
步骤d、反应完成后加入50μltyr-pb溶液终止反应,室温静置10min;
步骤e、纯化:平衡盐溶液为100ml20mmol/l的pbs溶液内加入0.3gbsa,混匀后调节ph到7.4,配置成0.3%bsa-pbs洗脱液,平衡gepd-10预装脱盐柱5个床体积,反应所得产物加入pd-10预装脱盐柱纯化,分20份等试样收集,0.5ml/份,每份取10μl,使用自动伽马计数仪(γ-counter)测定每份的放射性计数,合并放射性计数高的峰管,得到最终产物;
步骤f、所得标记物131i-pd-l1mab保存在真空瓶内,置于铅罐内,放于4℃冰箱内保存备用。
4)分子探针的有关特性分析
①化学纯度测定
用凝胶tsk柱(型号g2000swxl)hplc法或者sds-page结合伽马计数法测定131i-pd-l1mab的化学纯度。
②体外稳定性分析
将分子探针分别与200μl50mmol/lpbsph7.4和200μl人血清于4℃、25℃和37℃密闭孵育不同时间(1h,2h,4h,8h,24h,48h和96h)后,采用①中的方法测定其化学纯度,考察分子探针131i-pd-l1mab的体外稳定性。
5)分子探针131i-pd-l1mab体外药物学特性
①细胞试验系统
体外培养不同结直肠癌肿瘤细胞,包括sw620、ht29、lovo、rko,待细胞生长至对数生长期,将细胞用胰蛋白酶消化,收集细胞,并计数(图1)
②131i-pd-l1mab分子探针与pd-l1的亲和力的测定
将消化下来的sw620、ht29、lovo、rko细胞悬液在显微镜下用血球计数板计数,调整细胞浓度为5×106/ml。以含0.5%牛血清白蛋白(bovineserumalbumin,bsa)的rpmi-1640作为结合缓冲液,实验组(x组)将100μl的细胞悬液与100μl47.5pmol/l131i-pd-l1mab(1.3kbq)在37℃孵育。而在对照组(o组)和总计数组(t组)中加入相同量的131i-pd-l1mab而不加人细胞悬液,并加入结合缓冲液以补足液体总量至200μl。为了确定131i-pd-l1mab与细胞的非特异性结合(non-specificbinding,nsb)情况,在2000倍过量的未标记pd-l1抗体存在下,将131i-pd-l1mab与rko细胞孵育。细胞孵育1小时后,通过离心(4000rpm,10min)分离x组,o组和nsb组,得到蛋白结合级分(沉淀),并去除上清液。离心后,用γ-counter测量每组的放射性。每一步骤重复三次。细胞结合率计算为
③竞争抑制试验
在1ml结合缓冲液中,将131i-pd-l1mab(750bq)与5×105个rko细胞在不同浓度的未标记抗体(11.5-2300pmol/l)存在下于37℃孵育1小时。孵育后,通过离心获得细胞组分,并在屏蔽的井型γ计数器中测量细胞相关的活性。测定131i-pd-l1mab的半数抑制浓度(ic50),ic50定义为50%抑制放射性标记抗体所需的抗体浓度。
④饱和结合实验
在饱和结合试验中,将浓度逐步升高的131i-pd-l1mab(65-3333bq)与5×105个rko细胞在1ml结合缓冲液中于37℃温育1小时。为了去除非特异性结合的影响,另外增加条件相同的对照组,对照组内另外加入200倍摩尔比的未标记抗体用于共孵育。特异性结合定义为在肿瘤细胞膜上表达的pd-1抗原与pd-l1抗体的结合,相当于总结合与非特异性结合之间的差值。graphpadprism7软件拟合特异性结合与非特异性结合之间的关系曲线,以确定每个rko细胞的pd-l1受体密度和131i-pd-l1mab的解离常数(kd)。
2.皮下荷瘤模型体内131i-pd-l1mab切伦科夫显像和离体器官生物学分布实验
1)131i-pd-l1mab切伦科夫显像动物模型的建立
6-8周龄的雌性balb/c免疫缺陷小鼠共64只,购自常州卡文斯动物实公司,体重15-20g,所有动物实验方案均已得到江苏省原子医学研究所动物使用和护理委员会的批准,所有程序均符合批准的指南。将小鼠饲养在spf级动物设施的无菌笼中,光照/黑暗周期为12小时,温度为18℃-23℃,相对湿度为50%-60%。自由获得食物和饮用水,无菌条件下,于小鼠右胁皮下皮下接0.2mlrko、ht29、sw620、lovo细胞悬液,细胞悬液浓度为2.5×107个/ml。每隔2-3天观察肿瘤生长情况,测量肿瘤长径和短径当荷瘤体积达到800-1000mm3时进行成像,肿瘤体积为
2)131i-pd-l1mab切伦科夫显像和离体器官生物学分布的分析
使用131i-pd-l1mab切伦科夫显像来评估不同肿瘤模型中pd-l1表达情况。切伦科夫显像前48小时前,使用0.5%碘化钠溶液代替小鼠饮用水,以防止131i在小鼠甲状腺中的富集。通过尾静脉注射37mbq131i-pd-l1mab(蛋白质含量29.26μg),观察小鼠情况15min,将小鼠放回spf环境继续饲养,分别在小鼠经由尾静脉注射131i-pd-l1mab的24h、48h和120h对小鼠进行切伦科夫成像,小鼠使用2%异氟烷进行气体麻醉,待小鼠麻醉后,使用
为了确定131i-pd-l1mab结合的生物学分布和特异性,我们在皮下大肠癌细胞系异种移植小鼠中进行了两组实验,每次实验注射131i-pd-l1mab前48小时,同样使用0.5%碘化钠溶液代替小鼠饮用水。
在第一个实验中,将皮下移植的ht29、sw620、lovo小鼠分为三组,分别静脉注射7.5kbq131i-pd-l1mab。分别于注射131i-pd-l1mab后24、48、120小时对小鼠实行安乐死,取颈动脉血100μl。解剖并称重小鼠主要组织、器官和肿瘤组织。血液、组织、器官和肿瘤被放置在伽玛计数管中,它们的放射性在伽玛计数器上测量。
在第二个实验中,将皮下移植的rko小鼠分为两组。对照组注射7.5kbq131i-pd-l1mab。阻断组的皮下移植rko细胞的小鼠体内注射超过300μg未标记的pd-l1抗体以阻断pd-l1受体。注射131i-pd-l1mab后48天和120天对小鼠实施安乐死,并按上述步骤进行进一步处理。器官及肿瘤组织的每克组织百分注射剂量率(percentageofinjecteddosepergram,%id/g),计算公式如下:
实施例2
免疫检查点切伦科夫荧光成像
1、荷瘤模型鼠的准备
1)模型数量-64只;6-8周龄;
2)涉及细胞种类(rko、ht29、sw620、lovo);
3)每只鼠于右侧肋下种一种细胞的皮下瘤,如图2所示(具体以实际种植位置为准);
4)注射细胞数量及细胞浓度:每种皮下瘤细胞数量为5×106个;注射体积为0.1~0.2ml;细胞浓度2.5-5×107个/ml。
5)当荷瘤体积达到800-1000mm3时进行成像。
2、anti-pd-l1抗体的标记步骤:
1)抗体来源
①anti-pd-l1抗体,人源化单克隆抗体;medchemexpress公司,货号:hy-p9904;
②规格:100mg,浓度9.64mg/ml,casnumber:1380723-44-3;
③溶液存储形式:保存于的pbs溶液(ph7.2)中。
2)na131i来源
①成都中核高通同位素股份有限公司;
②na131i放射性核纯度≥99.9%,核素浓度89.9gbq/ml,核素溶液总活度10.7gbq;
③规格:核素溶液活度10.7gbq,体积119.02μl;
④na131i溶液保存保存在真空瓶中,真空瓶置于密闭铅罐内,4℃避光保存。
3)iodogen涂布微型离心管
①1,3,4,6-四氯-3α,6α-二苯基甘脲,商品名:iodogen,sigma-aldrich公司;
③分子式:c16h10cl4n4o2,casnumber:51592-06-4;
④规格:250mg,常温避光保存。
4)anti-pd-1抗体的光学标记
①100μl0.2mol/l的pb缓冲液加入到iodogen涂布的微型离心管内,再加入50μg阿特珠单抗,混匀后,在加入5μlna131i约22.2mbq,再次混匀,室温反应15min,期间每隔3min涡旋振荡器混匀一次;
②反应完成后加入50μltyr-pb溶液终止反应,室温静置10min;
③将上述反应溶液上入已用0.3%bsa-pbs溶液平衡好的pd-10柱,并用此buffer洗脱。分20份等试样收集,0.5ml/份,每份取10μl,使用γ-counter测定每管的放射性计数,合并放射性计数高的峰管,得到最终产物,
④所得标记物131i-pd-l1mab保存在真空瓶内,置于铅罐内,放于4℃冰箱内保存备用。
3、切伦科夫荧光显像结果
如图3所示,其中,a为四种结直肠癌细胞ht29、sw620、lovo、rko细胞系对相同剂量的131i-pd-l1mab的摄取率,差异具有统计学意义(p<0.001);b为rko细胞对相同剂量的131i-pd-l1mab的摄取率,阻断组与正常组相比,摄取明显降低差异具有统计学意义(p<0.001);c为131i-pd-l1mab对rko细胞饱和结合试验,细胞数目不变情况下,逐步增加131i-pd-l1mab的量,求得结合常数kd=0.4494nmol/l,每个rko细胞上有132671±4183个pd-1;d为131i-pd-l1mab对rko细胞竞争性结合试验,细胞数目和131i-pd-l1mab的量不变情况下,逐步增加未标记的pd-l1抗体的量,求得ic50=252.1nmol/l。
如图4所示,其中,a为结直肠癌细胞ht29、sw620、lovo模型鼠体内131i-pd-l1mab每克组织百分注射剂量率定量柱状图;b为结直肠癌细胞rko模型鼠体内131i-pd-l1mab48h和120h正常组和阻断组的每克组织百分注射剂量定量柱状图,120h时,正常组和阻断组的肿瘤摄取差异具有统计学意义(p<0.001)。
如图5所示,结直肠癌细胞rko、ht29、sw620、lovo移植瘤模型给药后不同时间(24h、48h、120h)仰卧位切伦科夫显像图。随着时间的延长,131i-pd-l1mab肿瘤光学显像越来越清晰,120h显像效果最好。四种模型肿瘤的平均荧光强度存在组间差异,差异有明显统计学意义(p<0.001),四种模型pd-l1表达水平由高到低分别为:rko>ht29>sw620>lovo。
实验结论:不同结直肠癌细胞(rko、ht29、sw620、lovo)pd-l1体外流式细胞学分析,结果显示三种细胞pd-l1的表达水平由高到低依次为rko>ht29>sw620>lovo;体内细胞结合与抑制试验证明,未标记的pd-l1抗体可以抑制131i-pd-l1-mab与细胞的结合,证明了131i-pd-l1-mab与细胞表面的pd-l1特异性结合,其结合率由大到小分别为rko>ht29>sw620>lovo;饱和结合试验和竞争性抑制试验求出kd常数和ic50均证明131i-pd-l1-mab与细胞表面的pd-1存在较强的亲和力;不同结直肠癌转移瘤模型(rko、ht29、sw620、lovo)体内131i-pd-l1-mab分布研究结果显示:rko模型鼠中肿瘤组织最高,各个模型鼠中分布较高的脏器依次为肺脏>肝脏>脾脏>肿瘤组织。体内分布研究结果说明三种肿瘤模型中肿瘤组织pd-l1的表达水平由高到低依次为rko>ht29>sw620>lovo;不同结直肠癌移植瘤模型(rko、ht29、sw620、lovo)尾静脉注射131i-pd-l1-mab后不同时间(24h、48h、120h)光学成像研究结果显示随着时间的延长,肿瘤的显像越来越清晰,120h时可以较好地显示出肿瘤的轮廓,三种肿瘤模型肿瘤组织的摄取131i-pd-l1-mab由高到低依次为rko>ht29>sw620>lovo,由此也说明三种模型pd-l1的表达水平由高到低分别为:rko>ht29>sw620>lovo。
- 还没有人留言评论。精彩留言会获得点赞!