一种脂肪酶催化在线合成8-甲氧基香豆素-3-羧酸-6′-O-D-葡萄糖酯的方法与流程
本发明涉及一种脂肪酶催化在线合成8-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯的方法。
背景技术:
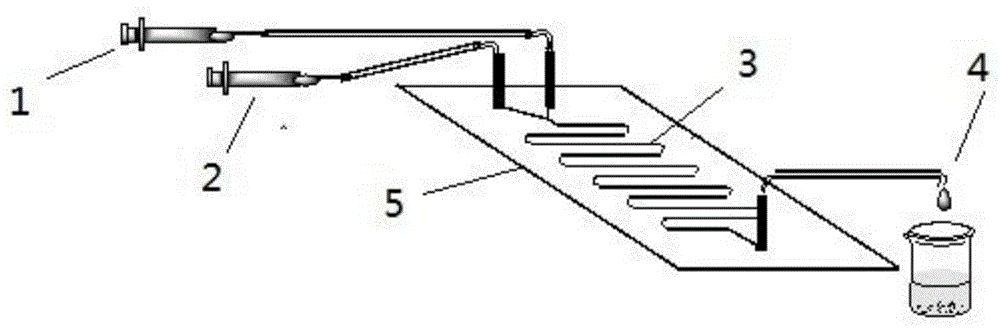
:香豆素是多种植物次生代谢产物和微生物代谢产物中的一种基本结构亚单位,具有一系列具有吸引力的生物活性,包括抗菌、抗凝剂、抗病毒、抗结核、抗氧化剂和抗肿瘤等活性。临床上已经应用了几种含有香豆素支架的天然合成药物,如华法林作为维生素k拮抗剂的抗凝剂,在血栓治疗中得到了广泛应用,常用的抗生素蜜环素a和新生霉素均含有香豆素亚结构单元。此外,由于香豆素的母体结构,它被广泛应用于特定的荧光探针、染料和荧光成像等领域。其中,含糖分支的香豆素衍生物的合成在有机和医药研究和开发中引起了相当大的关注。含糖香豆素的有趣之处在于这些化合物具有良好的水溶性。这些结果可改善药物的理化、生物药剂学和药动学性质。索尔森等人的研究表明华法林的糖基化引起了从抗凝剂到抗癌活性的转变,他们证明华法林的糖基化可以显示出比原化合物高70倍的抗癌活性。这项研究清楚地说明了附加的糖对于改变香豆素母体药物的作用机制和效力是至关重要的。在过去的几年里,有几项关于含糖香豆素的研究被报道。苏普兰等人合成了一系列糖基香豆素碳酸酐酶ix和xii抑制剂,对原发性乳腺肿瘤的生长有很强的抑制作用。2016年,nilsson等人报道了一种选择性半乳糖香豆素衍生物galetin-3抑制剂,在博莱霉素诱导的肺纤维化的小鼠模型中显示出与已知的非选择性galetin-1/galetin-3抑制剂相似的效果。含糖衍生物的构建可以通过基本的合成方法来实现,最常见的合成策略是化学方法。通过“保护”或“保护脱保护”步骤,糖上特定活泼羟基被选择性合成。可见光最近也被报道为糖基化催化剂,然而,大多数用于光诱导糖基化的方案要求过渡金属催化剂与昂贵的添加剂或氧化剂结合以进行反应。因此,用化学方法引入糖仍然受到区域和立体选择性差、官能团保护和脱保护冗长等缺点的限制。生物催化剂作为一种高效绿色的生物转化工具,在有机合成中引起了化学家和生物化学家的广泛关注。特别是生物催化中的催化混配,即利用旧酶形成新的键并遵循新的途径,得到了极大的扩展和迅速的扩展。一些酶,如工程化c-糖基转移酶(micgtb-gagm),已被应用于香豆素c-糖苷的合成,其中合成的两个c-葡萄糖苷具有很强的sglt2抑制活性。酶催化的反应相对温和、绿色,但要达到预期结果需要较长的反应时间(通常长到24小时或更长),有些反应依赖于昂贵的酶。近年来,连续流动微反应器与酶联用已成为缩短反应时间、提高收率的有效途径。现代合成化学面临着向社会提供高性能、环保、低成本、安全和原子效率的有价值产品的挑战。在这方面,连续流微反应器技术(mrt)作为传统分批化学合成的替代品越来越流行。特别是,就绿色化学的12项原则而言,mrt可以在改善化学过程中发挥主要作用。微反应器装置的高表面体积比,导致更好的热交换和有效的混合,从而提高反应效率。此外,mrt系统在科学之初就包含了反应规模,允许在紧凑、可重构的设备中有效地按需生成化合物。在这种情况下,“向外扩展”或“向上编号”指的是并行操作的连续流系统阵列,以满足所需的输出。流动化学,特别是连续流动系统中的催化剂/基质条件,可以提高反应性和选择性。同时,在连续流塔中填充多相催化剂时,催化剂和产物的分离非常容易。为了探索含糖香豆素的新的、生态友好的和高效的方案,以及作为我们正在进行的新型含糖药物开发研究的一部分,我们研究发现了微通道反应器中脂肪酶催化在线合成8-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯的方法,旨在寻找一种高效环保的8-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯的在线可控选择性合成方法。技术实现要素:本发明的目的是提供一种微流控通道反应器中脂肪酶催化在线合成8-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯的新工艺方法,该法具有反应时间短、产率高、选择性好的优点。本发明的技术方案如下:一种脂肪酶催化在线合成8-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯的方法,所述方法为:将脂肪酶lipozymermim(催化剂)均匀填充在微流控通道反应器的反应通道中,将8-甲氧基香豆素-3-羧酸甲酯、d-葡萄糖各自用反应溶剂溶解后,分别通过第一注射器、第二注射器注入管道汇总后,进入反应通道内进行反应,控制反应温度为30~60℃(优选35℃),混合液在反应通道内的连续流动反应时间为10~60min(优选40min),流出反应通道的反应液通过产物收集器在线收集,经后处理,得到产物8-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯(i);所述反应溶剂为二甲基亚砜和叔戊醇的混合溶剂,其中二甲基亚砜与叔戊醇的体积比为1:8~20,优选1:18;进入反应通道内的混合液中,8-甲氧基香豆素-3-羧酸甲酯、d-葡萄糖的物质的量之比为1:0.2~3,优选1:0.25,具体操作可以如下:所述8-甲氧基香豆素-3-羧酸甲酯、d-葡萄糖各自用反应溶剂溶解后,所得8-甲氧基香豆素-3-羧酸甲酯溶液、d-葡萄糖溶液的物质的量浓度之比为1:0.2~3,优选1:0.25;所述8-甲氧基香豆素-3-羧酸甲酯溶液、d-葡萄糖溶液分别通过第一注射器、第二注射器注射时,流速相同;所述脂肪酶lipozymermim可商购获得,例如购自诺维信(novozymes)公司,其是一种由微生物制备的、1,3位置专用、食品级脂肪酶(ec3.1.1.3)在颗粒硅胶上的制剂,它是从rhizomucormiehei得到的、用一种基因改性米曲霉(aspergillusoryzae)微生物经过深层发酵生产的;所述脂肪酶lipozymermim可通过物理法直接将颗粒状的催化剂均匀固定于反应通道内即可;在所述反应通道可容纳所填充催化剂的最大限度内,催化剂的加入量以反应介质的体积计为0.025~0.05g/ml;所述后处理的方法为:所得反应液减压蒸馏除去溶剂,进行硅胶柱层析分离,用200-300目硅胶湿法装柱,以二氯甲烷和甲醇体积比=10:1.5的混合液为洗脱剂,tlc跟踪洗脱进程,收集含目标化合物的洗脱液,蒸除溶剂并干燥,得到产物8-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯(i);本发明合成方法采用微流控通道反应器,所述微流控通道反应器包括:第一注射器、第二注射器、反应通道、产物收集器;所述第一注射器、第二注射器经y型或t型管道连接反应通道入口,所述产物收集器通过管道与反应通道出口连接;进一步,所述反应通道的内径为0.8~2.4mm,反应通道长为0.5~1.0m;所述第一注射器、第二注射器安装于注射泵中,由注射泵同步推动,第一注射器与第二注射器的规格一致;所述微流控通道反应器还包括恒温箱,所述反应通道置于恒温箱中,以此可以有效控制反应温度,所述恒温箱可以根据反应温度要求自行选择,比如水浴恒温箱等;所述反应通道的材质不限,推荐使用绿色、环保的材质,例如硅胶管;对于反应通道的形状最好为曲线形,可以保证反应液匀速稳定的通过。与现有技术相比,本发明的有益效果为:本发明在微流控通道反应器中利用脂肪酶催化在线合成8-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯,该法不仅大大地缩短了反应时间,而且具有高的转化率和选择性;同时首次利用经济的脂肪酶lipozymermim催化8-甲氧基香豆素-3-羧酸甲酯与d-葡萄糖反应,降低了反应成本,具有经济高效的优势。附图说明图1为本发明实施例采用的微流控通道反应器的结构示意图。图中,1-第一注射器,2-第二注射器,3-反应通道,4-产物收集器,5-水浴恒温箱。具体实施方式下面以具体实施例对本发明作进一步说明,但本发明的保护范围不限于此:本发明实施例使用的微流控通道反应器的结构参考图1,包括一个注射泵、第一注射器1、第二注射器2、反应通道3、水浴恒温箱5(仅显示其平面示意图)和产物收集器4;第一注射器1和第二注射器2安装于注射泵中,通过一个y型接口与反应通道3入口连接,所述反应通道3置于水浴恒温箱5中,通过水浴恒温箱5控制反应温度,所述反应通道3的内径2.0mm,管长1.0m,所述反应通道3出口通过一接口与产物收集器4连接。实施例1:8-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯的合成装置参考图1:将8-甲氧基香豆素-3-羧酸甲酯(2.0mmol)溶解在0.52ml二甲基亚砜和9.48ml叔戊醇中,d-葡萄糖(0.5mmol)溶解在0.52ml二甲基亚砜和9.48ml叔戊醇中,然后分别装于10ml注射器中备用。将0.87g脂肪酶lipozymermim均匀填充在反应通道中,在phd2000注射泵推动下,两路反应液分别以7.8μl·min-1的流速通过“y”接头进入反应通道中进行反应,通过水浴恒温箱控制反应器温度在35℃,反应液在反应通道内连续流动反应40min,反应结果通过薄层色谱tlc跟踪检测。通过产物收集器在线收集反应液,减压蒸馏除去溶剂,用200-300目硅胶湿法装柱,洗脱试剂为二氯甲烷:甲醇=10:1.5,柱高35cm,柱直径4.5cm,样品用少量洗脱试剂溶解后湿法上柱,洗脱液收集流速2ml·min-1,同时tlc跟踪洗脱进程,将得到的含有单一产物的洗脱液合并蒸干,得到淡黄色固体,获得8-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯,hplc检测8-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯转化率63%,选择性99%。核磁表征结果如下:1hnmr(dmso-d6,500mhz,δ,ppm)8.67(s,0.5h,h-4ofβ-d-glucose),8.65(s,0.5h,h-4ofα-d-glucose),7.45-7.39(m,2h,h-5,h-7),7.33(t,j=7.9hz,1h,h-6),6.72(s,0.5h,c1′-ohofβ-d-glucose),6.39(s,0.5h,c1′-ohofα-d-glucose)5.35-4.78(m,3h,c1′-hofd-glucose,c4′-ohofd-glucose,c2′-ohofβ-d-glucose),4.70-4.47(m,1.5h,c3′-ohofα-d-glucose,c6′-haofd-glucose),4.36(d,j=7.7hz,0.5h,c3′-ohofβ-d-glucose),4.30(td,j=12.1,6.2hz,1h,c6′-hbofd-glucose),3.92(s,3h,h-12),3.91(s,0.5h,c5′-hofα-d-glucose),3.51-3.47(m,1h,c5′-hofβ-d-glucose,c3′-hofα-d-glucose),3.24-3.18(m,2h,c2′-hofd-glucose,c3′-hofβ-d-glucose,c4′-hofα-d-glucose),2.97(t,j=8.2hz,0.5h,c4′-hofβ-d-glucose).13cnmr(126mhz,dmso)δ162.53,162.49(c-11),155.67(c-2),148.93,148.81(c-8),146.26(c-9),143.92(c-4),124.84(c-6),121.16(c-5),118.23(c-3),117.79,117.72(c-7),116.51(c-10),97.02(c1′ofβ-d-glucose),92.41(c1′ofα-d-glucose),76.46(c3′ofβ-d-glucose),74.72(c2′ofβ-d-glucose),73.50(c5′ofβ-d-glucose),72.91(c3′ofα-d-glucose),72.18(c2′ofα-d-glucose),70.59(c4′ofα-d-glucose),70.19(c4′ofβ-d-glucose),69.21(c5′ofα-d-glucose),65.26(c6′ofd-glucose),56.21,56.17(c-12).实施例2-8改变微流控通道反应器中反应介质dmso与叔戊醇的体积比,8-甲氧基香豆素-3-羧酸甲酯与d-葡萄糖的底物比为2:1(1.0mmol:0.5mmol),控制温度为50℃,反应时间30min,其他同实施例1,反应结果如表1所示:表1:反应介质中dmso与叔戊醇的体积比对反应的影响实施例dmso:叔戊醇转化率[%]选择性[%]21:8n.d./31:1015%99%41:1226%99%51:1434%99%61:1639%99%71:1844%99%81:2042%99%表1的结果表明,当反应物8-甲氧基香豆素-3-羧酸甲酯与d-葡萄糖的底物摩尔比为2:1,流速为10.4μl·min-1,反应时间均为30min,反应温度均为50℃时,随着反应介质中的叔戊醇体积比增加,反应的转化率也随着增加,当反应介质dmso与叔戊醇的体积比为1:18时,反应的转化率最优,此时如果继续增加叔戊醇的体积比,糖在反应介质中的溶解量减少,使得反应的转化率有所降低。因而本发明的微流控微通道反应器中该反应的最佳反应介质体积比为dmso:叔戊醇=1:18。实施例9-15改变微流控微通道反应器中8-甲氧基香豆素-3-羧酸甲酯与d-葡萄糖的底物摩尔比,控制反应器温度在50℃,反应时间30min,其他同实施例1,结果如表2所示:表2:8-甲氧基香豆素-3-羧酸甲酯和d-葡萄糖底物物质的量之比对反应的影响表2的结果表明,反应介质dmso与叔戊醇的体积比为1:18,流速为10.4μl·min-1,反应时间均为30min,反应温度均为50℃时,随着反应物8-甲氧基香豆素-3-羧酸甲酯的增加,反应的转化率也随着增加,当底物比为4:1时,反应的转化率最优,此时如果继续增加反应物8-甲氧基香豆素-3-羧酸甲酯的用量,反应的转化率有所降低。因而本发明的微流控微通道反应器中该反应的最佳底物摩尔比为8-甲氧基香豆素-3-羧酸甲酯与d-葡萄糖=4:1。实施例16-22改变微流控通道反应器的温度,控制反应时间为30min,其他同实施例1,反应结果如表3所示:表3:温度对反应的影响实施例温度[℃]转化率[%]选择性[%]1630℃55%98%1735℃59%99%1840℃57%99%1945℃53%98%2050℃50%97%2155℃46%94%2260℃42%90%表3的结果表明,当反应介质dmso与叔戊醇的体积比为1:18,8-甲氧基香豆素-3-羧酸甲酯与d-葡萄糖的底物摩尔比为4:1,流速为10.4μl·min-1,反应时间均为30min时,当反应温度处于35℃时,反应的转化率最佳,温度或太高或太低都将影响酶的活性。所以本发明中微流控微通道反应器中该反应的最佳反应温度为35℃。实施例23-27改变微流控通道反应器的反应时间,其他同实施例1,反应结果如表4所示:表4:反应时间对反应的影响实施例时间[min]转化率[%]选择性[%]231041%99%242051%99%253059%99%14063%99%265061%98%276057%94%表4的结果表明,当反应介质dmso与叔戊醇的体积比为1:18,8-甲氧基香豆素-3-羧酸甲酯与d-葡萄糖的底物摩尔比为4:1,反应温度均处于35℃时,流速为7.8μl·min-1,反应时间进行到40min时,反应转化率可以达到63%,此时如果继续延长反应时间,反而会导致反应转化率降低。因而,微流控通道反应器中该反应的最佳反应时间为40min。对比例1-3改变微流控微通道反应器中的催化剂,分别改为猪胰脂肪酶ppl(对比例1)、脂肪酶novozym435(对比例2)、枯草杆菌碱性蛋白酶(对比例3),其他同实施例1,结果如表5所示。表5:不同酶对反应转化率及选择性的影响对比例酶源转化率[%]选择性[%]1ppl18%64%2novozym43533%73%3枯草杆菌碱性蛋白酶00实施例1lipozymermim63%99%表5的结果表明,对于微流控反应器中酶促8-甲氧基香豆素-3-羧酸甲酯与d-葡萄糖的区域选择性酯交换反应而言,不同的酶对反应有着十分明显的影响。利用猪胰脂肪酶ppl催化反应,转化率为18%;利用枯草杆菌碱性蛋白酶催化该反应,转化率0%;利用novozym435催化该反应,转化率为33%。从表5的结果看,对于微流控反应器中酶促8-甲氧基香豆素-3-羧酸甲酯与d-葡萄糖的区域选择性酯交换化反应而言,最有效的催化剂为脂肪酶lipozymermim,转化率为63%,选择性为99%。对比例4-6改变微流控微通道反应器中的反应原料,酰基供体改为8-甲氧基香豆素-3-羧酸叔丁酯(对比例4),酰基受体改为d-半乳糖(对比例5),同时改变酰基供体和酰基受体(对比例6),其他同实施例1,结果如表6所示。表6不同酶对反应转化率及选择性的影响对比例酰基供体酰基受体转化率[%]选择性[%]48-甲氧基香豆素-3-羧酸叔丁酯d-葡萄糖13%73%58-甲氧基香豆素-3-羧酸甲酯d-半乳糖15%58%68-甲氧基香豆素-3-羧酸叔丁酯d-半乳糖00实施例18-甲氧基香豆素-3-羧酸甲酯d-葡萄糖63%99%表6的结果表明,对于微流控反应器中酶促8-甲氧基香豆素-3-羧酸糖酯的区域选择性酯交换合成反应而言,不同底物对反应有着十分明显的影响。利用8-甲氧基香豆素-3-羧酸叔丁酯作为酰基供体,d-葡萄糖作为酰基受体,转化率13%;利用8-甲氧基香豆素-3-羧酸甲酯作为酰基供体,d-半乳糖作为酰基受体,转化率15%;利用8-甲氧基香豆素-3-羧酸叔丁酯作为酰基供体,d-半乳糖作为酰基受体,转化率0%。从表6的结果看,对于微流控反应器中酶促8-甲氧基香豆素-3-羧酸糖酯的区域选择性酯交换合成反应而言,8-甲氧基香豆素-3-羧酸叔丁酯不是一种有效的酰基供体,d-半乳糖不是一种有效的酰基受体。应用例1利用牛津杯法测定8-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯对金黄色葡萄球菌的抑菌圈大小。在营养琼脂平板上加入100μl的试验菌液(菌液浓度为1×107cfu/ml),用无菌涂布器将菌液涂布均匀;在培养基表面等距离的摆放3个牛津杯并轻轻按压,使其与培养基接触;在杯中加入8-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯200μl(浓度1g/ml),做3个重复;置于28℃隔水式恒温培养箱中培养24h,观察结果。结果判定:以牛津杯周围无肉眼可见细菌生长区为抑菌圈,用直尺测量抑菌圈直径大小,取3次测量结果的平均值作为化合物对金黄色葡萄球菌的抑菌圈大小。抑菌圈直径以d表示,当d<10mm时,为耐药(r);当10≤d≤15时,为中度敏感(i);当d>15mm时,为高度敏感(s)。表78-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯对金黄色葡萄球菌的体外抑菌试验应用例化合物平均抑菌圈直径/mm敏感度18-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯22s表7表明8-甲氧基香豆素-3-羧酸-6′-o-d-葡萄糖酯对金黄色葡萄球菌具有很好的抑制作用,可作为金黄色葡萄球菌的抑制剂。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1