干扰素信号通路相关基因群及诊断产品和应用的制作方法
1.本发明属于生物技术领域,具体涉及干扰素信号通路相关基因群及其体外诊断产品和应用。
背景技术:
2.乳腺癌占我国妇女恶性肿瘤发病的第一位,并以每年4%左右的速度逐年增加。由于乳腺癌的高度异质性,目前国内外在乳腺癌术后的精准治疗和降低复发风险等方面仍面临很大挑战。乳腺癌远处转移是乳腺癌复发中最为严重的类型,是判断预后的重要指标,也是造成患者死亡的主要原因。因此,预测乳腺癌的远处转移风险,对评估和改善患者的预后尤其重要。基于乳腺癌组织中的多基因表达谱提出的乳腺癌分子分型,可将乳腺癌分为能反映肿瘤生物学行为的亚型,并可评估各亚型的复发风险,指导化疗、内分泌治疗或靶向治疗等治疗方案的应用,具有重要的临床治疗指导意义。
3.具有不同的分子生物学特征(例如,her2、激素受体(er/pr)或其他肿瘤标志物的表达情况)与临床和病理指标(例如,患者年龄、肿瘤的分期和淋巴结的有无等)的乳腺癌在恶性程度、对内分泌治疗、靶向治疗或化疗等治疗方案的敏感性及预后等方面均存在较大差异。her2富集型和her2阳性乳腺癌对于针对her2的靶向治疗+化疗的治疗方案较为敏感,但其病程发展迅速且预后较差。目前有待开发可用于评估her2富集型和her2阳性乳腺癌的复发风险和指导其治疗方案的检测手段和产品。
技术实现要素:
4.在一方面,本发明涉及用于进行乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导的基因群。优选地,所述乳腺癌是her2富集型或her2阳性乳腺癌。优选地,所述干扰素是i型干扰素。
5.在一实施方案中,本发明的基因群包括以下基因(g1)中的至少1个:ifi35、ifit3、oas2、oasl、rtp4和samd9。
6.在一优选实施方案中,本发明的基因群包括samd9和以下基因(g1)中的至少1个:ifi35、ifit3、oas2、oasl和rtp4。
7.在另一实施方案中,本发明的基因群包括以下基因(g2)中的至少1个:oas3、ddx58、sp110、ifih1、ddx60和xaf1。
8.在另一实施方案中,本发明的基因群包括以下基因(r)中的至少1个:eif2ak2、herc5、herc6、ifi27、ifi44、ifi44l、ifi6、ifit1、ifit5、ifitm1、isg15、mx1、mx2、oas1、plscr1、rsad2和usp18。
9.在又一实施方案中,本发明的基因群包括以下基因中的至少1个:ifi35、ifit3、oas2、oasl、rtp4和samd9,和/或以下基因中的至少1个:oas3、ddx58、sp110、ifih1、ddx60和xaf1;并且还包括以下基因中的至少1个:eif2ak2、herc5、herc6、ifi27、ifi44、ifi44l、ifi6、ifit1、ifit5、ifitm1、isg15、mx1、mx2、oas1、plscr1、rsad2和usp18。
10.在进一步优选的实施方案中,本发明的基因群还包括参考基因。优选地,所述参考基因包括以下中的至少1个、更优选3个、最优选6个:gapdh、gusb、mrpl19、psmc4、sf3a1、tfrc、actb、rplp0。
11.在一具体实施方案中,本发明的基因群包括:ifi35、ifit3、oas2、oasl、rtp4和samd9;以及actb、gapdh和rplp0。
12.在又一具体实施方案中,本发明的基因群包括:oas3、ddx58、sp110、ifih1、ddx60和xaf1;以及actb、gapdh和rplp0。
13.在另一具体实施方案中,本发明的基因群包括:ddx58、ddx60、eif2ak2、herc5、herc6、ifi27、ifi35、ifi44、ifi44l、ifi6、ifih1、ifit1、ifit3、ifit5、ifitm1、isg15、mx1、mx2、oas1、oas2、oas3、oasl、plscr1、rsad2、rtp4、samd9、sp110、usp18和xaf1;以及gapdh、gusb、mrpl19、psmc4、sf3a1和tfrc。
14.在又一方面,本发明还涉及所述基因群在进行乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导中的应用。
15.在另一方面,本发明提供一种用于检测本发明基因群中基因的表达水平的试剂,所述试剂用于进行乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导。
16.在又一方面,本发明提供一种诊断产品,用于进行乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导,其包含检测本发明的基因群中基因的表达水平的试剂。在一实施方案中,所述诊断产品为体外诊断产品的形式。在一具体实施方案中,所述诊断产品为诊断试剂盒的形式。在一具体实施方案中,所述诊断产品可以为二代测序试剂盒、实时荧光定量pcr检测试剂盒、基因芯片、蛋白质微阵列、elisa诊断试剂盒或免疫组化(ihc)试剂盒。
17.在另一方面,本发明还涉及一种用于确定受试对象乳腺癌的复发风险和/或进行干扰素乳腺癌治疗指导的方法,所述方法包括:
18.(1)提供受试对象的样本,
19.(2)测定所述样本中本发明的基因群中基因的表达水平,任选地,根据所述表达水平计算干扰素指数,
20.(3)判断(2)中所述表达水平或所述干扰素指数的强弱,
21.(4)根据(3)中所述表达水平或所述干扰素指数的强弱确定所述受试对象的乳腺癌复发风险和/或进行干扰素乳腺癌治疗指导。
22.在又一方面,本发明还提供了本发明的基因群或本发明的试剂在制备诊断产品中的应用,所述诊断产品用于进行乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导。
附图说明
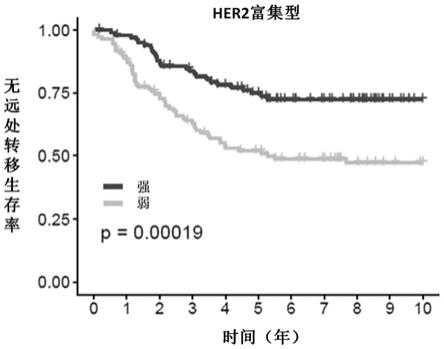
23.图1表示在乳腺癌72基因分子分型中的her2富集型乳腺癌病例中,基于基因群g1计算的干扰素指数的强弱对10年无远处转移生存率的影响。
24.图2表示在乳腺癌72基因分子分型中的基底细胞型、免疫增强型、管腔a型和管腔b型乳腺癌病例中,基于基因群g1计算的干扰素指数的强弱对10年无远处转移生存率的影响。
25.图3表示在乳腺癌72基因分子分型中的her2富集型乳腺癌病例中,基于基因群g2、或者全部29个基因计算的干扰素指数的强弱分别对10年无远处转移生存率的影响。
26.图4表示在乳腺癌72基因分子分型中的her2富集型乳腺癌病例中,基因群g1中各各基因表达水平的强弱对10年无远处转移生存率的影响。
27.图5表示在her2阳性的乳腺癌病例中,基于基因群g1计算的干扰素指数的强弱对10年无远处转移生存率的影响(图5左);在her2阴性的乳腺癌病例中,基于基因群g1计算的干扰素指数的强弱对10年无远处转移生存率的影响(图5右)。
28.图6表示在her2阳性且在乳腺癌72基因分子分型中为her2富集型的乳腺癌病例中,基于基因群g1计算的干扰素指数的强弱对10年无远处转移生存率的影响。
具体实施方式
29.一般定义和术语
30.以下将对本发明进一步详细说明,应理解,所述用语旨在描述目的,而非限制本发明。
31.除非另有说明,本文使用的所述技术和科学术语具有与本发明所属领域技术人员通常所理解的相同的含义。若存在矛盾,则以本申请提供的定义为准。当以范围、优选范围、或者优选的数值上限以及优选的数值下限的形式表述某个量、浓度或其他值或参数的时候,应当理解相当于具体揭示了通过将任意一对范围上限或优选数值与任意范围下限或优选数值结合起来的任何范围,而不考虑该范围是否具体揭示。除非另有说明,本文所列出的数值范围旨在包括范围的端点和该范围内的所有整数和分数(小数)。
32.术语“约”、“大约”当与数值变量并用时,通常指该变量的数值和该变量的所有数值在实验误差内(例如对于平均值95%的置信区间内)或在指定数值的
±
10%内,或更宽范围内。
33.术语“任选”或“任选存在”是指随后描述的事件或情况可能发生或可能不发生,该描述包括发生所述事件或情况和不发生所述事件或情况。例如,当某个基团描述为任选地被取代时,其可以是未被取代的,也可以是被取代的,例如被一个或多个独立地选自本文所述的那些取代基取代。本领域技术人员应当理解,任选还涵盖取代基的种类和数目可以任意选择和组合的含义,只要形成的化合物是稳定的。
34.表述“包含”或与其同义的类似表述“包括”、“含有”和“具有”等是开放性的,不排除额外的未列举的元素、步骤或成分。表述“由...组成”排除未指明的任何元素、步骤或成分。表述“基本上由
……
组成”指范围限制在指定的元素、步骤或成分,加上任选存在的不会实质上影响所要求保护的主题的基本和新的特征的元素、步骤或成分。应当理解,表述“包含”涵盖,表述“基本上由
……
组成”和“由
……
组成”。
35.表述“和/或”涵盖“和”以及“或”的情形。例如“a和/或b”涵盖a、b、a和b三种情形。又例如,“a、和/或b、和/或c”可以以类似的方式理解,也可以表示为从a、b、c及其任意组合中选择至少一个,示例性地涵盖a、b、c、a+b、a+c、b+c、a+b+c。
36.表述“至少一个(种)”或者类似的表述“一个(种)或多个(种)”表示1个(种)、2个(种)、3个(种)、4个(种)、5个(种)、6个(种)、7个(种)、8个(种)、9个(种)或者更多个(种)。例如,当指包含17个基因群中的至少1个时,其可以表示例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16或17个。
[0037]“乳腺癌”起源于乳腺各级导管和腺泡上皮,由腺上皮增生到不典型增生而逐步发
展形成。依据癌细胞对周围组织的侵犯程度和远处转移可能性的大小,可将乳腺癌大体分为原位癌(非浸润性癌)、早期浸润性癌和浸润性癌。在一优选的实施方案中,乳腺癌为浸润性乳腺癌。优选地,乳腺癌为her2富集型或her2阳性乳腺癌。
[0038]
在本文中,术语“预后”是指对乳腺癌的病程和发展结果的预测,包括但不限于对乳腺癌复发的可能性的预测,复发可能性较低的乳腺癌的预后较好,反之则预后较差。
[0039]
在本文中,术语“复发”是指在指定观察期间内乳腺癌经治疗后肿瘤细胞的再次出现,根据再次发现肿瘤细胞的位置,可包括局部复发、区域复发或远处转移。在本文中,术语“复发”优先表现为乳腺癌远处转移或局部复发,更优先表现为远处转移。在本文中,术语“局部复发”是指早期乳腺癌乳房保留治疗后同侧乳腺内,或可手术乳腺癌乳房切除术后同侧胸壁再次出现肿瘤;“区域复发”是指患侧的淋巴引流区,包括腋窝、锁骨上/下及内乳淋巴结区域出现肿瘤;“远处转移”是指原发于乳腺的肿瘤转移到远处器官或淋巴结的现象。术语“无远处转移生存率”在本文中是指在指定观察期间内,乳腺癌病例中没有发生远处转移的比例。
[0040]
在本文中,术语“风险”指不确定事件发生的概率或可能性。因此,乳腺癌复发的可能性可表示为“复发风险”,包括但不限于发生乳腺癌局部复发、区域复发或远处转移的风险。在本文中,术语“复发风险”优先表示乳腺癌远处转移风险或局部复发风险,更优先表示远处转移风险,并可通过“无远处转移生存率”来体现。因此,在本文中,无远处转移生存率较高的乳腺癌,其复发风险较低,预后较好;无远处转移生存率较低的乳腺癌,其复发风险较高,预后较差。
[0041]
在本文中,术语“乳腺癌分子分型”是指基于乳腺癌肿瘤组织的基因表达谱(gene expression profile)建立的乳腺癌分类方法。
[0042]
可以使用的乳腺癌的分子分型系统包括但不限于pam50(prosigna)(参见,例如parker,j.s.et al.,supervised risk predictor of breast cancer based on intrinsic subtypes.j.clin.oncol.2009,27:1160-1167)和乳腺癌72基因分子分型(参见,例如yang b.et al.,an assessment of prognostic immunity markers in breast cancer.np j breast cancer,2018,4:35。如无特别指明,本文中使用的具体乳腺癌72基因分子分型为基于该文献公开的72基因分子分型)。作为示例,pam50将乳腺癌分为管腔a(luminal a)、管腔b(luminal b)、基底细胞型(basal-like)及her2富集型(her2-enriched)四个亚型。作为另一示例,乳腺癌72基因分子分型将乳腺癌分为管腔a、管腔b、基底细胞型、her2富集型和免疫增强型。在一优选的实施方案中,乳腺癌分子分型采用乳腺癌72基因分子分型系统。
[0043]
her2/neu(又名c-erbb2)基因编码的人类表皮生长因子受体2(her2蛋白)是受体酪氨酸激酶家族的成员之一,其为调控细胞生长、增殖与分化的重要蛋白。her2基因在多种肿瘤(尤其是在乳腺癌和胃癌)中均有扩增和/或过表达。
[0044]
在本文中,术语“her2阳性乳腺癌”是指采用一种或多种方法检测到her2基因的扩增和/或过表达,包括从核酸或多肽水平上检测到的基因的扩增和/或过表达。例如,通过免疫组化法(ihc)检测到her2蛋白的过表达、荧光原位杂交法(fish)检测到her2基因的扩增、二代测序方法检测到her2 mrna的高表达,但不限于此。
[0045]
在本文中,术语“her2富集型”乳腺癌是指采用例如pam50或乳腺癌72基因分子分
型对乳腺癌进行分子分型,归为her2富集型的乳腺癌。在上述两种分型体系中,her2富集型乳腺癌约占全部乳腺癌的12%左右,预后较差。
[0046]
在本文中,her2阳性乳腺癌可以是her2富集型,也可以是其他分子亚型(例如管腔a、管腔b、基底细胞型、免疫增强型);her2富集型乳腺癌可以是her2阳性,少部分也可以是her2阴性。
[0047]
在本文中,术语“干扰素”是一类由病毒或其他诱因刺激机体产生的一种具有抗病毒、生长抑制、免疫调节作用的细胞因子。干扰素作用于靶细胞的表面受体后,可通过一系列信号传导诱导多种基因的表达,从而激活人体免疫系统。不受任何机理限制,干扰素可调控多种与癌细胞的生长、增殖、分化、迁移或侵袭相关的基因的表达。干扰素可包括i型、ii型和iii型干扰素。在本文中,术语“干扰素乳腺癌治疗”指在乳腺癌临床治疗中应用上述一种或多种干扰素的治疗方案,可以单独应用和与其他治疗方案(例如手术治疗、靶向治疗、化疗等)联用。术语“干扰素乳腺癌治疗指导”是指对乳腺癌患者是否能够受益于“干扰素乳腺癌治疗”方案的预测。术语“干扰素通路信号相关基因”指其表达水平受干扰素调控的基因。在本文中,干扰素可以为i型干扰素。
[0048]
术语“干扰素指数”在本文中是指根据本发明的干扰素信号通路相关基因的表达水平计算的一个加权平均指数,其可用于评估her2富集型或her2阳性乳腺癌患者的复发风险。本文中,根据干扰素指数评分,可将乳腺癌分为干扰素指数强或弱两组。干扰素指数“强”的her2富集型或her2阳性乳腺癌患者的复发风险显著低于干扰素指数“弱”的患者。对于干扰素指数“弱”的患者,通过联合干扰素治疗,增强干扰素信号通路,有可能降低其乳腺癌的复发风险。
[0049]
在本文中,术语“多肽”是指由氨基酸以肽键连接组成的化合物,包括多肽的全长或氨基酸片段。在本文中,术语“目标多肽”优先指待检测基因编码的多肽、蛋白或蛋白片段。
[0050]
术语“核苷酸”包括脱氧核糖核苷酸和核糖核苷酸。术语“核酸”是指由两个或以上核苷酸组成的聚合物,涵盖脱氧核糖核酸(dna)、核糖核酸(rna)以及核酸类似物。在本文中,术语“目标核酸”优先指目标基因的dna、rna转录物或与rna转录物互补的cdna。术语“rna转录物”指总rna,包括编码或者非编码rna,例如mrna、rrna或trna,可直接来自于组织或外周血样本中,也可间接来自于细胞裂解后的组织或血液样本中。术语“mrna”可包括前体mrna和成熟mrna,既可为mrna全长也可为其片段。在本文中,可用于检测的rna优选为mrna,更优选为成熟mrna。术语“cdna”是指具有与rna互补碱基序列的dna。本领域技术人员可应用本领域已知方法由基因的dna获得其rna转录物和/或与其rna转录物互补的cdna,例如,通过化学合成方法或分子克隆方法。
[0051]
术语“杂交”是指在适当条件下,两个核酸片段通过稳定且特异的氢键结合,形成双螺旋复合物的过程。术语“探针”、“杂交探针”或“分子探针”是指包括至少5个核苷酸的核酸片段(可以为dna或rna),比如,包含5~1000个核苷酸,其能在指定条件下与目标核酸或其扩增产物杂交形成复合物。术语“taqman探针”是一种基于taqman技术的探针,其5’末端携带荧光基团,例如fam、tet、hex、ned、vic或cy5等,3’末端携带荧光淬灭基团(例如tamra和bhq基团)或非荧光淬灭基团(taqman mgb探针),具有能够与目标核酸杂交的核苷酸序列,当应用于实时荧光定量pcr(rt-pcr)时可报告与其形成复合物的核酸的量。术语“扩增
引物”或“引物”,是指包含5~100个核苷酸的核酸片段,优选地,包含能起始酶促反应(如,酶促扩增反应)的15~30个核苷酸。
[0052]
术语“参考基因”在本文中指能够作为参照物用于校正和标准化目标基因的表达水平的基因,可以考虑的参考基因纳入标准有:(1)在组织中稳定表达,其表达水平不受病理状况或药物治疗影响或者影响较小;(2)表达水平不宜过高,以避免在表达数据(如通过二代测序获得)获取的数据中占比过高,影响其他基因的数据检测和解读的准确性。因此,可用于检测本发明的参考基因表达水平的试剂也在本发明的保护范围之内。
[0053]
本文所述的基因表达水平的检测可通过检测核酸或多肽的量来实现,并可使用本领域的常规技术而没有任何限制。在所述检测中,目标多肽的量,可以针对样本中总蛋白的量或参考基因所编码的多肽的量来标准化。在所述检测中,目标核酸的量,例如目标基因的dna、其rna转录物或与rna转录物互补的cdna的量,可以针对样本中总dna、总rna或总edna的量或者针对一组参考基因的dna、rna转录物或与rna转录物互补的cdna的量来标准化。
[0054]
本发明的基因群
[0055]
在一方面,本发明涉及用于进行乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导的基因群。在一些实施方案中,根据本发明的基因群中基因的表达水平的强弱进行乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导。在另一些实施方案中,根据本发明的干扰素指数的强弱进行乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导,其中所述干扰素指数是基于本发明的基因群中各基因的表达水平及其各自对乳腺癌复发风险的贡献计算所得。所述基因的表达水平的强弱或所述干扰素指数的强弱是进行受试对象的乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导的充分指示。优选地,所述乳腺癌是her2富集型或her2阳性乳腺癌。在一优选实施方案中,所述干扰素是i型干扰素。
[0056]
在本发明的实施方案中,本发明的基因群包括基因群g1中基因的至少1个,和/或基因群g2中基因的至少1个,和/或基因群r中基因的至少1个。
[0057]
基因群g1包括以下基因:ifi35、ifit3、oas2、oasl、rtp4和samd9(信息可以参见表1)。
[0058]
基因群g2包括以下基因:oas3、ddx58、sp110、ifih1、ddx60和xaf1(信息可参见表1)。
[0059]
基因群r包括以下基因:eif2ak2、herc5、herc6、ifi27、ifi44、ifi44l、ifi6、ifit1、ifit5、ifitm1、isg15、mx1、mx2、oas1、plscr1、rsad2和usp18(信息可以参见表1)。
[0060]
本领域技术人员应当理解,基因群g1、基因群g2、基因群r的名称仅为了分组方便使用,并不具有特定的指代性含义。根据本发明的各种实施方案,本发明的基因群可以涵盖基因群g1、和/或基因群g2、和/或基因群r中各自的一个或多个基因,或其任意组合,或者也可以涵盖基因群g1、和/或基因群g2、和/或基因群r的全部。本领域技术人员还应当理解,表述“基因群g1中基因的至少1个,和/或基因群g2中基因的至少1个,和/或基因群r中基因的至少1个”以和上文类似的方式理解,也可以表示为对于基因群g1、g2和r而言,本发明的基因群方案可以从其中一个或多个进行选择,例如g1、g2、r、g1和g2、g1和r、g2和r、g1和g2和r。在此基础上,在每种情况下,在g1、g2和r中再各自独立地选择至少一个基因。
[0061]
在一实施方案中,本发明的基因群包括基因群g1中基因的至少1个,例如1、2、3、4、5或6个。在涉及基因群g1的一优选实施方案中,本发明的基因群包括samd9和/或以下基因
中的至少1个:ifi35、ifit3、oas2、oasl和rtp4。应当理解,samd9和/或(ifi35、ifit3、oas2、oasl和rtp4)中的至少1个的方案属于基因群g1(例如其中至少1个基因)的一具体方案。更优选地,本发明的基因群包括ifi35、ifit3、oas2、oasl、rtp4和samd9。
[0062]
在另一实施方案中,本发明的基因群包括基因群g2中基因的至少1个,例如1、2、3、4、5或6个。在优选的实施方案中,本发明的基因群包括oas3、ddx58、sp110、ifih1、ddx60和xaf1。
[0063]
在一优选的实施方案中,本发明的基因群包括基因群g1中基因的至少1个,以及基因群g2中基因的至少1个。在优选的实施方案中,本发明的基因群包括samd9,和/或(ifi35、ifit3、oas2、oasl和rtp4)中的至少1个,和/或基因群g2中的至少1个。在又一实施方案中,本发明的基因群包括基因群g1中的全部基因,和基因群g2中的至少1个。或者,本发明的基因群包括基因群g2中的全部基因,和基因群g1中的至少1个。在更优选的实施方案中,本发明的基因群包括基因群g1的全部基因,和基因群g2的全部基因。
[0064]
在另一实施方案中,本发明的基因群包括所述基因群r中的至少1个,例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16或17个。
[0065]
在又一优选实施方案中,本发明的基因群包括基因群g1中的至少1个,和/或基因群g2中的至少1个,以及基因群r中的至少1个。在优选的实施方案中,本发明的基因群包括samd9,和/或(ifi35、ifit3、oas2、oasl和rtp4)中的至少1个,和/或基因群g2中的至少1个,以及基因群r中的至少1个。
[0066]
在又一优选实施方案中,本发明的基因群包括基因群g1中的全部基因,和基因群g2中的至少1个,以及基因群r中的至少1个。或者,本发明的基因群包括基因群g2中的全部基因,和基因群g1中的至少1个,和基因群r中基因的至少1个。
[0067]
在一具体的实施方案中,本发明的基因群包括基因群g1中的全部基因,和/或基因群g2中的全部基因,和/或基因群r中的全部基因。
[0068]
在一实施方案中,除了上文所述的基因群g1和/或基因群g2和/或基因群r中的基因外,本发明的基因群还可以包括参考基因。优选地,所述参考基因包括以下中的至少1个(例如1、2、3、4、5、6、7或8个)、更优选3个、最优选6个:gapdh、gusb、mrpl19、psmc4、sf3a1、tfrc、actb、rplp0(信息还可参见表1)。
[0069]
在一示例性实施方案中,本发明的基因群包括基因群g1中的至少1个、以及(actb、gapdh和rplp0)中的至少1个。
[0070]
在一示例性实施方案中,本发明的基因群包括基因群g2中的至少1个、以及(actb、gapdh和rplp0)中的至少1个。
[0071]
在另一示例性实施方案中,本发明的基因群包括基因群g1中的至少1个、基因群g2中的至少1个、以及(gapdh、gusb、mrpl19、psmc4、sf3a1和tfrc)中的至少1个。
[0072]
在一优选实施方案中,本发明的基因群包括:ifi35、ifit3、oas2、oasl、rtp4和samd9;以及actb、gapdh和rplp0。在一实施方案中,本发明的基因群中的基因的信息还可以参见表3。
[0073]
在另一优选实施方案中,本发明的基因群包括:oas3、ddx58、sp110、ifih1、ddx60和xaf1;以及actb、gapdh和rplp0。
[0074]
在另一实施方案中,本发明的基因群包括:ddx58、ddx60、eif2ak2、herc5、herc6、
ifi27、ifi35、ifi44、ifi44l、ifi6、ifih1、ifit1、ifit3、ifit5、ifitm1、isg15、mx1、mx2、oas1、oas2、oas3、oasl、plscr1、rsad2、rtp4、samd9、sp110、usp18和xaf1;以及gapdh、gusb、mrpl19、psmc4、sf3a1和tfrc。在一实施方案中,本发明的基因群中的基因的信息还参见表2。
[0075]
表1
[0076][0077]
表2
[0078]
序号功能基因名基因身份号码id1干扰素通路相关基因ddx58nm_0143142干扰素通路相关基因ddx60nm_017631
3干扰素通路相关基因eif2ak2nm 0011356514干扰素通路相关基因herc5nm_0163235干扰素通路相关基因herc6nm_0011651366干扰素通路相关基因ifi27nm_0011300807干扰素通路相关基因ifi35nm_0055338干扰素通路相关基因ifi44nm_0064179干扰素通路相关基因ifi44lnm_00682010干扰素通路相关基因ifi6nm_00203811干扰素通路相关基因ifih1nm_02216812干扰素通路相关基因ifit1nm_00127092713干扰素通路相关基因ifit3nm_00103168314干扰素通路相关基因ifit5nm_01242015干扰素通路相关基因ifitm1nm_00364116干扰素通路相关基因isg15nm_00510117干扰素通路相关基因mx1nm_00114492518干扰素通路相关基因mx2nm_00246319干扰素通路相关基因oas1nm_00103240920干扰素通路相关基因oas2nm_00103273121干扰素通路相关基因oas3nm_00618722干扰素通路相关基因oaslnm_00126182523干扰素通路相关基因plscr1nm_02110524干扰素通路相关基因rsad2nm_08065725干扰素通路相关基因rtp4nm_02214726干扰素通路相关基因samd9nm_00119330727干扰素通路相关基因sp110nm_00118501528干扰素通路相关基因usp18nm_01741429干扰素通路相关基因xaf1nm_01752330参考基因gapdhnm_00204631参考基因gusbnm_00018132参考基因mrpl19nm_01476333参考基因psmc4nm_00650334参考基因sf3a1nm_00587735参考基因tfrcnm_003234
[0079]
表3
[0080]
序号功能基因名基因身份号码d1干扰素通路相关基因ifi35nm_0055332干扰素通路相关基因ifit3nm_0010316833干扰素通路相关基因oas2nm_0010327314干扰素通路相关基因oaslnm_001261825
5干扰素通路相关基因rtp4nm_0221476干扰素通路相关基因samd9nm_0011933077参考基因actbnm_0011018参考基因gapdhnm_0020469参考基因rplp0nm_001002
[0081]
本领域技术人员应当理解,上述表1、表2和表3以及下文中的其他类似表格仅为了列举信息使用,除非明确指明,否则并不表示必须将同一表格中的所有条目一起使用。
[0082]
在具体实施方案中,本发明的基因群可用于进行乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导。优选地,所述乳腺癌是her2富集型或her2阳性乳腺癌。在一优选实施方案中,所述干扰素是i型干扰素。
[0083]
可以使用本发明的基因群进行乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导的受试对象可以为接受了her2或her2相关基因状态评估的受试对象,例如采用一种或多种方法检测到受试对象的样本中her2基因的扩增和/或过表达,或者采用一种或多种乳腺癌分子分型系统进行了乳腺癌分子分型。作为示例性实施方案,可以使用pam50或乳腺癌72基因分子分型(优选后者),进行评估或分型。在一优选的实施方案中,受试对象归类为“her2阳性乳腺癌”或“her2富集型”乳腺癌。更优选地,这样的归类使用pam50或乳腺癌72基因分子分型(特别优选后者)进行。
[0084]
本发明的试剂与论断产品
[0085]
在又一方面,本发明提供一种用于检测本发明基因群中基因的表达水平的试剂及其在制备诊断产品中的应用。所述试剂或诊断产品可以用于进行乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导。优选地,所述乳腺癌是her2富集型或her2阳性乳腺癌。在一优选实施方案中,所述干扰素是i型干扰素。其中所述基因群如上文所述。本领域技术人员应当理解,试剂或诊断产品中的选择可以各自对应于本发明的基因群中的基因。作为示例,当列举出多个选择,例如seq id no:1-70的引物时,并不表示本发明的试剂或诊断产品必须包含全部这些引物,而是表示所述试剂或诊断产品会包含其中所涵盖基因所对应的那些引物。这适用于上文所述的基因群g1、和/或基因群g2、和/或基因群r、和/或参考基因中的基因。
[0086]
在可选的方案中,所述试剂为检测所述基因编码的多肽的量的试剂。优选地,所述试剂为抗体、抗体片段或者亲和性蛋白,其能够与所述基因编码的多肽特异性结合。更优选地,所述试剂为能够与所述基因编码的多肽特异性结合的抗体或抗体片段。所述抗体、抗体片段或者亲和性蛋白还可带有用于检测的标记物,例如酶(例如过氧化物辣根酶)、放射性同位素、荧光标记物(例如alexa fluor染料、fitc、texas red、cy3、cy5等)、化学发光物质(例如鲁米诺)、生物素、量子点标记(qdot)等。因此,在一优选的方案中,所述试剂为能够与所述基因编码的多肽特异性结合的抗体或抗体片段,并且可选地带有用于检测的标记物,所述标记物选自酶、放射性同位素、荧光标记物、化学发光物质、生物素、量子点标记。在一实施方案中,所述试剂用于制备诊断产品,所述诊断产品为蛋白芯片(例如蛋白质微阵列)、elisa诊断试剂盒或免疫组化(ihc)试剂盒。
[0087]
在优选的方案中,所述试剂为用于检测所述基因的核酸(例如所述基因的dna、rna转录物或与rna转录物互补的cdna)的量的试剂,优选地,为用于检测所述基因转录的rna,
特别是mrna的量的试剂,或者检测与mrna互补的cdna的量的试剂。优选地,所述试剂为探针或引物或其组合,其中所述探针或引物能够与本发明的基因群的基因、其rna转录物或与rna转录物互补的cdna的部分序列互补,其序列没有限制,优选具有高特异性。所述探针或引物可以是人工合成的。
[0088]
在一优选方案中,所述试剂为引物。在一实施方案中,所述引物用于定量pcr,包括但不限于半定量pcr和rt-pcr。在一实施方案中,所述用于定量pcr的引物的序列如seq id no.71-seq id no.88所示(又参见表6)。在又一实施方案中,所述引物用于二代测序,优选地用于靶向测序。在一具体实施方案中,所述引物用于靶向测序且具有如seq id no.1-seq id no.70所示的序列(又参见表5)。在一实施方案中,所述引物用于制备诊断产品,所述诊断产品为基于靶向测序的二代测序试剂盒或实时荧光定量pcr试剂盒。
[0089]
在一方案中,所述试剂为探针,包括但不限于用于实时荧光定量pcr(rt-pcr)、原位杂交(ish)、dna印记或rna印记、基因芯片技术等检测的探针。
[0090]
在一优选方案中,所述探针为用于rt-pcr的探针。优选地,所述探针的序列如seq id no.89-seq id no.97所示(又参见表6)。优选地,所述探针为taqman探针。在一具体的实施方案中,所述探针为具有如seq id no.89-seq id no.97所示序列的taqman探针。在一实施方案中,所述探针可用于制备诊断产品,所述诊断产品为实时荧光定量pcr检测试剂盒。
[0091]
在另一优选方案中,所述试剂为可用于rt-pcr的探针和引物。在一优选的方案中,所述探针为taqman探针。在一更优选的方案中,所述探针的序列如seq id no.89-seq id no.97所示(又参见表6)。在一具体的实施方案中,所述探针为具有如seq id no.89-seq id no.97所示序列的taqman探针。在一优选方案中,所述引物的序列如seq id no.71-seq id no.88所示(又参见表6)。在一更优选的方案中,所述探针和引物的序列如表6所示(seq id no.71-97)。在一具体方案中,所述试剂为可用于rt-pcr的探针和引物,其中所述探针为taqman探针且具有如seq id no.89-seq id no.97所示序列(又参见表6),所述引物的序列如seq id no.71-seq id no.88所示(又参见表6)。在一实施方案中,所述探针和引物可用于制备诊断产品,所述诊断产品为实时荧光定量pcr检测试剂盒。
[0092]
在一方案中,所述探针为能够用于原位杂交的探针,例如用于双色银染原位杂交(dish)、dna荧光原位杂交(dna-fish)、rna荧光原位杂交(rna-fish)、显色原位杂交(cish)等的探针,所述探针可带有标记物,所述标记物可为荧光基团(例如alexafluor染料、fitc、texas red、cy3、cy5等)、生物素、地高辛等。在另一方案中,所述探针能够用于基因芯片检测,所述探针还可带有标记物,所述标记物可为荧光基团。在一具体实施方案中,所述探针可用于制备诊断产品,所述诊断产品为基因芯片。
[0093]
在另一方面,本发明提供一种诊断产品,其可用于进行乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导。所述产品包含检测本发明的基因群中基因的表达水平的试剂。所述基因群如上文所述。所述试剂如上文所述。优选地,所述乳腺癌是her2富集型或her2阳性乳腺癌。在一优选实施方案中,所述干扰素是i型干扰素。
[0094]
在一实施方案中,所述诊断产品为体外诊断产品的形式,其包含本发明所述的试剂。
[0095]
在一具体实施方案中,所述诊断产品为诊断试剂盒的形式,其包含本发明所述的试剂。
[0096]
在一具体实施方案中,所述诊断产品可以为蛋白质微阵列、elisa诊断试剂盒或免疫组化(ihc)试剂盒、二代测序试剂盒、实时荧光定量pcr试剂盒、基因芯片或其组合。
[0097]
在一具体实施方案中,所述诊断产品为基于实时荧光定量pcr的诊断产品,其包含如上所述的引物和/或探针。在又一具体实施方案中,所述诊断产品为基于实时荧光定量pcr的诊断产品,其包含核苷酸序列如表6所示的引物和/或探针。
[0098]
在一优选的实施方案中,所述诊断产品可还包括选自以下组中的至少一个:总rna抽提试剂、逆转录试剂、二代测序试剂、定量pcr试剂。
[0099]
所述总rna抽提试剂可为本领域常规的总rna抽提试剂。其实例包括但不限于rna storm cd201(cell data sciences)、rneasy ffpe kit(qiagen,#73504)、purelink rna mini kit(invitrogen)。
[0100]
所述逆转录试剂可以为本领域常规的逆转录试剂,并且优选地包括dntp溶液和/或rna逆转录酶。逆转录试剂的实例包括但不限于neb公司的ii逆转录酶(new england biolabs,#m0368l)、thermofisher公司的revertaid第一链cdna合成试剂盒(revertaid first strand edna synthesis kit,thermofisher,#k1622)、abi公司的taqman microrna逆转录试剂盒(taqman
tm microrna reverse transcription kit,applied biosystems,#4366596)。
[0101]
所述二代测序试剂可为本领域常规使用的试剂,只要能够满足对目标核酸进行二代测序的要求即可。二代测序试剂可以为市售产品,其实例包括但不限于illumina公司的reagent kit(illumina,#ms-102-3001)和targeted rna index kit a-96 indices(illumina,#rt-402-1001)。二代测序技术为本领域常规的二代测序技术,优选为靶向rna-seq技术。因此,所述二代测序试剂还可包括可供构建靶向rna-seq的文库illumina定制的试剂,例如illumina公司的targeted rna custom panel kit(illumina,#rt-102-1001)。
[0102]
所述定量pcr试剂为本领域常规使用的试剂,只要能够满足对目标核酸进行定量pcr的要求即可。所述定量pcr试剂较佳地为市售可得。所述定量pcr试剂为本领域常规的定量pcr试剂,且优选地包括dntp溶液、dna聚合酶。所述定量pcr试剂优选地为可用于实时荧光定量pcr的试剂,例如含有sybr green染料或用于taqman实时荧光定量pcr的试剂,更优选的为用于taqman实时荧光定量pcr的试剂。所述定量pcr试剂可选地包括可供构建定量pcr的文库的试剂。可通过可进行实时荧光定量检测的pcr仪(例如abi 7500实时荧光定量pcr仪(applied biosystems)或罗氏的480ii)进行实时荧光定量pcr反应并计算基因表达水平。
[0103]
在一具体实施方案中,所述诊断产品为基于靶向rna-seq的二代测序试剂盒,其包含核苷酸序列如表5所示的引物和选自以下组中的至少一个:总rna抽提试剂、逆转录试剂、二代测序试剂。其中所述总rna抽提试剂、逆转录试剂、二代测序试剂如上所述。优选地,所述二代测序试剂为可供构建靶向rna-seq的文库illumina定制的试剂。
[0104]
在一具体实施方案中,所述诊断产品为基于实时荧光定量pcr的pcr检测试剂盒,其包含核苷酸序列如表6所示的引物和/或探针和选自以下组中的至少一个:总rna抽提试剂、逆转录试剂、定量pcr试剂。其中所述总rna抽提试剂、逆转录试剂、定量pcr试剂如上所
述。优选地,所述定量pcr试剂为实时荧光定量pcr试剂。
[0105]
本发明的诊断产品(优选试剂盒的形式)还优选地包括从受试对象提取检测样本的器械;例如从受试对象体内提取组织或血液的器械,优选任何能用于取血的采血针、注射器等。所述受试对象为哺乳动物,优选为人,特别是患有乳腺癌的患者,更优选为her2富集型或her2阳性乳腺癌患者。
[0106]
适用于本发明的试剂或诊断产品的受试对象可以为接受了her2或her2相关基因状态评估的受试对象,例如采用一种或多种方法检测到受试对象的样本中her2基因的扩增和/或过表达,或者采用一种或多种乳腺癌分子分型系统进行了乳腺癌分子分型。作为示例性实施方案,可以使用pam50或乳腺癌72基因分子分型(优选后者),进行评估或分型。在一优选的实施方案中,受试对象归类为“her2阳性乳腺癌”或“her2富集型”乳腺癌患者。更优选地,这样的归类使用pam50或乳腺癌72基因分子分型(特别优选后者)进行。
[0107]
本发明的方法和应用
[0108]
在又一方面,本发明还涉及一种用于确定受试对象乳腺癌的复发风险和/或进行干扰素乳腺癌治疗指导的方法,所述方法包括:
[0109]
(1)提供受试对象的样本,
[0110]
(2)测定所述样本中本发明的基因群中基因的表达水平,任选地,根据所述表达水平计算干扰素指数,
[0111]
(3)判断(2)中所述表达水平的强弱或所述干扰素指数的强弱,
[0112]
(4)根据(3)中所述表达水平的强弱或所述干扰素指数的强弱确定所述受试对象的乳腺癌复发风险和/或进行干扰素乳腺癌治疗指导。
[0113]
用于本发明的方法的受试对象为哺乳动物,优选为人,特别是乳腺癌患者。所述乳腺癌优选为her2富集型或her2阳性乳腺癌。所述干扰素可以为i型干扰素。
[0114]
在步骤(1)中使用的样本没有特别的限制,只要能从其中获得基因群中的基因的表达水平即可,例如可以从所述样本提取受试对象的基因组总rna、总蛋白等,优选为总rna。所述样本优选地为组织、血液、血浆、体液或其组合的样本,优选为组织样本,特别是石蜡组织样本。在优选的实施方案中,样本为肿瘤组织样本或包含肿瘤细胞的组织样本。在本发明的实施方案中,所述受试对象的样本可以为接受了her2或her2相关基因状态评估的样本,例如采用一种或多种方法检测到受试对象的样本中her2基因的扩增和/或过表达,或者采用一种或多种乳腺癌分子分型系统对受试对象的样本进行了乳腺癌分子分型。作为示例性实施方案,可以使用pam50或乳腺癌72基因分子分型(优选后者),进行评估或分型。在一优选的实施方案中,所述受试对象的样本为归类为“her2阳性乳腺癌”或“her2富集型”乳腺癌的样本。更优选地,这样的归类使用pam50或乳腺癌72基因分子分型(特别优选后者)进行。
[0115]
步骤(2)中可采用多种方法测定本发明的基因群中基因的表达水平,包括但不限于检测所述基因的核酸和其编码的多肽的量。本领域技术人员可根据需要选择步骤(1)中的样本种类和样本量,并选择本领域的常规技术实现步骤(2)所述测定。
[0116]
在一实施方案中,步骤(2)可通过检测所述基因编码的多肽的量来实现。所述检测可通过如上所述的试剂与本领域已知的技术来实现,其中所述技术包括但不限于酶联免疫吸附分析法(elisa)、化学发光免疫分析技术(例如免疫化学发光分析、化学发光酶免疫分
析、电化学发光免疫分析)、流式细胞术、免疫组化法(ihc)。
[0117]
在一优选实施方案中,步骤(2)可通过检测所述基因的核酸的量实现。所述检测可通过如上所述的试剂与本领域已知的技术来实现,其中所述技术包括但不限于分子杂交技术、定量pcr技术或核酸测序技术等来实现。分子杂交技术包括但不限于ish技术(例如dish、dna-fish、rna-fish、cish技术等)、dna印记或rna印记技术、基因芯片技术(例如微阵列芯片或微流控芯片技术)等,优选原位杂交技术。定量pcr技术包括但不限于半定量pcr和rt-pcr技术,优选rt-pcr技术。核酸测序技术包括但不限于sanger测序、二代测序(ngs)、三代测序、单细胞测序技术等,优选二代测序,更优选靶向rna-seq技术。
[0118]
在一优选实施方案中,在步骤(2)中,采用二代测序技术测定本发明的基因群中基因的表达水平。所述基因群如上文所述,并且还可参见表2。在一具体的实施方案中,步骤(2)可包括:
[0119]
(2-1)提取样本中的总rna;
[0120]
(2-2)将(2-1)所述总rna转化为cdna,然后将其制备成可用于二代测序的文库;
[0121]
(2-3)对步骤(2-2)获得的文库进行测序。
[0122]
步骤(2-1)的提取可以通过本领域常规方法进行,优选地利用可商购的rna提取试剂盒提取受试对象的新鲜冷冻组织或石蜡包埋组织的总rna。
[0123]
在一优选的实施方案中,步骤(2-2)可包括以下步骤:(i)将提取的总rna反转录生成如表2所述的35个基因的cdna;(ii)将所得cdna制备成可供测序的文库。
[0124]
步骤(2-3)可通过rna测序完成。利用试剂盒中的引物对表2所示的基因进行扩增,根据步骤(2-2)所制备的文库的不同,可对所得基因进行二代测序。优选地,所述二代测序为靶向rna-seq技术,可利用illumina nextseq/miseq/miniseq/iseq测序仪进行双端测序或单端测序。
[0125]
在另一优选的实施方案中,在步骤(2)中,采用rt-pcr方法测定本发明的基因群中基因的表达水平。所述基因群如上文所述,并且还可参见表3。在一具体的实施方案中,步骤(2)可以包括:
[0126]
(2-1)提取样本中的总rna;
[0127]
(2-2)将(2-1)所述总rna反转录为cdna;
[0128]
(2-3)将所获得cdna进行rt-pcr检测。
[0129]
步骤(2-1)的提取可以通过本领域常规方法进行,优选地利用可商购的rna提取试剂盒rna提取试剂盒提取受试对象的新鲜冷冻组织或石蜡包埋组织的总rna。
[0130]
步骤(2-2)所述反转录可使用可商购的逆转录试剂盒进行。
[0131]
在一优选实施方案中,步骤(2-3)所述rt-pcr方法为taqman rt-pcr,可使用引物和探针对如表3所示的基因分别进行rt-pcr检测,所述引物和探针如上所述,所述探针为taqman探针。优选地所述引物和探针的序列如表6所示。
[0132]
在可选的实施方案中,步骤(2-3)所述rt-pcr方法为基于sybr green染料的rt-pcr,可使用引物和可商购的sybr green预混物对表6所示基因分别或同时进行检测,所述引物如上所述。优选地,所述引物的序列如seq id no.71-seq id no.88所示(又参见表6)。上述rt-pcr检测可使用abi 7500实时荧光定量pcr仪(applied biosystems)或罗氏的480ii)进行。反应结束后,记录每个基因的ct值,代表了各个基因的表达水
平。
[0133]
在一实施方案中,步骤(3)可以通过例如以下步骤进行:
[0134]
(3-1)根据本发明的基因群中的基因在具有统计学显著性数量的her2富集型或her2阳性乳腺样本中的表达数据,结合生存数据,采用本领域已知的统计学软件(例如x-tile软件、spss或其他能够用于计算临界值的分析软件,优选x-tile软件)进行生存分析,取得能最大限度区分生存曲线差异的表达值作为临界值(cut-offvalue);
[0135]
(3-2)基于步骤(3-1)所述临界值,判断步骤(2)中获得的所述基因在所述受试对象样本中的表达水平为强(表达水平>临界值)或弱(表达水平≤临界值);
[0136]
(3-3)步骤(3-2)中所述基因表达水平的强弱是进行受试对象的乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导的充分指示。
[0137]
在获得本发明的基因群中的基因的表达水平的数据之后,本领域技术人员能够应用本领域已知技术,结合生存数据进行生存分析,来获得所述临界值,并判断本发明的基因群中的基因的表达水平为强或弱。
[0138]
在一优选实施方案中,步骤(3)可以通过以下步骤进行:
[0139]
(3-1)通过将步骤(2)中测序或定量pcr的检测结果进行分析,结合生存数据,采用本领域已知的统计学软件,获得本发明的基因群中各基因对发生乳腺癌转移的影响,根据各基因对远处转移影响的贡献,获得对远处转移影响的贡献最大的一组干扰素通路相关基因(即优选干扰素通路相关基因),对所述优选干扰素通路相关基因采用加权法计算干扰素指数;
[0140]
(3-2)判断所述干扰素指数为强或弱(对于干扰素指数的计算方式和强弱的判断的详细描述可参见实施例1和2);
[0141]
(3-3)步骤(3-2)中所述干扰素指数的强弱是进行受试对象的乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导的充分指示。
[0142]
在获得本发明的基因群中的基因的表达水平的数据之后,本领域技术人员能够应用本领域已知技术,结合生存数据进行生存分析,来获得本发明的基因群中各基因对发生乳腺癌转移的影响并计算干扰素指数,以及判断干扰素指数为强或弱。
[0143]
本发明的检测方法可用于诊断目的或非诊断目的。
[0144]
本发明还提供了本发明的基因群或本发明的试剂在制备诊断产品中的应用,所述诊断产品用于乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导。所述基因群如上所述。所述试剂如上所述。优选地,所述乳腺癌优选为her2富集型或her2阳性乳腺癌。在一优选实施方案中,所述干扰素是i型干扰素。
[0145]
在优选的实施方案中,所述诊断产品为检测试剂盒的形式。
[0146]
因此在另一方面,本发明还提供用于进行乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导的诊断产品,其包含本发明的试剂。优选地,所述乳腺癌优选为her2富集型或her2阳性乳腺癌。在一优选实施方案中,所述干扰素是i型干扰素。
[0147]
本发明的试剂或诊断产品,还可与其他诊断产品联合使用,所述其他诊断产品包括但不限于乳腺癌分子分型诊断产品和检测乳腺癌中her2表达水平的诊断产品,所述乳腺癌分子分型诊断产品可例如选自pam50和乳腺癌72基因分子分型,所述检测乳腺癌中her2表达水平的诊断产品可检测到her2基因的扩增和/或mrna的高表达(例如基于定量pcr、
dna-fish、rna-fish、cish、二代测序、基因芯片的诊断产品)和/或her2蛋白的过表达(例如基于ihc、elisa、蛋白质微阵列的诊断产品)。
[0148]
本发明所用的检测样本优选为来自检测对象(受试对象)的组织,只要能从检测样本中抽提检测对象的总rna即可。所述检测样本优选地为组织样本、血液、血浆和体液中的一种或几种,更优选地为组织样本,例如石蜡组织样本。在优选的实施方案中,检测样本为肿瘤细胞含量高的组织。
[0149]
有益效果
[0150]
本发明涉及一种基因群、用于检测所述基因群中基因的表达水平的试剂以及进行乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导的方法与诊断产品。
[0151]
目前可用于评估乳腺癌复发风险和指导临床治疗的多基因表达谱检测产品有oncotype dx、mammaprint、pam50、endopredict、乳腺癌72基因分子分型等。oncotype dx可用于评估早期、雌激素受体阳性的乳腺癌患者的复发风险并指导化疗或内分泌治疗的临床应用。mammaprint可用于评估淋巴结阴性、雌激素受体阴性或阳性的早期乳腺癌患者的远处转移风险并指导化疗的临床应用。pam50将乳腺癌分为管腔a、管腔b、基底细胞型及her2富集型四个亚型,并且可指导淋巴结阴性、激素受体阳性且her2阴性的乳腺癌患者的化疗或内分泌治疗。endopredict可用于评估er阳性/her2阴性的乳腺癌的远处转移风险,并且指导术后化疗的临床应用。乳腺癌72基因分子分型将乳腺癌分为管腔a、管腔b、基底细胞型、her2富集型及免疫增强型,并根据肿瘤的亚型、免疫指数和增殖指数评估乳腺癌10年内的复发风险。
[0152]
乳腺癌的高度异质性导致不同类型的乳腺癌对内分泌治疗、靶向治疗或化疗等治疗方案的敏感性及预后等方面均存在较大差异。对于her2富集型或her2阳性乳腺癌,“抗her2靶向治疗+化疗”是目前临床治疗的金标准,但由于her2相关的乳腺癌的病程发展迅速且预后较差,her2富集型或her2阳性乳腺癌的治疗难度较大。另一方面,her2阳性乳腺癌对“抗her2靶向治疗+化疗”的治疗方案的应答差异性较大。有研究表明,对her2阳性乳腺癌采用pam50分子分型,her2富集型(her2-enriched)占多数,但其他分子亚型均有一定比例。而抗her2靶向治疗+化疗的治疗方案对于her2富集型的治疗效果最好。因此,继续对乳腺癌进行细分,将提高乳腺癌的诊断与治疗效率。本发明提供的诊断产品,可将her2富集型或her2阳性乳腺癌再分别细分为干扰素强、弱两组,对于干扰素指数低、复发风险高的乳腺癌期望通过干扰素结合靶向治疗和化疗,降低复发风险,提高生存率,不仅可以提高乳腺癌的诊断与治疗效率,还可以提高预测乳腺癌复发风险的效率。
[0153]
目前已有的诊断产品中,多针对her2阴性的乳腺癌。本发明提供的诊断产品,将使乳腺癌患者,尤其是her2富集型或her2阳性乳腺癌的患者受益。此外,在乳腺癌的临床治疗指导方面,已有诊断产品可预测某些乳腺癌亚型的患者是否会受益于化疗或内分泌治疗方案,而尚未有针对干扰素治疗的临床治疗指导。本发明提供的方案将填补这一空白,指导干扰素在乳腺癌,尤其是her2富集型或her2阳性乳腺癌的临床治疗上的应用。本发明的另一优势在于,提供了多个可以选择的基因或基因组合作为补充的实施方案,当将本发明应用于癌症患者时,如果由于患者的病理状况或其他原因(例如某个或某些基因的表达异常)导致某个或某些基因的表达水平检测无效或失灵时,可以采用多个替代方案进行补充,使得基于本发明的检测结果更加稳定、可靠。
[0154]
实施例
[0155]
下面通过实施例进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之内。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0156]
实施例1:影响her2富集型乳腺癌的远处转移及疗效的基因群的筛选
[0157]
实验方法:通过对包括1655例病例的乳腺癌队列研究中基因表达谱及临床信息结合乳腺癌72基因分子分型进行epig监督性聚类分析,筛选出一组包括干扰素通路相关基因的基因群,其表达水平与her2富集型乳腺癌远处转移密切相关,但对于其他分子亚型的乳腺癌远处转移无显著相关性,有可能指导这一亚型乳腺癌的干扰素治疗。
[0158]
实验结果:
[0159]
1.根据cox’s回归分析的结果,共获得29个干扰素通路相关基因(参见表4)。为了更好地说明本发明的实施方案,将29个基因分组为g1、g2、r。但是,本发明的实施方式并不特别限制于这些分组的基因群和实施例中所用基因群。
[0160]
表4
[0161][0162]
2.将表4中29个干扰素通路相关基因,结合6个参考基因,组成一组35个基因测试组合(参见表2)。从表4中29个干扰素通路相关基因中,优选与her2富集型乳腺癌远处转移关系最为密切的6个基因(优选干扰素通路相关基因,参见表4基因群g1)结合3个参考基因,组成一组9个基因测试组合(参见表3)。
[0163]
实施例2:根据干扰素指数进行乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导
[0164]
实验方法:采用乳腺癌72基因分子分型对1655例乳腺癌肿瘤病例进行分子分型,基于参考基因(actb、gapdh和rplp0)的表达水平对干扰素通路相关基因的表达水平进行标准化,根据干扰素通路相关基因的标准化的表达水平以及其对发生乳腺癌转移影响的贡献,采用加权法计算干扰素指数,评估干扰素指数对不同分子亚型的发生乳腺癌远处转移的影响。
[0165]
2.1基于基因群g1计算干扰素指数,计算公式如下:
[0166]
未定标的干扰素指数(unscaled interferon score,uis)
[0167]
uis
g1
=0.23xsamd9+0.17x(rtp4+oasl)/2+0.15xifi35+0.14xifit3+0.12xoas2
[0168]
其中基因名表示该基因标准化的表达水平(例如,samd9表示samd9基因的标准化的表达水平),基因名前面的系数表示该基因的加权系数(例如,0.23表示samd9基因的加权系数)。
[0169]
干扰素指数(interferon score,is)
[0170]
干扰素指数(is)=30xuis+26
[0171]
干扰素指数弱:is 1-32;干扰素指数强:is 33-100。
[0172]
实验结果:
[0173]
1.干扰素指数对her2富集型乳腺癌复发风险的影响
[0174]
根据计算所得干扰素指数,可将乳腺癌病例分为干扰素指数强和干扰素指数弱两组。在her2富集型乳腺癌病例中,干扰素指数强的病例组10年无远处转移生存率显著高于指数弱的病例组(p<0.001)(图1),表明干扰素指数强的her2富集型乳腺癌患者的复发风险较低,预后较好。对于干扰素指数弱的her2富集型乳腺癌患者,通过联合干扰素治疗,增强干扰素信号通路,有可能降低其乳腺癌的复发风险。
[0175]
2.干扰素指数对其他分子亚型乳腺癌复发风险的影响
[0176]
同样以干扰素指数分组,对于管腔a型、管腔b型、基底细胞型及免疫增强型乳腺癌,干扰数指数强、弱病例组的10年无远处转移生存率无显著差异(图2),表明干扰素指数强弱与这几个亚型的乳腺癌患者的复发风险无显著相关性,干扰素指数强弱不影响这几个亚型的乳腺癌患者的预后。
[0177]
2.2基于表4中所示基因群g2中6个基因或者全部29个基因计算干扰素指数,计算公式如下:
[0178]
未定标的干扰素指数(unscaled interferon score,uis)
[0179]
基因群g2:
[0180]
uis
g2
=0.22xoas3+0.17x(ddx58+sp110)/2+0.15xifih1+0.14x(ddx60+xaf1)/2
[0181]
基于全部29个基因:
[0182]
uis
29
=0.098xsamd9+0.074x(rtp4+oasl)/2+0.062x(ifi35+ifit3)/2+0.052x(oas2+oas3)/2+0.040x(ddx58+sp110)/2+0.034x(ifih1+ddx60+xaf1+rsad2)/4+0.028x(herc5+mx2+ifi44+oas1+ifit5)/5+0.023x(ifi44l+plscr1)/2+0.017x(ifi27+mx1+ifi6+herc6)/4+0.012x(ifitm1+eif2ak2+isg15+ifit1)/4+0.006xusp18
[0183]
干扰素指数(interferon score,is)
[0184]
干扰素指数(is)=30xuis+26
[0185]
干扰素指数弱:is 1-32;干扰素指数强:is 33-100。
[0186]
1.干扰素指数对her2富集型乳腺癌复发风险的影响
[0187]
根据计算所得干扰素指数,可将乳腺癌病例分为干扰素指数强和干扰素指数弱两组。在her2富集型乳腺癌病例中,基于基因群g2的干扰素指数强的病例组,或者基于全部29个基因的干扰素指数强的病例组,10年无远处转移生存率均高于指数弱的病例组(图3),表明干扰素指数强的her2富集型乳腺癌患者的复发风险较低,预后较好。对于干扰素指数弱的her2富集型乳腺癌患者,通过联合干扰素治疗,增强干扰素信号通路,有可能降低其乳腺癌的复发风险。
[0188]
2.干扰素指数对其他分子亚型乳腺癌复发风险的影响
[0189]
所有干扰素指数对于管腔a型、管腔b型、基底细胞型及免疫增强型乳腺癌,干扰数指数强、弱病例组的10年无远处转移生存率无显著差异。
[0190]
实施例3:根据干扰素通路基因各自的表达水平对her2富集型乳腺癌进行复发风险评估和/或干扰素乳腺癌治疗指导
[0191]
实验方法:采用乳腺癌72基因分子分型对1655例乳腺癌肿瘤病例进行分子分型,基于参考基因(actb、gapdh和rplp0)的表达水平对干扰素通路相关基因的表达水平进行标准化,评估本发明的基因群g1中各基因(参见表4)的表达水平各自对her2富集型发生乳腺癌远处转移的影响,步骤如下:
[0192]
(i)根据每个基因在her2富集型乳腺癌患者人群的表达水平分布,结合生存数据,采用x-tile软件进行生存分析,取得能最大限度区分生存曲线差异的表达值作为临界值;
[0193]
(ii)基于所述临界值,判断所述基因的表达水平为强或弱;
[0194]
(iii)根据所述基因表达水平的强弱进行受试对象的乳腺癌复发风险评估和/或干扰素乳腺癌治疗指导。
[0195]
3.1根据基因群g1中6个基因(参见表4)各自的表达水平对her2富集型乳腺癌进行复发风险评估和/或干扰素乳腺癌治疗指导
[0196]
实验结果:
[0197]
根据基因群g1中6个基因(参见表4)各自的表达水平分值,可将her2富集型乳腺癌病例分别分为表达水平强和表达水平弱两组,其中各个基因表达水平强的病例组10年无远处转移生存率均高于基因表达水平弱的病例组(图4),表明优选干扰素通路相关基因表达水平强的her2富集型乳腺癌患者的复发风险较低,预后较好。对于干扰素通路相关基因表达水平弱的her2富集型乳腺癌患者,通过联合干扰素治疗,增强干扰素信号通路,有可能降低其乳腺癌的复发风险。
[0198]
3.2根据基因群g2、r中基因(参见表4)各自的表达水平对her2富集型乳腺癌进行复发风险评估和/或干扰素乳腺癌治疗指导
[0199]
实验结果:
[0200]
基因群g2、r中基因表达水平对her2富集型乳腺癌10年无远处转移生存率的影响与基因群g1中基因相似,但其影响效率相对小于基因群g1中基因(表4)。
[0201]
实施例4:根据干扰素指数的强弱对her2阳性乳腺癌进行复发风险评估和/或干扰素乳腺癌治疗指导
[0202]
实验方法:将1655例乳腺癌肿瘤病例分为her2阳性和her2阴性两组,评估干扰素指数对其发生乳腺癌远处转移的影响。
[0203]
基于基因群g1计算干扰素指数,计算方法同实施例2.1。
[0204]
实验结果:
[0205]
1.干扰素指数对her2阳性乳腺癌复发风险的影响
[0206]
在her2阳性乳腺癌病例中,干扰素指数强的病例组的10年无远处转移生存率显著高于指数弱的病例组(p<0.01)(图5左),表明干扰素指数强的her2阳性乳腺癌患者的复发风险较低,预后较好。对于干扰素指数弱的her2阳性乳腺癌患者,通过联合干扰素治疗,增强干扰素信号通路,有可能降低其乳腺癌的复发风险。
[0207]
2.干扰素指数对her2阴性乳腺癌复发风险的影响
[0208]
在her2阴性乳腺癌病例中,干扰素指数强、弱病例组的10年无远处转移生存率无显著差异(图5右),表明干扰素指数强弱与her2阴性乳腺癌患者的复发风险无显著相关性,不影响her2阴性乳腺癌患者的预后。
[0209]
实施例5:根据干扰素指数的强弱对her2阳性乳腺癌中的her2富集型乳腺癌进行复发风险评估和/或干扰素乳腺癌治疗指导
[0210]
实验方法:采用乳腺癌72基因分子分型,对实施例4中1655例乳腺癌肿瘤病例中her2阳性的乳腺癌进行分子分型,评估干扰素指数对其发生乳腺癌远处转移的影响。
[0211]
基于基因群g1计算干扰素指数,干扰素指数计算同实施例2.1。
[0212]
实验结果:
[0213]
根据计算所得干扰素指数,可将归为her2富集型乳腺癌病例的病例分为干扰素指数强和干扰素指数弱两组,其中干扰素指数强的病例组10年无远处转移生存率显著高于指数弱的病例组(p<0.001)(图6),表明干扰素指数强的her2阳性乳腺癌中的her2富集型乳腺癌患者的复发风险较低,预后较好。此外,采用乳腺癌72基因分子分型对her2阳性乳腺癌进一步分子分型之后再进行复发风险评估,较单独对her2富集型(图1)或her2阳性(图5)乳腺癌的预后预测效率显著提高。对于干扰素指数弱的her2阳性乳腺癌中的her2富集型乳腺癌患者,通过联合干扰素治疗,增强干扰素信号通路,有可能降低其乳腺癌的复发风险。
[0214]
实施例6:干扰素通路相关基因群的二代测序检测试剂盒分析
[0215]
实验方法:取乳腺癌肿瘤组织,提取肿瘤细胞中的rna,采用illumina二代测序(ngs)技术,设计并优化如表2所示的35个基因对应的35对测序引物(参见表5),分别检测基因的表达水平。步骤如下:
[0216]
(1):取检测对象肿瘤或石蜡包埋组织,获取检测对象含肿瘤细胞高的区域为原始材料。
[0217]
(2):提取组织中总rna,例如可使用cell data sciences公司的rna抽提试剂盒(rna storm cd201)或qiagen公司的rna抽提试剂盒(qiagen rnease ffpe kit,货号#73504)。
[0218]
(3):将所得rna制备成可供靶向rna-seq技术二代测序的文库,文库的制备方法包括以下步骤:
[0219]
(3-1):使用ii逆转录酶(new england biolabs,#m0368l)将步骤(2)中提取的rna反转录成cdna。
[0220]
(3-2):使用illumina的targeted rna建库试剂盒(#15034457)将所得cdna处理制成可供测序的文库,具体步骤如下:(i)杂交:加入top(具体组成参见表5)4.5μl,混匀后加入21μl ob1,升温至70℃后缓慢梯度降温至30℃;(ii)延伸和连接:将(i)中产物用磁力架吸附后弃上清,用试剂盒中am1和ub1洗涤两次后弃上清,加入36μl elm4,在pcr仪或金属浴中37℃孵育45分钟;(iii)对(ii)所得产物进行测序标签(index)的连接,然后pcr:将(ii)所得产物用磁力架吸附后弃上清,加入稀释40倍的hp318μl,用磁力架吸附后吸取16μl,加入17.3μl tdp1、0.3μl pmm2、6.4μl index,混匀后进行pcr扩增32个循环;(iv)采用gnome dna(questgenomics,南京)纯化试剂盒纯化dna,得到文库。
[0221]
(4):对所得dna文库进行用nextseq/miseq/miniseq/iseq进行二代测序。用illumina nextseq/miseq/miniseq/iseq测序仪进行双端测序或单端测序。
[0222]
(5):结果统计分析。基于参考基因的表达水平,将所得检测结果进行标化后计算基因表达水平,判断基因表达水平强弱的方法如实施例3所示。
[0223]
表5
[0224]
[0225][0226]
实施例7:干扰素通路相关基因群的rt-pcr检测试剂盒分析
[0227]
实验方法:取乳腺癌肿瘤组织,提取肿瘤细胞中的rna,采用taqman rt-pcr技术,设计并优化如表3所示9个基因对应的9对引物和9个taqman探针(参见表6),分别检测基因的表达水平。步骤如下:
[0228]
(1):取检测对象肿瘤新鲜或石蜡包埋组织,获取检测对象中含肿瘤细胞高的区域作为原始材料。
[0229]
(2):提取组织中总rna。使用rna storm cd201rna或者qiagen rnease ffpekit rna抽提试剂盒来提取。
[0230]
(3):rt-pcr检测。所述rt-pcr检测的方法为taqman rt-pcr,对表3中所示基因(又
见表6),分别进行rt-pcr检测。步骤如下:
[0231]
(3-1):提取检测对象的总rna;
[0232]
(3-2):对(3-1)所得rna进行反转录,具体步骤为:取总量为2μg左右的样本rna(例如取200ng/μl左右的样本rna 11μl),和11μl参考rna一起反转录(thermo k1622反转录试剂盒)获得样本cdna和参考cdna;向样本cdna加入80μl无rna酶水将其5倍稀释,向参考cdna加入180μl无rna酶水将其10倍稀释;
[0233]
(3-3):对(3-2)所得对应每个基因的cdna样本进行taqman rt-pcr检测对6个靶基因和3个参考基因(参见表6)分别进行检测。步骤如下:(i)制备每孔反应体系:(3-2)所得的cdna样本2μl(总量100-400ng),如表6所示的正向、反向特异性引物及taqman荧光探针(10μm)共1.4μl,反应预混合液10μl,depc水6.6μl;(ii)95℃灭活逆转录酶2分钟;(iii)扩增与检测:95℃变性25秒,60℃退火、延伸及荧光检测60秒,进行45个循环,暂缓期60℃60秒;扩增反应结束后,记录每个基因的ct值,代表了各个基因的表达水平。
[0234]
(4):结果统计分析。基于参考基因的表达水平,将所得检测结果进行标化后计算干扰素指数,干扰素指数计算方法以及判断其强弱的方法如实施例2所示。
[0235]
表6
[0236][0237]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1