一种大黄鱼血红蛋白抗菌肽及其应用的制作方法
本发明涉及生物技术领域,尤其涉及一种大黄鱼血红蛋白抗菌肽及其应用。
背景技术:
致病微生物引起的食源性疾病是消费者、行业和监管机构面临的主要问题。据估计,约有6亿人(约占世界人口的十分之一)在食用受污染食品后患病,每年造成42万人死亡。在过去几十年中,使用化学合成防腐剂导致了各种与健康相关的问题。同时,我国养殖业在快速发展过程中出现病害严重和滥用药物等问题。抗菌肽是生物体产生的多种免疫因子,对细菌具有良好的抑制作用,有望成为化学防腐剂和养殖药物的替代品。
金黄色葡萄球菌和大肠杆菌是食品中最受关注的致病微生物。金黄色葡萄球菌广泛分布于包括人类在内的许多温血动物的皮肤和粘膜上,在制备和加工过程中会污染食物;大肠杆菌也是食品中最常见的食源性病原体之一,被认为是主要的公共卫生风险。海豚链球菌具有感染宿主广、传染性强和死亡率高等特点,多呈急性嗜神经组织病症,给水产养殖业造成巨大损失。
许多抗菌肽是从自然界生物内获得的。这种直接来源于生物体内的抗菌肽一般浓度很低(<10-6),很难得到足够的量去进行活性测定、结构鉴定和商业应用。
大黄鱼(larimichthyscrocea)是中国网箱养殖中最大的鱼类。已在大黄鱼中鉴定出几种抗菌肽家族,包括piscidin、leap-2和nk-lysin。血红蛋白不仅是氧载体蛋白,而且是海洋生物免疫系统的重要组成部分,但目前还没有在大黄鱼血红蛋白中发现抗菌肽。
技术实现要素:
本发明的目的在于提供一种大黄鱼血红蛋白抗菌肽及其应用,通过大黄鱼血红蛋白抗菌肽lch4对金黄色葡萄球菌、大肠杆菌和海豚链球菌抑菌活性的研究,为寻找新的食品防腐剂和预防鱼病水产饲料添加剂提供实验依据,促进我国食品和水产养殖行业的健康、持续发展。
为了解决上述目的,本发明采用的技术方案如下:
一种大黄鱼血红蛋白抗菌肽lch4,其氨基酸序列awqkflsavvsalgr,如seqidno:1所示。
研究表明大黄鱼血红蛋白的二级结构中富含α螺旋结构,这是抗菌肽典型功能结构,因此利用大黄鱼血红蛋白为目标寻找抗菌肽存在理论依据。我们首先对大黄鱼血红蛋白序列筛选和计算,然后通过swiss-model和i-tasser服务器对大黄鱼的血红蛋白结构进行预测,发现了对金黄色葡萄球菌、大肠杆菌和海豚链球菌具有很强抗菌作用的抗菌肽序列awqkflsavvsalgr,命名lch4,分子量为1633da。圆二色谱测定其二级结构含量为:α-螺旋含量为60.3%;β-折叠含量为3.7%;β-转角含量为26.7%,无规则卷曲含量为9.3%。
抗菌肽lch4可以从至少如下两方面对细菌造成破坏:一方面,吸附在细菌细胞膜表面,破坏细胞膜导致细菌死亡;另一方面,破坏细胞膜的同时改变细菌细胞膜的通透性,并抑制细胞膜生成,导致细菌死亡。
本发明还提供了上述大黄鱼血红蛋白抗菌肽的编码基因。
本发明还提供了上述编码基因的表达盒。
本发明还提供了上述编码基因的重组菌。
本发明还提供了上述编码基因的重组载体。
本发明还提供了上述编码基因的转基因细胞系。
本发明还提供了上述多肽、编码基因、重组载体或转基因细胞系在抑制细菌的用途。
优选的,上述细菌包括金黄色葡萄球菌、大肠杆菌、海豚链球菌中的一种或多种。优选的,上述抑制细菌的用途为用于制备食品防腐剂。
本发明对人正常肝细胞具有极低的毒性,可用做为食品防腐剂应用,特别是作为预防食品常见致病菌如金黄色葡萄球菌、大肠杆菌等病菌污染的防腐剂。
优选的,上述抑制细菌的用途为用于制备治疗或预防鱼病的饲料添加剂。
本发明还可作为治疗或预防海豚链球菌的预防鱼病添加剂,在水产饲料中应用。
本发明的抗菌肽可以采用本领域技术人员已知的方法合成,例如固相合成,并采用本领域技术人员已知的方法进行纯化,例如高效液相色谱法。
实施本发明,具有如下有益效果:
本发明以大黄鱼血红蛋白为研究对象,并通过筛选和计算,发现一个全新氨基酸序列的多肽lch4。研究lch4对金黄色葡萄球菌、大肠杆菌和海豚链球菌等细菌的抑菌活性;并以金黄色葡萄球菌为例利用透射电镜观察lch4对其破坏程度;利用激光共聚焦显微镜观察lch4是否能吸附在细菌表面;最后对它的人体安全性影响进行评估。实验结果表明,该肽对金黄色葡萄球菌、大肠杆菌和海豚链球菌等细菌具有强烈的抑制作用。它的抑菌机理是首先吸附在细菌表面,然后破坏细菌的细胞膜,并抑制膜的生成,,同时它对人体正常肝细胞毒性极低。本发明为lch4作为食品防腐剂和水产饲料添加剂提供了实验依据。
附图说明
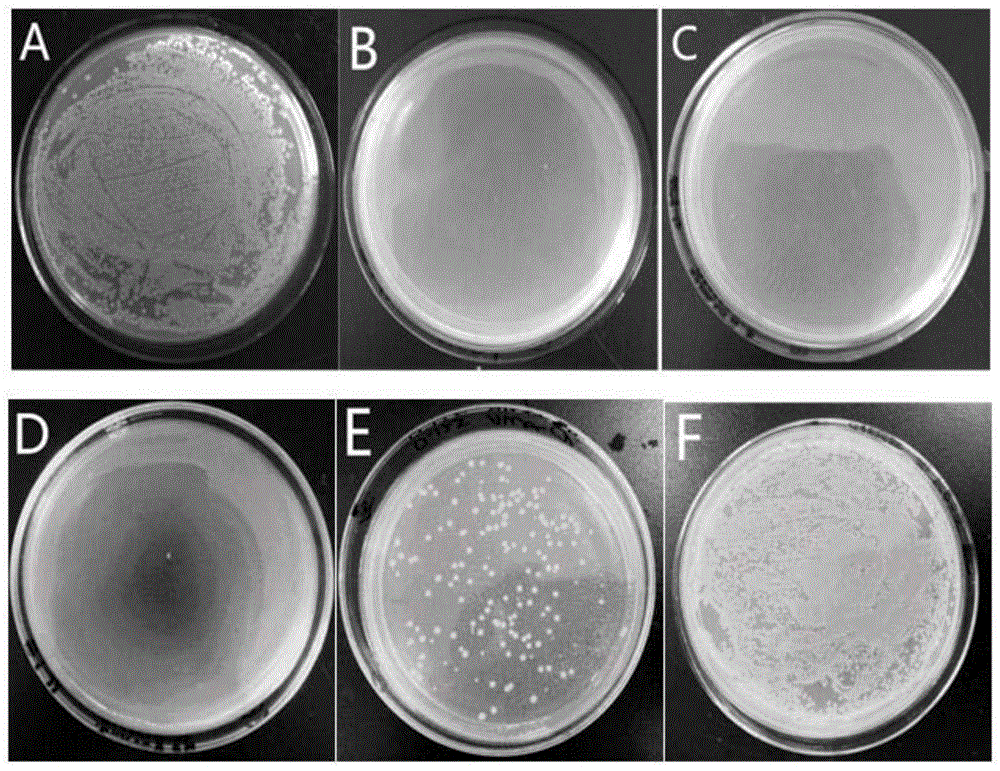
图1为本发明抗菌肽lch4对金黄色葡萄球菌最低抑制浓度(mic)测定对照图,其中,a:抗菌肽浓度0μg/ml;b:抗菌肽浓度62.5μg/ml;c:抗菌肽浓度31.25μg/ml;d:抗菌肽浓度15.6μg/ml;e:抗菌肽浓度7.8μg/ml;f:抗菌肽浓度3.9μg/ml。
图2为本发明抗菌肽lch4对大肠杆菌最低抑制浓度(mic)测定对照图,其中,a:抗菌肽浓度0μg/ml;b:抗菌肽浓度62.5μg/ml;c:抗菌肽浓度31.25μg/ml;d:抗菌肽浓度15.6μg/ml;e:抗菌肽浓度7.8μg/ml;f:抗菌肽浓度3.9μg/ml。
图3为本发明抗菌肽lch4对海豚链球菌最低抑制浓度(mic)测定对照图,其中,a:抗菌肽浓度0μg/ml;b:抗菌肽浓度250μg/ml;c:抗菌肽浓度125μg/ml;d:抗菌肽浓度62.5μg/ml;e:抗菌肽浓度31.25μg/ml;f:抗菌肽浓度15.6μg/ml。
图4为本发明抗菌肽lch4作用金黄色葡萄球菌的透射电镜观察图,其中,a:金黄色葡萄球菌空白对照组;b:lch4处理后的金黄色葡萄球菌。
图5为本发明抗菌肽lch4作用大肠杆菌的透射电镜观察图,其中,a:大肠杆菌空白对照组;b:lch4处理后的大肠杆菌。
图6为本发明抗菌肽lch4作用海豚链球菌的透射电镜观察图,其中,a:海豚链球菌空白对照组;b:lch4处理后的海豚链球菌。
图7为本发明抗菌肽lch4处理金黄色葡萄球菌细胞的共聚焦显微镜观察图,其中,a:荧光图像;b:明视野像;c:合并图像。
图8为本发明抗菌肽lch4对金黄色葡萄球菌细生物膜形成的抑制作用柱状图,其中,*表示显著性p<0.05;**表示显著性p<0.005;***表示显著性p<0.001。
图9为本发明抗菌肽lch4的预测模型结构视图。
图10为本发明抗菌肽lch4对正常人肝细胞(lo2细胞)活力的影响柱状图。
具体实施方式
为了更好地理解本发明,下面结合实施例和附图对本发明做进一步的详细说明,但本领域技术人员了解,下述实施例不是对本发明保护范围的限制,任何在本发明基础上做出的改变和变化,都在本发明的保护范围之内。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1:大黄鱼血红蛋白衍生抗菌肽的筛选
由于鱼血红蛋白富含α螺旋结构,这是抗菌肽最常见的特征结构,因此我们利用antibp服务器从大黄鱼血红蛋白中预测具有α螺旋结构的潜在抗菌肽,并利用camp软件对预测肽的可靠性进行了评价。预测得到了6种具有α螺旋潜在的抗菌肽,如表1所示。
表1大黄鱼血红蛋白潜在抗菌肽的预测
从表1可以看出,肽lch4得分最高,同时,肽lch4也具有典型抗菌肽的特征,即氨基酸数量(<50)、总正电荷(+2到+9)和疏水氨基酸百分比(>30%)。合成得分最高的前4个肽(lch1-lch4),分别对金黄色葡萄球菌、大肠杆菌、海豚链球菌进行抑菌实验,结果显示lch4的抑菌作用最强。
实施例2:最低抑制浓度(mic)测定
将金黄色葡萄球菌、大肠杆菌和海豚链球菌在37℃培养12h至对数生长期,在0.01mph7.2磷酸盐缓冲液中稀释至106-7cfu/ml。将肽溶于磷酸盐缓冲中,37℃等体积与菌混合2h。最低抑菌浓度(mic)是指在37℃孵育过夜后,从微量滴定板上看不到细菌生长的抗菌肽最低浓度。如图1、图2和图3所示,lch4对金黄色葡萄球菌、大肠杆菌的最低抑菌浓度(mic)均为15.6μg/ml,对海豚链球菌的最低抑菌浓度(mic)均为62.5μg/ml。
实施例3:透射电镜分析
以106-7cfu/ml的细菌在37℃下用2×mic的lch4处理2h,然后在2700g下离心10min,用磷酸盐缓冲液(ph7.2)洗涤两次。用1%的锇酸固定后,用95%乙醇脱水,然后丙酮处理20min。样品在70℃下烘烤24h,在铜网格上制备70-90nm的薄片,然后用柠檬酸铅和乙酸铀酯染色。用h-7650透射电子显微镜观察和捕获超微结构。
如图4、图5和图6所示,对于未经处理的细菌,细菌细胞的胞内组织和结构完整性良好。然而,用肽lch4处理后,可以看到细菌细胞膜结构开始随着细胞空泡化而模糊,细胞的形状变得不规则,细胞膜完全塌陷,细胞质内容物流出。透射电子显微镜结果表明,lch4肽对金黄色葡萄球菌、大肠杆菌和海豚链球菌的细胞膜和内部结构具有破坏作用。
实施例4:lch4在细菌细胞表面的聚集
以金黄色葡萄球为例,培养至对数期后,将细菌浓度调至106-7cfu/ml,用加荧光标记的肽lch4在37℃,2×mic浓度下孵育60min,然后离心、洗涤细胞,用磷酸盐缓冲液重新悬浮,然后用激光共聚焦扫描显微镜进行分析。
如图7所示,结果表明,lch4能聚集在金黄色葡萄球菌细胞表面上,在抗菌肽与细胞膜相互作用过程中,抗菌肽覆盖细胞表面直至达到阈值浓度,导致细胞膜破坏和细胞死亡(参见图7中7a、7b和7c)。
实施例5:lch4对细菌细胞膜成膜作用的影响
为了研究肽lch4对生物膜形成的影响,以金黄色葡萄球为例,将细菌置于低浓度的lch4下培养,观察其对细菌细胞膜形成的影响。具体操作如下:通过离心收集金黄色葡萄球菌细胞,再悬浮于luriabertani(lb)肉汤中,然后与不同浓度的等体积lch4相应稀释液混合。将混合物加入96孔平底板中,在37℃下孵育72h,然后用pbs(ph7.2)轻轻洗涤3次,去除未附着的细胞,然后加入200μl0.1%结晶紫。培养皿于25℃孵育30分钟,然后用pbs洗涤以去除结晶紫。在室温下干燥板后,向每个孔中添加200mg95%乙醇。nisin和pbs分别作为阳性对照和阴性对照。生物膜形成能力与lch4浓度呈负相关。但当lch4肽浓度低于1/4×mic时,对生物膜的形成影响不大,而当lch4肽浓度为1mic时,生物膜不形成,如图8所示。生物膜的形成代表了一种受保护的生长方式,为细菌细胞能够在恶劣的环境中生存提供保护,这被认为是食品加工行业的主要健康风险。因此,lch4的抑制生物膜生成活性是该肽的一个很好的特征,表明它可以被用作防腐剂。
实施6:lcwap的3d结构预测
利用在线结构预测服务器swiss-model,对大黄鱼乳清酸性蛋白及其衍生抗菌肽lcwap的结构进行预测,并利用pymol软件进行编辑和修改,得到抗菌肽lcwap的结构及其在大黄鱼乳清酸性蛋白(wap)中的空间位置,如图9所示。
实施例7:lch4对人体正常肝细胞的影响
mtt(3-(4-5-二甲基噻唑-2-基)-2-5-二苯基-2h-四唑溴化铵)法是评价细胞毒性的经典方法。具体操作如下:将10mg/ml正常人肝细胞(lo2)加入96孔板,在5%co2和37℃二氧化碳培养箱中孵育,直至细胞贴壁,然后加入不同浓度梯度的lch4至每个孔。在37℃的5%co2中孵育24h。培养结束后,在每个孔中加入5mg/ml浓度20μm的mtt溶液,在37℃下继续孵育4h,弃去孔板上清液,在每个孔中加入150μl二甲基亚砜,将晶体完全溶解于低速摇床10min,在490nm下测定吸光度值。nisin和pbs分别作为阳性对照和阴性对照。结果显示,不同lch4浓度对lo2细胞没有不良的细胞毒性作用,发现细胞存活率大于96%,如图10所示。lch4的细胞毒作用与nisin相似,说明lch4在食品工业中具有潜在的应用前景。
sequencelisting
<110>集美大学
<120>一种大黄鱼血红蛋白抗菌肽及其应用
<130>无
<160>1
<170>patentinversion3.5
<210>1
<211>15
<212>prt
<213>人工合成
<400>1
alatrpglnlyspheleuseralavalvalseralaleuglyarg
151015
- 还没有人留言评论。精彩留言会获得点赞!