一种抑制流感病毒的多肽及其在制备预防和治疗流感病毒感染药物中的应用的制作方法
本发明属于生物医药领域,涉及一种新型流感病毒侵入抑制类多肽,特别涉及该多肽及其衍生物在制备抗流感病毒药物中的用途。
背景技术:
流感病毒属于正粘病毒科,是人流感、禽流感、猪流感、马流感等人与动物疫病的病原病毒。流感病毒在历史上曾造成多次大流行,其中1918年甲型h1n1大流感造成全球四千多万人的死亡。目前,全球每年仍有几十万人死于流感病毒感染,2019年,美国有1500万人感染流感病毒,造成1万多人的死亡。在我国,流感疫情呈现出每年都会爆发的趋势,仅2019年上半年,就有超过200万的报告病例。近年来,人感染高致病性禽流感(h5n1、h7n9)的病例也在不断增加。由于流感病毒的传播途径、高变异性及宿主范围广等特点,使得流感病毒的防控面临严峻的形式。当前,疫苗接种及抗流感药物的使用是预防和治疗流感病毒的主要途径。但由于流感病毒的变异速度较快,接种一种流感疫苗往往只能得到暂时的保护,起不到长期有效的预防作用。
流感病毒的特异性药物能够起到预防和治疗流感病毒感染的目的,目前临床上使用的一线抗流感药物主要分为两类,一类是m2粒子通道抑制剂金刚烷胺和金刚乙胺,该类药物只对甲型流感病毒有效,对乙型流感病毒无抑制作用。由于当前的大部分甲型流感病毒毒株对金刚烷胺类药物都存在较强的耐药性,世界卫生组织已经不推荐使用金刚烷胺类药物用于流感病毒的预防和治疗的首选药物。抗流感病毒的另一类药物是神经氨酸酶(na)抑制剂。其对当前流行的大多数甲型及乙型流感均有较好的抗病毒效果,是who推荐的流感预防和治疗流感病毒治疗的首选药物。但随着na抑制剂的广泛使用,已经出现了耐药株。2008-2009的季节性h1n1流感对大部分的na抑制剂耐药。在欧洲的一些国家,奥司他韦耐药株的发生率在逐年增加,主要表现为na蛋白的292,274,222,119位置的氨基酸突变。2019年,一款新的抗流感药物巴洛沙韦获fda批准上市,该药物为pa抑制剂,用于对抗神经氨酸酶抑制剂耐药的流感毒株治疗。但甲型h1n1和乙型流感病毒中出现的i38t突变更加频繁,且儿童更易产生耐药性变异。此外,有研究显示巴洛沙韦具有至畸性。可以预见,在不久的将来,奥司他韦,扎那米韦巴洛沙韦等na抑制剂及pa抑制剂的持续使用必将导致大规模流感耐药株的出现。研究流感病毒的新型预防及治疗药物或制剂,仍然是全人类需要积极面对的重要任务。
技术实现要素:
为了解决流感病毒因耐药性变异产生的预防及治疗问题,本发明提供了一种抑制流感病毒的多肽,该多肽能够在微摩尔水平抑制流感病毒侵入细胞,从而抑制流感病毒的感染。
本发明还提供上述多肽在制备预防和治疗流感病毒感染药物中的应用。
本发明通过以下技术方案实现:
通过随机肽库的筛选,本发明提供了一种抑制a型及b型流感病毒的多肽,所述多肽能够与流感病毒ha蛋白唾液酸受体识别位点特异性结合。可进一步发展为预防或治疗流感病毒的药物。
一种抑制流感病毒的多肽,所述多肽为iva-p1,具有如seqidn0:1所示的氨基酸序列,所述多肽还可以为iva-p1的修饰产物,或者iva-p1在药学上可接受的盐、酯和前药中的一种。
具体的,多肽iva-p1的氨基酸序列为:aikrwfrykril。通过细胞学实验显示,多肽aikkwfryrrll能够在纳摩尔水平显著抑制流感病毒与宿主细胞的结合,从而有效抑制流感病毒的侵入。
通过研究流感病毒ha蛋白的三维结构,我们进一步改造该多肽分子,进行关键氨基酸替换实验,发现了一个全新的能够抑制流感病毒侵入的多肽衍生物。通过结构模拟及分子对接,定量构效关系等,确定该多肽衍生物能够以特异性的结合ha蛋白与唾液酸结合的结合口袋,从而封闭唾液酸受体与ha的结合。
改造后的多肽为iva-p1-r4,具有如seqidn0:2所示的氨基酸序列。所述多肽还可以为iva-p1-r4的修饰产物,或者iva-p1-r4在药学上可接受的盐、酯和前药中的一种。
多肽iva-p1-r4的氨基酸序列为:lrffvaikkwfryrrllpafsyrkqlk。
一种抑制流感病毒的多肽的制备方法,多肽采用fmoc多肽合成法制备,按照化学保护的方式由c端逐个向n端延伸,所得肽分子经过hplc纯化,纯度在95%以上。
一种抑制流感病毒的多肽在制备预防和治疗流感病毒感染药物中的应用,所述流感病毒为a型流感病毒或b型流感病毒。
一种预防和治疗流感病毒感染药物,所述药物的药效成分包括多肽iva-p1、多肽iva-p1-r4、多肽修饰产物、多肽在药学上可接受的盐、酯和前药中的一种或多种。药物的剂型为喷剂、口服制剂、注射制剂、片剂、胶囊剂、颗粒剂、混悬剂和丸剂中任意一种,还包含药学上可接受的载体和赋形剂。
本发明涉及的多肽,都通过elisa方法确认了与ha的结合能力。
本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
1.本发明一种抑制流感病毒的多肽,能够与流感病毒ha蛋白唾液酸受体识别位点特异性结合,可在纳摩尔水平显著抑制流感病毒与宿主细胞的结合,从而有效抑制流感病毒的侵入。
2.本发明一种预防和治疗流感病毒感染药物,其药效成分包括多肽iva-p1和/或iva-p1-r4,能够特异性的结合a型和b型流感病毒ha蛋白,阻挡流感病毒与宿主细胞的结合,抑制流感病毒的感染。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
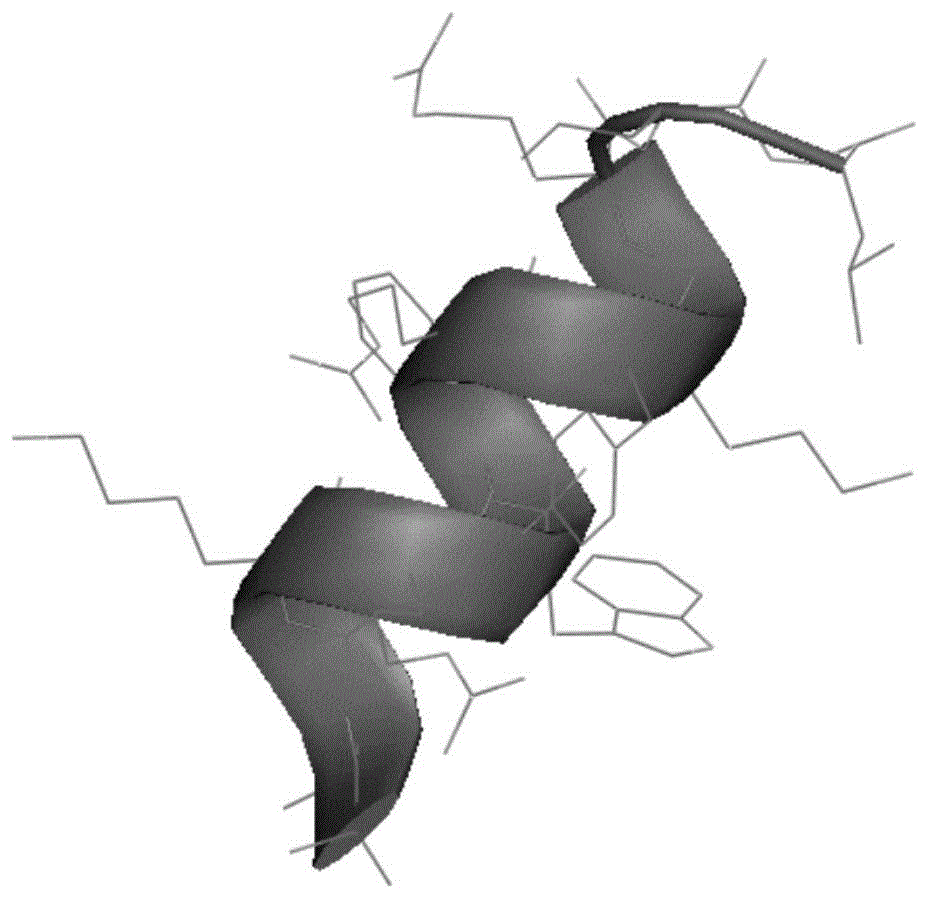
图1是iva-p1的螺旋结构示意图;
图2是iva-p1的螺旋结构俯视图;
图3是a型流感病毒的ha蛋白三聚体头部结构图;
图4是ha蛋白三聚体头部与唾液酸分子结合示意图;
图5是iva-p1与ha蛋白三聚体头部的结合模式;
图6是iva-p1-r4对a型流感病毒复制影响的荧光显微图;
图7是iva-p1对a型流感病毒复制的抑制效率图;
图8是iva-p1-r4对a型流感病毒复制的抑制效率图;
图9是iva-p1对a型流感病毒与细胞结合的抑制图;
图10是elisa检测多肽与ha蛋白的结合性;
图11是iva-p1对a型流感病毒与细胞结合的影响结果图;
图12是多肽细胞毒性检测结果;
图13是iva-p1关键氨基酸位点的分析图;
图14是iva-p1各个改造肽对a型流感的抑制效果。
具体实施方式
下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买得到或者可通过现有方法制备得到。
本发明实施例提供的技术方案为解决上述技术问题,总体思路如下:
流感病毒感染宿主细胞的第一步是病毒与宿主细胞受体间的结合,这个步骤对于流感病毒能否有效的侵入宿主细胞起到至关重要的作用。病毒受体指位于宿主细胞表面,负责结合病毒并介导病毒侵入的具有正常生理功能的蛋白质,糖及脂类分子。ha蛋白作为流感病毒表面的主要蛋白,负责与流感病毒宿主细胞受体间的结合,以及病毒与细胞间的膜融合。ha囊膜蛋白与宿主细胞的唾液酸受体结合后,通过内吞的方式,侵入细胞,释放遗传物质并最终完成病毒的复制过程。因此,从流感病毒与受体结合及膜融合这个角度来开发抑制病毒侵入的手段,能够在病毒侵入的最开始阶段,阻挡病毒与细胞的结合,从而有效的抑制和控制病毒的感染。当前,已有报道显示唾液酸受体的聚合物可以用来抑制流感病毒与细胞间的结合,从而抑制病毒侵入。
下面将结合实施例、附图及实验数据对本申请多肽抑制流感病毒的感染效果进行详细说明。
实施例1
1.多肽获取
1.1随机肽库筛选ha1结合多肽
流感病毒ha1蛋白作为靶分子对随机12肽库进行筛选。将ha1蛋白稀释于包被液中至质量浓度为20微克每毫升,取100微升包被酶标板,置于湿盒中4℃孵育过夜,链霉亲和素(0.2毫克每毫升;100微升)作为对照同样包被。弃包被液,加满封阻液,4℃作用1h,tbst(tbs+0.1%tween-20)缓冲液洗涤6次后,取噬菌体随机12肽库(2×1011pfu)稀释于200μltbst缓冲液中,室温孵育1h。tbst洗涤6次后,用0.2mol/lglycine-hci(ph2.2)洗脱结合的噬菌体,并用1mol/ltris-hci(ph9.1)中和。吸取1μl洗脱液测定噬菌体滴度,余下洗脱液吸取5μl进行扩增并测定扩增后噬菌体滴度。共进行4轮筛选,每轮包被的抗原量依次递减,分别为10、5、1、1μg/ml;tbst缓冲液中tween-20的体积分数依次递增,分别为0.1%、0.2%、0.5%、0.5%。筛选产物与靶蛋白ha1结合活性的elisa鉴定将第4轮筛选得到的噬菌体库10倍系列稀释,感染大肠杆菌后铺于双层琼脂板中间。从少于100个蓝色噬菌斑的平板上随机挑取30个,分别进行扩增纯化。纯化后的噬菌体一部分提取核酸用于测序,另一部分滴度测定后用于elisa检测。将ha1蛋白以1μg/ml包被elisa板,对4轮筛选的洗脱产物和挑出的30个噬菌体克隆取2×1011pfu进行elisa检测,噬菌体克隆进行10-1、10-2和10-3共3个稀释度稀释,同时以野生型m13噬菌体为阴性对照.以bsa为空白对照。
1.2噬菌体阳性克隆的序列测定
以病毒dna核酸提取试剂盒提取纯化后噬菌体的单链dna,并以此为模板,pcr扩增噬菌体展示多肽的dna片段送交测序,测序引物为:5′-gtatgggattttgctaaacaac-3′;
根据dna测序结果推导出噬菌体展示多肽的氨基酸序列。
1.3多肽的合成与纯化
本实施例中所用的多肽iva-p1和iva-p1-r4均由化学合成并纯化。
2.流感病毒的获取
2.1流感病毒的扩增及纯化
流感病毒a型h1n1-pr8采用鸡胚羊膜腔方法扩增。取出8日龄鸡胚,用照蛋器照射观察鸡胚,在气囊边缘用铅笔划横线,下方0.2cm处找到无血管位置标记出注射位置。每个稀释度3-4枚,一半从-1的稀释度开始。超净台准备,酒精灯,针头,大针头。先将蛋喷酒精,然后拿大针烧一烧后先在气囊顶端打孔,再在标记位置打孔。用1ml注射器将稀释好的稀释液注射。深度不易过深,0.2-0.5cm。蜡块儿融化后涂抹。放置37℃培养箱培养72h收毒。4度冰箱过夜。喷酒精消毒,用镊子捣碎顶端气室。烧镊子,撕破顶端膜结构。用注射器吸取尿囊液,鸡胚需灭菌处理。分装冻存。
2.2血凝实验
取25微升病毒液进行血凝实验。取适量鸡红细胞用pbs洗一次,不要超过3000转,短暂离心。pbs重悬,放到排枪吸盒中,上面套个一次性手套,用尖底一次性96孔板,设置阴性对照,按1∶125微升∶25微升比例加入红细胞,加入十倍倍比稀释的病毒悬液,放置20分钟,室温观察。病毒液2000转,4度离心10分钟,病毒液分装冻存。
2.3流感病毒滴度检测
以8%fbsdmem培养基培养mdck细胞,胰酶消化分细胞至96孔板,每孔2000个细胞。10%fbsdmem培养基培养24小时。吸取病毒液或病毒培养上清100μl,以dmem10倍稀释度倍比稀释。
取出96孔培养板,去除每孔培养基,按每孔100微升加入稀释的病毒液(按1∶2000加入tpck胰酶),4度吸附1小时,加200微升10%fbsdmem培养基,按1∶2000体积比加入tpck胰酶。37℃培养48-72小时,观察每个稀释度病变孔,以reed-muench法计算病毒滴度。
3.多肽对流感病毒抑制效果的间接免疫荧光检测
将流感病毒pr8株按照moi=2感染mdck细胞。感染前一天,取对数生长期mdck细胞,细胞弃上清,pbs洗两次,每次3毫升,以0.25%胰酶消化细胞。短暂离心5分钟(1000转),以dmem+fbs10%重悬细胞,按每孔10万个细胞分至12孔板。37℃培养,24小时后,弃上清,冰pbs洗两次,迅速加入多肽或对照多肽及病毒混合悬液,每个浓度设置三个重复,置冰上孵育1小时,以冰pbs洗两次,每次1毫升。
置37℃培养箱培养48小时,以4%多聚甲醛固定10分钟。0.2%triton-x100冰上破膜10分钟,加入3%bsa,室温封闭1小时。加入1μg/ml的a型流感病毒np蛋白抗体,室温孵育1小时,pbs洗三次,每次10分钟。加入0.5μg/ml的fitc标记山羊抗小鼠二抗。
室温孵育45分钟,pbs洗涤三次,每次10分钟。以488波长,在荧光显微镜下观察并拍照,结果如图6所示。以imagej计算绿色信号细胞数。以dapi计算细胞总数。计算感染效率或半数抑制浓度,结果如图7、8所示。
实施例2
流式细胞仪检测流感病毒与细胞的结合
将流感病毒h1n1-pr8株按照moi=2感染mdck细胞。感染前一天,取对数生长期mdck细胞,细胞弃上清,pbs洗两次,每次3毫升,以0.25%胰酶消化细胞。短暂离心5分钟(1000转),以dmem+fbs10%重悬细胞,按每孔10万个细胞分至12孔板。37℃培养,24小时后,弃上清,冰pbs洗两次,迅速加入多肽iva-p1或iva-p1-r4及病毒混合悬液,每个浓度设置三个重复,置冰上孵育1小时,以冰pbs洗两次,每次1毫升。细胞培养48小时。
将mdck细胞胰酶消化,吹下细胞,2000转,4℃,离心5分钟。弃掉上清,pbs重悬,细胞计数,以4%多聚甲醛室温固定细胞10分钟。pbs洗细胞三次,注意每次离心可至4000转,但每次要充分将细胞弹起混匀。离心后,以0.3%tritonx-100重悬,4℃十分钟,离心,去上清,加入200微升h1n1一抗稀释液,1∶500比例,转子上染色1小时,保持细胞悬浮。4度离心1000转10分钟。弃上清,加入pbs洗两次。弃上清,加入200微升二抗稀释液,一般1∶500比例。离心,弃上清。加入200微升pbs重悬。上流式细胞仪,488nm激发光读取fitc信号。以mock组为对照,分析阳性细胞数。结果如图9所示。
实施例3
elisa检测ha蛋白与多肽的结合
将ha蛋白包被至96孔板。方法如下,去聚苯乙烯elisa板室温平衡。以包被液稀释ha蛋白,终浓度0.1微克每微升。包被液成分:无水碳酸钠0.1696克,碳酸氢钠0.2856克,溶解到100毫升去离子水中。每孔加入100微升蛋白稀释液。4℃包被过夜。弃掉包被液,pbst洗涤,每孔加300微升,静置10分钟,弃掉洗液,加满洗液,重复5次,排干洗涤液。洗涤液pbst:氯化钠8克,12水合磷酸氢二钠2.9克,氯化钾0.2克,磷酸二氢钾0.24克,吐温200.5毫升,定容至1升。封闭:以10%bsa封闭elisa板。每孔加入300微升,4度过夜。洗涤液洗涤5次,方法同上。以包被液稀释不同浓度fitc标记多肽iva-p1或iva-p1-r4,及对照多肽,阳性对照抗体100微升每孔加入到elisa板中。37℃孵育1小时。以pbst洗涤5次。加入pbst100微升。488纳米读取绿色荧光值。阴性对照为非特异性随机多肽,检测结果如图10所示。
实施例4
荧光定量pcr检测流感病毒与细胞的结合
将流感病毒pr8株按照moi=2感染mdck细胞。感染前一天,取对数生长期mdck细胞,细胞弃上清,pbs洗两次,每次3毫升,以0.25%胰酶消化细胞。短暂离心5分钟(1000转),以dmem+fbs10%重悬细胞,按每孔10万个细胞分至12孔板。37℃培养,24小时后,弃上清,冰pbs洗两次,迅速加入多肽iva-p1或iva-p1-r4及病毒混合悬液,每个浓度设置三个重复,置冰上孵育1小时,以冰pbs洗两次,每次1毫升。细胞以trizol裂解进行rna提取。应用rna病毒核酸提取试剂盒(天根生化)提取病毒基因组rna。
流感病毒基因序列作同源性比对后,在病毒的m基因保守区设计特异性引物和taqman探针,探针标记fam荧光报告基团(激发波长为510nm)。
flua-f:tctcatggartggctaaagacaag
flua-r:acacaaayccyaaaatyccyttagt
flua-mgbpbfam-ccaatcctgtcacctct-mgb
采用一步法rt-pcr试剂盒检测。95℃3分钟,94度10秒,60度30秒,第二步和第三步循环40次。最终检测结果如图11所示。
实施例5
cck-8检测多肽细胞毒性
分对数生长期mdck细胞至96孔板,每孔5000个细胞。37℃5二氧化碳培养24小时,以dmem洗细胞两次,每次100微升,加入不同浓度dmem稀释的多肽100微升,放置培养箱培养48小时,加入10微升cck-8溶液,培养1小时,测量450纳米吸收峰,630纳米吸收为参比波长。结果如图12所示。
实施例6
多肽衍生物设计及ha蛋白与多肽的分子对接
以pdb数据库中的ha蛋白为模型,以ha头部受体结合部位为靶位点,设计可能的结合序列。以pep-fold软件计算多肽的结构,输入多肽序列后,以最低能量值进行计算,存储pdb文件,以swiss-dock进行结构对接。以最低能量值输出对接文件,对接结构域选定为ha三聚体头部。
elisa实验确认多肽与ha蛋白的结合。免疫荧光检测所述多肽对病毒的抑制效果。iva-p1衍生物中,以iva-p1-c结合最好。选取iva-p1-c进行改造,以提高其抑制流感病毒复制的效果,以氨基酸a逐个替代iva-p1的各个氨基酸,化学合成后,验证其与ha的结合效果。以此判定哪些氨基酸在结合中发挥重要作用。过程及结果如图13、14所示。
图1、2可见多肽呈现a螺旋结构,其侧链均分布于螺旋结构外围。
图3、4可见ha三聚体头部结构与唾液酸受体的结合,其中灰色部分为ha的头部,线条部分为唾液酸分子。
图5可见iva-p1以最佳自由能的方式结合于ha的头部唾液酸受体识别位点,这从侧面反映出该多肽是以占据唾液酸结合位点的方式来阻止流感病毒与其细胞受体的结合。
图6中,上方两图分别为流感病毒与对照多肽(gfp-p1)孵育后感染mdck细胞后的流感病毒抗体染色(左图)及细胞核染色(右图),下方两图分别为iva-p1-r4多肽与病毒孵育后,感染mdck细胞的流感病毒抗体染色(左图)及细胞核染色(右图)。免疫荧光结果显示,在相同操作条件下,iva-p1-r4对a型流感病毒有显著的抑制效果。
由图7、8可知:多肽对a型流感病毒的复制具有显著抑制效果,iva-p1多肽的半数抑制浓度为9.5微摩尔左右,iva-p1-r4多肽对流感pr8株的半数抑制浓度为1微摩尔左右。
由图9-11可知:多肽iva-p1和iva-p1-r4能够与多肽ha蛋白结合,阻挡流感病毒与宿主细胞的结合,通过多种检测方式可确认本发明多肽能够有效抑制流感病毒的感染。
由图12可知:多肽iva-p1和iva-p1-r4无明显细胞毒性。
图13中,对iva-p1的各个氨基酸位点进行突变后,在10微摩尔浓度下,分析对病毒复制能力的影响,以加入gfp-p1的对照多肽为100,计算抑制百分数。结果显示,在iva-p1的n端加上lrffv同时c端加上pafsyrkqlk后,其抑制病毒的效果显著提高。iva-p1的第4位r,第9位k,第11位i,都对多肽的抑制流感病毒功能起到决定性作用。
图14中,可见对iva-p1的4位,9位,11位进行相应氨基酸替换后,多肽抗流感病毒感染的效果显著提升。在上述突变的iva-p1的n端加上lrffv同时c端加上pafsyrkqlk后(iva-p1-r4),其抑制病毒的效果大幅度提高。
最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
序列表
<110>北京中科微盾生物科技有限责任公司
<120>一种抑制流感病毒的多肽及其在制备预防和治疗流感病毒感染药物中的应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>12
<212>prt
<213>流感病毒(多肽iva-p1)
<400>1
alailelysargtrppheargtyrlysargileleu
1510
<210>2
<211>27
<212>prt
<213>流感病毒(多肽iva-p1-r4)
<400>2
leuargphephevalalailelyslystrppheargtyrargargleu
151015
leuproalaphesertyrarglysglnleulys
2025
- 还没有人留言评论。精彩留言会获得点赞!