新人源TLR2胞外区段单克隆抗体及其制备方法和应用与流程
本发明属于生物
技术领域:
,特别涉及新人源tlr2胞外区段单克隆抗体及其制备方法和应用,具体涉及到新人源tlr2胞外区段编码259-278位氨基酸的基因序列的单克隆抗体及其制备方法和应用。
背景技术:
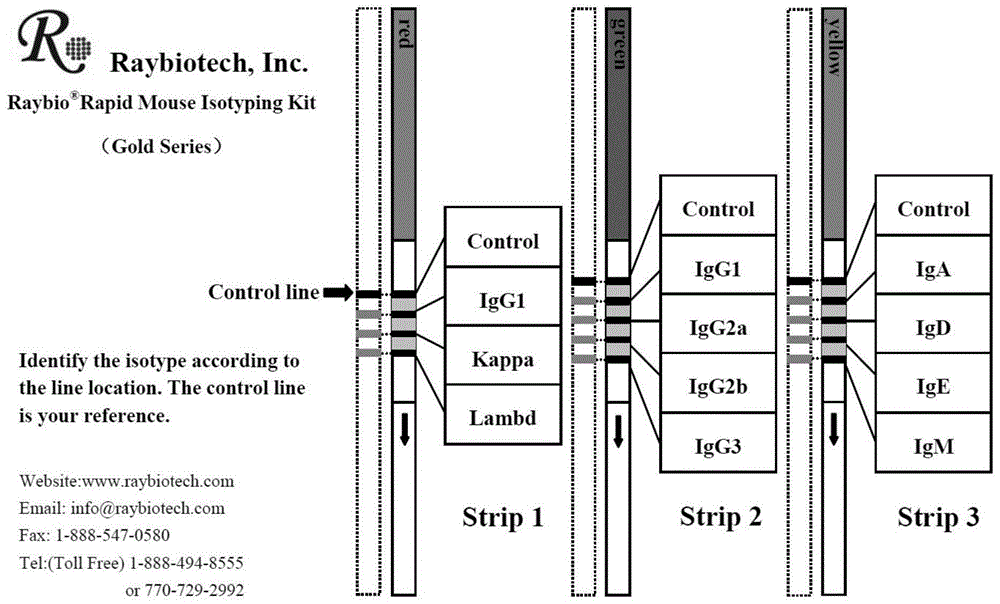
:toll样受体2(tolllikereceptor2,tlr2)是toll样受体(tolllikereceptor,tlr)家族的成员之一,在病原微生物的识别、入侵和天然免疫的激活等方面发挥重要的作用。tlr2基因序列在不同物种之间高度保守,其蛋白结构和蛋白功能在不同物种之间具有相似性。tlr2是一种细胞膜蛋白,其可以同其他tlr家族成员聚合形成异源二聚体,进而识别来自病原微生物的保守分子,这种识别模式被称为病原相关分子模式(pathogen-associatedmolecularpatterns,pamps)。tlr2被pamps激活后,能够进一步激活下游信号通路,从而调控宿主对病原微生物的免疫应答。tlr2被认为可以在细菌脂蛋白的刺激下,介导脂蛋白对宿主细胞凋亡的作用。目前,有相关文献显示:tlr2参与了宿主对布鲁杆菌的识别及免疫应答反应。tlr2和tlr4是布鲁杆菌表面蛋白bcsp31介导的细胞因子表达升高、th1免疫应答和巨噬细胞调控的重要因子。敲低宿主细胞的tlr2基因后,布鲁杆菌的感染作用显著降低;反之,过表达tlr2后,布鲁杆菌的感染作用显著增强,说明tlr2是布鲁杆菌入侵宿主细胞和介导宿主免疫应答的重要靶点。鉴于膜受体tlr2在病原微生物(布鲁杆菌)识别与感染中的重要作用,现有技术中有将tlr2作为靶点,研发相应的小分子抑制剂,评价了tlr2小分子抑制剂对布鲁杆菌感染的抑制作用。比如:pragnesh等人以tlr2胞内区的toll/il-1receptorresistance(tir)domains为靶点,利用计算机辅助药物设计方案,设计并合成了一种新的tlr2小分子抑制剂c29(如式ⅰ),该研究仅评价了c29对宿主巨噬细胞tlr2信号通路表达的影响、其能够抑制tlr2与myd88相互作用及下游mapk通路并抑制tlr2介导的免疫应答,但并没有进行c29抑制布鲁杆菌感染的研究;又如:kuicheng等人设计并合成了tlr1-tlr2复合物的小分子抑制剂(cu-cpt22),其能够特异性地与合成的三酰脂蛋白(pam3csk4)竞争性结合tlr1/2复合体,并抑制tnf-α和il-1β信号通路,但该研究也没有涉及并探讨cu-cpt22对布鲁杆菌感染的作用。可见,现有的以tlr2为靶点进行抑制剂或抗体研发,大多以tlr2胞内区域与第二信使直接结合的结构为靶点进行设计和研发,其主要目的是抑制细胞内tlr2介导的信号通路,从而抑制细胞免疫应答。而尚没有以tlr2胞外区域为靶点的抗体或抑制剂的研究。tlr2是一种细胞表面膜蛋白,也是布鲁杆菌感染宿主细胞的第一道闸门,是布鲁杆菌多种表面结构蛋白的重要受体,因此,以tlr2胞外区域为靶点研发相关的单克隆抗体,封闭布鲁杆菌入侵宿主细胞的重要通道,在布鲁杆菌感染中具有重要意义。技术实现要素:本发明的一个目的是解决至少上述问题,并提供至少后面将说明的优点。本发明的目的是提供一种单克隆抗体,以解决上述现有技术存在的问题,以tlr2胞外区域编码259-278位氨基酸的基因序列为靶点制备的抗体,该抗体可以实现封闭布鲁杆菌入侵宿主细胞的重要通道。本发明还有一个目的是提供一种单克隆抗体的制备方法,通过此方法可以得到纯化后的单克隆抗体,以便于应用于抑制布鲁杆菌感染中。本发明还有一个目的是提供一种单克隆抗体在制备抑制布鲁杆菌疫苗中的应用,应用于抑制布鲁杆菌疫苗株对人巨噬细胞thp-1的感染中。为实现上述目的,本发明提供了如下方案:本发明提供一种单克隆抗体,所述单克隆抗体是以人源tlr2胞外区域编码259-278位氨基酸的基因序列为靶点的抗体。优选的是,编码的259-278位氨基酸序列为:vkitdeslfqvmkllnqisg。本发明还提供一种所述的单克隆抗体的制备方法,包含以下步骤:步骤1:免疫小鼠,分离小鼠脾脏细胞,并将小鼠脾脏细胞和小鼠骨髓细胞进行融合,经培养后,用elisa方法筛选阳性杂交瘤细胞,并将初筛得到的阳性杂交瘤细胞扩大培养;通过有限稀释法克隆扩大培养后的阳性杂交瘤细胞,筛选出od值高的阳性杂交瘤细胞株;步骤2:将所得的阳性杂交瘤细胞株的细胞上清液,通过小鼠单克隆抗体亚型鉴定试纸条鉴定单抗的亚型;步骤3:在小鼠腹腔内接种步骤2中已鉴定单抗亚型的阳性杂交瘤细胞株,在小鼠腹水液中分离和纯化单克隆抗体。优选的是,步骤1中所述小鼠脾脏细胞和小鼠骨髓细胞按4:1的密度混合。优选的是,用有限稀释法将获得的阳性杂交瘤细胞连续克隆两次,每次克隆用ht选择性培养基进行培养,克隆7天后进行elisa筛选,直至单克隆细胞阳性率为100%为止。本发明还提供一种所述的单克隆抗体在制备抑制布鲁杆菌的疫苗中的应用。优选的是,应用于抑制布鲁杆菌的疫苗株对人巨噬细胞thp-1的感染中。本发明公开了以下技术效果:本发明公开的tlr2是一种细胞表面膜蛋白,也是布鲁杆菌感染宿主细胞的第一道闸门,是布鲁杆菌多种表面结构蛋白的重要受体,而本发明所述的单克隆抗体,是以tlr2胞外区段编码259-278位氨基酸的基因序列为靶点的抗体,可以特异性识别tlr2,通过封闭布鲁杆菌入侵宿主细胞的第一道闸门,进而抑制布鲁杆菌疫苗株对人巨噬细胞thp-1的感染。在tlr2抗体处理下,布鲁杆菌疫苗株感染thp-1细胞12小时、24小时、48小时和72小时后,布鲁杆菌在宿主细胞内的菌落形成单位(colony-formingunits,cfu)分别为对照组的33.2%、63.2%、85.3%和87.6%,可见,该单克隆当体对于布鲁杆菌具有明显的抑制作用。因此,该单克隆抗体对于抑制布鲁杆菌疫苗株感染人宿主细胞的科学研究中具有重要的价值和意义,并且具有广阔的推广前景。本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为raybio小鼠亚型鉴定试纸条;图2为tlr2(259-278aa)单克隆细胞株亚型测定;图3为布鲁杆菌疫苗株m5-90感染人源巨噬细胞thp-1后的胞内生存情况。具体实施方式现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本申请说明书和实施例仅是示例性的。关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。实施例1单克隆抗体的制备1.1小鼠免疫a.免疫程序采用3次基础免疫和1次加强免疫。选用6~8周龄、体重18g左右且健康的雌性balb/c小鼠3只(637#,640#,639#),适应性饲养1周后,采集阴性血作为对照;b.首次免疫时(50μg/只)按免疫原与等体积的弗氏完全佐剂搅拌乳化,背部皮下多点注射,此后按免疫原与等体积的弗氏不完全佐剂搅拌乳化进行常规免疫;c.3次免疫时,一般50μg抗原+titermax等量混合乳化后,背部多点注射,7天后测效价,效价达到8万及以上,准备加强免疫,加强免疫不加佐剂,加强免疫剂量为75μg,加强免疫后3天,摘眼球采血,分离血清保存,测定抗血清效价;根据表1的测定结果可以看出:三只小鼠的效价已经达到32万,然后选用640#小鼠进行脾脏融合。表1tlr2(259-278aa)小鼠抗血清效价测定1.2细胞融合a.细胞融合时,将640#小鼠脾细胞与骨髓瘤细胞按4:1左右进行混合,并在聚乙二醇(peg,分子量为1450)的促融作用下进行融合,融合细胞在hat选择性培养液中进行培养,10天后通过间接elisa方法筛选出阳性杂交瘤细胞,并将初筛得到的阳性杂交瘤细胞扩大培养。具体操作过程如下:(1)脾细胞和骨髓瘤细胞按4:1比例混合,用预热的基础培养液洗涤1次后,1000r/min离心5min,弃上清液。(2)静置1min后,用吸管吸取残留的培养液,用手轻轻弹击离心管底部沉淀,使沉淀细胞松散均匀散开,并将离心管底部置于盛有37℃灭菌蒸馏水中。(3)慢慢转动离心管,并1min内加入1mlpeg。(4)用吸管将细胞悬液吸入吸管内停30s,缓慢地吹入离心管底部,37℃灭菌蒸馏水中静止1min。(5)由慢到快的速度在3min内加入预热的3ml基础dmem培养液,边加边转动离心管。(6)3min内加入预热的不完全培养液10ml稀释peg,使其失去促融作用。(7)2min内加入10ml预热的不完全培养液。(8)室温下静置10min。(9)800r/min离心4min,弃上清液。(10)沉淀用预热的hat培养液悬浮,将细胞悬液加入到铺有培养细胞的96孔板中,100μl/孔,然后将细胞培养板置于37℃,5%co2的培养箱中培养。10天后检测5块板中的阳性孔,标注斜体的是阳性血清与阴性血清对照。根据检测结果,选取了5a5、3e12、5a12、4b3、4h11、2e4进行了亚克隆筛选。表2tlr2(259-278aa)小鼠融合板测定。表2tlr2(259~278aa)小鼠融合板测定b.tlr2(259-278aa)小鼠亚克隆板测定:用有限稀释法将获得的阳性杂交瘤细胞连续亚克隆两次,每次亚克隆用ht选择性培养基进行培养,亚克隆7天后进行elisa筛选,直至单克隆细胞阳性率为100%为止。采用有限稀释法克隆杂交瘤细胞株,具体操作过程如下:(1)在克隆筛选的前1d或者当天制备好培养细胞,加入96孔细胞培养板中,100μl/孔,37℃,5%co2培养箱中培养备用。(2)强阳性孔内的细胞用吸管缓慢吹打,使其悬浮于培养液中,吸出100μl至2ml完全培养基中,计数。(3)用ht稀释细胞至约50个/ml,取4.8ml,加入96孔细胞培养板的前两排,剩余的补加2.4mlht培养液,加入96孔细胞培养板第4排和第5排,再补加2.4mlht培养液。依次类推,直到加完一个96孔细胞培养板。(4)将96孔培养板置37℃,5%co2的恒温培养箱中培养,将剩余的阳性细胞直接加入50ml的培养瓶内培养并冻存。(5)第4d用ht培养液半数换液。(6)第7d,取100μl杂交瘤细胞生长孔内的上清液,用间接elisa检测细胞上清中抗体。(7)选择单克隆且为强阳性孔(阳性孔的判断标准为od值大于阴性od值的2.1倍即为阳性,而强阳性就是在阳性孔中od值最高的孔)再次亚克隆,直到阳性克隆达到100%。(8)将筛选出的杂交瘤强阳性孔内细胞转移到6孔培养板扩大培养。(9)将扩大培养的杂交瘤细胞用50ml培养瓶内再次扩大培养,以1000r/min离心5min,收集上清液用间接elisa测效价,并冻存部分杂交瘤细胞。如表3所示,是tlr2(259-278aa)的第二次亚克隆结果,标注斜体的是阳性血清与阴性血清对照。阳性率已达到90%以上,筛选阳性od值较高的克隆孔,选择扩大培养(依次为:24孔板-6孔板-10cm大皿)。表3tlr2(259-278aa)小鼠亚克隆板测定c.应用小鼠单克隆抗体亚型鉴定试纸条鉴定单抗亚型,按试纸条说明书取单克隆细胞株上清20μl,测定小鼠亚型。图1是raybio小鼠亚型鉴定试纸条(goldseries),根据图1的对照,可以得出所制备的单克隆细胞株的小鼠亚型,结果如图2所示:tlr2(259~278aa)-5a5(lambed,igg1)。1.3腹水抗体制备及纯化a.选择8-12周龄雌性健康balb/c小鼠,腹腔注射石蜡油,0.5ml/只;7-10天后,给每只小鼠腹腔注射1×106~5×106个单克隆杂交瘤细胞。b.将腹水10000r/min离心15min,除去细胞成分和其他的沉淀物、脂肪以及油层等,收集中间层,测定抗体效价。c.饱和硫酸铵沉淀:吸取5ml处理好的腹水移入小烧杯中,在搅拌条件下,逐滴加入过0.22μm滤膜的pbs5.0ml;混合均匀后,再逐滴加入10ml饱和硫酸铵溶液(ph7.4),继续缓慢搅拌30min;静置2h后10000r/min离心15min,弃去上清,沉淀物用过0.22μm滤膜的pbs重悬,然后再将该重悬液过0.22μm滤膜。d.根据抗体不同亚型,选定不同的gehealthcare公司的纯化柱,igg和igm的柱子均有相应说明书,根据其说明书配制不同的缓冲液进行纯化:以igg抗体纯化为例,先用结合缓冲液、洗脱缓冲液及再生缓冲液将柱子进行平衡,通常平衡5个柱体积,然后将重悬的腹水缓冲液以1ml/min的速度上样,上样完成后用结合缓冲液平衡,再用洗脱液洗至基线位置,收集抗体峰;用pbs缓冲液将抗体进行透析,用bca蛋白定量试剂盒测定抗体浓度,并将抗体分装保存,并用间接elisa进行效价测定。表4tlr2(259~278aa)小鼠亚克隆板测定1:ab131-005250002.559100001.921200001.601400001.057800000.6841600000.5183200000.347blank0.125如表4所示,采用间接elisa法对纯化的tlr2(259-278aa)小鼠单克隆抗体做了效价测定,结果显示抗体效价均已达到32万及以上。实施例2中和抗体阻止布鲁杆菌侵染巨噬细胞实验1)将布鲁杆菌疫苗株m5-90接种于布氏琼脂培养基中,封闭开口,放置于10%的co2,37℃培养箱中培养,倒置培养3-5天,直至固体培养基中长出单菌落,挑单菌落于布氏肉汤液体培养基中培养,于37℃摇床中培养36h,收集菌液,使用pbs洗涤细胞3次,使用离心机用5000rpm转速离心5min,然后用pbs重悬菌液,用计数仪计算细菌的浓度。2)使用含10%fbs的dmem培养巨噬细胞,然后将细胞接种于24孔板(每孔细胞数1×105),首先加入100μg的tlr2抗体(259-278aa)(对照组用普通igg抗体代替)与细胞孵育4h,然后加入布鲁杆菌感染细胞,按细菌个数:细胞数为50:1的比例侵染1h,用pbs彻底洗涤巨噬细胞,以将胞外的布鲁杆菌去掉,然后加入含10%fbs的dmem继续培养巨噬细胞24h。3)用细胞裂解液将培养板上细胞裂解,收集细胞裂解液,将细胞裂解液按1:10,1:100,1:1000,1:10000,1:100000的比例进行梯度稀释,混匀,每一个稀释梯度取50μl的体积,均匀地涂布在布氏琼脂培养基中,放置于10%的co2,37℃培养箱中培养6h,计算布鲁杆菌菌落个数。在未感染(0h)、感染后4h、24h、48h和72h分别对实验组和对照组的胞内生存的布鲁杆菌进行计数,如表5所示结果显示:加入tlr2(259-278aa)抗体后,布鲁杆菌疫苗株的感染效率显著降低,表明tlr2(259-278aa)抗体在一定程度上抑制了布鲁杆菌疫苗株的感染。表5布鲁杆菌疫苗株m5-90感染人巨噬细胞thp1的cfu计数以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1