一种他替瑞林的合成方法与流程
1.本发明属于药物合成技术领域,具体涉及一种他替瑞林的合成方法。
背景技术:
2.他替瑞林(英文名为taltirelin),化学名为((4s)-n-[(2s)-1-[(2s)-2-氨基甲酰基吡咯烷-1-基]-3-(3h-咪唑-4-基)-1-氧代丙-2-基]-1-甲基-2,6-二氧代-1,3-二氮杂己环-4-甲酰胺,其结构如下所示:
[0003][0004]
他替瑞林是一种垂体激素释放兴奋药,由tanabe seiyaku(日本)公司研制开发,2000年9月首次在日本上市,是目前临床用于改善脊髓小脑变性患者的运动失调最为有效的药物。他替瑞林(taltirelin)是世界上第一个批准的口服促甲状腺素释放激素(trh),除具有内分泌作用外,还可发挥一定的中枢神经系统(cns)作用,包括提高运动活性,拮抗利舍平诱导的体温降低,以及拮抗戊巴比妥诱导的睡眠。脊髓小脑共济失调(scas)旧称常染色体显性共济失调,是一组以共济失调、辨距不良为主要临床表现的中枢神经系统慢性变性疾病。2000年9月前,促chemicalbook甲状腺素释放激素(trh)注射液是唯一用于治疗该类疾病的药物。他替瑞林是trh的结构修饰改造药物,药理学研究显示本品经由脑trh受体对cns产生强而持久的多重作用。
[0005]
目前他替瑞林的合成路线报道虽然众多,但大都存在工艺路线复杂,纯度低、杂质多的问题,需要繁复的后续纯化操作,进而影响本品的工艺化进程。因此,提供一种他替瑞林的合成路线,工艺简单,所得成品纯度高,杂质少,成为了本领域技术人员亟待解决问题。
技术实现要素:
[0006]
本发明的目的在于,针对上述问题,提供一种他替瑞林的合成方法,工艺简单,所得成品纯度高,杂质少。
[0007]
本发明采用的技术方案如下:
[0008]
本发明所述的一种他替瑞林的合成方法,以sm1、sm2为起始物料,先缩合反应形成中间体1,再脱boc基团反应生成中间体2,而后缩合反应形成中间体3,最后脱trt基团,得到他替瑞林,其合成路线为:
[0009][0010]
本发明的技术方案中,他替瑞林的合成方法包括以下步骤:
[0011]
步骤1.sm1、sm2与缩合剂、有机碱在第一溶剂中缩合反应,生成中间体1;
[0012]
步骤2.中间体1与氯化氢有机溶液反应,脱boc基团,生成中间体2;
[0013]
步骤3.sm3与中间体2、缩合剂和有机碱在第二溶剂中缩合反应,生成中间体3,
[0014]
步骤4.中间体3与酸反应,脱trt基团,生成他替瑞林粗品;
[0015]
步骤5.他替瑞林粗品经中和反应,生成他替瑞林。
[0016]
本发明的技术方案中,还包括精制步骤:将步骤5制得的他替瑞林经大孔吸附脂分离、纯化,得到精制后的他替瑞林。
[0017]
本发明的技术方案中,所述步骤1和步骤2中的缩合剂均包括tbtu、pybop,或/和所述步骤1和步骤2中的有机碱均包括nmm、二异丙基乙胺,三乙胺。
[0018]
具体地,所述步骤1中,加入的第一溶剂包括二氯甲烷、乙腈、n,n-二甲基甲酰胺中的任意一种或几种,优选地,为二氯甲烷;
[0019]
或/和所述步骤2中,所述氯化氢有机溶液包括氯化氢丙酮溶液、氯化氢甲醇溶液、氯化氢乙酸乙酯溶液;优选为氯化氢丙酮溶液;所述氯化氢有机溶液中氯化氢的质量百分含量为10-20%;
[0020]
或/和所述步骤3中,第二溶剂包括二氯甲烷、乙腈、n,n-二甲基甲酰胺中的任意一种或几种,优选地,为二氯甲烷;
[0021]
或/和所述步骤4中,所述酸包括三氟乙酸、醋酸。
[0022]
本发明的技术方案中,所述步骤1中,缩合反应的温度为0~10℃,优选为0~5℃;
[0023]
或/和所述步骤2中反应的温度为0~10℃,优选为5~10℃;
[0024]
或/和所述步骤3中缩合反应的温度为0~15℃,优选为0~10℃。
[0025]
本发明的技术方案中,所述步骤4中,将中间体3与酸先于低温条件反应一段时间后,再升温反应一段时间;
[0026]
优选地,先于0~15℃搅拌反应0.5~4小时,再升温至15~25℃搅拌反应1~3小时;
[0027]
更优选地,先于0~10℃搅拌反应2小时,再升温至15~20℃搅拌反应3小时。
[0028]
本发明的技术方案中,所述步骤1中,各物料的用量摩尔比为sm1:sm2:有机碱:缩合剂=1:0.8~1.2:2~2.5:1.8~2.2,优选为1:1.05:2.3:2。
[0029]
本发明的技术方案中,所述步骤2中,所述氯化氢有机溶液的用量为1~3ml/g中间
体1;优选为2ml/g中间体1。
[0030]
本发明的技术方案中,所述步骤3中,各物料的用量摩尔比为中间体3:sm3:有机碱:缩合剂=1:0.8~1.2:2.8~3.5:1.8~2.2;优选为1:1:3.3:2;
[0031]
或/和所述步骤4中,所述酸的用量为2~5ml/g中间体3;优选为3ml/g中间体3。
[0032]
本发明的一些实施例中,所述步骤1中,将sm1、sm2加入第一溶剂溶解后,降温后再加入缩合剂、有机碱;优选降温至0~10℃,更优选为降温至0~5℃。
[0033]
本发明的一些实施例中,所述步骤1中,于0~10℃缩合反应后,再室温搅拌过夜。
[0034]
作为优选,本发明的一些实施例中,步骤1中反应结束后,将反应液过滤除去不溶物,滤液经浓缩得到白色泡状物质;或滤液经洗涤、干燥、过滤得到白色泡状物质,即为中间体1。
[0035]
进一步地,所述步骤1还包括中间体1的重结晶步骤,具体为:将白色泡状物质中间体1加乙酸乙酯、或/和二氯甲烷溶解,然后滴加入搅拌下的正庚烷、或/和石油醚、或/和正己烷中,析出固体,继续搅拌5-30min,过滤,滤饼洗涤后干燥,得精制后的中间体1。
[0036]
本明的一些实施例中,所述步骤2中,将氯化氢有机溶液降温后,在搅拌状态下加入中间体1;优选地,氯化氢有机溶液降温至0~10℃,更优选地,降温至0~5℃;优选地,分次加入中间体1;优选地,在加入中间体1的过程中,控制混合液的温度为0~15℃,更优选地,控制混合液的温度为0~10℃。
[0037]
本发明的一些实施例中,所述步骤2反应完成后,加入甲醇,搅拌均匀后,再滴加丙酮,过滤,滤饼用丙酮洗涤,干燥,得到中间体2;优选地,控制温度不超过15℃滴加丙酮,而后降温至0~10℃搅拌反应0.5~5小时,再过滤;更优选地,降温至0~5℃搅拌1~2小时再过滤。
[0038]
作为本发明的一些实施例,所述步骤3中,将sm3加入第二溶剂溶解后,加入中间体2,将混合液的温度降至0~10℃,优选为0~5℃后再加入有机碱;而后放热,再降温至0~10℃,优选为0~5℃后加入缩合剂。
[0039]
作为优选,本发明的一些实施例中,所述步骤3中缩合反应结束后,将反应液过滤除去不溶物,滤液经浓缩得到白色泡状物质;或滤液经洗涤、干燥、过滤得到白色泡状物质,即为中间体3。
[0040]
进一步地,还包括中间体3的重结晶步骤;具体为:将白色泡状物质中间体3加二氯甲烷溶解,然后滴加入搅拌下的甲基叔丁基醚中,继续搅拌5-30min,过滤,滤饼用甲基叔丁基醚醚干燥,得精制后的中间体3。
[0041]
作为本发明的一些实施例,所述步骤4中,将酸降温至0~10℃,优选为0~5℃后,搅拌状态下分次加入中间体3,在加入中间体3的过程中,控制加入中间体3后的混合液温度不超过15℃。
[0042]
作为本发明的一些实施例,所述步骤4反应完成后,将反应液降温,依次滴加乙酸乙酯、甲基叔丁基醚,加毕,搅拌,过滤,滤饼用甲基叔丁基醚洗涤抽干后,再用乙酸乙酯打浆,过滤、干燥得到他替瑞林粗品。
[0043]
本发明中所述的化合物或基团的英文缩写为:
[0044]
tbtu:o-苯并三氮唑-n,n,n',n'-四甲基脲四氟硼酸
[0045]
nmm:n-甲基吗啡啉
[0046]
dcm:二氯甲烷
[0047]
boc:叔丁氧羰基
[0048]
trt:三苯甲基
[0049]
acetone:丙酮
[0050]
pybop:六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷
[0051]
与现有技术相比,本发明具有以下有益效果:
[0052]
本发明设计科学、方法简单。本发明创造性地采用sm1、sm2化合物为起始物料,选择性地脱去boc基团与trt基团,减少中间体3合成时的反应位点,潜在杂质相对减少,并且中间体3与中间体1的制备采用相同的合成方法,工艺稳定,收率高,杂质少。
附图说明
[0053]
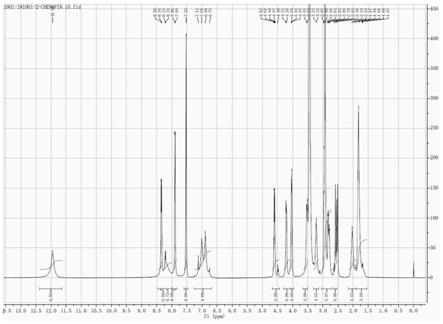
附图1为本发明方法制得的他替瑞林的红外图谱。
[0054]
附图2为日本药典的他替瑞林红外图谱。
[0055]
附图3为本发明方法制得的他替瑞林的hnmr图。
[0056]
附图4为采用文献报道方法制得的他替瑞林的杂质测定lc-ms图。
[0057]
附图5为本发明方法制得的他替瑞林的杂质测定lc-ms图。
具体实施方式
[0058]
以下具体实施方式可以对本发明的内容做出更为详细的说明,但本发明的主题范围不局限于以下具体实施例,凡是基于本发明内容所实现的技术、工艺均属于本发明的范围。
[0059]
实施例1
[0060]
本实施列提供了本发明的中间体1的合成方法,具体为:
[0061]
物料配比:
[0062]
名称m.w投料量摩尔比重量比/体积比sm1497.60149.3g1.001.00sm2114.1536.0g1.05-dcm-1500ml-10.0ml/gnmm101.1469.8g2.30-tbtu321.08192.6g2.00-[0063]
将sm1、sm2加入至反应瓶中,加入dcm溶解。降温至0~5℃,加入tbtu 2.00eq、nmm 2.30eq,控制温度0~5℃搅拌反应5~7小时,然后室温搅拌过夜。tlc原料sm1消失,过滤除去不溶物。滤液用8%碳酸氢钠溶液750ml洗涤三次,然后用5%柠檬酸溶液750ml、饱和氯化钠溶液洗涤750ml各洗涤一次。洗涤后有机相用无水硫酸钠干燥、过滤、浓缩得到白色泡状物质。将泡状物质溶解入乙酸乙酯(3ml/g)中,然后滴加入搅拌下正庚烷(18ml/g)中,析出固体,搅拌15分钟。过滤,滤饼用正庚烷洗涤后干燥得到175.0g中间体1,收率98.2%。
[0064]
实施例2
[0065]
本实施例公开了本发明的中间体2的合成方法,具体为:
[0066]
物料配比
[0067]
名称m.w投料量摩尔比重量比/体积比中间体1593.74130.0g1.001.00氯化氢甲醇溶液-260ml-2.00ml/g
[0068]
将氯化氢甲醇溶液加入至反应瓶中,降温至0~5℃。开启搅拌,分次加入按实施例1方法制得的中间体1,控制温度0~10℃。加毕,控制温度5~10℃搅拌反应完全。控制温度不超过15℃加入甲醇(2ml/g),搅拌均匀后,控制温度不超过15℃滴加丙酮(4ml/g)。降温至0~5℃搅拌1~2小时。过滤,滤饼用丙酮洗涤抽干。将滤饼于室温下减压干燥,得中间体2白色固体105.1g,收率90.55%。
[0069]
实施例3
[0070]
本实施例提供了本发明的中间体3的合成方法,具体为:
[0071]
名称m.w投料量摩尔比重量比/体积比中间体2530.1100.0g1.001.00sm3172.1432.5g1.00-dcm-1000ml-10.0ml/gnmm101.1462.93.30-tbtu321.08121.12.00-[0072]
将sm3加入至反应瓶中,加入dcm,开启搅拌,加入按实施例2的方法制得的中间体2。降温至0~5℃,加入nmm,放热,降温至0~5℃,加入tbtu。控制温度0~10℃搅拌反应4~6小时,然后5~15℃搅拌过夜。tlc原料中间体2消失,过滤除去不溶物。滤液用8%碳酸氢钠溶液500ml洗涤三次,然后用5%柠檬酸溶液500ml、饱和氯化钠溶液洗涤500ml各洗涤一次。洗涤后有机相用无水硫酸钠干燥、过滤、浓缩得到白色泡状物质。将泡状物质溶解入二氯甲烷(2.5ml/g)中,然后滴加入搅拌下甲基叔丁基醚醚中(10ml/g)中,析出固体,搅拌15分钟。过滤,滤饼用甲基叔丁基醚洗涤后干燥得到94.9g中间体3,收率77.66%。
[0073]
实施例4
[0074]
本实施例公开了本发明的由中间体3合成他替瑞林的方法,具体为:
[0075]
物料配比:
[0076]
名称m.w投料量摩尔比重量比/体积比中间体3647.7470.0g1.001.00三氟乙酸-210ml-3.00ml/g乙酸乙酯-420ml 6.00ml/g甲基叔丁基醚-1260ml 18.00ml/g
[0077]
将三氟乙酸加入至反应瓶中,降温至0~5℃,开启搅拌。分次加入中间体3,控制温度不超过15℃。加毕,控制温度0~10℃搅拌2小时。升温至15~20℃搅拌反应3小时,tlc监控反应终点。降温至0~5℃,控制温度20℃以下滴加乙酸乙酯。控制温度0~10℃滴加甲基叔丁基醚,加毕,搅拌1小时。过滤,滤饼用甲基叔丁基醚洗涤抽干。滤饼用乙酸乙酯(5.7ml/g)打浆16小时,过滤、40℃干燥得到48.3g粗品,收率86.12%,纯度97.6899%。
[0078]
实施例5
[0079]
本实施例公开了对实施例4制得的他替瑞林粗品的精制方法,具体为:
[0080]
将粗品用水(3ml/g)加入反应瓶中,开启搅拌。溶解后用碳酸氢钠调节ph=7~8,过滤。滤液上样至大孔吸附树脂层析柱(700g大孔树脂,体积约1000ml)。用2570ml水、860ml 5%甲醇溶液、1700ml10%甲醇溶液、1700ml 20%甲醇溶液、2570ml 30%甲醇溶液依次冲洗层析柱。通过tlc确定收集产品流分,收集到的流分60℃减压浓缩至干得到泡沫状固体4.63g。加入20ml水溶解,并用0.4g活性炭脱色30分钟。过滤,滤液60℃减压浓缩至干得到4.56g泡沫状固体。加入水8.52g加热至35~40℃溶解,开启搅拌。降温至0~5℃,搅拌30分钟后析出固体。搅拌30分钟后过滤。滤饼干燥后得到2.01g类白色固体。收率:20.10%,纯度:99.8976%,最大单杂0.0578%。
[0081]
熔点为69.5℃,与现有技术报道一致。
[0082]
水分:15.2%,日本药典中记载的水分值14.0~15.5%,与现有技术报道一致。
[0083]
旋光值:-23.9
°
,日本药典中记载的旋光值为-22.5~-24.5
°
,与现有技术报道一致。
[0084]
lc-ms:m+h=406.1828(不包含结晶水的理论值:406.1838)
[0085]
红外光谱:δ3316、1674有明显特征吸收,δ620.59~1448指纹区与jp标准图谱一致。
[0086]
hnmr(溶剂d-dmso):δ1.67~2.03(4h),δ2.54~2.63(1h),δ2.63~2.97(6h),δ3.21~3.22(1h),δ3.51~3.53(1h),δ4.03~4.04(1h),δ4.20~4.22(1h),δ4.59~4.62(1h),δ6.75~7.12(2h),δ7.52(1h),δ8.21~8.23(1h),δ8.34~8.36(1h),δ11.93(1h)。
[0087]
实施例6
[0088]
他替瑞林中杂质的测定。
[0089]
取实施例4制得的他替瑞林、以及采用专利cn 102002004a公开方法合成得到的他替瑞林,测杂质含量。
[0090]
测定方法:采用lc-ms测定,色谱条件如下:
[0091]
采用ods c18柱,50mm*4.6mm*3.5um,柱温为40℃,流速为2ml/min;以含0.01mol/l nh4hco3的水溶液为流动相a,以乙腈为流动相b,按下表规定进行洗脱,
[0092]
时间(min)流动相a(%)流动相b(%)05951.69553955。
[0093]
结果如附图4所示,本发明方法制成的他替瑞林最大单杂为1.28%,总杂为4.86%;采用文献报道方法制成的他替瑞林的最大单杂为19.80%,总杂为58.59%。
[0094]
综上,采用本发明所得的他替瑞林的收率更高,杂质含量更少。且本发明工艺简单,操作简便,反应条件温和,所需原料易得,具有良好的工业化基础。
[0095]
上述实施例仅为本发明的优选实施方式之一,不应当用于限制本发明的保护范围,但凡在本发明的主体设计思想和精神上作出的毫无实质意义的改动或润色,其所解决的技术问题仍然与本发明一致的,均应当包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1