一种异喹啉酮类衍生物的制备方法与流程
本发明涉及一种合成一类新型含内酰胺类化合物的制备方法,尤其涉及一种多取代喹啉酮类衍生物的制备方法。
背景技术:
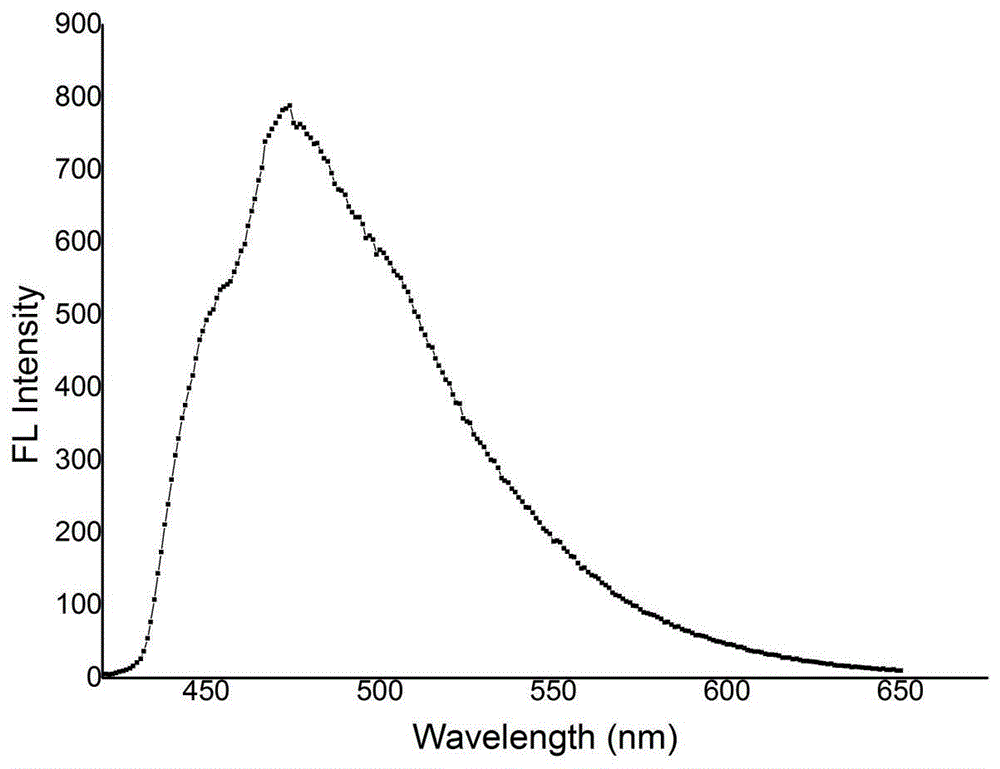
:异喹啉酮结构骨架是有机化学中一类重要的结构单元,而且其衍生物种类繁多,其母核结构广泛存在于天然产物、天然植物生物碱中,并且具有很好的生物活性(j.nat.prod.1997,60,108;j.med.chem.2006,49,6451;j.med.chem.2004,47,5651.),例如消炎杀菌(tetrahedronlett.1998,39,3099.)、抗肿瘤(j.am.chem.soc.2011,133,14952.)、舒张血管(chin.j.org.chem.2015,35,1112.)和降血压等作用。因此,关于异喹啉酮类衍生物的合成方法研究吸引了众多化学家的关注。传统的构建异喹啉酮类衍生物的方法包括以下几种:一是利用异香豆素氨化构建异喹啉酮,该反应需要预先制备的异香豆素作为反应底物,碳酸铵或者伯胺为氨源,在乙酸中回流得到对应的异喹啉酮衍生物(chem.pharm.bull.1983,31,1277.);二是利用双锂化反应构建异喹啉酮,该反应以邻甲基苯甲酰胺为底物,利用仲丁基锂对酰胺和甲基攫氢,然后碳负对n,n-二甲基甲酰胺加成,最后用盐酸脱去一分子水构建异喹啉酮(j.org.chem.1992,57,2700.),反应中使用两种锂试剂具有一定的危险性;还有一种方法是利用2-溴甲基苯甲腈在三乙胺作碱的条件下,与邻苯二甲酸酐缩合构建异喹啉酮骨架,但是该方法只适用于强缺电子底物,使反应受限,且反应效率不高(org.lett.2005,7,1753.)。综上可知,传统构建方法普遍存在底物受限,反应条件苛刻的问题,例如强酸、强碱或低温等。随着近十几年来过渡金属催化的发展,给异喹啉酮衍生物的合成提供了很多新的合成思路。一种是利用c-h键活化策略构建异喹啉酮衍生物,但是该方法需要加入大量氧化剂,且需要高温。而另一种方法是利用邻炔基苯甲酰胺来构建,但由于化学选择性的影响,使得产物常常是两种甚至两种以上的混合物。因此急需发展一种高效且可控的方法来构建异喹啉酮类化合物。技术实现要素:本发明的目的是针对现有技术的不足,提供了一种异喹啉酮类衍生物的制备方法。本发明的目的是通过以下技术方案来实现的:一种异喹啉酮类衍生物的制备方法,该方法包括:按照1:0.1-1.5的摩尔比称取8-炔基-1-芳酰萘胺类化合物和催化剂,将它们置于反应容器中,然后在反应容器中加入溶剂至8-炔基-1-芳酰萘胺类化合物完全溶解;将反应容器置于80-150℃下搅拌反应0-36小时,经过后处理即得产物多取代异喹啉酮类化合物。进一步地,所述8-炔基-1-芳酰萘胺类化合物为8-取代芳烃乙炔基-1-芳酰萘胺类化合物、8-杂环乙炔基-1-芳酰萘胺类化合物或8-烷烃乙炔基-1-芳酰萘胺类化合物;溶剂采用非质子性溶剂。进一步地,所述非质子性溶剂为乙腈、甲苯、四氢呋喃、二氯甲烷、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n-甲基吡咯烷酮、六甲基磷酰胺或二甲亚砜。进一步地,所述非质子性溶剂优选为n,n-二甲基甲酰胺。进一步地,所述催化剂为ag2o、agoac、agno3、agtfa、agotf、cu(oac)2·h2o、cu(oac)2、cu(acac)2、cubr2、cuso4、cucn、cuf2、cuotf、cu(otf)2、cu(no3)2·3h2o、cucl2·2h2o、cui、cubr、cucl、cu2o、pd(oac)2、pd(otf)2和pdcl2中的一种或多种。进一步地,所述催化剂优选为cucn。进一步地,所述反应温度为80℃、90℃、100℃、110℃、120℃、130℃、140℃或150℃。优选的,所述反应温度为120℃。进一步地,所述8-炔基-1-芳酰萘胺类化合物和催化剂的摩尔比优选为1.0:0.2。本发明的有益效果是:本发明采用“一锅法”合成多取代异喹啉酮类衍生物,该反应操作方法容易,反应条件简单,反应原料易得,反应选择性好,产率优良,底物普适性良好,使用催化量的cucn为催化剂,生产成本低廉,不仅适用于实验室小规模制备,还适用于工业化生产。而且该反应减少了中间体分离纯化的工艺,本发明以8-炔基-1-芳酰萘胺类化合物为起始原料,以cucn为催化剂;反应原料简单易得,为多取代异喹啉酮类衍生物的活性筛选提供了很好的方法,而且多取代异喹啉酮类衍生物还具有良好的荧光性能,为寻找新型荧光分子提供了帮助。进一步的,可以将多取代异喹啉酮类衍生物转化为更多有生物活性的分子。具体实施方式多取代异喹啉酮类衍生物结构如下所示:其中:r1=h,r2=h,r3=h,r4=ph,r5=h,r6=h;r1=me,r2=h,r3=h,r4=ph,r5=h,r6=h;r1=cl,r2=h,r3=h,r4=ph,r5=h,r6=h;r1=h,r2=h,r3=h,r4=p-chlorophenyl,r5=h,r6=h;r1=h,r2=h,r3=h,r4=p-fluorophenyl,r5=h,r6=h;r1=h,r2=h,r3=h,r4=m-fluorophenyl,r5=h,r6=h;r1=h,r2=h,r3=h,r4=m-methylphenyl,r5=h,r6=h;r1=h,r2=h,r3=h,r4=m-chlorophenyl,r5=h,r6=h;r1=h,r2=h,r3=h,r4=o-methylphenyl,r5=h,r6=h;r1=h,r2=h,r3=h,r4=o-chlorophenyl,r5=h,r6=h;r1=h,r2=h,r3=h,r4=o-methoxyphenyl,r5=h,r6=h;r1=h,r2=h,r3=h,r4=p-methylphenyl,r5=h,r6=h;r1=h,r2=h,r3=h,r4=p-ethylphenyl,r5=h,r6=h;r1=h,r2=h,r3=h,r4=1-naphthyl,r5=h,r6=h;r1=h,r2=h,r3=h,r4=2-thienyl,r5=h,r6=h;r1=h,r2=h,r3=h,r4=3-thienyl,r5=h,r6=h;r1=h,r2=h,r3=h,r4=n-butyl,r5=h,r6=h;r1=h,r2=h,r3=h,r4=p-chlorophenyl,r5=br,r6=h;r1=h,r2=h,r3=h,r4=p-chlorophenyl,r5=no2,r6=h;r1=h,r2=h,r3=h,r4=p-chlorophenyl,r5=nh2,r6=h;r1=h,r2=h,r3=h,r4=p-chlorophenyl,r5=ch2,r6=ch2.本发明的合成方法是采用“一锅法”的合成方式,具体为:按照1:0.1-1.5的摩尔比称取8-炔基-1-芳酰萘胺类化合物和催化剂,将它们置于反应容器中,然后在反应容器中加入溶剂1-10毫升至8-炔基-1-芳酰萘胺类化合物完全溶解;将反应容器置于80-150℃下搅拌反应0-36小时,反应结束后冷却至室温,将反应液转移至分液漏斗,加入10-100毫升水,用10-50毫升乙酸乙酯萃取两次,合并有机相减压蒸馏除去溶剂;经硅胶色谱柱分离,减压蒸馏,即得产物多取代异喹啉酮类化合物。本合成方法中,8-炔基-1-芳酰萘胺类化合物为8-取代芳烃乙炔基-1-芳酰萘胺类化合物、8-杂环乙炔基-1-芳酰萘胺类化合物或8-烷烃乙炔基-1-芳酰萘胺类化合物。溶剂可以采用非质子性溶剂,如乙腈、甲苯、四氢呋喃、二氯甲烷、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n-甲基吡咯烷酮、六甲基磷酰胺或二甲亚砜中的一种或多种。其中最好的为n,n-二甲基甲酰胺。催化剂为ag2o、agoac、agno3、agtfa、agotf、cu(oac)2·h2o、cu(oac)2、cu(acac)2、cubr2、cuso4、cucn、cuf2、cuotf、cu(otf)2、cu(no3)2·3h2o、cucl2·2h2o、cui、cubr、cucl、cu2o、pd(oac)2、pd(otf)2和pdcl2中的一种或多种,其中最好的催化剂为cucn。所述反应温度为80℃、90℃、100℃、110℃、120℃、130℃、140℃或150℃,其中最好的反应温度为120℃。8-炔基-1-芳酰萘胺类化合物和催化剂的摩尔比优选为1.0:0.2。附图说明图1为本发明实施例7得到产物的液体荧光光谱图;图2为本发明实施例7得到产物在自然光(左)和紫外光(365nm,右)下的拍摄图片。下面通过具体的实施例子进一步说明本发明,但并不因此将本发明限制在所述的实施范例之中。表一给出了实施例1-7中异喹啉酮类化合物的结构。表1多取代异喹啉酮类衍生物实施例1-7实施例r1r2r3r41hp-chlorophenylhh2hphhh3mephhh4hp-methylphenylhh5hm-chlorophenylhh6hp-chlorophenylch2ch27h2-thienylhh实施例1室温下在圆底烧瓶中依次加入n-苯甲酰基-8-对氯苯乙炔基萘胺(0.1mmol),cucn(0.02mmol)和n,n-二甲基甲酰胺(2ml),之后在120℃下搅拌反应直至n-苯甲酰基-8-对氯苯乙炔基萘胺反应完全。反应结束后,冷却至室温,将反应液转移至分液漏斗,加入20毫升水,用10毫升乙酸乙酯萃取两次,合并有机相减压蒸馏除去溶剂;经硅胶(300-400目青岛海洋硅胶粉)柱色谱分离,减压蒸馏,产率为84%,鉴定结果为:yellowsolid,1hnmr(400mhz,cdcl3)δ8.67(d,j=7.8hz,1h),8.53(d,j=6.0hz,1h),7.80(d,j=8.1hz,1h),7.75–7.59(m,5h),7.58–7.52(m,1h),7.50–7.36(m,3h),7.27(d,j=8.1hz,1h),6.61(d,j=7.1hz,1h);13cnmr(100mhz,cdcl3)δ160.33,137.99,136.75,136.13,134.85,133.43,132.50,132.03,130.25,130.20,129.57,129.18,128.56,128.21,127.20,127.14,126.65,125.62,125.43,122.47,121.28,116.85,113.64;ir(neat)3131,1658,1401,763cm-1;hrms(esi-tof)calcdforc25h15clno(m+h):380.0842,found380.0838.实施例2室温下在圆底烧瓶中依次加入n-苯甲酰基-8-苯乙炔基萘胺(0.5mmol),cucl(0.2mmol)和n,n-二甲基乙酰胺(3ml),之后在130℃下搅拌反应直至n-苯甲酰基-8-苯乙炔基萘胺反应完全。反应结束后,冷却至室温,将反应液转移至分液漏斗,加入50毫升水,用20毫升乙酸乙酯萃取两次,合并有机相减压蒸馏除去溶剂;经硅胶(300-400目青岛海洋硅胶粉)柱色谱分离,减压蒸馏,产率为81%,鉴定结果为:yellowsolid,1hnmr(400mhz,cdcl3)δ8.69(d,j=7.8hz,1h),8.59–8.46(m,1h),7.77(d,j=8.1hz,1h),7.72–7.61(m,5h),7.60(d,j=9.1hz,1h),7.58–7.52(m,1h),7.48(d,j=7.5hz,2h),7.40–7.28(m,2h),6.52(d,j=7.3hz,1h);13cnmr(100mhz,cdcl3)δ160.32,138.03,137.00,135.97,134.93,132.33,131.97,130.43,130.12,129.85,129.78,129.02,128.72,128.49,128.06,127.00,126.30,125.73,125.62,122.28,121.26,118.25,113.45;ir(neat)3128,1654,1401,765cm-1;hrms(esi-tof)calcdforc25h16no(m+h):346.1232,found346.1235.实施例3室温下在圆底烧瓶中依次加入n-对甲基苯甲酰基-8-苯乙炔基萘胺(0.2mmol),agotf(0.1mmol)和二甲亚砜(4ml),之后在80℃下搅拌反应直至n-对甲基苯甲酰基-8-苯乙炔基萘胺反应完全。反应结束后,冷却至室温,将反应液转移至分液漏斗,加入30毫升水,用15毫升乙酸乙酯萃取两次,合并有机相减压蒸馏除去溶剂;经硅胶(300-400目青岛海洋硅胶粉)柱色谱分离,减压蒸馏,产率为62%,鉴定结果为:yellowsolid,1hnmr(400mhz,cdcl3)δ8.63–8.49(m,2h),7.76(d,j=8.2hz,1h),7.72–7.60(m,5h),7.52–7.44(m,2h),7.43–7.31(m,2h),7.07(s,1h),6.46(d,j=7.3hz,1h),2.40(s,3h);13cnmr(100mhz,cdcl3)δ170.30,143.13,138.16,137.15,136.10,135.07,130.44,130.17,129.96,129.94,129.88,129.10,128.68,128.51,128.11,127.23,126.26,125.57,123.49,122.21,121.23,118.27,113.40,22.01;ir(neat)3133,1657,1401,761cm-1;hrms(esi-tof)calcdforc26h18no(m+h):360.1388,found360.1389.实施例4室温下在圆底烧瓶中依次加入n-苯甲酰基-8-对甲基苯乙炔基萘胺(0.3mmol),cui(0.1mmol)和n,n-二甲基甲酰胺(5ml),之后在100℃下搅拌反应直至n-苯甲酰基-8-对甲基苯乙炔基萘胺反应完全。反应结束后,冷却至室温,将反应液转移至分液漏斗,加入50毫升水,用20毫升乙酸乙酯萃取两次,合并有机相减压蒸馏除去溶剂;经硅胶(300-400目青岛海洋硅胶粉)柱色谱分离,减压蒸馏,产率为56%,鉴定结果为:yellowsolid,1hnmr(400mhz,cdcl3)δ8.68(d,j=7.7hz,1h),8.59–8.48(m,1h),7.77(d,j=8.1hz,1h),7.69–7.63(m,2h),7.62(d,j=7.6hz,1h),7.61–7.54(m,1h),7.46(d,j=7.6hz,2h),7.41–7.30(m,4h),6.60(d,j=7.2hz,1h),2.56(s,3h);13cnmr(100mhz,cdcl3)δ160.46,138.51,138.13,137.24,136.01,132.33,131.78,130.57,130.22,130.17,129.94,129.08,128.54,128.07,127.23,127.02,126.26,125.84,125.66,122.32,121.34,118.37,113.46,21.54;ir(neat)3133,1661,1401,773cm-1;hrms(esi-tof)calcdforc26h18no(m+h):360.1388,found360.1387.实施例5室温下在圆底烧瓶中依次加入n-苯甲酰基-8-间氯苯乙炔基萘胺(0.6mmol),cubr(0.24mmol)和n-甲基吡咯烷酮(7ml),之后在90℃下搅拌反应直至n-苯甲酰基-8-间氯苯乙炔基萘胺反应完全。反应结束后,冷却至室温,将反应液转移至分液漏斗,加入60毫升水,用25毫升乙酸乙酯萃取两次,合并有机相减压蒸馏除去溶剂;经硅胶(300-400目青岛海洋硅胶粉)柱色谱分离,减压蒸馏,产率为51%,鉴定结果为:yellowsolid,1hnmr(400mhz,cdcl3)δ8.69(d,j=7.8hz,1h),8.56(d,j=4.9hz,1h),7.82(d,j=8.1hz,1h),7.77–7.55(m,6h),7.52(s,1h),7.44–7.36(m,2h),7.28(d,j=7.8hz,1h),6.60(d,j=7.2hz,1h);13cnmr(100mhz,cdcl3)δ160.36,137.99,136.84,136.60,135.65,132.57,131.25,130.65,130.21,129.49,129.21,129.03,128.83,128.61,128.59,128.24,127.28,127.15,126.72,125.61,125.46,122.52,121.36,116.69,113.71;ir(neat)3153,1656,1401,767cm-1;hrms(esi-tof)calcdforc25h15clno(m+h):380.0842,found380.0840.实施例6室温下在圆底烧瓶中依次加入n-苯甲酰基-4,5-环乙基8-对氯苯乙炔基萘胺(1.0mmol),cucn(1.0mmol)和n,n-二甲基甲酰胺(7ml),之后在150℃下搅拌反应直至n-苯甲酰基-4,5-环乙基8-对氯苯乙炔基萘胺反应完全。反应结束后,冷却至室温,将反应液转移至分液漏斗,加入80毫升水,用30毫升乙酸乙酯萃取两次,合并有机相减压蒸馏除去溶剂;经硅胶(300-400目青岛海洋硅胶粉)柱色谱分离,减压蒸馏,产率为57%,鉴定结果为:yellowsolid,1hnmr(400mhz,cdcl3)δ8.70(d,j=8.0hz,1h),8.32(d,j=7.2hz,1h),7.70–7.60(m,3h),7.57(t,j=7.5hz,1h),7.47(d,j=8.1hz,2h),7.43(d,j=7.4hz,1h),7.32(d,j=8.1hz,1h),7.23(d,j=7.4hz,1h),6.66(d,j=7.1hz,1h),3.51(s,4h);13cnmr(100mhz,cdcl3)δ160.44,146.52,141.49,137.08,136.60,134.73,134.63,133.82,132.29,132.12,130.01,128.21,126.87,126.84,125.71,125.58,125.39,125.32,123.17,122.05,121.45,120.33,115.21,32.89,32.18;ir(neat)3131,1664,1401,761cm-1;hrms(esi-tof)calcdforc27h17clno(m+h):406.0999,found406.0993.实施例7室温下在圆底烧瓶中依次加入n-苯甲酰基-8-2-噻吩乙炔基萘胺(0.6mmol),cuotf(0.3mmol)和n,n-二甲基乙酰胺(6ml),之后在140℃下搅拌反应直至n-苯甲酰基-8-2-噻吩乙炔基萘胺反应完全。反应结束后,冷却至室温,将反应液转移至分液漏斗,加入70毫升水,用25毫升乙酸乙酯萃取两次,合并有机相减压蒸馏除去溶剂;经硅胶(300-400目青岛海洋硅胶粉)柱色谱分离,减压蒸馏,产率为73%,鉴定结果为:yellowsolid,1hnmr(400mhz,cdcl3)δ8.66(d,j=7.9hz,1h),8.53(d,j=6.5hz,1h),7.82(d,j=8.1hz,1h),7.73–7.61(m,4h),7.56(t,j=7.5hz,1h),7.52–7.41(m,2h),7.40–7.32(m,1h),7.22(d,j=2.5hz,1h),6.69(d,j=7.2hz,1h);13cnmr(100mhz,cdcl3)δ160.48,138.11,137.89,137.63,135.15,132.64,130.09,129.38,129.08,128.82,128.74,128.34,128.01,127.97,127.20,127.03,126.91,125.54,125.34,122.61,121.95,113.80,110.16;ir(neat)3132,1655,1401,766cm-1;hrms(esi-tof)calcdforc23h14nos(m+h):352.0796,found352.0793.该化合物具有很好的荧光性能,其中,图1为该化合物的荧光光谱图,图2为该化合物在自然光(左)和紫外光(365nm,右)下的拍摄图片,说明了本实施例化合物具有较好的荧光性能。上述实施例用来解释说明本发明,而不是对本发明进行限制,在本发明的精神和权利要求的保护范围内,对本发明作出的任何修改和改变,都落入本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1