一种乙酰苯胺类化合物及其制备方法和应用与流程
本发明涉及一种乙酰苯胺类化合物及其制备方法和应用,属于有机合成技术领域。
背景技术:
乙酰苯胺类化合物作为经典的药物骨架结构一直活跃在药物世界中,含有乙酰苯胺类化合物结构的药物也层出不穷。乙酰苯胺类化合物质是一类具有生物和药物活性的含氮杂环化合物,是某些天然产物和药物的重要结构骨架。乙酰苯胺类化合物是许多天然产物、药物合成的结构单元,而且最为重要的是许多杂环化合物呈现生物活性,如神经系统中的局部麻醉药奥他卡因(octacaine),依替卡因(etidocaine)酰胺族局麻药,解热镇痛药非那西丁(phenacetin),β1受体阻滞剂醋丁洛尔(acebutolol),酰苯胺类解热镇痛药布西丁(bucetin)。因此,对这类化合物的绿色合成新方法研究具有重要的实践意义。
发展绿色、环境友好的合成新工艺成为现代药物合成研究工作者新的兴趣所在。近些年,合成含有乙酰苯胺化合物的方法陆续报道,这些传统的方法需要较为复杂的条件——合成步骤繁琐、需要添加贵金属催化剂、需要环境不友好的原料、很长的反应时间等。
本发明研究出了一种合成乙酰苯胺类化合物的新方法,并合成12个未见文献报道的乙酰苯胺类新化合物。该方法有着绿色环保、简捷高效、条件温和、产率高等优点;这类化合物的合成,选择了价廉易得且未见报道的1,4-二氧六环化合物为酰化试剂,具有原始创新性和很高的应用价值。
技术实现要素:
本发明的目的在于克服上述现有技术的不足之处而提供一种乙酰苯胺类化合物及其制备方法和应用。
为实现上述目的,本发明采取的技术方案为:一种乙酰苯胺类化合物,所述乙酰苯胺类化合物的结构如通式i所示:
其中,r选自氢、c1~c4的烃基、c1~c4的烷氧基、卤素、羟基、芳基、酯基、硝基或3,5-二甲基。
作为本发明所述乙酰苯胺类化合物的优选实施方式,所述c1~c4的烃基为-ch3或-c(ch3)3。
作为本发明所述乙酰苯胺类化合物的优选实施方式,所述c1~c4的烷氧基为-och3。
作为本发明所述乙酰苯胺类化合物的优选实施方式,所述酯基为-cooch2ch3。
作为本发明所述乙酰苯胺类化合物的优选实施方式,所述乙酰苯胺类化合物的结构为:
第二方面,本发明提供了上述乙酰苯胺类化合物的制备方法,包括以下步骤:
在反应器中,加入化合物1和1,4-二氧六环,然后加入氧化剂和酸,搅拌反应,即得乙酰苯胺类化合物。
作为本发明所述乙酰苯胺类化合物的制备方法的优选实施方式,所述化合物1和1,4-二氧六环的摩尔比为1:(10~20),所述化合物1和氧化剂的摩尔比为1:(0.5~2),所述化合物1和酸的摩尔比为1:(0.1~1)。
优选地,所述化合物1和1,4-二氧六环的摩尔比为1:10。
作为本发明所述乙酰苯胺类化合物的制备方法的优选实施方式,所述反应温度为80~160℃,反应时间为1~24h。
作为本发明所述乙酰苯胺类化合物的制备方法的优选实施方式,所述氧化剂为过氧化氢、过氧乙酸、二叔丁基过氧化物、叔丁基过氧化氢、2,2,6,6-四甲基哌啶氧化物、过硫酸铵中的至少一种,所述酸为间氯过氧苯甲酸、三氟甲磺酸、盐酸、对甲苯磺酸、三氟乙酸、醋酸中的至少一种。
作为本发明所述乙酰苯胺类化合物的制备方法的优选实施方式,反应结束后冷却至室温,稀释反应液,过滤,减压旋蒸除去溶剂得到粗产物,粗产物经柱层析提纯得到乙酰苯胺类化合物。
优选地,所述反应器是指schlenk管(史兰克管),在空气条件下反应。
优选地,柱层析提纯所用的洗脱液为石油醚:二氯甲烷:乙酸乙酯的体积比为(0.5~50):(0~20):1的混合溶剂。
第三方面,本发明提供了上述乙酰苯胺类化合物在制备抗肿瘤药物中的应用。
优选地,所述抗肿瘤药物为抗人早幼粒急性白血病细胞hl60和人宫颈癌hela细胞的药物。
与现有技术相比,本发明的有益效果为:本发明提供了一种具有抗肿瘤活性的乙酰苯胺类化合物及其制备方法与应用,有效地解决了具有抗肿瘤活性的乙酰苯胺类化合物的制备问题。通过本发明的制备方法可以高效合成乙酰苯胺类化合物,具有合成步骤简单、操作安全、原料无毒且原料价廉易得等优点。本发明制备过程选择性好且原子经济性高,得到的乙酰苯胺类产物结构新颖,可进一步开发其生物活性;本发明的乙酰苯胺类化合物对人白血病细胞k562、人早幼粒急性白血病细胞hl60和人宫颈癌hela细胞具有良好的抑制作用。因此,该类化合物既作为抗肿瘤试剂用于体外抗肿瘤活性筛选中,也可用于防治肿瘤的药物中。
附图说明
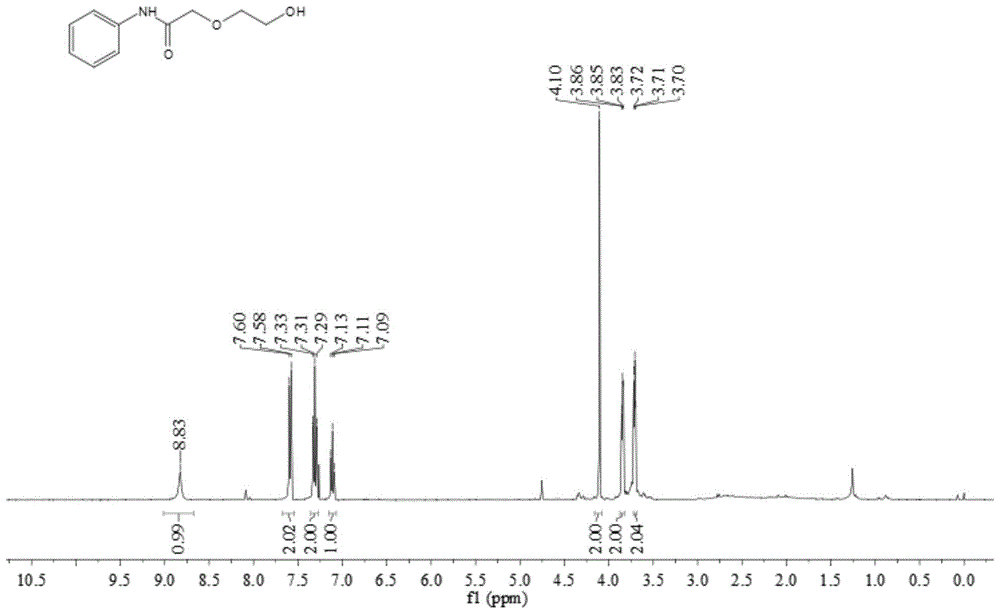
图1为实施例1所得产物2a的氢谱图。
图2为实施例1所得产物2a的碳谱图。
图3为实施例2所得产物2b的氢谱图。
图4为实施例2所得产物2b的碳谱图。
图5为实施例3所得产物2c的氢谱图。
图6为实施例3所得产物2c的碳谱图。
图7为实施例4所得产物2d的氢谱图。
图8为实施例4所得产物2d的碳谱图。
图9为实施例5所得产物2e的氢谱图。
图10为实施例5所得产物2e的碳谱图。
图11为实施例6所得产物2f的氢谱图。
图12为实施例6所得产物2f的碳谱图。
图13为实施例7所得产物2g的氢谱图。
图14为实施例7所得产物2g的碳谱图。
图15为实施例8所得产物2h的氢谱图。
图16为实施例8所得产物2h的碳谱图。
图17为实施例9所得产物2i的氢谱图。
图18为实施例9所得产物2i的碳谱图。
图19为实施例10所得产物2j的氢谱图。
图20为实施例10所得产物2j的碳谱图。
图21为实施例11所得产物2k的氢谱图。
图22为实施例11所得产物2k的碳谱图。
图23为实施例12所得产物2l的氢谱图。
图24为实施例12所得产物2l的碳谱图。
具体实施方式
为更好地说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。
实施例1
在反应器中,加入0.5毫摩尔苯胺和5毫摩尔1,4-二氧六环,0.25毫摩尔二叔丁基过氧化物,0.05毫摩尔三氟乙酸,在80℃下搅拌反应16小时,反应结束后冷却至室温,稀释反应液,过滤,减压旋蒸除去溶剂即可得到粗产物,粗产物经柱层析提纯得到2-(2-hydroxyethoxy)-n-phenylacetamide化合物2a。
所得产物2a的氢谱图及碳谱图分别如图1和图2所示,结构表征数据如下:
1hnmr(400mhz,cdcl3)δ8.83(s,1h),7.59(d,j=8.0hz,2h),7.31(t,j=7.8hz,2h),7.11(t,j=7.4hz,1h),4.10(s,2h),3.87–3.83(m,2h),3.72–3.69(m,2h);
13cnmr(101mhz,cdcl3)δ168.23,137.30,128.98,124.55,119.95,73.17,70.54,61.48;
hrms(esi):calcd.forc10h14no3[m+h]+:196.0968;found:196.0961。
根据以上数据推断所得产物2a的结构如下式所示:
实施例2
在反应器中,加入0.5毫摩尔4-甲基苯胺和10毫摩尔1,4-二氧六环,1毫摩尔过氧化氢,0.05毫摩尔间氯过氧苯甲酸,在100℃下搅拌反应16小时,反应结束后冷却至室温,稀释反应液,过滤,减压旋蒸除去溶剂即可得到粗产物,粗产物经柱层析提纯得到2-(2-hydroxyethoxy)-n-(p-tolyl)acetamide化合物2b。
所得产物2b的氢谱图及碳谱图分别如图3和图4所示,结构表征数据如下:
1hnmr(400mhz,cdcl3)δ8.67(s,1h),7.38(d,j=8.3hz,2h),7.03(d,j=8.2hz,2h),4.02(s,2h),3.79–3.73(m,2h),3.64–3.60(m,2h),2.23(s,3h);
13cnmr(101mhz,cdcl3)δ168.04,134.73,134.16,129.46,119.98,73.16,70.55,61.48,20.87;
hrms(esi):calcd.forc11h16no3[m+h]+:210.1125;found:210.1113。
根据以上数据推断所得产物2b的结构如下式所示:
实施例3
在反应器中,加入0.5毫摩尔3-甲氧基苯胺和10毫摩尔1,4-二氧六环,0.5毫摩尔过氧乙酸,0.5毫摩尔三氟甲磺酸,在160℃下搅拌反应16小时,反应结束后冷却至室温,稀释反应液,过滤,减压旋蒸除去溶剂即可得到粗产物,粗产物经柱层析提纯得到2-(2-hydroxyethoxy)-n-(3-methoxyphenyl)acetamide化合物2c。
所得产物2c的氢谱图及碳谱图分别如图5和图6所示,结构表征数据如下:
1hnmr(400mhz,cdcl3)δ8.78(s,1h),7.33(s,1h),7.20(t,j=8.1hz,1h),7.08(d,j=7.9hz,1h),6.67(d,j=8.2hz,1h),4.10(s,2h),3.88–3.83(m,2h),3.79(s,3h),3.73–3.70(m,2h).
13cnmr(101mhz,cdcl3)δ168.19,160.12,138.52,129.67,112.13,110.29,105.71,73.18,70.56,61.51,55.32.
hrms(esi):calcd.forc11h16no4[m+h]+:226.1074;found:226.1063。
根据以上数据推断所得产物2c的结构如下式所示:
实施例4
在反应器中,加入0.5毫摩尔4-叔丁基苯胺和8毫摩尔1,4-二氧六环,0.25毫摩尔二叔丁基过氧化物,0.5毫摩尔盐酸,在120℃下搅拌反应24小时,反应结束后冷却至室温,稀释反应液,过滤,减压旋蒸除去溶剂即可得到粗产物,粗产物经柱层析提纯得到n-(4-(tert-butyl)phenyl)-2-(2-hydroxyethoxy)acetamide化合物2d。
所得产物2d的氢谱图及碳谱图分别如图7和图8所示,结构表征数据如下:
1hnmr(400mhz,cdcl3)δ8.73(s,1h),7.50(d,j=8.4hz,2h),7.33(d,j=8.4hz,2h),4.10(s,2h),3.88–3.81(m,2h),3.84(d,j=4.3hz,1h),3.74–3.69(m,2h),1.30(s,9h).
13cnmr(101mhz,cdcl3)δ168.03,147.53,134.64,125.79,119.74,73.15,70.57,61.52,34.38,31.36.
hrms(esi):calcd.forc14h22no3[m+h]+:252.1594;found:252.1599。
根据以上数据推断所得产物2d的结构如下式所示:
实施例5
在反应器中,加入0.5毫摩尔2-羟基苯胺和5毫摩尔1,4-二氧六环,0.5毫摩尔叔丁基过氧化氢,0.25毫摩尔对甲苯磺酸,在150℃下搅拌反应5小时,反应结束后冷却至室温,稀释反应液,过滤,减压旋蒸除去溶剂即可得到粗产物,粗产物经柱层析提纯得到2-(2-hydroxyethoxy)-n-(2-hydroxyphenyl)acetamide化合物2e。
所得产物2e的氢谱图及碳谱图分别如图9和图10所示,结构表征数据如下:
1hnmr(400mhz,cdcl3)δ9.11(s,1h),7.20(d,j=7.8hz,1h),7.10(dd,j=11.1,4.3hz,1h),6.99(d,j=8.1hz,1h),6.84(t,j=7.6hz,1h),4.14(s,2h),3.88–3.81(m,2h),3.73–3.70(m,2h).
13cnmr(101mhz,cdcl3)δ169.79,127.19,124.94,122.51,120.44,73.26,70.08,61.46.
hrms(esi):calcd.forc10h14no4[m+h]+:212.0917;found:212.0906。
根据以上数据推断所得产物2e的结构如下式所示:
实施例6
在反应器中,加入0.5毫摩尔4-氟苯胺和10毫摩尔1,4-二氧六环,0.25毫摩尔2,2,6,6-四甲基哌啶氧化物,0.5毫摩尔醋酸,在80℃下搅拌反应20小时,反应结束后冷却至室温,稀释反应液,过滤,减压旋蒸除去溶剂即可得到粗产物,粗产物经柱层析提纯得到n-(4-fluorophenyl)-2-(2-hydroxyethoxy)acetamide化合物2f。
所得产物2f的氢谱图及碳谱图分别如图11和图12所示,结构表征数据如下:
1hnmr(400mhz,cdcl3)δ8.91(s,1h),7.56(dd,j=8.8,4.8hz,2h),7.01(t,j=8.6hz,1h),4.12(s,2h),3.86(d,j=4.3hz,2h),3.73(d,j=4.5hz,2h)..
13cnmr(101mhz,cdcl3)δ168.25,159.49(d,j=243.6hz),133.37(d,j=2.7hz),121.68(d,j=7.9hz),115.59(d,j=22.6hz),73.17,70.45,61.47.
19fnmr(376mhz,cdcl3)δ-117.75.
hrms(esi):calcd.forc10h13fno3[m+h]+:214.0874;found:214.0880。
根据以上数据推断所得产物2f的结构如下式所示:
实施例7
在反应器中,加入0.5毫摩尔4-氯苯胺和5毫摩尔1,4-二氧六环,1毫摩尔二叔丁基过氧化物,0.5毫摩尔间氯过氧苯甲酸,在80℃下搅拌反应24小时,反应结束后冷却至室温,稀释反应液,过滤,减压旋蒸除去溶剂即可得到粗产物,粗产物经柱层析提纯得到n-(4-chlorophenyl)-2-(2-hydroxyethoxy)acetamide化合物2g。
所得产物2g的氢谱图及碳谱图分别如图13和图14所示,结构表征数据如下:
1hnmr(400mhz,cdcl3)δ8.99(s,1h),7.54(d,j=8.5hz,2h),7.25(d,j=8.5hz,2h),4.09(d,j=4.0hz,2h),3.83(d,,j=3.6hz,2h),3.69(d,j=3.6hz,2h),2.93(s,1h).
13cnmr(101mhz,cdcl3)δ168.50,135.92,129.50,128.96,121.20,73.18,70.44,61.40.
hrms(esi):calcd.forc10h13clno3[m+h]+:230.0579;found:230.0566。
根据以上数据推断所得产物2g的结构如下式所示:
实施例8
在反应器中,加入0.5毫摩尔3-溴苯胺和5毫摩尔1,4-二氧六环,0.5毫摩尔二叔丁基过氧化物,0.05毫摩尔三氟乙酸,在150℃下搅拌反应4小时,反应结束后冷却至室温,稀释反应液,过滤,减压旋蒸除去溶剂即可得到粗产物,粗产物经柱层析提纯得到n-(3-bromophenyl)-2-(2-hydroxyethoxy)acetamide化合物2h。
所得产物2h的氢谱图及碳谱图分别如图15和图16所示,结构表征数据如下:
1hnmr(400mhz,cdcl3)δ8.91(s,1h),7.82(t,j=1.8hz,1h),7.54(d,j=8.0hz,1h),7.24(d,j=8.1hz,1h),7.17(t,j=8.0hz,1h),4.12(s,2h),3.91–3.85(m,2h),3.76–3.71(m,2h).
13cnmr(101mhz,cdcl3)δ168.34,138.66,130.28,127.45,122.71,118.33,73.16,70.48,61.53.
hrms(esi):calcd.forc10h13brno3[m+h]+:274.0073;found:274.0068。
根据以上数据推断所得产物2h的结构如下式所示:
实施例9
在反应器中,加入0.5毫摩尔4-苯基苯胺和6毫摩尔1,4-二氧六环,0.25毫摩尔过硫酸铵,0.5毫摩尔三氟甲磺酸,在110℃下搅拌反应18小时,反应结束后冷却至室温,稀释反应液,过滤,减压旋蒸除去溶剂即可得到粗产物,粗产物经柱层析提纯得到n-([1,1'-biphenyl]-4-yl)-2-(2-hydroxyethoxy)acetamide化合物2i。
所得产物2i的氢谱图及碳谱图分别如图17和图18所示,结构表征数据如下:
1hnmr(400mhz,cdcl3)δ8.79(s,1h),7.68(d,j=8.5hz,2h),7.57(d,j=6.7hz,4h),7.43(t,j=7.6hz,2h),7.33(t,j=7.4hz,1h),4.16(s,2h),3.90(t,j=4.7hz,2h),3.80–3.75(t,j=4.7hz,2h).
13cnmr(101mhz,cdcl3)δ167.98,140.53,137.39,136.64,128.78,127.64,127.13,126.86,120.11,73.14,70.62,61.65,29.70.
hrms(esi):calcd.forc16h18no3[m+h]+:272.1281;found:272.1282。
根据以上数据推断所得产物2i的结构如下式所示:
实施例10
在反应器中,加入0.5毫摩尔2-硝基苯胺和10毫摩尔1,4-二氧六环,0.5毫摩尔过氧化氢,0.5毫摩尔对甲苯磺酸,在100℃下搅拌反应12小时,反应结束后冷却至室温,稀释反应液,过滤,减压旋蒸除去溶剂即可得到粗产物,粗产物经柱层析提纯得到2-(2-hydroxyethoxy)-n-(2-nitrophenyl)acetamide化合物2j。
所得产物2j的氢谱图及碳谱图分别如图19和图20所示,结构表征数据如下:
1hnmr(400mhz,cdcl3)δ9.11(s,1h),7.20(d,j=7.8hz,1h),7.10(t,j=7.7hz,1h),6.99(d,j=8.1hz,1h),6.84(t,j=7.6hz,1h),4.14(s,2h),3.88–3.82(m,2h),3.73–3.70(m,2h).
13cnmr(101mhz,cdcl3)δ169.79,127.19,124.94,122.51,120.44,73.26,70.08,61.46.
hrms(esi):calcd.forc10h13n2o5[m+h]+:241.0819;found:241.0815。
根据以上数据推断所得产物2j的结构如下式所示:
实施例11
在反应器中,加入0.5毫摩尔3-甲酸乙酯苯胺和10毫摩尔1,4-二氧六环,0.5毫摩尔二叔丁基过氧化物,0.5毫摩尔醋酸,在120℃下搅拌反应16小时,反应结束后冷却至室温,稀释反应液,过滤,减压旋蒸除去溶剂即可得到粗产物,粗产物经柱层析提纯得到ethyl3-(2-(2-hydroxyethoxy)acetamido)benzoate化合物2k。
所得产物2k的氢谱图及碳谱图分别如图21和图22所示,结构表征数据如下:
1hnmr(400mhz,cdcl3)δ9.04(s,1h),8.05(s,1h),8.01(d,j=8.2hz,1h),7.77(d,j=7.7hz,1h),7.38(t,j=7.9hz,1h),4.36(q,j=7.1hz,2h),4.14(s,2h),3.97–3.86(m,2h),3.77–3.73(m,2h),1.38(t,j=7.1hz,3h).
13cnmr(101mhz,cdcl3)δ168.46,166.38,137.61,131.14,129.10,125.42,124.30,120.68,73.21,70.53,61.49,61.21,14.29.
hrms(esi):calcd.forc13h18no5[m+h]+:268.1179;found:268.1183。
根据以上数据推断所得产物2k的结构如下式所示:
实施例12
在反应器中,加入0.5毫摩尔3,5-二甲基苯胺和5毫摩尔1,4-二氧六环,0.5毫摩尔二叔丁基过氧化物,0.05毫摩尔三氟乙酸,在120℃下搅拌反应6小时,反应结束后冷却至室温,稀释反应液,过滤,减压旋蒸除去溶剂即可得到粗产物,粗产物经柱层析提纯得到n-(3,5-dimethylphenyl)-2-(2-hydroxyethoxy)acetamide化合物2l。
所得产物2l的氢谱图及碳谱图分别如图23和图24所示,结构表征数据如下:
1hnmr(400mhz,cdcl3)δ8.59(s,1h),7.22(s,2h),6.77(s,1h),4.10(s,2h),3.87–3.84(m,2h),3.73–3.70(m,2h),2.29(s,6h).
13cnmr(101mhz,cdcl3)δ167.89,138.71,137.08,126.30,117.63,73.12,70.61,61.56,21.36.
hrms(esi):calcd.forc12h18no3[m+h]+:224.1281;found:224.1288。
根据以上数据推断所得产物2l的结构如下式所示:
效果例
将实施例1~12所制得的新化合物2a~2l,进行抗肿瘤活性测试:将各个化合物分别配制成100μg·ml-1的甲醇溶液,阳性对照药5-氟尿嘧啶(5-fluorouracil,5-fu)配成100μg·ml-1的二甲基亚砜(dmso)溶液,分别以甲醇和dmso溶剂为空白对照,采用四甲基偶氮唑盐(methylthiazolyltetrazoliummethod,mtt)法测试各化合物对人白血病细胞k562、人早幼粒急性白血病细胞hl60和人宫颈癌hela细胞的抑制作用,具体操作如下:
(1)细胞培养液的配制:取一袋rpmi-1640培养基粉末(净含量为10.4g)倒入干净的烧杯中,用900ml超净水将其溶解,并加入100mg·ml-1的链霉素1ml、青霉素0.5ml及nahco32g。磁力搅拌均匀后,于超净台中用已高压灭菌的蔡氏(zeiss)滤器经0.22μm滤膜过滤除菌,滤液直接保存于湿热灭菌后的玻璃瓶中(450ml/瓶)。培养基使用前,取冷冻保藏的血清,56℃灭活30min后,加入已配好rpmi-1640培养液中(450ml培养基中加入50ml血清),轻轻摇匀后,加盖,用锡箔纸封口,于4℃冰箱中保存。
mtt溶液配制:50mg的mtt粉末溶解于10ml的pbs溶液中,用0.22μm的滤膜过滤,于4℃冰箱中保存。
(2)抗肿瘤活性实验:分别取生长对数期的k562、hl60和hela细胞,于4℃、3000rpm离心机上离心3min,吸去上清液,加入新鲜的rpmi-1640培养基稀释成1×105个/毫升的细胞悬液。每孔200μl接种于96孔板中,于37℃、5%co2的细胞培养箱中培养1h后,每孔各加样品溶液2μl,每个样品设3个平行孔,另设两组各三孔的空白对照,加样后以相同条件培养24h。24h后,在光学显微镜下观察细胞有无形态变化,初步判断样品有无细胞毒活性,必要时进行拍照。每孔加入5mg·ml-1的mtt溶液各20μl,培养箱中继续培养4h。取出96孔板离心(4℃、2000rpm,20min)除去上清液,每孔各加150μldmso,充分振荡使紫色沉淀物完全溶解。在酶标仪上于570nm下测定其光密度od值,每组样品取平均值并按抑制率(inhibitionrate,ir)%=(od空白-od样品)/od空白×100%公式计算。
mtt法测试乙酰苯胺类化合物对k562、hl60和hela细胞的增殖活性抑制结果如表1所示。
表1
由表1可以看出,本发明方案制得的化合物对k562、hl60和hela细胞具有一定的抑制作用。其中,化合物2k对k562、hl60和hela细胞的抑制作用与5-fu相当。
综上所述,本发明提供的乙酰苯胺类化合物对肿瘤具有抑制作用,本发明方案的制备方案绿色环保且经济效益好,具有良好的生产应用前景。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 还没有人留言评论。精彩留言会获得点赞!