一种外泌体包裹AAV载体、AAV-靶基因载体及其制备方法和应用与流程
本发明属于基因药物载体技术领域,具体涉及一种外泌体包裹aav载体、aav-靶基因载体及其制备方法和应用。
背景技术:
腺相关病毒(adeno-associatedvirus,aav)是属微小病毒科家族的无包膜病毒。aav对人无致病性,只有在辅助病毒如腺病毒或疱疹病毒存在下才能复制。aav基因组是约4.7kb的单链线状dna分子,在每个末端都有发夹结构的反向末端重复序列(itrs),itrs的功能在于基因组复制起始位点及包装病毒粒子。aav病毒中能够插入小于2.5kb大小的dna片段。aav载体在体内基因转染效率高,整体安全性好,已成为首选的基因药物载体。aav虽然是首选药物载体,由于生物本身存在中和抗体、血脑屏障和血眼屏障等原因,临床试验治疗效果远不及动物实验效果。因此考虑aav的转染效率不佳造成差异。
外泌体(exosomes)由含有跨膜蛋白、胞质蛋白和各种核酸的脂质双层组成。其粒径在40~200nm之间,主要是细胞膜内陷形成的包含溶酶体微粒的多囊泡体(mvbs),经多囊泡体外膜与细胞膜融合后释放到胞外基质中。是一种很有前途的新型药物和基因传递载体。与传统aav载体比较,外泌体作为基因药物载体具有以下优点:
1.外泌体具有粒径小、生物相容性高、免疫性低等优点;
2.外泌体可以递送基因药物、蛋白质和小分子药物等;
3.外泌体可以穿过血脑屏障和血眼等屏障,且在体内对中和抗体表现出显著的抗性;
4.外泌体包裹aav载体(exo-aav)可以绕过需要aav衣壳与细胞受体结合进入细胞这一过程从而提高转染效率;
5.外泌体载体不仅能将基因药物更有效送至靶组织,同时保护内容物不被降解。
技术实现要素:
为克服现有技术中存在的不足之处,本发明的目的旨在提供一种外泌体包裹aav载体、aav-靶基因载体及其制备方法和应用。
为实现上述目的,本发明采取的技术方案如下:
一种外泌体包裹aav载体的制备方法,步骤如下:
(1)、将hek-293t细胞用dmem完全培养基培养,待细胞生长至融合度达60%-80%时用于转染,转染前1-4h用dmem基础培养基置换旧的培养基;
(2)、将paav-zsgreen质粒、prc2-mir342质粒和phelper质粒共转染至步骤(1)所得hek-293t细胞培养液中,37℃共转染12-16h之后,加入无外泌体胎牛血清,继续培养48-72h,收集上清,离心分离,获得外泌体包裹aav载体。
具体地,步骤(2)的过程为:将10-15μgpaav-zsgreen质粒、10-15μgprc2-mir342质粒和20-25μgphelper质粒加入50-100μlcacl2溶液和水中,三质粒均以其溶液形式添加且溶液浓度均为1-2μg/μl,cacl2溶液的浓度为2-3m,水的用量为三质粒溶液总体积的10倍,吹打混匀;将混匀的三质粒溶液涡旋状态下滴加到500-1000μl2×hebs溶液中,室温静置20-30min后,再滴加到8-10ml步骤(1)所得hek-293t细胞培养液中,37℃共转染12-16h之后,加入160-200μl无外泌体胎牛血清继续培养48-72h,收集细胞培养上清,离心分离,获得外泌体包裹aav载体。
具体地,步骤(2)中,所述离心分离的过程为:首先,3-5℃300-600g离心10-15min,离心结束收集上清液,然后将收集的上清液3-5℃2000-2500g离心10-15min,离心结束收集上清液;进一步将收集的上清液3-5℃100000g离心1-1.5h,离心结束去除上清,收集底部沉淀,加入pbs重悬沉淀,再次3-5℃100000g离心1-1.5h,离心结束去除上清,收集底部沉淀,所得沉淀即为外泌体包裹aav载体。
一种利用所述制备方法制备的外泌体包裹aav载体。
一种外泌体包裹aav-靶基因载体的制备方法,步骤如下:
(1)、paav-zsgreen质粒首先经过ecori酶切,获得线性paav-zsgreen质粒;然后通过同源重组法将靶基因构建到线性paav-zsgreen质粒中,通过无内毒素质粒大提试剂盒提取paav-靶基因-zsgreen质粒;
(2)、将hek-293t细胞用dmem完全培养基培养,待细胞生长至融合度达60%-80%时用于转染,转染前1-4h用dmem基础培养基置换旧的培养基;
(3)、将paav-靶基因-zsgreen质粒、prc2-mir342质粒和phelper质粒共转染至步骤(2)所得hek-293t细胞培养液中,37℃共转染12-16h之后,加入无外泌体胎牛血清,继续培养48-72h,收集上清,离心分离,获得外泌体包裹aav-靶基因载体。
较好地,步骤(1)中,ecori酶切体系为:浓度150-200ng/μl的paav-zsgreen质粒溶液3-5μl、ecori酶1-2μl、10×buffer溶液2-4μl,补水至总体系20μl;酶切条件为:37℃16-18h,70-80℃5-10min;构建体系为:浓度150-200ng/μl的线性paav-zsgreen质粒溶液1-2μl、浓度30-50ng/μl的靶基因cdna溶液2-5μl、2×sosoo溶液3-5μl,补水至总体系10μl;构建条件为:50℃15-20min;2-4℃∞。
具体地,步骤(3)的过程为:将10-15μgpaav-靶基因-zsgreen质粒、10-15μgprc2-mir342质粒和20-25μgphelper质粒加入50-100μlcacl2溶液和水中,三质粒均以其溶液形式添加且溶液浓度均为1-2μg/μl,cacl2溶液的浓度为2-3m,水的用量为三质粒溶液总体积的10倍,吹打混匀;将混匀的三质粒溶液涡旋状态下滴加到500-1000μl2×hebs溶液中,室温静置20-30min后,再滴加到8-10ml步骤(2)所得hek-293t细胞培养液中,37℃共转染12-16h之后,加入160-200μl无外泌体胎牛血清继续培养48-72h,收集细胞培养上清,离心分离,获得外泌体包裹aav-靶基因载体。
具体地,步骤(3)中,所述离心分离的过程为:首先,3-5℃300-600g离心10-15min,离心结束收集上清液,然后将收集的上清液3-5℃2000-2500g离心10-15min,离心结束收集上清液;进一步将收集的上清液3-5℃100000g离心1-1.5h,离心结束去除上清,收集底部沉淀,加入pbs重悬沉淀,再次3-5℃100000g离心1-1.5h,离心结束去除上清,收集底部沉淀,所得沉淀即为外泌体包裹aav-靶基因载体。
一种利用所述制备方法制备的外泌体包裹aav-靶基因载体。
一种所述外泌体包裹aav-靶基因载体在制备治疗靶基因所对应疾病药物中的应用。
本发明中,所述靶基因包括但不限于下列基因:人源retinoschisin1、chm、best1、rpe65、nd1~6、sod2、hif-1。对应地,所述疾病包括但不限于下列疾病:先天性视网膜劈裂症、视网膜色素变性、视神经病变、无脉络症、best卵黄样黄斑营养不良、先天性黑矇。
本发明与现有技术相比,具有以下优点和效果:
1、本发明选择外泌体构建包裹aav递送载体,利用外泌体的天然属性,相较于aav载体,外泌体有粒径小,生物相容性高,免疫性低等优点,可以穿过血脑屏障和血眼等屏障,且在体内对中和抗体表现出显著的抗性;外泌体包裹aav-靶基因载体可以绕过需要aav衣壳与细胞受体结合进入细胞这一过程从而提高aav转染效率;
2、本发明利用外泌体包裹aav-靶基因载体的方式实现治疗基因的载入,操作简洁高效,相较于aav-靶基因载体,外泌体的天然膜结构可有效增强aav在视网膜组织中的转运,增加靶基因转染效率。
附图说明
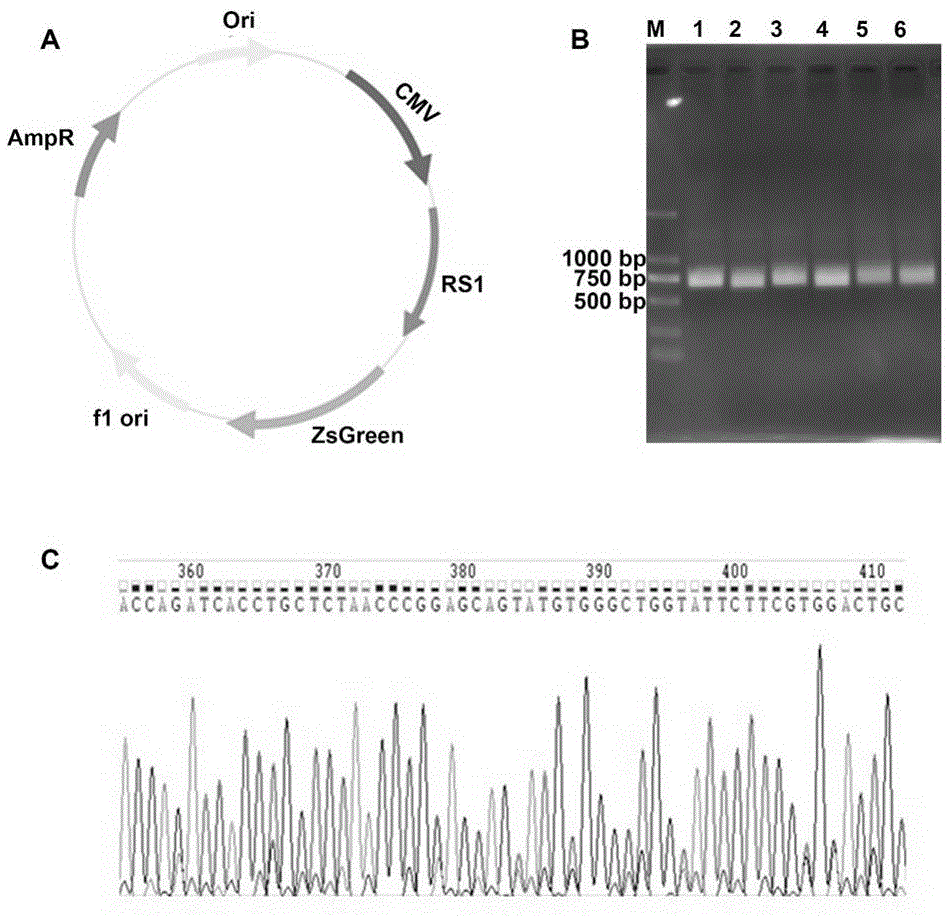
图1:paav-rs1-zsgreen质粒的合成简图(a)、水平凝胶电泳(b)和部分碱基序列测试(c),其中m:marker,泳道1-6:paav-rs1-zsgreen菌落。
图2:exo-aav2-rs1-zsgreen载体的电子透射显微镜图(a)、纳米追踪仪分析粒径分布图(b)和westernblotting图(c)。
图3:aav2-rs1-zsgreen载体和exo-aav2-rs1-zsgreen载体转染hek-293t细胞荧光显微镜图(a),rt-pcr图(b,c)和westernblotting图(d,e)。
图4:aav2-rs1-zsgreen载体和exo-aav2-rs1-zsgreen载体感染小鼠视网膜冰冻切片免疫荧光图。
图5:aav2-rs1-zsgreen载体和exo-aav2-rs1-zsgreen载体感染小鼠视网膜rt-pcr图(a,b)和westernblotting图(c,d)。
具体实施方式
以下结合具体实施例,对本发明做进一步说明。应理解,以下实施例仅用于说明本发明而非用于限制本发明的范围。
实施例1
一种外泌体包裹aav载体即exo-aav2-zsgreen载体的制备方法,步骤如下:
(1)、将5×106个hek-293t细胞接种到10cm培养皿中,10mldmem完全培养基培养,待细胞生长至融合度达80%时更换培养基,用10ml不含血清和抗体的dmem高糖基础培养基(hyclone,sh30022.01)继续培养2h;其中,dmem完全培养基的制备:dmem高糖基础培养基(hyclone,sh30022.01)中补充10%(v/v)胎牛血清(fetalbovineserum,fbs;corning,35-081-cv)和1%(v/v)抗体(solarbio,p1400),获得dmem完全培养基,4℃保存;
(2)、共转染:将12μgpaav-zsgreen质粒(takara,6231)、12μgprc2-mir342质粒(takara,6234)和25μgphelper质粒(takara,6234)加入59μlcacl2溶液和无菌水溶液中,三质粒均以其溶液形式添加且溶液浓度均为1μg/μl,paav-zsgreen质粒溶液的添加量为12μl,prc2-mir342质粒溶液的添加量为12μl,phelper质粒溶液的添加量为25μl,cacl2溶液的浓度为2m,无菌水的用量490μl,轻轻吹打混匀;将混匀的三质粒溶液涡旋状态下滴加到590μl2×hebs溶液中,室温静置20min;将室温静置后的三质粒溶液滴加到步骤(1)所得10mlhek-293t细胞培养液中,37℃共转染16h;然后补加200μl无外泌体胎牛血清(absin,abs993)继续培养72h,收集上清,4℃300g离心10min,离心结束收集上清液,然后将收集的上清液4℃2000g离心10min,再离心结束收集上清液,弃去沉淀;进一步将收集的上清液,用超高速离心机(cp100wx,japan)4℃100000g离心1h,离心结束去除上清收集试管底部沉淀,加入1ml无菌pbs重悬试管底部沉淀,再次4℃100000g离心1h,用枪头吸去试管中pbs,可看到试管底部有白色沉淀,即为exo-aav2-zsgreen载体,加入200μl无菌pbs重悬,并储存在-80℃直至使用。
实施例2
x-相关视网膜劈裂症(xlrs)由retinoschisin1(rs1)基因突变导致。rs1蛋白主要由双极细胞和光感受器细胞合成并分泌到视网膜各细胞层。由于rs1基因突变导致rs1蛋白缺失进而造成视网膜空腔,突触功能紊乱,视敏感性降低。现以rs1基因作为靶基因为例,说明外泌体包裹aav-靶基因载体即exo-aav2-rs1-zsgreen载体的制备。
一种exo-aav2-rs1-zsgreen载体的制备方法,步骤如下:
(1)、paav-rs1-zsgreen质粒的制备方法:paav-zsgreen质粒首先经过ecori酶切,获得线性paav-zsgreen质粒;然后通过通过同源重组法将目的基因retinoschisin1构建到线性paav-zsgreen质粒中,通过无内毒素质粒大提试剂盒(tiangen,dp117)提取paav-rs1-zsgreen质粒;
ecori酶切体系为:浓度150ng/μl的paav-zsgreen质粒溶液5μl、ecori酶1μl、10×buffer溶液2μl,补水至总体系20μl;酶切条件为:37℃16h,80℃5min;构建体系为:浓度150ng/μl的线性paav-zsgreen质粒溶液1μl、浓度30ng/μl的rs1cdna溶液2μl、2×sosoo溶液(qingke,tsv-s1)5μl,补水至总体系10μl;构建条件为:50℃15min,4℃∞;
(2)、aav2-rs1-zsgreen载体和exo-aav2-rs1-zsgreen载体的制备:
(2a)、将5×106个hek-293t细胞接种到10cm培养皿中,10mldmem完全培养基培养,待细胞生长至融合度达80%时更换培养基,用10ml不含血清和抗体的dmem高糖基础培养基(hyclone,sh30022.01)继续培养2h;
(2b)、共转染:将12μgpaav-rs1-zsgreen质粒、12μgprc2-mir342质粒和25μgphelper质粒加入59μlcacl2溶液和无菌水溶液中,三质粒均以其溶液形式添加且溶液浓度均为1μg/μl,paav-rs1-zsgreen质粒溶液的添加量为12μl,prc2-mir342质粒溶液的添加量为12μl,phelper质粒溶液的添加量为25μl,cacl2溶液的浓度为2m,无菌水的用量490μl,轻轻吹打混匀;将混匀的三质粒溶液涡旋状态下滴加到590μl2×hebs溶液中,室温静置20min;将室温静置后的三质粒溶液滴加到步骤(2a)所得10mlhek-293t细胞培养液中,37℃共转染16h;然后补加200μl无外泌体胎牛血清继续培养72h,分别收集细胞和细胞上清;
(2c)、步骤(2b)获得的细胞,用1ml无菌pbs重悬,20℃600g离心15min,收集底部细胞;准备37℃恒温水浴锅和液氮,将收集的细胞在液氮及37℃水浴反复冻融三次,4℃2000g离心5min,去除细胞碎片,收集上清,根据腺相关病毒纯化试剂盒纯化浓缩,获得aav2-rs1-zsgreen载体,加入200μl无菌pbs重悬,冻存于-80℃保存;
(2d)、步骤(2b)获得的细胞上清,首先,4℃300g离心10min,离心结束收集上清液,然后将收集的上清液4℃2000g离心10min,再离心结束收集上清液,弃去沉淀;进一步将收集的上清液,用超高速离心机(cp100wx,japan)4℃100000g离心1h,离心结束去除上清收集试管底部沉淀,加入1ml无菌pbs重悬试管底部沉淀,再次4℃100000g离心1h,用枪头吸去试管中pbs,可看到试管底部有白色沉淀,即为exo-aav2-rs1-zsgreen载体,加入200μl无菌pbs重悬,并储存在-80℃直至使用。
图1为paav-rs1-zsgreen质粒的合成简图(a)、水平凝胶电泳(b)和部分碱基序列测试(c),其中m:marker,泳道1-6:paav-rs1-zsgreen菌落。由图1可知:rs1的cdna(长度为675bp)成功构建到paav-zsgreen质粒中,并且rs1的碱基序列是正向的,通过对比ncbi上rs1的cds,两者是完全一致。
exo-aav2-rs1-zsgreen载体的鉴定
将实施例2步骤(2d)中获取的exo-aav2-rs1-zsgreen载体pbs重悬液,取50μl重悬于50μl无菌pbs中,然后用2%磷钨酸负染色并涂在网格上,使用透射电子显微镜获得透射图像。
将实施例2步骤(2d)中获取的exo-aav2-rs1-zsgreen载体pbs重悬液,取100μl稀释在50ml无菌pbs中,使用nanosightlm10仪器进行纳米颗粒跟踪分析。
将实施例2步骤(2d)中获取的exo-aav2-rs1-zsgreen载体pbs重悬液,在10%sds-page凝胶上进行western印迹。蛋白质被印迹到聚氟乙烯膜上。使用cd63抗体(novus,nbp2-32830;体积比,抗体∶抗体稀释液(solarbio,a1800)=1∶1000)4℃孵育16h。用hrp结合的二级抗体(cst,7076p2;体积比,抗体:抗体稀释液(solarbio,a1800)=1∶10000)和ecl检测试剂(millipor,wbkls0050)对印迹进行可视化,并在bio-rad仪器上成像。
图2为exo-aav2-rs1-zsgreen载体的电子透射显微镜图(a)、纳米追踪仪分析粒径分布图(b)和westernblotting图(c)。由图2可知:提取的外泌体明显具有磷脂双分子层膜结构,且有茶托样形态(a);外泌体的粒径分布范围50~200nm,粒径以120nm为主(b);cd63是外泌体的主要标记蛋白,westernblotting检测到外泌体中cd63膜蛋白(c)。
aav2-rs1-zsgreen载体和exo-aav2-rs1-zsgreen载体的滴度测定
分别取步骤(2c)中获取的aav2-rs1-zsgreen载体pbs重悬液和步骤(2d)中获取的exo-aav2-rs1-zsgreen载体pbs重悬液3μl加入dnasei酶反应体系:dnasei酶10μl、buffer溶液6μl、无菌水41μl,aav2-rs1-zsgreen载体pbs重悬液或exo-aav2-rs1-zsgreen载体pbs重悬液3μl,总体系60μl;反应程序:37℃水浴1h,100℃水浴10min;目的是降解病毒载体外壳和外泌体载体外壳在提取过程中附着的基因组;然后每个样品加入蛋白酶k2μl,55℃水浴1h,100℃水浴10min,目的是完全裂解病毒载体蛋白和外泌体蛋白衣壳,将包裹的基因组完全释放出来,为后续检测基因组拷贝数做准备。将标准品paav-rs1-zsgreen质粒用depc水梯度稀释5个浓度,分别为109、108、107、106、105基因拷贝数/μl。将aav2-rs1-zsgreen载体提取的基因组,exo-aav2-rs1-zsgreen载体提取的基因组和5个梯度的标准品paav-rs1-zsgreen质粒进行rt-pcr检测,每个样品重复测3次,反应程序:50℃2min;95℃2min;95℃15s,60℃15s,72℃1min,40个循环。结果见表1,可知:aav2-rs1-zsgreen载体和exo-aav2-rs1-zsgreen载体的基因拷贝数分别达到1012gc/ml,1011gc/ml。
aav2-rs1-zsgreen载体和exo-aav2-rs1-zsgreen载体的体外转染效率测定
将hek-293t细胞接种在6孔板中,每孔接种1.2×106个细胞和2mldmem完全培养基,37℃培养箱孵育24h,然后弃去孔中培养基,ctrl组即空白对照组加入1ml不含血清和抗体的dmem高糖基础培养基,实验组则加入2μl步骤(2c)获得的aav2-rs1-zsgreen载体pbs重悬液或步骤(2d)获得的exo-aav2-rs1-zsgreen载体pbs重悬液、1ml不含血清和抗体的dmem高糖基础培养基;继续转染6h,之后添加20μl胎牛血清继续孵育72h。用倒置荧光显微镜(olympusix73,japan)检测zsgreen的荧光强度,分别提取细胞核酸和蛋白质进行rt-pcr和westernblotting实验,检测不同组荧光强度、核酸和蛋白质的差异。图3为aav2-rs1-zsgreen载体和exo-aav2-rs1-zsgreen载体转染hek-293t细胞荧光显微镜图(a),rt-pcr图(b,c)和westernblotting图(d,e)。结果表明:exo-aav2-rs1-zsgreen载体绿色荧光强度明显高于aav2-rs1-zsgreen载体(图3a)。exo-aav2-rs1-zsgreen载体感染的细胞内rs1的mrna表达水平和蛋白表达水平显著高于aav2-rs1-zsgreen载体(图3b、c、d、e)。
载体和exo-aav2-rs1-zsgreen载体的体内转染效率测定
将牛血清白蛋白和triton-x100溶解于1×pbs中制备封闭液,牛血清白蛋白在封闭液中的浓度为5%(g/ml),triton-x100在封闭液中的浓度为0.3%(v/v);将吐温20溶于1×pbs中制备洗液,吐温20在洗液中的浓度为0.1%(v/v)。
将4-5周大的雄性c57bl/6j小鼠(vitalriverlaboratoryanimaltechnologiesco.ltd,beijing)随机分为两组(n=6):(1)单眼注射1μlaav2-rs1-zsgreen载体1×108gc/eye(基因拷贝数/眼,下同),对照眼注射1μlpbs,(2)单眼注射1μlexo-aav2-rs1-zsgreen载体1×108gc/eye,对照眼注射1μlpbs。注射28天后,小鼠吸入过量co2处死。
将小鼠眼球摘取放在pbs中清洗三次。双目体视显微镜(xtl-2300,caikang)下切去角膜前段,取出晶体留下眼杯。眼杯于4%多聚甲醛溶液(v/v)中室温固定4h,随后10%(g/ml)蔗糖溶液和20%(g/ml)蔗糖溶液中室温脱水2h,最后30%(g/ml)蔗糖溶液4℃过夜脱水。-20℃条件下o.c.t冰冻切片包埋剂(sakura,4583)包埋。包埋的眼杯于冰冻切片机(leicacm3050s,germany)中切取6μm厚度的切片。将获得的视网膜冰冻切片进行免疫荧光染色:切片置于暗盒中滴加封闭液室温封闭1h,洗液洗片三次洗去封闭液;然后,封闭液稀释一抗rs1(sigma,hpa059546;体积比,抗体∶封闭液=1∶100)滴加到切片组织,于4℃孵育过夜,次日,洗液洗去一抗,封闭液稀释荧光结合二抗(cst,8890s;体积比,抗体∶封闭液=1∶100)室温孵育1h,洗液洗片三次,dapi染核5min。正置荧光显微镜(nikon+80i,japan)下观察自发荧光蛋白zsgreen绿色荧光和免疫荧光rs1蛋白红色荧光。图4为aav2-rs1-zsgreen载体和exo-aav2-rs1-zsgreen载体感染小鼠视网膜冰冻切片免疫荧光图,绿色荧光为载体转染的zsgreen自发荧光蛋白,红色荧光为由载体转染到视网膜并成功表达的rs1蛋白免疫荧光蛋白。结果证明:两种载体转染的目的基因在视网膜中都有表达,zsgreen蛋白和rs1蛋白分布在视网膜各层细胞,在同样感染滴度下,相较于aav2-rs1-zsgreen载体,exo-aav2-rs1-zsgreen载体转染的视网膜荧光亮度更强。
将小鼠处死后剥取的视网膜,先用研磨杵将组织研碎,一部分组织加入trizol(thermofisher,10296028)室温裂解;依次用氯仿、异丙醇、75%无水乙醇提取rna,最后溶于depc水(beyotim,r0021),primescriptrt逆转试剂盒(takara,rr037a)用于rna逆转录为cdna,srbrgreen预混液(thermofisher,4472913)用于实时荧光定量;另一部分组织加入含有蛋白抑制剂(mce,hy-k0010)的裂解液(thermofisher,89901),4℃12000g离心15min,将上清液转移到新的无酶ep管。10%sds-page凝胶分离蛋白,聚偏二氟乙烯膜转移蛋白,4℃过夜孵育rs1(sigma,sab1401345;抗体∶封闭液=1∶1000)一抗,次日孵育二抗(cst,7076p2;体积比,抗体∶封闭液=1∶10000),ecl化学发光液(millipor,wbkls0050)显影。图5为aav2-rs1-zsgreen载体和exo-aav2-rs1-zsgreen载体感染小鼠视网膜rt-pcr图(a,b)和westernblotting图(c,d)。结果显示:相比于aav2-rs1-zsgreen载体,exo-aav2-rs1-zsgreen载体载体提高aav载体在视网膜中转染效率,增加目的基因核酸和蛋白质表达。
- 还没有人留言评论。精彩留言会获得点赞!