一种咽拭子样本中病原体核酸提取试剂盒及提取方法与流程
本发明实施例涉及核酸提取
技术领域:
,具体涉及一种咽拭子样本中病原体核酸提取试剂盒及提取方法。
背景技术:
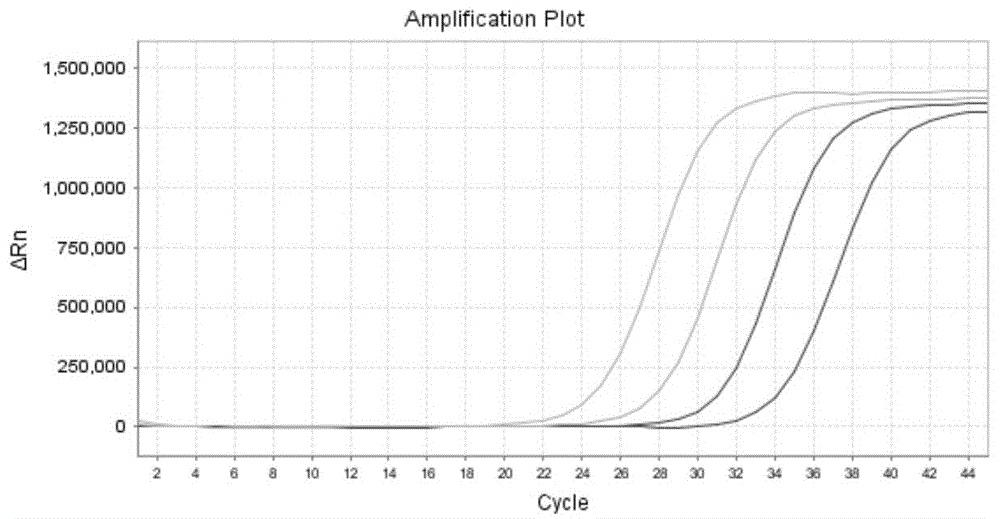
:口腔由于呼吸和进食,会存留大量种类繁多的细菌。正常人咽峡部培养应有口腔正常菌群,而无致病菌生长。但在机体全身或局部抵抗力下降和其他外部因素下可以出现感染等而导致疾病,如呼吸道感染、流感等。因此,咽拭子分泌物中病原体(细菌、病毒、衣原体等)的检测,是临床上重要的诊断手段。目前病原体核酸提取纯化的方法有很多种,如离心柱法和磁珠法。这些方法各有优缺点,但都应考虑以下原则:将蛋白质、脂类、糖类等物质分离干净;排除有机溶剂和金属离子的污染。基于纳米磁珠的提取技术是利用亲水性纳米磁珠特异性地吸附样品溶液中的核酸,在外加磁场的作用将吸附的核酸-磁珠复合物从样品溶液中分离,通过洗涤液洗涤去除溶液中的蛋白和盐离子,最后在仅留有特异吸附核酸的磁珠中加入洗脱液,将核酸释放于洗脱液中。磁珠法提取病原体核酸与离心柱法相比,操作简单,不易污染,已经成为目前分子生物学和临床检验医学研究的理想方法。但是现有纳米磁珠提取技术还存在以下不足:提取纯化步骤较多,操作繁琐,所得病原体核酸含量底,且纯度不高,不能够直接用于后续检测。技术实现要素:为此,本发明实施例提供一种咽拭子样本中病原体核酸提取试剂盒及提取方法,提取纯化步骤少,操作简便,整个过程不涉及有毒试剂,安全便捷,所得病原体核酸含量高,纯度高,可直接用于后续检测,以解决现有技术中存在的问题。为了实现上述目的,本发明实施例提供如下技术方案:一种咽拭子样本中病原体核酸提取试剂盒,所述试剂盒包括蛋白酶处理液、裂解液、纳米磁珠、洗涤液和洗脱液;本发明还提供了一种咽拭子样本中病原体核酸的提取方法,包括如下步骤:步骤s1:取一新鲜咽拭子样本于1.5ml离心管中,使用无菌移液枪头向该离心管中加入300ul生理盐水和10-40ul蛋白酶处理液,震荡混匀1min,56℃水浴静置10min;步骤s2:取50-200ul步骤s1中的样本处理液于1.5ml离心管中,使用无菌移液枪头向该离心管中加入75-300ul裂解液、75-300ul异丙醇和纳米磁珠5-20ul,震荡混匀1min,室温静置10min;步骤s3:将步骤s2中的离心管置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸弃上清溶液;步骤s4:使用无菌移液枪头向步骤s3离心管中加入300-800ul洗涤液,将该离心管震荡混匀1min,置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸弃上清溶液;步骤s5:重复步骤s4一次;步骤s6:室温开盖干燥5-20min直至管内无液体残留;步骤s7:使用无菌移液枪头向步骤s6离心管中加入100-200ul洗脱液,56℃水浴5-10min;步骤s8:将步骤s7离心管震荡混匀1min,置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸取上清至新的离心管,即获得样本中的病原体核酸。进一步地,步骤s1中所述的蛋白酶处理液浓度为10-200mg/ml。进一步地,所述蛋白酶处理液包括蛋白酶k,且蛋白酶k浓度为10-50mg/ml。进一步地,所述裂解液包括异硫氰酸胍、碘化锂、柠檬酸、tween20,其中异硫氰酸胍浓度为3-5mm,碘化锂浓度为1-5m,柠檬酸三钠浓度为50-200mm,tween20浓度为1%-5%,所述裂解液ph值为4.0-7.0。进一步地,步骤s2中所述的纳米磁珠添加浓度为50-200mg/ml。进一步地,所述纳米磁珠为包裹有二氧化硅的fe3o4,所述纳米磁珠直径为200-2000nm,浓度为50-200mg/ml。进一步地,所述洗涤液包括tris-hcl、nacl和无水乙醇,所述tris-hc的ph为6.5-8.5,浓度为1-5mm,所述nacl浓度为10-50mm,所述无水乙醇浓度为40%-80%。进一步地,所述洗脱液为无菌depc水,ph值为7.0-9.0。本发明实施例具有如下优点:本发明病原体核酸提取试剂盒采用蛋白酶处理液、裂解液、纳米磁珠、洗涤液和洗脱液,采用该试剂盒进行核酸提取,提取过程不涉及有毒试剂,安全便捷,且提取方法具有提取纯化步骤少,操作简便,所得病原体核酸含量高,纯度高,可直接用于后续检测的优点。附图说明为了更清楚地说明本发明的实施方式或现有技术中的技术方案,下面将对实施方式或现有技术描述中所需要使用的附图作简单地介绍。显而易见地,下面描述中的附图仅仅是示例性的,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图引申获得其它的实施附图。本说明书所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本发明所能产生的功效及所能达成的目的下,均应仍落在本发明所揭示的技术内容得能涵盖的范围内。图1为本发明实施例1提供的咽拭子样本呼吸道合胞病毒提取产物及其稀释物采用荧光pcr检测的扩增曲线。图2为本发明实施例2提供的咽拭子样本柯萨奇病毒a组16型提取产物及其稀释物采用荧光pcr检测的扩增曲线。图3为本发明实施例3提供的咽拭子样本肠道病毒71型提取产物采用荧光pcr检测的扩增曲线。图4为本发明实施例4提供的咽拭子样本流感病毒提取产物采用荧光pcr检测的扩增曲线。具体实施方式以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。该实施例的一种咽拭子样本中病原体核酸提取试剂盒,所述试剂盒包括蛋白酶处理液、裂解液、纳米磁珠、洗涤液和洗脱液;进一步地,所述蛋白酶处理液包括蛋白酶k,且蛋白酶k浓度为10-50mg/ml。进一步地,所述裂解液包括异硫氰酸胍、碘化锂、柠檬酸、tween20,其中异硫氰酸胍浓度为3-5mm,碘化锂浓度为1-5m,柠檬酸三钠浓度为50-200mm,tween20浓度为1%-5%,所述裂解液ph值为4.0-7.0。进一步地,所述纳米磁珠为包裹有二氧化硅的fe3o4,所述纳米磁珠直径为200-2000nm,浓度为50-200mg/ml。进一步地,所述洗涤液包括tris-hcl、nacl和无水乙醇,所述tris-hc的ph为6.5-8.5,浓度为1-5mm,所述nacl浓度为10-50mm,所述无水乙醇浓度为40%-80%。进一步地,所述洗脱液为无菌depc水,ph值为7.0-9.0。本发明还提供了一种咽拭子样本中病原体核酸的提取方法,包括如下步骤:步骤s1:取一新鲜咽拭子样本于1.5ml离心管中,使用无菌移液枪头向该离心管中加入300ul生理盐水和10-40ul蛋白酶处理液,震荡混匀1min,56℃水浴静置10min;步骤s2:取50-200ul步骤s1中的样本处理液于1.5ml离心管中,使用无菌移液枪头向该离心管中加入75-300ul裂解液、75-300ul异丙醇和纳米磁珠5-20ul,震荡混匀1min,室温静置10min;步骤s3:将步骤s2中的离心管置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸弃上清溶液;步骤s4:使用无菌移液枪头向步骤s3离心管中加入300-800ul洗涤液,将该离心管震荡混匀1min,置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸弃上清溶液;步骤s5:重复步骤s4一次;步骤s6:室温开盖干燥5-20min直至管内无液体残留;步骤s7:使用无菌移液枪头向步骤s6离心管中加入100-200ul洗脱液,56℃水浴5-10min;步骤s8:将步骤s7离心管震荡混匀1min,置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸取上清至新的离心管,即获得样本中的病原体核酸。进一步地,步骤s1中所述的蛋白酶处理液浓度为10-200mg/ml。进一步地,步骤s2中所述的纳米磁珠添加浓度为50-200mg/ml。以下举出本发明的具体实施例。实施例1:1)取临床pcr检定呼吸道合胞病毒感染患者的咽拭子样本于1.5ml离心管中,使用无菌移液枪头向该离心管中加入300ul生理盐水和浓度为10mg/ml的蛋白酶处理液10ul,震荡混匀1min,56℃水浴静置10min;2)取50ul上述样本处理液于1.5ml离心管中,使用无菌移液枪头向该离心管中加入75ul裂解液、75ul异丙醇和50mg/ml的纳米磁珠5ul,震荡混匀1min,室温静置10min;其中,裂解液内加入的成分分别是:浓度2.5mm的异硫氰酸胍、浓度50mm的柠檬酸和5%tween20,其余成分为水;裂解液的ph值为4.5;3)将该离心管置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸弃上清溶液;4)从磁力架上取出离心管,使用无菌移液枪头向该离心管中加入300ul洗涤液,将该离心管震荡混匀1min,置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸弃上清溶液;其中,洗涤液内加入的成分分别是:ph6.5且浓度1mm的tris-hcl、浓度10mmnacl和40%的无水乙醇,其余成分为水;5)重复步骤4)一次;6)从磁力架上取出离心管,室温开盖干燥5min直至管内无液体残留;7)使用无菌移液枪头向该离心管中加入100ul洗脱液,56℃水浴5min;其中,洗脱液为无菌depc水;洗脱液的ph值为7.0;8)将该离心管震荡混匀1min,置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸取上清至新的离心管,即获得样本中的病原体核酸;9)用上述的核酸提取产物制备其10倍梯度稀释物,用于荧光pcr扩增检定提取结果,如下表和附图1所示:表1合胞病毒核酸ct值原液24.12稀释10倍后的稀释物27.41稀释100倍后的稀释物30.61稀释1000倍后的稀释物33.69结论:采用实施例1成功从咽拭子中提取到了呼吸道合胞病毒核酸rna,该rna经10倍梯度稀释后,pcr检测结果曲线呈明显s型,且梯度均一,说明提取的核酸rna纯度较高。实施例2:1)取临床pcr检定为柯萨奇病毒a组16型感染患者的一新鲜咽拭子样本于1.5ml离心管中,使用无菌移液枪头向该离心管中加入300ul生理盐水和浓度为10mg/ml的蛋白酶处理液40ul,震荡混匀1min,56℃水浴静置10min;2)取200ul上述样本处理液于1.5ml离心管中,使用无菌移液枪头向该离心管中加入300ul裂解液、300ul异丙醇和50mg/ml的纳米磁珠20ul,震荡混匀1min,室温静置10min;其中,裂解液内加入的成分分别是:浓度4.5mm的异硫氰酸胍、浓度150mm的柠檬酸和10%tween20,其余成分为水;裂解液的ph值为6.5;3)将该离心管置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸弃上清溶液;4)从磁力架上取出离心管,使用无菌移液枪头向该离心管中加入800ul洗涤液,将该离心管震荡混匀1min,置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸弃上清溶液;其中,洗涤液内加入的成分分别是:ph8.5且浓度5mm的tris-hcl、浓度50mmnacl和80%的无水乙醇,其余成分为水;5)重复步骤4)一次;6)从磁力架上取出离心管,室温开盖干燥20min直至管内无液体残留;7)使用无菌移液枪头向该离心管中加入100ul洗脱液,56℃水浴10min;其中,洗脱液为无菌depc水;洗脱液的ph值为8.0;8)将该离心管震荡混匀1min,置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸取上清至新的离心管,即获得样本中的病原体核酸;9)用上述的核酸提取产物制备其10倍梯度稀释物,用于荧光pcr扩增检定提取结果,如下表2和附图2所示:表2柯萨奇病毒a组16型核酸ct值原液23.00稀释10倍后的稀释物26.15稀释100倍后的稀释物29.40稀释1000倍后的稀释物32.60稀释10000倍后的稀释物36.05结论:采用实施例2成功从咽拭子中提取到了柯萨奇病毒a组16型核酸rna,该rna经10倍梯度稀释后,pcr检测结果曲线呈明显s型,且梯度均一,说明提取的核酸rna纯度较高。实施例3:1)取临床pcr检定为肠道病毒71型感染患者的一新鲜咽拭子样本于1.5ml离心管中,使用无菌移液枪头向该离心管中加入300ul生理盐水和浓度为50mg/ml的蛋白酶处理液10ul,震荡混匀1min,56℃水浴静置10min;2)取六份50ul上述样本处理液于1.5ml离心管中,使用无菌移液枪头向六个离心管中加入150ul裂解液、150ul异丙醇和100mg/ml的纳米磁珠10ul,震荡混匀1min,室温静置10min;其中,裂解液内加入的成分分别是:浓度4.0mm的异硫氰酸胍、浓度100mm的柠檬酸和10%tween20,其余成分为水;裂解液的ph值为6.0;3)将六个离心管置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸弃上清溶液;4)从磁力架上取出离心管,使用无菌移液枪头向六个离心管中加入500ul洗涤液,将该离心管震荡混匀1min,置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸弃上清溶液;其中,洗涤液内加入的成分分别是:ph7.5且浓度3mm的tris-hcl、浓度20mmnacl和50%的无水乙醇,其余成分为水;5)重复步骤4)一次;6)从磁力架上取出六个离心管,室温开盖干燥10min直至管内无液体残留;7)使用无菌移液枪头向六个离心管中加入100ul洗脱液,56℃水浴10min。其中,洗脱液为无菌depc水。洗脱液的ph值为7.5;8)将六个离心管震荡混匀1min,置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸取上清至新的离心管,即获得样本中的病原体核酸;9)将上述六个核酸提取产物用于荧光pcr扩增检定提取结果,如下表和附图3所示:表3结论:采用实施例3成功从咽拭子中提取到了肠道病毒71型核酸rna,六个样本处理液的pcr检测结果曲线均呈明显s型,且重复性好(cv值小于1%),说明提取过程均一性较好。实施例4:1)取临床pcr检定为流感病毒感染患者的一新鲜咽拭子样本于1.5ml离心管中,使用无菌移液枪头向该离心管中加入300ul生理盐水和浓度为40mg/ml的蛋白酶处理液20ul,震荡混匀1min,56℃水浴静置10min;2)取六份各50ul上述样本处理液于六个1.5ml离心管中,使用无菌移液枪头分别向六个离心管中加入250ul裂解液、250ul异丙醇和200mg/ml的纳米磁珠20ul,震荡混匀1min,室温静置10min;其中,裂解液内加入的成分分别是:浓度3.5mm的异硫氰酸胍、浓度150mm的柠檬酸和7%tween20,其余成分为水;裂解液的ph值为5.5;3)将六个离心管置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸弃上清溶液;4)从磁力架上取出离心管,使用无菌移液枪头向六个离心管中加入800ul洗涤液,将六个离心管震荡混匀1min,置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸弃上清溶液;其中,洗涤液内加入的成分分别是:ph8.5且浓度4mm的tris-hcl、浓度40mmnacl和70%的无水乙醇,其余成分为水;5)重复步骤4)一次;6)从磁力架上取出离心管,室温开盖干燥15min直至管内无液体残留。7)使用无菌移液枪头分别向六个离心管中加入100ul洗脱液,56℃水浴10min;其中,洗脱液为无菌depc水;洗脱液的ph值为9.0;8)将六个离心管震荡混匀1min,置于磁力架上30s,待纳米磁珠完全吸至管壁之后,使用无菌移液枪头吸取上清至新的离心管,即获得样本中的病原体核酸;9)将上述六个核酸提取产物用于荧光pcr扩增检定提取结果,如下表和附图4所示:表4结论:采用实施例4成功从咽拭子中提取到了流感病毒核酸rna,六个样本处理液的pcr检测结果曲线均呈明显s型,且重复性好(cv值小于1%),说明提取过程均一性较好。虽然,上文中已经用一般性说明及具体实施例对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1