一类雌激素相关受体β突变体及其应用
一类雌激素相关受体
β
突变体及其应用
技术领域
1.本发明涉及基因工程和蛋白质工程,尤其是涉及一类雌激素相关受体β突变体及其应用。
背景技术:
2.蛋白质是生命的物质基础,机体所有重要的组成部分和生命活动都需要有蛋白质的参与。从生物材料中分离、制备蛋白质,并研究其结构与功能,对于了解生命活动的规律,阐明生命现象的本质有重大意义。外源重组蛋白的制备可以应用基因重组技术,从获得带有目的蛋白的基因片段的重组载体开始,之后将其转入可以表达目的蛋白的宿主细胞,进而在特定条件下诱导宿主细胞表达特定的重组蛋白。重组蛋白在工业生产和研究中都有广泛的应用:工业生产的蛋白酶制剂;医疗上用猪胰岛素来治疗糖尿病及体外诊断靶点;药物研究中对靶点蛋白进行体外药物筛选和受体-药物生物学与药理学特性研究;其它研究如蛋白质结构的测定和蛋白抗体的制备等。
3.重组蛋白表达纯化的工艺优化需要在保留蛋白质活性的前提下提高蛋白稳定性和可溶性。根据对蛋白质结构和功能的分析,可以通过定点突变的方式设计改变修饰,以提高蛋白质稳定性、酶活性及可溶性等。定点突变是指通过聚合酶链式反应(pcr)等方法引入所需变化,包括碱基的添加、删除、点突变等,最终改变dna所表达的目的蛋白的性状及表征。
4.核受体是全球药物研发的重要靶蛋白,在人类发育分化和代谢稳态等基本生命活动的调节中发挥着广泛且深远的影响(santos et al.,nat rev drug discov,2017,16(1),19-34.);其超家族成员包括内分泌介导类固醇激素、甲状腺激素、脂溶性维生素a和d作用的受体,以及大量内源配体未知的孤儿核受体。
5.作为一种孤儿核受体,雌激素相关受体errs(estrogen-related receptors)在人类基因组中存在三种亚型,包括errα、errβ和errγ(eudy jd et al.,genomic,1998,50(3):382-384)。errs参与机体的代谢调节、细胞周期以及内稳态的维持等重要生理活动,与酒精性脂肪肝、炎症性骨质疏松、胰岛素抵抗、癌症等多种疾病息息相关,是一个极具价值的药物研究靶点。与经典核受体结构组成相似,errs有五个主要的功能域:可变的n端域(ntd)、高度保守的dna结合域(dbd)、配体结合域(lbd)、dbd与lbd间的铰链域(hinge)及c端延伸域(ctd)。
6.雌激素相关受体errs是自激活蛋白,即在没有配体结合的情况下,errs处于激活构象,与辅激活因子结合,能够促进下游基因的转录。除此之外,errs的配体结合域(lbd)还可以与不同的配体结合,进而发生构象变化,募集多种辅调节因子,包括辅激活因子和辅抑制因子,最终达到调节靶基因转录水平的目的。激活剂类配体能使errs募集src1、src2、src3、pgc-1α、trap220等多种辅激活因子,而拮抗剂类配体则促使errs与ncor等辅抑制因子结合。通过差异性募集辅调节因子,导致不同配体差异性调节靶基因的表达水平,并最终调节机体的生理功能。
7.研究表明,errβ分布广泛并参与调控多种重要的生理功能。在胚胎时期,errβ高丰度表达可以促进胚胎发育,出生后则广泛分布于心、肾、前列腺和中枢神经等部位调节细胞周期及内稳态。errβ基因敲除小鼠体重减轻,脂肪量减少,代谢活性和能源消耗增加,提示errβ与能量内环境稳态的维持密切相关。此外,与errγ相似,errβ还具备调节细胞增殖周期、诱导胚胎和多能干细胞重编程的能力。这一特殊的能力,使其成为癌症相关疾病治疗的新热靶点。同时,在多氯联苯(pcb)、双酚a(bpa)等环境污染物对动物和人类造成的不良影响事件中,errβ亦扮演重要角色。
8.然而,难以获得溶解度高且稳定的errβ lbd蛋白质,一直是阻碍errβ靶点药物研究的瓶颈之一。在errs三个亚型中,errγ和errα的lbd因为良好的体外表达溶解性和稳定性,早在十多年前就成功实现体外纯化并凭借高效、廉价的生物化学平台进行了广泛的药物研究(audet-walsh et al.,actapharmacologicasinica,2015,36(1):51-61)。因为体外难以获取高纯度的蛋白,errβ参与的蛋白生化研究、大规模体外药物筛选、受体-药物生物学与药理学特性研究进程显著落后于errα和γ。
9.随着蛋白质工程和分子生物学技术的发展,运用理性设计和定向突变手段对蛋白质分子进行人工化改造已成为当前解决蛋白质工程领域问题的基础方法。通过与高同源性可溶蛋白质之间进行序列和结构比对,可以帮助识别导致溶解度低或聚合问题的关键残基,如识别糖皮质激素受体的f602s突变和盐皮质激素受体的c808s突变(bledsoe et al.,cell,2002,110,93-105;li,y.et al.,mol cell,2015,19,367-380)。半胱氨酸残基通常被优先用于系统性突变,以避免由于二硫键的形成引起的蛋白质的错误折叠和聚集。需要注意的是,要严格确保突变不会改变蛋白质的原有功能。具体到本发明的核受体时,需要确保突变残基引入lbds的情况下,配体结合口袋和辅调节因子结合位点不受到突变的干扰。
技术实现要素:
10.本发明的目的在于提供运用理性设计和定向突变手段构建的一类雌激素相关受体β突变体及其应用。
11.所述一类雌激素相关受体β突变体由seqidno.1所示的人源errβ氨基酸序列比对后,配体结合域螺旋1于突变位点相应位置的酪氨酸突变为组氨酸获得。
12.所述errβ相应位置的酪氨酸突变为组氨酸后的突变体,包括全长或含有该突变位点的部分功能域蛋白,其中含该突变位点的全长人源氨基酸序列如seqidno.2所示,所述errβ氨基酸序列为不同种属或同源异构体。
13.所述突变位点可为多位点组合,包括但不限于y215h、e234d、r382h、y356h、q416e等中的至少一个。
14.所述errβ蛋白包括全长或含有螺旋1上酪氨酸的部分功能域蛋白。
15.所述雌激素相关受体β突变体蛋白通过原核表达系统体外表达,所述原核表达系统包括但不限于大肠杆菌表达系统。
16.所述一类雌激素相关受体β突变体蛋白可在err配体及靶向药物筛选、蛋白结晶研究、抗体制备、蛋白-药物生理药理学参数检测及蛋白-蛋白相互作用以及结构生物学研究等中的应用。
17.所述一类雌激素相关受体β突变体质粒经表达、纯化后可以得到大量且稳定的突
变体蛋白,同时具备正常的配体和辅调节因子结合及转导下游信号的功能,为研究errβ提供了蛋白质工具,可以用于靶向药物筛选、抗体制备、蛋白-药物生理药理学参数检测、蛋白-蛋白相互作用以及结构生物学研究等各个领域。
18.实验证明,errβ突变体质粒表达的蛋白与野生型相比有溶解性提高或稳定性提高或溶解性和稳定性均提高的特性。蛋白表达及纯化结果显示野生型errβ lbd溶解度极低,仅为0.01mg/ml,而且杂质众多,无法据此纯化获得蛋白;而y215h单突变和含有y215h的r382h/y356h/y215h三突变均明显提高蛋白溶解性,可溶解蛋白量达到1mg/ml,相对野生型提高了100倍。类似的其余实验结果表明含有y215h的单突变或多突变均具有显著的增加体外表达的errβ蛋白溶解性和表达量的作用。
19.errβ蛋白突变体具有保持原有野生型蛋白类似功能的特性。基于细胞的报告基因实验表明errβ y215h突变体和野生型全长蛋白具有相似的持续性激活特性和被外源配体调控特征。这一功能性实验不仅表明突变引入未改变errβ与辅调节因子结合,也表明配体结合口袋未受到突变的干扰,仍能结合相关配体调控errβ活性及下游信号。
20.errβ lbd蛋白突变体经分离纯化制备后填补了errβ lbd蛋白的空白,在科学研究和医药工业等各方面都具有很重要的应用。所述应用为表达的突变蛋白在纯化后可以作为实验用单一蛋白或实验用组合蛋白的一部分,所述应用包括但不限于突变体蛋白用于靶向药物筛选、抗体制备、蛋白-药物生理药理学参数检测、蛋白-蛋白相互作用以及结构生物学研究等应用。例如,用errβ y215h突变蛋白测定了errβ与各种配体和辅调节因子的结合功能。
21.孤儿核受体errs家族蛋白被发现已经近三十年,相关方面的研究也证明errβ与细胞代谢和肿瘤发生等生理病理密切相关。但与errα或errγ不同的是,errβ由于难以在体外获得大量且稳定的蛋白,相关体外研究停滞不前,靶向errβ的药物研究速度也迟迟落后。本发明提供了一类不影响功能且具备显著性提升体外表达蛋白溶解性和稳定性的突变残基位点,使得在体外可以轻易得到大量且稳定蛋白,为研究errβ提供蛋白质工具,具有创造性。同时,本发明提供的errβ突变体具有重要的社会价值和经济价值,具有实用性。
22.本发明一个明显的目标是采取基于分子生物学技术提高errβ体外表达蛋白的溶解性和稳定性,并保持原有蛋白功能性。errβ蛋白的成功纯化获取可以促进靶向errβ相关基础研究,满足高效率、低成本、大规模体外药物筛选和治疗errs相关疾病药物的研究需求。
23.本发明提供一类显著提升雌激素相关受体β配体结合域(errβrr合域)溶解性和稳定性的突变残基位点。含有y215h突变的errβrr5h经纯化后可以得到大量且稳定的蛋白,同时具备正常的配体和辅调节因子结合及转导下游信号的功能,为研究errβ提供了蛋白质工具,可以用于靶向药物筛选、抗体制备、蛋白-药物生理药理学参数检测、蛋白-蛋白相互作用以及结构生物学研究等各个领域。
附图说明
24.图1为人类errβ、errα和errγlbd序列比对图。二级结构元素在序列的上方进行框注,残基根据其侧链性质着色。含有酸性侧链的残基底部标注下划线,碱性侧链为实心圆,羟基或胺基侧链为实心三角,较小或疏水侧链的残基则未标记。星号表示这三种errs的配
体结合口袋中的残基。errβ y215h突变的位置及其与螺旋h3相互作用的残基用箭头表示。
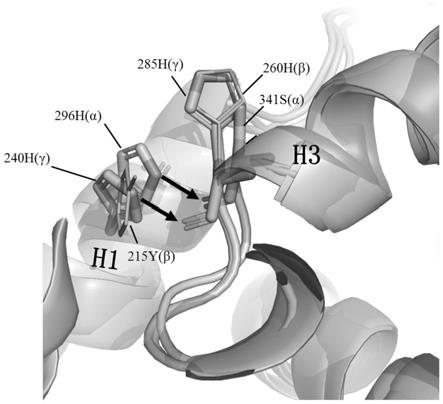
25.图2为errβ y215h突变对蛋白质稳定性的结构影响模式图。结构比对errα(pdb代码:1xb7)与errγ lbd(pdb代码:2e2r)和errβlbd模型。errβ中y215、h260如图标注并用细线表示,errα和errγ相应位置的残基如图标注并用棍棒表示,涉及的氢键则用箭头表示。
26.图3为errβlbd蛋白的纯化与检测结果。野生型蛋白errβ、errβy215h单突变体、errβr382h/y356h/y215h三突变体和表达量高的阳性对照errγ lbd表达蛋白纯化结果。每道蛋白上样种类如图中标记且上样量相同。
27.图4为基于细胞的全长野生型和突变errβ转录功能测定。结果是三次重复实验的平均值,误差棒表示取样群体内的标准偏差。**表示p<0.01。
28.图5为体外表达的errs lbd蛋白受bpa调控而招募lxxll基序核心的辅激活因子能力的测定。errβ lbd蛋白是y215h单突变体。alphascreen试验中三种err亚型招募辅激活因子src2基序能力相对bpa的剂量-响应曲线。结果是三次重复实验的平均值,误差棒表示取样群体内的标准偏差。
29.图6为体外表达的errs lbd蛋白受4-oht调控而招募lxxll基序核心的辅激活因子能力的测定。errβ lbd蛋白是y215h单突变体。alphascreen试验中三种err亚型招募辅激活因子src2基序能力相对4-oht的剂量-响应曲线。结果是三次重复实验的平均值,误差棒表示取样群体内的标准偏差。
30.图7为体外表达的errs、sf-1、lrh-1和rorγ蛋白招募llxyl基序核心的辅激活因子能力测定。lxxll基序核心的src2和llxyl基序核心的pgc-1α与errs或其他孤儿核受体差异性结合检测。errβ lbd蛋白是y215h单突变体。实验中辅激活因子核心序列如下:biotin-src1-2:terhki lhrll qess,biotin-src2-3:kkenal lryll dkdd,
31.biotin-src3-3:kennal lryll drdd,biotin-pgc1-α-1:aeepsl lkkll lapa,
32.biotin-pgc1-α-2:rrpcse llkyl ttnd。
具体实施方式
33.以下结合实施例将结合附图对本发明做进一步说明,本实施列仅用于解释本发明,而非对本发明范围的限制。
34.本发明实施例采用理性设计和定向突变构建一类雌激素相关受体β突变体。所述理性设计为采用生物信息学方法分析与errβ同源性高的可溶蛋白质之间的序列和结构,来识别导致errβ溶解度低或变性沉淀的关键残基,并在errβ蛋白中通过突变引入氢键稳定蛋白结构。所述定向突变,例如y215h突变在errβ蛋白中螺旋1(h1)与螺旋3(h3)间引入新氢键来稳定蛋白,理由在于具有高溶解性和稳定性的errα和errγ野生型蛋白该部位都存在一个氢键,这个氢键可以显著性提高两者的结构稳定性,而在errβ中却不存在这样一个氢键。分子动力学分析也表明该部位引入氢键对提高整体稳定性具有重要作用。
35.所述构建方式包括但不限于通过分子克隆技术将设计的突变氨基酸所对应碱基引物通过聚合酶链式反应(pcr)引入errβ基因(esrrb)中,并通过基因全序列测序确定突变体基因正确构建。
36.所述突变体不限于单突变,为一类包括y215h的突变体组合,特征在于errβ突变体中至少存在y215h突变,也可以包含y215h与e234d、r382h、y356h和q416e等突变的相互间或
多重组合。
37.所述表达系统,包括但不限于利用大肠杆菌表达系统表达构建errβ突变体蛋白。
38.所述溶解性、稳定性提高为errβ突变体表达的蛋白与野生型相比有溶解性提高或稳定性提高或溶解性和稳定性均提高的特性。蛋白表达及纯化结果显示野生型errβ lbd溶解度极低,仅为0.01mg/ml,而且杂质众多,无法据此纯化获得蛋白;而y215h单突变和含有y215h的r382h/y356h/y215h三突变均明显提高蛋白溶解性,可溶解蛋白量达到1mg/ml,相对野生型提高了100倍。类似的其余实验结果表明含有y215h的单突变或多突变均具有显著的增加体外表达的errβ蛋白溶解性和表达量的作用。
39.以下给出具体实施例。
40.实施例1,生物信息学分析探寻及确定突变位点。
41.为了找出可能导致errβ lbd溶解性低和稳定性差的关键残基,对errβ与可溶性稳定性高的errα和errγ进行生物信息学分析,包括一级序列比对、三维结构比对和突变模型模拟。如图1,在基于序列比对时发现errβ lbd螺旋1(h1)第215位氨基酸为酪氨酸(υ215),而err其它两成员errα和errγ在此处均为组氨酸,而组氨酸比酪氨酸具有更强的亲水性和带电性。如图2,进一步地分析errα(pdb:2e2r)和errγ(pdb:1kv6)的三维结构时发现此处h1的组氨酸对维持errα和errγ的稳定性具有重要作用。在errα和errγ中,此处组氨酸的咪唑侧链分别与errα螺旋3(h3)上的丝氨酸和errγ螺旋3上的组氨酸主链羰基氧形成氢键,从而稳定errα和errγ蛋白三维结构。而在errβ中疏水的酪氨酸(y215)苯环核则无法参与形成这样的氢键。因此,突变errβ y215h预计引入能有效提升errβ蛋白稳定性的氢键。图2的突变模型也表示此部位突变对提高整体稳定性具有重要作用。重要的是,y215h突变残基位于配体结合口袋的外侧,远离辅调节因子结合位点,因此y215h可作为能提高整体稳定性而不影响errβ蛋白功能的潜在突变位点。利用相似的分析方法,还确定了e234d、r382h、y356h和q416e等为潜在突变位点,并且分析得出,同时突变两个甚至更多位点在理论上是有价值的。
42.实施例2,利用点突变技术构建突变表达质粒。
43.人源errβ(uniprotkb标识号:o95718-3)氨基酸序列见seq idno.1。本发明首先采用原核表达质粒载体pet24a(novagen,usa),以野生型errβ序列为模板,通过重叠延伸pcr的方法将设计的含有突变的引物克隆入errβ基因中。以y215h突变为例,所用引物为:
44.f:5
’-
cattgaccaagattgtctcacacctactggtggctgagccgga-3’45.r:5
’-
tccggctcagccaccagtaggtgtgagacaatcttggtcaatg-3’46.反应条件为95℃预变性5min,之后26个循环以下程序:95℃变性1min,60℃退火1min,72度延伸6min。利用thermofastdigest限制性内切酶dpn1对pcr反应后的dna进行酶切,破坏作为模板的野生型errβ。37℃酶切30min后,将酶切产物转入大肠杆菌,让突变质粒的缺口在大肠杆菌中修复并进行复制扩增利用抗性培养基筛选,挑取单克隆菌落进行进一步扩增,后送往测序公司进行序列鉴定,根据测序结果确定突变体基因正确构建。最终构建获得如氨基酸序列seq idno.2所示突变体基因。
47.发明内容中所述两个组合突变位点的构建,不同于单突变克隆。单突变引入errβ基因后,需继续以该单突变质粒为新克隆模板,再将设计含有新突变位点的引物克隆入errβ基因中。以y215h、r382h双突变为例,利用已构建成功的errβy215h为模板,用如下引物,引
入新的r382h突变位点。具体实验步骤同构建单突变实验。
48.f:5
’-
aggactacgagctgagccagcaccatgaggagccctggaggac-3’49.r:5
’-
gtcctccagggctcctcatggtgctggctcagctcgtagtcct-3’50.同样,两个以上组合位点需要在双突变引入errβ基因后,再将设计含有新突变的引物克隆入errβ基因中。以y215h、r382h、y356h三突变为例,利用已构建成功的y215h、r382h为模板,用如下引物,引入新的y356h突变位点。具体实验步骤同构建单突变实验。
51.f:5
’-
tcgccaactccgattccatgcacatcgaggatctagaggctgt-3’52.r:5
’-
acagcctctagatcctcgatgtgcatggaatcggagttggcga-3’53.需要指出的是两个及以上组合位点的突变无严格突变顺序要求。以y215h、r382h、y356h三突变为例,为获得此三突变,既可以先构建errβ y215h后再引入r382h和y356h,亦可以先构建r382h或y356h再引入剩下两处突变位点。
54.真核突变体质粒采用类似方法,所用模板为带有野生型errβ基因的真核表达载体,如cmx-human errβ和pbind errβ lbd。
55.seq id no.1
56.mssddrhlgsscgsfiktepsspssgidalshhspsgssdasggfglalgthangldsppmfagaglggtpcrksyedcasgimedsaikceymlnaipkrlclvcgdiasgyhygvasceackaffkrtiqgnieyscpatneceitkrrrkscqacrfmkclkvgmlkegvrldrvrggrqkykrrldsesspylslqisppakkpltkivsyllvaepdklyampppgmpegdikalttlcdladrelvviigwakhipgfsslslgdqmsllqsawmeililgivyrslpyddklvyaedyimdeehsrlagllelyrailqlvrrykklkvekeefvtlkalalansdsmyiedleavqklqdllhealqdyelsqrheepwrtgkllltlpllrqtaakavqhfysvklqgkvpmhklflemleakv
57.seq id no.2
58.mssddrhlgsscgsfiktepsspssgidalshhspsgssdasggfglalgthangldsppmfagaglggtpcrksyedcasgimedsaikceymlnaipkrlclvcgdiasgyhygvasceackaffkrtiqgnieyscpatneceitkrrrkscqacrfmkclkvgmlkegvrldrvrggrqkykrrldsesspylslqisppakkpltkivshllvaepdklyampppgmpegdikalttlcdladrelvviigwakhipgfsslslgdqmsllqsawmeililgivyrslpyddklvyaedyimdeehsrlagllelyrailqlvrrykklkvekeefvtlkalalansdsmyiedleavqklqdllhealqdyelsqrheepwrtgkllltlpllrqtaakavqhfysvklqgkvpmhklflemleakv
59.实施例3,含有y215h突变的errβ蛋白溶解性与表达量测定。
60.将构建好的突变蛋白与野生型蛋白进行小规模体外表达与检测。构建好的人源pet24a errβlbd基因含有6聚组氨酸融合标签。将构建好的质粒转化进入大肠杆菌bl21(de3)中,并在30℃进行培养扩增,至od600约为0.8时降温至18℃,加入终浓度为0.1mm异丙基1-硫代-β-d-半乳糖苷(iptg)诱导靶蛋白表达过夜。表达的大肠杆菌细胞在4℃低速离心(4200r.p.m.)30min后进行收集,并冰上重悬于缓冲液(25mm tris ph7.5,25mm咪唑,300mm氯化钠)中。-70℃冷冻30min后流水化冻,并采用超声破碎细胞。裂解的细胞液在4℃高速离心(20000r.p.m.)30min,后取上清与含有镍金属螯合的珠子孵育10min。随后离心(约7000r.p.m)弃上清。用含有25mm咪唑的缓冲液洗去游离蛋白后用含有500mm咪唑的洗脱缓冲液一次性洗脱蛋白。洗脱出的蛋白使用聚丙烯酰胺凝胶电泳法(sds-page)检测可溶解的errβlbd蛋白含量和纯度。如图3,sds蛋白胶显示野生型errβlbd可溶解度极低,仅为0.01mg/ml,而且杂质众多,无法纯化获得蛋白;
61.而y215h单突变和r382h/y356h/y215h三突变具有明显的提高蛋白表达量和溶解性的能力,可溶解蛋白浓度均为1mg/ml,相对野生型提高了100倍。errγlbd为实验的表达稳定的阳性对照。类似的其余实验结果表明含有y215h的单突变或多突变均具有显著的增加体外表达的errβ蛋白溶解性和表达量的作用。
62.实施例4,y215h突变保留野生型errβ蛋白功能。
63.y215h残基位置远离errβ蛋白功能中心,预示该位点突变不会改变该蛋白功能。为了进一步验证该突变蛋白的功能,进行了荧光素酶报告基因测定实验,用于对比突变蛋白与野生型蛋白转录激活能力和受配体调节能力的差异。293t细胞培养在含10%胎牛血清的dmem中,转染前一天在24孔板进行细胞接种,接种密度为5
×
104细胞/每孔,第二天进行转染。使用lipofectamine 2000(invitrogen)进行瞬时转染。将实施例2中构建的cmx-human errβy215h或野生型cmx-human errβ质粒分别与errβ反应元件delta-mtv-ere质粒和含有内参的renilla-luc质粒转染入293t细胞。转染5h后加入双酚a(bpa)或4-羟基他莫昔芬(4-oht)配体处理细胞。转染24h后收集细胞,并利用双荧光素酶报告基因检测试剂盒(promega)进行荧光素酶测定。如图4,实验结果表明y215h突变的errβ和野生型errβ显示出相似的持续性自激活特性,并且激活能力受到配体化合物处理后表现出相似的反应。这一功能性实验不仅表明突变引入未改变errβ与辅调节因子结合,也表明配体结合口袋未受到突变的干扰,仍能结合相关配体进而调控errβ转录活性。
64.实施例5,纯化的errβ y215h蛋白可以用来测定各种配体和辅调节因子的结合能力。
65.分离制备蛋白质在科学研究和医药工业等各方面都有很广泛的应用。首先利用纯化的errβ蛋白进行其相应配体活性和亲和度测试。对pet24a errβ lbd y215h、pet24a errαlbd和pet24a errγlbd质粒如实施例3的方式进行了放大培养和表达。裂解的细胞液经4℃离心后,取上清上柱于ge公司的镍离子亲和层析柱(niso4-loadedhitraphpcolumn,gehealthcare)。随后,装载样品的镍柱于ge公司的akta pure纯化仪中使用25~500mm咪唑的洗脱缓冲液梯度洗脱。洗脱出的蛋白进一步使用阴离子交换柱(q-sepharose column)纯化,蛋白纯化期间通过sds蛋白胶检测纯化效率。
66.alphascreen技术目前已经广泛应用于基于核受体与配体相互作用的药物研发中。(jin et al.,nature communications 2013,4,1937)。其原理是带有his6标记的errs lbd蛋白会与标记有镍的受体珠子结合,而生物素标记的辅调节因子多肽会与标记有链霉亲和素的供体珠子结合。如果配体能诱导核受体构象发生变化从而使其与辅调节因子多肽结合,这时供体珠子与受体珠子靠近,用680nm光激发,就会检测到520-620nm荧光信号。该实验的反应体系是20-80nm的受体lbd蛋白,20nm生物素化的辅调节因子多肽,5μg/ml的供体和受体玻璃珠,缓冲液(25mmhepes,100mmnacl and 0.1mg/ml bovine serum albumin,ph 7.0)。利用alphascreen试剂盒(perkins-elmer)检测errs三种亚型蛋白与辅激活因子受配体调控结合能力和配体剂量-活性曲线。结果表明,实验阴性对照组errα结果与当前研究理论相似,不受两配体调控。而bpa促进errβ突变体与src2活性的ec50约为300nm,4-oht抑制errβ的ic50约为280nm,这与实验阳性对照组相似。errγ中bpa的ec50约为160nm(如图5),而4-oht的ic50约为50nm(如图6)。因此,alphascreen实验证明,体外纯化的errβlbd突变体能像errα或errγlbd具有结合含有经典的lxxll基序的辅激活因子src2的特性,并具
备受到配体剂量依赖调节性质(如图5和6)。
67.大多数辅激活因子含有经典的lxxll基序,如辅激活因子src2。有的辅激活因子含有非经典的基序,如pgc1-α第二基序是llkyl,是一种经典的lxxll的倒置形式。为了进一步了解体外表达errβlbd突变体是否能保持相似能力,对三种errs成员和其它三种孤儿受体lrh1、sf1和rorγ分别招募srcs和pgc1-α的能力进行鉴定。alphascreen实验表明,六种孤儿核受体在无配体的情况下表现出强有力的招募含有经典的lxxll基序的srcs的能力,这符合核受体的一般性质。特别的是,所有三种errs成员均表现出招募经典的lxxll基序srcs和非经典的llxyl基序的pgc1-α-2的能力,相比之下,lrh1、sf1和rorγ几乎不与pgc1-α-2相互作用(图7)。这些实验证明体外表达的errβ突变体蛋白与野生型errα和errγ蛋白类似,均可以用来测定各种配体和辅调节因子的结合功能。
68.所述errβ蛋白突变体具有保持原有野生型蛋白类似功能的特性。基于细胞的报告基因实验表明errβy215h突变体和野生型全长蛋白具有相似的持续性激活特性和被外源配体调控特征。这一功能性实验不仅表明突变引入未改变errβ与辅调节因子结合,也表明配体结合口袋未受到突变的干扰,仍能结合相关配体调控errβ活性及下游信号。
69.所述errβlbd蛋白突变体经分离纯化制备后填补了errβlbd蛋白的空白,在科学研究和医药工业等各方面都具有很重要的应用。所述应用为表达的突变蛋白在纯化后可以作为实验用单一蛋白或实验用组合蛋白的一部分,所述应用包括但不限于突变体蛋白用于靶向药物筛选、抗体制备、蛋白-药物生理药理学参数检测、蛋白-蛋白相互作用以及结构生物学研究等应用。例如,用errβ y215h突变蛋白测定了errβ与各种配体和辅调节因子的结合功能。
70.孤儿核受体errs家族蛋白被发现已经近三十年,相关方面的研究也证明errβ与细胞代谢和肿瘤发生等生理病理密切相关。但与errα或errγ不同的是,errβ由于难以在体外获得大量且稳定的蛋白,相关体外研究停滞不前,靶向errβ的药物研究速度也迟迟落后。本发明提供了一类不影响功能且具备显著性提升体外表达蛋白溶解性和稳定性的突变残基位点,使得在体外可以轻易得到大量且稳定蛋白,为研究errβ提供蛋白质工具,具有创造性。同时,本发明提供的errβ突变体具有重要的社会价值和经济价值,具有实用性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1