一种依维莫司的制备方法及其中间体与流程
1.本发明属于医药合成技术领域,具体涉及一种依维莫司的制备方法及其中间体。
背景技术:
2.依维莫司(everolimus,商品名afinitot)是由雷帕霉素的42-oh衍生为42-o-(2-羟乙基),故依维莫司又称42-o-(2-羟乙基)-雷帕霉素,是由瑞士诺华公司(novartis)最先研制开发的大环内酯类免疫抑制剂,可阻断细胞周期从g1期到s期进程,从而导致癌细胞死亡,其作用机制包括免疫抑制作用、抗肿瘤作用、抗病毒作用以及血管保护作用,常常与环孢素等其他免疫抑制剂联合使用以降低毒性。2004年首次在德国上市,2006年就已全面占领欧洲市场,2009年fda批准依维莫司用于治疗使用舒尼替尼或索拉非尼无效的晚期肾癌,此外,依维莫司还具有抑制血管内皮细胞增殖的作用,可用作药物支架的涂层药物防止冠状动脉支架植入后引起血管再狭窄。
[0003][0004]
由于雷帕霉素反应活性位点多,直接以雷帕霉素与活性酯反应,反应选择性差,收率低,且生成较多与依维莫司性质接近的副产物(31位),较难分离。专利us5665772最早报道了依维莫司及其合成工艺,在2,6-二甲基吡啶存在下,雷帕霉素与三氟甲磺酸2-(叔丁基二甲基硅氧基)乙酯反应得到中间体a,再将中间体a的硅醚键在hcl/甲醇中断裂得到目标产物。该方法中第一步反应收率仅为5%左右,大部分原料未转化,同时原料及产物有明显的降解;第二步反应中极易产生降解产物,所得产物纯度较低,不利于产物的纯化。专利申请cn102786534a同样将雷帕霉素和三氟甲磺酸2-(叔丁基二甲基硅氧基)乙酯直接反应,然后于稀盐酸中水解后得目标产物,收率提高至35%,但仍不能满足实际生产的需要。文献:依维莫司的合成,中国医药工业杂志,2015,46(12),1271-1277.中以雷帕霉素与2-[(四氢-2h-吡喃-2-基)氧基]乙基三氟甲磺酸酯在有机碱作用下缩合得到40-o-[(四氢-2h-吡喃-2-氧基)乙基]雷帕霉素,然后直接在酸性条件下脱除缩醛保护基,最后经制备液相分离纯化得到依维莫司,虽然产率相较之前有所提高,但是原料活性酯2-[(四氢-2h-吡喃-2-基)氧基]乙基三氟甲磺酸酯活性高,需现用现制,且需检测其含量大于70%后才可以使用,给工业化大生产造成不便。除三氟甲磺酸2-(叔丁基二甲基硅氧基)乙酯和2-[(四氢-2h-吡喃-2-基)氧基]乙基三氟甲磺酸酯外,其他的活性酯还包括叔丁基二苯基硅基乙醇三氟甲
磺酸酯、四氢吡喃-2-氧基乙醇三氟甲磺酸酯和甲氧基甲基乙醇三氟甲磺酸酯等,均存在上述收率、纯度低的问题。专利申请cn104478898a同样以雷帕霉素和三氟甲磺酸2-(叔丁基二甲基硅氧基)乙酯为原料直接反应,得中间体化合物,然后以三乙胺三氟化氢为脱保护试剂,得目标产物,其中第一步得到的中间体化合物经柱层析分析收率高达89%,总收率达83%,目标产物纯度达99.56%,综合前述文献报道,直接进行反应无法避免31位羟基参与反应,且31位取代副产物极性和目标产物相近,分离困难,其收率真实性有待考证。
[0005]
cn102268015a公布了一种依维莫司的合成方法,以雷帕霉素直接与三氟甲磺酸酐反应得到三氟甲磺酸酯,再与单保护乙二醇取代反应后酸解,总收率为50%左右。
[0006]
cn109776569a公开的依维莫司制备方法中,首先合成了双保护的雷帕霉素,再选择性的水解42位羟基保护基,与三氟甲磺酸2-(叔丁基二甲基硅氧基)乙酯反应、水解后得产物依维莫司,但由于水解42位羟基保护基过程中不可避免出现过度水解的问题,生成许多雷帕霉素原料,从而参与后续的反应,导致生成相对较多的副产物。
[0007]
综上,改进依维莫司的合成工艺及条件,提高雷帕霉素的综合利用率及产品纯度是依维莫司工业放大生产中的迫切需要解决的问题。
技术实现要素:
[0008]
鉴于现有技术的不足,本发明提供了三种新的依维莫司中间体化合物及合成依维莫司的新路线。该路线采用两个保护基分步保护雷帕霉素,不存在31位副产物,且有效的避免了过度水解问题,操作可控范围广,大大提高了产品收率、纯度。
[0009]
本发明的具体技术方案如下:
[0010]
本发明第一个方面,提供一种依维莫司的制备方法,该方法包括如下步骤:
[0011][0012]
一种如上所示的依维莫司的制备方法,具体包括如下步骤:
[0013]
1)n2保护下,将雷帕霉素、有机碱依次加至有机溶剂a中,搅拌溶解,控温缓慢滴加叔丁基二苯基氯硅烷,反应完毕,得中间体化合物ⅰ;
[0014]
2)n2保护下,将步骤1)所得中间体化合物ⅰ溶解于有机溶剂b中,控温滴加(boc)2o溶液,反应完毕,得含有中间体化合物ⅱ的反应液;然后将含有中间体化合物ⅱ的反应液转至室温,加入氟化盐,室温搅拌反应,反应完毕,得中间体化合物ⅲ;
[0015]
3)n2保护下,将有机碱、2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯依次加入到溶解有中间体化合物ⅲ的有机溶剂c中,控温反应,得中间体ⅳ;
[0016]
4)将中间体化合物ⅳ溶解于有机溶剂d中,控温滴加酸溶液,反应完毕,得依维莫司。
[0017]
优选的,步骤(1)中所述有机溶剂a选自乙酸乙酯、甲醇、乙醇、丙酮、四氢呋喃中的一种或多种,其中特别优选乙酸乙酯。
[0018]
优选的,步骤(1)中所述有机碱选自三乙胺、吡啶、2,6二甲基吡啶、n,n-二异丙基
乙基胺中的一种或多种,其中特别优选三乙胺。
[0019]
优选的,步骤(1)中所述控温滴加温度为-5~10℃,其中特别优选0~5℃。
[0020]
优选的,步骤(1)中所述雷帕霉素、叔丁基二苯基氯硅烷与有机碱的投料摩尔比为1:1.0~1.5:1.2~1.8,其中特别优选1:1.3:1.5。
[0021]
在一优选方案中,步骤(1)中后处理步骤为,反应完毕后析晶,过滤;所述析晶方法为向将所得反应液转至室温,然后加入烃类溶液,搅拌析晶;优选的,所述烃类选自正庚烷、正己烷、环己烷中的一种或多种。
[0022]
优选的,步骤(2)中所述有机溶剂b选自四氢呋喃、二氯甲烷、乙酸乙酯中的一种或多种,其中特别优选二氯甲烷。
[0023]
优选的,步骤(2)中所述中间体化合物ⅰ与(boc)2o的投料摩尔比为1:1~1.5,其中特别优选1:1.2。
[0024]
优选的,步骤(2)中所述控温滴加温度为0~10℃,其中特别优选5℃。
[0025]
优选的,步骤(2)中所述氟化盐选自四丁基氟化铵三水合物、四甲基氟化铵四水合物、四乙基氟化铵二水合物、氟化钠中的一种或多种,其中特别优选四丁基氟化铵三水合物。
[0026]
优选的,步骤(2)中所述中间体化合物ⅰ与氟化盐摩尔比为1:1.0~1.5,其中特别优选1:1.3。
[0027]
在一优选方案中,步骤(2)中后处理步骤为,反应完毕后向反应液中加入纯水将有机相洗至中性,无水硫酸钠干燥,减压浓缩至干,得中间体化合物ⅲ。
[0028]
优选的,步骤(3)中所述有机碱选自三乙胺、吡啶、2,6二甲基吡啶、n,n-二异丙基乙基胺中的一种或多种,其中特别优选2,6二甲基吡啶。
[0029]
优选的,步骤(3)中所述溶解中间体化合物ⅲ的有机溶剂c选自乙酸乙酯、甲苯、甲醇、乙醇、丙酮、四氢呋喃中的一种或多种,其中特别优选甲苯。
[0030]
优选的,步骤(3)中所述控温反应温度为40~60℃,其中特别优选50℃。
[0031]
优选的,步骤(3)中所述中间体化合物ⅲ、2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯与有机碱的投料摩尔比为1:10~14:6~10,其中特别优选1:12:8。
[0032]
在一优选方案中,步骤(3)中后处理步骤为,反应完毕后,将反应液自然降至室温后,加入乙酸乙酯,搅拌,抽滤,所得有机相用饱和碳酸氢钠溶液和饱和食盐水各洗一次,有机层用无水硫酸钠于室温下干燥,过滤除去干燥剂,滤液减压蒸至基本无馏分流出时,浓缩液中加入硅胶继续减压蒸干,柱层析分离得中间体化合物ⅳ。优选的,所述柱层析分离过程以石油醚:乙酸乙酯(v/v)=2:1洗脱,再用石油醚:乙酸乙酯(v/v)=1:1洗脱。
[0033]
优选的,步骤(4)中所述酸调节ph至2~3。
[0034]
优选的,步骤(4)中所述控温反应温度为-5~10℃,其中特别优选5℃。
[0035]
优选的,步骤(4)中所述酸选自盐酸、硫酸以及氢溴酸中的一种,其中特别优选盐酸。
[0036]
优选的,步骤(4)中所述有机溶剂d选自乙酸乙酯、甲醇、乙醇、丙酮、四氢呋喃中的一种或多种,其中特别优选丙酮。
[0037]
在一优选方案中,步骤(4)中后处理步骤为,反应完毕后依次加入乙酸乙酯和纯水萃取,合并有机相,依次用碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩,柱
层析分离,得依维莫司;优选的,所述柱层析分离过程以石油醚:乙酸乙酯(v/v)=1:1洗脱,再用乙酸乙酯洗脱。
[0038]
中间体化合物ⅳ是新化合物,构成了本发明的另一发明内容。
[0039]
本发明的第二个方面,是提供一种新的依维莫司中间体化合物ⅳ:
[0040][0041]
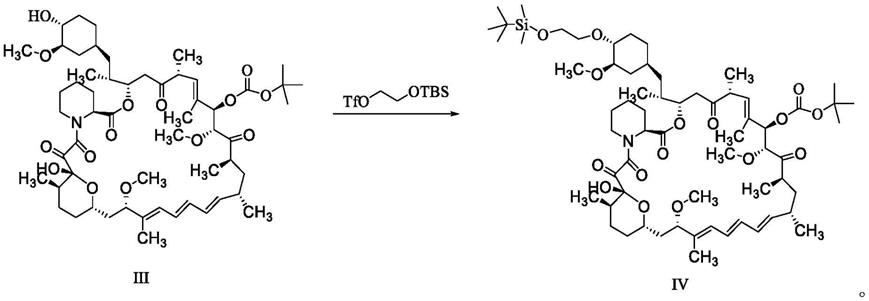
同时提供依维莫司中间体化合物ⅳ的制备方法,包括如下步骤:中间体化合物ⅲ与2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯进行控温反应,得中间体化合物ⅳ,反应路线如下:
[0042][0043]
所述依维莫司中间体化合物ⅳ的制备方法,具体包括如下步骤:n2保护下,将有机碱、2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯依次加入到溶解有中间体化合物ⅲ的有机溶剂c中,控温反应,得中间体化合物ⅳ。
[0044]
优选的,所述有机碱选自三乙胺、吡啶、2,6-二甲基吡啶、n,n-二异丙基乙基胺中的一种或多种,其中特别优选2,6-二甲基吡啶。
[0045]
优选的,所述有机溶剂c选自乙酸乙酯、甲苯、甲醇、乙醇、丙酮、四氢呋喃中的一种或多种,其中特别优选甲苯。
[0046]
优选的,所述控温反应温度为40~60℃,其中特别优选50℃。
[0047]
优选的,所述中间体化合物ⅲ、2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯与有机碱的投料摩尔比为1:10~14:6~10,其中特别优选1:12:8。
[0048]
在一优选方案中,中间体化合物ⅳ的后处理步骤为,反应完毕后,将反应液自然降至室温后,加入乙酸乙酯萃取,所得有机相用饱和碳酸氢钠溶液和饱和食盐水各洗一次,有机层用无水硫酸钠于室温下干燥,过滤除去干燥剂,滤液减压蒸至基本无馏分流出时,浓缩液中加入硅胶继续减压蒸干,柱层析分离得中间体化合物ⅳ。优选的,所述柱层析分离过程以石油醚:乙酸乙酯(v/v)=2:1洗脱,再用石油醚:乙酸乙酯(v/v)=1:1洗脱。
[0049]
所述依维莫司中间体化合物ⅳ用于制备依维莫司的用途。
[0050]
一种依维莫司中间体化合物ⅳ制备依维莫司的方法,包括以下步骤:中间体化合物ⅳ在酸性条件下水解,反应完毕,得依维莫司,其合成路线如下:
[0051][0052]
所述依维莫司中间体化合物ⅳ用于制备依维莫司的方法,具体包括以下步骤:将中间体ⅳ溶解于有机溶剂d中,控温滴加酸溶液,反应完毕,得依维莫司。
[0053]
优选的,所述酸调节溶液ph至2~3。
[0054]
优选的,所述控温反应温度为-5~10℃,其中特别优选5℃。
[0055]
优选的,所述酸选自盐酸、硫酸以及氢溴酸中的一种,其中特别优选盐酸。
[0056]
优选的,所述有机溶剂d选自乙酸乙酯、甲醇、乙醇、丙酮、四氢呋喃中的一种或多种,其中特别优选丙酮。
[0057]
在一优选方案中,依维莫司后处理步骤为,反应完毕后加入乙酸乙酯和纯水萃取,合并有机相,依次用碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩,柱层析分离,得依维莫司;优选的,所述柱层析分离过程以石油醚:乙酸乙酯(v/v)=1:1洗脱,再用乙酸乙酯洗脱。
[0058]
中间体化合物ⅲ是新化合物,构成了本发明的另一发明内容。
[0059]
本发明的第三个方面,是提供一种新的依维莫司中间体化合物ⅲ:
[0060][0061]
所述中间体化合物ⅲ的制备方法,包括如下步骤:室温条件下,中间体化合物ⅱ在氟化盐作用下水解,反应完毕,得中间体化合物ⅲ,反应路线如下:
[0062][0063]
所述氟化盐选自四丁基氟化铵三水合物、四甲基氟化铵四水合物、四乙基氟化铵二水合物、氟化钠中的一种或多种,其中特别优选四丁基氟化铵三水合物。
[0064]
所述依维莫司中间体化合物ⅲ用于制备依维莫司的用途。
[0065]
一种依维莫司中间体化合物ⅲ用于制备依维莫司的方法,包括如下步骤:a)n2保护下,2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯和中间体化合物ⅲ在有机碱的作用下进行控温反应,得中间体化合物ⅳ;b)中间体化合物ⅳ在酸性条件下水解,反应完毕,得依维莫司,合成路线如下:
[0066][0067]
所述依维莫司中间体化合物ⅲ用于制备依维莫司的方法,具体包括如下步骤:
[0068]
a)n2保护下,将有机碱、2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯依次加入到溶解有中间体化合物ⅲ的有机溶剂c中,控温反应,得中间体化合物ⅳ;
[0069]
b)将中间体化合物ⅳ溶解于有机溶剂d中,控温滴加酸溶液,反应完毕,得依维莫司。
[0070]
优选的,步骤a)中所述有机碱选自三乙胺、吡啶、2,6-二甲基吡啶、n,n-二异丙基乙基胺中的一种或多种,其中特别优选2,6-二甲基吡啶。
[0071]
优选的,步骤a)中所述溶解中间体化合物ⅲ的有机溶剂c选自乙酸乙酯、甲苯、甲醇、乙醇、丙酮、四氢呋喃中的一种或多种,其中特别优选甲苯。
[0072]
优选的,步骤a)中所述控温反应温度为40~60℃,其中特别优选50℃。
[0073]
优选的,步骤a)中所述中间体化合物ⅲ、2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯与有机碱的投料摩尔比为1:10~14:6~10,其中特别优选1:12:8。
[0074]
在一优选方案中,步骤a)中后处理步骤为,反应完毕后,将反应液自然降至室温后,加入乙酸乙酯,搅拌,抽滤,所得有机相用饱和碳酸氢钠溶液和饱和食盐水各洗一次,有机层用无水硫酸钠于室温下干燥,过滤除去干燥剂,滤液减压蒸至基本无馏分流出时,浓缩液中加入硅胶继续减压蒸干,柱层析分离得中间体化合物ⅳ。优选的,所述柱层析分离过程以石油醚:乙酸乙酯(v/v)=2:1洗脱,再用石油醚:乙酸乙酯(v/v)=1:1洗脱。
[0075]
优选的,步骤b)中所述酸调节ph至2~3。
[0076]
优选的,步骤b)中所述控温反应温度为-5~10℃,其中特别优选5℃。
[0077]
优选的,步骤b)中所述酸选自盐酸、硫酸以及氢溴酸中的一种,其中特别优选盐酸。
[0078]
优选的,步骤b)中所述有机溶剂d选自乙酸乙酯、甲醇、乙醇、丙酮、四氢呋喃中的一种或多种,其中特别优选丙酮。
[0079]
在一优选方案中,步骤b)中后处理步骤为,反应完毕后加入乙酸乙酯和纯水萃取,合并有机相,依次用碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩,柱层析分离,得依维莫司;优选的,所述柱层析分离过程以石油醚:乙酸乙酯(v/v)=1:1洗脱,再用乙酸乙酯洗脱。
[0080]
中间体化合物ⅱ是新化合物,也构成了本发明的另一发明内容。
[0081]
本发明的第四个方面,是提供一种新的依维莫司中间体化合物ⅱ:
[0082][0083]
所述中间体化合物ⅱ的制备方法,包括如下步骤:将中间体化合物ⅰ与(boc)2o反应,反应完毕,得中间体化合物ⅱ,反应路线如下:
[0084][0085]
所述依维莫司中间体化合物ⅱ的制备方法,具体包括如下步骤:n2保护下,将中间体化合物ⅰ溶解于有机溶剂b中,控温滴加(boc)2o溶液,反应完毕,得中间体化合物ⅱ。
[0086]
优选的,所述有机溶剂b选自二氯甲烷、乙酸乙酯中的一种或其组合,其中特别优选二氯甲烷。
[0087]
优选的,所述控温滴加温度为0~10℃,其中特别优选5℃。
[0088]
优选的,所述中间体化合物ⅰ与(boc)2o的投料摩尔比为1:1~1.5,其中特别优选1:1.2。
[0089]
在一优选方案中,中间体化合物ii的后处理步骤为:反应完毕后,用饱和碳酸氢钠溶液洗涤,有机相用无水硫酸钠室温干燥,过滤,减压浓缩至干,即得中间体化合物ii。
[0090]
在一优选方案中,所述中间体化合物ⅰ的制备步骤包括:n2保护下,将雷帕霉素、有机碱依次加至有机溶剂a中,搅拌溶解,控温缓慢滴加叔丁基二苯基氯硅烷,反应完毕,析晶,过滤,得固体中间体化合物ⅰ,反应路线如下:
[0091][0092]
优选的,所述有机溶剂a选自乙酸乙酯、甲醇、乙醇、丙酮、四氢呋喃中的一种或多种,其中特别优选乙酸乙酯。
[0093]
优选的,所述有机碱选自三乙胺、吡啶、2,6二甲基吡啶、n,n-二异丙基乙基胺中的一种或多种,其中特别优选三乙胺。
[0094]
优选的,所述控温滴加温度为-5~10℃,其中特别优选0~5℃。
[0095]
优选的,所述雷帕霉素、叔丁基二苯基氯硅烷与有机碱的投料摩尔比为1:1.0~
1.5:1.2~1.8,其中特别优选1:1.3:1.5。
[0096]
在一优选方案中,所述析晶方法为,将所得反应液转至室温,然后加入烃类溶液,搅拌析晶;优选的,所述烃类选自正庚烷、正己烷、环己烷中的一种或多种。
[0097]
所述依维莫司中间体化合物ⅱ用于制备依维莫司的用途。
[0098]
一种所述依维莫司中间体化合物ⅱ制备依维莫司的方法,包括如下步骤:i)中间体化合物ⅱ在氟化盐的作用下进行水解反应,反应完毕,得中间体化合物ⅲ;ii)n2保护下,2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯和中间体化合物ⅲ在有机碱存在的条件下进行控温反应,反应完毕,得中间体化合物ⅳ;iii)中间体化合物ⅳ在酸性条件下进行水解反应,反应完毕,得依维莫司,反应路线如下:
[0099][0100]
在一优选方案中,上述通过中间体化合物ⅰ制备所得的含有中间体化合物ⅱ的溶液不经过后处理,直接用于制备依维莫司,具体包括如下步骤:
[0101]
i)将含有中间体化合物ⅱ的溶液转至室温,加入氟化盐,室温搅拌反应,反应完毕,得中间体化合物ⅲ;
[0102]
ii)n2保护下,将有机碱、2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯依次加入到溶解有中间体化合物ⅲ的有机溶剂c中,控温反应,得中间体ⅳ;
[0103]
iii)将中间体化合物ⅳ溶解于有机溶剂d中,控温滴加酸溶液,反应完毕,得依维莫司。
[0104]
优选的,步骤(i)中所述氟化盐选自四丁基氟化铵三水合物、四甲基氟化铵四水合物、四乙基氟化铵二水合物、氟化钠中的一种或多种,其中特别优选四丁基氟化铵三水合物。
[0105]
优选的,所述中间体化合物ⅰ与氟化盐摩尔比为1:1.0~1.5,其中特别优选1:1.3。
[0106]
在一优选方案中,步骤(i)中后处理步骤为,反应完毕后向反应液中加入纯水将有机相洗至中性,无水硫酸钠干燥,过滤,减压浓缩至干,得中间体化合物ⅲ。
[0107]
优选的,步骤(ii)中所述有机碱选自三乙胺、吡啶、2,6二甲基吡啶、n,n-二异丙基乙基胺中的一种或多种,其中特别优选2,6二甲基吡啶。
[0108]
优选的,步骤(ii)中所述溶解中间体化合物ⅲ的有机溶剂c选自乙酸乙酯、甲苯、甲醇、乙醇、丙酮、四氢呋喃中的一种或多种,其中特别优选甲苯。
[0109]
优选的,步骤(ii)中所述控温反应温度为40~60℃,其中特别优选50℃。
[0110]
优选的,步骤(ii)中所述中间体化合物ⅲ、2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯与有机碱的投料摩尔比为1:10~14:6~10,其中特别优选1:12:8。
[0111]
在一优选方案中,步骤(ii)中后处理步骤为,反应完毕后,将反应液自然降至室温,加入乙酸乙酯萃取,所得有机相用饱和碳酸氢钠溶液和饱和食盐水各洗一次,有机层用无水硫酸钠于室温下干燥,过滤除去干燥剂,滤液减压蒸至基本无馏分流出时,浓缩液中加入硅胶继续减压蒸干,柱层析分离得中间体化合物ⅳ。优选的,所述柱层析分离过程以石油醚:乙酸乙酯(v/v)=2:1洗脱,再用石油醚:乙酸乙酯(v/v)=1:1洗脱。
[0112]
优选的,步骤(iii)中所述酸调节ph至2~3。
[0113]
优选的,步骤(iii)中所述控温反应温度为-5~10℃,其中特别优选5℃。
[0114]
优选的,步骤(iii)中所述酸选自盐酸、硫酸以及氢溴酸中的一种,其中特别优选盐酸。
[0115]
优选的,步骤(iii)中所述有机溶剂d选自乙酸乙酯、甲醇、乙醇、丙酮、四氢呋喃中的一种或多种,其中特别优选丙酮。
[0116]
在一优选方案中,步骤(iii)中后处理步骤为,反应完毕后加入乙酸乙酯和纯水萃取,合并有机相,依次用碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩,柱层析分离,得依维莫司;优选的,所述柱层析分离过程以石油醚:乙酸乙酯(v/v)=1:1洗脱,再用乙酸乙酯洗脱。
[0117]
与现有技术相比,本发明提供了三个依维莫司中间体化合物及利用该化合物合成依维莫司的新路线,合成路线采用两个保护基分步保护,操作可控范围广,避免生成31位副产物,不存在目标产物分离困难问题,纯度达99.87%;同时避免过度水解,大大提高原料利用率,节约生产成本,更适于工业化生产。
具体实施方式
[0118]
下面通过实施例来进一步说明本发明,应该正确理解的是:本发明的实施例仅仅是用于说明本发明,而不是对本发明的限制,所以,在本发明的方法前提下对本发明的简单改进均属于本发明要求保护的范围。
[0119]
本发明依维莫司中间体化合物ⅱ结构确认:
[0120]
lc-ms(m/z):1252.71[m+h]
+
;ap-esi(m/z):1274.71[m+na]
+
;
[0121]1h nmr(400mhz,cdcl3)δ:7.36~7.61(m,10h),6.40(dd,j=11.4,13.8hz,1h),6.23(t,j=10.2hz,1h),6.14(m,1h),6.11(m,1h),5.47(dd,j=10.2,14.4hz,1h),5.10(d,j=10.2hz,1h),4.98(m,1h),4.94(d,j=3.6hz,1h),4.50(m,1h),4.02(brs,1h),4.02(m,
1h),3.96(d,j=3.6hz,1h),3.63(d,j=11.4hz,1h),3.44~3.12(m,2h),3.30(s,3h),3.26(m,1h),3.16(m,1h),3.15(s,3h),3.05(s,3h),2.94(m,1h),2.73~2.35(m,2h),2.37(m,1h),2.22(m,1h),2.11(m,1h),2.01(m,1h),1.95(m,2h),1.87(m,2h),1.85(m,2h),1.84(m,2h),1.75(s,3h),1.71(m,3h),1.68(s,3h),1.57(m,2h),1.55(m,2h),1.53(m,2h),1.42~1.45(s,9h)1.40(m,2h),1.09(m,2h),1.06(m,2h),0.98(s,9h)0.91(d,j=6.6hz,3h),0.87(d,j=6.0hz,3h),0.82(d,j=6.0hz,3h),0.78(d,j=6.0hz,3h),0.73(d,j=6.6hz,3h);
[0122]
13
c nmr(100mhz,dmso-d6)δ:210.7,208.0,199.2,169.6,167.2,155.5,139.7,138.3,137.6,134.2,134.1,132.8,130.8,130.7,130.6,130.5,130.4,130.3,130.2,129.8,129.7,129.6,129.5,127.4,125.2,99.4,85.9,84.2,82.6,80.6,76.2,76.3,74.0,66.6,64.1,64.0,57.7,57.3,55.9,51.2,50.3,43.9,40.3,40.0,39.9,39.5,38.5,36.3,35.6,35.2,33.8,32.8,32.5,30.9,30.1,29.7,28.6,28.5,28.4,26.9,26.8,26.7,26.6,26.5,24.9,22.0,20.8,17.3,16.0,13.9,13.7,10.9。
[0123]
本发明依维莫司中间体化合物ⅲ结构确认:
[0124]
lc-ms(m/z):1014.61[m+h]
+
;ap-esi(m/z):1036.61[m+na]
+
;
[0125]1h nmr(400mhz,cdcl3)δ:6.40(dd,j=11.4,13.8hz,1h),6.23(t,j=10.2hz,1h),6.14(m,1h),6.11(m,1h),5.47(dd,j=10.2,14.4hz,1h),5.10(d,j=10.2hz,1h),4.98(m,1h),4.94(d,j=3.6hz,1h),4.71(s,1h)4.50(m,1h),4.02(brs,1h),4.02(m,1h),3.96(d,j=3.6hz,1h),3.63(d,j=11.4hz,1h),3.44~3.12(m,2h),3.30(s,3h),3.26(m,1h),3.16(m,1h),3.15(s,3h),3.05(s,3h),2.94(m,1h),2.73~2.35(m,2h),2.37(m,1h),2.22(m,1h),2.11(m,1h),2.01(m,1h),1.95(m,2h),1.87(m,2h),1.85(m,2h),1.84(m,2h),1.75(s,3h),1.71(m,3h),1.68(s,3h),1.57(m,2h),1.55(m,2h),1.53(m,2h),1.42~1.45(s,9h)1.40(m,2h),1.09(m,2h),1.06(m,2h),0.91(d,j=6.6hz,3h),0.87(d,j=6.0hz,3h),0.82(d,j=6.0hz,3h),0.78(d,j=6.0hz,3h),0.73(d,j=6.6hz,3h);
[0126]
13
c nmr(100mhz,dmso-d6)δ:210.5,208.0,199.1,169.5,167.3,155.5,139.7,138.3,137.6,132.8,130.8,127.4,125.2,99.4,85.9,84.2,82.6,80.6,76.2,76.3,74.0,66.6,64.1,64.0,57.7,57.3,55.9,51.2,50.3,43.9,40.3,40.0,39.9,39.5,38.5,36.3,35.6,35.2,33.8,32.5,30.9,30.1,29.7,28.6,28.5,28.4,26.8,26.6,24.9,22.0,20.8,17.3,16.0,13.9,13.7,10.9。
[0127]
本发明依维莫司中间体化合物ⅳ结构确认:
[0128]
lc-ms(m/z):1172.71[m+h]
+
;ap-esi(m/z):1194.72[m+na]
+
;
[0129]1h nmr(400mhz,cdcl3)δ:6.40(dd,j=11.4,13.8hz,1h),6.23(t,j=10.2hz,1h),6.14(m,1h),6.11(m,1h),5.47(dd,j=10.2,14.4hz,1h),5.10(d,j=10.2hz,1h),4.98(m,1h),4.94(d,j=3.6hz,1h),4.50(m,1h),4.02(brs,1h),4.02(m,1h),3.96(d,j=3.6hz,1h),3.92(m,2h),3.77(m,2h)3.63(d,j=11.4hz,1h),3.44~3.12(m,2h),3.30(s,3h),3.26(m,1h),3.16(m,1h),3.15(s,3h),3.05(s,3h),2.94(m,1h),2.73~2.35(m,2h),2.37(m,1h),2.22(m,1h),2.11(m,1h),2.01(m,1h),1.95(m,2h),1.87(m,2h),1.85(m,2h),1.84(m,2h),1.75(s,3h),1.71(m,3h),1.68(s,3h),1.57(m,2h),1.55(m,2h),1.53(m,2h),1.42~1.45(s,9h)1.40(m,2h),1.09(m,2h),1.06(m,2h),0.98(s,9h),0.91(d,j=6.6hz,3h),0.87(d,j=6.0hz,3h),0.82(d,j=6.0hz,3h),0.78(d,j=6.0hz,3h),0.73(d,j=6.6hz,
3h),0.21((s,6h);
[0130]
13
c nmr(100mhz,dmso-d6)δ:210.8,207.9,199.3,168.9,167.4,155.5,139.7,138.3,137.6,132.8,130.8,127.4,125.2,99.4,85.9,84.2,82.6,80.6,76.2,76.3,74.0,71.7,66.6,64.3,64.1,64.0,57.7,57.3,55.9,51.2,50.3,43.9,40.3,40.0,39.9,39.5,38.5,36.3,35.6,35.2,33.8,32.5,30.9,30.6,30.1,29.7,28.6,28.5,28.4,26.8,26.6,24.9,25.9,25.8,25.7,22.0,20.8,17.3,16.0,13.9,13.7,10.9,2.3,2.2。
[0131]
依维莫司中间体化合物ⅰ的制备
[0132]
实施例1
[0133]
n2保护下,将50g雷帕霉素、8.30g三乙胺、600ml乙酸乙酯依次加至四口瓶中,搅拌溶解,控温0~5℃缓慢滴加19.55g叔丁基二苯基氯硅烷溶液,tlc检测反应进程,无雷帕霉素斑点后,将体系转至室温中,向反应液中加入1000ml正庚烷,搅拌析晶1h,过滤,得白色固体中间体化合物ⅰ60.75g,收率96.37%。
[0134]
实施例2
[0135]
n2保护下,将50g雷帕霉素、7.79g吡啶、500ml甲醇依次加至四口瓶中,搅拌溶解,控温-5~0℃缓慢滴加15.03g叔丁基二苯基氯硅烷溶液,tlc检测反应进程,无雷帕霉素斑点后,将体系转至室温中,向反应液中加入1000ml正己烷,搅拌析晶1h,过滤,得白色固体中间体化合物ⅰ59.90g,收率95.02%。
[0136]
实施例3
[0137]
n2保护下,将50g雷帕霉素、8.48g n,n-二异丙基乙基胺、600ml乙醇依次加至四口瓶中,搅拌溶解,控温5~10℃缓慢滴加22.55g叔丁基二苯基氯硅烷溶液,tlc检测反应进程,无雷帕霉素斑点后,将体系转至室温中,向反应液中加入1000ml环己烷,搅拌析晶1h,过滤,得白色固体中间体化合物ⅰ59.60g,收率94.55%。
[0138]
实施例4
[0139]
n2保护下,将50g雷帕霉素、9.38g 2,6-二甲基吡啶、750ml丙酮依次加至四口瓶中,搅拌溶解,控温0~5℃缓慢滴加18.04g叔丁基二苯基氯硅烷溶液,tlc检测反应进程,无雷帕霉素斑点后,将体系转至室温中,向反应液中加入1000ml环己烷,搅拌析晶1h,过滤,得白色固体中间体化合物ⅰ60.36g,收率95.75%。
[0140]
实施例5
[0141]
n2保护下,将50g雷帕霉素、5.53g三乙胺、600ml四氢呋喃依次加至四口瓶中,搅拌溶解,控温5~10℃缓慢滴加30.07g叔丁基二苯基氯硅烷溶液,tlc检测反应进程,无雷帕霉素斑点后,将体系转至室温中,向反应液中加入1000ml正庚烷,搅拌析晶1h,过滤,得白色固体中间体化合物ⅰ58.02g,收率92.04%。
[0142]
实施例6
[0143]
n2保护下,将50g雷帕霉素、4.47g咪唑、600ml乙酸乙酯依次加至四口瓶中,搅拌溶解,控温10~15℃缓慢滴加22.55g叔丁基二苯基氯硅烷溶液,tlc检测反应进程,无雷帕霉素斑点后,将体系转至室温中,向反应液中加入1000ml正庚烷,搅拌析晶1h,过滤,得白色固体中间体化合物ⅰ58.44g,收率92.71%。
[0144]
实施例7
[0145]
n2保护下,将50g雷帕霉素、5.53g三乙胺、600ml乙酸乙酯依次加至四口瓶中,搅拌
溶解,控温0~5℃缓慢滴加15.03g叔丁基二苯基氯硅烷溶液,tlc检测反应进程,无雷帕霉素斑点后,将体系转至室温中,向反应液中加入1000ml正庚烷,搅拌析晶1h,过滤,得白色固体中间体化合物ⅰ57.64g,收率91.44%。
[0146]
实施例8
[0147]
n2保护下,将50g雷帕霉素、8.30g三乙胺、600ml吡啶依次加至四口瓶中,搅拌溶解,控温-5~0℃缓慢滴加19.55g叔丁基二苯基氯硅烷溶液,tlc检测反应进程,无雷帕霉素斑点后,将体系转至室温中,向反应液中加入1000ml正庚烷,搅拌析晶1h,过滤,得白色固体中间体化合物ⅰ60.19g,收率95.48%。
[0148]
实施例9
[0149]
n2保护下,将50g雷帕霉素、11.31g n,n-二异丙基乙基胺、700ml四氢呋喃依次加至四口瓶中,搅拌溶解,控温0~5℃缓慢滴加18.04g叔丁基二苯基氯硅烷溶液,tlc检测反应进程,无雷帕霉素斑点后,将体系转至室温中,向反应液中加入1000ml环己烷,搅拌析晶1h,过滤,得白色固体中间体化合物ⅰ59.10g,收率93.75%。
[0150]
实施例10
[0151]
n2保护下,将50g雷帕霉素、6.64g三乙胺、600ml乙酸乙酯依次加至四口瓶中,搅拌溶解,控温0~5℃缓慢滴加22.55g叔丁基二苯基氯硅烷溶液,tlc检测反应进程,无雷帕霉素斑点后,将体系转至室温中,向反应液中加入1000ml正庚烷,搅拌析晶1h,过滤,得白色固体中间体化合物ⅰ59.96g,收率95.12%。
[0152]
实施例11
[0153]
n2保护下,将50g雷帕霉素、8.30g三乙胺、600ml乙酸乙酯依次加至四口瓶中,搅拌溶解,控温-5~0℃缓慢滴加19.55g叔丁基二苯基氯硅烷溶液,tlc检测反应进程,无雷帕霉素斑点后,将体系转至室温中,向反应液中加入1000ml正庚烷,搅拌析晶1h,过滤,得白色固体中间体化合物ⅰ60.31g,收率95.67%。
[0154]
实施例12
[0155]
n2保护下,将50g雷帕霉素、6.49g吡啶、600ml四氢呋喃依次加至四口瓶中,搅拌溶解,控温0~5℃缓慢滴加19.55g叔丁基二苯基氯硅烷溶液,tlc检测反应进程,无雷帕霉素斑点后,将体系转至室温中,向反应液中加入1000ml正庚烷,搅拌析晶1h,过滤,得白色固体中间体化合物ⅰ60.59g,收率96.12%。
[0156]
依维莫司中间体化合物ⅱ的制备
[0157]
实施例13
[0158]
n2保护下,依次将59.10g中间体化合物ⅰ、800ml乙酸乙酯加入到四口瓶中,搅拌溶解,控温10℃缓慢滴加13.43g(boc)2o溶液,tlc检测反应进程,无中间体ⅰ斑点后,室温下用饱和碳酸氢钠溶液洗涤,有机相用无水硫酸钠干燥,过滤,减压浓缩至干,即得中间体化合物ii 61.15g,收率95.19%,纯度99.74%。
[0159]
实施例14
[0160]
n2保护下,依次将59.96g中间体化合物ⅰ、900ml二氯甲烷加入到四口瓶中,搅拌溶解,控温5℃缓慢滴加11.35g(boc)2o溶液,tlc检测反应进程,无中间体ⅰ斑点后,室温下用饱和碳酸氢钠溶液洗涤,有机相用无水硫酸钠干燥,过滤,减压浓缩至干,即得中间体化合物ii 63.27g,收率97.08%,纯度99.80%。
[0161]
实施例15
[0162]
n2保护下,依次将60.31g中间体化合物ⅰ、900ml乙酸乙酯加入到四口瓶中,搅拌溶解,控温0℃缓慢滴加17.13g(boc)2o溶液,tlc检测反应进程,无中间体ⅰ斑点后,室温下用饱和碳酸氢钠溶液洗涤,有机相用无水硫酸钠干燥,过滤,减压浓缩至干,即得中间体化合物ii 63.22g,收率96.44%,纯度99.75%。
[0163]
实施例16
[0164]
n2保护下,依次将60.59g中间体化合物ⅰ、900ml二氯甲烷加入到四口瓶中,搅拌溶解,控温5℃缓慢滴加13.77g(boc)2o溶液,tlc检测反应进程,无中间体ⅰ斑点后,室温下用饱和碳酸氢钠溶液洗涤,有机相用无水硫酸钠干燥,过滤,减压浓缩至干,即得中间体化合物ii 64.23g,收率97.53%,纯度99.87%。
[0165]
依维莫司中间体化合物ⅲ的制备
[0166]
实施例17
[0167]
n2保护下,依次将60.75g中间体化合物ⅰ、900ml二氯甲烷加入到四口瓶中,搅拌溶解,控温5℃缓慢滴加13.80g(boc)2o溶液,tlc检测反应进程,无中间体ⅰ斑点后,得含有中间体化合物ⅱ的反应液;将含有中间体化合物ⅱ的反应液转至室温,称量21.62g四丁基氟化铵三水合物至反应体系中,搅拌反应1h后,向反应液中加入纯水将有机相洗至中性,无水硫酸钠干燥有机相,过滤,减压浓缩至干,得淡黄色固体中间体化合物ⅲ50.94g,收率95.28%,纯度99.95%。
[0168]
实施例18
[0169]
n2保护下,依次将59.90g中间体化合物ⅰ、1000ml二氯甲烷入到四口瓶中,搅拌溶解,控温0℃缓慢滴加17.01g(boc)2o溶液,tlc检测反应进程,无中间体ⅰ斑点后,得含有中间体化合物ⅱ的反应液;将含有中间体化合物ⅱ的反应液转至室温,称量9.63g四乙基氟化铵二水合物至反应体系中,搅拌反应1h后,向反应液中加入纯水将有机相洗至中性,无水硫酸钠干燥有机相,过滤,减压浓缩至干,得淡黄色固体中间体化合物ⅲ49.25g,收率93.43%,纯度99.90%。
[0170]
实施例19
[0171]
n2保护下,依次将59.60g中间体化合物ⅰ、800ml乙酸乙酯加入到四口瓶中,搅拌溶解,控温10℃缓慢滴加11.29g(boc)2o溶液,tlc检测反应进程,无中间体ⅰ斑点后,得含有中间体化合物ⅱ的反应液;将含有中间体化合物ⅱ的反应液转至室温,称量12.81g四甲基氟化铵四水合物至反应体系中,搅拌反应1h后,向反应液中加入纯水将有机相洗至中性,无水硫酸钠干燥有机相,过滤,减压浓缩至干,得淡黄色固体中间体化合物ⅲ48.83g,收率93.10%,纯度99.92%。
[0172]
实施例20
[0173]
n2保护下,依次将60.36g中间体化合物ⅰ、900ml二氯甲烷加入到四口瓶中,搅拌溶解,控温5℃缓慢滴加14.86g(boc)2o溶液,tlc检测反应进程,无中间体ⅰ斑点后,得含有中间体化合物ⅱ的反应液;将含有中间体化合物ⅱ的反应液转至室温,称量11.64g四乙基氟化铵二水合物至反应体系中,搅拌反应1h后,向反应液中加入纯水将有机相洗至中性,无水硫酸钠干燥有机相,过滤,减压浓缩至干,得淡黄色固体中间体化合物ⅲ50.20g,收率94.50%,纯度99.93%。
[0174]
实施例21
[0175]
n2保护下,依次将58.02g中间体化合物ⅰ、900ml乙酸乙酯加入到四口瓶中,搅拌溶解,控温0℃缓慢滴加21.97g(boc)2o溶液,tlc检测反应进程,无中间体ⅰ斑点后,得含有中间体化合物ⅱ的反应液;将含有中间体化合物ⅱ的反应液转至室温,称量2.75g氟化钠至反应体系中,搅拌反应1h后,向反应液中加入纯水将有机相洗至中性,无水硫酸钠干燥有机相,过滤,减压浓缩至干,得淡黄色固体中间体化合物ⅲ47.15g,收率92.34%,纯度99.87%。
[0176]
实施例22
[0177]
n2保护下,依次将58.44g中间体化合物ⅰ、700ml乙酸乙酯加入到四口瓶中,搅拌溶解,控温10℃缓慢滴加13.28g(boc)2o溶液,tlc检测反应进程,无中间体ⅰ斑点后,得含有中间体化合物ⅱ的反应液;将含有中间体化合物ⅱ的反应液转至室温,称量20.80g四丁基氟化铵三水合物至反应体系中,搅拌反应1h后,向反应液中加入纯水将有机相洗至中性,无水硫酸钠干燥有机相,过滤,减压浓缩至干,得淡黄色固体中间体化合物ⅲ48.49g,收率94.28%,纯度99.90%。
[0178]
实施例23
[0179]
n2保护下,依次将57.64g中间体化合物ⅰ、900ml甲苯加入到四口瓶中,搅拌溶解,控温5℃缓慢滴加13.10g(boc)2o溶液,tlc检测反应进程,无中间体ⅰ斑点后,得含有中间体化合物ⅱ的反应液;将含有中间体化合物ⅱ的反应液转至室温,称量31.21g四丁基氟化铵三水合物至反应体系中,搅拌反应1h后,向反应液中加入纯水将有机相洗至中性,无水硫酸钠干燥有机相,过滤,减压浓缩至干,得淡黄色固体中间体化合物ⅲ46.42g,收率91.51%,纯度99.82%。
[0180]
实施例24
[0181]
n2保护下,依次将60.19g中间体化合物ⅰ、700ml二氯甲烷加入到四口瓶中,搅拌溶解,控温15℃缓慢滴加13.68g(boc)2o溶液,tlc检测反应进程,无中间体ⅰ斑点后,得含有中间体化合物ⅱ的反应液;将含有中间体化合物ⅱ的反应液转至室温,称量21.42g四丁基氟化铵三水合物至反应体系中,搅拌反应1h后,向反应液中加入纯水将有机相洗至中性,无水硫酸钠干燥有机相,过滤,减压浓缩至干,得淡黄色固体中间体化合物ⅲ48.80g,收率92.13%,纯度99.79%。
[0182]
依维莫司中间体化合物ⅳ的制备
[0183]
实施例25
[0184]
n2保护下,将50.94g中间体化合物ⅲ、43.05g 2,6-二甲基吡啶、700ml甲苯依次加入至四口瓶中,加热至50℃,将185.85g 2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯溶液加入到反应液中,tlc监控基本无中间体化合物ⅲ斑点后,停止加热,将反应液自然降至室温后,加入乙酸乙酯(200ml
×
3)萃取,有机相用饱和碳酸氢钠溶液和饱和食盐水各洗一次,有机层用无水硫酸钠于室温下干燥,过滤除去干燥剂,滤液减压蒸至基本无馏分流出时,加入100g硅胶继续减压蒸干,先用石油醚:乙酸乙酯(v/v)=2:1洗脱至中间体化合物ⅳ斑点开始出现,再用石油醚:乙酸乙酯(v/v)=1:1洗脱,洗脱完毕后将洗脱液浓缩至干得浅黄色泡状固体中间体化合物ⅳ56.05g,收率95.18%,纯度99.95%。
[0185]
实施例26
[0186]
n2保护下,将49.25g中间体化合物ⅲ、49.13g三乙胺、700ml乙酸乙酯依次加入至四口瓶中,加热至40℃,将149.74g 2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯溶液加入到反应液中,tlc监控基本无中间体化合物ⅲ斑点后,停止加热,将反应液自然降至室温后,加入乙酸乙酯(200ml
×
3)萃取,所得有机相用饱和碳酸氢钠溶液和饱和食盐水各洗一次,有机层用无水硫酸钠于室温下干燥,过滤除去干燥剂,滤液减压蒸至基本无馏分流出时,加入100g硅胶继续减压蒸干,先用石油醚:乙酸乙酯(v/v)=2:1洗脱至中间体化合物ⅳ斑点开始出现,再用石油醚:乙酸乙酯(v/v)=1:1洗脱,洗脱完毕后将洗脱液浓缩至干得浅黄色泡状固体中间体化合物ⅳ53.16g,收率93.37%,纯度99.90%。
[0187]
实施例27
[0188]
n2保护下,将48.83g中间体化合物ⅲ、22.85g吡啶、600ml丙酮依次加入至四口瓶中,加热至60℃,将207.85g 2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯溶液加入到反应液中,tlc监控基本无中间体化合物ⅲ斑点后,停止加热,将反应液自然降至室温后,加入乙酸乙酯(200ml
×
3)萃取,所得有机相用饱和碳酸氢钠溶液和饱和食盐水各洗一次,有机层用无水硫酸钠于室温下干燥,过滤除去干燥剂,滤液减压蒸至基本无馏分流出时,加入100g硅胶继续减压蒸干,先用石油醚:乙酸乙酯(v/v)=2:1洗脱至中间体化合物ⅳ斑点开始出现,再用石油醚:乙酸乙酯(v/v)=1:1洗脱,洗脱完毕后将洗脱液浓缩至干得浅黄色泡状固体中间体化合物ⅳ52.81g,收率93.55%,纯度99.91%。
[0189]
实施例28
[0190]
n2保护下,将50.20g中间体化合物ⅲ、63.97g n,n-二异丙基乙基胺、800ml甲醇依次加入至四口瓶中,加热至50℃,将183.16g 2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯溶液加入到反应液中,tlc监控基本无中间体化合物ⅲ斑点后,停止加热,将反应液自然降至室温后,加入乙酸乙酯(200ml
×
3)萃取,所得有机相用饱和碳酸氢钠溶液和饱和食盐水各洗一次,有机层用无水硫酸钠于室温下干燥,过滤除去干燥剂,滤液减压蒸至基本无馏分流出时,加入100g硅胶继续减压蒸干,先用石油醚:乙酸乙酯(v/v)=2:1洗脱至中间体化合物ⅳ斑点开始出现,再用石油醚:乙酸乙酯(v/v)=1:1洗脱,洗脱完毕后将洗脱液浓缩至干得浅黄色泡状固体中间体化合物ⅳ54.59g,收率94.06%,纯度99.93%。
[0191]
实施例29
[0192]
n2保护下,将48.49g中间体化合物ⅲ、30.73g 2,6-二甲基吡啶、600ml四氢呋喃依次加入至四口瓶中,加热至65℃,将147.43g 2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯溶液加入到反应液中,tlc监控基本无中间体化合物ⅲ斑点后,停止加热,将反应液自然降至室温后,加入乙酸乙酯(200ml
×
3)萃取,所得有机相用饱和碳酸氢钠溶液和饱和食盐水各洗一次,有机层用无水硫酸钠于室温下干燥,过滤除去干燥剂,滤液减压蒸至基本无馏分流出时,加入100g硅胶继续减压蒸干,先用石油醚:乙酸乙酯(v/v)=2:1洗脱至中间体化合物ⅳ斑点开始出现,再用石油醚:乙酸乙酯(v/v)=1:1洗脱,洗脱完毕后将洗脱液浓缩至干得浅黄色泡状固体中间体化合物ⅳ51.71g,收率92.24%,纯度99.90%。
[0193]
实施例30
[0194]
n2保护下,将46.42g中间体化合物ⅲ、39.23g 2,6-二甲基吡啶、700ml甲苯依次加入至四口瓶中,加热至50℃,将169.36g 2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯溶液加入到反应液中,tlc监控基本无中间体化合物ⅲ斑点后,停止加热,将反应液自然降
至室温后,加入乙酸乙酯(200ml
×
3)萃取,所得有机相用饱和碳酸氢钠溶液和饱和食盐水各洗一次,有机层用无水硫酸钠于室温下干燥,过滤除去干燥剂,滤液减压蒸至基本无馏分流出时,加入100g硅胶继续减压蒸干,先用石油醚:乙酸乙酯(v/v)=2:1洗脱至中间体化合物ⅳ斑点开始出现,再用石油醚:乙酸乙酯(v/v)=1:1洗脱,洗脱完毕后将洗脱液浓缩至干得浅黄色泡状固体中间体化合物ⅳ51.03g,收率95.09%,纯度99.76%。
[0195]
实施例31
[0196]
n2保护下,将48.80中间体化合物ⅲ、45.67g吡啶、700ml甲苯依次加入至四口瓶中,加热至50℃,将237.40g 2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯溶液加入到反应液中,tlc监控基本无中间体化合物ⅲ斑点后,停止加热,将反应液自然降至室温后,加入乙酸乙酯(200ml
×
3)萃取,所得有机相用饱和碳酸氢钠溶液和饱和食盐水各洗一次,有机层用无水硫酸钠于室温下干燥,过滤除去干燥剂,滤液减压蒸至基本无馏分流出时,加入100g硅胶继续减压蒸干,先用石油醚:乙酸乙酯(v/v)=2:1洗脱至中间体化合物ⅳ斑点开始出现,再用石油醚:乙酸乙酯(v/v)=1:1洗脱,洗脱完毕后将洗脱液浓缩至干得浅黄色泡状固体中间体化合物ⅳ51.52g,收率91.32%,纯度99.82%。
[0197]
实施例32
[0198]
n2保护下,将48.75g中间体化合物ⅲ、72.95g三乙胺、700ml丙酮依次加入至四口瓶中,加热至50℃,将177.86g 2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯溶液加入到反应液中,tlc监控基本无中间体ⅲ斑点后,停止加热,将反应液自然降至室温后,加入乙酸乙酯(200ml
×
3)萃取,所得有机相用饱和碳酸氢钠溶液和饱和食盐水各洗一次,有机层用无水硫酸钠于室温下干燥,过滤除去干燥剂,滤液减压蒸至基本无馏分流出时,加入100g硅胶继续减压蒸干,先用石油醚:乙酸乙酯(v/v)=2:1洗脱至中间体化合物ⅳ斑点开始出现,再用石油醚:乙酸乙酯(v/v)=1:1洗脱,洗脱完毕后将洗脱液浓缩至干得浅黄色泡状固体中间体化合物ⅳ52.23g,收率92.67%,纯度99.80%。
[0199]
实施例33
[0200]
n2保护下,将49.99g中间体化合物ⅲ、63.70g n,n-二异丙基乙基胺、700ml甲苯依次加入至四口瓶中,加热至50℃,将212.79g 2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯溶液加入到反应液中,tlc监控基本无中间体ⅲ斑点后,停止加热,将反应液自然降至室温后,加入乙酸乙酯(200ml
×
3)萃取,所得有机相用饱和碳酸氢钠溶液和饱和食盐水各洗一次,有机层用无水硫酸钠于室温下干燥,过滤除去干燥剂,滤液减压蒸至基本无馏分流出时,加入100g硅胶继续减压蒸干,先用石油醚:乙酸乙酯(v/v)=2:1洗脱至中间体化合物ⅳ斑点开始出现,再用石油醚:乙酸乙酯(v/v)=1:1洗脱,洗脱完毕后将洗脱液浓缩至干得浅黄色泡状固体中间体化合物ⅳ54.43g,收率94.18%,纯度99.93%。
[0201]
实施例34
[0202]
n2保护下,将50.53g中间体化合物ⅲ、53.38g 2,6-二甲基吡啶、700ml乙酸乙酯依次加入至四口瓶中,加热至50℃,将184.36g 2-(叔丁基二甲基硅烷基)氧基乙醇三氟甲磺酸酯溶液加入到反应液中,tlc监控基本无中间体ⅲ斑点后,停止加热,将反应液自然降至室温后,加入乙酸乙酯(200ml
×
3)萃取,所得有机相用饱和碳酸氢钠溶液和饱和食盐水各洗一次,有机层用无水硫酸钠于室温下干燥,过滤除去干燥剂,滤液减压蒸至基本无馏分流出时,加入100g硅胶继续减压蒸干,先用石油醚:乙酸乙酯(v/v)=2:1洗脱至中间体化合物
ⅳ
斑点开始出现,再用石油醚:乙酸乙酯(v/v)=1:1洗脱,洗脱完毕后将洗脱液浓缩至干得浅黄色泡状固体中间体化合物ⅳ55.20g,收率94.49%,纯度99.95%。
[0203]
依维莫司的制备
[0204]
实施例35
[0205]
依次向三口烧瓶中加入120ml丙酮、11.73g中间体化合物ⅳ,溶解完成后,控温至5℃,滴加1.0m盐酸溶液,调节反应液ph=2~3,搅拌反应,tlc检测,反应完毕,35℃减压浓缩,蒸至基本无液体流出,向浓缩液中加入乙酸乙酯和纯水萃取,合并有机相,依次用碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩,先用石油醚:乙酸乙酯(v/v)=1:1洗脱,出现粗品点时,再用乙酸乙酯洗脱,将洗脱液减压蒸干得浅黄色粉末状依维莫司9.22g,收率96.28%,纯度99.87%,31位副产物0%。
[0206]
实施例36
[0207]
依次向三口烧瓶中加入100ml乙酸乙酯、11.73g中间体化合物ⅳ,溶解完成后,控温至-5℃,滴加1.0m硫酸溶液,调节反应液ph=2~3,搅拌反应,tlc检测,反应完毕,35℃减压浓缩,蒸至基本无液体流出,向浓缩液中加入乙酸乙酯和纯水萃取,合并有机相,依次用碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩,先用石油醚:乙酸乙酯(v/v)=1:1洗脱,出现粗品点时,再用乙酸乙酯洗脱,将洗脱液减压蒸干得浅黄色粉末状依维莫司9.02g,收率94.20%,纯度99.80%,31位副产物0%。
[0208]
实施例37
[0209]
依次向三口烧瓶中加入180ml甲醇、11.73g中间体化合物ⅳ,溶解完成后,控温至10℃,滴加1.0m硫酸溶液,调节反应液ph=2~3,搅拌反应,tlc检测,反应完毕,35℃减压浓缩,蒸至基本无液体流出,向浓缩液中加入乙酸乙酯和纯水萃取,合并有机相,依次用碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩,先用石油醚:乙酸乙酯(v/v)=1:1洗脱,出现粗品点时,再用乙酸乙酯洗脱,将洗脱液减压蒸干得浅黄色粉末状依维莫司9.00g,收率93.99%,纯度99.79%,31位副产物0%。
[0210]
实施例38
[0211]
依次向三口烧瓶中加入150ml乙醇、11.73g中间体化合物ⅳ,溶解完成后,控温至0℃,滴加1.0m硫酸溶液,调节反应液ph=2~3,搅拌反应,tlc检测,反应完毕,35℃减压浓缩,蒸至基本无液体流出,向浓缩液中加入乙酸乙酯和纯水萃取,合并有机相,依次用碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩,先用石油醚:乙酸乙酯(v/v)=1:1洗脱,出现粗品点时,再用乙酸乙酯洗脱,将洗脱液减压蒸干得浅黄色粉末状依维莫司9.09g,收率94.93%,纯度99.78%,31位副产物0%。
[0212]
实施例39
[0213]
依次向三口烧瓶中加入120ml四氢呋喃、11.73g中间体化合物ⅳ,溶解完成后,控温至5℃,滴加1.0m氢溴酸溶液,调节反应液ph=2~3,搅拌反应,tlc检测,反应完毕,35℃减压浓缩,蒸至基本无液体流出,向浓缩液中加入乙酸乙酯和纯水萃取,合并有机相,依次用碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩,先用石油醚:乙酸乙酯(v/v)=1:1洗脱,出现粗品点时,再用乙酸乙酯洗脱,将洗脱液减压蒸干得浅黄色粉末状依维莫司9.15g,收率95.55%,纯度99.82%,31位副产物0%。
[0214]
实施例40
[0215]
依次向三口烧瓶中加入120ml乙醇、11.73g中间体化合物ⅳ,溶解完成后,控温至15℃,滴加1.0m硫酸溶液,调节反应液ph=4~5,搅拌反应,tlc检测,反应完毕,35℃减压浓缩,蒸至基本无液体流出,向浓缩液中加入乙酸乙酯和纯水萃取,合并有机相,依次用碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩,先用石油醚:乙酸乙酯(v/v)=1:1洗脱,出现粗品点时,再用乙酸乙酯洗脱,将洗脱液减压蒸干得浅黄色粉末状依维莫司8.66g,收率90.43%,纯度99.72%,31位副产物0%。
[0216]
对比实施例1
[0217]
将雷帕霉素17.5g、氢氧化钠0.8g溶于乙腈(150ml)中,加热至80℃,搅拌加入三氟甲磺酸2-(叔丁基二甲基硅氧基)乙酯28.27g,反应3h,减压浓缩,粗产物中加入100ml纯化水、150ml乙酸乙酯萃取,静置分液,收集有机相然后分别用饱和碳酸氢钠、饱和食盐水洗涤,有机相经无水硫酸钠干燥后,过滤,35℃减压浓缩,得到中间体化合物20.10g,收率97.90%,纯度52.44%。
[0218]
将20.10g中间体化合物加入到乙腈(350ml)中,保持温度-10~5℃,加入三乙胺三氟化氢(40ml)反应7~8h,薄层色谱检测基本反应完全,加入碳酸氢钠溶液调节ph至7~8,用二氯甲烷(100ml
×
3)萃取,合并有机层,用氯化钠溶液(300ml
×
2)洗涤,无水硫酸钠干燥有机层,过滤浓缩,浓缩固体经乙酸乙酯/石油醚过柱纯化,得灰白色粉末17.71g,收率98.67%,纯度51.70%,31位副产物47.9%。
[0219]
对比实施例2
[0220]
将雷帕霉素17.5g、氢氧化钠0.8g溶于乙腈(150ml)中,加热至80℃,搅拌加入三氟甲磺酸2-(叔丁基二甲基硅氧基)乙酯28.27g,反应3h,将反应液自然降温至室温后,加入200ml乙酸乙酯,搅拌,抽滤,所得有机相用饱和碳酸氢钠溶液和饱和食盐水各洗一次,有机层用无水硫酸钠于室温下干燥,过滤除去干燥剂,滤液减压蒸至基本无馏分流出时,加入100g硅胶继续减压蒸干,先用石油醚:乙酸乙酯(v/v)=2:1洗脱至中间体ⅳ斑点开始出现,再用石油醚:乙酸乙酯(v/v)=1:1洗脱,洗脱完毕后将洗脱液浓缩至干得中间体8.70g,收率42.39%,纯度98.74%。
[0221]
将8.70g中间体化合物加入到乙腈(150ml)中,保持温度-10~5℃,加入三乙胺三氟化氢(18ml)反应7~8h,薄层色谱检测基本反应完全,加入碳酸氢钠溶液调节ph至7~8,用二氯甲烷(100ml
×
3)萃取,合并有机层,用氯化钠溶液(300ml
×
2)洗涤,无水硫酸钠干燥有机层,过滤浓缩,向浓缩液中加入乙酸乙酯和纯水萃取,合并有机相,依次用碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩,柱层析分离,先用石油醚:乙酸乙酯(v/v)=1:1洗脱,出现粗品点时,再用乙酸乙酯洗脱,将洗脱液减压蒸干得依维莫司7.16g,收率92.13%,纯度99.57%,31位副产物0.34%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1