用于检测乳腺癌的miRNA标记物组合、试剂盒和方法与流程
本申请涉及一种生物标记物技术,其用于以从检查对象者采取的血清或血浆为对象来检查乳腺癌。
背景技术:
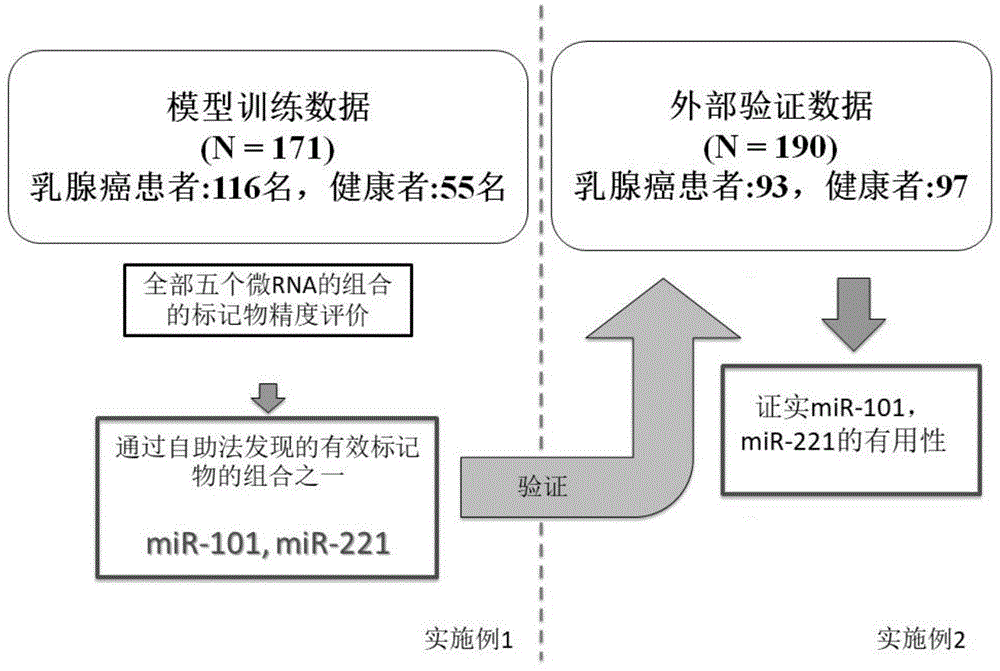
:乳腺癌是威胁女性健康的主要疾病之一。根据世界卫生组织(who:worldhealthorganization)2008年的统计,在全世界中乳腺癌排在成年女性的死因的第五位。乳腺癌根据其基因类型大致分为luminala型、luminalb型、her2rich以及triplenegative型这四种,已知对抗癌剂的敏感性不同等作为癌细胞的性质和恶性度的差异。在luminala和b型中,雌激素受体(estrogenreceptor;er)和孕激素受体(progesteronereceptor;pgr)为阳性,在luminalb型和her2rich型中,her2受体为阳性。此外,在从癌的浸润的发展程度观察的情况下,阶段分类为阶段0、阶段ⅰ、阶段ⅱ、阶段ⅲ、阶段ⅳ这5期,在从转移的发展程度观察的情况下,tnm分类为原发肿瘤(tumor;t)、淋巴结转移(lymphnodes;n)、远隔转移(metastasis;m)。乳腺癌生长为1cm需要15年,但1cm的癌生长为2cm不需要2年。在早期癌(阶段ⅰ)之前实施了治疗的情况下的5年生存率维持约98%,但在乳腺癌的发现晚至确认达到阶段ⅲ的淋巴结转移的情况下,5年生存率降低至约68%,因此认识到早期发现是重要的。被称为早期癌(阶段ⅰ)的阶段通常是指2cm以下的肿瘤体积,因此为了早期发现乳腺癌建议两年诊查一次。癌症诊查的目的在于,通过癌症的发现来展开救命治疗,降低癌症的死亡率。为了早期发现,存在灵敏度和特异性高的检查法和受诊者前往诊查是重要的。当前的乳腺癌诊查包括进行问诊、望诊触诊、x射线摄影乳房摄影检查、超声波诊查这四种。即使在日本,从2000年引入的乳房摄影检查也有时存在对于乳腺密集的年轻女性而言被拍摄得整体发白而难以检查的情况,自治体进行的居民诊查以40岁以上为对象。虽然对微细的乳腺癌的发现发挥威力,但会因将乳房夹入摄影装置中而引起疼痛,因此也成为患者不愿自主前往诊查的主要原因。在乳房摄影检查中,进入到精密检查的比例为5%左右,最终被诊断为乳腺癌的为约0.3%,因此假阳性高也上升为一个课题。超声波检查以不作为对策型乳腺癌诊查对象的20岁、30岁的一代为对象来实施,但为了辨别癌症而需要高度熟练的检查技师、医师,因此医疗机构的检查精度参差不齐也成为课题。在发展中国家,由于平均寿命的延长、生活习惯的现代化等,癌症患者数正在持续增加,在全世界2012年的癌症导致的死亡例中,发展中地区占比约65%。在这些国家,特别是乳腺癌导致的死亡急剧增加。也存在难以配备发达国家那样的检查医疗设施的经济情况,期待引入不需要高额的设备投资的检查方法来改善该现状。作为其代表性的方法可以想到的是通过分析存在于唾液、尿、血清等生物体样品中的疾病特异成分来确定癌症的生物标记物技术。作为癌症筛查用生物标记物最著名的是用于前列腺癌的检查的前列腺特异性抗原(psa:prostatespecificantigen),在引入psa检查前,发展为转移癌而被发现的患者为约60%,相对于此,在引入该检查后,其降低至约10%,通过早期发现有助于延长剩余寿命期限。前列腺癌难以出现初期症状,因此定期的癌症诊查是重要的,即使在这样的情况下,癌症检查简便、精度高且便宜,对于检查受诊者而言身体的负担低也是重要的。毕竟,即使确立了良好的癌症检查方法,如果不接受检查,则也无法实现癌症导致的死亡率的降低。因此,对于检查法而言,受诊者能够轻松地前往检查也是极其重要的。作为最常用的血清中的乳腺癌标记物,存在ca15-3(carbohydrateantigen15-3:糖类抗原15-3),但除了乳腺癌之外,其有时在肺癌、前列腺癌、肝炎等中也会上升,不能说是对于乳腺癌的特异性高。此外,ca15-3的正常范围被设为25u/ml,但在该截止值中,初期阶段的乳腺癌的阳性率停留在10%左右,ca15-3对于早期诊断不太起作用。作为其他血清标记物,还利用了cea(carcinoembryonicantigen:癌胚抗原),但其灵敏度比ca15-3更低。这些血清标记物主要用于转移性乳腺癌的治疗监控。如此,在癌症诊查的技术开发中,必须考虑因检查的精度不够或灵敏度不够而导致的假阳性或假阴性、因过度诊断而导致的不利、以及身体侵袭性。例如过度诊断之一有癌前病变,但实际发展为癌症只不过为百分之几。如果为甚至检测到癌前病变的癌症诊查标记物,则产生进行之后的详细检查的检查机构的处理能力的问题,成为担心检查受诊者的精神负担的事态。因此,需要配合在科学上确立了有效性的早期诊查技术和检查的精度管理。近年来,报道了许多暗示血清中的mirna对癌症诊断的有用性的研究。mirna是18~25碱基的rna,于1993年在线虫中首次被发现。mirna具有如下作用:通过部分地或完全地与具有互补性的mrna的3’端非翻译区结合,来抑制该mrna的分解或蛋白质翻译。已知:mirna靶向的mrna一般存在多个,一个mirna对多样的基因表达带来影响。在2014年的时候,作为对mirna进行编码的染色体上的区域,报道了1881处(mirbasehttp://www.mirbase.org/blog/2014/06/mirbase-21-finally-arrives/)。在2019年,登记了2656种人的rna。微rna不仅包含于细胞、组织中,还包含于唾液、血液等中,因此能够容易地进行检查样本的采取,因此作为新的液体活检在全世界中备受关注。关于微rna和癌症,作为最初期的事例已知有与慢性淋巴性白血病的关连性的报道,之后,截止目前为止,存在许多支持作为癌症诊断标记物的有用性的研究报道[非专利文献1]。其中,乳腺癌和微rna的研究是最盛行的对象之一。在可以获知的范围内,2005年报道了最初的乳腺癌与微rna的关连性。以下记载事例。在现有研究中,有如下报道:对接受了抗癌剂治疗的乳腺癌患者的血浆mir-221进行了解析,其结果是,mir-221与总缓解率(overallresponserate)高度相关(p=0.044),另一方面,与病理学完全缓解(pathologicalcompleteresponse)的相关是部分的(p=0.477)[非专利文献2]。此外,根据另一报道,在乳腺癌组织中,mir-221是伴随着乳腺癌的恶性化、远隔转移而表达上升的生物标记物[非专利文献3]。接着,作为mir-155辅助关于是否具有乳腺癌或者具有产生乳腺癌的风险的检测的方法,已经申请了专利[专利文献1]。此外,报道了:对于mir-155,通过定量rt-pcr来评价了癌症患者血清(n=103),其结果是,与健康人的血清(n=55)相比,确认到表达显著上升,平均表达量的差异为2.94倍[非专利文献4]。该报道中的mir-155的乳腺癌感测的特异性和灵敏度分别为65.0%、81.8%,曲线下面积(auc)为0.801,在阶段ⅰ至ⅳ的任一种中,观察到显著的表达上升。报道了:在48名乳腺癌患者与57名健康者的对比中,13种在癌症患者中表达上升,46种在癌症患者中表达降低(显著水准5%)。此外,从同一乳腺癌患者采取乳腺癌组织和正常的乳房组织,评价了组织中的mir-101的表达,其结果是,在乳腺癌组织中,确认到表达显著降低[非专利文献5]。已知mir-101除了乳腺癌之外在原发性肝细胞癌、前列腺癌、胃癌等多种癌性肿瘤中表达降低。另一方面,在以168名浸润性乳腺癌患者、19名良性乳房疾病、以及28名健康者为对象的临床研究中,判明了:作为血清中的微rna,mir-101在乳腺癌中显示出显著高于良性乳房疾病的表达[非专利文献6]。关于mir-101,进行解析的样本存在组织和血清的差异,但已知表达上升的事例和降低的事例。此外,作为已申请专利的事例,选自由mir-92a1、mir-92a2、mir-22、mir-370、mir-601、mir-658以及mir-494构成的组中的至少一种微rna已知为乳腺癌关连标记物[专利文献2]。如此,存在许多通过微rna来检测乳腺癌的评价技术的报道。但仍然需要鉴定特定的微rna标记物或微rna标记物组合来更高效地检测乳腺癌。[现有技术文献][专利文献]pct/jp2009/056293:乳腺癌判定用标记物、检查方法以及检查用试剂盒[非专利文献][非专利文献1]procnatlacadsciusa.2002nov26;99(24):15524-9.epub2002nov14.frequentdeletionsanddown-regulationofmicro-rnagenesmir15andmir16at13q14inchroniclymphocyticleukemia.calinga1,dumitrucd,shimizum,bichir,zupos,noche,aldlerh,rattans,keatingm,raik,rassentil,kippst,negrinim,bullrichf,crocecm.[非专利文献2]onkologie.2011;34(12):675-80.doi:10.1159/000334552plasmamir-221asapredictivebiomarkerforchemoresistanceinbreastcancerpatientswhopreviouslyreceivedneoadjuvantchemotherapy.zhaor1,wuj,jiaw,gongc,yuf,renz,chenk,hej,suf.[非专利文献3]brjcancer.2013nov12;109(10):2714-23.doi:10.1038mir-221/-222differentiateprognosticgroupsinadvancedbreastcancersandinfluencecellinvasion.falkenbergn1,anastasovn,rapplk,braselmannh,auerg,walcha,huberm,i,schmittm,h,atkinsonmj,aubelem.[非专利文献4]plosone.2012;7(10):e47003.doi:10.1371/journal.pone.0047003.epub2012oct10.serummicrorna-155asapotentialbiomarkertotrackdiseaseinbreastcancer.suny1,wangm,ling,suns,lix,qij,lij.[非专利文献5]oncotarget.2014oct30;5(20):9650-63.increasedserumlevelsofcirculatingexosomalmicrorna-373inreceptor-negativebreastcancerpatients.eichelserc1,stückrathi1,müllerv2,milde-langoschk2,wikmanh1,pantelk1,schwarzenbachh1.[非专利文献6]plosone.2012;7(10):e46173.doi:10.1371/journal.pone.0046173.epub2012oct11.mir-101isinvolvedinhumanbreastcarcinogenesisbytargetingstathmin1.wangr1,wanghb,haocj,cuiy,hanxc,huy,liff,xiahf,max.技术实现要素:一方面,本申请提供了一种用于检测乳腺癌的mirna标记物组合,包括选自mir-101、mir-221和mir-155的至少两种标记物。在一个实施方案中,mirna标记物组合包括mir-101和mir-221。在一个实施方案中,mirna标记物组合包括mir-101和mir-155。在一个实施方案中,mirna标记物组合包括mir-221和mir-155。在一个实施方案中,mirna标记物组合包括mir-101、mir-221和mir-155。在一个实施方案中,mirna标记物组合由mir-101和mir-221组成。在一个实施方案中,mirna标记物组合由mir-101和mir-155组成。在一个实施方案中,mirna标记物组合由mir-221和mir-155组成。在一个实施方案中,mirna标记物组合由mir-101、mir-221和mir-155组成。根据本发明,mir-101具有如seqidno.1(caguuaucacagugcugaugcu)所示核苷酸序列。根据本发明,mir-221具有如seqidno.2(accuggcauacaauguagauuu)所示核苷酸序列。根据本发明,mir-155具有如seqidno.3(uuaaugcuaaucgugauagggguu)所示核苷酸序列。在一个实施方案中,乳腺癌为luminala型、luminalb型、her2rich或triplenegative型。在一个实施方案中,乳腺癌处于临床病期0期、i期、ii期、iii期或iv期。另一方面,本申请提供了所述mirna标记物组合在制备用于检测乳腺癌的试剂盒中的应用。在一个实施方案中,本申请提供了由mir-101和mir-221组成的mirna标记物组合在制备用于检测乳腺癌的试剂盒中的应用。在一个实施方案中,本申请提供了由mir-101和mir-155组成的mirna标记物组合在制备用于检测乳腺癌的试剂盒中的应用。在一个实施方案中,本申请提供了由mir-221和mir-155组成的mirna标记物组合在制备用于检测乳腺癌的试剂盒中的应用。在另一个实施方案中,本申请提供了由mir-101、mir-221和mir-155组成的mirna标记物组合在制备用于检测乳腺癌的试剂盒中的应用。另一方面,本申请提供了一种检测乳腺癌的方法,包括:检测来自受试者的样品中所述mirna标记物组合中每种标记物的水平,其中若每种标记物的水平与对照值相比均增加,则表示所述受试者患有乳腺癌。在一个优选的实施方案中,本申请提供的检测乳腺癌的方法包括:检测来自受试者的样品中所述mirna标记物组合中每种标记物的水平,其中若每种标记物的水平与对照值相比均在统计学上显著增加,则表示所述受试者患有乳腺癌。在一个实施方案中,对照值是不患有乳腺癌的人或患有乳房良性纤维腺瘤的人的样品中每种标记物的水平。在一个实施方案中,本申请提供的检测乳腺癌的方法包括:检测来自受试者的样品中mir-101和mir-221的水平,其中若mir-101和mir-221的水平与对照值相比均增加,则表示所述受试者患有乳腺癌。在该实施方案中,对照值是不患有乳腺癌的人的样品中mir-101和mir-221的水平。在该实施方案中,若受试者的mir-101水平与对照mir-101水平相比增加,并且受试者的mir-221水平与对照mir-221水平相比增加,则表示受试者患有乳腺癌。在另一个实施方案中,本申请提供的检测乳腺癌的方法包括:检测来自受试者的样品中mir-101和mir-221的水平,其中若mir-101和mir-221的水平与对照值相比均增加,则表示所述受试者患有乳腺癌。在该实施方案中,对照值是患有乳房良性纤维腺瘤的人的样品中mir-101和mir-221的水平。在该实施方案中,若受试者的mir-101水平与对照mir-101水平相比增加,并且受试者的mir-221水平与对照mir-221水平相比增加,则表示受试者患有乳腺癌。在另一个实施方案中,本申请提供的检测乳腺癌的方法包括:检测来自受试者的样品中mir-101和mir-155的水平,其中若mir-101和mir-155的水平与对照值相比均增加,则表示所述受试者患有乳腺癌。在该实施方案中,对照值是不患有乳腺癌的人的样品中mir-101和mir-155的水平。在该实施方案中,若受试者的mir-101水平与对照mir-101水平相比增加,并且受试者的mir-155水平与对照mir-155水平相比增加,则表示受试者患有乳腺癌。在另一个实施方案中,本申请提供的检测乳腺癌的方法包括:检测来自受试者的样品中mir-101和mir-155的水平,其中若mir-101和mir-155的水平与对照值相比均增加,则表示所述受试者患有乳腺癌。在该实施方案中,对照值是患有乳房良性纤维腺瘤的人的样品中mir-101和mir-155的水平。在该实施方案中,若受试者的mir-101水平与对照mir-101水平相比增加,并且受试者的mir-155水平与对照mir-155水平相比增加,则表示受试者患有乳腺癌。在另一个实施方案中,本申请提供的检测乳腺癌的方法包括:检测来自受试者的样品中mir-221和mir-155的水平,其中若mir-221和mir-155的水平与对照值相比均增加,则表示所述受试者患有乳腺癌。在该实施方案中,对照值是不患有乳腺癌的人的样品中mir-221和mir-155的水平。在该实施方案中,若受试者的mir-221水平与对照mir-221水平相比增加,并且受试者的mir-155水平与对照mir-155水平相比增加,则表示受试者患有乳腺癌。在另一个实施方案中,本申请提供的检测乳腺癌的方法包括:检测来自受试者的样品中mir-221和mir-155的水平,其中若mir-221和mir-155的水平与对照值相比均增加,则表示所述受试者患有乳腺癌。在该实施方案中,对照值是患有乳房良性纤维腺瘤的人的样品中mir-221和mir-155的水平。在该实施方案中,若受试者的mir-221水平与对照mir-221水平相比增加,并且受试者的mir-155水平与对照mir-155水平相比增加,则表示受试者患有乳腺癌。在另一个实施方案中,本申请提供的检测乳腺癌的方法包括:检测来自受试者的样品中mir-101、mir-221和mir-155的水平,其中若mir-101、mir-221和mir-155的水平与对照值相比均增加,则表示所述受试者患有乳腺癌。在该实施方案中,对照值是不患有乳腺癌的人的样品中mir-101、mir-221和mir-155的水平。在该实施方案中,若受试者的mir-101水平与对照mir-101水平相比增加,并且受试者的mir-221水平与对照mir-221水平相比增加,并且受试者的mir-155水平与对照mir-155水平相比增加,则表示受试者患有乳腺癌。在另一个实施方案中,本申请提供的检测乳腺癌的方法包括:检测来自受试者的样品中mir-101、mir-221和mir-155的水平,其中若mir-101、mir-221和mir-155的水平与对照值相比均增加,则表示所述受试者患有乳腺癌。在该实施方案中,对照值是患有乳房良性纤维腺瘤的人的样品中mir-101、mir-221和mir-155的水平。在该实施方案中,若受试者的mir-101水平与对照mir-101水平相比增加,并且受试者的mir-221水平与对照mir-221水平相比增加,并且受试者的mir-155水平与对照mir-155水平相比增加,则表示受试者患有乳腺癌。在一个优选的实施方案中,增加是指统计学上的显著增加。在一个实施方案中,受试者是人。在一个实施方案中,样品是从外周血分离的血清。在另一个实施方案中,样品是从外周血分离的血浆。在一个实施方案中,通过rt-pcr来检测标记物的水平。另一方面,本申请提供了一种用于检测乳腺癌的试剂盒,包括用于检测所述mirna标记物组合中每种标记物的水平的试剂。在一个实施方案中,本申请的试剂盒包括用于检测mir-101和mir-221的水平的试剂。在一个实施方案中,本申请的试剂盒包括用于检测mir-101和mir-155的水平的试剂。在一个实施方案中,本申请的试剂盒包括用于检测mir-221和mir-155的水平的试剂。在一个实施方案中,本申请的试剂盒包括用于检测mir-101、mir-221和mir-155的水平的试剂。在一个实施方案中,本申请的试剂盒包括通过rt-pcr来检测mir-101、mir-155和/或mir-221的水平的试剂。根据本发明,用于检测mir-101的水平的试剂包括逆转录引物:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacagcatc;正向引物:cacgcacagttatcacag;反向引物:ccagtgcagggtccgaggta;和探针:5'-tgctgtcgtatccagtgcgaatacc-3'。根据本发明,用于检测mir-221的水平的试剂包括逆转录引物:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacaaatct;正向引物:cacgcaacctggcataca;反向引物:ccagtgcagggtccgaggta;和探针:5'-tgtcgtatccagtgcgaatacctcg-3'。根据本发明,用于检测mir-155的水平的试剂包括逆转录引物:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacaacccc;正向引物:cacgcattaatgctaatc;反向引物:ccagtgcagggtccgaggta;和探针:5'-tgtcgtatccagtgcgaatacctcg-3'。在一个实施方案中,试剂盒还可以包括通过rt-pcr来检测mir-101、mir-155和/或mir-221的水平所需的其他试剂,例如逆转录酶、缓冲液、dntp、dna聚合酶、探针等。如本申请这样能够通过使用特定的微rna标记物的组合来更高效地检测乳腺癌的技术此前是不存在,是创新的。附图说明图1示出了mir-101和mir-221标记物的筛选和验证。图2示出了模型训练数据集中mir-101和mir-221的t-检验和来自于自助法的auc。图3示出了模型训练数据集中mir-101和mir-221的预测精度的验证(n=171)。图4示出了验证数据集中mir-101和mir-221的t-检验和来自于自助法的auc。图5示出了mir-101和mir-221标记物外部数据验证集中的预测精度的验证(n=190)。图6示出了mir-101和mir-155标记物的筛选和验证(n=190)。图7示出了mir-101和mir-155标记物的t-检验。图8示出了mir-101和mir-155标记物外部数据验证集中的的预测精度的验证(n=190)。图9示出了mir-221和mir-155标记物的筛选和验证(n=190)。图10示出了mir-221和mir-155标记物的t-检验。图11示出了mir-221和mir-155标记物外部数据验证集中的预测精度的验证(n=190)。图12示出了mir-101、mir-221和mir-155标记物的筛选和验证(n=190)。图13示出了mir-101、mir-221和mir-155标记物的t-检验。图14示出了mir-101、mir-221和mir-155标记物外部数据验证集中的预测精度的验证(n=190)。具体实施方式为了实施本申请,从实施乳腺癌检查的被检者进行采血,分离出血浆或血清后,通过离心柱(spincolumns)法等进行微rna的纯化。以纯化后的微rna为模板,通过用于检测本申请的两种微rna的引物组来进行定量rt-pcr法,例如,当为两种的组合时,进行mir-101、mir-221的定量解析。关于乳腺癌的评价,将mir-101、mir-221的表达量与非乳腺癌的健康人进行定量比较,实施统计学显著差异检验,在这两种微rna标记物与健康人相比具有显著差异地高表达的情况下,能够判定为乳腺癌的风险持有者。[实施例]下述记载了代表性实施例,但本申请的范围并不限定于这些实施例。·此次选定的mirna的选定方法如下。在已经被报道了在乳腺癌组织中表达变高的mirna中,选定了与源自作为正常细胞的乳腺上皮细胞株mcf10a的外来体中的表达相比,在源自乳腺癌细胞株mda-mb-231的外来体中表达量高的mirna。关于外来体的表达谱,使用了在本研究室中实施的数据。具体而言,可列举出mir-101、mir-29a、mir-29b、mir-125b、mir-221、mir-222、mir-210、mir-10b、mir-21。另一方面,虽然未观察到与细胞株的相关性,但广泛观察到在乳腺癌患者中的表达异常的mir-145、mir-155也加入了候选。而且,作为在健康人和乳腺癌患者血清中存在量差异小的mirna的候选,选定了mir-16。mir-16在健康人和乳腺癌患者中没有差异的事情在多篇论文和我们的研究室均有报道。以这些mirna为对象,通过源自癌症患者的血清97例和正常女性血清7例进行了验证,其结果是,在使用从源自癌症患者的血清和源自健康人的血清分别提取出的rna实施的mirna的表达解析中,对显示出1.2倍以上的存在量的血清进一步进行了详细解析。它们的候选为mir-21(seqidno.4)、mir-29a(seqidno.5)、mir-101、mir-155、mir-221。作为实施例,示出mir-101与mir-221这两种的组合的数据。[实施例1]<模型训练数据>关于暗示了与乳腺癌的关连性的五种微rna(mir-21、mir-29a、mir-101、mir-221和mir-155),通过训练组进行了详细评价[图1]。在训练组中,对通过利用这五种微rna中最有效的标记物和它们的组合实现的标记物特性的提高进行讨论,因此进行了使用自助法的解析。各个微rna的定量解析使用了通过逆转录反应进行的定量pcr法。以下记载实验的详情。血浆的分离:用一根5ml或7ml容量的edta-2na真空采血管从乳腺癌患者和健康者进行静脉采血,在进行倒置混合后,在室温下立即供于离心分离(2500×g/10分钟)。然后,将上层的血浆组分用一次性移液管分取至另一管中,在-80℃下保管直至使用时。微rna的纯化:向从-80℃迅速在室温下融解后的200μl的血浆中,加入5倍量(1000μl)的qiazollysisreagent(qiagen:79306),通过涡旋振荡器(vortex)进行了15秒钟搅拌。然后,添加0.1nm浓度的syntheticc.elegansmirna(syn-cel-mir-39)10μl,在提取微rna后用于通过实时pcr来进行微rna的表达解析时的、样品间的提取效率的校正。syn-cel-mir-39:tcaccgggtgtaaatcagcttg(seqidno.6)。进而,添加与血浆相同量的氯仿,通过涡旋振荡器搅拌15秒钟后,在室温下静置3分钟,在室温下供于离心分离(12000×g/15分钟)。离心后回收分成三层的上层组分,向其中加入1.5倍量的乙醇,通过移液进行混合,向一根mirneasyminikit(qiagen:217004)的柱中应用70μl,按照该试剂盒附带的说明书进行了微rna的纯化。从柱中的回收用50μl的不含rnase的水来进行。在用于以下的解析之前的期间,洗脱样品在-80℃下保管。逆转录反应和定量pcr:对于纯化后的微rna,使用micrornaassays,made-to-order,large(appliedbiosystems:4440888),按照试剂盒附带的说明书进行了表达量解析。所制作的环型(looptype)逆转录引物序列如下。mir-21-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgactcaaca(seqidno.7)mir-29a-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacctgaac(seqidno.8)mir-101-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacagcatc(seqidno.9)mir-155-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacaacccc(seqidno.10)mir-221-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacaaatct(seqidno.11)syn-cel-mir-39-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgaccaagct(seqidno.18)在pcr中使用的正向引物如下。mir-21-fw:cacgcatagcttatcaga(seqidno.12)mir-29a-fw:cacgcaactgatttcttt(seqidno.13)mir-101-fw:cacgcacagttatcacag(seqidno.14)mir-155-fw:cacgcattaatgctaatc(seqidno.15)mir-221-fw:cacgcaacctggcataca(seqidno.16)syn-cel-mir-39-fw:cacgcatcaccgggtgta(seqidno.19)反向引物为通用引物ccagtgcagggtccgaggta(seqidno.17)。在pcr中使用的taqman探针如下:mir-21-probe:5'(fam)-ttgagtcgtatccagtgcgaatacctc-3'(bhq1)(seqidno.20)mir-29a-probe:5'(fam)-tcaggtcgtatccagtgcgaatacc-3'(bhq1)(seqidno.21)mir-101-probe:5'(fam)-tgctgtcgtatccagtgcgaatacc-3'(bhq1)(seqidno.22)mir-155-probe:5'(cy5)-tgtcgtatccagtgcgaatacctcg-3'(bhq3)(seqidno.23)mir-221-probe:5'(vic)-tgtcgtatccagtgcgaatacctcg-3'(bhq2)(seqidno.24)syn-cel-mir-39-probe:5'(texas_red)-gcttggtcgtatccagtgcgaatacc-3'(bhq2)(seqidno.25)反应液组成如下。rt-pcr反应液由反转录酶、taqdna聚合酶、反转录引物、pcr上下游引物及taqman探针、pcr反应缓冲液等组成。需要说明的是,为了制作mir-21、mir-29a、mir-101、mir-155、mir-221的校准曲线,使用浓度已知的合成rna,以变为各浓度的方式添加至不同的孔(well)中,使用各个环型逆转录引物同样地进行了反应。反应条件如下。50℃/30分钟95℃/2分钟(95℃/15秒→60℃/30秒,检测荧光)×40循环微rna的绝对定量和标准化:基于根据校准曲线计算出的各微rna添加量的ct值,计算出从乳腺癌患者和健康者制备出的血浆中微rna的拷贝数。然后,使用在提取微rna时加标(spike)的syn-cel-mir-39,加入微rna的提取率等的校正计算,计算出规定液量的血浆中的mir-21、mir-29a、mir-101、mir-155、mir-221的表达量。训练组的队列信息:将作为解析对象的训练组的队列信息示于表1a、1b和1c。在训练组的队列中,乳腺癌患者116名(女性:平均年龄52.6岁)、健康者55名(女性:平均年龄58岁)作为被检者。若将乳腺癌患者按乳腺癌阶段进行分类,则阶段1为9名(8%),阶段2a为32名(28%),阶段2b为45名(39%),阶段3a为19名(17%),阶段3b为9名(8%),阶段3c为1名(1%),阶段4为0名(0%)。若按亚型进行分类,则luminala型为61名(56%),luminalb型为11名(10%),her2型为18名(17%),triplenegative型为19名(17%)。若等级进行分类,则级别1为12名(11%),级别2为55名(48%),级别3为47名(41%)。若按雌激素受体表达进行分类,则阴性为38名(33%),阳性为77名(67%)。若按孕激素受体表达进行分类,则阴性为60名(52%),阳性为55名(48%)。若按her2表达进行分类,则阴性为80名(73%),阳性为29名(27%)。作为标记物解析后的随访调查的结果,乳腺癌的治疗的完全缓解率为19%,部分缓解率为53%,稳定为25%,病情发展为4%,病理学完全缓解为27%,乳腺癌的手术后复发的比例为22%,到复发为止的平均期间为33.6个月,评价期间中的死亡率为8%。标记物精度统计解析:将从五个标记物候选(mir-21、mir-29a、mir-101、mir-155、mir-221)中选择的例如为两种的组合的mir-101、mir-221这两个的情况下的模型训练数据集中的统计学解析结果示于以下的图和表中。图2示出了模型训练数据集中的t-检验和来自于自助法的auc。图3示出了模型训练数据集中的预测精度的验证(n=171)。表2示出了模型训练数据集中的优势比。表3示出了模型训练数据集中的相对于概率的灵敏度和特异度。表2模型训练数据集中的优势比概率(p)=exp(a)/(1+exp(a));a=-2.2726–1.2242*age+3.1941*mir101+0.1873*mir221;表3模型训练数据集中的相对于概率的灵敏度和特异度概率灵敏度特异度0100.05100.1100.1510.040.210.150.2510.20.30.990.220.350.960.290.40.940.360.450.910.450.50.90.60.550.840.650.60.790.710.650.730.730.70.70.80.750.590.840.80.530.870.850.410.930.90.30.960.950.20.98101[实施例2]<验证数据>针对在实施例1的训练组中实施的评价标记物,以由另一队列构成的验证组为对象,使用逻辑回归分析,基于auc评价了各标记物的判别精度。在此,从用训练组实施的评价标记物中选择mir-101和mir-221,使用逻辑回归分析,基于auc评价了各标记物的判别精度。关于实验方法,依据实施例2,使用纯化后的血浆中的微rna,通过逆转录反应和定量pcr法来进行。以下记载详情。血浆的分离:用一根5ml或7ml容量的edta-2na真空采血管从乳腺癌患者和健康者进行静脉采血,在进行倒置混合后,在室温下立即供于离心分离(2500×g/10分钟)。然后,将上层的血浆组分用一次性移液管分取至另一管中,在-80℃下保管直至使用时。微rna的纯化:向从-80℃迅速在室温下融解后的200μl的血浆中,加入5倍量(1000μl)的qiazollysisreagent(qiagen:79306),通过涡旋振荡器(vortex)进行了15秒钟搅拌。然后,添加0.1nm浓度的syntheticc.elegansmirna(syn-cel-mir-39)10μl,在提取微rna后用于通过实时pcr来进行微rna的表达解析时的、样品间的提取效率的校正。syn-cel-mir-39:tcaccgggtgtaaatcagcttg(seqidno.6)。进而,添加与血浆相同量的氯仿,通过涡旋振荡器搅拌15秒钟后,在室温下静置3分钟,在室温下供于离心分离(12000×g/15分钟)。离心后回收分成三层的上层组分,向其中加入1.5倍量的乙醇,通过移液进行混合,向一根mirneasyminikit(qiagen:217004)的柱中应用700μl,按照该试剂盒附带的说明书进行了微rna的纯化。从柱中的回收用50μl的不含rnase的水来进行。在用于以下的解析之前的期间,洗脱样品在-80℃下保管。逆转录反应和定量pcr:对于纯化后的微rna,使用micrornaassays,made-to-order,large(appliedbiosystems:4440888),按照试剂盒附带的说明书进行了表达量解析。所制作的环型逆转录引物序列如下。mir-101-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacagcatc(seqidno.9)mir-221-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacaaatct(seqidno.11)syn-cel-mir-39-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgaccaagct(seqidno.18)在pcr中使用的正向引物如下。mir-101-fw:cacgcacagttatcacag(seqidno.14)mir-221-fw:cacgcaacctggcataca(seqidno.16)syn-cel-mir-39-fw:cacgcatcaccgggtgta(seqidno.19)反向引物为通用引物ccagtgcagggtccgaggta(seqidno.17)。在pcr中使用的taqman探针如下:mir-101-probe:5'(fam)-tgctgtcgtatccagtgcgaatacc-3'(bhq1)(seqidno.22)mir-221-probe:5'(vic)-tgtcgtatccagtgcgaatacctcg-3'(bhq2)(seqidno.24)syn-cel-mir-39-probe:5'(texas_red)-gcttggtcgtatccagtgcgaatacc-3'(bhq2)(seqidno.25)反应液组成如下。rt-pcr反应液由反转录酶、taqdna聚合酶、反转录引物、pcr上下游引物及taqman探针、pcr反应缓冲液等组成。需要说明的是,为了制作mir-101和mir-221的校准曲线,使用浓度已知的合成rna,以变为各浓度的方式添加至不同的孔(well)中,使用各个环型逆转录引物同样地进行了反应。反应条件如下。50℃/30分钟95℃/2分钟(95℃/15秒→60℃/30秒,检测荧光)×40循环微rna的绝对定量和标准化:基于根据校准曲线计算出的各微rna添加量的ct值,计算出从乳腺癌患者和健康者制备出的血浆中微rna的拷贝数。然后,使用在提取微rna时加标(spike)的syn-cel-mir-39,加入微rna的提取率等的校正计算,计算出规定液量的血浆中的mir-101和mir-221的表达量。验证组的队列信息:将作为解析对象的验证组的队列信息示于表1a、1b和1c。在验证组的队列中,乳腺癌患者93名(女性:平均年龄56岁)、健康者97名(女性:平均年龄55岁)为被检者。若将乳腺癌患者按乳腺癌阶段进行分类,则阶段1为0名(0%),阶段2a为37名(42%),阶段2b为39名(44%),阶段3a为3名(3%),阶段3b为2名(2%),阶段3c为0名(0%),阶段4为7名(8%)。若按照亚型进行分类,则luminala型为4名(13%),luminalb型为5名(16%),her2型为15名(48%),triplenegative型为7名(23%)。若按等级进行分类,则级别1为5名(5%),级别2为58名(63%),级别3为29名(32%)。若按雌激素受体表达进行分类,则阴性为11名(22%),阳性为39名(78%)。若按孕激素受体表达进行分类,则阴性为16名(32%),阳性为34名(68%)。若按her2表达进行分类,则阴性为33名(69%),阳性为15名(31%)。作为标记物解析后的随访调查的结果,乳腺癌的治疗的完全缓解率为36%,部分缓解率为57%,稳定为7%,病情发展为0%,病理学完全缓解为6%,乳腺癌的手术后复发的比例为11%,到复发为止的平均期间为24个月,评价期间中的死亡率为4%。标记物精度统计解析:图4示出了验证数据集中的t-检验和来自于自助法的auc。图5示出了外部数据验证集中的预测精度的验证(n=190)。与模型训练数据同样地,mir-101与mir-221的组合与各自单独使用标记物相比,作为乳腺癌标记物的精度高,进而还记载了表示能够检测临床病期阶段0~4、四种亚型的任一种乳腺癌的数据。[实施例3]<验证数据>针对在实施例1的训练组中实施的评价标记物,以由另一队列构成的验证组为对象,使用逻辑回归分析,基于auc评价了各标记物的判别精度。在此,从用训练组实施的评价标记物中选择mir-101和mir-155,使用逻辑回归分析,基于auc评价了各标记物的判别精度。关于实验方法,依据实施例3,使用纯化后的血浆中的微rna,通过逆转录反应和定量pcr法来进行。以下记载详情。血浆的分离:用一根5ml或7ml容量的edta-2na真空采血管从乳腺癌患者和健康者进行静脉采血,在进行倒置混合后,在室温下立即供于离心分离(2500×g/10分钟)。然后,将上层的血浆组分用一次性移液管分取至另一管中,在-80℃下保管直至使用时。微rna的纯化:向从-80℃迅速在室温下融解后的200μl的血浆中,加入5倍量(1000μl)的qiazollysisreagent(qiagen:79306),通过涡旋振荡器(vortex)进行了15秒钟搅拌。然后,添加0.1nm浓度的syntheticc.elegansmirna(syn-cel-mir-39)10μl,在提取微rna后用于通过实时pcr来进行微rna的表达解析时的、样品间的提取效率的校正。syn-cel-mir-39:tcaccgggtgtaaatcagcttg(seqidno.6)。进而,添加与血浆相同量的氯仿,通过涡旋振荡器搅拌15秒钟后,在室温下静置3分钟,在室温下供于离心分离(12000×g/15分钟)。离心后回收分成三层的上层组分,向其中加入1.5倍量的乙醇,通过移液进行混合,向一根mirneasyminikit(qiagen:217004)的柱中应用700μl,按照该试剂盒附带的说明书进行了微rna的纯化。从柱中的回收用50μl的不含rnase的水来进行。在用于以下的解析之前的期间,洗脱样品在-80℃下保管。逆转录反应和定量pcr:对于纯化后的微rna,使用micrornaassays,made-to-order,large(appliedbiosystems:4440888),按照试剂盒附带的说明书进行了表达量解析。所制作的环型逆转录引物序列如下。mir-101-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacagcatc(seqidno.9)mir-155-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacaacccc(seqidno.10)syn-cel-mir-39-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgaccaagct(seqidno.18)在pcr中使用的正向引物如下。mir-101-fw:cacgcacagttatcacag(seqidno.14)mir-155-fw:cacgcattaatgctaatc(seqidno.15)syn-cel-mir-39-fw:cacgcatcaccgggtgta(seqidno.19)反向引物为通用引物ccagtgcagggtccgaggta(seqidno.17)。在pcr中使用的taqman探针如下:mir-101-probe:5'(fam)-tgctgtcgtatccagtgcgaatacc-3'(bhq1)(seqidno.22)mir-155-probe:5'(cy5)-tgtcgtatccagtgcgaatacctcg-3'(bhq3)(seqidno.23)syn-cel-mir-39-probe:5'(texas_red)-gcttggtcgtatccagtgcgaatacc-3'(bhq2)(seqidno.25)反应液组成如下。rt-pcr反应液由反转录酶、taqdna聚合酶、反转录引物、pcr上下游引物及taqman探针、pcr反应缓冲液等组成。需要说明的是,为了制作mir-101和mir-155的校准曲线,使用浓度已知的合成rna,以变为各浓度的方式添加至不同的孔(well)中,使用各个环型逆转录引物同样地进行了反应。反应条件如下。50℃/30分钟95℃/2分钟(95℃/15秒→60℃/30秒,检测荧光)×40循环微rna的绝对定量和标准化:基于根据校准曲线计算出的各微rna添加量的ct值,计算出从乳腺癌患者和健康者制备出的血浆中微rna的拷贝数。然后,使用在提取微rna时加标(spike)的syn-cel-mir-39,加入微rna的提取率等的校正计算,计算出规定液量的血浆中的mir-101和mir-155的表达量。验证组的队列信息:将作为解析对象的验证组的队列信息示于表1a、1b和1c。在验证组的队列中,乳腺癌患者93名(女性:平均年龄56岁)、健康者97名(女性:平均年龄55岁)为被检者。若将乳腺癌患者按乳腺癌阶段进行分类,则阶段1为0名(0%),阶段2a为37名(42%),阶段2b为39名(44%),阶段3a为3名(3%),阶段3b为2名(2%),阶段3c为0名(0%),阶段4为7名(8%)。若按照亚型进行分类,则luminala型为4名(13%),luminalb型为5名(16%),her2型为15名(48%),triplenegative型为7名(23%)。若按等级进行分类,则级别1为5名(5%),级别2为58名(63%),级别3为29名(32%)。若按雌激素受体表达进行分类,则阴性为11名(22%),阳性为39名(78%)。若按孕激素受体表达进行分类,则阴性为16名(32%),阳性为34名(68%)。若按her2表达进行分类,则阴性为33名(69%),阳性为15名(31%)。作为标记物解析后的随访调查的结果,乳腺癌的治疗的完全缓解率为36%,部分缓解率为57%,稳定为7%,病情发展为0%,病理学完全缓解为6%,乳腺癌的手术后复发的比例为11%,到复发为止的平均期间为24个月,评价期间中的死亡率为4%。标记物精度统计解析:图6示出了mir-101和mir-155标记物的筛选和验证(n=190)。图7示出了mir-101和mir-155标记物的t-检验。图8示出了mir-101和mir-155标记物外部数据验证集中的的预测精度的验证(n=190)。使用标记物mir-101和mir-155检测乳腺癌具有优异的auc,为0.989。[实施例4]<验证数据>针对在实施例1的训练组中实施的评价标记物,以由另一队列构成的验证组为对象,使用逻辑回归分析,基于auc评价了各标记物的判别精度。在此,从用训练组实施的评价标记物中选择mir-221和mir-155,使用逻辑回归分析,基于auc评价了各标记物的判别精度。关于实验方法,依据实施例2,使用纯化后的血浆中的微rna,通过逆转录反应和定量pcr法来进行。以下记载详情。血浆的分离:用一根5ml或7ml容量的edta-2na真空采血管从乳腺癌患者和健康者进行静脉采血,在进行倒置混合后,在室温下立即供于离心分离(2500×g/10分钟)。然后,将上层的血浆组分用一次性移液管分取至另一管中,在-80℃下保管直至使用时。微rna的纯化:向从-80℃迅速在室温下融解后的200μl的血浆中,加入5倍量(1000μl)的qiazollysisreagent(qiagen:79306),通过涡旋振荡器(vortex)进行了15秒钟搅拌。然后,添加0.1nm浓度的syntheticc.elegansmirna(syn-cel-mir-39)10μl,在提取微rna后用于通过实时pcr来进行微rna的表达解析时的、样品间的提取效率的校正。syn-cel-mir-39:tcaccgggtgtaaatcagcttg(seqidno.6)。进而,添加与血浆相同量的氯仿,通过涡旋振荡器搅拌15秒钟后,在室温下静置3分钟,在室温下供于离心分离(12000×g/15分钟)。离心后回收分成三层的上层组分,向其中加入1.5倍量的乙醇,通过移液进行混合,向一根mirneasyminikit(qiagen:217004)的柱中应用700μl,按照该试剂盒附带的说明书进行了微rna的纯化。从柱中的回收用50μl的不含rnase的水来进行。在用于以下的解析之前的期间,洗脱样品在-80℃下保管。逆转录反应和定量pcr:对于纯化后的微rna,使用micrornaassays,made-to-order,large(appliedbiosystems:4440888),按照试剂盒附带的说明书进行了表达量解析。所制作的环型逆转录引物序列如下。mir-221-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacaaatct(seqidno.11)mir-155-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacaacccc(seqidno.10)syn-cel-mir-39-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgaccaagct(seqidno.18)在pcr中使用的正向引物如下。mir-221-fw:cacgcaacctggcataca(seqidno.12)mir-155-fw:cacgcattaatgctaatc(seqidno.15)syn-cel-mir-39-fw:cacgcatcaccgggtgta(seqidno.19)反应液组成如下。rt-pcr反应液由反转录酶、taqdna聚合酶、反转录引物、pcr上下游引物及taqman探针、pcr反应缓冲液等组成。需要说明的是,为了制作mir-221和mir-155的校准曲线,使用浓度已知的合成rna,以变为各浓度的方式添加至不同的孔(well)中,使用各个环型逆转录引物同样地进行了反应。反应条件如下。50℃/30分钟95℃/2分钟(95℃/15秒→60℃/30秒,检测荧光)×40循环微rna的绝对定量和标准化:基于根据校准曲线计算出的各微rna添加量的ct值,计算出从乳腺癌患者和健康者制备出的血浆中微rna的拷贝数。然后,使用在提取微rna时加标(spike)的syn-cel-mir-39,加入微rna的提取率等的校正计算,计算出规定液量的血浆中的mir-221和mir-155的表达量。验证组的队列信息:将作为解析对象的验证组的队列信息示于表1a、1b和1c。在验证组的队列中,乳腺癌患者93名(女性:平均年龄56岁)、健康者97名(女性:平均年龄55岁)为被检者。若将乳腺癌患者按乳腺癌阶段进行分类,则阶段1为0名(0%),阶段2a为37名(42%),阶段2b为39名(44%),阶段3a为3名(3%),阶段3b为2名(2%),阶段3c为0名(0%),阶段4为7名(8%)。若按照亚型进行分类,则luminala型为4名(13%),luminalb型为5名(16%),her2型为15名(48%),triplenegative型为7名(23%)。若按等级进行分类,则级别1为5名(5%),级别2为58名(63%),级别3为29名(32%)。若按雌激素受体表达进行分类,则阴性为11名(22%),阳性为39名(78%)。若按孕激素受体表达进行分类,则阴性为16名(32%),阳性为34名(68%)。若按her2表达进行分类,则阴性为33名(69%),阳性为15名(31%)。作为标记物解析后的随访调查的结果,乳腺癌的治疗的完全缓解率为36%,部分缓解率为57%,稳定为7%,病情发展为0%,病理学完全缓解为6%,乳腺癌的手术后复发的比例为11%,到复发为止的平均期间为24个月,评价期间中的死亡率为4%。标记物精度统计解析:图9示出了mir-221和mir-155标记物的筛选和验证(n=190)。图10示出了mir-221和mir-155标记物的t-检验。图11示出了mir-221和mir-155标记物外部数据验证集中的预测精度的验证(n=190)。使用标记物mir-221和mir-155检测乳腺癌具有优异的auc,为0.995。[实施例5]<验证数据>针对在实施例1的训练组中实施的评价标记物,以由另一队列构成的验证组为对象,使用逻辑回归分析,基于auc评价了各标记物的判别精度。在此,从用训练组实施的评价标记物中选择mir-101、mir-221和mir-155,使用逻辑回归分析,基于auc评价了各标记物的判别精度。关于实验方法,依据实施例3,使用纯化后的血浆中的微rna,通过逆转录反应和定量pcr法来进行。以下记载详情。血浆的分离:用一根5ml或7ml容量的edta-2na真空采血管从乳腺癌患者和健康者进行静脉采血,在进行倒置混合后,在室温下立即供于离心分离(2500×g/10分钟)。然后,将上层的血浆组分用一次性移液管分取至另一管中,在-80℃下保管直至使用时。微rna的纯化:向从-80℃迅速在室温下融解后的200μl的血浆中,加入5倍量(1000μl)的qiazollysisreagent(qiagen:79306),通过涡旋振荡器(vortex)进行了15秒钟搅拌。然后,添加0.1nm浓度的syntheticc.elegansmirna(syn-cel-mir-39)10μl,在提取微rna后用于通过实时pcr来进行微rna的表达解析时的、样品间的提取效率的校正。syn-cel-mir-39:tcaccgggtgtaaatcagcttg(seqidno.6)。进而,添加与血浆相同量的氯仿,通过涡旋振荡器搅拌15秒钟后,在室温下静置3分钟,在室温下供于离心分离(12000×g/15分钟)。离心后回收分成三层的上层组分,向其中加入1.5倍量的乙醇,通过移液进行混合,向一根mirneasyminikit(qiagen:217004)的柱中应用700μl,按照该试剂盒附带的说明书进行了微rna的纯化。从柱中的回收用50μl的不含rnase的水来进行。在用于以下的解析之前的期间,洗脱样品在-80℃下保管。逆转录反应和定量pcr:对于纯化后的微rna,使用micrornaassays,made-to-order,large(appliedbiosystems:4440888),按照试剂盒附带的说明书进行了表达量解析。所制作的环型逆转录引物序列如下。mir-101-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacagcatc(seqidno.9)mir-221-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacaaatct(seqidno.11)mir-155-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacaaccccsyn-cel-mir-39-rt:gtcgtatccagtgcagggtccgaggtattcgcactggatacgaccaagct(seqidno.18)在pcr中使用的正向引物如下。mir-101-fw:cacgcacagttatcacag(seqidno.14)mir-155-fw:cacgcattaatgctaatc(seqidno.15)mir-221-fw:cacgcaacctggcataca(seqidno.16)syn-cel-mir-39-fw:cacgcatcaccgggtgta(seqidno.19)反应液组成如下。rt-pcr反应液由反转录酶、taqdna聚合酶、反转录引物、pcr上下游引物及taqman探针、pcr反应缓冲液等组成。需要说明的是,为了制作mir-101、mir-155、mir-221的校准曲线,使用浓度已知的合成rna,以变为各浓度的方式添加至不同的孔(well)中,使用各个环型逆转录引物同样地进行了反应。反应条件如下。50℃/30分钟95℃/2分钟(95℃/15秒→60℃/30秒,检测荧光)×40循环微rna的绝对定量和标准化:基于根据校准曲线计算出的各微rna添加量的ct值,计算出从乳腺癌患者和健康者制备出的血浆中微rna的拷贝数。然后,使用在提取微rna时加标(spike)的syn-cel-mir-39,加入微rna的提取率等的校正计算,计算出规定液量的血浆中的mir-101、mir-155和mir-221的表达量。验证组的队列信息:将作为解析对象的验证组的队列信息示于表1a、1b和1c。在验证组的队列中,乳腺癌患者93名(女性:平均年龄56岁)、健康者97名(女性:平均年龄55岁)为被检者。若将乳腺癌患者按乳腺癌阶段进行分类,则阶段1为0名(0%),阶段2a为37名(42%),阶段2b为39名(44%),阶段3a为3名(3%),阶段3b为2名(2%),阶段3c为0名(0%),阶段4为7名(8%)。若按照亚型进行分类,则luminala型为4名(13%),luminalb型为5名(16%),her2型为15名(48%),triplenegative型为7名(23%)。若按等级进行分类,则级别1为5名(5%),级别2为58名(63%),级别3为29名(32%)。若按雌激素受体表达进行分类,则阴性为11名(22%),阳性为39名(78%)。若按孕激素受体表达进行分类,则阴性为16名(32%),阳性为34名(68%)。若按her2表达进行分类,则阴性为33名(69%),阳性为15名(31%)。作为标记物解析后的随访调查的结果,乳腺癌的治疗的完全缓解率为36%,部分缓解率为57%,稳定为7%,病情发展为0%,病理学完全缓解为6%,乳腺癌的手术后复发的比例为11%,到复发为止的平均期间为24个月,评价期间中的死亡率为4%。标记物精度统计解析:图12示出了mir-101、mir-221和mir-155标记物的筛选和验证(n=190)。图13示出了mir-101、mir-221和mir-155标记物的t-检验。图14示出了mir-101、mir-221和mir-155标记物外部数据验证集中的预测精度的验证(n=190)。使用标记物mir-101、mir-221和mir-155检测乳腺癌具有优异的auc,为0.999。[产业上的可利用性]居民诊查“对策型诊查”→确立了有效性的诊查。综合体检(nigendock)“任意型诊查”→医疗机构任意提供的医疗服务。序列表<110>上海圣梓茂生物科技有限公司上海圣特佳健康科技发展有限公司<120>用于检测乳腺癌的mirna标记物组合、试剂盒和方法<130>kl200302p<160>7<170>siposequencelisting1.0<210>1<211>22<212>rna<213>智人(homosapiens)<400>1caguuaucacagugcugaugcu22<210>2<211>22<212>rna<213>智人(homosapiens)<400>2accuggcauacaauguagauuu22<210>3<211>24<212>rna<213>智人(homosapiens)<400>3uuaaugcuaaucgugauagggguu24<210>4<211>22<212>rna<213>智人(homosapiens)<400>4uagcuuaucagacugauguuga22<210>5<211>22<212>rna<213>智人(homosapiens)<400>5acugauuucuuuugguguucag22<210>6<211>22<212>dna<213>秀丽隐杆线虫(caenorhabditiselegans)<400>6tcaccgggtgtaaatcagcttg22<210>7<211>50<212>dna<213>人工序列()<220>当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1