一种重组巴斯德毕赤酵母菌株、其构建方法和应用
1.本发明属于微生物基因工程与代谢工程应用领域,具体涉及一种利用甲醇生产脂肪酸衍生物的重组巴斯德毕赤酵母的构建方法、优化及其应用。
背景技术:
2.当前世界快速发展的城市化建设与工业化进程导致了前所未有的对于化石燃料的依赖性,液体运输燃料的需求量逐年递增。目前,全世界三分之一的能源来自于石油原料,其余来自煤炭、天然气、核能、水电和可再生能源(bp,2014),而大约80%的液体燃料来自石油(floudas et al.comput.chem.eng.,2012,41:24-51.)石油资源储备的快速消耗以及化石燃料使用产生的温室气体排放导致的气候变化等问题,已经成为现代社会面临的最大挑战之一,也促使人们寻找可以替代化石燃料的廉价可再生能源。燃料乙醇是目前最主要的生物燃料,可以大幅较少二氧化碳的排放,然而其带来的粮食与经济问题,以及燃料乙醇本身能量密度低和吸湿性限制其广泛应用(hu et al.open.biol.,2019,9:190049.)。
3.脂肪酸类衍生物如脂肪醇、烷烃和烯烃等因其与当前使用的液体燃料具有相似的高能量密度和燃烧特性,可以用作航空与重型卡车燃料,是一种比生物乙醇更好的石油资源替代品(sheng et al.front.microbiol.,2015,6:554.)。此外,脂肪酸及其衍生物也是重要的化工原料,如脂肪酸可以用来制造洗涤剂和表面活性剂;脂肪醇广泛应用于医药、化妆品、洗涤剂和护肤品的生产过程;α泛烯烃是制备航空燃料和高端润滑油的重要原料(liu et al.microb.cell.fact.,2016,15:129;zhou et al.nat.energy.,2018,3:925-935.)。bcc research调查报告显示2018年全球天然脂肪酸市场接近135亿美元,而这一数据到2023年将增至175亿美元,2018-2023年期间复合年增长率(cagr)为5.4%。脂肪酸类衍生品市场规模将从2018年的69亿美元增长到2023年的近95亿美元,年复合增长率为6.4%(bcc research llc,2018)。
4.由于脂肪酸及其衍生物的结构特性,化学合成法过程复杂,成本较高,从自然生物来源的数量又十分有限,因此亟需开发新型高效的生产工艺来满足日益增长的需求,随着合成生物学与代谢工程的发展,以微生物细胞工厂作为脂肪酸及其衍生物的生产平台逐渐成为一种高效经济的补充方法。目前也有大量研究已经专注于该领域的研究,开发了不同菌株的生产平台,如酿酒酵母、大肠杆菌、红球菌等。在大肠杆菌中,通过合成基因模块化转录水平调控,平衡了前体供应与消耗过程,并通过酶的核糖体结合位点改造提升了蛋白质的翻译效率,工程菌株经分批补料发酵,脂肪酸的最终产量可以达到8.6g/l(xu et al.nat.comm.,2013,4:1409.)。在酿酒酵母中,通过整合细胞质柠檬酸裂解途径,增强乙酰辅酶a供应,敲除脂肪酸β氧化途径基因等改造,在摇瓶发酵水平实现了1g/l的脂肪酸产量,经生物反应器中分批补料发酵,产量达到10.4g/l(zhou et al.nat.comm.,2016,7:11709.)。在此基础上,进一步强化碳源流向乙酰辅酶a过程,增强辅酶nadph与atp供给等改造,结合实验室适应性进化手段,将酿酒酵母完全改造成为产油酵母,分批补料脂肪酸产量达到33.4g/l(yu et al.cell.,2018,174(6):1549-1558.)。在红球菌中,首先通过培养条
件的优化,可以生产82.9g/l的三酰甘油,再敲除酰基辅酶a合成酶,并过表达脂肪酶特异性折叠酶和三种脂肪酶,工程菌可以生产50.2g/l的游离脂肪酸(kim et al.nat.chem.biol.,2019,15(7):721-729.)。
5.现有的脂肪酸及其衍生物的生产底物主要是葡萄糖,虽然葡萄糖是一种微生物的最适碳源,但其来源于粮食受地理气候、经济等因素影响较大。因此需要寻找一种更廉价的生产原料作为替代。甲醇是最简单的一元醇,主要来自煤化工行业的副产物和天然气的催化合成,生产工艺成熟,是一种来源广泛,价格低廉的可再生资源(price et al.pnas,2016,113:12691-12696.)。由于我国的能源结构是“缺油、少气、富煤”的特点,所以近年来国内甲醇产能、产量大幅增长。与常用的发酵底物糖类相比,甲醇具有更强的还原力,能够为异源产物的合成提供更多的驱动力(whitaker et al.curr.opin.biotechnol.,2015,33:165-175.),甲醇这种低价格高体量高能效的特点使其成为一种潜在的原料,甲醇的生物炼制将极大的拓展已有的甲醇转化路线,实现煤炭资源的清洁利用。
6.巴斯德毕赤酵母是一种天然甲基营养型酵母,可以在以甲醇培养基中快速生长,并且能够实现高密度培养,同时毕赤酵母也有较为成熟的异源蛋白表达系统,因此巴斯德毕赤酵母是一种非常具有潜力的微生物细胞工厂底盘。但是,目前在毕赤酵母中生产脂肪酸及其衍生物,尤其是以甲醇为底物的研究还未见报道。因此,本发明旨在构建毕赤酵母甲醇转化生产脂肪酸的高产菌株,一方面拓宽甲醇利用和脂肪酸生产的路线,另一方面探索了毕赤酵母作为微生物细胞工厂的应用潜力与前景。
技术实现要素:
7.本发明的目的是提供一种产脂肪酸、脂肪醇和α-烯烃的巴斯德毕赤酵母的构建方法、优化及其应用。
8.本发明的第一方面,提供一种高产脂肪酸的毕赤酵母菌株的构建方法,能够显著增加细胞生产脂肪酸的能力,脂肪酸积累量达1.1g/l以上。
9.所述构建方法包括:构建具有seq id no:1所示的靶向核苷酸序列的sgrna表达载体ppicz-cas9-gfaa1;将所述sgrna表达载体ppicz-cas9-gfaa1导入巴斯德毕赤酵母菌株,敲除毕赤酵母菌株中的kpfaa1基因。
10.其中,所述巴斯德毕赤酵母菌株整合有cas9蛋白。
11.可选地,所述构建方法还包括:构建具有seq id no:2所示的靶向核苷酸序列的sgrna表达载体ppicz-cas9-gfaa2;将所述sgrna表达载体ppicz-cas9-gfaa2导入巴斯德毕赤酵母菌株,敲除巴斯德毕赤酵母菌株中的kpfaa2基因。
12.可选地,所述构建方法还包括:构建具有seq id no:3所示的靶向核苷酸序列的sgrna表达载体ppicz-cas9-gpox1;将所述sgrna表达载体ppicz-cas9-gpox1导入巴斯德毕赤酵母菌株,敲除巴斯德毕赤酵母菌株中的kppox1基因。
13.在一个具体实施方式中,敲除编码脂酰辅酶a合成酶的基因kpfaa1和kpfaa2以及编码脂酰辅酶a氧化酶的基因kppox1。
14.进一步地,上述技术方案的具体步骤是:以无缝敲除基因kpfaa1为例,本发明对巴斯德毕赤酵母的基因编辑主要基于自主构建的crispr/cas9系统实现。首先,构建靶向基因kpfaa1的sgrna表达载体ppicz-cas9-gfaa1,其中20bp的靶向序列如seq id no.1所示的核
苷酸序列;第二,构建donor dna片段,分别扩增基因kpfaa1编码区上下游各1000bp序列,通过重叠延伸pcr的方法获得完整的donor dna片段;第三,转化,通过电转化方式,将grna表达载体ppicz-cas9-gfaa1和donor dna转化进野生型巴斯德毕赤酵母gs115中,于含有博莱霉素的ypd平板30℃静置培养3天,转化子经ypd-zeocin
+
的液体培养基培养过夜,进行pcr验证,正确转化子经质粒丢失后进行菌株保存或进行下一步实验。敲除基因kpfaa2和kppox1(20bp靶向序列如seq id no.2和seq id no.3所示核苷酸序列)以及下文中的其他基因的编辑过程均按照相似流程进行。
15.在一个实施例中,提供了一种利用葡萄糖或甲醇高效合成脂肪酸的巴斯德毕赤酵母重组菌株,出发菌株为gs115,敲除了脂酰辅酶a合成酶(由基因kpfaa1,kpfaa2编码)和脂酰辅酶a氧化酶(由基因kppox1编码)。
16.在一个实施例中,提供了一种利用甲醇高效合成脂肪酸的巴斯德毕赤酵母重组菌株,出发菌株为gs115,过表达了来自毕赤酵母的基因kprad52并且敲除了脂酰辅酶a合成酶基因kpfaa1。
17.进一步地,鉴定了kpfaa1、kpfaa2和kppox1基因在巴斯德毕赤酵母中的序列(分别如seq id no.4,seq id no.5和seq id no.6所示的核苷酸序列)以及功能。
18.进一步地,以20g/l葡萄糖为碳源的基础盐培养基中,接种敲除了kpfaa1、kpfaa2和kppox1基因的巴斯德毕赤酵母,进行脂肪酸发酵实验。其参数设置为初始接种od
600
为0.1,发酵条件如下:装液量20ml/100ml,220rpm,30℃,发酵时间为72~96h。进一步地,发现并鉴定出巴斯德毕赤酵母所积累的脂肪酸种类主要为c16:1、c16、c18:2、c18:1和c18。
19.在一个实施例中,所述菌株在含有20g/l葡萄糖的基础成分培养基中发酵96h,摇瓶水平脂肪酸产量达到1.1g/l,脂肪酸种类包括c16:1、c16、c18:2、c18:1和c18。
20.进一步地,以20g/l甲醇为碳源的基础盐培养基中,接种敲除了kpfaa1、kpfaa2和kppox1基因的巴斯德毕赤酵母,进行脂肪酸发酵实验。其参数设置为初始接种od
600
为0.2,发酵条件如下:装液量20ml/100ml,220rpm,30℃,发酵时间为96~120h。结果证明重组毕赤酵母能够以甲醇为唯一碳源和能量来源进行生长和代谢,并能够生产600mg/l左右的脂肪酸,脂肪酸种类同葡萄糖。
21.在一个实施例中,所述菌株在含有20g/l甲醇的基础成分培养基中发酵120h,摇瓶水平脂肪酸产量达到577mg/l,脂肪酸种类包括c16:1、c16、c18:2、c18:1和c18。
22.根据本发明第二方面,提供一种在巴斯德毕赤酵母中增加乙酰辅酶a前体和辅酶nadph供给的策略,过表达了来源于小家鼠的柠檬酸裂解酶(由基因mmacl编码),来源于巴斯德毕赤酵母内源的异柠檬酸脱氢酶2(由基因kpidp2编码),来源于酿酒酵母的柠檬酸转运蛋白(由基因scyhm2编码)。从而提高了毕赤酵母的脂肪酸产量。
23.在一个实施例中,高产脂肪酸的重组毕赤酵母菌株同时过表达了来自小家鼠的柠檬酸裂解酶mmacl,酿酒酵母的柠檬酸转运蛋白scyhm2以及毕赤酵母内源的胞浆异柠檬酸脱氢酶kpidp2,能够提高毕赤酵母利用甲醇生产脂肪酸的能力。
24.可选地,所述毕赤酵母菌株his4位点整合有蛋白kprad52。
25.可选地,所述毕赤酵母菌株敲除了基因kpfaa1。
26.可选地,使所述重组毕赤酵母菌株过表达由基因mmacl编码的柠檬酸裂解酶,包括:将来源于小家鼠的基因mmacl整合至所述巴斯德毕赤酵母,优选整合至酵母基因组
pnsi-2位点。
27.可选地,使所述重组毕赤酵母菌株过表达由基因kpidp2编码的异柠檬酸脱氢酶2,包括:将来源于毕赤酵母的kpidp2进行基因的过表达,优选整合至pnsi-3位点。
28.可选地,使所述重组毕赤酵母菌株过表达由基因scyhm2编码的柠檬酸转运蛋白,包括:将来源于酿酒酵母的基因scyhm2整合至所述巴斯德毕赤酵母,优选整合至pnsi-4位点。
29.在一个具体实施方式中,上述技术方案的实施步骤是:
30.(1)基因mmacl的过表达
31.具体流程与上述本发明第一方面内容一致,其中构建的sgrna表达载体为ppicz-cas9-gpnsi-2,其中20bp靶向序列为seq id no.7所示核苷酸序列。第二,构建用于染色体整合的donor dna,包括位点两侧各1000bp的同源臂以及外源基因表达盒p
aox1-mmacl-t
faa1
。进一步地,基因mmacl基因来源为人工合成,其核苷酸序列如seq id no.8所示。
32.(2)基因kpidp2和scyhm2的过表达
33.具体流程与上述本发明第一方面内容一致,其中构建的sgrna表达载体为ppicz-cas9-gpnsi-3(其中20bp的靶向序列seq id no.9所示的核苷酸序列)和ppicz-cas9-gpnsi-4(其中20bp的靶向序列如seq id no.10所示的核苷酸序列)。进一步地,鉴定了kpidp2在毕赤酵母中的序列(其核苷酸序列如seq id no.11所示)以及功能。基因scyhm2由酿酒酵母cenpk-113基因组扩增获得(其序列如seq id no.12所示核苷酸序列)。
34.本发明的第三方面,提供了根据本技术第一方面所述的构建方法或根据本技术第二方面所述的方法构建得到的产脂肪酸的重组巴斯德毕赤酵母菌株。
35.本技术的第四方面,提供了一种生产脂肪醇巴斯德毕赤酵母菌株的构建方法,包括:在巴斯德毕赤酵母中过表达羧酸还原酶mmcar以及辅因子annpga,醇脱氢酶scadh5,脂酰辅酶a还原酶facoar,以构建脂肪醇合成通路。
36.可选地,所述巴斯德毕赤酵母菌株his4位点整合有kprad52基因。
37.可选地,所述巴斯德毕赤酵母菌株无缝敲除了脂肪醛脱氢酶基因kphfd1。
38.可选地,将海鱼分枝杆菌的羧酸还原酶基因mmcar整合至所述重组毕赤酵母菌株地pnsi-2位点,以过表达羧酸还原酶mmcar。
39.可选地,将来源于构巢曲霉辅因子蛋白annpga基因整合至所述重组毕赤酵母菌株地pnsi-3位点,以过表达辅因子蛋白annpga。
40.可选地,将酿酒酵母来源的scadh5基因整合至所述重组毕赤酵母菌株地pnsi-4位点,以过表达醇脱氢酶scadh5。
41.可选地,将密码子优化后的facoar基因整合至所述重组毕赤酵母菌株的pnsi-5位点,以过表达脂酰辅酶a还原酶facoar。
42.在一个实施例中,在底盘细胞为野生型毕赤酵母gs115过表达基因kprad52并且敲除了脂肪醛脱氢酶基因kphfd1和基因kpfaa1,在此底盘细胞上进一步过表达羧酸还原酶基因mmcar以及辅因子基因annpga,醇脱氢酶基因scadh5,脂酰辅酶a还原酶基因facoar,可以实现75.8mg/l的脂肪醇产量。
43.在一个具体实施方式中,借助crispr/cas9系统,将脂肪醇合成途径的4个关键基因,羧酸还原酶基因mmcar以及辅因子基因annpga,醇脱氢酶基因scadh5和脂酰辅酶a还原
酶基因facoar整合至pnsi-2、pnsi-3、pnsi-4及pnsi-5位点。其中,mmcar、annpga和facoar按照毕赤酵母密码子偏好性进行优化,优化后的序列依次如seq id no:13,seq id no:14,seq id no:15所示的核苷酸序列。
44.具体流程与上述本发明第一方面内容一致,其中构建的sgrna表达载体为ppicz-cas9-gpnsi-5(其中20bp的靶向序列如seq id no.16所示的核苷酸序列)。
45.进一步地,为了提高脂肪醇产量,将负责催化脂肪醛到脂肪酸的基因kphfd1进行了无缝敲除。
46.基因kphfd1无缝敲除的具体流程与上述本发明第一方面内容一致,其中构建的sgrna表达载体为ppicz-cas9-ghfd1,20bp靶向序列如seq id no:17所示的核苷酸序列。同时,鉴定了基因kphfd1在巴斯德毕赤酵母中的序列(如seq id no:18所示的核苷酸序列)以及功能。
47.根据本技术的第五方面,提供了根据本技术第四方面所述的构建方法构建得到的脂肪醇合成重组巴斯德毕赤酵母菌株。
48.根据本技术的第六方面,提供了一种α-烯烃合成重组巴斯德毕赤酵母菌株的构建方法,对该过程关键步骤脂肪酸脱羧酶基因pfundb(其核酸序列如seq id no:19所示)及其辅因子蛋白基因cama(其核酸序列如seq id no:20所示)和camb(其核酸序列如seq id no:21所示)进行了密码子优化。在高产脂肪酸的菌株中,过表达基因pfundb及其两个辅因子蛋白基因cama和camb,首次实现了毕赤酵母中15碳和17碳α-烯烃的生物合成。
49.进一步地,将辅因子蛋白与脱羧酶靶向过氧化物酶体表达,使得α-烯烃提高了两倍。
50.进一步地,在含有辅因子蛋白cama和camb的底盘细胞中过表达另外两种经密码子适配性优化的脂肪酸脱羧酶基因ppunda(其核酸序列如seq id no:22)和jeolet(其核酸序列如seq id no:23),同样实现了毕赤酵母中α-烯烃的生物合成。
51.在一个实施例中,以本技术第一方面所述的敲除了基因kpfaa1的产脂肪酸的重组毕赤酵母菌株为出发菌株,使其过表达辅因子蛋白基因cama和camb,进一步过表达脂肪酸脱羧酶基因pfundb、ppunda或jeolet中的一个或多个。
52.根据本技术的第七方面,提供了根据本技术第一方面或第二方面所述的构建方法、本技术第三方面所述的产脂肪酸的重组巴斯德毕赤酵母菌株、本技术第四方面所述的构建方法、本技术第五方面所述的脂肪醇合成重组巴斯德毕赤酵母菌株,以及本技术第六方面α-烯烃合成重组巴斯德毕赤酵母菌株细胞大规模培养中的应用。
53.根据本技术第八方面,提供了根据本技术第一方面或第二方面所述的构建方法、本技术第三方面所述的产脂肪酸的重组毕巴斯德赤母菌株、本技术第四方面所述的构建方法、本技术第五方面所述的脂肪醇合成重组巴斯德毕赤酵母菌株以及本技术第六方面α-烯烃合成重组巴斯德毕赤酵母菌株在脂肪酸和/脂肪醇和/α-烯烃的合成中的应用。
54.本技术能产生的有益效果包括:
55.1)本技术提供了一种产脂肪酸的重组毕巴斯德赤母菌株的构建方法,首先通过敲除脂肪酸β氧化途径中的脂酰辅酶a合成酶(由基因kpfaa1,kpfaa2编码)和脂酰辅酶a氧化酶(由基因kppox1编码)能够大幅提高毕赤酵母脂肪酸的积累能力,在含20g/l葡萄糖的基础成分培养基的摇瓶中发酵96h,脂肪酸产量能够达到1.1g/l,脂肪酸的种类主要为c16:1、
c16、c18:2、c18:1和c18。为了探索一碳资源的绿色转化,进行了甲醇为唯一碳源的脂肪酸发酵,产量可以达到577mg/l。通过过表达来自小家鼠的柠檬酸裂解酶aclp,酿酒酵母的柠檬酸转运蛋白yhm2以及毕赤酵母内源的胞浆异柠檬酸脱氢酶基因idp2,强化了细胞质内乙酰辅酶a的合成以及一定程度上补充了细胞还原力nadph。通过多个酶协同作用,甲醇转化生产脂肪酸最终产量较对照提升了2.4倍。
56.2)本技术还提供了一种脂肪醇合成重组毕巴斯德赤母菌株的构建方法,通过染色体整合途径,使基因mmcar、npga、adh5和facoar在重组毕巴斯德赤母菌株中过表达并敲除毕赤酵母内源的脂肪醛脱氢酶hfd1,首次在毕赤酵母中实现了脂肪醇的合成,葡萄糖条件下脂肪醇产量达到75.8mg/l,以甲醇为唯一碳源时同样实现了脂肪醇的合成。
57.3)本技术还提供了一种α-烯烃合成重组毕巴斯德赤母菌株的构建方法,在染色体整合了辅因子蛋白cama和camb的高产脂肪酸底盘细胞中,以游离载体表达脂肪酸脱羧酶undb,unda或olet,首次实现了α-烯烃的合成。
58.4)本发明首次实现了毕赤巴斯德酵母脂肪酸衍生物合成,特别是甲醇到脂肪酸的高效生物合成,拓展了甲醇绿色转化路径,并且发掘了巴斯德毕赤酵母在微生物细胞工厂领域的应用潜力
附图说明
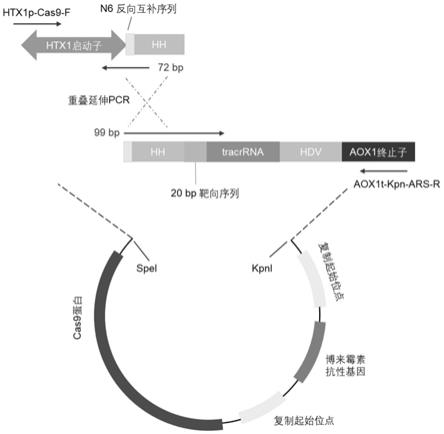
59.图1为巴斯德毕赤酵母crispr/cas9系统中sgrna构建过程示意图。
60.图2示出了高产脂肪酸巴斯德毕赤酵母菌株的构建。
61.图3为代谢工程改造策略促进巴斯德毕赤酵母脂肪酸积累示意图。
62.图4示出了20g/l葡萄糖为底物的基础培养基条件下毕赤酵母脂肪酸发酵情况。
63.图5示出了20g/l甲醇为底物的基础培养基条件下毕赤酵母脂肪酸发酵情况。
64.图6示出了过表达基因mmacl,kpidp2和scyhm2对脂肪酸产量的影响。
65.图7示出了脂肪醇合成菌株构建。
66.图8示出了20g/l葡萄糖为底物的基础培养基条件下毕赤酵母脂肪醇发酵。
67.图9示出了20g/l甲醇为底物的基础培养基条件下毕赤酵母脂肪醇发酵情况。
68.图10示出了α-烯烃合成途径构建示意图。
69.图11示出了重组毕赤酵母合成α-烯烃产物分析气相色谱图。
具体实施方式
70.下述非限制性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。下述实施例中,如无特殊说明,所使用的实验方法均为常规方法,所用材料、试剂等均可从生物或化学公司购买。
71.实施例1
72.高产脂肪酸巴斯德毕赤酵母菌株的构建
73.(1)基因编辑crispr/cas9系统构建
74.出发菌株毕赤酵母(komagataella phaffii gs115)由华东理工大学蔡孟浩副教授赠送。sgrna表达载体构建过程如图1所示,本发明中使用的所有sgrna表达载体除20bp靶向序列不同,其余部分完全一致。通过pcr扩增获得ppicz-cas9质粒骨架,同时在骨架两头
分别引入酶切位点kpni和spei便于后续实验的grna部分序列的替换;接着通过两条长引物分别扩增p
htx1
和sgrna部分,以重叠延伸pcr的方式融合成为完整的sgrna表达盒。其中两侧扩增序引物固定为htx1-cas9-f
75.(ggagtacttcttgtccatcgtttcgactagttgttgtagttttaatatagtttgagtatgagatggaactc)与aox1t-kpn-ars-r
76.(aaacgtcaaatcataatcagcactaggtaccgcacaaacgaacgtctcacttaatcttc)固定不变,通过中间一对长引物改变grna20bp与hh中6bp反向互补序列,以sgrna-faa1为例,htx1-cas9-f与gfaa1-r
77.(gtttcgtcctcacggactcatcagtgaacgtttgatttgtttaggtaacttgaactggatgtattagtttgg)扩增p
htx1
部分,gfaa1-f
78.(cgttcactgatgagtccgtgaggacgaaacgagtaagctcgtctgaacgacatgaagacaacagttttagagctagaaatagcaagttaaaataaggct)与aox1t-kpn-ars-r扩增sgrna部分。融合后获得的基因kpfaa1的sgrna表达盒与载体骨架通过t4dna连接酶进行连接,转化至大肠杆菌,进一步pcr鉴定、测序验证获得正确的重组sgrna质粒,用于后续实验。
79.本发明中涉及的sgrna表达载体包括ppicz-cas9-gfaa1(靶向基因kpfaa1),ppicz-cas9-gfaa2(靶向基因kpfaa2),ppicz-cas9-gpox1(靶向基因kppox1),ppicz-cas9-gpnsi2(靶向染色体位点pnsi2),ppicz-cas9-gpnsi3(靶向染色体位点pnsi3)和ppicz-cas9-gpnsi4(靶向染色体位点pnsi4)。
80.donor dna构建如图2所示。即首先分别扩增靶向基因编码区或靶向位点上下游各1000bp序列作为同源臂,之后通过融合pcr的方式将donor dna各部分按顺序连接,获得完整的donor dna用于后续电转化实验,获得基因编辑效果。
81.(2)高产脂肪酸菌株的构建
82.酵母细胞中脂肪酸的合成与分解代谢途径如图3所示,脂肪酸是经乙酰辅酶a通过碳链延伸合成,申请人发现通过阻断酿酒酵母脂肪酸的β-氧化途径中脂肪酸的活化步骤,即敲除脂酰辅酶a合成酶(由基因kpfaa1和kpfaa4编码)和脂酰辅酶a氧化酶(由基因kppox1编码),可以使酵母获得一定量的脂肪酸积累并防止脂肪酸降解。我们通过核苷酸与蛋白序列比对,在巴斯德毕赤酵母中找到了对应的脂酰辅酶a合成酶(kpfaa1和kpfaa2)和脂酰辅酶a氧化酶(kppox1)。
83.基于以上基础,为了构建高产脂肪酸的巴斯德毕赤酵母菌株,我们借助于crispr-cas9基因编辑系统,首先对kpfaa1,kpfaa2进行了单独敲除以及两基因的双敲除,分别构建了菌株pc101(kpfaa1单独敲除),pc102(kpfaa2单独敲除)和pc103(kpfaa1和kpfaa2双敲除)。随后,在pc101与pc103菌株的基础上进行了进一步kppox1基因的无缝敲除,分别获得了工程菌株pc105和pc106。此一系列菌株用于后续脂肪酸生产能力的测试。
84.实施例2
85.重组毕赤酵母菌株的脂肪酸发酵
86.(1)培养基
87.ypd培养基:20g/l葡萄糖,20g/l蛋白胨,10g/l酵母粉;
88.发酵培养基(基础成分培养基):(nh4)2so
4 2.5g/l,kh2po
4 14.4g/l,mgso4·
7h2o 0.5g/l,histidine 40mg/l,加入约800ml ddh2o,搅拌溶解后用koh调节ph为5.6,定容至
950ml,115℃灭菌30min。灭菌后,补加2ml微量金属溶液和1ml维生素溶液。向发酵培养基中添加不同种类碳源,包括20g/l葡萄糖或20g/l甲醇,用于脂肪酸发酵。
89.(2)发酵流程及条件
90.菌株活化,从ypd划线平板上挑取3个单菌落于3/15ml ypd培养基中,或者deft-g培养基中,220rpm,30℃,振荡培养过夜,不超过20h;发酵接种,按初始od
600
=0.1(接种于deft-g培养基),或od
600
=0.2(deft-m培养基)。装液量为20ml/100ml锥形瓶,220rpm,30℃条件下进行发酵。定点取样用于生物量(以600nm处的吸光值表示)和脂肪酸产量分析。
91.(3)脂肪酸合成
92.获得了构建成功的kpfaa1,kpfaa2和kppox1基因无缝敲除菌株后,我们首先在deft-g培养基条件下进行了脂肪酸的发酵实验。实验结果如图4所示。发酵历程96h结束,不论是野生型还是工程菌株,在葡萄糖培养条件下,生物量基本没有差异,终点od值在15左右。而在脂肪酸积累方面,与野生型菌株相比随着敲除基因个数的增加两者呈正相关性,脂肪酸积累量也随之发生一定量的增加,脂肪酸产量超过1g/l。巴斯德毕赤酵母中,巴斯德毕赤酵母中积累的脂肪酸种类主要是c16:1,c16,c18:1,c18:2和c18,其中以c16,c18:1,c18:2三种脂肪酸为主,占脂肪酸总产量的80%以上。
93.随后我们又进行了deft-m培养基的脂肪酸发酵实验,实验结果如图5所示。初始碳源量为10g/l甲醇,发酵培养大约48h时补加10g/l的甲醇。发酵历程120h,发生基因敲除的毕赤酵母工程菌株不论敲除基因个数其生物量大致相似,do值达到9左右。在脂肪酸产量方面,野生型菌株与葡萄糖培养基相似,只有少量脂肪酸积累。敲除kpfaa1基因后即获得较多的脂肪酸积累,产量超过200mg/l,kpfaa1,kpfaa2和kppox1三敲菌株获得了甲醇培养条件下的最大脂肪酸产量,达到577mg/l。甲醇培养时,积累的脂肪酸主要种类与葡萄糖一致,为c16:1,c16,c18:1,c18:2和c18,其中c16:1所占的比例略微有所提升。本发明首次实现了一碳资源甲醇至长链脂肪酸的高效合成。
94.实施例3
95.乙酰辅酶a合成途径强化对脂肪酸合成的影响
96.乙酰辅酶a是一种十分重要的基础能量代谢中间产物,也是酵母细胞合成脂肪酸类化合物的直接前体物质。脂肪酸合成量的大幅提升可能导致细胞内乙酰辅酶a不足。除了糖酵解途径产生的丙酮酸进入线粒体生成乙酰辅酶a,微生物体内还存在一套柠檬酸裂解酶(acl)系统,线粒体中生成的柠檬酸可以跨越线粒体内膜,在细胞溶质中受到柠檬酸裂解酶的作用而断裂,生成乙酰辅酶a和草酰乙酸。申请人发现过表达来源于小家鼠的柠檬酸裂解酶基因mmacl时,脂肪酸的产量可以提升19.4%。在酿酒酵母中yhm2基因编码的蛋白负责将线粒体内的柠檬酸转运到细胞质中,同时将细胞质中的α-酮戊二酸转运至线粒体中参与柠檬酸循环,过表达基因yhm2同样有利于脂肪酸的合成(yu et al.cell.,2018,174:1549)。由于脂肪酸生物合成会大量的消耗细胞还原力nadph,尤其是以甲醇为底物时,缺乏较强的戊糖磷酸途径,细胞内nadph会严重不足,这也可能是导致甲醇为底物产量低于葡萄糖的原因之一。异柠檬酸脱氢酶2(由基因ipd2编码)负责将细胞质内柠檬酸转化为α-酮戊二酸,同时产生一个nadph,该步骤可以将线粒体内外的柠檬酸循环连通,同样有利于脂肪酸的生产(yu et al.cell.,2018,174:1549.)。因此,我们在毕赤酵母中过表达了源于小家鼠的柠檬酸裂解酶基因mmacl,来源于酿酒酵母的柠檬酸跨线粒体膜转运蛋白基因scyhm2,
来源于巴斯德毕赤酵母内源的异柠檬酸脱氢酶基因kpidp2。
97.由于毕赤酵母属于非传统酵母,其修复过程主要是非同源末端连接,较难发生同源重组,因此外源基因的过表达出发菌株均采用同源重组增强(高表达kprad52基因,其核苷酸序列如seq id no.24所示)的工程菌株提高基因编辑效率。使用的出发菌株gs115为his营养缺陷型菌株,因此his4基因可以作为一个基因过表达的靶点。首先与实例1相似的,使用引物htx1-cas9-f与ghis4-r(gtttcgtcctcacggactcatcagaacgagtttgatttgtttaggtaacttgaactggatgtattagtttg)扩增htx1启动子部分,ghis4-1-f(ctcgttctgatgagtccgtgaggacgaaacgagtaagctcgtcaacgagagcagactacaccagttttagagctagaaatagcaagttaaaataaggct)与aox1t-kpn-ars-r扩增sgrna部分。融合后获得的基因his4的sgrna表达盒与载体骨架通过t4dna连接酶进行连接,构建sgrna表达载体ppicz-cas9-ghis4(其中20bp的靶向序列如seq id no.25所示的核苷酸序列)。
98.构建整合donor dna时,首先使用一对引物pprad52-gapp-f(ttcaatcaattgaacaactatcaaaacacaatgtctttcgatgacgctgagc)与pprad52-aox1t-r(aggcaaatggcattctgacatcctcttgattaattcgaagctggagagttttcttttcct)经pcr扩增获得巴斯德毕赤酵母内源的kprad52基因序列,再经过重叠延伸pcr与启动子p
gap
和终止子t
aox1
相融合获得rad52蛋白的表达盒。随后同样通过pcr扩增的方式,获得巴斯德毕赤酵母his4基因上下游各1000bp的同源臂区域序列,再一次经过融合pcr方式获得完整的kprad52基因过表达donor dna,随后的转化与鉴定步骤与实例1相同,由此获得了过表达rad52蛋白进而增强同源重组的巴斯德毕赤酵母重组菌株。
99.在此基础上,敲除kpfaa1。工程菌株以甲醇为唯一碳源进行脂肪酸发酵性能检测,发酵条件与检测方法与本发明实例2一致,结果如图6所示。在pnsi-2位点单独过表达基因mmacl时,细胞质中乙酰辅酶a的合成途径得到加强,脂肪酸的产量较出发菌株提高了19.1%,达到206mg/l。在此基础上继续过表达基因kpidp2,一定程度弥补了细胞nadph的供应,脂肪酸的产量与pc115相比提升了24.3%。最后过表达来源酿酒酵母的柠檬酸转运蛋白scyhm2,增强了乙酰辅酶a上游步骤,并强化了细胞质与线粒体的柠檬酸转运与代谢过程,发酵过程重点时脂肪酸的产量达到了410mg/l,较上一步代谢改造获得了60.5%的提升,是出发菌株产量的2.4倍。
100.实施例4
101.毕赤酵母合成脂肪醇
102.(1)脂肪醇合成菌株的构建
103.实验室前期构建了高产脂肪醇的酿酒酵母(zhou et al.j.am.chem.soc.,2016,138(47):15368-15377.),在此基础上,我们选取脂肪醇合成途径的4个关键基因,醇脱氢酶基因scadh5、脂酰辅酶a还原酶基因facoar,羧酸还原酶基因mmcar以及辅因子基因annpga进行表达(图7),希望能够实现毕赤酵母中脂肪醇的合成。同时,将其中关键基因facoar(核苷酸序列如seq id no:13)、mmcar(核苷酸序列如seq id no:14)和npga(核苷酸序列如seq id no:15)进行了密码子优化。借助实验室前期构建的毕赤酵母crispr-cas9系统,首先敲除了巴斯德毕赤酵母的faa1基因,以实现脂肪酸的积累,敲除方法同实施例1。同样借鉴实验室前期研究基础,对基因kphfd1进行了无缝敲除,其催化脂肪醛到脂肪酸的逆向反应。敲除后能够有效阻止脂肪醛被重新氧化,增加脂肪醇合成的前体物质供给。因此在构建脂肪
醇通路前,首先对kphfd1基因进行敲除,获得重组底盘菌株。最后,将上述4个基因以完整表达盒整合至pnsi-2,pnsi-3,pnsi-4和pnsi-5位点,构建毕赤酵母内的脂肪醇合成途径。
104.(2)毕赤酵母的脂肪醇发酵实验
105.发酵方法与参数基本与实例2一致,获得了正确的重组菌株后首先在含有20g/l葡萄糖的基础成分培养基中进行了菌株脂肪醇生产的发酵分析,72h发酵终点取发酵液2ml进行分析。实验结果如图8所示,所构建的重组毕赤酵母菌株成功实现了脂肪醇的生物合成,主要的脂肪醇产物种类有c16-1-oh、c16-oh、c18-1-oh和c18-oh,其中c18-1-oh产量可以接近30mg/l,是产量最高的一种脂肪醇,而毕赤酵母总脂肪醇产量达到了76mg/l,为目前毕赤酵母中最高产量。
106.我们同样探索了重组毕赤酵母以甲醇为底物生产脂肪醇的潜力,在含有20g/l甲醇的基础成分培养基中进行了重组毕赤酵母菌株脂肪醇生产的发酵分析。实验结果如图9所示,所构建的重组毕赤酵母菌株同样成功实现了利用甲醇合成脂肪醇,主要的脂肪醇产物种类与葡萄糖培养条件相比,未检测到c16-1-oh,其余三种脂肪醇都能成功检测到。重组菌株甲醇为碳源时,脂肪醇总产量约为3mg/l。
107.实例5
108.毕赤酵母合成α-烯烃
109.长链(c12-c20)α-烯烃(long-chainα-alkene)是一类双键在分子链端部的单烯烃,是制备航空燃料、增塑剂、高性能合成润滑油、洗涤剂和香料等多种化工产品的重要原料。前期成功构建了高产脂肪酸的重组毕赤酵母菌株,该实施例进一步将脂肪酸转化为α-烯烃,拓展了毕赤酵母作为微生物细胞工厂的产物目录。实验室前期筛选到一个来源于pseudomonas fluorescens pf-5的脂肪酸脱羧酶基因pfundb,将其外源导入高产脂肪酸的酿酒酵母工程菌可以实现长链α-烯烃的生物合成(zhou et al.acs.synth.biol.,2018,7:584-590.)。
110.以前期构建的高产脂肪酸菌株pc101为出发菌株,过表达辅因子蛋白基因cama和camb,p
adh2
驱动表达整合至pnsi-3和pnsi-4位点,构建底盘细胞。脂肪酸脱羧酶基因pfundb、ppunda和jeolet由强启动子p
gap
驱动表达,分别整合至pnsi-5位点(如图10所示),筛选验证正确的重组菌株用于α-烯烃发酵检测实验。发酵条件同实施例2,在含有20g/l葡萄糖的基础成分培养基中,初始接种od为0.1,30℃,220rpm培养72h。发酵结束后取5ml发酵液,离心去上清后,用1ml ddh2o重悬后冻干。使用氯仿:甲醇=2:1作为萃取剂,添加1mg/l十六烷作为内标物,气相色谱检测α为烯烃产量。上清取2ml,加入1ml含1mg/l十六烷作为内标物的正己烷进行萃取,同样使用气相色谱进行产物分析。
111.实验结果如图11所示,表达了脂肪酸脱羧酶基因pfundb和其辅因子蛋白基因cama和camb的毕赤酵母菌株成功检测到α-烯烃的合成。由气相色谱分析结果显示,1-十五烯和1-十七烯的α七烯烃分别在18.4min和20.7min出峰,与标准品一致。接着对产物进行gc-ms检测,进一步验证该峰的确为目标产物。
112.由于α-烯烃的直接前体为脂肪酸,而过氧化物酶体是脂肪酸发生β氧化的主要场所之一,因此通过将α-烯烃的合成途径靶向至过氧化物酶体,有可能进一步提高α-烯烃的产量。通过在蛋白的c端加上短肽skl即可实现过氧化物酶体的定位表达。因此,本实验在辅因子蛋白与三种脂肪酸脱羧酶的c端通过gggs连接了skl定位短肽,构建了靶向过氧化物酶
体的α-烯烃合成途径,通过发酵检测可以发现,靶向过氧化酶体可以提升α-烯烃的产量,以pfundb为例,α-烯烃产量提升了两倍,达到2.5mg/l左右。此外,由于pfundb为膜嵌合蛋白,因此有部分产物被转运至胞外,而ppunda的重组菌发酵时,胞外未检测到产物α-烯烃的生成。三种脱羧酶中pfundb的催化效果最好。
113.该实例结果首次确定了毕赤酵母能够通过表达脂肪酸脱羧酶和辅因子蛋白实现α-烯烃的合成,并且验证了多种脂肪酸脱羧酶在毕赤酵母中都能发挥功能,为开发毕赤酵母作为高效微生物细胞工厂生产脂肪酸类衍生物探索了其可行性,奠定了实验基础。
114.以上所述,仅是本技术的几个实施例,并非对本技术做任何形式的限制,虽然本技术以较佳实施例揭示如上,然而并非用以限制本技术,任何熟悉本专业的技术人员,在不脱离本技术技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1