一种复制型人腺病毒及其应用的制作方法
1.本发明涉及基因治疗领域,特别涉及重组溶瘤腺病毒、用于制备重组溶瘤腺病毒的重组溶瘤腺病毒载体及其应用。
背景技术:
2.癌症由自身因素(遗传基因突变,自然衰老等)或环境因素(如吸烟,紫外辐射,化学物质,病毒感染等)引起。根据who报道,肿瘤目前已经是继心血管疾病的世界第二大死因,全球有近1/6的死亡是由癌症造成的。2018年全球癌症死亡人数达960万。预计到2025年,全球每年新增癌症病例数将高达2449万例。其中,肺癌的死亡人数最多,随后是结直肠癌,胃癌,肝癌和乳腺癌。
3.治疗癌症的经典方法主要是手术,化学疗法,和放射性疗法。手术切除效果有限,对转移癌细胞没有作用;放疗和化疗副作用大,尽管靶点药物在很大程度上改善了患者生活质量,但耐受性是化疗一直面临的一个难题。近年来,免疫疗法已成为癌症治疗领域的热点。免疫疗法的原理是通过激活机体自身的免疫系统来消灭肿瘤细胞,具有疗效好,副作用小和防止复发等优点。
4.近几年溶瘤病毒在癌症治疗领域又重新兴起。溶瘤病毒(oncolytic virus),是一类具有复制能力,能够直接裂解肿瘤细胞的病毒。早在1912年,意大利医生就发现一名子宫颈癌患者在感染狂犬病病毒后肿瘤随之消退。2005年中国批准了世界上第一个溶瘤腺病毒(h101)上市,但临床疗效目前还未得到国际认可。该病毒敲除了e1b-55k和e3区大部分基因。e1b-55k蛋白能够抑制抗癌基因p53的表达,阻止p53介导的感染细胞的凋亡。由于正常的细胞中的p53蛋白功能完好,而大部分肿瘤丧失p53功能,因此,e1b-55k基因的删除使病毒能特异性在缺乏有功能的p53的肿瘤细胞内复制。然而,e1b-55k蛋白是病毒mrna从细胞核输出必需的蛋白,因此,h101复制能力和溶瘤能力比野生毒株明显减弱。2015年,fda批准了第一个溶瘤病毒疗法t-vec(单纯疱疹病毒-1)用于治疗手术切除后复发的黑色素瘤。作为第三代溶瘤病毒,t-vec删除了γ34.5基因,使其具有肿瘤细胞靶向性,同时它还携带了gm-csf(粒细胞-巨噬细胞集落因子)增强抗肿瘤免疫能力。
5.溶瘤病毒是免疫疗法的一个重要分支,其可以通过多种不同的作用途径杀伤肿瘤细胞,并破坏肿瘤免疫抑制的微环境诱导长期的肿瘤特异性免疫反应,同时还可以通过携带治疗基因使其在肿瘤细胞中特异地,长时间地表达,从而增强抗肿瘤疗效。另外,溶瘤病毒与其他抗癌药物的联合用药的实验结果如联合免疫检查点抑制剂等方面都显现出良好的抗肿瘤效果。近年来,许多病毒包括痘苗病毒、呼肠孤病毒、麻疹病毒、单纯疱疹病毒、新城疫病毒以及柯萨奇病毒已经作为溶瘤剂进行了临床试验。
6.腺病毒(adenovirus)是一种没有包膜的直径为70~90nm的颗粒,由252个壳粒呈廿面体排列构成。每个壳粒的直径为7~9nm。衣壳里是线状双链dna分子,约含4.7kb,两端各有长约100~600bp的反向末端重复序列。人腺病毒(human adenoviruses,hadv)属于腺病毒科(adenoviridae),根据免疫学、生物学、生物化学特性不同,将其分为a~g7个亚种,
共有52个血清型,不同的血清型有不同的器官亲和性并引起相应的临床表现。腺病毒侵入宿主细胞后至少能引起3种感染:慢性、潜伏性感染:常在淋巴细胞内发生,潜伏感染时外放的病毒量极少,细胞坏死也不明显,故临床上感染不明显,潜伏感染的机制尚不清楚。溶解性感染:病毒在细胞内如人类上皮细胞中经历复制过程,通过溶解细胞作用使细胞死亡。肿瘤样变异:此时病毒繁殖只进行最初几步,然后腺病毒dna与细胞dna整合并复制,但不产生感染性病毒,腺病毒抗原性较稳定。
7.周立,何婉婉,朱桢楠,et al.溶瘤腺病毒靶向癌症治疗的临床研究进展[j].中国生物工程杂志,2013,33(12):105-113.指出,溶瘤腺病毒能够特异性地感染肿瘤细胞并在肿瘤细胞中完成感染-复制周期,从而特异性地杀伤和裂解肿瘤细胞但不损伤其他正常细胞和组织,因此成为目前最具研究前景的抗肿瘤药物之一。不同的病毒有着复杂的生物学特性,而目前人类完全熟悉的病毒资源仍旧比较匮乏。尤其大多临床前实验资料均是来自免疫缺陷动物体内人肿瘤移植模型,与人在体内环境、组织细胞的生物学特性等方面都存在很大差异。已有的溶瘤腺病毒之间并无明显的共性,难以基于腺病毒的序列确定其是否具有溶瘤效果,但大多数腺病毒对肿瘤细胞不敏感,不具有溶瘤的特性。
技术实现要素:
[0008]
本发明的目的在于克服现有技术中的至少一种不足,提供一种溶瘤腺病毒载体及其应用。
[0009]
本发明所采取的技术方案是:
[0010]
本发明的第一个方面,提供:
[0011]
一种复制型人腺病毒,其全序列如seq id no.:21所示,其中的抗性筛选基因可使用公知的筛选基因替换。
[0012]
在一些实例中,所述复制型人腺病毒的全序列如seq id no.:21所示。
[0013]
在一些实例中,所述病毒的e1区和e3区被删除。
[0014]
在一些实例中,所述病毒可在动物细胞、人源细胞或人体内复制。
[0015]
在一些实例中,所述复制型人腺病毒的构建方法包括:
[0016]
s1)pcr扩增获得nbov1901基因组的左右两端,连接在抗性载体质粒a得到pt-nbov1901(l+r),线性化后与nbov1901基因组重组得到基因组质粒pnbov1901;
[0017]
s2)pcr扩增获得从srfi至整个e3区左右臂连接至抗性载体质粒b上,线性化后与paci酶切的nbov1901进行重组,得到去除srfi至整个e3区的基因组质粒pnbov1901
△
e3-srfi;
[0018]
s3)以nbov1901基因组为模板,pcr扩增获得e3gp19k上游片段:srfi至e3gp19k,和e3gp19k下游片段:e3gp19k至e3区包含e3-14.7k基因片段,将e3gp19k上游片段、e3gp19k下游片段和酶切后的构建载体三个片段重组连接至pnbov1901
△
e3-srfi左右臂之间,线性化后与pnbov1901
△
e3-srfi进行重组,得到修改了srfi酶切位点的基因组质粒pnbov1901
△
e3gp19k;
[0019]
s4)pcr扩增获得e1区左右臂连接至抗性载体质粒b上,线性化后与srfi酶切的pnbov1901
△
e3gp19k重组,得到去除e1区的基因组质粒pnbov1901
△
e3gp19k
△
e1;
[0020]
s5)pcr扩增获得去除e1b19k、prb基因的e1区基因组,连接至含有e1区左右臂的抗
性载体质粒b上,线性化后与酶切后的pnbov1901
△
e3gp19k
△
e1进行重组,得到敲除e1b19k、prb基因的基因组质粒pnbov1910,即所述复制型人腺病毒。
[0021]
在一些实例中,抗性载体质粒a和抗性载体质粒b具有不同的抗性。
[0022]
在一些实例中,抗性载体质粒a和抗性载体质粒b独立选自氨苄抗性载体质粒或卡那霉素抗性载体质粒。这些抗性质粒更为成熟,易于获得,同时筛选成本也更低。
[0023]
在一些实例中,包括:
[0024]
s1)pcr扩增获得nbov1901基因组的左右两端,连接在氨苄抗性载体质粒得到pt-nbov1901(l+r),线性化后与nbov1901基因组重组得到基因组质粒pnbov1901;
[0025]
s2)pcr扩增获得从srfi至整个e3区左右臂,连接至卡那霉素抗性载体质粒上,线性化后与paci酶切的nbov1901进行重组,得到去除srfi至整个e3区的基因组质粒pnbov1901
△
e3-srfi;
[0026]
s3)以nbov1901基因组为模板,pcr扩增获得e3gp19k上游片段:srfi至e3gp19k,和e3gp19k下游片段:e3gp19k至e3区包含e3-14.7k基因片段,将e3gp19k上游片段、e3gp19k下游片段和酶切后的构建载体三个片段重组连接至pnbov1901
△
e3-srfi左右臂之间,线性化后与pnbov1901
△
e3-srfi进行重组,得到修改了srfi酶切位点的基因组质粒pnbov1901
△
e3gp19k;
[0027]
s4)pcr扩增获得e1区左右臂,连接至卡那霉素抗性载体质粒上,线性化后与srfi酶切的pnbov1901
△
e3gp19k重组,得到去除e1区的基因组质粒pnbov1901
△
e3gp19k
△
e1;
[0028]
s5)pcr扩增获得去除e1b19k、prb基因的e1区基因组,连接至含有e1区左右臂的卡那霉素抗性载体质粒上,线性化后与酶切后的pnbov1901
△
e3gp19k
△
e1进行重组,得到敲除e1b19k、prb基因的基因组质粒pnbov1910。
[0029]
本发明的第二个方面,提供:
[0030]
本发明第一个方面所述复制型人腺病毒作为重组溶瘤病毒载体的应用。
[0031]
在一些实例中,所述重组溶瘤病毒载体负载有表达以下分子的核酸序列:
[0032]
对肿瘤具有治疗效果的分子;
[0033]
生物学报告示踪分子。
[0034]
在一些实例中,所述对肿瘤具有治疗效果的分子选自肿瘤抑制因子、肿瘤杀伤因子、肿瘤微环境调节因子、肿瘤细胞表面特异性结合因子;
[0035]
所述生物学报告示踪分子选自β-半乳糖苷酶、分泌型碱性磷酸酶、绿色荧光蛋白、荧光素酶。
[0036]
在一些实例中,所述重组溶瘤病毒载体还负载有表达肿瘤特异性识别因子的核酸序列。
[0037]
在一些实例中,所述肿瘤特异性识别因子选自肿瘤表位特异性识别因子、肿瘤细胞选择性复制因子。
[0038]
这些分子或序列可是本领域技术人员已知的。
[0039]
在一些实例中,所述肿瘤选自肺癌、肝癌,胃癌、结直肠癌、胰腺癌、卵巢癌。
[0040]
在一些实例中,所述载体的原e1区和e3区的至少一个区域用于整合外源基因。
[0041]
本发明的第三个方面,提供:
[0042]
一种组合物,该组合物中含有本发明第一个方面所述的复制型人腺病毒。
[0043]
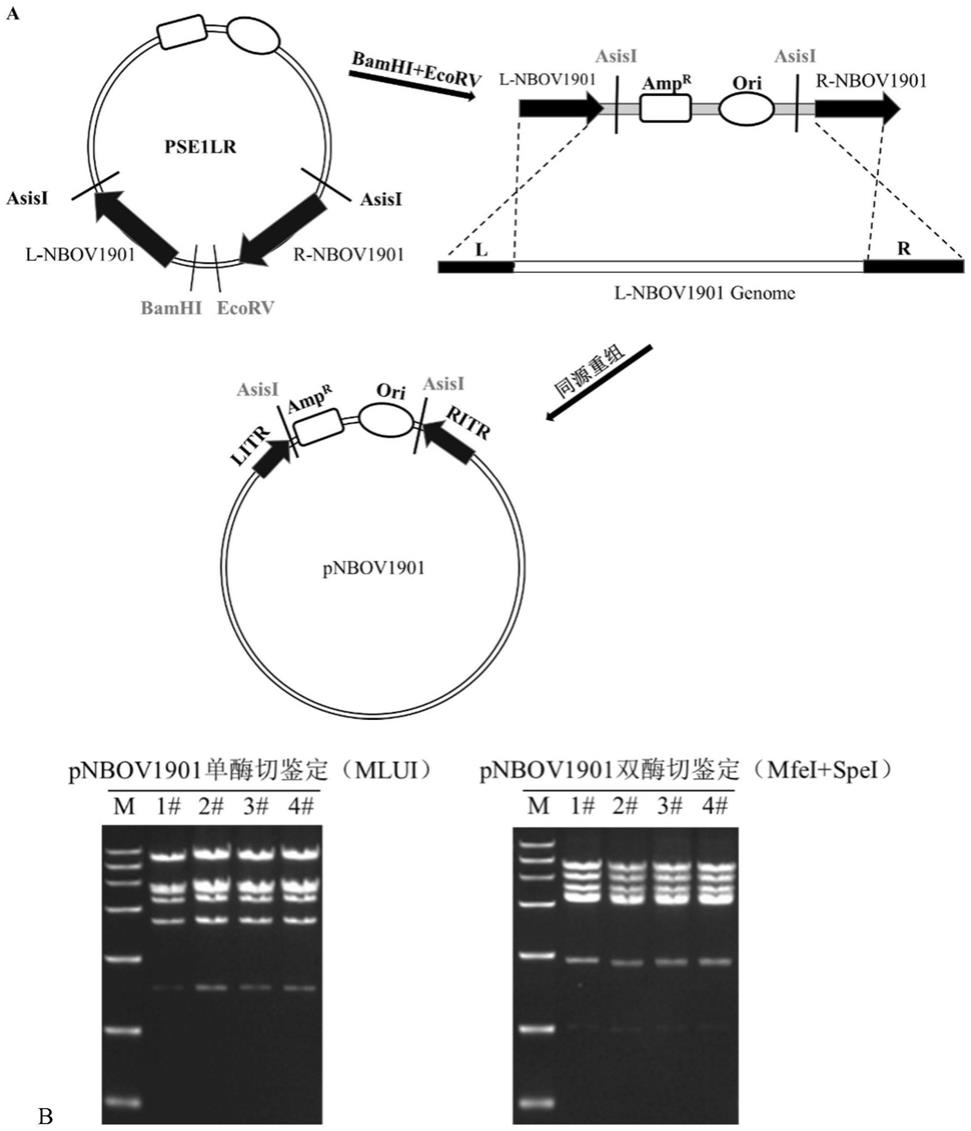
在一些实例中,所述组合物中包括:a)免疫调控剂;b)免疫调控细胞;c)放射性治疗物;d)光疗法化合物;或e)化学治疗化合物中的至少一种。
[0044]
在一些实例中,述组合物中还含有药学上可接受的佐剂、稀释剂或赋形剂。
[0045]
本发明的第四个方面,提供:
[0046]
一种溶瘤制剂,包括本发明第一个方面所述的复制型人腺病毒。
[0047]
在一些实例中,所述复制型人腺病毒负载有表达以下分子的核酸序列:
[0048]
对肿瘤具有治疗效果的分子;
[0049]
生物学报告示踪分子。
[0050]
在一些实例中,所述对肿瘤具有治疗效果的分子选自肿瘤抑制因子、肿瘤杀伤因子、肿瘤微环境调节因子、肿瘤细胞表面特异性结合因子;
[0051]
所述生物学报告示踪分子选自β-半乳糖苷酶、分泌型碱性磷酸酶、绿色荧光蛋白、荧光素酶。
[0052]
在一些实例中,所述重组溶瘤病毒载体还负载有表达肿瘤特异性识别因子的核酸序列。
[0053]
在一些实例中,所述肿瘤特异性识别因子选自肿瘤表位特异性识别因子、肿瘤细胞选择性复制因子。
[0054]
在一些实例中,所述肿瘤选自肺癌、肝癌,胃癌、结直肠癌、胰腺癌、卵巢癌。
[0055]
本发明的第五个方面,提供:
[0056]
组合物在制备预防或治疗肿瘤或肿瘤检测制剂中的应用,所述组合物如本发明第三个方面所述。
[0057]
在一些实例中,所述肿瘤选自乳腺癌、脑癌、肺癌、鼻咽癌、头颈癌、肾癌、膀胱癌、肝癌、食道癌、胃癌、结直肠癌、胰腺癌、卵巢癌、皮肤癌、前列腺癌、输卵管癌、尿道癌、泌尿生殖系统癌、子宫内膜异位症、宫颈癌、骨癌或癌症的转移性病变。
[0058]
本发明的有益效果是:
[0059]
本发明一些实例所述的复制型人腺病毒,在负载相关核酸序列后,可以直接注射于实体肿瘤,包括但不限于h1299,还包括skov-3、u251等肿瘤后,经鉴定,该腺病毒不仅可以在肿瘤细胞中复制并直接杀死肿瘤细胞,在所感染肿瘤细胞裂解后感染其周围肿瘤细胞;同时对正常人体细胞没有杀伤作用,具有意料之外的溶瘤效果。
[0060]
本发明一些实例所述的复制型人腺病毒对于多种肿瘤细胞h1299、u251、skov-3等具有双重靶向性。
附图说明
[0061]
图1是利用同源重组对nbov1901的基因组环化的原理(a),及pnbov1901的酶切鉴定结果(b);
[0062]
图2是敲除nbov1901从srfi至整个e3区基因组原理图(a),及pnbov1901
△
e3-srfi的pcr和酶切鉴定结果(b);
[0063]
图3是敲除nbov1901e3gp19k基因原理图(a)及pnbov1901
△
e3gp19k酶切结果(b);
[0064]
图4是敲除nbov1901e1基因原理图(a)及pnbov1901
△
e3gp19k的pcr及酶切鉴定结果(b);
[0065]
图5是敲除nbov1901e1b19k、prb基因原理图(a)及pnbov1910酶切结果(b);
[0066]
图6是复制型腺病毒nbov1901重组腺病毒的生产及纯化结果;
[0067]
图7是复制型腺病毒nbov1901重组腺病毒在各种肿瘤细胞双向筛选结果;
[0068]
图8是复制型腺病毒nbov1901重组腺病毒非核心区域改造对h1299细胞溶瘤效果影响;
[0069]
图9是复制型腺病毒nbov1901重组腺病毒在h1299小鼠肿瘤模型上的实验结果;
[0070]
图10是现有溶瘤腺病毒的溶瘤作用。
[0071]
图1~5中,m代表15000bp dna marker。
具体实施方式
[0072]
本发明的新型腺病毒载体pnbov1901改造自从人的咽拭子样品中分离到的一株腺病毒nbov1901(全序列的genbank:mh558113.1)。nbov1901不同于目前已报道的腺病毒,为一种新型人腺病毒。腺病毒的e1a基因是病毒调节细胞周期的必需基因,通过e1a基因上cr2结合位点与细胞的rb蛋白结合,使细胞周期由g1期进入s期。本发明的肿瘤靶向性腺病毒载体pnbov1910,删除了e1a-cr2,使得该病毒的e1a不能与宿主细胞的rb蛋白结合。因此,pnbov1910只能选择性地在处于分裂期的细胞如肿瘤细胞中复制而不在正常细胞中复制,从而增加溶瘤的特异性和安全性。
[0073]
腺病毒的e1b19k与细胞bcl-2基因同源,可以通过与beclin-1结合,抑制细胞凋亡。而e3gp19k蛋白可以在内质网上与mhc i类分子的重链结合阻止其转运到细胞表面,并且可以延缓mhc i的表达。因此,删除这两个基因能够提高病毒的肿瘤选择性及在肿瘤中的扩散能力,并激活宿主免疫反应,从而增强疫毒对肿瘤细胞的杀伤能力。
[0074]
本腺病毒转录单位编码一系列具有相关功能的多肽,e1a单元编码两种主要蛋白质,它们激活转录并诱导宿主细胞进入细胞周期的s期;e1b编码两种阻断细胞凋亡的蛋白质;e2编码三种直接参与dna复制的蛋白质;e3编码调节宿主对感染的反应的产物;较晚的mrnas家族与衣壳成分的生产和组装有关。e4产物介导转录、rna剪接和翻译调节;mrna核输出并调节dna复制和凋亡。e1b19k和e3的删除不会影响腺病毒的复制并且可以为外源基因的插入腾出空间
[0075]
一种复制型腺病毒载体pnbov1901,由如下方法制备得到:将nbov1901基因组环化,敲除e3gp19k、e1b19k、prb基因得到。
[0076]
在一些实例中,在腺病毒质粒中引入编码rgd肽的基因,构成靶向性骨架质粒。
[0077]
一种复制型人nbov1901型溶瘤腺病毒载体制备方法,包含如下步骤:
[0078]
s1)pcr扩增获得nbov1901基因组的左右两端,连接在氨苄抗性载体质粒得到pt-nbov1901(l+r),线性化后与nbov1901基因组重组得到基因组质粒pnbov1901;
[0079]
s2)pcr扩增获得从srfi至整个e3区左右臂,连接至卡那霉素抗性载体质粒上,线性化后与paci酶切的nbov1901进行重组,得到去除srfi至整个e3区的基因组质粒pnbov1901
△
e3-srfi;
[0080]
s3)以nbov1901基因组为模板,pcr扩增获得e3gp19k上游片段:srfi至e3gp19k,和e3gp19k下游片段:e3gp19k至e3区包含e3-14.7k基因片段,将e3gp19k上游片段、e3gp19k下游片段和酶切后的构建载体三个片段重组连接至pnbov1901
△
e3-srfi左右臂之间,线性化
后与pnbov1901
△
e3-srfi进行重组,得到修改了srfi酶切位点的基因组质粒pnbov1901
△
e3gp19k;
[0081]
s4)pcr扩增获得e1区左右臂,连接至卡那霉素抗性载体质粒上,线性化后与srfi酶切的pnbov1901
△
e3gp19k重组,得到去除e1区的基因组质粒pnbov1901
△
e3gp19k
△
e1;
[0082]
s5)pcr扩增获得去除e1b19k、prb基因的e1区基因组,连接至含有e1区左右臂的卡那霉素抗性载体质粒上,线性化后与酶切后的pnbov1901
△
e3gp19k
△
e1进行重组,得到敲除e1b19k、prb基因的基因组质粒pnbov1910。
[0083]
氨苄抗性载体质粒、卡那霉素抗性载体质粒也可以使用其他周知的筛选质粒替换,只要可以实现产物的有效分离即可。
[0084]
在一些实例中,步骤s1的具体方法为:
[0085]
以nbov1901基因组为模板,pcr扩增得到nbov1901基因组左右两端l-nbov1901和r-nbov1901作为重组臂连接到线性化的t载体上,得到pt-nbov1901(l+r),同时在pt-nbov1901(l+r)的左右臂之间引入了ecori、bamhi作为酶切位点,ecori+bamhi双酶切pt-nbov1901(l+r)线性化后与nbov1901基因组重组,得到pnbov1901。
[0086]
进一步的,在一些实例中,步骤s1的具体方法为:
[0087]
以nbov1901基因组为模板,pcr扩增得到nbov1901基因组左右两端l-nbov1901和r-nbov1901,使用exnase重组酶将l-nbov1901和r-nbov1901和线性化的t载体进行三片段重组得到pt-nbov1901(l+r),同时在pt-nbov1901(l+r)的左右臂之间引入了ecori、bamhi作为酶切位点,pt-nbov1901(l+r)用ecori+bamhi双酶切线性化后与nbov1901基因组重组,得到pnbov1901。
[0088]
在一些实例中,步骤s2的具体方法为:
[0089]
以nbov1901基因组为模板,pcr扩增获得从srfi至整个e3区左右臂基因l-δe3-srfi及r-δe3-srfi,连接到线性化的t载体上,得到pt-δe3-srfi(l+r),线性化后与经过paci酶切的pnbov1901基因组进行重组,得到敲除δe3-srfi同时在δe3-srfi位置引入唯一的酶切位点paci的基因组质粒pnbov1901
△
e3-srfi。
[0090]
进一步的,在一些实例中,步骤s2的具体方法为:
[0091]
以nbov1901基因组为模板,pcr扩增获得e3-srfi区左右两端同源臂l
-△
e3-srfi和r
-△
e3-srfi,使用exnase重组酶进行三片段连接得到pvax
-△
e3-srfi。线性化后与paci酶切线性化的pnbov1901同源重组,经氨苄抗性筛选后得到敲除e3-srfi区基因同时引入唯一的线性化酶切位点swai的质粒pnbov1901
△
e3-srfi。
[0092]
在一些实例中,步骤s3的具体方法为:
[0093]
以nbov1901基因组为模板,pcr扩增获得e3gp19k上游片段(srfi至e3gp19k)和e3gp19k下游片段(e3gp19k至e3区,包含e3-14.7k基因片段),exnase重组酶三片段重组连接到pvax-δe3-srfi(l+r)左右臂之间,得到pvax-δe3gp19k载体质粒,线性化后与paci酶切的pnbov1901
△
e3-srfi基因组质粒进行同源重组,经氨苄抗性基因筛选得到敲除e3gp19k的pnbov1901
△
e3gp19k基因组质粒。
[0094]
在一些实例中,步骤s4的具体方法为:
[0095]
以nbov1901基因组为模板,pcr扩增得到e1基因同源重组臂l-δe1及r-δe1,连接到线性化的t载体上,得到pvax-δe1(l+r),线性化后与srfi酶切的pnbov1901δe3gp19k同
nbov1901)和右臂(r-nbov1901)。
[0110]
l-nbov1901引物:
[0111]
l-nbov1901-f:gcgggatccgaattcttaatgcgatcgccatcatcaataatataccttat(seq id no.:1)
[0112]
l-nbov1901-r:tatctgcatgagcatgatgatatcctttgacccggaacgcgg(seq id no.:2)
[0113]
pcr条件:95℃,3min;95℃,30s;60℃30s;72℃,30s;cycles 28;72℃,5min;12℃保存。
[0114]
r-nbov1901引物:
[0115]
r-nbov1901-f:ccgcgttccgggtcaaaggatatcatcatgctcatgcagata(seq id no.:3)
[0116]
r-nbov1901-r:gaagcgagatcgaattcttagcgatcgccatcatcaataaatacctta(seq id no.:4)
[0117]
pcr条件:95℃,3min;95℃,30s;60℃30s;72℃,1min;cycles 28;72℃,5min;12℃保存。
[0118]
2.构建pnbov1901。
[0119]
pt-nbov1901(l+r)使用ecori+bamhi进行酶切线性化,然后和nbov1901的基因组共转化bj5183感受态细胞进行重组,氨苄抗性平板进行抗性筛选,将筛选得到单克隆扩增后提取其质粒转化xl感受态细胞,提取质粒得到pnbov1901,使用不同的酶切方式进行鉴定(图1b),pnbov1901在基因组的两侧引入了两个asisi酶切位点,方便后续对改造后的nbov1901的基因组进行线性化进行病毒拯救。
[0120]
实施例2:srfi至e3区基因的敲除,构建pnbov1901δe3_srfi质粒的构建
[0121]
1.构建srfi至e3区基因敲除的穿梭质粒pvax-δe3_srfi(l+r)。
[0122]
参照图2a,以nbov1901的基因组为模板,pcr获得srfi至e3区基因的左臂(l-δe3_srfi)和右臂(r-δe3_srfi)。
[0123]
l-δe3_srfi引物:
[0124]
l-δe3_srfi-f:gatatacgcgtgtatac cttcccaggatggcaccca(seq id no.:5)
[0125]
l-δe3_srfi-r:gtaagtaatttattgtgtgtttatg ttaattaa ctgtgtgaccgctgctgt(seq id no.:6)
[0126]
pcr条件:95℃,3min;95℃,30s;60℃30s;72℃,30s;cycles 28;72℃,5min;12℃保存。
[0127]
r-δe3引物:
[0128]
r-δe3_srfi-f:acagcagcggtcacacag ttaattaa cataaacacacaataaattacttac(seq id no.:7)
[0129]
r-δe3_srfi-r:ccgcccagtagaagcgccggtg ccgcccgttttaatttccatgtt(seq id no.:8)
[0130]
pcr条件:95℃,3min;95℃,30s;60℃30s;72℃,50s;cycles 28;72℃,5min;12℃保存。
[0131]
l-δe3_srfi、r-δe3_srfi和bstz17i+sgrai双酶切pvax载体获得的质粒骨架使用exnase酶进行三片段连接得到pvax-δe3_srfi(l+r)。
[0132]
2.构建pnbov1901δe3_srfi
[0133]
pvax-δe3_srfi(l+r)使用bstz17i+sgrai双酶切,pnbov1901使用paci进行酶切,将两者酶切回收的片段共转化bj5183感受态细胞进行重组,用氨苄抗性平板进行抗性筛选,将筛选得到单克隆扩增后提取其质粒转化xl感受态细胞,提取质粒得到pnbov1901δe3_srfi,使用不同的酶切方式进行鉴定(图2b),pnbov1901δe3_srfi在敲除基因区引入唯一酶切位点paci,方便后续克隆操作。
[0134]
实施例3:构建pnbov1901δe3gp19k质粒
[0135]
1.构建敲除e3gp19k的穿梭载体pvax
-△
e3gp19k。
[0136]
参照图3a,以nbov1901基因组为模板,pcr扩增获得除e3gp19k外从srfi(位点)至整个e3区基因片段。
[0137]
e3gp19k上游片段p1-e3-srfi
△
e3gp19k:
[0138]
e3gp19k-f1:gtcacagggtgcggtcgccaggacagggtataactcacct(seq id no.:9)
[0139]
e3gp19k-r1:ggaatacaagcaagcggaaaa tcatcttggatgtcgcccccag(seq id no.:10)
[0140]
pcr条件:95℃,3min;95℃,30s;60℃30s;72℃,30s;cycles 28;72℃,5min;12℃保存。
[0141]
e3gp19k下游片段p2-e3-srfi
△
e3gp19k;
[0142]
e3gp19k-f2:ctgggggcgacatccaagatga ttttccgcttgcttgtattcc(seq id no.:11)
[0143]
e3gp19k-r2:ccgcccagtagaagcgccggtg ccgcccgttttaatttccatgtt(seq id no.:8)
[0144]
p1-e3-srfi
△
e3gp19k、p2-e3-srfi
△
e3gp19k和paci酶切后的pvax
-△
e3-srfi(l+r)使用exnase酶进行三片段连接得到pvax
-△
e3gp19k。
[0145]
2.构建pnbov1901δe3gp19k质粒
[0146]
pvax
-△
e3gp19k使用bstz17i+sgrai双酶切,pnbov1901δe3_srfi使用paci进行酶切,将两者酶切回收的片段共转化bj5183感受态细胞进行重组,用氨苄抗性平板进行抗性筛选,将筛选得到单克隆扩增后提取其质粒转化xl感受态细胞,提取质粒得到pvax
-△
e3gp19k,使用不同的酶切方式进行鉴定(图3b)。
[0147]
实施例4:构建pnbov1901
△
e3gp19k
△
e1质粒
[0148]
1.构建敲除e1区基因的穿梭载体pvax
-△
e3gp19k
△
e1(l+r)。
[0149]
参照图4a,以nbov1901基因组为模板,pcr扩增得到e1基因同源重组臂l-δe1及r-δe1。
[0150]
l-δe1引物:
[0151]
l-δe1-fw:cagatatacgcgtgtataccatcatcaataatatacct(seq id no.:12)
[0152]
l-δe1-rw:agacagcaagacacttgctatcgatttttagtcccggtgttgga(seq id no.:13)
[0153]
pcr条件:95℃,3min;95℃,30s;60℃30s;72℃,30s;cycles 28;72℃,5min;12℃保存。
[0154]
r-δe1引物:
[0155]
r-δe1-fw:tccaacaccgggactaaaaatcgatagcaagtgtcttgctgtct(seq id no.:14)
[0156]
r-δe1-rw:gcccagtagaagcgccggtggaattcatctgaactcaaagcgtg(seq id no.:15)
[0157]
pcr条件:95℃,3min;95℃,30s;60℃30s;72℃,30s;cycles 28;72℃,5min;12℃保存。
[0158]
m-δe1、r-δe1和bstz17i+sgrai双酶切pvax载体获得的质粒骨架使用exnase酶进行三片段连接得到pvax
-△
e3gp19k
△
e1(l+r)。
[0159]
2.构建pnbov1901
△
e3gp19k
△
e1。
[0160]
pvax
-△
e3gp19k
△
e1(l+r)使用bstz17i+sgrai双酶切,p nbov1901δe3gp19k使用srfi进行酶切,将两者酶切回收的片段共转化bj5183感受态细胞进行重组,用氨苄抗性平板进行抗性筛选,将筛选得到单克隆扩增后提取其质粒转化xl感受态细胞,提取质粒得到pnbov1901
△
e3gp19k
△
e1,使用不同的酶切方式进行鉴定(图4b),pnbov1901
△
e3gp19k
△
e1在敲除基因区引入唯一酶切位点srfi,方便后续克隆操作。
[0161]
实施例5:构建载体pnbov1901
△
e3gp19k
△
e1b19k_prb,即pnbov1910
[0162]
1.构建敲除e1b19k、prb基因的穿梭载体穿梭载体pvax
-△
e1b19k_prb。
[0163]
参照图5a,以nbov1901基因组为模板,pcr扩增获得缺失e1b19k、prb基因的e1区基因。
[0164]
p1
-△
e1b19k_prb引物:
[0165]
p1
-△
e1b19k_prb-fw:caacaccgggactaaaaatgagacatattatctgcc(seq id no.:16)
[0166]
p1
-△
e1b19k_prb-rw:atcctcgtcgtcactgggtgg atcgaccacctccggtacaa(seq id no.:17)
[0167]
pcr条件:95℃,3min;95℃,30s;60℃30s;72℃,30s;cycles 28;72℃,5min;12℃保存。
[0168]
p2
-△
e1b19k_prb引物:
[0169]
p2
-△
e1b19k_prb-fw:ttgtaccggaggtggtcgat ccacccagtgacgacgaggat(seq id no.:18)
[0170]
p2
-△
e1b19k_prb-rw:gatgggtttcttcgctccat gaggtcaaatgtaaccaaga(seq id no.:19)
[0171]
pcr条件:95℃,3min;95℃,30s;60℃30s;72℃,30s;cycles 28;72℃,5min;12℃保存。
[0172]
p3
-△
e1b19k_prb引物:
[0173]
p3
-△
e1b19k_prb-fw:tcttggttacatttgacctc atggagcgaagaaacccatc(seq id no.:20)
[0174]
p3
-△
e1b19k_prb-rw:tcttggttacatttgacctc atggagcgaagaaacccatc(seq id no.:20)
[0175]
pcr条件:95℃,3min;95℃,30s;60℃30s;72℃,30s;cycles 28;72℃,5min;12℃保存。
[0176]
p1
-△
e1b19k_prb、p2
-△
e1b19k_prb、p3
-△
e1b19k_prb和srfi酶切后的pvax
-△
e1(l+r)使用exnase酶进行四片段连接得到pvax
-△
e1b19k_prb。
[0177]
2.构建pnbov1901
△
e3gp19k
△
e1b19k_prb
[0178]
pvax
-△
e1b19k_prb使用bstz17i+sgrai双酶切,pnbov1901δe3gp19kδe1使用
srfi进行酶切,将两者酶切回收的片段共转化bj5183感受态细胞进行重组,用氨苄抗性平板进行抗性筛选,将筛选得到单克隆扩增后提取其质粒转化xl感受态细胞,提取质粒得到pnbov1910,使用不同的酶切方式进行鉴定(图5b)。
[0179]
经测序,pnbov1910如seq id no.:21所示。
[0180]
实施例6:复制型腺病毒nbov1901重组腺病毒的生产及纯化结果
[0181]
pnbov1910用asisi线性化后进行病毒拯救,拯救出毒以后逐步扩大培养,在对毒种进行pcr和酶切鉴定确认后进行大扩培养,收集细胞,cscl密度梯度离心纯化病毒,结果如图6所示,收集得到的病毒,-80度保存。从图中可以看出,pnbov1910保留了复制型腺病毒nbov1901生产性能,复制能力未有减弱。
[0182]
实施例7:不同剂量nbov1910、nbov1901在h1299等肿瘤细胞溶瘤效果
[0183]
对数生长期的各肿瘤细胞铺板5*10^3cell/well,培养24h,每孔病毒量tcid50分别为1250、250、50、10、2、0梯度进行病毒稀释,稀释后每孔添加100μl感染细胞孵育1h,培养24-72小时(72hpi)或96hpi测定肿瘤细胞杀伤效果。
[0184]
实验结果如图7所示。接毒72h后cck-8检测结果,结果显示随着病毒浓度的增加对肿瘤细胞杀伤作用更强。改造得到的nbov1910具有良好的溶瘤效果,在某些剂量区间具有更好的溶瘤效果。
[0185]
实施例8:不同剂量nbov1901δe3δe1b19k_prb、nbov1910、nbov1901在h1299肿瘤细胞溶瘤效果
[0186]
对数生长期的各肿瘤细胞铺板5
×
10^3cell/well,培养24h,每孔病毒量tcid50分别为1250、250、50、10、2、0梯度进行病毒稀释,稀释后每孔添加100μl感染细胞孵育1h,培养72小时(72hpi)或96hpi测定肿瘤细胞杀伤效果。
[0187]
图8为接毒72h后cck-8检测结果,结果显示复制型溶瘤腺病毒nbov1901可变区的改造不影响其溶瘤效果。
[0188]
实施例9:nbov1910、nbov1901小鼠体内抗肿瘤效果
[0189]
用balb/c_nude小鼠模型,在5-6周龄的balb/c_nude小鼠大腿与背腹部交界或前腿后肋下皮肤松弛处接种5
×
10^6cell的h1299细胞。当肿瘤生长到200mm3时,用1
×
10
11
vp病毒在瘤内注射分别注射pbs、nbov1910和nbov1901,然后观察肿瘤大小和肿瘤清除率。
[0190]
实验结果如图9所示,说明治疗组nbov1910、nbov01能够显著抑制肿瘤生长,具有治疗肿瘤的潜力。
[0191]
图10是现有溶瘤腺病毒的溶瘤作用(参见taki m,kagawa s,nishizaki m,et al.enhanced oncolysis by a tropism-modified telomerase-specific replication-selective adenoviral agent obp-405(
‘
telomelysin-rgd’)[j].oncogene,2005,24(19):3130-3140.),可见nbov1910、nbov1901在非小细胞肺癌细胞具有更好的效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1