一种高稳定性类Fab抗体及其制备方法和应用
一种高稳定性类fab抗体及其制备方法和应用
技术领域
1.本发明属于生物技术领域,具体涉及类fab抗体片段或抗原结合片段、分离的vh-ch3多肽、vl-ch3多肽,以及构建上述类fab抗体片段或抗原结合片段、vh-ch3多肽、vl-ch3多肽的方法,所需的核酸、质粒、宿主细胞,相应的药用组合物及其应用。
背景技术:
2.现有技术公开了单抗药物具有靶向性强、疗效显著及毒副作用低等特点,在多种疾病治疗上显示了极好的疗效与广阔的应用前景。相对于癌症治疗与免疫性疾病治疗,单抗药物在其它一些种类疾病的治疗领域中的开发与应用相对较缓慢。其中主要是因为全长的单抗igg分子量过大(约150kd),从而导致其在一些临床应用时存在显著的缺陷,如,首先,分子量过大造成组织渗透性较差,影响治疗效果;其次,无法达到一些具有空间位阻的靶点;更重要的是,大分子量导致单抗药物生产成本高、价格昂贵,严重阻碍了其在抗病毒治疗等疾病治疗领域的临床应用,成为本领域瓶颈。长期以来业内研究人员在探索用具有更小分子量、可在原核细胞中可溶表达的“抗体片段”(antibody fragment)代替单克隆抗体,作为生产成本低、组织渗透能力强的新一代抗体药物。因此,研发分子量小,特异性高,可在原核系统高效可溶表达的小分子抗体片段药物已成为研究人员的关注点。
3.基于现有技术的现状,本申请的发明人拟提供一种高稳定性类fab抗体及其制备方法和应用,尤其涉及类fab抗体片段或抗原结合片段、分离的vh-ch3多肽、vl-ch3多肽及其制备方法。
技术实现要素:
4.本发明的目的在于,基于现有技术的现状,为解决现有技术存在的问题,通过计算机模拟及基因工程改造,制得一种新型类fab抗体片段或抗原结合片段,尤其涉及类fab抗体片段或抗原结合片段、分离的vh-ch3多肽、vl-ch3多肽及其制备方法。所述的类fab抗体片段或抗原结合片段其具有更高的稳定性和更好的抗原结合能力,能实现原核系统共表达。
5.本发明提供了一种类fab抗体片段或抗原结合片段,其特征在于,所述类fab抗体片段或抗原结合片段包含:
6.1)重链可变区、连接子和抗体恒定区ch3片段,和
7.2)轻链可变区、连接子和抗体恒定区ch3片段。
8.优选的,所述类fab抗体片段或抗原结合片段中的重链可变区以氨基酸qvql/qmql/evql/qiql/qvtl/tvql/evhl/emql/evel/edql/qlql/eaql起始,以氨基酸tvss结束。
9.优选的,所述类fab抗体片段或抗原结合片段包含的重链可变区的氨基酸序列与seq id no:5或seq id no:7具有至少95%的同源性。
10.优选的,所述类fab抗体片段或抗原结合片段中的轻链可变区以氨基酸diqmt/aiqmt/airmt/diqlt/aiqlt/viwmt/niqmt/divmt/eivmt/eivlt/ettlt/dvvmt/divlt起始,
以氨基酸veik结束。
11.优选的,所述类fab抗体片段或抗原结合片段中的轻链可变区包含的氨基酸序列与seq id no:6或seq id no:8具有至少95%的同源性。
12.优选的,所述类fab抗体片段或抗原结合片段中的连接子包含的氨基酸序列与seq id no:3或seq id no:4具有至少80%的同源性。
13.优选的,所述类fab抗体片段或抗原结合片段中的连接子,连接重链可变区和抗体恒定区ch3片段的连接子包含的氨基酸序列与seq id no:4具有至少80%的同源性。
14.优选的,所述类fab抗体片段或抗原结合片段中的连接子,连接轻链可变区和抗体恒定区ch3片段的连接子包含的氨基酸序列与seq id no:3具有至少80%的同源性。
15.优选的,所述类fab抗体片段或抗原结合片段中的抗体恒定区ch3片段包含的氨基酸序列与seq id no:1或seq id no:2具有至少95%的同源性。
16.优选的,所述类fab抗体片段或抗原结合片段中的抗体恒定区ch3片段的氨基酸序列含有:
17.seq id no:1,其中x1是氨基酸s或t,x2是氨基酸l或a,x3是氨基酸v或y,或,
18.seq id no:2,其中x1是氨基酸w或t。
19.优选的,所述类fab抗体片段或抗原结合片段中的抗体恒定区ch3片段,通过连接子与重链可变区连接的抗体恒定区ch3片段包含的氨基酸序列与seq id no:1具有至少95%的同源性。
20.优选的,所述类fab抗体片段或抗原结合片段中的抗体恒定区ch3片段,通过连接子与重链可变区连接的抗体恒定区ch3片段包含的氨基酸序列与seq id no:1具有至少95%的同源性,其中x1是氨基酸s或t,x2是氨基酸l或a,x3是氨基酸v或y。
21.优选的,所述类fab抗体片段或抗原结合片段中的抗体恒定区ch3片段,通过连接子与轻链可变区连接的抗体恒定区ch3片段包含的氨基酸序列与seq id no:2具有至少95%的同源性。
22.优选的,所述类fab抗体片段或抗原结合片段中的抗体恒定区ch3片段,通过连接子与轻链可变区连接的抗体恒定区ch3片段包含的氨基酸序列与seq id no:2具有至少95%的同源性,其中x1是氨基酸w或t。
23.优选的,所述类fab抗体片段或抗原结合片段包含:
24.1)以氨基酸qvql/qmql/evql/qiql/qvtl/tvql/evhl/emql/evel/edql/qlql/eaql起始,以氨基酸tvss结束的重链可变区,含有氨基酸序列与seq id no:4具有至少80%同源性的连接子和含有氨基酸序列与seq id no:1具有至少95%同源性的抗体恒定区ch3片段,和
25.2)以氨基酸
26.diqmt/aiqmt/airmt/diqlt/aiqlt/viwmt/niqmt/divmt/eivmt/eivlt/ettlt/dvvmt/divlt起始,以氨基酸veik结束的轻链可变区,含有氨基酸序列与seq id no:3具有至少80%同源性的连接子和含有氨基酸序列与seq id no:2具有至少95%同源性的抗体恒定区ch3片段。
27.优选的,所述类fab抗体片段或抗原结合片段包含:
28.1)以氨基酸qvql/qmql/evql/qiql/qvtl/tvql/evhl/emql/evel/edql/qlql/eaql
起始,以氨基酸tvss结束的重链可变区,含有氨基酸序列与seq id no:4具有至少80%同源性的连接子和含有氨基酸序列与seq id no:1具有至少95%同源性的抗体恒定区ch3片段,其中seq id no:1中的x1是氨基酸s或t,x2是氨基酸l或a,x3是氨基酸v或y,和
29.2)以氨基酸
30.diqmt/aiqmt/airmt/diqlt/aiqlt/viwmt/niqmt/divmt/eivmt/eivlt/ettlt/dvvmt/divlt起始,以氨基酸veik结束的轻链可变区,含有氨基酸序列与seq id no:3具有至少80%同源性的连接子和含有氨基酸序列与seq id no:2具有至少95%同源性的抗体恒定区ch3片段,其中seq id no:2中的x1是氨基酸w或t。
31.优选的,所述类fab抗体片段或抗原结合片段包含:
32.1)含有氨基酸序列与seq id no:5或seq id no:7具有至少95%同源性的重链可变区,含有氨基酸序列与seq id no:4具有至少80%同源性的连接子和含有氨基酸序列与seq id no:1具有至少95%同源性的抗体恒定区ch3片段,和
33.2)含有氨基酸序列与seq id no:6或seq id no:8具有至少95%同源性的轻链可变区,含有氨基酸序列与seq id no:3具有至少80%同源性的连接子和含有氨基酸序列与seq id no:2具有至少95%同源性的抗体恒定区ch3片段。
34.优选的,所述类fab抗体片段或抗原结合片段包含:
35.1)含有氨基酸序列与seq id no:5或seq id no:7具有至少95%同源性的重链可变区,含有氨基酸序列与seq id no:4具有至少80%同源性的连接子和含有氨基酸序列与seq id no:1具有至少95%同源性的抗体恒定区ch3片段,其中seq id no:1中的x1是氨基酸s或t,x2是氨基酸l或a,x3是氨基酸v或y,和
36.2)含有氨基酸序列与seq id no:6或seq id no:8具有至少95%同源性的轻链可变区,含有氨基酸序列与seq id no:3具有至少80%同源性的连接子和含有氨基酸序列与seq id no:2具有至少95%同源性的抗体恒定区ch3片段,其中seq id no:2中的x1是氨基酸w或t。
37.本发明提供了一种分离的vh-ch3多肽,其特征在于,所述分离的vh-ch3多肽包含重链可变区、连接子和抗体恒定区ch3片段。
38.优选的,所述vh-ch3多肽中的重链可变区以氨基酸
39.qvql/qmql/evql/qiql/qvtl/tvql/evhl/emql/evel/edql/qlql/eaql起始,以氨基酸tvss结束。
40.优选的,所述vh-ch3多肽中的重链可变区包含的氨基酸序列与seq id no:5或seq id no:7具有至少95%同源性。
41.优选的,所述vh-ch3多肽中的连接子包含的氨基酸序列与seq id no:4具有至少80%同源性。
42.优选的,所述vh-ch3多肽中的抗体恒定区ch3片段包含的氨基酸序列与seq id no:1具有至少95%同源性。
43.优选的,所述vh-ch3多肽中的抗体恒定区ch3片段包含的氨基酸序列与seq id no:1具有至少95%同源性,其中x1是氨基酸s或t,x2是氨基酸l或a,x3是氨基酸v或y。
44.本发明提供了一种分离的vl-ch3多肽,其特征在于所述分离的vl-ch3多肽包含轻链可变区、连接子和抗体恒定区ch3片段。
carbohydrate),人巨细胞病毒(hcmv)gh包膜糖蛋白,hiv gp120,hiv gp140,hcmv,呼吸合胞病毒rsvf,rsvf fgp,vnr整联蛋白,il-8,细胞角蛋白肿瘤相关抗原,hep b gp120,cmv,gpiibiiia,hiv iiib gp120v3环,呼吸合胞病毒(rsv)fgp,单纯疱疹病毒(hsv)gd糖蛋白,hsv gb糖蛋白,hcmv gb包膜糖蛋白和产气荚膜梭菌(clostridium perfrmgens)毒素、程序性死亡蛋白(programmed death-1,pd-1)。
53.本领域技术人员应当理解上述列出的靶抗原不仅指特定的蛋白质及生物分子,而且还指包含它们的生化途径或各种途径。例如,当提及的ctla-4作为靶抗原时,意味着配体和受体组成了t细胞共刺激途径,包括ctla-4、b7-1、b7-2、cd28,并且任何其它未被发现的配体或受体也是靶对象。因此本文中使用的靶抗原不仅指特定的生物分子,也指与所述靶抗原以及所述靶抗原所属的生化途径的成员相互作用的一组蛋白。本领域技术人员应当进一步理解任一上述的靶抗原、连接它们的配体或受体,或它们相应的生化途径的其它成员能可操作地与本发明的fc单体多肽连接以便产生fc融合体。因此,举例来说,靶向egfr的fc融合体能通过可操作地将fc单体多肽与egf、tgf-α或任何其它已发现或未被发现的能结合egfr的配体连接而得到构建。因此,本发明的fc变体能可操作地与egfr连接以便产生能结合egf、tgfα或任何其它已发现或未被发现的可结合egfr的配体的fc融合体。因而,事实上任何多肽,无论是配体、受体或一些其它蛋白质或蛋白质结构域,包括但不限于上述靶抗原和组成它们相应的生化途径的蛋白质,能可操作地与本发明的fc单体多肽连接以便开发fc融合体。
54.更优选的,本发明提供的类fab抗体片段或抗原结合片段、vh-ch3多肽或vl-ch3多肽能够特异性结合对应改造fab所针对的抗原,所述抗原来源包括但不限于癌症、感染性疾病(如病毒、细菌、真菌、寄生虫感染等)、自身免疫性疾病、炎症紊乱性疾病。
55.所述抗原可来自病毒。本发明所述的病毒,例如来自以下家族之一的病毒:逆转录病毒科(例如,人免疫缺陷病毒(hiv)、人t细胞白血病病毒(htlv));小核糖核酸病毒科(例如,脊髓灰质炎病毒、甲型肝炎病毒、丙型肝炎病毒、肠道病毒、人类柯萨奇病毒、鼻病毒、埃可病毒、口蹄疫病毒);钙粘病毒科(如引起胃肠炎的病毒株);披膜病毒科(例如马脑炎病毒、风疹病毒);黄病毒科(例如,登革病毒、黄热病病毒、西尼罗河病毒、圣路易斯脑炎病毒、日本脑炎病毒和其他脑炎病毒);冠状病毒科(例如冠状病毒、严重急性呼吸道综合征(sars)病毒);弹状病毒科(例如,水疱性口炎病毒、狂犬病病毒);副粘病毒科(例如,副流感病毒、腮腺炎病毒、麻疹病毒、呼吸道合胞病毒(rsv));正粘病毒科(例如,流感病毒);布尼亚病毒科(例如汉坦病毒、sin nombre病毒、裂谷热病毒、bunya病毒、phleboviruses和nairo病毒);沙粒病毒科(例如出血热病毒、machupo病毒、junin病毒);呼肠孤病毒科(例如呼肠孤病毒、orbiviurse和轮状病毒);双核糖核酸病毒科;嗜肝病毒科(例如乙型肝炎病毒);细小病毒科(例如细小病毒);乳多空病毒科(例如乳头瘤病毒、多瘤病毒、bk病毒);腺病毒科(例如,大多数腺病毒,如腺相关病毒);疱疹病毒科(例如,单纯疱疹病毒(hsv-1和hsv-2)、巨细胞病毒(cmv)、爱泼斯坦-巴尔病毒(ebv)、水痘带状疱疹病毒(vzv)、和其他疱疹病毒、包括hsv-6);痘病毒科(例如天花病毒、痘苗病毒、痘病毒);和虹膜病毒科(如非洲猪瘟病毒);病毒科(例如,埃博拉病毒、马尔堡病毒);杯状病毒科(例如,诺沃克病毒)和未分类的病毒(例如,海绵状脑病的病原体、三角洲肝炎的病原体(被认为是乙型肝炎病毒的有缺陷的卫星)和星状病毒)。
56.所述抗原可来自细菌。本发明所述的细菌如幽门螺杆菌、borelia burgdorferi、嗜肺军团菌、分枝杆菌(如m.tuberculosis,m.avium,m.intracellulare,m.kansaii,m.gordonae)、金黄色葡萄球菌、淋病奈瑟菌,脑膜炎奈瑟菌、单核细胞增生李斯特菌、化脓性链球菌(a组链球菌)、无乳链球菌(b组链球菌)、链球菌(草绿蝇群)、粪链球菌、牛链球菌、链球菌(厌氧菌)、肺炎链球菌、致病性弯曲杆菌、肠球菌、流感嗜血杆菌、炭疽芽孢杆菌、白喉棒状杆菌、棒状杆菌、猪瘟病毒、产气荚膜梭菌、破伤风梭菌、产气肠杆菌、肺炎克雷伯菌、多杀巴斯德氏菌、拟杆菌属、梭状芽孢杆菌、麦芽链霉菌、梅毒螺旋体、密螺旋体、钩端螺旋体或放线菌(actinomyces israelli)。
57.所述抗原可来自真菌。本发明所述的真菌如新型隐球菌、夹膜组织胞浆菌(histoplasma capsulatum)、粗球孢子菌(coccidioides immitis)、皮炎芽生菌(blastomyces dermatitidis)、沙眼衣原体(chlamydia trachomatis)或白念珠菌(candida albicans)。
58.所述抗原可来自寄生虫。本发明所述的寄生虫例如恶性疟原虫(plasmodium falciparum)或弓形虫(toxoplasma gondii)。
59.所述抗原可以是癌症抗原,例如实体瘤或血源性癌抗原。本发明所述的实体瘤是肉瘤或癌,例如纤维肉瘤,粘液肉瘤,脂肪肉瘤,软骨肉瘤,成骨肉瘤,或另一种肉瘤,滑膜瘤,间皮瘤,尤文氏瘤,平滑肌肉瘤,横纹肌肉瘤,结肠癌,淋巴恶性肿瘤,胰腺癌,乳腺癌,肺癌,卵巢癌,前列腺癌,肝细胞癌,鳞状细胞癌,基底细胞癌,腺癌,汗腺癌,皮脂腺癌,乳头状癌,乳头状腺癌,髓样癌,支气管癌,肾细胞癌,肝细胞癌,胆管癌,绒毛膜癌,肾母细胞瘤,宫颈癌,睾丸肿瘤,膀胱癌或中枢神经系统肿瘤(如胶质瘤,星形细胞瘤,成神经管细胞瘤,颅咽管瘤,室管膜瘤,松果体,血管母细胞瘤,听神经瘤,少突神经胶质瘤,血管瘤,黑素瘤,神经母细胞瘤或视网膜母细胞瘤)。本发明所述的血源性癌症是白血病,如急性白血病(如急性淋巴细胞白血病,急性髓细胞白血病,急性髓性白血病和成髓细胞,早幼粒细胞,髓单核细胞,单核细胞和红白血病);慢性白血病(如慢性粒细胞性(粒细胞)白血病,慢性粒细胞白血病和慢性淋巴细胞白血病),真性红细胞增多症,淋巴瘤,霍奇金病,非霍奇金淋巴瘤(惰性和高级形式),多发性骨髓瘤,瓦尔登斯特伦巨球蛋白血症,重链性疾病,骨髓增生异常综合征,多毛细胞白血病或骨髓增生异常。肿瘤抗原是本领域公知的,包括例如癌胚抗原(cea),β-人绒毛膜促性腺激素(β-hcg),甲胎蛋白(afp),凝集素反应性afp,(afp-l3),甲状腺球蛋白,rage-1,mn-ca ix,人端粒酶逆转录酶(htert),ru1,ru2(as),肠道羧基酯酶,mut hsp70-2,m-csf,前列腺素酶,前列腺特异性抗原(psa),pap,ny-eso-1,lage-1a,p53,prostein,psma,her2/neu,存活蛋白和端粒酶,前列腺癌肿瘤抗原-1(pcta-1),黑色素瘤相关抗原(mage),elf2m,中性粒细胞弹性蛋白酶,ephrinb2和cd22。还可以是任何癌症相关蛋白,例如igf-i,igf-ii,igr-ir或间皮素。
60.本发明提供了一种药用组合物,由类fab抗体片段或抗原结合片段、vh-ch3多肽或vl-ch3多肽或类fab抗体片段或抗原结合片段、vh-ch3多肽或vl-ch3多肽的核酸分子、质粒和生理学上或药学上可接受的载体、赋形剂或稳定剂混合制备而成,所述组合物包括但不限于冻干剂型、水溶液剂型、脂质体或胶囊剂型等。本发明的类fab抗体片段或抗原结合片段、vh-ch3多肽或vl-ch3多肽或类fab抗体片段或抗原结合片段、vh-ch3多肽或vl-ch3多肽的核酸分子、质粒的浓度可从约0.1%变化为100%(重量)。
61.本发明提供了一种检测试剂盒,含有本发明所述的抗体、多肽、核酸分子或质粒。该检测试剂盒用于检测病原体、肿瘤细胞,所述病原体包括病毒、细菌、真菌、寄生虫感染等,所述肿瘤细胞包括各种良性肿瘤细胞、恶性肿瘤细胞(即癌细胞)、实体瘤细胞、血源性癌细胞。
62.本发明提供了一种构建类fab抗体片段或抗原结合片段方法,其特征在于,包含:
63.(a)将突变引入权利要求1-18任一项类fab抗体片段或抗原结合片段的抗体恒定区ch3结构域的一个或多个β链中;或者
64.(b)利用从异源免疫球蛋白可变区中保留有特异性结合抗原的互补决定区(cdr)或功能片段代替部分ch3结构域;或者
65.(c)二者都有;
66.利用上述方法构建类fab抗体片段或抗原结合片段。
67.本发明提供了一种按照该方法构建的类fab抗体片段或抗原结合片段。
附图说明
68.图1:新型高稳定性类fab抗体片段改造设计。
69.图2:新型高稳定性类fab抗体片段改造及制备方法。
70.图3:新型高稳定性类fab抗体片段的稳定性检测。
71.图4:利用生物膜层光学干涉技术(bli)检测新型高稳定性类fab抗体片段与抗内皮素(mesothelin)和血管内皮生长因子(vegf165)的结合能力。
72.发明详述
73.为了能更彻底地理解发明,以下列出一些定义。上述定义意在包含语法等同成分。
74.本文中所使用的“抗体片段或抗原结合片段”意指抗体的一部分,如f(ab’)2、f(ab)2、fab’、fab、fv、scfv(单链fv)、单结构域抗体(dab或vhh)等,包括上文引用的igg4的半分子(van der neut kolfschoten等人,science 2007;317(9月14日):1554-1557)。无论结构如何,所使用的抗体片段与完整抗体所识别的相同抗原结合。术语“抗体片段”还包括通过与特定抗原结合以形成复合物而起抗体作用的合成或遗传工程化的蛋白质。举例来说,抗体片段包括由可变区组成的分离的片段,如由重链和轻链的可变区组成的“fv”片段,以及其中轻和重可变区由肽接头连接的重组单链多肽分子(“scfv蛋白”)。可以不同方式构建片段以产生多价和/或多特异性结合形式。
75.本文中所使用的“重链可变区”意指免疫球蛋白重链靠近n端氨基酸序列变化较大的区域。本文中涉及的重链可变区优选以氨基酸
76.qvql/qmql/evql/qiql/qvtl/tvql/evhl/emql/evel/edql/qlql/eaql起始,以氨基酸tvss结束。
77.本文中所使用的“轻链可变区”意指免疫球蛋白轻链靠近n端氨基酸序列变化较大的区域。本文中涉及的轻链可变区优选以氨基酸
78.diqmt/aiqmt/airmt/diqlt/aiqlt/viwmt/niqmt/divmt/eivmt/eivlt/ettlt/dvvmt/divlt起始,以氨基酸veik结束。
79.本文中所使用的“连接子”意指连接两个或多个蛋白片段的肽。本文中涉及的连接子优选为rqprepq或aqprepq。
80.本文中所使用的“ch3片段或结构域”意指衍生自免疫球蛋白ch3片段或结构域的多肽,ch3片段或结构域分子包含至少一个cdr或其功能片段;或者可以进一步包含额外的氨基酸序列,例如完整的高变环;可以具有被cdr或其功能片段替换的一条或多条β链的至少一部分;或者ch3片段或结构域在分子的环区域中包含一个或多个突变。ch3片段或结构域的“环区”是指位于β链区域之间的蛋白质部分。ch3片段或结构域分子尺寸小,通常小于15kd。其大小可以根据插入环区域的cdr/高变氨基酸序列的长度,或插入的cdr数量以及是否另一个分子(例如效应分子或标记)与ch3域结合而变化。ch3片段或结构域分子可以是糖基化的或未糖基化的。例如,重组ch3片段或结构域可以在合适的哺乳动物细胞中表达,以允许分子的糖基化。
81.本文中使用的“氨基酸”意指20种天然存在的氨基酸之一或任一非天然类似物,它们可位于具体规定的位置。本文中“蛋白质”意指至少两个共价连接的氨基酸,其包括蛋白质、多肽、寡肽和肽。蛋白质可由天然存在的氨基酸和肽键构成,或由合成的肽模拟物结构构成,该肽模拟物即“类似物”。因此本文中使用的“氨基酸”或“肽残基”意指天然存在和合成的氨基酸。举例来说,对于本发明目的而言,高苯基丙氨酸、瓜氨酸和降亮氨酸被认为是用于本发明目的的氨基酸。“氨基酸”也包括诸如脯氨酸和羟脯氨酸的亚氨基酸残基。侧链可以是(r)或(s)构型。在优选的实施方案中,氨基酸以(s)或l-构型存在。如果使用非天然存在的侧链,可使用非氨基酸取代,例如以阻止或延迟体内降解。
82.本文中使用的“多肽”意指一种聚合物,其中单体是通过酰胺键连接在一起的氨基酸残基。当氨基酸是α-氨基酸时,可以使用l-光学异构体或d-光学异构体。如本文所用的术语“多肽”或“蛋白质”旨在涵盖任何氨基酸序列并包括修饰的序列,例如糖蛋白。术语“多肽”特别旨在涵盖天然存在的蛋白质,以及重组或合成产生的蛋白质。
83.本文中“抗体”意指由基本上为公认的免疫球蛋白基因的全部或部分所编码的一种或多种多肽组成的蛋白质。所述公认的免疫球蛋白基因,例如在人中,包括kappa(κ)、lambda(λ)和重链基因座,其中包含了无数的可变区基因,以及分别编码igm、igd、igg、ige和iga 同种型的恒定区基因mu(μ)、delta(δ)、gamma(γ)、epsilon(ε)、alpha(α)。本文中的抗体意指包括全长抗体和抗体片段,以及来自任意生物体的天然抗体,工程抗体,或为试验、治疗目的或其它如下所进一步规定的目的而重组产生的抗体。术语“抗体”包括抗体片段,为本领域所公知,诸如fab、fab’、f(ab’)2、fv,scfv或抗体的抗原结合的其它亚序列,或通过修饰完整抗体或使用重组dna技术重新合成的那些抗体而产生的抗体片段。术语“抗体”包括单克隆以及多克隆抗体。抗体可以是拮抗剂、激动剂、中和性抗体、或抑制性抗体、或刺激性抗体。本发明的抗体可以是非人抗体,嵌合抗体,人源化抗体或完全人抗体。
84.具体地包括于“抗体”定义范围内的是非糖基化抗体。优选的,本文使用的为“非糖基化抗体”,意指在fc区297位缺少糖附着的抗体,其中编号方式依照kabat的eu系统。非糖基化的抗体可以是去糖基化的抗体,其是一种fc糖已去除的抗体,例如以化学或酶的方法去除。可选地,所述非糖基化抗体可以是非糖基化或未糖基化的抗体,其是一种无fc糖表达的抗体,例如通过突变一种或多种编码糖基化型的残基或通过在不将糖附着到蛋白质上的生物体诸如细菌中表达。
85.本文中使用的“igg”意指一种属于抗体类的多肽,其基本上为公认的免疫球蛋白γ基因所编码。在人类中,该类包含igg1、igg2、igg3和igg4。在小鼠中,该类包含igg1、
igg2a、igg2b、igg3。本文中“免疫球蛋白(ig)”意指由基本上为免疫球蛋白基因所编码的一个或多个多肽组成的蛋白质。免疫球蛋白包括但不限于抗体。免疫球蛋白可具有许多结构型,包括但不限于全长抗体、抗体片段和单个免疫球蛋白结构域。抗体igg类中已知的ig结构域vh、cγi、cγ2、cγ3、vl以及cl。
86.本文中使用的“抗原”意指可以在动物体内刺激抗体产生或t细胞反应的化合物、组合物或物质,包括注射或吸收到动物体内的组合物,可以是蛋白质、糖类、脂质或其它病原体。
87.本文所使用的“核酸”意指由核苷酸单元(核糖核苷酸,脱氧核糖核苷酸,相关的天然存在的结构变体及其合成的非天然存在的类似物)通过磷酸二酯键组成的聚合物。因此,该术语包括核苷酸聚合物,其中核苷酸和它们之间的键包括非天然存在的合成类似物,例如但不限于硫代磷酸酯,氨基磷酸酯,甲基磷酸酯,手性甲基磷酸酯,2'-o-甲基核糖核苷酸,肽核酸(pna)等。例如,可以使用自动dna合成仪合成这些多核苷酸。术语“寡核苷酸”通常是指短多核苷酸,通常不大于约50个核苷酸。应当理解,当核苷酸序列由dna序列(即a,t,g,c)表示时,这也包括其中“u”取代“t”的rna序列(即a,u,g,c)。
88.本文使用常规符号来描述核苷酸序列:单链核苷酸序列的左手末端5'末端;双链核苷酸序列的左手方向称5'方向。向新生rna转录物添加5'至3'核苷酸的方向称为转录方向。具有与mrna相同序列的dna链被称为编码链。
89.本文中使用的“同源性”意指核苷酸或氨基酸序列之间的相似性,或者称为序列同一性。序列同一性通常根据百分比同一性(或相似性或同源性)来衡量;百分比越高,两个序列越相似。当使用标准方法比对时,同源物或变体将具有相对高程度的序列同一性。用于比较的序列比对方法是本领域熟知的。各种程序和对准算法描述于:smith and waterman,adv appl.math.,2:482,1981;needlema and wunsch,j.mol.biol.48:443,1970;pearson and lipman,proc.natl.acad.sci.u.s.a.85:2444,1988;higgins and sharp,gene 73:237-244,1988;higgins and sharp,cabios 5:151-153,1989;corpet等,nucleic acids research 16:10881-10890,1988;和altschul等,nature genet.,1994,6:119-129。
90.可从若干来源获得ncbi基本局部比对搜索工具(blast tm)(altschul等,j.mol.biol.,215:403-410,1990。),包括国家生物技术信息中心(ncbi,bethesda,md.)和在因特网上有关用于序列分析程序blastp,blastn,blastx,tblastn和tblastx。
91.本文中使用的“质粒”意指在天然质粒的基础上为适应实验室操作而进行人工构建的质粒。可将核酸分子导入宿主细胞,从而产生转化的宿主细胞。载体可包括允许其在宿主细胞中复制的核酸序列,例如复制起点,还可以包括一种或多种选择标记基因和本领域已知的其他遗传元件。
92.本文所使用的“宿主细胞”也称为受体细胞,是指在转化和转导(感染)中接受外源基因的宿主细胞。
93.本文中使用的“药学可接受载体”意指常规的药学上可接受的载体。remington's pharmaceutical sciences,ewmartin,mack publishing co.,easton,pa.,第15版(1975),描述了适用于药物递送一种或多种治疗化合物或分子(例如一种或多种抗体)的组合物和制剂,以及另外的药剂。
94.本文中“有效预防或治疗剂量”意指足以在用该药剂治疗的受试者中达到所需效
果的一定量的特定药剂。精确的剂量将依赖于治疗的目的,并可为本领域技术人员通过使用公知技术所确定。剂量范围可为0.01-100mg/kg体重或更大,例如0.1、1、10或50mg/kg体重,优选1-10mg/kg。如本领域所公知,对于抗体或fc融合体降解、全身性或局部性递药和新蛋白酶合成速率,以及年龄、体重、大致健康状况、性别、饮食、给药时间、药物相互作用以及病症的严重程度而言,调整可以是必需的,并可由本领域那些技术人员通过常规的实验方法来确定。此类试剂包括本文所述的类fab抗体片段或抗原结合片段、vh-ch3多肽或vl-ch3多肽。理想地,治疗有效量的抗体是足以预防,治疗或改善感染或疾病的量,例如由受试者中的hiv感染引起而不会在受试者中引起显着的细胞毒性作用。用于预防,改善和/或治疗受试者的治疗有效量的药剂将取决于所治疗的受试者,痛苦的类型和严重程度,以及治疗组合物的施用方式。
95.本文中使用的“β链”意指是一段多肽链,通常为3至10个氨基酸长,骨架处于几乎完全延伸的构象。通常,β链是采用这种延伸构象的单个连续氨基酸段,并且涉及与至少一个其他链的主链氢键,从而它们形成β折叠。在β折叠中,大多数β链与其他链相邻排列,并与它们的邻居形成广泛的氢键网络,其中一条链骨架中的n-h基团与相邻股骨架的c=o基团形成氢键。在完全延伸的β链中,连续的侧链指向上直,然后直下,然后直接向上等。β折叠中相邻的β链排成一行,使得它们的c
α
原子相邻并且它们的侧链指向相同的方向。β链的“褶皱”外观来自c
α
原子的四面体化学键合;例如,如果侧链指向正上方,则与c
v
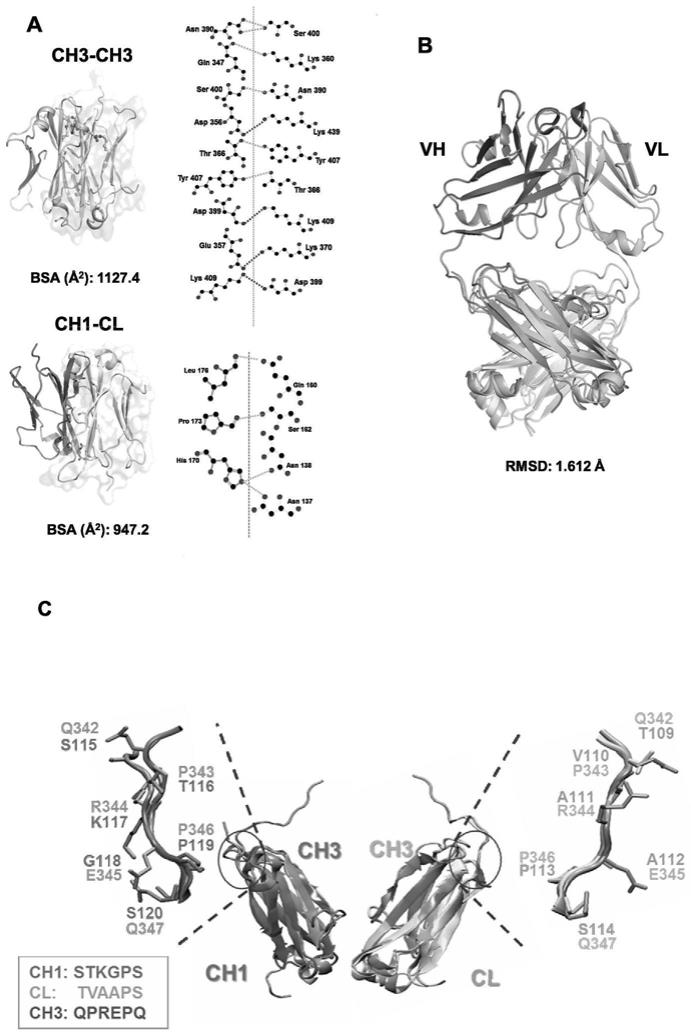
的键合必须略微向下,因为其键角约为109.5
°
。打褶导致c
αi
和c
αi+2
之间的距离约为而不是两个完全延伸的反式肽虚拟键所预期的氢键β链中相邻cα原子之间的“侧向”距离大约为
96.本文中使用的“互补决定区(cdr)”意指抗体可变区内氨基酸残基在组成和排列顺序上更易发生变异的区域,亦称高变区。在l链、h链的v区中有三个高变区(hypervariable regions,hvr),该部位在空间结构上可与抗原决定簇形成精密的互补。每种抗原受体包含六个高变环:h1,h2,h3,l1,l2和l3。例如,h1环包含重链的cdr1,l3环包含轻链的cdr3。ch2和ch3结构域分子可包括来自抗体可变结构域的移植氨基酸。移植的氨基酸包含cdr的至少一部分。移植的氨基酸还可以包括额外的氨基酸序列,例如完整的高变环。如本文所用,cdr的“功能片段”是cdr的至少一部分,其保留结合特定抗原的能力。
97.本文中“分离的”意指生物组分(例如核酸分子或蛋白质)已经基本上从组分天然存在的其他生物组分(例如,细胞的其他生物组分)中分离或纯化,例如其他染色体和染色体外dna,rna和蛋白质,包括其他抗体。已经“分离”的核酸和蛋白质包括通过标准纯化方法纯化的核酸和蛋白质。分离的抗体是基本上与其他蛋白质或生物组分分离或纯化的抗体,从而维持其抗原特异性。该术语还包括通过在宿主细胞中重组表达制备的核酸和蛋白质,以及化学合成的核酸或蛋白质或其片段。
98.本文中所使用的“编码”意指多核苷酸中特定核苷酸序列的固有特性,例如基因,cdna或mrna,用作在具有确定的核苷酸序列的生物过程中合成其他聚合物和大分子的模板,或确定的氨基酸序列和由此产生的生物学特性。因此,如果由该基因产生的mrna的转录和翻译在细胞或其他生物系统中产生蛋白质,则基因编码蛋白质。编码链(其核苷酸序列与mrna序列相同并且通常在序列表中提供)和非编码链(用作转录模板,基因或cdna)可以被
称为编码蛋白质。或该基因或cdna的其他产物。除非另有说明,否则“编码氨基酸序列的核苷酸序列”包括彼此简并形式且编码相同氨基酸序列的所有核苷酸序列。编码蛋白质和rna的核苷酸序列可包括内含子。
99.除非另外说明,否则本文使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的含义相同的含义。除非上下文另有明确说明,否则单数术语“一”,“一个”和“该”包括复数指示物。还应理解,对于核酸或多肽给出的所有碱基大小或氨基酸大小,以及所有分子量或分子量值是近似的,并且提供用于描述。尽管与本文描述的那些类似或等同的方法和材料可用于本公开的实践或测试,但下文描述了合适的方法和材料。术语“包含”表示“包括”。本文提及的所有出版物、专利申请、专利和其他参考文献均通过引用整体并入。如果发生冲突,将以本说明书(包括术语解释)为准。另外,材料,方法和实施例仅是说明性的而不是限制性的。
具体实施方式
100.实施例中使用的标准的重组dna技术和分子克隆技术是本领域所熟知的(ausubel,f.m等人,current protocols in molecular biology,greene publishing assoc.和wiley-interscience出版),适用于微生物生长的材料和方法是本领域熟知的。主要化学、生物试剂购自kapa biosystems,new england biolabs,transgen biotech,thermo fisher scientific,omega bio-tek等。
101.下面结合具体实施例对本发明进行详细说明。
102.实施例1高稳定性类fab抗体片段的改造设计
103.相关文献表明,抗体的ch3结构上具有较多的生物学性质作用位点(相关文献pmid:29181008;pmid:24765095;pmid:22518843;pmid:23867459)。通过计算机分子模拟(pymol molecular graphics system和pdbepisa),确定了igg上的抗体片段ch3与ch1、cl有较好的同源性,均方根偏差(rmsd)仅为同时,本发明经过计算机同源模拟也比较了ch3与ch1、cl的氨基端氨基酸序列,根据氨基酸的侧链走向,选取rqprepq(精氨酸,谷氨酰胺,脯氨酸,精氨酸,谷氨酸,脯氨酸和谷氨酰胺)和aqprepq(丙氨酸,谷氨酰胺,脯氨酸,精氨酸,谷氨酸,脯氨酸和谷氨酰胺)分别连接类fab抗体片段轻链可变区和重链可变区与抗体恒定区ch3结构域(如图1所示)。
104.实施例2高稳定性类fab抗体片段改造及制备方法
105.对igg-fab的氨基酸序列进行改造,用ch3分别替代ch1、cl,设计并合成vl-ch3与vh-ch3序列,连接子为天然抗体所具有的氨基酸序列(如用igg1-ch3上341-347位氨基酸qprepq替代igg1-ch1上114-120位氨基酸stkgps和igg1-cl上109-114位tvaaps)。其中,通过knobs-into-holes技术(见文献pmid:25427258;pmid:23831709)对ch3片段进行特定位点突变,使其表达的蛋白在空间构象上形成凹凸嵌合的互补结构,减少随机重组配对,提高表达产率,突变后的ch3片段氨基酸序列如序列seq id no:1(其中x1是氨基酸s或t,x2是氨基酸l或a,x3是氨基酸v或y)和序列seq id no:2(其中x1是氨基酸w或t)所示。
106.表达类fab抗体片段vl-ch3与vh-ch3序列分别构建至质粒pcomb3x(载体为dr.dennis burton所赠,the scripps research institute)中,后将两个重组质粒分别转化大肠杆菌hb2151,经过培养诱导后(转化和有道培养方法见文献pmid:28966056;pmid:
23831709),将诱导后菌液按照5:5或4:6比例混合进行裂解菌液,经过两步纯化得到高纯度目的蛋白(根据镍柱纯化说明书的步骤,使用ni-nta树脂(qiagen,valencia,ca)纯化蛋白质;然后经过(iba-lifesciences)纯化,通过sds-page测定蛋白质纯度,并通过分光光度法(nano vue,ge healthcare)测定蛋白质浓度)。
107.类fab抗体片段改造、制备方法的主要流程、纯化后的目的蛋白如图2所示。
108.实施例3高稳定性类fab抗体片段的稳定性检测
109.将抗体fab和新型高稳定性类fab抗体片段均稀释浓度为0.25mg/ml,利用仪器jasco j-815spectropolarimeter(jasco international)在216nm处检测蛋白的稳定性及zetasizer nano zs zen3600(malvern instruments limited,westborough,ma,usa)检测蛋白聚集性。用cd(circular dichroism spectrum)来评估类fab抗体片段的热稳定性,以及通过dls(dynamic light scattering)来评估类fab抗体片段的聚集特性。以及将蛋白分别在4℃及37℃放置1,3,7天,利用sds-page和elisa检测蛋白的稳定性(蛋白稳定性和聚集特性的具体检测方法见文献pmid:29181008;pmid:24765095;pmid:22518843;pmid:23867459;pmid:26963639);结果如图3所示,制备的高稳定性类fab抗体片段呈现较高的稳定性以及很好的聚集性。
110.实施例4高稳定性类fab抗体片段与抗原内皮素(mesothelin)和血管内皮生长因子(vegf165)的结合能力检测
111.利用生物膜层光学干涉技术(bli)(见文献pmid:29181008;pmid:28966056)及氨基偶联探针(arg2)(购自octet-red(pall fortebio))检测抗体fab和新型高稳定性类fab抗体片段与抗原内皮素(mesothelin)和血管内皮生长因子(vegf165)的结合能力。
112.基于抗原内皮素(mesothelin)即m912-fab改造的类fab抗体片段和基于血管内皮生长因子(vegf165)即ranibizumab-fab改造的类fab抗体片段的改造及制备方法如实施例2所示,其中基于抗原内皮素(mesothelin)即m912-fab改造的类fab抗体片段的重链可变区的氨基酸序列m912-fabch3-vh如seq id no:5所示,轻链可变区的氨基酸序列m912-fabch3-vl如seq id no:6所示;基于血管内皮生长因子(vegf165)即ranibizumab-fab改造的类fab抗体片段的重链可变区的氨基酸序列ranibizumab-fabch3-vh如seq id no:7所示,轻链可变区的氨基酸序列ranibizumab-fabch3-vl如seq id no:8所示。
113.检测过程中,蛋白按照2倍倍比稀释,在ph 7.4条件下检测结合与解离获得亲和常数;图4结果显示,与抗体fab比较,制备的高稳定性类fab抗体片段结合对应抗原的能力均得到提高。
114.实施例5高稳定性类fab抗体片段不同序列的表达及稳定性检测
115.选择fab抗体片段或抗原结合片段中的重链可变区以氨基酸
116.qvql/qmql/evql/qiql/qvtl/tvql/evhl/emql/evel/edql/qlql/eaql起始,以氨基酸tvss结束;轻链可变区以氨基酸
117.diqmt/aiqmt/airmt/diqlt/aiqlt/viwmt/niqmt/divmt/eivmt/eivlt/ettlt/dvvmt/divlt起始,以氨基酸veik结束;连接子为天然抗体所具有的氨基酸序列(如用igg1-ch3上341-347位氨基酸qprepq替代igg1-ch1上114-120位氨基酸stkgps和igg1-cl上109-114位tvaaps),用ch3分别替代ch1、cl,通过knobs-into-holes技术(见文献pmid:25427258;pmid:23831709)对ch3片段进行特定位点突变,构建载体。按照上述说明进行表
达纯化,最终获取新型类fab抗体片段。我们用cd(circular dichroism spectrum)来评估类fab抗体片段的热稳定性,以及通过dls(dynamic light scattering)来评估类fab抗体片段的聚集特性。以及将蛋白分别在4℃及37℃放置1,3,7天,利用sds-page和elisa检测蛋白的稳定性;结果显示大部分类fab抗体片段均具有较好的稳定性甚至优于改造前的fab抗体片段。
118.以上所述仅是本发明的优选实施方式,应当指出,对于本领域的技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和补充,这些改进和补充也应当视为本发明的保护范围。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
119.序列表
120.seq id no:1(igg1-ch3 mutants的氨基酸序列)
121.vytlppsrdeltknqvslx1cx2vkgfypsdiavewesngqpennykttppvldsdgsfflx3skltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
122.seq id no:2(igg1-ch3 mutants的氨基酸序列)
123.vytlppsrdeltknqvslx1clvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
124.seq id no:3(抗原结合片段与igg1-ch3之间的连接子氨基酸序列)
125.rqprepq
126.seq id no:4(抗原结合片段与igg1-ch3之间的连接子氨基酸序列)
127.aqprepq
128.seq id no:5(基于m912-fab改造的类fab抗体片段的重链可变区的氨基酸序列m912-fabch3-vh)
129.qvqlqesgpglvkpsetlsltctvsggsvssgsyywswirqppgkglewigyiyysgstnynpslksrvtisvdtsknqfslklssvtaadtavyycaregkngafdiwgqgtmvtvss
130.seq id no:6(基于m912-fab改造的类fab抗体片段的轻链可变区的氨基酸序列m912-fabch3-vl)
131.diqmtqspsslsasvgdrvtitcrasqsissylnwyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqsystpltfgggtkveik
132.seq id no:7(基于ranibizumab-fab改造的类fab抗体片段的重链可变区的氨基酸序列ranibizumab-fabch3-vh)
133.evqlvesggglvqpggslrlscaasgydfthygmnwvrqapgkglewvgwintytgeptyaadfkrrftfsldtskstaylqmnslraedtavyycakypyyygtshwyfdvwgqgtlvtvss
134.seq id no:8(基于ranibizumab-fab改造的类fab抗体片段的轻链可变区的氨基酸序列ranibizumab-fabch3-vl)
135.diqltqspsslsasvgdrvtitcsasqdisnylnwyqqkpgkapkvliyftsslhsgvpsrfsgsgsgtdftltisslqpedfatyycqqystvpwtfgqgtkveik。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1