一种那拉曲坦制备用中间体化合物的制备方法与流程
1.本发明涉及药物中间体合成领域,特别是涉及一种那拉曲坦制备用中间体化合物的制备方法。
背景技术:
2.那拉曲坦(英文名naratriptan,又名amenaramig),化学名为m-甲基-3-(1
ー
甲基-4-哌啶基)-1,4-吲噪-5-乙基磺酰胺,其结构式如下:
[0003][0004]
其合成路线如下:
[0005][0006]
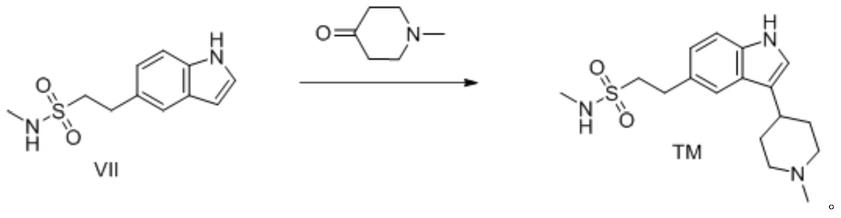
那拉曲坦是葛莱素成康公司开发的第二代曲坦类抗偏头痛药,用于治疗偏头痛、串头痛、慢性阵发性偏头痛、血管失调引起的头痛,以及用来减轻与此有关的症状,中间体vii具有很高的市场价值。
[0007]
目前已公开的资料显示那拉曲坦合成路线共分为两类大类。其中一大类是先成苯环取代的乙基磺酰胺衍生物,再进行吲哚关环以及和n-甲基哌啶酮的缩合。此类方法合成起始原料无商品化供应,步骤长,收率低,在关环的过程中要用到昂贵的试剂,或有较大环境污染的试剂比如二氯化锡、四氯化钛等,难以工业化生产和商业化生产。
[0008]
另一大类那拉曲坦合成路线是在吲哚环上引入乙基磺酰胺基团,得到关键中间体2-(1h-吲哚-5-基)-n-甲基乙-1-磺酰胺(vii)再和n一甲基哌啶酮缩合。这类方法是当今工业化生产那拉曲坦的主要方法。
[0009]
专利us4997841的方法是通过n一甲基乙烯基磺酰胺(1)和5-溴吲哚(2)的heck反应,然后加氢还原来引入乙磺酰胺基团,合成路线如下:
[0010][0011]
该路线中heck反应的原料之一化合物(1)无商品化供应,易于聚合,制备困难,由此造成难以工业化生产和商业化生产。
[0012]
专利cn200410093115的方法是通过基团保护的n-甲基甲磺酰胺(3)和5-甲醛哚(4)在碱性条件下缩合,然后脱保护剂、加氢还原、来引入乙磺酰胺基团,合成路线如下:
[0013][0014]
其缺陷是在于需要用到强碱丁基锂、lda等需要超低温反应,反应设备要求较高;氰基还原步骤需要用到微波反应不适用工业化大规模生产。
技术实现要素:
[0015]
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种那拉曲坦制备用中间体化合物的制备方法,用于解决现有技术中的那拉曲坦的重要中间体合成物合成中存在的反应条件苛刻,成本高,不适用于大规模生产的问题。
[0016]
为实现上述目的及其他相关目的,本发明是通过包括以下技术方案获得的。
[0017]
本发明公开了那拉曲坦制备用中间体化合物的制备方法,包括采用结构如式vi所示的化合物与氢气进行氢化反应,得到结构如式vii所述的中间体化合物,反应路线如下:
[0018][0019]
根据上述所述的中间体化合物的制备方法,上述氢化反应体系中还含有反应介质,反应介质为第一有机溶剂。更优选地,所述第一有机溶剂为选自四氢呋喃、乙醇和甲醇中的一种或多种。更优选地,所述第一有机溶剂为四氢呋喃。
[0020]
根据上述所述的中间体化合物的制备方法,氢化反应在催化剂下进行。更优选地,所述催化剂为钯碳或雷尼镍。更优选地,催化剂为钯碳。
[0021]
根据上述所述的中间体化合物的制备方法,氢化反应在氢气氛围下进行,氢气压
力为0.1mpa~1mpa。氢气压力为0.1mpa反应可以正常进行,但是反应速度慢,随着氢气压力增加,反应速度提高,高于1mpa后吲哚环双键,产生杂质。更优选地,反应体系中氢气压力0.1mpa~0.2mpa。
[0022]
根据上述所述的中间体化合物的制备方法,氢化反应温度为20~60℃。更优选地,反应温度为20~40℃。
[0023]
根据上述所述的中间体化合物的制备方法,氢化反应结束后还包括后处理步骤,所述后处理步骤包括抽滤、浓缩、打浆和抽滤。优选地,抽滤是指抽出反应液。浓缩是指浓缩干。优选地,加入乙酸乙酯和石油醚的混合溶剂进行打浆。更优选地,所述乙酸乙酯的体积为式vi化合物体积的0.5~5倍。更优选地,所述石油醚的体积为式vi化合物体积的3~10倍。更优选地,抽滤终产物。
[0024]
本发明还公开了,采用结构如式v所示的化合物在酸性条件下脱保护基反应,得到结构式如式vi所示的化合物,反应路线如下:
[0025][0026]
根据上述所述的制备方法,对于得到结构式如式vi所示的中间体化合物的反应,脱保护基反应的反应体系中还含有反应介质,所述反应介质为第二有机溶剂。更优选地,第二有机溶剂为选自二氯甲烷和甲醇中的一种或两种。更优选地,第二有机溶剂为二氯甲烷。
[0027]
根据上述所述的制备方法,脱boc条件需要酸或碱,对于得到结构式如式vi所述的中间体化合物的反应,反应体系中还含有选自盐酸和三氟乙酸中一种或多种。更优选地,脱boc条件为酸性条件,更优选地,酸为三氟乙酸。
[0028]
根据上述所述的制备方法,对于得到结构式如式vi所述的中间体化合物的反应,脱保护基反应的反应温度为20~60℃。更优选地,反应温度为30~40℃。
[0029]
根据上述所述的中间体化合物f的制备方法,对于得到结构式如式vi所述的中间体化合物的反应,脱保护基反应的反应时间15~20h。
[0030]
根据上述所述的制备方法,对于得到结构式如式vi所述的中间体化合物的反应,脱保护基反应的反应结束后还包括后处理步骤,所述后处理步骤包括冷却和抽滤。更优选地,将反应结束后的反应也进行冷却然后抽滤。
[0031]
本发明还公开了采用结构如式iv所示的化合物与甲胺的四氢呋喃溶液进行缩合反应,得到结构如式v所示的化合物,反应路线如下:
[0032][0033]
根据上述所述的制备方法,将结构如式iv所示的化合物滴入甲胺的四氢呋喃溶液中或将甲胺的四氢呋喃溶液滴入结构如式iv所示的化合物中进行缩合反应。更优选地,将
结构如式iv所述的化合物滴入甲胺的四氢呋喃溶液中。
[0034]
根据上述所述的制备方法,对于得到结构如式v所示的化合物的反应,缩合反应温度为-20~10℃。更优选地,缩合反应温度为0~10℃。
[0035]
根据上述所述的制备方法,对于得到结构如式v所示的化合物的反应,缩合反应时间不超过1h。优选地,缩合反应时间为0.1~1h。
[0036]
根据上述所述的制备方法,对于得到结构如式v所示的化合物的反应,缩合反应结束后还包括后处理步骤,所述后处理步骤包括分液和浓缩。更优选地,分液是指分离获取有机相。优选地,所述浓缩为减压蒸馏有机相。
[0037]
本发明还公开了,采用结构如式iii所示的化合物与氯代试剂进行氯化反应,得到结构如式iv所示的化合物,反应路线如下:
[0038][0039]
根据上述所述的制备方法,对于得到结构如式iv所示的化合物的反应,氯化反应的反应体系还含有反应介质,所述反应介质为第三有机溶剂。更优选地,所述第三有机溶剂为选自四氢呋喃和n,n-二甲基甲酰胺中的一种或两种。
[0040]
根据上述所述的制备方法,对于得到结构如式iv所示的中间体化合物的反应,所述氯代试剂为选自三氯氧磷、五氯化磷、磺酰氯和氯化亚砜中的一种或多种。更优选地,所述氯代试剂选用氯化亚砜。
[0041]
根据上述所述的制备方法,对于得到结构如式iv所示的中间体化合物的反应,氯化反应的反应温度为0~50℃。更优选地,氯化反应的反应温度为40~50℃。
[0042]
根据上述所述的制备方法,对于得到结构如式iv所示的中间体化合物的反应,氯化反应时间不超过4h。优选地,氯化反应时间为0.5~4h。
[0043]
根据上述所述的的制备方法,对于得到结构如式iv所示的中间体化合物的反应,氯化反应后无需后处理,反应液直接投下一步。
[0044]
本发明还公开了,采用结构如式ii所示的化合物与乙烯基磺酸钠水溶液进行heck反应,得到结构如式iii所示的化合物,反应路线如下:
[0045][0046]
根据上述所述的制备方法,对于得到结构式如式iii所示的化合物的反应,heck反应的反应体系中还采用第四有机溶剂作为反应介质。更优选地,所述第四有机溶剂选自二甲基甲酰胺(缩写为dmf)、二甲基亚砜(缩写为dmso)、二氧六环和乙腈一种或多种。更优选地,有机溶剂为乙腈。
[0047]
根据上述所述的制备方法,对于得到结构式如式iii所示的化合物的反应,乙烯基
磺酸钠水溶液的浓度为20wt%~30wt%,优选为25wt%。
[0048]
根据上述所述的制备方法,对于得到结构式如式iii所示的化合物的反应,heck反应在催化剂下进行。更优选地,催化剂为醋酸钯。
[0049]
根据上述所述的制备方法,对于得到结构如式iii所示的化合物的反应,heck反应在碱性条件下进行。更优选地,碱性条件为在反应体系中加入碳酸钾、醋酸钠和三乙胺中的一种或多种。更优选地,碱为三乙胺。所述碱性条件用于中和反应中产生的酸。
[0050]
根据上述所述的制备方法,对于得到结构式如式iii所示的化合物的反应,heck反应的反应体系中还含有膦配体。更优选地,膦配体选自三苯基膦和三(邻甲基苯基)磷中的一种或两种。更优选地,膦配体为三苯基磷。
[0051]
根据上述所述的制备方法,对于得到结构式如式iii所示的化合物的反应,heck反应温度为60~90℃。更优选地,heck反应温度为70~80℃。
[0052]
根据上述所述的制备方法,对于得到结构式如式iii所示的化合物的反应,heck反应时间不超过12h。优选地,heck反应时间为0.5h~12h。
[0053]
根据上述所述的制备方法,对于得到结构如式iii所示的化合物的反应,heck反应结束后还包括后处理步骤,所述后处理步骤包括萃取和浓缩。更优选地,萃取是向反应结束后的体系中先加入水和乙酸乙酯进行分层并获取水相,水相酸化至ph为2~3后,再用二氯甲烷进行萃取获得有机相即为结构如式iii所示的化合物。更优选地,酸化为将盐酸水溶液加入水相中调节ph为2~3;盐酸水溶液的浓度可以为0.5~5mol/l。本技术中此处萃取是先在碱性条件下萃取杂质,然后再调酸萃取获得结构如式iii所示的化合物,其在后处理过程中就可以起到纯化产物的作用。更优选地,萃取时,以1kg结构如式ii所示的化合物为基准计,水的体积用量至少为12l,如13l、14l、15l等。更优选地,萃取时,以1kg结构如式ii所示的化合物为基准计,所述乙酸乙酯和二氯甲烷的体积的至少为10l。优选地,所述浓缩为减压蒸馏有机相。
[0054]
本发明还公开了,采用结构式如式i所示的化合物与boc酸酐进行胺基保护反应,得到结构式如式ii所示的化合物,反应路线如下:
[0055][0056]
根据上述所述的制备方法,对于得到结构式如式ii所示的化合物的反应,胺基保护反应的反应体系中采用反应介质,反应介质为第五有机溶剂。更优选地,第五有机溶剂选自二氯甲烷。
[0057]
根据上述所述的制备方法,对于得到结构式如式ii所示的化合物的反应,胺基保护反应在催化剂下进行。更优选地,催化剂为4-二甲氨基吡啶(简写为dmap)。
[0058]
根据上述所述的制备方法,对于得到结构式如式ii所示的化合物的反应,胺基保护反应结束后还包括后处理步骤,所述后处理步骤包括萃取和浓缩。更优选地,萃取是先向反应结束后的体系中加入稀盐酸水溶液分层获取有机相,再向有机相中加入饱和碳酸氢钠水溶液再分层获取有机相。更优选地,所述稀盐酸水溶液和饱和碳酸氢钠水溶液的体积均为式i化合物体积的至少2倍。更优选地,所述稀盐酸水溶液的浓度为0.5~3mol/l。优选地,
所述浓缩为减压蒸馏有机相。
[0059]
本发明提供的上述制备方法能够获得高品质的那拉曲坦制备用中间体化合物,本技术中的此合成路线以5-溴-1h-吲哚为起始原料、经boc保护、heck反应、氯化、缩合、脱boc、氢化得到目标产物;5-溴-1h-吲哚以及乙烯基磺酸钠均为商业化的原料简单易得且成本相对较低、反应条件均为常规操作、避免了超低温反应条件、各步骤所得中间体无需使用硅胶柱分离纯化,也无需繁琐的后处理操作,避免了繁琐的分离提纯步骤,也避免了原料的浪费各反应收率在80%以上、总收率达到40%。解决了现有技术中的那拉曲坦的重要中间体合成物合成中存在的原料不易得、反应条件苛刻,成本高,不适用于大规模生产的问题,降低了生产成本,更适用于工业化生产。
附图说明
[0060]
图1为实施例中中间体化合物ii所示的化合物的制备路线图
[0061]
图2为实施例中结构式如式iii所示的化合物的制备路线图
[0062]
图3为实施例中结构式如式iv所示的化合物的制备路线图
[0063]
图4为实施例中结构如式v所示的化合物的制备路线图
[0064]
图5为实施例中结构如式vi所示的化合物的制备路线图
[0065]
图6为实施例中结构如式vii所示的化合物的制备路线图
[0066]
图7为实施例中制备的结构如式ii的化合物的h
1-nmr谱图
[0067]
图8为实施例中制备的结构如式ii的化合物的hplc谱图
[0068]
图9为实施例中制备的结构如式v的化合物的h
1-nmr谱图
[0069]
图10为实施例中制备的结构如式v的化合物的hplc谱图
[0070]
图11为实施例中制备的结构如式vi的化合物的h
1-nmr谱图
[0071]
图12为实施例中制备的结构如式vi的化合物的hplc谱图
[0072]
图13为实施例中制备的结构如式vii的化合物的h
1-nmr谱图
[0073]
图14为实施例中制备的结构如式vii的化合物的hplc谱图
具体实施方式
[0074]
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效。
[0075]
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。
[0076]
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
[0077]
本技术实施例中hplc的分析方法如下:
[0078]
仪器:hplc:lc-20a,配紫外检测器
[0079]
试剂:乙腈(色谱级);磷酸(ar级);哇哈哈纯净水
[0080]
样品溶液的配制:称取样品适量,用20%乙腈/水溶解,样品浓度约0.5mg/ml。
[0081]
流动相配置:a相:0.01%h3po4/h2o,在1l容量瓶中加入600ml水,移取0.1ml磷酸于容量瓶中,加水稀释定容,充分混匀。b相:乙腈
[0082]
色谱条件如下所示
[0083][0084]
实施例1
[0085]
本实施例为如图1所示的合成路线:中间体化合物ii的制备。
[0086]
向机械搅拌的100l反应釜中加入化合物i(12kg,61.2mol),二氯甲烷(60l),三乙胺(7.4kg,73.5mol),室温下滴加boc酸酐(16kg,73.5mol),室温反应12h。反应液中滴入稀盐酸(1m,24l),分液后有机相中加入饱和碳酸氢钠溶液(24l)搅拌10min后分出有机相,真空浓缩有机相,得棕色晶体17.2kg,收率95%。图7为本实施例中制备的结构如式ii的化合物的h
1-nmr谱图。
[0087]
图8为实施例中制备的结构如式ii的化合物的hplc谱图。
[0088]
实施例2
[0089]
本实施例为如图2所示的合成路线:结构式如式iii的化合物的制备。
[0090]
向机械搅拌的100l反应釜中加入化合物ii(8kg,27mol),乙烯基磺酸钠水溶液(14.8kg,28.4mol),三乙胺(4.1kg,40.5mol),三苯基磷(629g,2.4mol),乙腈(64l),醋酸钯(48.5g,0.22mol),氩气保护下70~80℃反应12小时,降至室温反应液中加入水(96l),再用80l
×
2的乙酸乙酯洗两次并保留水相,水相采用1mol/l的盐酸酸化至ph为3后,再用80l
×
4的二氯甲烷萃取,合并二氯甲烷真空浓缩得到结构如式iii所示的化合物,无需进一步纯化直接投下一步。
[0091]
实施例3
[0092]
本实施例为如图3所示的合成路线:结构式如式iv的化合物的制备。
[0093]
向机械搅拌的20l反应釜中加入化合物iii(2.39kg,7.4mol),四氢呋喃(8l),10~20℃加入氯化亚砜(1.1kg,8.9mol),滴完升温40~50℃反应3h,反应液降至室温直接投下一步。
[0094]
实施例4
[0095]
本实施例为如图4所示的合成路线:结构式如式v的化合物的制备。
[0096]
向机械搅拌的100l反应釜中加入(3m/l)甲胺的四氢呋喃溶液(15l,44.6mol),控制温度0~10℃,将(3)反应液滴入,搅拌15min后分液,有机相真空浓缩并油泵拉干得粘稠状产物2kg,其中产物有1.6kg,两步收率65%;产物无需进一步纯化直接做下一步反应。
[0097]
图9为本实施例中制备的结构如式v的化合物的h
1-nmr谱图
[0098]
图10为本实施例中制备的结构如式v的化合物的hplc谱图
[0099]
实施例5
[0100]
本实施例为如图5所示的合成路线:结构式如式vi的化合物的制备。
[0101]
向机械搅拌的20l反应釜中加入化合物v(2kg,5.9mol),二氯甲烷(10l),三氟乙酸(2l,1vol),升温至35℃反应12h,降温至10℃,搅拌2h后抽滤,烘干得白色固体1.1kg,收率80%。
[0102]
图11为本实施例中制备的结构如式vi的化合物的h1-nmr谱图。
[0103]
图12为本实施例中制备的结构如式vi的化合物的hplc谱图。
[0104]
实施例6
[0105]
本实施例为如图6所示的合成路线:结构式如式vii的终产物的制备。
[0106]
向机械搅拌的20l氢化釜中加入化合物vi(2kg,8.5mol),四氢呋喃(10l),钯碳(100g),氢气压力加至0.2mpa室温反应12h,抽滤清液真空浓缩干,产物中加入乙酸乙酯(2l),石油醚(10l)打浆2h,抽滤烘干得白色固体1.6kg,收率80%。
[0107]
图13为本实施例中制备的结构如式vii的化合物的h
1-nmr谱图。
[0108]
图14为本实施例中制备的结构如式vii的化合物的hplc谱图。
[0109]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1