同时检测四种B组柯萨奇病毒亚型的核酸组合物及其试剂盒和检测方法与流程
本发明涉及体外分子检测的技术领域,尤其是涉及一种同时检测四种b组柯萨奇病毒亚型的核酸组合物及其试剂盒和检测方法。
背景技术:
柯萨奇病毒(coxsachievirus)是一种肠病毒,以血清学分析依据分为a和b两型,其中a型包含24种亚型,b型包含5种不同亚型。柯萨奇病毒a型感染表现为上呼吸道感染起病急,流涕、咳嗽、咽痛、发热,全身不适;柯萨奇病毒b型感染引起特征性传染性胸肋痛,可合并脑膜脑炎、心肌炎、发热、肝炎、溶血性贫血和肺炎。
目前,在体外核酸检测技术领域中,实时荧光定量pcr技术作为国内外应用最为广泛的技术方法之一,该方法的原理主要基于标记不同颜色taq-man荧光探针,结合相关荧光检测系统仪器,从而达到检测的目的。而在体外病毒rna的核酸检测方法中,主要包括一步法rt-pcr法,荧光染料rt-pcr法和荧光探针rt-pcr法,其中一步法rt-pcr法由于需要进行开盖电泳,容易导致实验室污染,不宜大范围使用;而荧光染料rt-pcr法由于其荧光显色原理导致其易出现假阳性结果,因此也不适合临床检测。荧光探针rt-pcr法由于其特异性高、灵敏度高等优势,目前是应用最为广泛的技术。
上述中的现有技术方案存在以下缺陷:现有的大多数检测试剂盒主要以单重单靶标检测技术为主,每一次操作仅能检测出一种病毒亚型,无法实现同时对多亚型病原体的分型检测,出于临床考虑,需要实现多靶标检测,以完成临床上对柯萨奇病毒的快速分型检测。
技术实现要素:
本发明的目的是提供一种同时检测四种b组柯萨奇病毒亚型的核酸组合物,从而能在一次反应中同时对柯萨奇病毒的四种b组亚型进行分型检测,以完成临床需求。
本发明的上述技术目的是通过以下技术方案得以实现的:
一种同时检测四种b组柯萨奇病毒亚型的核酸组合物,包括以下引物和探针序列:
cb2上游引物序列caccaaagagaagaagtttgcseqidno:1;
cb2下游引物序列cgtgaacagttctaacttcctcseqidno:2;
cb2探针序列cagcttgcctaacactcaccttccatgseqidno:3;
cb3上游引物序列tgctgagtgggtgataacaseqidno:4;
cb3下游引物序列agctccaaatcaaacctcatatacseqidno:5;
cb3探针序列ttcttcgcagttgtaccgcctggcseqidno:6;
cb4上游引物序列ttcgttgtgacatggaactgseqidno:7;
cb4下游引物序列attatttgatgtgtctggaccgseqidno:8;
cb4探针序列tcaagagatgtccaccgccaccaactseqidno:9;
cb5上游引物序列tgggtgatcaataccagacaseqidno:10;
cb5下游引物序列ggactgttcttgtgtacttgttaseqidno:11;
cb5探针序列cgcaactacgccgcaagctggaseqidno:12。
通过采用上述技术方案,本发明设计了不同的荧光标记taq-man探针,并同时设计筛选除了最佳的引物与探针组合,从而减小了不同的引物探针组合之间因相互抑制、竞争等原因而出现交叉扩增的可能性,提高了检测的灵敏度与特异性,进而本发明中的核酸组合物能够对样本中柯萨奇病毒的b2型、b3型、b4型和b5型进行快速筛查,能在一次反应中同时对柯萨奇病毒的四种b组亚型进行分型检测,达到临床需求。
本发明的另一目的在于:提供一种同时检测四种b组柯萨奇病毒亚型的试剂盒,包括上述核酸组合物、dntps、rt-pcrbuffer、酶液和ddh2o。
通过采用上述技术方案,可以利用试剂盒对四种b组柯萨奇病毒亚型进行快速分型检测,从而方便了检测工作进行的同时提高了检测工作的效率,且具有实验结果准确,特异性好,重复性好及操作简便的优点。
本发明在一较佳示例中可以进一步配置为:所述rt-pcrbuffer为10×rt-pcrbuffer,所述rt-pcrbuffer包括400mm的tris-base,0.5%的tritonx-100,80mm的mgcl2,5%甘油。
通过采用上述技术方案,rt-pcrbuffer能在pcr反应体系中起到缓冲作用,从而能为试剂盒中的酶液提供一个最适合酶催化反应的环境。
本发明在一较佳示例中可以进一步配置为:所述dntps包括datp、dctp、dgtp、dutp。
通过采用上述技术方案,datp、dctp、dgtp、dutp这几种核苷酸,将以碱基互补原则,在酶的作用下与上游引物和下游引物进行连接,从而完成rt-pcr的扩增。
本发明在一较佳示例中可以进一步配置为:所述酶液包括逆转录酶m-mlv、热启动化学修饰taqdna聚合酶、rna酶抑制剂以及udg酶。
通过采用上述技术方案,逆转录酶m-mlv为点突变去除了rnaseh的活性中心的逆转录酶,使得rnaseh的活性降低,从而减少了逆转录反应中rna的降解,提高了cdna第一链的得率,进而更容易获得全长cdna。热启动化学修饰taqdna聚合酶可以抑制或将pcr反应中的非特异性dna扩增最小化,而且激活时间更短,活性时间更长,短时间内就可以恢复5’-3’聚合酶活性和5’外切酶活性。rna酶抑制剂能够抑制作为模板的rna的降解,提高cdna第一链的得率,而udg酶则会对cdna中的碱基对进行检查,从而减少cdna中碱基对出现配对错误的可能性,进而提高了探针的识别率。
本发明在一较佳示例中可以进一步配置为:所述逆转录酶m-mlv、热启动化学修饰taqdna聚合酶、rna酶抑制剂以及udg酶的比例为1:4:2:3。
本发明的另一目的在于:提供一种同时检测四种b组柯萨奇病毒亚型的方法,采用荧光探针rt-pcr法,荧光定量pcr扩增反应体系为:
2.5mm/mldntps2μl;
10×rt-pcrbuffer2.5μl;
50pmol/μlcb2上游引物0.1-0.2μl;
50pmol/μlcb2下游引物0.1-0.2μl;
50pmol/μlcb3上游引物0.1-0.2μl;
50pmol/μlcb3下游引物0.1-0.2μl;
50pmol/μlcb4上游引物0.1-0.2μl;
50pmol/μlcb4下游引物0.1-0.2μl;
50pmol/μlcb5上游引物0.1-0.2μl;
50pmol/μlcb5下游引物0.1-0.2μl;
50pmol/μlcb2探针0.03-0.08μl;
50pmol/μlcb3探针0.1-0.15μl;
50pmol/μlcb4探针0.05-0.1μl;
50pmol/μlcb5探针0.1-0.15μl;
酶液0.5-1.5μl;
核酸样本0.5~5μl;
ddh2o补至25μl。
通过采用上述技术方案,本发明构建了一种多重荧光pcr反应体系,且同时对体系中每一个成分的加入量进行了优化,进而保障了检测结果的准确性和重复性。
本发明在一较佳示例中可以进一步配置为:荧光定量pcr扩增反应体系为:
2.5mm/mldntps2μl;
10×rt-pcrbuffer2.5μl;
50pmol/μlcb2上游引物0.1μl;
50pmol/μlcb2下游引物0.1μl;
50pmol/μlcb3上游引物0.2μl;
50pmol/μlcb3下游引物0.2μl;
50pmol/μlcb4上游引物0.1μl;
50pmol/μlcb4下游引物0.1μl;
50pmol/μlcb5上游引物0.2μl;
50pmol/μlcb5下游引物0.2μl;
50pmol/μlcb2探针0.05μl;
50pmol/μlcb3探针0.12μl;
50pmol/μlcb4探针0.08μl;
50pmol/μlcb5探针0.12μl;
酶液1μl;
核酸样本0.5~5μl;
ddh2o补至25μl。
本发明在一较佳示例中可以进一步配置为:荧光定量pcr反应程序为:42-50℃逆转录10-30min,1个循环;93~95℃预变性5~15min,1个循环;93~95℃变性10~20s,;55~60℃退火、延伸、信号采集30~60s;循环40~45次。
通过采用上述技术方案,本发明进一步确定了多重荧光pcr的反应程序,从而能对柯萨奇病毒的b2,b3,b4和b5亚型进行监测,且可同时作为一种技术储备,也可作为技术平台开发其他亚型的检测,以备未来所需。
本发明在一较佳示例中可以进一步配置为:pcr扩增反应程序为:50℃逆转录15min;95℃预变性3min;95℃变性15s;55℃退火、延伸、信号采集40s;循环40次。
综上所述,依据本发明可以得到以下至少一种的有益技术效果:
1.本发明中设计的探针组合,减小了不同的引物探针组合之间因相互抑制,竞争等原因而出现交叉扩增的可能性,提高了检测的灵敏度与特异性;
2.通过设定相应的rt-pcr反应体系,实现了对柯萨奇病毒b2、b3、b4和b5四种亚型的快速分型检测,完成了临床上对柯萨奇病毒b2、b3、b4和b5四种亚型的快速筛查。
附图说明
图1是柯萨奇病毒b2型/b3型/b4型/b5型的四重荧光定量pcr试剂盒核酸样本10倍稀释梯度系列样品的扩增曲线图;
图2是柯萨奇病毒b2型的fam通道定量标准曲线图;
图3是柯萨奇病毒b3型的vic通道定量标准曲线图;
图4是柯萨奇病毒b4型的texasred通道定量标准曲线图;
图5是柯萨奇病毒b5型的cy5通道定量标准曲线图;
图6对照组1阳性参考品扩增曲线结果图;
图7对照组2阳性参考品扩增曲线结果图;
图8是本发明方法对阳性参考品和阴性参考品的扩增结果图;
图9是本发明方法对17例样本的扩增检测结果图;
图10是最佳实施例cb2精密性扩增结果图;
图11是最佳实施例cb3精密性扩增结果图;
图12是最佳实施例cb4精密性扩增结果图;
图13是最佳实施例cb5精密性扩增结果图。
具体实施方式
以下结合附图对本发明作进一步详细说明。
本发明中的柯萨奇b2型、b3型、b4型和b5型病毒及17个样本均来源于深圳市龙华区疾控中心;
提取试剂盒购自天根生化科技(北京)有限公司,病毒基因组dna/rna提取试剂盒(dp315);体外转录试剂盒购自thermoscientifictranscriptaidt7highyieldtranscriptionkit#k0441;
本发明的探针和引物由生工生物工程(上海)股份有限公司合成。
本发明用于检测柯萨奇病毒b2型、柯萨奇病毒b3型、柯萨奇病毒b4型、柯萨奇病毒b5型的四重荧光定量pcr仪包括但不限于:abi系列、bio-rad系列(icycler/mjopticon2)、stratagenemx系列、rochelightcycler、ccpheidsmartcycler、corbettrortor-gene、杭州博日系列。
1、靶基因筛选
分别选择柯萨奇病毒b2型,b3型,b4型,b5型特异性基因作为检测靶基因。
2、引物探针设计
本发明根据柯萨奇病毒b2型、柯萨奇病毒b3型、柯萨奇病毒b4型、柯萨奇病毒b5型的核苷酸序列,分别设计了大量用于检测柯萨奇病毒b2型、柯萨奇病毒b3型、柯萨奇病毒b4型、柯萨奇病毒b5型的四重荧光定量pcr的引物和探针。经过大量筛选后,挑选出一组灵敏度高和特异性强的引物和探针,序列如下:
cb2引物和探针
cb2fcaccaaagagaagaagtttgcseqidno:1
cb2rcgtgaacagttctaacttcctcseqidno:2
cb2pcagcttgcctaacactcaccttccatgseqidno:3
cb2质粒:
ccaccaaagagaagaagtttgccacatggaaggtgagtgttaggcaagctgcgcaactgaggaggaagttagaactgttcacgseqidno:13
cb3引物和探针
cb3ftgctgagtgggtgataacaseqidno:4
cb3ragctccaaatcaaacctcatatacseqidno:5
cb3pttcttcgcagttgtaccgcctggcseqidno:6
cb3质粒:
tgctgagtgggtgataacaactcgccaggcggtacaactgcgaagaaagttggagtttttcacgtatatgaggtttgatttggagctseqidno:14
cb4引物和探针
cb4fttcgttgtgacatggaactgseqidno:7
cb4rattatttgatgtgtctggaccgseqidno:8
cb4ptcaagagatgtccaccgccaccaactseqidno:9
cb4质粒:
ttcgttgtgacatggaactgacattcgtcattactagtcatcaagagatgtccaccgccaccaactctgatgtcccggtccagacacatcaaataatseqidno:15
cb5引物和探针
cb5ftgggtgatcaataccagacaseqidno:10
cb5rggactgttcttgtgtacttgttaseqidno:11
cb5pcgcaactacgccgcaagctggaseqidno:12
cb5质粒:
tgggtgatcaataccagacaggtcgcgcaactacgccgcaagctggaaatgttcacatacgccaggtttgatttggaactcacctttgtgataacaagtacacaagaacagtccseqidno:16
3、质粒制备
为了绘制四重荧光定量pcr的标准曲线,分别提取柯萨奇病毒b2型、柯萨奇病毒b3型、柯萨奇病毒b4型、柯萨奇病毒b5型的rna核酸作为逆转录pcr模板,分别用相应扩增引物将对应的靶序列进行扩增,将扩增产物连入puc57-kan载体中,分别获得含柯萨奇病毒b2型、柯萨奇病毒b3型、柯萨奇病毒b4型、柯萨奇病毒b5型的靶基因序列的质粒,然后将质粒进行体外转录获得相应rna,即柯萨奇病毒b2型、柯萨奇病毒b3型、柯萨奇病毒b4型、柯萨奇病毒b5型核酸样本。
将上述柯萨奇病毒b2型、柯萨奇病毒b3型、柯萨奇病毒b4型、柯萨奇病毒b5型的核酸样本进行10倍梯度稀释作为标准品来检测定量范围,并确定其灵敏度。pcr检测时,对不同的所述基因探针采用荧光标记物进行多色组合探针编码标记,使所述的柯萨奇病毒b2/b3/b4/b5型基因探针上标记的荧光信号不相同。本发明选用了fam、vic、texasred和cy5荧光基团标记,但是本发明要求的权利不仅限于这4种固定荧光标记
在101~106copies/ml范围内4种标准曲线均呈现良好的线性关系,检测灵敏度可达200copies/ml。
4.阳性标准品的四重荧光定量pcr检测
在最优扩增条件下对稀释好的质粒标准品分别进行扩增。
实施例1
荧光定量pcr扩增反应体系为:
2.5mm/mldntps2μl
10×rt-pcrbuffer2.5μl
50pmol/μl引物cvb2-f10.1μl
50pmol/μl引物cvb2-r10.1μl
50pmol/μl引物cvb3-f10.1μl
50pmol/μl引物cvb3-r10.1μl
50pmol/μl引物cvb4-f10.1μl
50pmol/μl引物cvb4-r10.1μl
50pmol/μl引物cvb5-f10.1μl
50pmol/μl引物cvb5-r10.1μl
50pmol/μl探针cvb2-p10.03μl
50pmol/μl探针cvb3-p10.1μl
50pmol/μl探针cvb4-p10.05μl
50pmol/μl探针cvb5-p10.11μl
酶液0.5μl
阳性标准品5μl
ddh2o补至25μl
pcr扩增反应程序为:50℃逆转录15min;95℃预变性3min;95℃变性15s;55℃退火、延伸、信号采集40s;循环40次。
实施例2
荧光定量pcr扩增反应体系为:
2.5mm/mldntps2μl
10×rt-pcrbuffer2.5μl
50pmol/μl引物cvb2-f10.2μl
50pmol/μl引物cvb2-r10.2μl
50pmol/μl引物cvb3-f10.2μl
50pmol/μl引物cvb3-r10.2μl
50pmol/μl引物cvb4-f10.2μl
50pmol/μl引物cvb4-r10.2μl
50pmol/μl引物cvb5-f10.2μl
50pmol/μl引物cvb5-r10.2μl
50pmol/μl探针cvb2-p10.08μl
50pmol/μl探针cvb3-p10.15μl
50pmol/μl探针cvb4-p10.1μl
50pmol/μl探针cvb5-p10.15μl
酶液1.5μl
阳性标准品0.5μl
ddh2o补至25μl
pcr扩增反应程序为:50℃逆转录10min;95℃预变性5min;95℃变性10s;60℃退火、延伸、信号采集30s;循环45次
实施例3
荧光定量pcr扩增反应体系为:
2.5mm/mldntps2μl
10×rt-pcrbuffer2.5μl
50pmol/μl引物cvb2-f10.1μl
50pmol/μl引物cvb2-r10.1μl
50pmol/μl引物cvb3-f10.2μl
50pmol/μl引物cvb3-r10.2μl
50pmol/μl引物cvb4-f10.1μl
50pmol/μl引物cvb4-r10.1μl
50pmol/μl引物cvb5-f10.2μl
50pmol/μl引物cvb5-r10.2μl
50pmol/μl探针cvb2-p10.05μl
50pmol/μl探针cvb3-p10.12μl
50pmol/μl探针cvb4-p10.08μl
50pmol/μl探针cvb5-p10.12μl
酶液1μl
阳性标准品0.5~5μl
ddh2o补至25μl
pcr扩增反应程序为:50℃逆转录15min;95℃预变性5min;95℃变性15s;55℃退火、延伸、信号采集40s;循环40次。
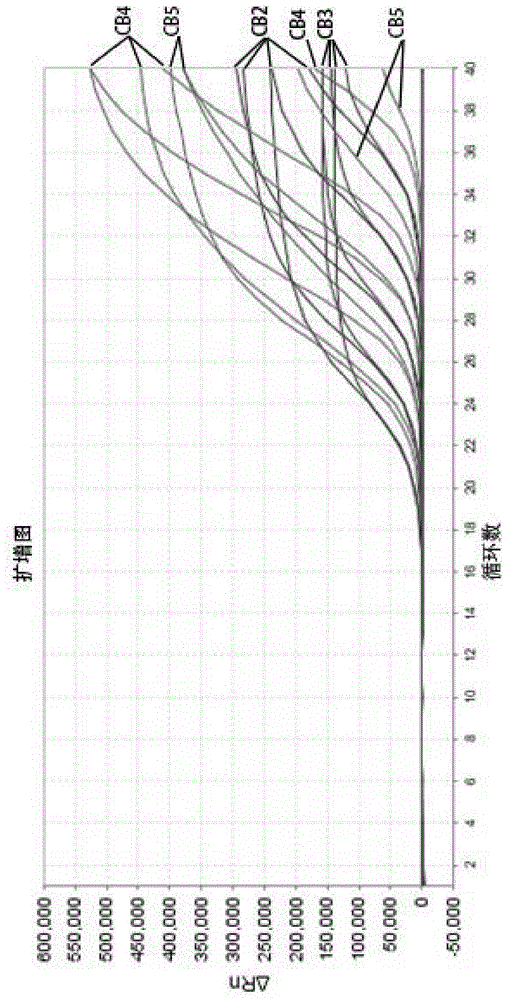
将核酸样本分别采用实施例1-3中的荧光定量pcr扩增反应体系和pcr扩增反应程序进行扩增,实验结果表明,实施例1-3的荧光定量pcr扩增反应体系和pcr扩增反应程序均能扩增出目的条带。图1-5为本发明筛选出的最优荧光定量pcr扩增反应体系和pcr扩增反应程序的实验结果图。
检测结果如图1~5所示,图1为柯萨奇病毒b2\b3\b4和b5型核酸样本10倍稀释梯度系列样品的扩增曲线图;图2为柯萨奇病毒b2型的fam通道核酸样本的梯度曲线图,图3为柯萨奇病毒b3型的vic通道核酸样本的梯度曲线图,图4为柯萨奇病毒b4型的texasred通道核酸样本的梯度曲线图,图5为柯萨奇病毒b5型的cy5通道核酸样本的梯度曲线图。从图中可以看出,在101~106copies/ml范围内4种标准曲线均呈现良好的线性关系,检测灵敏度最低可达200copies/mll(图中由于101浓度太低,试剂盒检测灵敏度达不到,未在图中显示)。
上述结果说明,本发明含有柯萨奇病毒b2\b3\b4和b5型的特异性引物和taqman基因探针,在反应体系中含有柯萨奇病毒b2\b3\b4和b5型基因模板的情况下,可以实现rt-pcr反应,并释放荧光信号。利用荧光定量pcr仪器对pcr过程中相应通道的信号强度进行实时监测和输出,实现检测结果的定性、定量分析。
5.选用其它引物和探针组合对核酸样本的四重荧光定量pcr检测
对比例1
选用柯萨奇病毒b4型引物cvb4-f2替换实施例3中的引物cvb4-f1进行反应,cvb4-f2的核苷酸序列如下:
cvb4-f2gatccaccatcaacttcaccseqidno:17
荧光定量pcr扩增反应体系和pcr扩增反应程序等其它参数与实施例3相同
对比例2
选用柯萨奇病毒b3型引物cvb3-p2替换实施例3中的引物cvb3-p1进行反应,cvb3-p2的核苷酸序列如下:
cvb3-p2atcgctgtatccacatgcttccgctseqidno:18
荧光定量pcr扩增反应体系和pcr扩增反应程序等其它参数与实施例3相同
实验结果如图6、图7所示,对比例1中的cvb4-f2组合会导致cb2和cb4通道出现非特异扩增,存在明显的柯萨奇病毒b4型的假阳性扩增;cvb3-p2组合会导致线性倾斜,柯萨奇病毒cb5通道出现明显扩增延后,同时导致灵敏度降低
6.样本检测
样本核酸提取:待提样品17例,包括5例阳性样本:2例cb2,1例cb3,1例cb4,1例cb5和12例阴性样本:2例ca2,1例ca4,2例ca5,1例ca8,2例ca6,2例ca10,2例ca16。
以提取的核酸为模板进行四重荧光定量pcr扩增。
其中,荧光定量pcr扩增反应体系为:
2.5mm/mldntps2μl
10×rt-pcrbuffer2.5μl
50pmol/μl引物cvb2-f10.1μl
50pmol/μl引物cvb2-r10.1μl
50pmol/μl引物cvb3-f10.2μl
50pmol/μl引物cvb3-r10.2μl
50pmol/μl引物cvb4-f10.1μl
50pmol/μl引物cvb4-r10.1μl
50pmol/μl引物cvb5-f10.2μl
50pmol/μl引物cvb5-r10.2μl
50pmol/μl探针cvb2-p10.05μl
50pmol/μl探针cvb3-p10.12μl
50pmol/μl探针cvb4-p10.08μl
50pmol/μl探针cvb5-p10.12μl
酶液1μl
核酸样本0.5~5μl
ddh2o补至25μl
pcr扩增反应程序为:50℃逆转录15min;95℃预变性3min;95℃变性15s;55℃退火、延伸、信号采集40s;循环40次。
同时,设置阴性对照组和阳性对照组,其中阴性对照为不含有柯萨奇病毒b2型、柯萨奇病毒b3型、柯萨奇病毒b4型、柯萨奇病毒b5型基因组的生理盐水溶液。阳性对照组为同时含有柯萨奇病毒b2型、柯萨奇病毒b3型、柯萨奇病毒b4型和柯萨奇病毒b5型基因组的混合核酸样本的溶液,该混合核酸样本为各单一标准品106浓度按照等体积混合而成。
通过荧光扩增曲线图ct值的大小来判断结果的阴阳性,确定样品中是否含有柯萨奇病毒b2型、柯萨奇病毒b3型、柯萨奇病毒b4型、柯萨奇病毒b5型。当扩增曲线图ct值≤38,并呈现明显指数增长时,结果表现为阳性;当扩增曲线图ct值>38或无ct值,结果表现为阴性;因此,为了在判断阴阳性时具有参照,检测样本时需要给柯萨奇病毒b2型、柯萨奇病毒b3型、柯萨奇病毒b4型、柯萨奇病毒b5型的四重荧光定量pcr检测试剂盒设置阴性对照液和阳性对照液。
检测结果如图8~9所示,其中图8为阳性对照和阴性对照扩增结果图;图9为阴、阳对照组和检测样本的扩增结果,其中检出,2例cb2,1例cb3,1例cb4,1例cb5和6例,其余阴性样本2例ca2,1例ca4,2例ca5,1例ca8,2例ca6,2例ca10,2例ca16全部为阴性,检测结果符合预期,准确率达100%。
7.精密性阳性参考品的四重荧光定量pcr检测
本发明的精密性阳性参考品的制备方法与核酸样本相同,精密性阳性参考品由混合核酸样本稀释获得。精密性阳性参考品的浓度为2.5×105copies/ml。
选择实施例3的荧光定量pcr扩增反应体系和pcr扩增反应程序,检测精密性阳性参考品各10个复孔,实验结果如图10~13所示,结果表明各通道精密性均小于3%
本具体实施方式的实施例均为本发明的较佳实施例,并非依此限制本发明的保护范围,故:凡依本发明的结构、形状、原理所做的等效变化,均应涵盖于本发明的保护范围之内。
序列表
<110>深圳市艾伟迪生物科技有限公司
<120>同时检测四种b组柯萨奇病毒亚型的核酸组合物及其试剂盒和检测方法
<130>wzf000pta01f2000694
<160>1
<170>siposequencelisting1.0
<210>1
<211>21
<212>dna
<213>人工序列()
<220>
- 还没有人留言评论。精彩留言会获得点赞!