鱼肌原纤维蛋白可食性复合膜的制备方法与流程
本发明涉及生物材料技术领域。更具体地说,本发明涉及一种鱼肌原纤维蛋白可食性复合膜的制备方法。
背景技术:
在过去的几十年中,化工合成的塑料薄膜在食品包装的生产和应用中迅速增长。由于合成塑料难以降解,从而导致严重的环境问题。现在,学者们正在寻求能减少与食品包装相关环境问题的可生物降解的材料。目前,研究主要集中在将生物聚合物材料作为食品包装和保存的原材料。由于生物聚合物具有能够防止水分流失、香气损失、氧气渗透、可食用和可生物降解等性质,因此可以使用生物聚合物代替合成包装材料。
鱼类加工的残留物(副产品)可达到鱼类初始重量的70%,被认为是商业价值低的优质原料,大部分未使用,造成了生态环境的危害和经济损失,因此可以考虑将这些副产物制备成可生物降解的鱼蛋白膜。由于二硫键的存在,单一的鱼肌原纤维蛋白(fmp)膜机械性能较差,这使得它们大多数情况下不能具有实际应用。为了增加这种薄膜的柔韧性,必须加入亲水性增塑剂以减少蛋白质-蛋白质相互作用来降低薄膜脆性。但是,添加增塑剂又会降低膜的拉伸强度和水蒸气阻隔性。目前,国内外对肌原纤维蛋白膜的改性研究往往集中于肌原纤维蛋白与单一天然高分子化合物复配等单一改性方式,而对肌原纤维蛋白与多种共混剂复合的研究报道甚少。
技术实现要素:
本发明的一个目的是解决至少上述问题和/或缺陷,并提供至少后面将说明的优点。
本发明还有一个目的是提供了一种鱼肌原纤维蛋白可食性复合膜的制备方法,能够提高复合膜的机械性能,阻水性能,抗菌性能和抗氧化性能。
为了实现本发明的这些目的和其它优点,提供了一种鱼肌原纤维蛋白可食性复合膜的制备方法,包括下列步骤:
步骤一、提取草鱼肌原纤维蛋白;
步骤二、壳聚糖溶液的制备:将壳聚糖溶解于乙酸溶液中得到质量浓度为1%~4%的壳聚糖溶液,搅拌直至澄清,并过滤不溶物;
步骤三、复合膜的制备:向草鱼肌原纤维蛋白中加入蒸馏水,使草鱼肌原纤维蛋白的质量浓度为2%~4%,然后使其在转速为8000~10000r/min的条件下均质1~3min,调节ph至3~4后再在室温下以3000~3500g的离心力离心10~12min,收集上清液;在收集的上清液里加入甘油,搅拌30~40min使其均匀混合,然后和制备的壳聚糖溶液按照体积比4~5:3.5~4进行混合,并加入质量浓度为0.05%~0.2%的迷迭香提取物,均匀混合后得到制作复合膜的混合物溶液;将混合物溶液在38~42℃的烘箱中烘15~18h,得到鱼肌原纤维蛋白可食性复合膜。
优选的是,所述的鱼肌原纤维蛋白可食性复合膜的制备方法,所述提取草鱼肌原纤维蛋白的具体步骤为:
a、取尸僵前草鱼身上的白肉,加工成鱼糜,使用低盐磷酸缓冲液对鱼糜进行溶解,低盐磷酸缓冲液和鱼糜的体积比为3~5:1,并在转速为8000~10000r/min的条件下均质1~3min;
b、静置10~20min,在3000-5000r/min的转速下离心8~12min,重复3~5次,取沉淀物;
c、将步骤b获得的沉淀物溶于高盐缓冲液中,沉淀物与高盐缓冲液的体积比为1:3~5,在转速为8000~10000r/min的条件下均质1~2min,静提20~24h;
d、将步骤c得到的混合物溶液在转速为1000~14000r/min的条件下离心10~15min,取上清液,使用冷凝水对上清液进行沉淀25~35min,冷凝水与上清液的体积比为8~12:1,然后在转速为8000~12000r/min的转速下离心10~12min,取沉淀物即为草鱼肌原纤维蛋白;
其中,上述步骤均在1°~5°温度条件下进行。
优选的是,所述的鱼肌原纤维蛋白可食性复合膜的制备方法,所述将壳聚糖溶解于乙酸溶液中得到质量浓度为1%~4%的壳聚糖溶液具体包括:
将1ml冰乙酸加入99ml去离子水中制备质量浓度为1%的乙酸溶液,然后取1~4g壳聚糖溶于1%乙酸溶液中得到质量浓度为1%~4%的壳聚糖溶液。
优选的是,所述的鱼肌原纤维蛋白可食性复合膜的制备方法,所述步骤三中,使用1mol/l的盐酸溶液将草鱼肌原纤维蛋白溶液的ph值调至3~4。
优选的是,所述的鱼肌原纤维蛋白可食性复合膜的制备方法,所述将混合物溶液在38~42℃的烘箱中烘15~18h,得到鱼肌原纤维蛋白可食性复合膜,具体为:将40ml的混合物溶液倒入13cm的一次性培养皿中,然后放置于烘箱中进行烘烤。
优选的是,所述的鱼肌原纤维蛋白可食性复合膜的制备方法,提取的草鱼肌原纤维蛋白使用双缩脲法进行含量测定。
本发明至少包括以下有益效果:一、草鱼肌原纤维蛋白与壳聚糖复配,能够增加复合膜的机械性能,同时解决了草鱼肌原纤维蛋白单一薄膜带来的阻水性能差的问题;二、制作的该复合膜加工方法中未添加任何化学合成防腐剂,天然环保,同时壳聚糖还能起到一定的抗菌作用;使用具有亲水性的甘油作为增塑剂也减少了蛋白质与蛋白质之间的相互作用降低了复合膜的脆性;三、该复合膜成型后由于美拉德反应以及壳聚糖溶液的颜色作用,使薄膜呈现出一定的淡黄色,具有良好的阻光性;四、制备过程中加入迷迭香提取物也增加了复合膜的抗氧化性能。
本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
图1为本发明的一个实施例中鱼肌原纤维蛋白可食性复合膜的制备方法流程示意图;
图2为实施例1~5值得的产品进行机械性能测定的结果图;
图3为实施例1~5制得的产品进行抗氧化测定的结果图。
具体实施方式
下面结合附图对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不配出一个或多个其它元件或其组合的存在或添加。
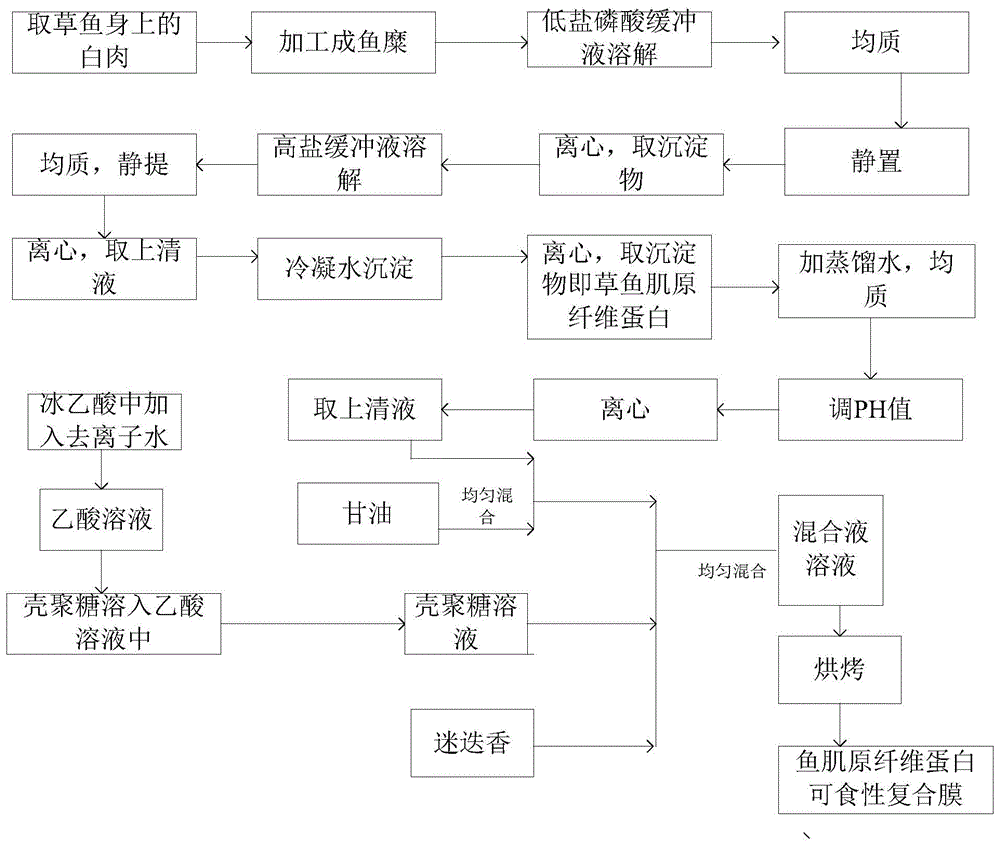
如图1所示,本发明实施例提供了一种鱼肌原纤维蛋白可食性复合膜的制备方法,包括下列步骤:
步骤一、提取草鱼肌原纤维蛋白;
步骤二、壳聚糖溶液的制备:将壳聚糖溶解于乙酸溶液中得到质量浓度为1%~4%的壳聚糖溶液,搅拌直至澄清,并过滤不溶物;
步骤三、复合膜的制备:向草鱼肌原纤维蛋白中加入蒸馏水,使草鱼肌原纤维蛋白的质量浓度为2%~4%,然后使其在转速为8000~10000r/min的条件下均质1~3min,调节ph至3~4后再在室温下以3000~3500g的离心力离心10~12min,收集上清液;在收集的上清液里加入甘油,搅拌30~40min使其均匀混合,然后和制备的壳聚糖溶液按照体积比4~5:3.5~4进行混合,并加入质量浓度为0.05%~0.2%的迷迭香提取物,均匀混合后得到制作复合膜的混合物溶液;将混合物溶液在38~42℃的烘箱中烘15~18h,得到鱼肌原纤维蛋白可食性复合膜。
其中,关于上清液与甘油混合后,和制备的壳聚糖溶液混合的体积比优选可以为4.3:3.7,壳聚糖溶液的浓度优选为2%。
本发明实施例将草鱼肌原纤维蛋白与壳聚糖复配,能够增加复合膜的机械性能,同时解决了草鱼肌原纤维蛋白单一薄膜带来的阻水性能差的问题;制作的该复合膜加工方法中未添加任何化学合成防腐剂,天然环保,同时壳聚糖还能起到一定的抗菌作用;使用具有亲水性的甘油作为增塑剂也减少了蛋白质与蛋白质之间的相互作用降低了复合膜的脆性;该复合膜成型后由于美拉德反应以及壳聚糖溶液的颜色作用,使薄膜呈现出一定的淡黄色,具有良好的阻光性;制备过程中加入迷迭香提取物也增加了复合膜的抗氧化性能。
在其中一种具体实施方式中,所述的鱼肌原纤维蛋白可食性复合膜的制备方法,所述提取草鱼肌原纤维蛋白的具体步骤为:
a、取尸僵前草鱼身上的白肉,加工成鱼糜,使用低盐磷酸缓冲液对鱼糜进行溶解,低盐磷酸缓冲液和鱼糜的体积比为3~5:1,并在转速为8000~10000r/min的条件下均质1~3min;
b、静置10~20min,在3000-5000r/min的转速下离心8~12min,重复3~5次,取沉淀物;
c、将步骤b获得的沉淀物溶于高盐缓冲液中,沉淀物与高盐缓冲液的体积比为1:3~5,在转速为8000~10000r/min的条件下均质1~2min,静提20~24h;
d、将步骤c得到的混合物溶液在转速为1000~14000r/min的条件下离心10~15min,取上清液,使用冷凝水对上清液进行沉淀25~35min,冷凝水与上清液的体积比为8~12:1,然后在转速为8000~12000r/min的转速下离心10~12min,取沉淀物即为草鱼肌原纤维蛋白;
其中,上述步骤均在1°~5°温度条件下进行。
在其中一种具体实施方式中,所述的鱼肌原纤维蛋白可食性复合膜的制备方法,所述将壳聚糖溶解于乙酸溶液中得到质量浓度为1%~4%的壳聚糖溶液具体包括:
将1ml冰乙酸加入99ml去离子水中制备质量浓度为1%的乙酸溶液,然后取1~4g壳聚糖溶于1%乙酸溶液中得到质量浓度为1%~4%的壳聚糖溶液。
在其中一种具体实施方式中,所述的鱼肌原纤维蛋白可食性复合膜的制备方法,所述步骤三中,使用1mol/l的盐酸溶液将草鱼肌原纤维蛋白溶液的ph值调至3~4。
在其中一种具体实施方式中,所述的鱼肌原纤维蛋白可食性复合膜的制备方法,所述将混合物溶液在38~42℃的烘箱中烘15~18h,得到鱼肌原纤维蛋白可食性复合膜,具体为:将40ml的混合物溶液倒入13cm的一次性培养皿中,然后放置于烘箱中进行烘烤。
在其中一种具体实施方式中,所述的鱼肌原纤维蛋白可食性复合膜的制备方法,提取的草鱼肌原纤维蛋白使用双缩脲法进行含量测定。
下面将给出具体的实施例进行说明:
实施例1
s10、提取草鱼肌原纤维蛋白:s11、取尸僵前草鱼身上的白肉,红色不取,去除血及杂质,用食品调理机加工成鱼糜,使用低盐磷酸缓冲液对鱼糜进行溶解,低盐磷酸缓冲液和鱼糜的体积比为3:1,并在转速为8000r/min的条件下均质1min;s12、静置10min,在3000r/min的转速下离心8min,重复3次,取沉淀物;s13、将步骤s12获得的沉淀物溶于高盐缓冲液中,沉淀物与高盐缓冲液的体积比为1:3,在转速为8000r/min的条件下均质1min,静提20h;s14、将步骤s13得到的混合物溶液在转速为1000r/min的条件下离心10min,取上清液,使用冷凝水对上清液进行沉淀25min,冷凝水与上清液的体积比为8:1,然后在转速为8000r/min的转速下离心10min,取沉淀物即为草鱼肌原纤维蛋白;其中,上述步骤均在1°温度条件下进行,提取的草鱼肌原纤维蛋白使用双缩脲法进行含量测定。
s20、壳聚糖溶液的制备:将1ml冰乙酸加入99ml去离子水中制备质量浓度为1%的乙酸溶液,然后取1g壳聚糖溶于1%乙酸溶液中得到质量浓度为1%的壳聚糖溶液,搅拌直至澄清,并过滤不溶物;
s30、复合膜的制备:向草鱼肌原纤维蛋白中加入蒸馏水,使草鱼肌原纤维蛋白的质量浓度为2%,然后使其在转速为8000r/min的条件下均质1min,使用1mol/l的盐酸溶液将草鱼肌原纤维蛋白溶液的ph值调至3后再在室温下以3000g的离心力离心10min,收集上清液;在收集的上清液里加入甘油,搅拌30min使其均匀混合,然后和制备的壳聚糖溶液按照体积比4:3.5进行混合,并加入质量浓度为0.05%的迷迭香提取物,均匀混合后得到制作复合膜的混合物溶液;将40ml的混合物溶液倒入13cm的一次性培养皿中,然后放置于烘箱中进行烘烤,在38℃的条件下烘15h,得到鱼肌原纤维蛋白可食性复合膜。
实施例2
s10、提取草鱼肌原纤维蛋白:s11、取尸僵前草鱼身上的白肉,红色不取,去除血及杂质,用食品调理机加工成鱼糜,使用低盐磷酸缓冲液对鱼糜进行溶解,低盐磷酸缓冲液和鱼糜的体积比为5:1,并在转速为10000r/min的条件下均质3min;s12、静置20min,在5000r/min的转速下离心12min,重复5次,取沉淀物;s13、将步骤s12获得的沉淀物溶于高盐缓冲液中,沉淀物与高盐缓冲液的体积比为1:5,在转速为10000r/min的条件下均质2min,静提24h;s14、将步骤s13得到的混合物溶液在转速为14000r/min的条件下离心15min,取上清液,使用冷凝水对上清液进行沉淀35min,冷凝水与上清液的体积比为12:1,然后在转速为12000r/min的转速下离心12min,取沉淀物即为草鱼肌原纤维蛋白;其中,上述步骤均在5°温度条件下进行,提取的草鱼肌原纤维蛋白使用双缩脲法进行含量测定。
s20、壳聚糖溶液的制备:将1ml冰乙酸加入99ml去离子水中制备质量浓度为1%的乙酸溶液,然后取4g壳聚糖溶于1%乙酸溶液中得到质量浓度为4%的壳聚糖溶液,搅拌直至澄清,并过滤不溶物;
s30、复合膜的制备:向草鱼肌原纤维蛋白中加入蒸馏水,使草鱼肌原纤维蛋白的质量浓度为4%,然后使其在转速为10000r/min的条件下均质3min,使用1mol/l的盐酸溶液将草鱼肌原纤维蛋白溶液的ph值调至4后再在室温下以3500g的离心力离心12min,收集上清液;在收集的上清液里加入甘油,搅拌40min使其均匀混合,然后和制备的壳聚糖溶液按照体积比5:4进行混合,并加入质量浓度为0.2%的迷迭香提取物,均匀混合后得到制作复合膜的混合物溶液;将40ml的混合物溶液倒入13cm的一次性培养皿中,然后放置于烘箱中进行烘烤,在42℃的条件下烘18h,得到鱼肌原纤维蛋白可食性复合膜。
实施例3
s10、提取草鱼肌原纤维蛋白:s11、取尸僵前草鱼身上的白肉,红色不取,去除血及杂质,用食品调理机加工成鱼糜,使用低盐磷酸缓冲液对鱼糜进行溶解,低盐磷酸缓冲液和鱼糜的体积比为4:1,并在转速为9000r/min的条件下均质1min;s12、静置15min,在4000r/min的转速下离心10min,重复3次,取沉淀物;s13、将步骤s12获得的沉淀物溶于高盐缓冲液中,沉淀物与高盐缓冲液的体积比为1:4,在转速为9000r/min的条件下均质1min,静提22h;s14、将步骤s13得到的混合物溶液在转速为12000r/min的条件下离心10min,取上清液,使用冷凝水对上清液进行沉淀30min,冷凝水与上清液的体积比为10:1,然后在转速为10000r/min的转速下离心10min,取沉淀物即为草鱼肌原纤维蛋白;其中,上述步骤均在4°温度条件下进行,提取的草鱼肌原纤维蛋白使用双缩脲法进行含量测定。
s20、壳聚糖溶液的制备:将1ml冰乙酸加入99ml去离子水中制备质量浓度为1%的乙酸溶液,然后取2g壳聚糖溶于1%乙酸溶液中得到质量浓度为1%~4%的壳聚糖溶液,搅拌直至澄清,并过滤不溶物;
s30、复合膜的制备:向草鱼肌原纤维蛋白中加入蒸馏水,使草鱼肌原纤维蛋白的质量浓度为2%,然后使其在转速为9000r/min的条件下均质1min,使用1mol/l的盐酸溶液将草鱼肌原纤维蛋白溶液的ph值调至3后再在室温下以3000g的离心力离心10min,收集上清液;在收集的上清液里加入甘油,搅拌30min使其均匀混合,然后和制备的壳聚糖溶液按照体积比4.3:3.7进行混合,并加入质量浓度为0.10%的迷迭香提取物,均匀混合后得到制作复合膜的混合物溶液;将40ml的混合物溶液倒入13cm的一次性培养皿中,然后放置于烘箱中进行烘烤,在40℃的条件下烘16h,得到鱼肌原纤维蛋白可食性复合膜。
实施例4
s10、提取草鱼肌原纤维蛋白:s11、取尸僵前草鱼身上的白肉,红色不取,去除血及杂质,用食品调理机加工成鱼糜,使用低盐磷酸缓冲液对鱼糜进行溶解,低盐磷酸缓冲液和鱼糜的体积比为4:1,并在转速为9000r/min的条件下均质2min;s12、静置17min,在4000r/min的转速下离心9min,重复4次,取沉淀物;s13、将步骤s12获得的沉淀物溶于高盐缓冲液中,沉淀物与高盐缓冲液的体积比为1:4,在转速为85000r/min的条件下均质2min,静提23h;s14、将步骤s13得到的混合物溶液在转速为13000r/min的条件下离心13min,取上清液,使用冷凝水对上清液进行沉淀30min,冷凝水与上清液的体积比为9:1,然后在转速为11000r/min的转速下离心11min,取沉淀物即为草鱼肌原纤维蛋白;其中,上述步骤均在3°温度条件下进行,提取的草鱼肌原纤维蛋白使用双缩脲法进行含量测定。
s20、壳聚糖溶液的制备:将1ml冰乙酸加入99ml去离子水中制备质量浓度为1%的乙酸溶液,然后取3g壳聚糖溶于1%乙酸溶液中得到质量浓度为3%的壳聚糖溶液,搅拌直至澄清,并过滤不溶物;
s30、复合膜的制备:向草鱼肌原纤维蛋白中加入蒸馏水,使草鱼肌原纤维蛋白的质量浓度为3%,然后使其在转速为9500r/min的条件下均质2min,使用1mol/l的盐酸溶液将草鱼肌原纤维蛋白溶液的ph值调至3后再在室温下以3400g的离心力离心11min,收集上清液;在收集的上清液里加入甘油,搅拌35min使其均匀混合,然后和制备的壳聚糖溶液按照体积比4:3.5进行混合,并加入质量浓度为0.15%的迷迭香提取物,均匀混合后得到制作复合膜的混合物溶液;将40ml的混合物溶液倒入13cm的一次性培养皿中,然后放置于烘箱中进行烘烤,在39℃的条件下烘17h,得到鱼肌原纤维蛋白可食性复合膜。
实施例5
s10、提取草鱼肌原纤维蛋白:s11、取尸僵前草鱼身上的白肉,红色不取,去除血及杂质,用食品调理机加工成鱼糜,使用低盐磷酸缓冲液对鱼糜进行溶解,低盐磷酸缓冲液和鱼糜的体积比为4:1,并在转速为9000r/min的条件下均质2min;s12、静置15min,5000r/min的转速下离心10min,重复5次,取沉淀物;s13、将步骤s12获得的沉淀物溶于高盐缓冲液中,沉淀物与高盐缓冲液的体积比为1:4,在转速为9000r/min的条件下均质2min,静提21h;s14、将步骤s13得到的混合物溶液在转速为12000r/min的条件下离心10min,取上清液,使用冷凝水对上清液进行沉淀30min,冷凝水与上清液的体积比为9:1,然后在转速为9000r/min的转速下离心012min,取沉淀物即为草鱼肌原纤维蛋白;其中,上述步骤均在4°温度条件下进行,提取的草鱼肌原纤维蛋白使用双缩脲法进行含量测定。
s20、壳聚糖溶液的制备:将1ml冰乙酸加入99ml去离子水中制备质量浓度为1%的乙酸溶液,然后取2g壳聚糖溶于1%乙酸溶液中得到质量浓度为2%的壳聚糖溶液,搅拌直至澄清,并过滤不溶物;
s30、复合膜的制备:向草鱼肌原纤维蛋白中加入蒸馏水,使草鱼肌原纤维蛋白的质量浓度为2%,然后使其在转速为9000r/min的条件下均质1min,使用1mol/l的盐酸溶液将草鱼肌原纤维蛋白溶液的ph值调至3后再在室温下以3000g的离心力离心12min,收集上清液;在收集的上清液里加入甘油,搅拌40min使其均匀混合,然后和制备的壳聚糖溶液按照体积比4:3.5进行混合,均匀混合后得到制作复合膜的混合物溶液;将40ml的混合物溶液倒入13cm的一次性培养皿中,然后放置于烘箱中进行烘烤,在38℃的条件下烘17h,得到鱼肌原纤维蛋白可食性复合膜。
将实施例1、2、3、4、5制得的产品进行机械性能测定。用制样刀制取50mm×20mm矩形样品,放入温度25℃,相对湿度50%的恒温恒湿箱内平衡12h,取出后用质构仪测定其抗拉强度(ts)和断裂伸长率(e),两夹头间试样长度为30mm,试验速度为2.00mm/s,进行3次平行试验,取平均值(wangn2015)。
抗拉强度:ts=f/a
式中:ts—样品的抗拉强度(mpa);
f—样品断裂时承受的最大张力(n);
a—样品试验前的横截面积(mm2)。
断裂伸长率:e=(l-l0/l0)×100%
式中:e—样品的断裂伸长率;
l0—样品测试前的长度,mm;
l—样品在断裂时的长度,mm。
测试结果如图2所示。
将实施例1、2、3、4、5制得的产品进行抗氧化性测定。向薄膜样品(25mg)中加入3ml蒸馏水,并剧烈搅拌3h。在此之后,将混合物在3000g离心力下使用离心机离心10分钟。所得上清液进一步用于dpph自由基清除活性和铁还原抗氧化剂能力的测定。在薄膜提取液(1.5ml)中加入在95%乙醇中的1.5ml,0.15mm2,2-二苯基-1-吡啶酰肼(dpph),然后充分混合。之后,将混合物在室温下在黑暗中保持30分钟,然后使用分光光度计在517nm处测量吸光度。计算dpph自由基清除活性,并表示为dpph清除活性的百分比。测试结果如图3所示。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用。它完全可以被适用于各种适合本发明的领域。对于熟悉本领域的人员而言,可容易地实现另外的修改。因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
- 还没有人留言评论。精彩留言会获得点赞!