黄酮-8-羟化酶及其在8-羟基黄酮化合物合成中的应用
黄酮-8-羟化酶及其在8-羟基黄酮化合物合成中的应用
1.相关申请的交叉引用
2.本申请要求2019年12月26日提交的申请号为201911369033.2的中国发明专利申请的优先权和权益,其整体内容通过引用的方式纳入本文。
技术领域
3.本发明涉及生物技术领域,具体地,本发明涉及黄酮-8-羟化酶及其在8-羟基黄酮化合物中的应用。
背景技术:
4.黄酮-8-羟化酶(f8h)最早在菊科植物(chrysanthemum segetum)的花瓣中发现,在nadph和fad存在的情况下,它可以催化黄酮醇和黄酮的8位羟基化。此外,2014年berim等在紫花罗勒中分离出一种rieske类型的黄酮8位羟化酶,它可以将三裂鼠尾草素或者蓟黄素(crisimaritin)转化为8-羟基三裂鼠尾草素或者8-羟基蓟黄素。zhao等在2017年报道一种来自黄芩的f8h,它可以催化白杨素的8位羟基化,但是效率非常低。
5.唇形科植物半枝莲中含有丰富的汉黄芩素以及汉黄芩苷,汉黄芩素是由白杨素经过8位羟基化和甲基化修饰后得到的一类具有抗肝癌活性的化合物。但是,目前尚无半枝莲来源的黄酮8-羟化酶的相关报道,因此本领域迫切需要筛选一类高效的黄酮-8-羟化酶,开发一种天然合成汉黄芩素的方法。
技术实现要素:
6.本发明提供一种高效的黄酮-8-羟化酶,并提供一种8-羟基黄酮化合物合成的方法。
7.本发明提供如下技术方案:
8.第一方面,本发明提供一种黄酮-8-羟化酶,其选自以下组:
9.(a)具有seq id no:1或2或3所示氨基酸序列的蛋白;
10.(b)由seq id no:1或2或3所示氨基酸序列经过一个或数个,优选1-50个,更优选1-30个,还要优选1-10个,最优选1-6个氨基酸残基的缺失或添加而形成的且具有(a)所述蛋白功能的衍生蛋白;例如是在seq id no:1或2或3所示氨基酸序列的c末端和/或n末端添加或缺失一个或数个,优选1-50个,更优选1-30个,还要优选1-10个,最优选1-6个氨基酸残基而形成的且具有催化黄酮类化合物8位羟基化活性的衍生蛋白;或者
11.(c)氨基酸序列与seq id no:1或2或3所示氨基酸序列具有同源性≥50%(例如≥70%、再例如≥90%),且具有催化黄酮类化合物8位羟基化活性的衍生蛋白。
12.在一个实施方案中,所述(b)是由(a)的氨基酸序列添加标签序列、信号序列或分泌序列后所形成的融合蛋白。
13.在一个实施方案中,所述黄酮-8-羟化酶是来源于半枝莲或猴面花。
14.第二方面,本发明还提供一种分离的多核苷酸,所述多核苷酸包括选自以下组的
核苷酸序列:
15.(a)编码如seq id no:1或2或3所示蛋白的核苷酸序列;
16.(b)seq id no:4或5或6所示的核苷酸序列;
17.(c)seq id no:4或5或6所示的5’端和/或3’端截短的核苷酸序列或者添加核苷酸所形成的核苷酸序列;
18.(d)与seq id no:4或5或6所示核苷酸序列具有同源性≥50%(例如≥70%、再例如≥90%)的核苷酸序列;
19.(e)上述(a)-(d)任一核苷酸序列互补的核苷酸序列。
20.在一个实施方案中,所述(e)所述的核苷酸序列与(a)-(d)任一核苷酸序列完全互补。
21.在一个实施方案中,所述seq id no:4或5或6所示的核苷酸序列分别编码seq id no:1或2或3所示的蛋白。
22.第三方面,本发明进一步提供一种载体,所述载体含有本发明所述的多核苷酸。
23.在一个实施方案中,所述载体是可以在酵母菌种表达的载体,所述载体选自细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒或其他载体,例如ycp系列载体、yep系列载体、yip系列载体、pcs系列载体、prs系列载体。
24.第四方面,本发明还提供一种重组的宿主细胞,其包括如第二方面所述的多核苷酸。
25.在一个实施方案中,所述重组的宿主细胞包括本发明第三方面所述的载体,或者其基因组中整合第二方面所述的多核苷酸。
26.在一个实施方案中,所述重组的宿主细胞是来源于原核细胞或真核细胞,例如是真菌或者细菌细胞;具体地,所述宿主细胞可以是酿酒酵母或者大肠杆菌。在一个实施方案中,所述重组的宿主细胞具有表达黄酮-8-羟化酶的能力。
27.在一个实施方案中,所述重组的宿主细胞还进一步包含编码c8位甲基化酶的核苷酸序列。
28.第五方面,本发明提供本发明所述黄酮-8-羟化酶或所述载体或所述重组的宿主细胞的用途,其用于催化黄酮类化合物8位碳的羟基化反应。
29.在一个实施方案中,所述黄酮类化合物选自白杨素、芹菜素、山奈酚中的至少一种。
30.在一个实施方案中,所述黄酮-8-羟化酶催化白杨素8位碳的羟基化反应,生成去甲汉黄芩素。
31.在一个实施方案中,所述黄酮-8-羟化酶催化芹菜素8位碳的羟基化反应,生成异野黄芩素。
32.在一个实施方案中,所述黄酮-8-羟化酶催化山奈酚8位碳的羟基化反应,生成8-羟基-山奈酚。
33.第六方面,本发明提供一种8-羟基-黄酮化合物的制备方法,包括将本发明所述黄酮-8-羟化酶与底物接触,催化底物的c8位点发生羟基化反应,制备8-羟基-黄酮化合物,其中所述底物为黄酮类化合物。
34.在一个实施方案中,所述黄酮类化合物选自白杨素、芹菜素、山奈酚中的至少一
种。
35.在一个实施方案中,所述8-羟基-黄酮化合物为去甲汉黄芩素、异野黄芩素或8-羟基-山奈酚中的至少一种。
36.在一个实施方案中,所述制备方法包括制备所述黄酮-8-羟化酶的步骤,例如将第四方面所述的重组的宿主细胞进行培养,制备所述黄酮-8-羟化酶。在一个具体实施方案中,可以从培养液中分离所述黄酮-8-羟化酶,或者在培养液中加入底物进行反应。
37.在一个实施方案中,所述制备方法包括发酵培养重组的酿酒酵母菌株,并在发酵培养基中加入所述底物进行发酵培养,制备所述8-羟基-黄酮化合物。
38.本发明还提供一种以葡萄糖为底物制备汉黄芩素的方法,包括培养重组的宿主细胞,并加入葡萄糖进行反应,其中所述重组的宿主细胞可表达如第一方面所述的黄酮-8-羟化酶和c8位甲基化酶。
39.在一个实施方案中,所述重组的宿主细胞具有如第四方面所述的含义。
40.有益效果:
41.(1)本发明首次提供了半枝莲、猴面花、黄芩来源的黄酮-8-羟化酶,并发现半枝莲、猴面花、黄芩来源的黄酮-8-羟化酶能够催化白杨素的c8进行羟基化的催化反应,从而获得去甲汉芩素。
42.(2)本发明还首次揭示本发明的黄酮-8-羟化酶也具有催化芹菜素、山奈酚的c8进行羟基化的催化反应的功能,并可以用于以葡萄糖为底物制备汉黄芩素,提供了一种制备汉黄芩素的新思路。
附图说明
43.图1为f8h的氨基酸序列比对和进化分析图。
44.图2为重组质粒y22-atr2-sbarf8h的质粒图谱。
45.图3为重组质粒y22-atr2-egf8h的质粒图谱。
46.图4为重组质粒y22-atr2-sbaif8h的质粒图谱。
47.图5为sbarf8h催化白杨素8位羟基化反应合成去甲汉黄芩素的hplc-ms分析图。
48.图6为sbarf8h催化芹菜素8位羟基化反应合成异野黄芩素的hplc-ms分析图。
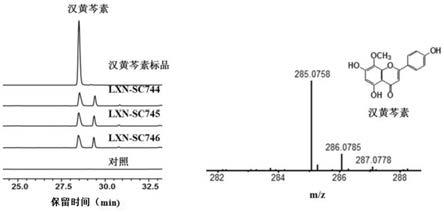
49.图7为sbarf8h催化山奈酚8位羟基化反应合成8-羟基山奈酚的hplc-ms分析图。
50.图8为egf8h催化白杨素8位羟基化反应合成去甲汉黄芩素的hplc-ms分析图。
51.图9为egf8h催化芹菜素8位羟基化反应合成异野黄芩素的hplc-ms分析图。
52.图10为egf8h催化山奈酚8位羟基化反应合成8-羟基山奈酚的hplc-ms分析图。
53.图11为sbaif8h催化白杨素8位羟基化反应合成去甲汉黄芩素的hplc-ms分析图。
54.图12为sbaif8h催化芹菜素8位羟基化反应合成异野黄芩素的hplc-ms分析图。
55.图13为sbaif8h催化山奈酚8位羟基化反应合成8-羟基山奈酚的hplc-ms分析图。
56.图14为酿酒酵母菌株从头合成汉黄芩素的hplc-ms分析图。
具体实施方式
57.下文将结合具体实施例对本发明的制备方法做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。
羟化酶”的差别可以是氨基酸序列上的差异,也可以是不影响序列的修饰形式上的差异,或者兼而有之。这些多肽包括天然或诱导的遗传变异体。诱导变异体可以通过各种技术得到,如通过辐射或暴露于诱变剂而产生随机诱变,还可通过定点诱变法或其他已知分子生物学的技术。类似物还包括具有不同于天然l-氨基酸的残基(如d-氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的蛋白并不限于上述例举的代表性蛋白。
65.修饰(通常不改变一级结构)形式包括:体内或体外的多肽的化学衍生形式如乙酰化或羧基化。修饰还包括糖基化。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的蛋白。
66.在本发明中,“黄酮-8-羟化酶”的保守性变异多肽指与seq id no:1或2或3所示氨基酸序列相比,有至多20个,较佳地至多10个,更佳地至多5个,最佳地至多3个氨基酸被性质相似或相近的氨基酸所替换而形成多肽,但所述保守性变异多肽依然具有与氨基酸序列如seq id no:1或2或3所示蛋白相同或相似的活性,即,催化白杨素8位羟基化的活性。
67.因此,本文所用的“含有”,“具有”或“包括”包括了“包含”、“主要由
……
构成”、“基本上由
……
构成”、和“由
……
构成”;“主要由
……
构成”、“基本上由
……
构成”和“由
……
构成”属于“含有”、“具有”或“包括”的下位概念。
68.本发明的蛋白可以是重组蛋白、天然蛋白、合成蛋白,优选重组蛋白。本发明的蛋白可以是天然纯化的产物,或是化学合成的产物,或使用重组技术从原核或真核宿主(例如,细菌、酵母、高等植物、昆虫和哺乳动物细胞)中产生。根据重组生产方案所用的宿主,本发明的蛋白可以是糖基化的,或可以是非糖基化的。本发明的蛋白还可包括或不包括起始的甲硫氨酸残基。
69.本领域技术人员明白,本发明的“黄酮-8-羟化酶”还包括“黄酮-8-羟化酶”的片段、衍生物和类似物。如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持本发明的“黄酮-8-羟化酶”相同的生物学功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的,或(ii)在一个或多个氨基酸残基中具有取代基团的多肽,或(iii)成熟多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽,或(iv)附加的氨基酸序列融合到此多肽序列而形成的多肽(如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列,或融合蛋白)。根据本文的定义这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。
70.基于本发明的教导和本领域普通技术知识,本领域技术人员不难获得本发明黄酮-8-羟化酶的活性片段。因此,任何一种“黄酮-8-羟化酶”的生物活性片段都可以应用于本发明。在本文中,“黄酮-8-羟化酶”的生物活性片段是指“黄酮-8-羟化酶”的片段,但其仍然能保持全长“黄酮-8-羟化酶”的全部或部分功能。通常情况下,所述的生物活性片段至少保持全长“黄酮-8-羟化酶”的50%的活性。在更优选的条件下,所述活性片段能够保持全长“黄酮-8-羟化酶”的60%、70%、80%、90%、95%、99%、或100%的活性。
71.基于本发明的教导和现有技术,本领域技术人员还可以明白,可以将本发明的黄
酮-8-羟化酶制成固定化酶等其它利用形式。
72.本发明还提供了编码本发明“黄酮-8-羟化酶”或其保守性变异多肽的多核苷酸序列。
73.本发明的多核苷酸可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的。dna可以是编码链或非编码链。编码成熟多肽的编码区序列可以与seq id no:4或5或6所示的编码区序列相同或者是简并的变异体。如本文所用,“简并的变异体”在本发明中是指编码具有seq id no:1或2或3所示的蛋白质,但与seq id no:4或5或6所示的编码区序列有差别的核酸序列。
74.编码seq id no:1或2或3所示的成熟多肽的多核苷酸包括:只编码成熟多肽的编码序列;成熟多肽的编码序列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。
75.术语“编码多肽的多核苷酸”可以是包括编码所述多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
76.本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的多肽或多肽的片段、类似物和衍生物。此多核苷酸的变异体可以是天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码的多肽的功能。
77.本发明还涉及与上述的序列杂交且两个序列之间具有至少50%,较佳地至少70%,更佳地至少80%相同性的多核苷酸。本发明特别涉及在严格条件下与本发明所述多核苷酸可杂交的多核苷酸。在本发明中,“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2
×
ssc,0.1%sds,60℃;或(2)杂交时加有变性剂,如50%(v/v)甲酰胺,0.1%小牛血清/0.1%ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。并且,可杂交的多核苷酸编码的多肽与seq id no.:1或2或3所示的成熟多肽有相同的生物学功能和活性。
78.本发明还涉及与上述的序列杂交的核酸片段。如本文所用,“核酸片段”的长度至少含15个核苷酸,较好是至少30个核苷酸,更好是至少50个核苷酸,最好是至少100个核苷酸以上。核酸片段可用于核酸的扩增技术(如pcr)以确定和/或分离编码“黄酮-8-羟化酶”的多聚核苷酸。
79.本发明的“黄酮-8-羟化酶”核苷酸全长序列或其片段通常可以用pcr扩增法、重组法或人工合成的方法获得。对于pcr扩增法,可根据本发明所公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cdna库或按本领域技术人员已知的常规方法所制备的cdna库作为模板,扩增而得有关序列。
80.一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。
81.目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和
细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。
82.在优选的实施方式中,所述“黄酮-8-羟化酶”是:(a)具有seq id no:1、或2或3所示氨基酸序列的蛋白;或(b)由seq id no:1或2或3所示氨基酸序列经过一个或数个,优选1-50个,更优选1-30个,还要优选1-10个,最优选1-6个氨基酸残基的缺失或添加而形成的且具有(a)所述蛋白功能的衍生蛋白;例如在seq id no:1或2或3所示氨基酸序列的c末端和/或n末端添加或缺失一个或数个,优选1-50个,更优选1-30个,还要优选1-10个,最优选1-6个氨基酸残基而形成的且具有催化黄酮类化合物8位羟基化活性的衍生蛋白;或(c)氨基酸序列与seq id no:1或2或3所示氨基酸序列具有同源性≥50%(例如≥70%、再例如≥90%),且具有催化黄酮类化合物8位羟基化活性的衍生蛋白。
83.相应地,所述“黄酮-8-羟化酶”的编码基因是:
84.(a)氨基酸序列如seq id no:1或2或3所示的蛋白的编码核苷酸序列;或
85.(b)由seq id no:1或2或3所示氨基酸序列经过一个或数个,优选1-50个,更优选1-30个,还要优选1-10个,最优选1-6个氨基酸残基的取代、缺失或添加而形成的且具有氨基酸序列如seq id no:1或2或3所示蛋白功能的衍生蛋白的编码核苷酸序列;例如在seq id no:1或2或3所示氨基酸序列的c末端和/或n末端添加或缺失一个或数个,优选1-50个,更优选1-30个,还要优选1-10个,最优选1-6个氨基酸残基而形成的且具有(a)所述蛋白功能的衍生蛋白的编码序列;或
86.(c)氨基酸序列与seq id no:1或2或3所示氨基酸序列具有同源性≥50%(例如≥70%、再例如≥90%),且具有催化黄酮类化合物8位羟基化活性的衍生蛋白的编码序列。
87.在一个实施方案中,所述编码基因是:
88.(a)编码如seq id no:1或2或3所示蛋白的核苷酸序列;
89.(b)seq id no:4或5或6所示的核苷酸序列;
90.(c)seq id no:4或5或6所示的5’端和/或3’端截短的核苷酸序列或者添加核苷酸所形成的核苷酸序列;
91.(d)与seq id no:4或5或6所示核苷酸序列具有同源性≥50%(例如≥70%、再例如≥90%)的核苷酸序列;
92.(e)上述(a)-(d)任一核苷酸序列互补的核苷酸序列。
93.在进一步优选的实施方式中,所述“黄酮-8-羟化酶”的编码基因是:(i)具有seq id no:4或5或6所示序列的多核苷酸;或(ii)具有与seq id no:4或5或6所示序列互补的多核苷酸。
94.表达载体
95.本发明也涉及包含本发明编码核苷酸序列的表达载体,以及用本发明的表达载体或“黄酮-8-羟化酶”编码序列经基因工程产生的宿主细胞,以及经重组技术产生本发明所述多肽的方法。
96.通过常规的重组dna技术(science,1984;224:1431),可利用本发明的多核苷酸序列来表达或生产重组的“黄酮-8-羟化酶”。一般来说有以下步骤:
97.1.用本发明的编码“黄酮-8-羟化酶”的多核苷酸(或其变异体),或用含有该多核苷酸的重组表达载体转化或转导合适的宿主细胞;
98.2.在合适的培养基中培养的宿主细胞;
laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
110.如果没有特别说明,实施例中所用的材料均为市售产品。
111.本发明中所用的基因序列由苏州泓迅生物科技有限公司合成。在本发明中,半枝莲、猴面花、黄芩三种植物来源的具有黄酮化合物8位羟化酶功能的多肽,分别命名为sbarf8h、egf8h、sbaif8h,分别为seq id no:1、seq id no:2和seq id no:3所示的氨基酸序列组成的多肽。
112.实施例1构建sbarf8h、egf8h、sbaif8h表达载体
113.针对表达sbarf8h、egf8h、sbaif8h宿主细胞的不同,选取穿梭质粒载体进行ycplacz-22克隆构建。
114.1.1基因片段的扩增、纯化
115.以sbarf8h-f(seq id no:7)、sbarf6h-r(seq id no:8)为引物,以半枝莲cdna为模板进行常规pcr扩增;或以egf8h-f(seq id no:9)、egf8h-r(seq id no:10)为引物,以人工合成序列egf8h为模板进行常规pcr扩增,并将所得的扩增片段进行切胶纯化;或以sbaif8h-f(seq id no:11)、sbaif8h-r(seq id no:12)为引物,以人工合成序列egf8h为模板进行常规pcr扩增,并将所得的扩增片段进行切胶纯化;
116.根据拟南芥(arabidopsis thaliana)来源的p450还原酶(atr2)基因序列(genbank号:145361355)设计引物atr2-f(seq id no:13)和atr2-r(seq id no:14),以拟南芥cdna为模板进行常规pcr得到atr2的编码核苷酸,并将所得的扩增片段进行切胶纯化;
117.使用引物pgk1+tdh-f(seq id no:15)和pgk1+tdh-r(seq id no:16),利用常规pcr方法,特异性扩增双向启动子pgk1+tdh3的核苷酸,并将所得的扩增片段进行切胶纯化。使用引物y22-f(seq id no:17)和y22-r(seq id no:18),载体ycplac22的核苷酸,并将所得的扩增片段进行切胶纯化。
118.1.2利用gibson组装技术构建分别含有基因sbarf8h、egf8h、sbaif8h和atr2的重组载体
119.将片段加入gibson mix中后,补水至10μl,混匀放入50℃环境内,反应1h后,经过dmt酶消化,纯化,然后转化入大肠杆菌dh5α感受态内。测序所得正确的重组载体分别命名为y22-atr2-sbarf8h、y22-atr2-egf8h、y22-atr2-sbaif8h。其物理图谱分别图2、图3、图4所示。
120.实施例2产8-羟基黄酮酿酒酵母菌构建
121.利用常规醋酸锂转化方法分别将实施例1中1.2所述重组载体y22-atr2-sbarf8h、y22-atr2-egf8h、y22-atr2-sbaif8h转化入酿酒酵母野生菌w303-1b中,挑取可以在色氨酸缺陷的sd培养基上长出的克隆,命名为w303-sbarf8h、w303-egf8h和w303-sbaif8h。以浓度1mm的白杨素、芹菜素或山奈酚为底物进行后续发酵培养。
122.实施例3从头合成汉黄芩素酿酒酵母菌构建
123.利用常规醋酸锂转化方法将重组载体y22-atr2-sbarf8h或者y22-atr2-egf8h或者y22-atr2-sbaif8h质粒与含有8位甲基化酶基因(pfomt5,参考文献:the reference genome sequence of scutellaria baicalensis provides insights into the evolution ofwogonin biosynthesis,mol plant.2019jul 1;12(7):935-950)的重组载体
共转化入白杨素生产酿酒酵母宿主菌中,挑取可以在组氨酸、色氨酸及尿嘧啶缺陷的sd培养基上长出的阳性克隆,命名为lxn-sc744和lxn-sc745和lxn-sc746。并以葡萄糖为底物进行发酵生产汉黄芩素。
124.实施例4发酵生产8-羟基黄酮
125.4.1酿酒酵母工程菌株种子液培养
126.选用sd培养基(购自索莱宝生物科技有限公司)(配方:ynb w/o aa(0.67%),葡萄糖(2g/l),dropoutpowder(0.083%),其中dropout powder中含有(mg/l):苏氨酸150,酪氨酸30,缬氨酸150,赖氨酸30,谷氨酸100,丝氨酸150,天冬氨酸100,甲硫氨酸20,苯丙氨酸50,异亮氨酸30,精氨酸20;其它营养成分(mg/l):腺嘌呤50,尿嘧啶50,组氨酸100,亮氨酸100,色氨酸100(氨基酸)),液体培养基调ph5.6,固体培养基加1.5%琼脂粉(购自索莱宝生物科技有限公司),调ph6.5。分别在平板上挑取单克隆到含有4ml灭过菌的培养基的试管中,于30℃、200rpm条件下对酿酒酵母工程菌株进行过夜培养。
127.4.2发酵生产
128.将种子液以1:50的接种比例接种到灭菌后的24孔板中,加入终浓度为1mm相应的底物,在30℃、800rpm条件下发酵培养4天。从头合成目的产物的菌株,直接将种子液以1:50的接种比例接种到30ml培养基中,在30℃、800rpm条件下,摇瓶发酵培养4天。
129.实施例5反应产物的lc-ms鉴定
130.5.1发酵结束后,取900ul样品,加入等体积的无水甲醇,用超声清洗仪进行超声30min。12000rpm离心10min,上清液做高效液相分析。
131.5.28-羟基黄酮的hplc检测条件:
132.仪器:岛津高效液相色谱仪1200
133.色谱柱:kinetex h15-168747(4.6
×
250mm),紫外检测器,白杨素检测波长290nm、芹菜素和山奈酚检测波长335nm。
134.流动相:a相为0.1%甲酸;b相为乙腈;c相为甲醇
135.起始浓度a:75%b:22%c:5%
136.流速:1ml/min
137.柱温:30℃
138.检测器:pda检测器
139.梯度洗脱程序:(浓度为b相百分比)
[0140][0141]
5.3lc-ms检测条件
[0142]
质谱仪:bruker-microtof-ii:
[0143]
esi离子源,正离子模式
[0144]
核质比(m/z):50-1000
[0145]
氮气流速:6.0升/分钟
[0146]
温度:180℃
[0147]
雾化器压力:1bar
[0148]
探头电压:14.5kv。
[0149]
5.3sbarf8h活性鉴定
[0150]
以1mm白杨素为底物对菌株w303-sbarf8h进行发酵,发酵产物经过hplc检测结果显示,sbarf8h可以催化白杨素生成一个新产物,出峰时间为19.3min与去甲汉黄芩素标品相一致(图5),质谱结果显示该新产物分子量为(m/z,271[m+h]
+
),这与去甲汉黄芩素标品的分子量一致,确定该物质是去甲汉黄芩素。
[0151]
另外,sbarf8h还可以催化芹菜素生成一个新产物,出峰时间为9.2min(图6),质谱结果显示该新产物的分子量为(m/z,287[m+h]
+
),这与异野黄芩素标品的分子量一致,确定该物质是异野黄芩素。
[0152]
另外,sbarf8h还可以催化山奈酚生成一个新产物,出峰时间为10.1min(图7),质谱结果显示该新产物的分子量为(m/z,303[m+h]+),这与8位羟基化的山奈酚的分子量一致。
[0153]
5.4egf8h活性鉴定
[0154]
以1mm白杨素为底物对菌株w303-egf8h进行发酵,发酵产物经过hplc检测结果显示,egf8h可以催化白杨素生成一个新产物,出峰时间为19.3min与去甲汉黄芩素标品相一致(图8),质谱结果显示该新产物分子量为(m/z,271[m+h]
+
),这与去甲汉黄芩素标品的分子量一致,确定该物质是去甲汉黄芩素。
[0155]
另外,egf8h还可以催化芹菜素生成一个新产物,出峰时间为9.2min(图9),质谱结果显示该新产物的分子量为(m/z,287[m+h]
+
),这与异野黄芩素标品的分子量一致,确定该物质是异野黄芩素。
[0156]
另外,egf8h还可以催化山奈酚生成一个新产物,出峰时间为10.1min min,质谱结果显示(图10)该新产物的分子量为(m/z,303[m+h]
+
),这与8位羟基化的山奈酚的分子量一致。
[0157]
5.5sbaif8h活性鉴定
[0158]
以1mm白杨素为底物对菌株w303-sbaif8h进行发酵,发酵产物经过hplc检测结果显示,sbaif8h可以催化白杨素生成一个新产物,出峰时间为19.3min与去甲汉黄芩素标品相一致(图11),质谱结果显示该新产物分子量为(m/z,271[m+h]
+
),这与去甲汉黄芩素标品的分子量一致,确定该物质是去甲汉黄芩素。
[0159]
另外,sbaif8h还可以催化芹菜素生成一个新产物,出峰时间为9.2min(图12),质谱结果显示该新产物的分子量为(m/z,287[m+h]
+
),这与异野黄芩素标品的分子量一致,确定该物质是异野黄芩素。
[0160]
另外,sbaif8h还可以催化山奈酚生成一个新产物,出峰时间为10.1min,质谱结果显示(图13)该新产物的分子量为(m/z,303[m+h]
+
),这与8位羟基化的山奈酚的分子量一致。
[0161]
5.5以葡萄糖为底物从头合成汉黄芩素
[0162]
在sd培养基发酵菌株lxn-sc744和lxn-sc745,产物进行hplc检测。结果显示,28.5min时两者都可以催化葡萄糖生成新产物,并且与汉黄芩素标品出峰时间相一致(图14)。质谱结果显示该新产物分子量为(m/z,285[m+h]
+
),这与汉黄芩素标品的分子量一致,确定该物质是汉黄芩素。
[0163]
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的记载的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1