一种轴手性吡啶联芳环类化合物及其制备方法
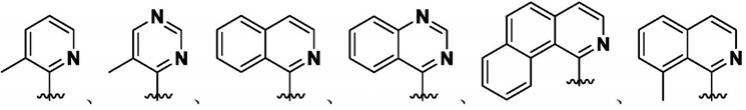
1.本发明属于有机合成领域,具体涉及一种轴手性吡啶联芳环类化合物及其制备方法。
背景技术:
2.具有轴手性骨架的化合物普遍存在于天然产物和具有生物活性的化合物中(bringmann,g.;gulder,t.;gulder,t.a.m.;breuning,m.chem.rev.2011,111,563
–
639.brunel,j.m.;chem.rev.2005,105,857
–
897.murphy,a.r.;fr
é
chet,j.m.j.chem.rev.2007,107,1066
–
1096.),同时在药物化学领域发挥着重要作用(glunz,p.w.,bioorg.med.chem.lett.2018,28,53
–
60;toenjes,s.t.;gustafson,j.l.,future med.chem.2018,10,409
–
422.),同时也作为有机催化剂或手性配体应用在不对称催化之中(privileged chiral ligands and catalysts;zhou,q.-l.ed.;wiley-vch:weinheim,germany,2011)。发展利用催化不对称的方法合成轴手性化合物吸引了研究者的广泛兴趣并取得了巨大的进展。
3.c-h键的直接不对称官能团反应是合成轴手性化合物非常简洁的方法(liao,g.;zhou,t.;yao,q.j.;shi,b.-f.,chem.commun.2019,55,8514-8523;wang,q.,gu,q.,you,s.-l.,acta chim.sinica 2019,77,690-704.),但在报道中,需要使用预先官能团化的芳基试剂,如芳基卤代物,芳基金属试剂以及重氮化合物等。直接使用简单芳烃作为芳基化试剂的来源,无疑会提高合成轴手性化合物的效率。
4.鉴于轴手性吡啶联芳环类化合物及其衍生物在手性配体和催化剂之中的广泛用途(rokade,b.v.;guiry,p.j.acs catal.2018,8,624-643.francos,j.;grande-carmona,f.;faustino,h.;iglesias-sig
ü
enza,j.;d
í
ez,e.;alonso,i.;fern
á
ndez,r.;lassaletta,j.m.;l
ó
pez,f.;j.l.j.am.chem.soc.2012,134,14322-14325.malkov,a.v.;ram
í
rez-l
ó
pez,p.;biedermannov
á
,l.;l.;dufkov
á
,l.;kotora,m.;zhu,f.;p.j.am.chem.soc.2008,130,5341-5348.),同时,在以往的报道中,利用芳基卤代物作为芳基化试剂的反应中,对于富电子杂环的底物的适用范围较局限,同时反应的对映选择性控制不足(wang,q.;cai,z.-j.;liu,c.-x.;gu,q.;you,s.-l.,j.am.chem.soc.2019,141,9504.),因此发展高效的不对称c-h/c-h氧化偶联反应来合成该类化合物具有重要的意义。
技术实现要素:
5.本发明所要解决的技术问题在于克服现有的轴手性吡啶联芳环类化合物的制备方法较为单一,需要使用预先官能团化的试剂,收率和对映选择性较低的缺陷,而提供了一种轴手性吡啶联芳环类化合物及其制备方法。本发明的制备方法可一步合成轴手性吡啶联芳环类化合物,无需对原料进行预先官能团化,在简化操作的基础上,还能进一步使得产物具有相当或者更高的收率和对映选择性,且底物普适性较好。
6.本发明通过以下技术方案解决上述技术问题。
7.本发明提供了一种化合物1的制备方法,其包括以下步骤:在保护气体氛围下,在有机溶剂中,在铑催化剂、氧化剂和手性酸存在下,将如式ii所示化合物与如式iii所示化合物进行如下所示的不对称偶联反应,得到化合物1即可;
8.所述的化合物1为如式i和/或式i’所示化合物:
[0009][0010]
其中,x1为cr1或n;
[0011]
r1、r2,r5和r6独立地为氢、卤素、c
1-10
的烷基、c
1-10
的烷基-o-、c
6-10
的芳基或被一个或多个r
1-1
取代的c
6-10
的芳基;
[0012]r1-1
独立地为氰基、卤素、被一个或多个卤素取代的c
1-6
烷基、c
1-10
的烷基或c
1-10
的烷基-o-;
[0013]
r3和r4独立地为c
1-10
的烷基、c
1-10
的烷基-o-或c
2-10
的氧杂烷基;
[0014]
或者,r2和r3与其间的碳原子一起或r2和r1与其间的碳原子一起,和/或,r4和r5与其间的碳原子一起或r5和r6与其间的碳原子一起独立地形成:c
6-10
的芳基、被一个或多个r
2-1
取代的c
6-10
的芳基、5-10元的杂芳基、被一个或多个r
2-2
取代的5-10元的杂芳基、c
3-7
的环烯基或被一个或多个r
2-3
取代的c
3-7
的环烯基;当存在多个取代基时,相同或不同;所述的5-10元的杂芳基和被一个或多个r
2-2
取代的5-10元的杂芳基里的5-10元的杂芳基中,杂原子选自n、o和s,杂原子个数为1-3个;当所述的5-10元的杂芳基中含nh时,所述的nh中h被r
2-4
取代;
[0015]r2-1
、r
2-2
和r
2-3
独立地为c
1-10
的烷基、c
1-10
的烷基-o-、c
2-10
的氧杂烷基或苯基;
[0016]
或者,r1、r2和r3与其间的碳原子一起,和/或,r4、r5和r6与其间的碳原子一起独立地形成:c
10-20
的芳基、或、c
6-10
的芳基并c
3-7
的环烯基;
[0017]
r7为5元的杂芳基、被一个或多个r
7-1
取代的5元的杂芳基或所述的5元的杂芳基和被一个或多个r
7-1
取代的5元的杂芳基里的5元的杂芳基中,杂原子选自n、o和s,杂原子个数为1-3个;当所述的5元的杂芳基中含nh时,所述的nh中h被r
7-4
取代;当存在多个取代基时,相同或不同;
[0018]r7-1
独立地为氰基、卤素、c
1-6
烷基-c(=o)-o-、被一个或多个r
7-a
取代的c
1-6
烷基-c(=o)-o-、c
1-6
烷基-o-c(=o)-、被一个或多个r
7-b
取代的c
1-6
烷基-o-c(=o)-、c
1-10
的烷基、被一个或多个r
7-c
取代的c
1-10
的烷基、c
1-10
的烷基-o-、被一个或多个r
7-d
取代的c
1-10
的烷基-o-、c
6-10
的芳基、被一个或多个r
7-e
取代的c
6-10
的芳基、6-10元的杂芳基或被一个或多个r
7-f
取代的6-10元的杂芳基;当存在多个取代基时,相同或不同;所述的6-10元的杂芳基和被一个或多个r
7-f
取代的6-10元的杂芳基里的6-10元的杂芳基中,杂原子选自n、o和s,杂原子个数为1-3个;
[0019]
当r
7-1
独立地为c
6-10
的芳基、被一个或多个r
7-e
取代的c
6-10
的芳基、6-10元的杂芳基或被一个或多个r
7-f
取代的6-10元的杂芳基时,r
7-1
与相连的5元的杂芳基并环连接或单键连接;
[0020]r7-2
独立地为氰基、h或r
7-3-l-;
[0021]
l为连接键(单键)、-o-、-o-c(=o)-、-c(=o)-o-、-o-c(=o)-o-、-c(=o)-、-c(=o)-n(r
7b
)-或-n(r
7c
)-c(=o)-;
[0022]r7-3
、r
7a
、r
7a’、r
7b
和r
7c
独立地为c
1-10
的烷基、被一个或多个r
7-g
取代的c
1-10
的烷基、3-10元环烷基、被一个或多个r
7-h
取代的3-10元环烷基、c
6-10
的芳基或被一个或多个r
7-i
取代的c
6-10
的芳基;当存在多个取代基时,相同或不同;
[0023]
中的连接键表示双键为z构型、e构型、或z构型和e构型的混合物;
[0024]r2-4
和r
7-4
独立地为c
1-10
的烷基或n保护基;
[0025]r7-a
、r
7-b
、r
7-c
、r
7-d
、r
7-e
、r
7-f
、r
7-g
、r
7-h
和r
7-i
独立地为氰基、卤素、被一个或多个卤素取代的c
1-6
烷基、c
1-6
烷基-c(=o)-o-、c
1-6
烷基-o-c(=o)-、c
1-10
的烷基或c
1-10
的烷基-o-。
[0026]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0027]
当r1、r2,r5和r6独立地为卤素时,所述的卤素可为氟、氯、溴或碘,例如氟。
[0028]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0029]
当r1、r2,r5和r6独立地为c
1-10
的烷基或c
1-10
的烷基-o-时,所述的c
1-10
的烷基和c
1-10
的烷基-o-里的c
1-10
的烷基可为c
1-4
的烷基(例如甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、异丁基或叔丁基),例如甲基。
[0030]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0031]
当r1、r2,r5和r6独立地为c
6-10
的芳基或被一个或多个r
1-1
取代的c
6-10
的芳基时,所述的c
6-10
的芳基和被一个或多个r
1-1
取代的c
6-10
的芳基里的c
6-10
的芳基可为苯基或萘基。
[0032]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0033]
当r
1-1
独立地为卤素、被一个或多个卤素取代的c
1-6
烷基时,所述的卤素和被一个或多个卤素取代的c
1-6
烷基里的卤素可为氟、氯、溴或碘,例如氟、氯或溴。
[0034]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0035]
当r
1-1
独立地为被一个或多个卤素取代的c
1-6
烷基时,所述的c
1-6
烷基可为c
1-4
的烷基(例如甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、异丁基或叔丁基),例如甲基。
[0036]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的
基团同本技术任一方案所述),
[0037]
当r
1-1
独立地为被一个或多个卤素取代的c
1-6
烷基时,所述的卤素的个数可为1、2或3个;
[0038]
例如三氟甲基。
[0039]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0040]
当r
1-1
独立地为c
1-10
的烷基或c
1-10
的烷基-o-时,所述的c
1-10
的烷基和c
1-10
的烷基-o-里的c
1-10
的烷基可为c
1-4
的烷基(例如甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、异丁基或叔丁基),例如甲基。
[0041]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0042]
当r3和r4独立地为c
1-10
的烷基或c
1-10
的烷基-o-时,所述的c
1-10
的烷基和c
1-10
的烷基-o-里的c
1-10
的烷基可为c
1-4
的烷基(例如甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、异丁基或叔丁基),例如甲基。
[0043]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0044]
当r3和r4独立地为c
2-10
的氧杂烷基时,所述的c
2-10
的氧杂烷基可为c
2-4
的氧杂烷基,例如me-o-ch
2-ch
2-或me-o-ch
2-。
[0045]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0046]
当r2和r3与其间的碳原子一起或r2和r1与其间的碳原子一起,和/或,r4和r5与其间的碳原子一起或r5和r6与其间的碳原子一起独立地形成c
6-10
的芳基、或被一个或多个r
2-1
取代的c
6-10
的芳基时,所述的c
6-10
的芳基和被一个或多个r
2-1
取代的c
6-10
的芳基里的c
6-10
的芳基可为苯基或萘基;例如表示并环连接的位置,下同);较佳地,中环a位于化合物1中与手性轴相近一侧。
[0047]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0048]
当r2和r3与其间的碳原子一起或r2和r1与其间的碳原子一起,和/或,r4和r5与其间的碳原子一起或r5和r6与其间的碳原子一起独立地形成5-10元的杂芳基、或被一个或多个r
2-2
取代的5-10元的杂芳基时,所述的5-10元的杂芳基和被一个或多个r
2-2
取代的5-10元的杂芳基里的5-10元的杂芳基可为5-6元的杂芳基,例如呋喃基、吡咯基、噻吩基、吡喃基或吡啶基。
[0049]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0050]
当r2和r3与其间的碳原子一起或r2和r1与其间的碳原子一起,和/或,r4和r5与其间
的碳原子一起或r5和r6与其间的碳原子一起独立地形成c
3-7
的环烯基或被一个或多个r
2-3
取代的c
3-7
的环烯基时,所述的c
3-7
的环烯基和被一个或多个r
2-3
取代的c
3-7
的环烯基里的c
3-7
的环烯基可为环丙烯基、环丁烯基、环戊烯基或环己烯基。
[0051]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0052]
当r
2-1
、r
2-2
和r
2-3
独立地为c
1-10
的烷基或c
1-10
的烷基-o-时,所述的c
1-10
的烷基和c
1-10
的烷基-o-里的c
1-10
的烷基可为c
1-4
的烷基(例如甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、异丁基或叔丁基),例如甲基。
[0053]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0054]
当r
2-1
、r
2-2
和r
2-3
独立地为c
2-10
的氧杂烷基时,所述的c
2-10
的氧杂烷基可为c
2-4
的氧杂烷基,例如me-o-ch
2-ch
2-或me-o-ch
2-。
[0055]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0056]
当r
2-1
、r
2-2
和r
2-3
独立地为一个或多个时,优选地,所述一个或多个中的一个r
2-1
、r
2-2
和r
2-3
独立地位于化合物1中手性轴的间位。
[0057]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0058]
当r1、r2和r3与其间的碳原子一起,和/或,r4、r5和r6与其间的碳原子一起独立地形成c
10-20
的芳基时,所述的c
10-20
的芳基可为c
10-14
的芳基,例如
[0059]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0060]
当r1、r2和r3与其间的碳原子一起,和/或,r4、r5和r6与其间的碳原子一起独立地形成c
6-10
的芳基并c
3-7
的环烯基时,所述的c
6-10
的芳基并c
3-7
的环烯基可为c
6-10
的芳基并c
5-6
的环烯基,又可为1h-非那烯基或苯并环戊烯基或,例如
[0061]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0062]
当r7为被一个或多个r
7-1
取代的5元的杂芳基时,所述r
7-1
的个数可为1、2或3个。
[0063]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0064]
当r7为5元的杂芳基或被一个或多个r
7-1
取代的5元的杂芳基时,所述的5元的杂芳基和被一个或多个r
7-1
取代的5元的杂芳基里的5元的杂芳基可为呋喃基、吡咯基、噻吩基、
吡喃基或吡啶基,又可为呋喃基、噻吩基或吡咯基,例如
[0065]
本领域技术人员可以预期,所述的不对称偶联反应中,所述的如式ii所示化合物优先与所述的如式iii所示化合物中富电子碳原子连接;例如呋喃基和噻吩基的2位,吡咯基的3位。
[0066]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0067]
当r
7-1
独立地为卤素时,所述的卤素可为氟、氯、溴或碘,例如氟、氯或溴。
[0068]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0069]
当r
7-1
独立地为c
1-6
烷基-c(=o)-o-、被一个或多个r
7-a
取代的c
1-6
烷基-c(=o)-o-、c
1-6
烷基-o-c(=o)-、或被一个或多个r
7-b
取代的c
1-6
烷基-o-c(=o)-时,所述的c
1-6
烷基-c(=o)-o-、被一个或多个r
7-a
取代的c
1-6
烷基-c(=o)-o-、c
1-6
烷基-o-c(=o)-和被一个或多个r
7-b
取代的c
1-6
烷基-o-c(=o)-里的c
1-6
烷基可独立地为c
1-4
的烷基(例如甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、异丁基或叔丁基),例如甲基或乙基。
[0070]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0071]
当r
7-1
独立地为c
1-10
的烷基、被一个或多个r
7-c
取代的c
1-10
的烷基、c
1-10
的烷基-o-、或被一个或多个r
7-d
取代的c
1-10
的烷基-o-时,所述的c
1-10
的烷基、被一个或多个r
7-c
取代的c
1-10
的烷基、c
1-10
的烷基-o-和被一个或多个r
7-d
取代的c
1-10
的烷基-o-里的c
1-10
的烷基可为c
1-4
的烷基(例如甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、异丁基或叔丁基),例如甲基或正丁基。
[0072]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0073]
当r
7-1
独立地为c
6-10
的芳基或被一个或多个r
7-e
取代的c
6-10
的芳基时,所述的c
6-10
的芳基和被一个或多个r
7-e
取代的c
6-10
的芳基里的c
6-10
的芳基可为苯基或萘基。
[0074]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0075]
当r
7-1
独立地为6-10元的杂芳基或被一个或多个r
7-f
取代的6-10元的杂芳基时,所述的6-10元的杂芳基和被一个或多个r
7-f
取代的6-10元的杂芳基里的6-10元的杂芳基可为呋喃并苯基,例如
[0076]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0077]
当r
7-3
、r
7a
、r
7a’、r
7b
和r
7c
独立地为c
1-10
的烷基或被一个或多个r
7-g
取代的c
1-10
的烷基时,所述的c
1-10
的烷基和被一个或多个r
7-g
取代的c
1-10
的烷基里的c
1-10
的烷基可为c
1-4
的烷基(例如甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、异丁基或叔丁基),例如甲基、
乙基或叔丁基。
[0078]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0079]
当r
7-3
、r
7a
、r
7a’、r
7b
和r
7c
独立地为3-10元环烷基或被一个或多个r
7-h
取代的3-10元环烷基时,所述的3-10元环烷基和被一个或多个r
7-h
取代的3-10元环烷基里的3-10元环烷基可为环丙基、环丁基、环戊基、环己基、环庚基或金刚烷基。
[0080]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0081]
当r
7-3
、r
7a
、r
7a’、r
7b
和r
7c
独立地为c
6-10
的芳基或被一个或多个r
7-i
取代的c
6-10
的芳基时,所述的c
6-10
的芳基和被一个或多个r
7-i
取代的c
6-10
的芳基里的c
6-10
的芳基可为苯基或萘基;例如
[0082]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0083]
当r
2-4
和r
7-4
独立地为c
1-10
的烷基时,所述的c
1-10
的烷基可为c
1-4
的烷基(例如甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、异丁基或叔丁基),例如甲基或正丁基。
[0084]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0085]
当r
2-4
和r
7-4
独立地为n保护基时,所述的n保护基可为对甲苯磺酰基(ts)。
[0086]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0087]
当r
7-a
、r
7-b
、r
7-c
、r
7-d
、r
7-e
、r
7-f
、r
7-g
、r
7-h
和r
7-i
独立地为卤素或被一个或多个卤素取代的c
1-6
烷基时,所述的卤素可为氟、氯、溴或碘,例如氟。
[0088]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0089]
当r
7-a
、r
7-b
、r
7-c
、r
7-d
、r
7-e
、r
7-f
、r
7-g
、r
7-h
和r
7-i
独立地为被一个或多个卤素取代的c
1-6
烷基、c
1-6
烷基-c(=o)-o-或c
1-6
烷基-o-c(=o)-时,所述的被一个或多个卤素取代的c
1-6
烷基、c
1-6
烷基-c(=o)-o-和c
1-6
烷基-o-c(=o)-里的c
1-6
的烷基可为c
1-4
的烷基(例如甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、异丁基或叔丁基),例如甲基。
[0090]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0091]
当r
7-a
、r
7-b
、r
7-c
、r
7-d
、r
7-e
、r
7-f
、r
7-g
、r
7-h
和r
7-i
独立地为被一个或多个卤素取代的c
1-6
烷基时,所述的卤素的个数可为1、2或3个;
[0092]
例如三氟甲基。
[0093]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0094]
当r
7-a
、r
7-b
、r
7-c
、r
7-d
、r
7-e
、r
7-f
、r
7-g
、r
7-h
和r
7-i
独立地为c
1-10
的烷基或c
1-10
的烷基-o-时,所述的c
1-10
的烷基和c
1-10
的烷基-o-里的c
1-10
的烷基可为c
1-4
的烷基(例如甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、异丁基或叔丁基),例如甲基。
[0095]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0096]
r1、r2、r5和r6独立地为氢、卤素、c
1-10
的烷基或c
1-10
的烷基-o-;
[0097]
例如,r1、r2和r5独立地为氢;
[0098]
r6为氢、卤素、c
1-10
的烷基或c
1-10
的烷基-o-。
[0099]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0100]
r2和r3与其间的碳原子一起或r2和r1与其间的碳原子一起,和/或,r4和r5与其间的碳原子一起或r5和r6与其间的碳原子一起独立地形成:c
6-10
的芳基、被一个或多个r
2-1
取代的c
6-10
的芳基。
[0101]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0102]
r2和r3与其间的碳原子一起,和/或,r4和r5与其间的碳原子一起独立地形成:c
6-10
的芳基、被一个或多个r
2-1
取代的c
6-10
的芳基。
[0103]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0104]
r4、r5和r6与其间的碳原子一起独立地形成:c
10-20
的芳基、或、c
6-10
的芳基并c
3-7
的环烯基。
[0105]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0106]r7-1
独立地为c
1-6
烷基-c(=o)-o-、c
1-6
烷基-o-c(=o)-、c
1-10
的烷基、被一个或多个r
7-c
取代的c
1-10
的烷基、c
1-10
的烷基-o-、被一个或多个r
7-d
取代的c
1-10
的烷基-o-、c
6-10
的芳基、被一个或多个r
7-e
取代的c
6-10
的芳基、6-10元的杂芳基或被一个或多个r
7-f
取代的6-10元的杂芳基。
[0107]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0108]
r7为5元的杂芳基或被一个或多个r
7-1
取代的5元的杂芳基。
[0109]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0110]
r7为例如为
[0111]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0112]r7-2
独立地为h或r
7-3-l-;例如r
7-3-l-;
[0113]
例如l为连接键,和/或,r
7-3
为c
6-10
的芳基或被一个或多个r
7-i
取代的c
6-10
的芳基;例如c
6-10
的芳基。
[0114]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0115]
r1、r2、r5和r6独立地为氢、卤素、c
1-10
的烷基或c
1-10
的烷基-o-;
[0116]
r3和r4独立地为c
1-10
的烷基、c
1-10
的烷基-o-或c
2-10
的氧杂烷基;
[0117]
或者,r2和r3与其间的碳原子一起,和/或,r4和r5与其间的碳原子一起独立地形成:c
6-10
的芳基、被一个或多个r
2-1
取代的c
6-10
的芳基;
[0118]
或者,r4、r5和r6与其间的碳原子一起独立地形成:c
10-20
的芳基、或、c
6-10
的芳基并c
3-7
的环烯基;
[0119]
r7为5元的杂芳基、被一个或多个r
7-1
取代的5元的杂芳基或
[0120]r7-1
独立地为c
1-6
烷基-c(=o)-o-、c
1-6
烷基-o-c(=o)-、c
1-10
的烷基、被一个或多个r
7-c
取代的c
1-10
的烷基、c
1-10
的烷基-o-、被一个或多个r
7-d
取代的c
1-10
的烷基-o-、c
6-10
的芳基、被一个或多个r
7-e
取代的c
6-10
的芳基、6-10元的杂芳基或被一个或多个r
7-f
取代的6-10元的杂芳基;
[0121]r7-2
独立地为h或r
7-3-l-;
[0122]
例如,r1、r2和r5独立地为氢;
[0123]
和/或,r6为氢、卤素、c
1-10
的烷基或c
1-10
的烷基-o-。
[0124]
和/或,r3和r4独立地为c
1-10
的烷基、c
1-10
的烷基-o-或c
2-10
的氧杂烷基;
[0125]
和/或,r
2-1
、r
2-2
和r
2-3
独立地为c
1-10
的烷基、c
1-10
的烷基-o-、c
2-10
的氧杂烷基或苯基;
[0126]
和/或,l为连接键;
[0127]
和/或,r
7-3
为c
6-10
的芳基或被一个或多个r
7-i
取代的c
6-10
的芳基;
[0128]
和/或,r
2-4
和r
7-4
独立地为c
1-10
的烷基或n保护基;
[0129]
和/或,r
7-c
、r
7-d
、r
7-e
和r
7-f
独立地为卤素或c
1-6
烷基-o-c(=o)-。
[0130]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0131]
x1为ch或n。
[0132]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0133]
r2和r3独立地为氢或甲基;例如r2为氢;r3为甲基。
[0134]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0135]
r2和r3与其间的碳原子一起形成苯基、萘基
[0136]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0137]
为
[0138]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0139]
r4独立地为甲基、甲基-o-或me-o-ch
2-。
[0140]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0141]
r5和r6独立地为氢、f、甲基或甲基-o-;例如r5为氢;r6独立地氢、f、甲基或甲基-o-。
[0142]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0143]
r4、r5与其间的碳原子一起形成:
[0144]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0145]
r4、r5和r6与其间的碳原子一起形成:
[0146]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0147]
为为
[0148]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0149]r7-1
独立地为甲基、正丁基、me-o-ch
2-ch
2-、苯基、对甲氧基苯基、对氟苯基、
ac(ch
3-c(=o)-o-)、ch
3-o-c(=o)-或
[0150]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0151]
当r7为5元的杂芳基或被一个或多个r
7-1
取代的5元的杂芳基时,例如取代的5元的杂芳基时,例如取代的5元的杂芳基时,例如
[0152]
在本发明某些优选实施方案中,所述的化合物1中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0153]
当r7为时,例如乙烯基、时,例如乙烯基、
[0154]
在本发明某些优选实施方案中,所述的化合物1可为如下任一结构:
[0155]
[0156]
[0157][0158]
本发明中,所述的保护气体可为本领域常规的保护气体,例如氦气、氖气、氮气和氩气中的一种或多种,又例如氩气。
[0159]
本发明中,所述的有机溶剂可为本领域常规的有机溶剂,较佳地为酰胺类溶剂{例如二甲基甲酰胺(dmf)和/或二甲基乙酰胺(dma)}和/或醚类溶剂{例如四氢呋喃(thf)}。
[0160]
本发明中,所述的如式ii所示化合物在所述的有机溶剂中的摩尔浓度可为本领域常规的摩尔浓度,较佳地为0.01-0.8mol/l,更佳地为0.05-0.5mol/l(例如0.05-0.1mol/l)。
[0161]
本发明中,所述的如式iii所示化合物与所述的如式ii所示化合物的摩尔比可为本领域常规的摩尔比,较佳地为1:1-8:1,更佳地为2:1-4:1(例如3:1)。
[0162]
本发明中,所述的铑催化剂与所述的如式ii所示化合物的摩尔比可为本领域常规的摩尔比,较佳地为0.02:1-0.2:1,更佳地为0.025:1-0.07:1(例如0.05:1)。
[0163]
本发明中,所述的手性酸与所述的铑催化剂的摩尔比可为本领域常规的摩尔比,较佳地为1:1-10:1(例如4:1)。
[0164]
本发明中,所述的铑催化剂可为本领域常规的铑催化剂,例如一价铑催化剂和/或三价铑催化剂;较佳地为一价铑催化剂。
[0165]
本发明中,所述的三价铑催化剂可为本领域常规的手性环戊二烯铑(iii)络合物;例如联萘酚(binol)衍生的手性环戊二烯铑(iii)络合物和/或螺环骨架衍生的环戊二烯铑(iii)络合物;
[0166]
较佳地为:或其对映异构体、或其对映异构体;其中,r
1a
和r
1a
‘
独立地选自h、c1~c
16
烷基、c1~c
16
全氟烷基、c1~c
16
烷基-o-、c
6-c
20
芳基或苄基氧基;r
1b
独立地选自h、c1~c
16
烷基,c
3-c7环烷基;r
1c
和r
1c’独立地选自h、c1~c
16
烷基、c1~c
16
全氟烷基、c1~c
16
烷基-o-、c
6-c
20
芳基或苄基氧基。
[0167]
在本发明某一方案中,所述的三价铑催化剂可为:
[0168]
或其对映异构体,或,或其对映异构体。
[0169]
本发明中,所述的一价铑催化剂可为本领域常规的手性环戊二烯铑(i)络合物,例如联萘酚(binol)衍生的手性环戊二烯铑(i)络合物和/或螺环骨架衍生的环戊二烯铑(i)络合物;较佳地为:或其对映异构体、或其对映异构体其中,r
1d
和r
1d
‘
独立地选自h、c1~c
16
烷基、c1~c
16
全氟烷基、c1~c16
烷基-o-、c
6-c
20
芳基或苄基氧基;r
1e
和r
1e’选自h、c1~c
16
烷基、c1~c
16
全氟烷基、c1~c
16
烷基-o-、c
6-c
20
芳基或苄基氧基。
[0170]
在本发明某一方案中,所述的一价铑催化剂可为或其对映异构体,或其对映异构体或其对映异构体,或其对映异构体。
[0171]
本发明中,所述的氧化剂可为本领域常规的氧化剂,较佳地为氧化银、氟化银、乙酸银和苯甲酸银中的一种或多种,更佳地为氟化银。
[0172]
本发明中,所述的氧化剂与所述的铑催化剂的摩尔比可为本领域常规的摩尔比,较佳地为100:1-20:1,更佳地为40:1-70:1(例如60:1)。
[0173]
本发明中,所述的氧化剂与所述的如式ii所示化合物的摩尔比可为本领域常规的摩尔比,较佳地为1:1-5:1,更佳地为2:1-4:1(例如3:1)。
[0174]
本发明中,所述的手性酸可为本领域常规的手性酸,例如含羧基、磺酸基或磷酸基的手性酸;较佳地为含羧基或磺酸基的手性酸;更佳地为含羧基的手性酸;
[0175]
所述的手性酸可为所述的手性酸可为
或其对映异构体;其中,r8和r8’
独立地为h、未取代或被一个或多个r
8-1
取代的c
6-c
10
的芳基,r9和r9’
独立地为h或卤素;r
10
和r
10’独立地为未取代或被一个或多个r
10-1
取代的c
6-c
10
的芳基、未取代或被一个或多个r
10-2
取代的c
1-c
16
的烷基;r
11a
和r
11b
、r
11a’和r
11b
′
相连一起形成c
6-c
10
的芳基;当取代基为多个时,相同或不同;r
8-1
独立地为c
1-c6的烷基或被一个或多个卤素取代的c
1-c6的烷基;r
10-1
独立地为卤素或c
1-c6的烷基;r
10-2
独立地为c
6-c
10
的芳基。
[0176]
本发明中,所述的手性酸可为以下任一结构或其对映异构体:
[0177]
[0178]
本发明中,所述的手性酸较佳地为或其对映异构体、或或其对映异构体
[0179]
本发明中,所述的不对称偶联反应的温度可为本领域常规的温度,较佳地为0-100℃,更佳地为40-80℃(例如40℃、50℃、60℃或80℃)。
[0180]
本发明中,所述的不对称偶联反应的进程可采用本领域中的常规测试方法(如tlc、hplc、gc或nmr)进行监控,一般以所述的如式ii所示化合物不再反应时作为反应终点。所述不对称偶联反应的时间较佳地为1h-48h(例如12h、24h或48h)。
[0181]
本发明某一实施方案中(未定义的基团如前任一方案所述),在保护气体氛围下,在有机溶剂中,在铑催化剂、手性酸和氧化剂的存在下,将如式ii所示化合物与如式iii所示化合物进行不对称偶联反应;所述的有机溶剂为酰胺类溶剂;所述的氧化剂为氧化银、氟化银、乙酸银和苯甲酸银中的一种或多种;例如氟化银;所述的铑催化剂为或其对映异构体、或其对映异构体、或其对映异构体、或其对映异构体所述的手性酸为
例如例如
[0182]
所述的如式ii所示化合物在所述的有机溶剂中的摩尔浓度为0.05-0.3mol/l;所述的如式iii所示化合物与所述的如式ii所示化合物的摩尔比为2:1-4:1;所述的铑催化剂与所述的如式ii所示化合物的摩尔比为0.025:1-0.07:1(例如0.05:1);所述的手性酸与所述的铑催化剂的摩尔比为1:1-10:1(例如4:1);所述的氧化剂与所述的一价铑催化剂的摩尔比为40:1-70:1(例如60:1)。
[0183]
本发明某一实施方案中(未定义的基团同本技术任一方案所述),当所述的铑催化剂为剂为时,所述的化合物1中,以式i所示化合物为优势构型(例如ee值大于40%,较佳地大于80%,更佳地大于90%,最佳的对95%);手性酸较佳地为
[0184]
本发明某一实施方案中(未定义的基团同本技术任一方案所述),当所述的铑催化剂为时,所述的化合物1中,以式i’所示化合物为优势构型,手性酸较佳
地为
[0185]
本发明某一实施方案中,所述的化合物1的制备方法包括以下步骤:加入铑催化剂、手性酸、加入如式ii、如式iii所示化合物、氧化剂和有机溶剂混合,在40-80℃进行所述的不对称偶联反应,即可。
[0186]
所述的不对称偶联反应结束后,较佳地,其还可进一步包括后处理操作,所述的后处理操作和条件可为本领域该类反应常规的后处理的操作和条件,较佳地包括以下步骤:稀释反应液,浓缩,分离纯化。所述稀释的操作和条件可为本领域常规的操作和条件,所述稀释的溶剂较佳地为酯类溶剂(例如乙酸乙酯)。所述浓缩的操作和条件可为本领域常规的操作和条件,较佳地为减压浓缩。所述分离纯化的操作和条件可为本领域常规的操作和条件,较佳地为柱层析分离;所述的柱层析分离的展开剂体系可为本领域该类反应常规的展开剂体系,较佳地为酯类溶剂/芳烃类溶剂(例如乙酸乙酯/甲苯),更佳地为酯类溶剂/芳烃类溶剂=1/50。
[0187]
本发明提供了一种催化剂组合物,其包括如上所述的铑催化剂、所述的氧化剂和所述的手性酸。
[0188]
本发明中,所述的氧化剂与所述的一价铑催化剂的摩尔比可为本领域常规的摩尔比,较佳地为100:1-20:1,更佳地为40:1-70:1(例如60:1)。
[0189]
本发明中,所述的手性酸与所述的铑催化剂的摩尔比可为本领域常规的摩尔比,较佳地为1:1-10:1(例如4:1)。
[0190]
本发明还提供了一种如上所述的催化剂组合物在不对称催化反应中的应用。
[0191]
在某一方案中,所述的应用为制备轴手性吡啶联芳环类化合物;例如,所述的应用中的反应条件和操作如上所述的化合物1的制备方法。
[0192]
本发明还提供了一种如式i或式i’所示化合物,其结构如下所示,
[0193][0194]
其中,r7为5元的杂芳基或被一个或多个r
7-1
取代的5元的杂芳基;所述的5元的杂芳基或被一个或多个r
7-1
取代的5元的杂芳基、x1、r
2-r6的定义如前任一方案所述;
[0195]
且所述的如式i所示化合物不为以下任一结构:
[0196]
或其对映异构体、或其对映异构体。
[0197]
本发明某一实施方案中,所述的如式i所示化合物可为以下任一结构:
[0198][0199]
[0200][0201]
[0202]
本发明某一实施方案中,所述的如式i’所示化合物可为
[0203]
如无特别说明,本发明所用术语具有如下含义:
[0204]
在本说明书中,可由本领域技术人员选择基团及其取代基以提供稳定的结构部分和化合物。当通过从左向右书写的常规化学式描述取代基时,该取代基也同样包括从右向左书写结构式时所得到的在化学上等同的取代基。
[0205]
在本文中定义的某些化学基团前面通过简化符号来表示该基团中存在的碳原子总数。例如,c
1-c6烷基是指具有总共1、2、3、4、5或6个碳原子的如下文所定义的烷基。简化符号中的碳原子总数不包括可能存在于所述基团的取代基中的碳。
[0206]
在本文中,取代基中定义的数值范围如0至4、1-4、1至3等表明该范围内的整数,如1-6为1、2、3、4、5、6。
[0207]
除前述以外,当用于本技术的说明书及权利要求书中时,除非另外特别指明,否则以下术语具有如下所示的含义。
[0208]
术语“一种(个)或多种(个)”或“一种(个)或两种(个)以上”是指即1、2、3、4、5、6、7、8、9或更多。
[0209]
术语“包括”为开放式表达,即包括本发明所指明的内容,但并不排除其他方面的内容。
[0210]
术语“被取代的”是指特定原子上的任意一个或多个氢原子被取代基取代,包括重氢和氢的变体,只要特定原子的价态是正常的并且取代后的化合物是稳定的。
[0211]
一般而言,术语“取代的”表示所给结构中的一个或多个氢原子被具体取代基所取代。进一步地,当该基团被1个以上所述取代基取代时,所述取代基之间是相互独立,即,所述的1个以上的取代基可以是互不相同的,也可以是相同的。除非其他方面表明,一个取代基团可以在被取代基团的各个可取代的位置进行取代。当所给出的结构式中不只一个位置能被选自具体基团的一个或多个取代基所取代,那么取代基可以相同或不同地在各个位置取代。
[0212]
在本说明书的各部分,本发明公开化合物的取代基按照基团种类或范围公开。特别指出,本发明包括这些基团种类和范围的各个成员的每一个独立的次级组合。术语“c
x-cy烷基"是指含有x至y个碳原子的直链或支链饱和烃。例如,术语“c1~c6烷基”或“c
1-6
烷基”特别指独立公开的甲基、乙基、c3烷基、c4烷基、c5烷基和c6烷基;“c
1-4
烷基”特指独立公开的甲基、乙基、c3烷基(即丙基,包括正丙基和异丙基)、c4烷基(即丁基,包括正丁基、异丁基、仲丁基和叔丁基)。
[0213]
术语“卤素”选自于f,cl,br或i,尤其指f或cl。
[0214]
术语“烷氧基”是指基团-o-r
x
,其中,r
x
为如上文所定义的烷基。
[0215]
本文所用术语“部分”、“结构部分”、“化学部分”、“基团”、“化学基团”是指分子中的特定片段或官能团。化学部分通常被认为是嵌入或附加到分子上的化学实体。
[0216]
当所列举的取代基中没有指明其通过哪一个原子连接到化学结构通式中包括但未具体提及的化合物时,这种取代基可以通过其任何原子相键合。取代基和/或其变体的组合只有在这样的组合会产生稳定的化合物的情况下才是被允许的。
[0217]
当所列举的基团中没有明确指明其具有取代基时,这种基团仅指未被取代。例如当“c1~c4烷基”前没有“取代或未取代的”的限定时,仅指“c1~c4烷基”本身或“未取代的c1~c4烷基”。
[0218]
在本发明的各部分,描述了连接取代基。当该结构清楚地需要连接基团时,针对该基团所列举的马库什变量应理解为连接基团。例如,如果该结构需要连接基团并且针对该变量的马库什基团定义列举了“烷基”,则应该理解,该“烷基”代表连接的亚烷基基团。
[0219]
在一些具体的结构中,当烷基基团清楚地表示为连接基团时,则该烷基基团代表连接的亚烷基基团,例如,基团“卤代-c1~c6烷基”中的c
1-c6烷基应当理解为c1~c6亚烷基。
[0220]
术语“亚烷基”表示从饱和的直链或支链烃基中去掉两个氢原子所得到的饱和的二价烃基基团。亚烷基基团的实例包括亚甲基(-ch
2-),亚乙基{包括-ch2ch
2-或-ch(ch3)-},亚异丙基{包括-ch(ch3)ch
2-或-c(ch3)
2-}等等。
[0221]
在本技术中,作为基团或是其它基团的一部分(例如用在卤素取代的烷基等基团中),术语“烷基”意指包括具有指定碳原子数目的支链和直链的饱和脂族烃基;比如含有1至16个碳原子的直链或支链饱和烃链;又例如,c
1-c6的烷基。如在“c1~c6烷基”中定义为包括在直链或者支链结构中具有1、2、3、4、5、或者6个碳原子的基团。其中,丙基为c3烷基(包括同分异构体,例如正丙基或异丙基);丁基为c4烷基(包括同分异构体,例如正丁基、仲丁基、异丁基或叔丁基);戊基为c5烷基(包括同分异构体,例如正戊基、1-甲基-丁基、1-乙基-丙基、2-甲基-1-丁基、3-甲基-1-丁基、异戊基、叔戊基或新戊基);己基为c6烷基(包括同分异构体,例如正己基、1-乙基-2-甲基丙基、1,1,2-三甲基丙基、1,1-二甲基丁基、1,2-二甲基丁基、2,2-二甲基丁基、1,3-二甲基丁基、2-乙基丁基、2-甲基戊基、3-甲基戊基、4-甲基戊基、2,3-二甲基丁基)。
[0222]
术语“卤代烷基”是指被一个或多个卤素取代的烷基,例如三氟甲基,其中,“多个”、“卤素”和“烷基”均如上文所定义。
[0223]
术语“环烷基”,指仅由碳原子和氢原子组成的饱和的单环或者多环碳环取代基,且其可经由任何适宜的碳原子通过单键与分子的其余部分连接;当为多环时,可为并环连接、桥环连接或螺环连接(即,碳原子上的两个偕氢被亚烷基取代)的并环体系、桥环体系或螺环体系。在某一方案中,优选具有3-10个环碳原子、更优选3-7个碳原子的单价饱和的环状烷基。在某一方案中,典型的单环环烷基,如环丙基、环丁基、环戊基、环己基或环庚基。
[0224]
在本技术中,本身或者作为另一取代基的一部分,术语“环烯基”是指含有双键的不饱和的非芳香基团。其含有部分不饱和双键的单环、多环或者桥接碳环取代基,且其可经由任何适宜的碳原子通过单键与分子的其余部分连接;当为多环时,可为并环连接或螺环连接(即,碳原子上的两个偕氢被亚烷基取代)的桥环体系或螺环体系。在一些实施例中,“环烯基”优选具有3-7个环碳原子、更优选3-6个碳原子的含有一个双键的非芳香基团,例如环丙烯基、环丁烯基、环戊烯基或环己烯基。在一些实施例中,“环烯基”是具有5至6个环原子的单环的,不饱和的碳环烯基基团(“5-6元环烯基”)。
[0225]
术语“杂环烷基”是指具有杂原子的饱和的单环基团,优选含有1个、2个或3个独立
选自n、o和s的环杂原子的3-7元饱和的单环。杂环烷基的示例为:吡咯烷基、四氢呋喃基、四氢吡喃基、四氢噻吩基、四氢吡啶基、四氢吡咯基、氮杂环丁烷基、噻唑烷基、唑烷基、哌啶基、吗啉基、硫代吗啉基、哌嗪基、氮杂环庚烷基、二氮杂环庚烷基、氧氮杂环庚烷基、二氧戊环基、二氧六环基等。优选的杂环基为1,3-二氧戊环基、1,4-二氧六环基。
[0226]
在本技术中,本身或者作为另一取代基的一部分,除非另有规定,术语“杂环烯基”是指具有杂原子的含有双键的不饱和的非芳香基团。其可为通过杂原子或杂原子团连接的环状稀基。由此,“杂环稀基”包含以上“杂”和环稀基的定义。在一些实施例中,在某一实施例方案中,所述的“杂环稀基”为由2-9个碳原子以及含有1、2、3或4个选自n、o、s、s(=o)或s(=o)2杂原子或含杂原子的基团组成的稳定的3-10元含不饱和双键的杂环系统的基团。非本说明书中另外特别指明,否则杂环稀基基团或者可以是单环的(“单环的杂环稀基”),或者是双环、三环或更多环的环体系,其可包括融合的、桥联的或螺的环系统(例如二环系统(“二环的杂环稀基”)。杂环稀基二环的环系统可以在一个或两个环中包括一个或多个杂原子。)并且是含不饱和双键的。杂环稀基可以经由碳原子并通过单键与分子其余部分连接;在包含一个或多个氮原子的杂环稀基基团中,连接点可以是碳或氮原子;或者,与分子其余部分并环连接;只要化合价许可。在一些实施例中,优选含有1个、2个或3个独立选自n、o和s的环杂原子的3-7元,更优选3-6元不饱和的非芳香基团。
[0227]
术语“芳基”,指具有具有指定的碳原子数的、完全共轭的π电子体系的全碳芳香基团(例如当为双环或者三环时,每个环均满足休克尔规则),可为单环或稠合环,通常具有6-20个碳原子,优选具有6-14个碳原子,最优选具有6个碳原子。芳基的实例包括但不限于:单环的芳基例如c6芳基(苯基)、双环的芳基例如c
10
芳基(萘基)、三环的芳基例如c
14
芳基(菲基和蒽基)。
[0228]
术语“芳基并环烯基”是指芳基和环烯基稠合形成的基团,其中,“芳基”和“环烯基”均同前所述,“芳基并环烯基”的实例为
[0229]
术语“杂芳基”是指含有杂原子的芳香基团,可为单环或稠合环,优选含有1-4个独立选自n、o和s的5-12元杂芳基,包括但不限于吡咯基、呋喃基、噻吩基、吲哚基、咪唑基、噁唑基、异噁唑基、吡唑基、吡啶基、嘧啶基、吡嗪基、哒嗪基、喹啉基、异喹啉基、(苯并)噁唑基、(苯并)呋喃基、(苯并)噻吩基、(苯并)噻唑基、三唑基。在某一方案中,典型地含1个或多个独立选自n、o和s的杂原子的5-6元单环杂芳基。在某一方案中,“杂芳基”为5-6元杂芳基,其中杂原子选自n、o和s中的一种或多种,杂原子数为1、2或3个。
[0230]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0231]
本发明所用试剂和原料均市售可得。
[0232]
本发明的积极进步效果在于:本发明的制备方法可一步合成轴手性异喹啉化合物,无需对原料进行预处理,在简化操作的基础上,还能进一步使得产物具有相当或者更高的收率和对映选择性,且底物普适性较好。
附图说明
[0233]
图1为单晶x衍射测得的化合物i的结构图。
具体实施方式
[0234]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0235]
实施例1:化合物i的合成
[0236][0237]
在氩气氛围下,向schlenk反应瓶中加入[scprh](2.6mg,0.005mmol),a11(6.8mg,0.02mmol),agf(38.0mg,0.30mmol),化合物ii(0.10mmol)和相应的芳烃iii(0.30mmol,3.0equiv.)和dmf(2.0ml),然后加热至60℃反应。反应结束后,用乙酸乙酯稀释,加入饱和碳酸溶液(10.0ml),分离有机相,水相用乙酸乙酯萃取,合并有机相,用饱和食盐水洗有机相,硫酸钠干燥有机相,减压除去溶剂残留物经柱层析分离获得目标产物i(乙酸乙酯/甲苯=1/50)。
[0238]
以下实施例2-实施例34的化合物参照实施例1制备获得。
[0239]
实施例2
[0240]
i-1:
[0241]
(36.1mg,85%产率,93%ee).分析数据:(c=0.5,chcl3,93%ee).1h nmr(400mhz,cdcl3)δ8.87(d,j=4.5hz,1h),8.04(d,j=8.3hz,1h),7.98-7.89(m,2h),7.89-7.82(m,2h),7.80-7.76(m,2h),7.60(d,j=8.4hz,1h),7.43-7.38(m,2h),7.25-7.14(m,1h),7.14-6.94(m,2h),6.39(d,j=3.6hz,1h),6.28(d,j=3.8hz,1h),2.17(s,3h).
13
c nmr(101mhz,cdcl3)δ156.9,144.0,140.5,140.3,138.0,137.7,133.2,133.1,132.4,132.1,130.7,129.3,128.8,128.8,128.0,128.0,127.5,127.0,126.9,126.8,126.5,126.1,126.0,126.0,125.7,125.1,121.8,15.1.手性柱chiralpak ig column(25cm),正己烷/异丙醇=90:10,1ml/min,检测波长=254nm,tr(minor)=30.81min,tr(major)=45.02min.
[0242]
实施例3
[0243]
i-2:
[0244]
(36.7mg,83%产率,91%ee).分析数据:(c=0.5,chcl3,91%ee)).1h nmr(400mhz,cdcl3)δ8.85(d,j=5.2hz,1h),8.04(d,j=8.7hz,1h),7.97-7.90(m,1h),7.88(d,j=8.8hz,1h),7.83(d,j=7.7hz,1h),7.81(d,j=4.3hz,1h),7.77(dd,j=7.9,1.5hz,1h),7.74(d,j=8.8hz,1h),7.61-7.53(m,1h),7.43(ddd,j=8.1,4.5,3.3hz,1h),7.39(ddd,j=8.0,7.0,1.1hz,1h),7.26-7.19(m,2h),7.03(ddd,j=8.6,7.0,1.5hz,1h),6.27(d,j=3.6hz,1h),6.25(d,j=3.6hz,1h),2.48(t,j=7.5hz,2h),1.41-1.33(m,2h),1.17-1.08(m,2h),0.81(t,j=7.3hz,3h).
13
c nmr(101mhz,cdcl3)δ157.0,146.4,144.0,139.9,138.0,138.0,133.3,133.1,132.2,132.1,130.8,129.3,128.7,128.7,128.1,128.0,127.3,126.9,126.8,126.2,126.1,126.1,125.6,123.8,121.5,33.4,29.4,21.9,13.8.手性柱chiralpak ig column(25cm),正己烷/异丙醇=90:10,1ml/min,检测波长=254nm,tr(minor)=18.92min,tr(major)=36.60min.
[0245]
实施例4
[0246]
i-3:
[0247]
(38.0mg,85%产率,90%ee).分析数据:(c=0.5,chcl3,90%ee).1h nmr(400mhz,cdcl3)δ8.86(d,j=5.2hz,1h),8.04(d,j=8.6hz,1h),7.93(d,j=8.2hz,1h),7.89(d,j=8.8hz,1h),7.84(d,j=8.6hz,1h),7.82(d,j=5.3hz,1h),7.80-7.72(m,2h),7.57(d,j=8.7hz,1h),7.46-7.35(m,2h),7.25-7.14(m,2h),7.03(ddd,j=8.7,7.0,1.5hz,1h),6.34(s,2h),3.35(t,j=6.8hz,2h),3.21(s,3h),2.76(t,j=6.8hz,2h).
13
c nmr(101mhz,cdcl3)δ157.0,144.1,141.9,140.8,138.1,138.0,133.3,133.1,132.2,132.1,130.6,129.3,128.8,128.1,128.0,127.4,127.0,126.8,126.8,126.3,126.1,126.1,126.1,125.6,124.9,121.6,73.0,58.6,30.3.手性柱chiralpak ig column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=18.88min,tr(major)=30.31min.
[0248]
实施例5
[0249]
i-4:
[0250]
(36.5mg,79%产率,94%ee).分析数据:(c=0.5,chcl3,94%ee).1h nmr(400mhz,cdcl3)δ8.92(d,j=5.2hz,1h),8.11(d,j=8.7hz,1h),7.98(d,j=8.2hz,1h),7.93(d,j=6.5hz,1h),7.91(d,j=6.9hz,1h),7.88(d,j=5.2hz,1h),7.81-7.77(m,2h),7.62(d,j=8.7hz,1h),7.48(ddd,j=8.1,6.5,1.4hz,1h),7.42(t,j=7.4hz,1h),7.34-7.30(m,2h),7.30-7.22(m,4h),7.22-7.15(m,1h),7.08(ddd,j=8.5,6.9,1.4hz,1h),6.84(d,j=3.8hz,1h),6.51(d,j=3.8hz,1h).
13
c nmr(101mhz,cdcl3)δ156.8,144.4,144.1,142.1,138.3,138.1,134.1,133.5,133.2,132.4,132.1,130.3,129.2,128.9,128.9,128.7,128.1,128.0,127.6,127.4,127.3,127.1,126.9,126.7,126.4,126.2,126.0,125.6,125.5,122.9,121.8.手性柱chiralpak ig column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=18.66min,tr(major)=38.46min.
[0251]
实施例6
[0252]
i-5:
[0253]
(44.0mg,89%产率,93%ee).分析数据:(c=0.5,chcl3,93%ee).1h nmr(400mhz,cdcl3)δ8.86(d,j=5.2hz,1h),8.05(d,j=8.6hz,1h),7.92(d,j=8.2hz,1h),7.87(dd,j=8.8,7.6hz,2h),7.82(d,j=5.3hz,1h),7.78-7.70(m,2h),7.58(d,j=8.7hz,1h),7.42(ddd,j=8.1,6.5,1.5hz,1h),7.37(ddd,j=8.0,7.0,1.1hz,1h),7.23-7.15(m,3h),7.19(d,j=8.0hz,1h)7.03(ddd,j=8.6,7.0,1.5hz,1h),6.76-6.73(m,1h),6.75(d,j=8.0hz,1h)6.67(d,j=3.8hz,1h),6.44(d,j=3.8hz,1h),3.72(s,3h).
13
c nmr(101mhz,cdcl3)δ159.0,156.9,144.4,144.2,141.1,138.2,138.1,133.4,133.2,132.4,132.2,130.4,129.2,128.9,128.1,127.9,127.5,127.4,127.1,127.0,126.9,126.7,126.3,126.2,126.0,125.6,122.0,121.7,114.1,55.3.手性柱chiralpak ig column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=28.42min,tr(major)=58.00min.
[0254]
实施例7
[0255]
i-6:
[0256]
(47.0mg,98%产率,95%ee).分析数据:(c=0.5,chcl3,95%ee).1h nmr(400mhz,cdcl3)δ8.86(d,j=5.2hz,1h),8.06(d,j=8.6hz,1h),7.93(d,j=8.2hz,1h),7.90-7.84(m,2h),7.82(d,j=5.2hz,1h),7.78-7.68(m,2h),7.56(d,j=8.7hz,1h),
7.43(ddd,j=8.1,6.5,1.5hz,1h),7.41-7.33(m,1h),7.26-7.13(m,4h),7.03(ddd,j=8.6,7.0,1.5hz,1h),6.95-6.84(m,2h),6.69(d,j=3.8hz,1h),6.45(d,j=3.8hz,1h).
13
c nmr(101mhz,cdcl3)δ162.12(d,j=247.0hz),156.76,144.17,143.29,142.11,138.41,138.07,133.49,133.17,132.39,132.14,130.42(d,j=3.4hz),130.11,129.21,128.94(d,j=4.5hz),128.09,127.89,127.57,127.46,127.15,127.14,127.06,126.89,126.73,126.41,126.19,125.99,125.63,122.90(d,j=1.2hz),121.77,115.62(d,j=21.8hz).手性柱chiralpak ig column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=15.93min,tr(major)=44.06min.
[0257]
实施例8
[0258]
i-7:
[0259]
(21.1mg,45%产率,87%ee).分析数据:(c=0.5,chcl3,87%ee).1h nmr(400mhz,cdcl3)δ8.88(d,j=5.2hz,1h),8.07(d,j=8.6hz,1h),7.95(d,j=8.2hz,1h),7.90(d,j=8.8hz,1h),7.89-7.82(m,2h),7.81-7.74(m,2h),7.55(d,j=8.7hz,1h),7.45(ddd,j=8.1,6.5,1.4hz,1h),7.40(ddd,j=8.0,6.9,1.1hz,1h),7.23(dd,j=6.6,1.4hz,1h),7.21-7.16(m,1h),7.11-6.99(m,2h),6.94-6.80(m,2h),6.67(d,j=3.8hz,1h),6.41(d,j=3.8hz,1h).
13
c nmr(101mhz,cdcl3)δ156.6,144.1,141.6,138.3,138.1,137.6,137.2,133.5,133.2,132.4,132.1,130.0,129.2,129.0,128.9,128.1,127.8,127.6,127.5,127.3,127.1,126.9,126.7,126.4,126.2,126.0,125.6,124.1,123.5,123.3,121.8.手性柱chiralpak ig column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=20.08min,tr(major)=32.87min.
[0260]
实施例9
[0261]
i-8:
[0262]
(34.0mg,73%产率,91%ee).分析数据:(c=0.5,chcl3,91%ee).1h nmr(400mhz,cdcl3)δ8.93(d,j=5.2hz,1h),8.12(d,j=8.6hz,1h),8.01(d,j=8.2hz,1h),7.93-7.88(m,2h),7.87(d,j=5.2hz,1h),7.80(d,j=8.0hz,1h),7.76(d,j=8.8hz,1h),7.60(d,j=8.7hz,1h),7.54-7.48(m,1h),7.45-7.40(m,1h),7.39-7.31(m,2h),7.31-7.26(m,2h),7.25-7.18(m,3h),7.09(ddd,j=8.6,7.0,1.5hz,1h),7.03(d,j=1.5hz,1h),6.82(d,j=1.6hz,1h).
13
c nmr(101mhz,cdcl3)δ156.8,144.1,143.1,141.4,138.6,138.1,135.7,133.6,133.1,132.4,132.1,130.3,129.2,129.0,128.9,128.6,128.1,128.0,127.4,127.2,126.9,126.9,126.8,126.5,126.3,126.1,126.0,125.8,125.5,121.7,
121.0.手性柱chiralpak ig column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=19.12min,tr(major)=43.20min.
[0263]
实施例10
[0264]
i-9:
[0265]
(31.0mg,70%产率,82%ee).分析数据:(c=0.5,chcl3,82%ee).1h nmr(400mhz,cdcl3)δ8.87(d,j=5.2hz,1h),8.08(d,j=8.6hz,1h),8.01-7.95(m,1h),7.90(d,j=8.8hz,1h),7.85(d,j=5.2hz,1h),7.81(d,j=8.6hz,1h),7.80-7.77(m,1h),7.76(d,j=8.8hz,1h),7.50(ddd,j=8.1,5.1,2.9hz,1h),7.46-7.37(m,2h),7.32-7.27(m,2h),7.03(ddd,j=8.6,7.0,1.5hz,1h),6.29(s,1h),2.20(s,3h),2.16(s,3h).
13
c nmr(101mhz,cdcl3)δ190.9,156.2,146.7,144.3,144.0,139.4,138.1,136.0,133.9,133.2,132.5,132.2,132.0,129.2,129.1,129.0,128.9,128.1,127.5,127.4,127.4,126.9,126.9,126.7,126.5,125.8,125.5,121.8,29.4,16.6.手性柱chiralpak ig column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=30.90min,tr(major)=44.63min.
[0266]
实施例11
[0267]
i-10:
[0268]
(27.0mg,59%产率,87%ee).分析数据:(c=0.5,chcl3,87%ee).1h nmr(400mhz,cdcl3)δ8.89(d,j=5.2hz,1h),8.10(d,j=8.6hz,1h),7.98(d,j=8.2hz,1h),7.92(d,j=8.8hz,1h),7.87(d,j=5.2hz,1h),7.85-7.79(m,2h),7.78(d,j=8.8hz,1h),7.53-7.46(m,2h),7.44-7.39(m,1h),7.31-7.24(m,2h),7.05(ddd,j=8.6,7.0,1.5hz,1h),6.28(s,1h),3.70(s,3h),2.19(s,3h).
13
c nmr(101mhz,cdcl3)δ163.1,156.2,146.9,145.6,144.0,139.2,138.1,133.8,133.2,132.5,132.0,131.2,129.4,129.1,129.0,128.9,128.1,127.7,127.4,127.3,126.9,126.8,126.6,126.4,126.3,125.8,125.6,121.8,51.5,15.7.手性柱chiralpak ig column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=19.94min,tr(major)=34.05min.
[0269]
实施例12
[0270]
i-11:
[0271]
(36.4mg,88%产率,95%ee).分析数据:(c=0.5,chcl3,95%ee)1h nmr(400mhz,cdcl3)δ8.87(d,j=5.2hz,1h),8.02(d,j=8.7hz,1h),7.91(dd,j=8.5,3.3hz,2h),7.86(d,j=6.9hz,1h),7.84(d,j=3.6hz,1h),7.80-7.76(m,2h),7.59(d,j=8.8hz,1h),7.41-7.37(m,2h),7.17(ddd,j=8.2,6.7,1.3hz,1h),7.08-7.00(m,2h),6.37(s,1h),2.01(s,3h),1.81(s,3h).
13
c nmr(101mhz,cdcl3)δ156.0,143.1,136.9,136.5,136.4,133.0,132.1,131.7,131.2,131.1,129.5,128.6,128.3,127.7,127.6,126.9,126.7,126.4,125.8,125.8,125.7,125.0,124.9,124.6,120.6,12.3,11.7.手性柱chiralpak ig column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=21.33min,tr(major)=29.96min.
[0272]
实施例13
[0273]
i-12:
[0274]
(24.4mg,55%产率,90%ee).分析数据:(c=0.5,chcl3,90%ee).1h nmr(400mhz,cdcl3)δ8.89(d,j=5.2hz,1h),8.14(d,j=8.6hz,1h),8.01-7.97(m,2h),7.89(d,j=8.8hz,1h),7.85(d,j=5.2hz,1h),7.80(dd,j=7.9,1.5hz,1h),7.75(d,j=8.8hz,1h),7.64(d,j=8.7hz,1h),7.55-7.50(m,2h),7.48-7.39(m,2h),7.31-7.25(m,1h),7.22(dd,j=8.6,1.2hz,1h),7.19-7.05(m,3h),6.89(s,1h).
13
c nmr(101mhz,cdcl3)δ156.5,144.1,143.0,140.4,139.6,139.4,138.0,133.7,133.2,132.4,132.0,130.4,129.2,129.0,128.9,128.4,128.1,127.4,127.2,126.9,126.8,126.7,126.3,126.0,125.6,123.9,123.8,123.4,123.4,121.9,121.7.手性柱chiralpak ig column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=16.40min,tr(major)=31.92min.
[0275]
实施例14
[0276]
i-13:
[0277]
(44.0mg,97%产率,94%ee).分析数据:(c=0.5,chcl3,94%ee).1h nmr(400mhz,cdcl3)δ8.89(d,j=5.2hz,1h),8.14(d,j=8.6hz,1h),8.01-7.97(m,2h),
7.91-7.83(m,2h),7.83-7.73(m,2h),7.65(d,j=8.7hz,1h),7.50(ddd,j=8.2,6.7,1.3hz,1h),7.45-7.37(m,2h),7.30-7.24(m,2h),7.23-7.18(m,1h),7.10(ddd,j=8.7,7.0,1.5hz,1h),6.96(dd,j=8.2,1.7hz,1h),6.82(s,1h),2.33(s,3h).
13
c nmr(101mhz,cdcl3)δ156.5,144.0,143.1,140.0,139.3,138.0,137.6,133.7,133.6,133.2,132.4,132.0,130.5,129.2,129.0,128.9,128.4,128.1,127.4,127.2,126.9,126.8,126.6,126.3,126.0,125.7,125.6,123.3,123.1,121.9,121.4,21.3.手性柱chiralpak ig column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=25.07min,tr(major)=38.71min.
[0278]
实施例15
[0279]
i-14:
[0280]
(42.0mg,93%产率,95%ee).分析数据:(c=0.5,chcl3,95%ee).1h nmr(400mhz,cdcl3)δ8.79(d,j=5.2hz,1h),8.10(d,j=8.5hz,1h),8.03(d,j=8.2hz,1h),7.83-7.71(m,2h),7.65(d,j=5.2hz,1h),7.62(d,j=8.5hz,1h),7.58(d,j=8.4hz,1h),7.57-7.47(m,3h),7.48-7.41(m,2h),7.41-7.33(m,2h),7.21-7.16(m,1h),7.16-7.03(m,2h),1.98(s,3h).
13
c nmr(101mhz,cdcl3)δ156.2,143.5,141.5,139.7,139.7,137.7,136.7,133.9,133.0,131.9,131.9,130.6,129.8,129.4,129.3,128.8,128.2,128.2,127.1,126.9,126.7,126.7,126.5,126.4,126.2,125.4,123.6,123.3,121.6,121.5,121.4,12.3.手性柱chiralpak ig column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=8.93min,tr(major)=15.58min.
[0281]
实施例16
[0282]
i-15:
[0283]
(33.0mg,86%产率,88%ee).分析数据:(c=0.5,chcl3,88%ee).1h nmr(400mhz,cdcl3)δ8.89(d,j=5.2hz,1h),8.16(d,j=8.8hz,1h),8.06(d,j=8.8hz,1h),7.95(d,j=8.8hz,1h),7.91(d,j=8.2hz,1h),7.88(d,j=5.2hz,1h),7.84-7.78(m,2h),7.62(d,j=8.7hz,1h),7.42-7.36(m,2h),7.17(ddd,j=8.2,6.7,1.3hz,1h),7.08-6.99(m,2h),5.66-5.52(m,1h),5.06(d,j=3.3hz,1h),2.04(s,3h).
13
c nmr(101mhz,cdcl3)δ157.6,151.7,150.7,144.7,138.1,135.6,133.1,133.0,132.4,132.2,129.3,128.8,128.6,128.0,127.6,126.9,126.8,126.6,126.2,126.1,125.9,125.8,125.7,124.4,121.6,110.0,107.8,13.4.手性柱phenomenex lux 5u cellulose-4column(25cm),正己烷/异丙醇=95:5,1ml/min,检测波长=254nm,tr(minor)=25.04min,tr(major)=
34.48min.
[0284]
实施例17
[0285]
i-16:
[0286]
(31.0mg,61%产率,85%ee).分析数据:(c=0.5,chcl3,85%ee).1h nmr(400mhz,cdcl3)δ8.86(d,j=5.2hz,1h),8.15(d,j=8.8hz,1h),8.10(d,j=8.8hz,1h),8.02(d,j=8.8hz,1h),7.94(d,j=8.2hz,1h),7.92-7.86(m,2h),7.85-7.80(m,3h),7.72(d,j=8.7hz,1h),7.45-7.38(m,2h),7.19(t,j=7.6hz,1h),7.10-7.02(m,2h),7.02-7.01(m,2h),6.49(d,j=3.6hz,1h),5.86(d,j=3.6hz,1h),3.89(s,3h).
13
c nmr(101mhz,cdcl3)δ166.7,157.4,153.6,152.2,144.6,138.0,136.8,134.1,133.4,133.1,132.5,132.1,129.7,129.2,129.0,128.9,128.1,128.0,127.6,127.1,126.9,126.4,126.3,126.0,125.9,125.7,125.6,124.7,122.9,121.6,111.2,109.3,52.0.手性柱ig column(25cm),正己烷/异丙醇=70:30,1ml/min,检测波长=254nm,tr(minor)=22.14min,tr(major)=31.19min.
[0287]
实施例18
[0288]
i-17:
[0289]
(25.0mg,61%产率,90%ee).分析数据:(c=0.5,chcl3,90%ee).1h nmr(400mhz,cdcl3)δ8.77(d,j=5.2hz,1h),8.12(d,j=8.5hz,1h),8.02(d,j=8.2hz,1h),7.80-7.70(m,3h),7.67(d,j=5.2hz,1h),7.61-7.57(m,3h),7.56-7.49(m,1h),7.40-7.34(m,2h),7.19(dd,j=7.4,1.7hz,1h),7.04(ddd,j=8.8,7.1,1.6hz,1h),7.02-6.95(m,2h),6.68-6.60(m,1h),1.93(s,3h).
13
c nmr(101mhz,cdcl3)δ156.8,153.6,150.8,143.6,140.9,137.5,134.0,132.9,132.0,131.7,129.8,129.3,128.5,128.4,128.1,127.6,127.2,127.1,126.8,126.6,126.6,126.6,126.5,126.2,125.2,123.6,121.6,120.7,118.8,113.1,110.3,8.4.手性柱ad-h column(25cm),正己烷/异丙醇=90:10,1ml/min,检测波长=254nm,tr(minor)=11.62min,tr(major)=33.84min.
[0290]
实施例19
nmr(400mhz,cd2cl2)δ8.73(d,j=5.2hz,1h),8.00(d,j=8.6hz,1h),7.89(d,j=8.2hz,1h),7.84(d,j=8.8hz,1h),7.78(d,j=5.2hz,1h),7.76
–
7.70(m,2h),7.66(d,j=8.6hz,1h),7.42
–
7.29(m,3h),7.19(ab,j
ab
=8.1hz,2h),7.14(ddd,j=8.2,6.8,1.2hz,1h),7.05(ba,j
ba
=8.1hz,2h),7.01(d,j=8.5hz,1h),6.91(ddd,j=8.6,7.1,1.4hz,1h),6.65(dd,j=3.2,2.3hz,1h),6.30(t,j=1.9hz,1h),5.83(dd,j=3.3,1.7hz,1h),2.31(s,3h).
13
c nmr(101mhz,cdcl3)δ157.3,144.5,143.9,138.3,137.9,135.8,133.3,133.0,132.2,132.0,129.7,129.7,129.1,128.8,128.8,128.4,128.0,127.5,127.3,126.9,126.8,126.4,126.2,126.0,125.9,125.5,121.5,120.1,118.7,114.2,21.6.手性柱ic column(25cm),正己烷/异丙醇=70:30,1ml/min,检测波长=254nm,tr(minor)=25.37min,tr(major)=30.91min.
[0299]
实施例22
[0300]
i-21:
[0301]
(48.5mg,97%产率,97%ee).分析数据:(c=0.5,chcl3,97%ee).1h nmr(400mhz,cdcl3)δ8.88(d,j=5.2hz,1h),8.23(d,j=8.3hz,1h),7.90(d,j=8.8hz,1h),7.86(d,j=5.2hz,1h),7.80-7.75(m,2h),7.61(d,j=7.2hz,1h),7.58(d,j=4.4hz,1h),7.52(t,j=7.6hz,1h),7.42(t,j=7.4hz,1h),7.30(t,j=7.7hz,1h),7.23-7.18(m,3h),7.10(t,j=7.9hz,1h),6.94-6.90(m,2h),6.73(d,j=3.8hz,1h),6.50(d,j=3.8hz,1h).
13
c nmr(101mhz,cdcl3)δ162.2(d,j=247.4hz),158.8(d,j=253.0hz),156.0,144.2,143.8,141.0(d,j=1hz),138.2,134.5(d,j=4.3hz),133.6(d,j=5.4hz),133.2,132.5,130.4(d,j=8.6hz),130.2(d,j=3.4hz),129.1,129.0,128.2,127.9,127.5,127.2(d,j=7.9hz),127.0,126.9,126.7(d,j=1.8hz),126.2(d,j=2.9hz),125.8,125.6,123.8(d,j=16.6hz),122.9(d,j=1.3hz),122.0,120.7(d,j=5.0hz),115.7(d,j=21.8hz),111.3(d,j=21.4hz).手性柱ig column(25cm),正己烷/异丙醇=70:30,1ml/min,检测波长=254nm,tr(minor)=9.57min,tr(major)=30.67min.
[0302]
实施例23
[0303]
i-22:
[0304]
(45.8mg,92%产率,92%ee).分析数据:(c=0.5,chcl3,92%ee).1h nmr(400mhz,cdcl3)δ8.85(d,j=5.2hz,1h),8.09(d,j=8.4hz,1h),7.87(d,j=8.8hz,1h),7.82(d,j=5.2hz,1h),7.79-7.69(m,3h),7.65(d,j=8.7hz,1h),7.48(ddd,j=8.3,6.2,1.8hz,1h),7.38(t,j=7.5hz,1h),7.25-7.17(m,4h),7.08-7.02(m,1h),6.93-6.88(m,2h),6.70(d,j=3.8hz,1h),6.43(d,j=3.8hz,1h),2.88(s,3h).
13
c nmr(101mhz,cdcl3)δ162.1(d,j=247.0hz),157.0,144.2,143.1,142.3,138.0,136.8,135.3,133.2,132.8,132.3,132.3,130.5(d,j=3.4hz),129.6,129.3,128.9,128.5,127.4,127.4,127.1(d,j=8.0hz),126.8,126.8,126.7,126.2,126.1,125.6,124.3,122.9,122.8,121.6,115.6(d,j=21.8hz),19.8.手性柱ig column(25cm),正己烷/异丙醇=70:30,1ml/min,检测波长=254nm,tr(minor)=9.38min,tr(major)=45.41min.
[0305]
实施例24
[0306]
i-23:
[0307]
(46.3mg,90%产率,97%ee).分析数据:(c=0.5,chcl3).1h nmr(400mhz,dmso-d6)δ8.88(d,j=5.2hz,1h),8.32(d,j=8.4hz,1h),8.12(d,j=5.2hz,1h),8.08(d,j=8.9hz,1h),7.99(d,j=8.8hz,1h),7.94(d,j=7.8hz,1h),7.57(d,j=8.7hz,1h),7.53-7.47(m,1h),7.45(t,j=7.5hz,1h),7.40(s,1h),7.36-7.30(m,2h),7.27(d,j=7.7hz,1h),7.16-7.06(m,4h),6.91(d,j=8.5hz,1h),6.86(d,j=3.9hz,1h),4.21(s,3h).
13
c nmr(101mhz,dmso-d6)δ162.0(d,j=245.3hz),156.4,155.4,144.8,143.0,142.1,138.2,133.4,133.1,132.6,131.3,130.3(d,j=3.3hz),130.0,129.7,129.0,128.6,128.2,127.8,127.5,127.3(d,j=8.3hz),126.5,126.4,126.0,125.5,125.3,124.1,122.5,122.2,116.4(d,j=21.8hz),105.9,56.5.手性柱ig column(25cm),正己烷/异丙醇=70:30,1ml/min,检测波长=254nm,tr(minor)=9.88min,tr(major)=40.34min.
[0308]
实施例25
[0309]
i-24:
[0310]
(45.6mg,90%产率,93%ee).分析数据:(c=0.5,chcl3,93%ee).1h nmr(400mhz,cdcl3)δ8.82(d,j=5.2hz,1h),7.86(d,j=8.8hz,1h),7.78-7.77(m,2h),
7.76-7.69(m,2h),7.65(s,1h),7.39(ddd,j=8.1,7.1,1.1hz,1h),7.28-7.19(m,4h),7.07(ddd,j=8.5,6.9,1.5hz,1h),6.94-6.88(m,3h),6.68(d,j=3.8hz,1h),6.41(d,j=3.8hz,1h),3.65-3.42(m,4h).
13
c nmr(101mhz,cdcl3)δ162.1(d,j=246.9hz),156.8,146.9,145.8,144.1,143.2,142.9,139.4,137.9,134.7,133.1,132.2,131.8,130.5(d,j=3.4hz),130.2,129.4,129.0,128.8,127.5,127.3,127.1(d,j=7.9hz)126.8,126.6,126.1,125.6,122.8(d,j=1.2hz),121.5,121.4,121.3,120.1,115.6(d,j=21.8hz),30.6,30.4.手性柱ig column(25cm),正己烷/异丙醇=70:30,1ml/min,检测波长=254nm,tr(minor)=9.99min,tr(major)=51.96min.
[0311]
实施例26
[0312]
i-25:
[0313]
(48.0mg,86%产率,90%ee).分析数据:(c=0.5,chcl3,90%ee)1h nmr(400mhz,cdcl3)δ8.93(d,j=5.2hz,1h),8.56(s,1h),8.24(d,j=7.8hz,1h),8.20(d,j=3.6hz,2h),8.11(d,j=7.4hz,1h),8.01(t,j=7.6hz,1h),7.93-7.87(m,2h),7.86(d,j=9.3hz,1h),7.79-7.76(m,2h),7.50(d,j=9.2hz,1h),7.39-7.31(m,2h),7.29-7.26(m,2h),6.98-6.92(m,2h),6.87(ddd,j=8.7,7.0,1.5hz,1h),6.74(d,j=3.7hz,1h),6.49(d,j=3.8hz,1h).
13
c nmr(101mhz,cdcl3)δ162.1(d,j=247.1hz),157.1,144.1,143.5,142.3,142.3,138.0,136.8,133.2,132.4,131.5,131.4,131.0,130.9,130.5(d,j=3.3hz),129.6,129.3,128.9,128.6,128.4,127.9,127.5,127.4,127.1(d,j=8.0hz),126.9,126.8,126.4,126.0,125.6,125.6,125.5,125.2,124.9,124.6,123.0(d,j=1.0hz),121.7,115.7(d,j=21.7hz).手性柱ig column(25cm),正己烷/异丙醇=70:30,1ml/min,检测波长=254nm,tr(minor)=16.85min,tr(major)=66.03min.
[0314]
实施例27
[0315]
i-26:
[0316]
(36.5mg,82%产率,82%ee).分析数据:(c=0.5,chcl3,82%ee).1h nmr(400mhz,cdcl3)δ8.79(d,j=5.2hz,1h),7.87(d,j=8.8hz,1h),7.82(d,j=7.8hz,1h),7.79(d,j=8.7hz,1h),7.73(d,j=5.2hz,1h),7.69(d,j=8.8hz,1h),7.60(d,j=7.7hz,1h),7.52-7.47(m,2h),7.39(d,j=7.5hz,1h),7.31-7.26(m,1h),7.24-7.16(m,
2h),6.97-6.85(m,2h),6.65(d,j=3.8hz,1h),6.31(d,j=3.8hz,1h),1.92(s,3h).
13
c nmr(101mhz,cdcl3)δ161.0(d,j=246.8hz),156.6,142.9,141.6,141.1,140.7,136.8,135.3,132.1,131.8,131.1,129.6,129.4(d,j=3.3hz),128.6,127.9,127.5,127.2,126.5,126.0,126.0,125.9(d,j=6.0hz),124.6,124.6,124.4,121.7(d,j=1.0hz),120.3,114.5(d,j=21.8hz),19.1.手性柱ad-h column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=5.30min,tr(major)=15.39min.
[0317]
实施例28
[0318]
i-27:
[0319]
(33.1mg,70%产率,79%ee).分析数据:(c=0.5,chcl3,79%ee).1h nmr(400mhz,cdcl3)δ8.79(d,j=5.2hz,1h),7.85(d,j=8.8hz,1h),7.80(d,j=7.8hz,1h),7.77-7.69(m,3h),7.69-7.64(m,2h),7.61(t,j=7.6hz,1h),7.49(t,j=7.4hz,1h),7.30-7.23(m,1h),7.23-7.13(m,2h),6.93-6.88(m,2h),6.61(d,j=3.8hz,1h),6.23(d,j=3.8hz,1h),4.22(ab,j
ab
=13.2hz,1h),4.04(ba,j
ba
=13.2hz,1h),3.06(s,3h).
13
c nmr(101mhz,cdcl3)δ161.0(d,j=246.9hz),155.3,142.6,141.7,140.6,139.2,136.8,136.0,132.0(d,j=11.0hz),131.2,129.4(d,j=3.4hz),128.6,127.9,127.8,126.6,126.4,126.1,126.0,126.0,125.9,124.8,124.8,124.5,121.7,121.6,120.5,114.5(d,j=21.8hz),71.1,57.3.手性柱ad-h column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=6.08min,tr(major)=19.83min.
[0320]
实施例29
[0321]
i-28:
[0322]
(42.0mg,91%产率,92%ee).分析数据:(c=0.5,chcl3,92%ee).1h nmr(400mhz,cdcl3)δ8.79(d,j=5.4hz,1h),7.96(d,j=8.7hz,1h),7.84(d,j=8.8hz,1h),7.81(d,j=7.9hz,1h),7.74-7.69(m,1h),7.68(d,j=8.7hz,1h),7.55(t,j=8.1hz,1h),7.49(t,j=7.4hz,1h),7.41(d,j=7.8hz,1h),7.29(dd,j=15.1,7.7hz,1h),7.25-7.16(m,2h),7.07(d,j=8.3hz,1h),6.92-6.87(m,2h),6.66(d,j=3.5hz,1h),6.36(d,j=3.7hz,1h),3.57(s,3h).
13
c nmr(101mhz,cdcl3)δ162.1(d,j=246.9hz),157.3,155.3,143.9,142.9,141.5,137.8,134.1,133.1,131.9,131.5,130.4(d,j=3.4hz),129.9,129.7,129.0,127.3,127.3,127.1(d,j=7.9hz),126.8,126.4,125.8,125.5,122.9(d,j=
1.2hz),122.8,121.5,115.6(d,j=21.7hz),111.2,56.1.手性柱ig column(25cm),正己烷/异丙醇=70:30,1ml/min,检测波长=254nm,tr(minor)=9.04min,tr(major)=29.03min.
[0323]
实施例30
[0324]
i-29:
[0325]
(44.0mg,87%产率,47%ee).分析数据:(c=0.5,chcl3,47%ee).1h nmr(400mhz,cdcl3)δ8.79(d,j=5.5hz,1h),7.95-7.84(m,2h),7.65(d,j=8.0hz,1h),7.63-7.56(m,1h),7.48(d,j=8.7hz,1h),7.41-7.27(m,6h),7.15(dd,j=7.0,1.0hz,1h),7.04-6.97(m,2h),6.97-6.88(m,2h),6.86(d,j=3.8hz,1h),6.73(tt,j=7.3,1.5hz,1h),6.38(d,j=3.8hz,1h),6.29(d,j=7.7hz,1h),6.19(t,j=7.5hz,1h).
13
c nmr(101mhz,cdcl3)δ162.2(d,j=247.1hz),158.8,143.0,141.8,141.0,140.5,138.0,136.4,133.3,132.8,131.4,130.6(d,j=3.4hz),130.5,129.3,128.5,128.4,127.7(d,j=6.8hz),127.7,127.6,127.1,127.1,126.9,126.8,126.4,126.3,126.3,125.5,125.2,122.9(d,j=1.2hz),121.4,115.7(d,j=21.8hz).手性柱ad-h column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=13.59min,tr(major)=26.50min.
[0326]
实施例31
[0327]
i-30:
[0328]
(36.8mg,86%产率,91%ee).分析数据:(c=0.5,chcl3,91%ee).1h nmr(400mhz,cdcl3)δ8.69(d,j=5.5hz,1h),7.97(d,j=8.6hz,1h),7.89(d,j=8.2hz,1h),7.83(d,j=8.7hz,1h),7.77(d,j=5.7hz,1h),7.75(d,j=7.8hz,1h),7.48(t,j=7.6hz,1h),7.43(ddd,j=8.1,6.8,1.2hz,1h),7.38
–
7.32(m,2h),7.31
–
7.25(m,2h),7.23(s,1h),7.20
–
7.14(m,2h),7.06(d,j=8.4hz,1h),6.92(d,j=3.9hz,1h),6.58(d,j=3.8hz,1h),1.80(s,3h).
13
c nmr(101mhz,cdcl3)δ158.3,144.6,142.5,141.6,138.1,138.0,136.0,134.1,133.5,132.7,130.8,130.6,129.9,129.0,128.8,128.8,128.0,127.7,127.4,127.1,127.0,126.4,126.2,126.1,125.5,123.2,121.8,22.9.手性柱ig column(25cm),正己烷/异丙醇=70:30,1ml/min,检测波长=254nm,tr(minor)=13.70min,tr(major)=24.13min.
[0329]
实施例32
[0330]
i-31:
[0331]
(33.7mg,76%产率,60%ee).分析数据:(c=0.5,chcl3,60%ee).1h nmr(400mhz,cdcl3)δ8.55(d,j=5.8hz,1h),7.97(d,j=8.6hz,1h),7.80(dd,j=8.4,2.5hz,2h),7.64(d,j=5.8hz,1h),7.61
–
7.50(m,2h),7.46(d,j=8.4hz,1h),7.39(t,j=7.9hz,1h),7.36
–
7.32(m,2h),7.32
–
7.28(m,1h),7.27-7.23(m,2h),7.20
–
7.13(m,1h),6.85(d,j=3.8hz,1h),6.68(d,j=7.6hz,1h),6.52(d,j=3.8hz,1h),3.03(s,3h).
13
c nmr(101mhz,cdcl3)δ162.9,156.5,144.3,142.2,140.8,135.4,134.8,134.2,132.2,129.8,129.2,129.0,128.7,128.5,128.4,127.2,127.0,126.8,126.7,126.5,125.4,124.9,122.7,121.1,119.6,107.5,56.0.手性柱ig column(25cm),正己烷/异丙醇=80:20,1ml/min,检测波长=254nm,tr(minor)=24.20min,tr(major)=55.88min.
[0332]
实施例33
[0333]
i-32:
[0334]
(36.0mg,87%产率,97%ee).分析数据:(c=0.5,chcl3).1h nmr(400mhz,cdcl3)δ8.55(d,j=5.7hz,1h),7.94(d,j=8.5hz,1h),7.74(d,j=8.1hz,1h),7.67(dd,j=12.5,8.4hz,2h),7.61(d,j=5.7hz,1h),7.46(t,j=7.5hz,1h),7.38(d,j=8.4hz,1h),7.29(t,j=7.6hz,1h),7.27
–
7.19(m,3h),7.19
–
7.14(m,2h),7.13
–
7.06(m,2h),6.72(d,j=3.7hz,1h),6.35(d,j=3.7hz,1h),1.46(s,3h).
13
c nmr(101mhz,cdcl3)δ161.2,143.2,141.5,140.2,134.6,134.3,133.4,133.4,133.1,132.2,130.8,129.8,129.1,129.0,128.9,127.7,127.4,126.7,126.6,126.3,126.2,126.0,125.7,125.0,124.3,121.4,119.7,22.8.手性柱ig column(25cm),正己烷/异丙醇=90:10,1ml/min,检测波长=254nm,tr(minor)=19.56min,tr(major)=30.06min.
[0335]
实施例34
[0336]
i-33:
[0337]
(40.7mg,88%产率,99%ee).分析数据:(c=0.5,chcl3,99%ee).1h nmr(400mhz,cdcl3)δ8.68(d,j=5.7hz,1h),8.07(d,j=8.3hz,1h),7.89(d,j=8.2hz,
1h),7.85
–
7.80(m,2h),7.79
–
7.74(m,3h),7.57
–
7.47(m,2h),7.39
–
7.28(m,3h),7.28
–
7.22(m,3h),7.20
–
7.14(m,1h),6.86
–
6.78(m,2h),6.72(d,j=8.7hz,1h),6.39(d,j=3.8hz,1h).
13
c nmr(101mhz,cdcl3)δ162.49,144.37,142.54,142.42,136.36,135.15,134.30,134.18,133.94,133.27,130.46,130.12,129.79,129.72,129.11,128.87,128.75,128.52,128.49,127.54,127.27,127.26,127.02,126.87,126.52,126.06,125.66,125.41,122.52,120.90.手性柱ig column(25cm),正己烷/异丙醇=70:30,1ml/min,检测波长=254nm,tr(minor)=16.39min,tr(major)=41.99min.
[0338]
实施例35
[0339][0340]
(86%产率,96%ee).hrms(esi)calcd for c
22h20
ns[m+h]
+
:330.1311;found:330.1310.
[0341]
实施例36
[0342][0343]
(84%产率,97%ee).hrms(esi)calcd for c
25h20
ns[m+h]
+
:366.1311;found:366.1310.
[0344]
实施例37
[0345][0346]
(82%产率,99%ee).hrms(esi)calcd for c
21h19
n2s[m+h]
+
:331.1263;found:331.1260.
[0347]
实施例38
[0348][0349]
(85%产率,95%ee).hrms(esi)calcd for c
24h19
n2s[m+h]
+
:367.1263;found:367.1260.
[0350]
实施例39
[0351][0352]
(81%产率,96%ee).hrms(esi)calcd for c
25h20
ns[m+h]
+
:366.1311;found:366.1310.
[0353]
实施例40
[0354][0355]
(81%产率,95%ee).hrms(esi)calcd for c
28h20
ns[m+h]
+
:402.1311;found:402.1310.
[0356]
实施例41
[0357][0358]
(83%产率,93%ee).hrms(esi)calcd for c
24h19
n2s[m+h]
+
:367.1263;found:367.1260.
[0359]
实施例42
[0360][0361]
(87%产率,96%ee).hrms(esi)calcd for c
27h19
n2s[m+h]
+
:403.1263;found:403.1260.
[0362]
实施例43
[0363][0364]
除铑催化剂和手性酸不同外,其他条件和操作均同实施例1。
[0365]
(36.0mg,85%产率,93%ee).分析数据:[α]2d3=-229.1(c=0.5,chcl3,93%ee).1h nmr(400mhz,cdcl3)δ8.87(d,j=4.5hz,1h),8.04(d,j=8.3hz,1h),7.98-7.89(m,2h),7.89-7.82(m,2h),7.80-7.76(m,2h),7.60(d,j=8.4hz,1h),7.43-7.38(m,2h),7.25-7.14(m,1h),7.14-6.94(m,2h),6.39(d,j=3.6hz,1h),6.28(d,j=3.8hz,1h),2.17(s,3h).
13
c nmr(101mhz,cdcl3)δ156.9,144.0,140.5,140.3,138.0,137.7,133.2,133.1,132.4,132.1,130.7,129.3,128.8,128.8,128.0,128.0,127.5,127.0,126.9,126.8,126.5,126.1,126.0,126.0,125.7,125.1,121.8,15.1.手性柱chiralpak ig column(25cm),正己烷/异丙醇=90:10,1ml/min,检测波长=254nm,tr(major)=30.81min,tr(minor)=45.02min.
[0366]
实施例44
[0367]
除下表1中特别指明的条件外,其余条件和操作均同实施例1。
[0368][0369]
表1
[0370]
[0371][0372]
注:a通过1h nmr(以1,3,5-三甲氧基苯作为内标)分析粗反应混合物;b手性hplc分析确定;c扩号内为分离收率。
[0373]
实施例45化合物i-1的单晶衍射实验
[0374]
1.单晶培养:将实施例2中得到的主要组分化合物i-1(30mg)溶于无水二氯甲烷和石油醚的混合溶剂中,于4℃静置3天,有单晶析出,收集单晶进行单晶衍射测试。
[0375]
2.测试参数如下表所示:
[0376]
[0377][0378]
3.测定结果:化合物i-1的构型由单晶衍射确定为ra构型(a表示轴手性)。因此,本发明化合物i-1~i-41均为ra构型。
[0379]
实施例46不同的铑催化剂
[0380]
除下述特别指明的条件外,其余条件和操作均同实施例1。
[0381]
[0382][0383]
实施例47不同的手性酸
[0384]
除下述特别指明的条件外,其余条件和操作均同实施例1。
[0385]
[0386][0387]
实施例48
[0388]
除下述特别指明的条件外,其余条件和操作均同实施例1。
[0389][0390]
当化合物iii为烯烃时,反应可以发生,并且与现有技术(lit:zheng,j.;cui,w.j.;zheng,c.;you,s.l.,j.am.chem.soc.2016,138,5242.)相比能够取得更好的对映选择性控制。
[0391]
试验例1
[0392][0393]
参考实施例1的方法,在氩气氛围下,向schlenk反应瓶中加入[scprh](2.6mg,0.005mmol),a11(6.8mg,0.02mmol),agf(38.0mg,0.30mmol),化合物ii(0.10mmol)和苯(0.30mmol,3.0equiv.)和dmf(2.0ml),然后加热至60℃反应。没有获得相应产物。
[0394]
试验例2
[0395]
现有催化体系:
[0396][0397]
本发明的催化体系:
[0398][0399]
使用现有的催化体系(j.am.chem.soc.2019,141,9504),得到产物的收率和对映选择性偏低。
[0400]
试验例3
[0401][0402]
使用现有催化体系,对于杂芳基的底物不兼容。
[0403]
试验例4
[0404][0405]
参考实施例1的方法,在氩气氛围下,向schlenk反应瓶中加入[scprh](2.6mg,0.005mmol),a11(6.8mg,0.02mmol),化合物ii(0.10mmol)和iii(0.30mmol,3.0equiv.)和dmf(2.0ml),然后加热至60℃反应。没有获得相应产物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1