miR-1468-5p在评估宫颈癌患者PD-L1表达中应用的制作方法
本发明属于生物医学领域,涉及mir-1468-5p在评估宫颈癌患者pd-l1表达中应用。
背景技术:
pd-l1也称为b7-h1或cd274,通过与程序性死亡1(pd-1)受体结合而促进t细胞功能障碍。作为主要的免疫检查点,pd-l1在塑造免疫抑制性肿瘤微环境中起着关键作用。多数肿瘤高表达pd-l1蛋白,与其不良预后密切相关。目前检测pd-l1的方式主要是免疫组化法,但是存在以下问题:1.采用“免疫组化法”直观检测肿瘤组织中pd-l1蛋白表达,但不能实现实时检测;2.免疫组化抗体多样性,评估层次不均一。因此,如何高效准确的判断肿瘤组织pd-l1表达量对评估患者临床预后至关重要。
液态活检是指以非侵入方式从体液中获得生物标记物并对其分析,从而反映其来源组织的相关信息的检测技术。随着社会的进步和医学技术的不断发展,对于恶性肿瘤精准诊治的要求不断提高。随着对肿瘤分子机制逐渐深入地研究,使得液态活检所涉及的研究内容从传统的肿瘤循环细胞(circulatingtumorcell,ctc)和肿瘤循环dna(circulatingtumordna,ctdna)发展至肿瘤细胞来源的外泌体。
肿瘤细胞来源的外泌体(exosome)富含肿瘤细胞特征性物质,尤其是mirnas,并普遍存在于患者体液中,其能够将这些遗传信息或肿瘤信号通路转移至肿瘤微环境中,促进肿瘤转移,在应用于肿瘤的早期筛查和临床诊断中有显著优势。因此,开发一种能够通过液态活检对pd-l1表达进行评估的方法具有重要的意义。
技术实现要素:
针对上述问题,本发明的目的是提供一种通过对宫颈癌(cca)患者血浆外泌体mir-1468-5p表达水平的检测实时评估pd-l1表达,从而有效评估宫颈癌临床预后的方法。
为实现上述目的,本发明采取的技术方案为:mir-1468-5p在评估宫颈癌患者pd-l1表达中应用。
本发明还要求保护mir-1468-5ppcr引物在制备pd-l1表达诊断试剂或试剂盒中的应用。
具体地,通过mir-1468-5ppcr引物检测宫颈癌患者样品中mir-1468-5p的表达,从而评估pd-l1表达。
作为本发明的优选实施方式,所述宫颈癌患者样品为血样。
本发明还要求保护mir-1468-5ppcr引物在制备宫颈癌临床预后诊断试剂或试剂盒中的应用。
具体地,通过mir-1468-5ppcr引物检测宫颈癌患者样品中mir-1468-5p的表达,从而评估pd-l1表达,进而实现宫颈癌临床预后的评估。
作为本发明的优选实施方式,所述宫颈癌患者样品为宫颈癌患者血样。
本发明还提供了一种通过血浆评估pd-l1表达的方法,包括如下步骤:
(1)、提取血浆外泌体;
(2)、通过mir-1468-5ppcr引物检测mir-1468-5p的表达量;
(3)、若mir-1468-5p的相对表达量≥1.793,说明pd-l1高表达,否则pd-l1低表达。
相对于组织切片,血浆的获取更容易,优选通过提取血浆中的外泌体,检测其中mir-1468-5p的含量,从而对pd-l1的表达进行评估。相比于血浆外泌体mir-1468-5p低表达组,高表达组的临床预后更差。
作为本发明的优选实施方式,所述步骤(1)中血浆外泌体的提取的具体过程为:
(1a)、收集宫颈癌患者血浆的全血样本,离心获取血浆;
(1b)、离心步骤(1a)所述血浆,去除残余血细胞;
(1c)、离心步骤(1b)去除残余血细胞后的血样,去除细胞碎片;
(1d)、将步骤(1c)获得的混合物与pbs等比例稀释,离心得到所述血浆外泌体。
更优选地,所述血浆外泌体的制备方法如下:
(1)、收集2mlcca患者全血样本,4℃,3000g,离心30分钟,获取约1ml的血浆;
(2)、4℃,8000g,离心30分钟,去除残余血细胞;
(3)、4℃,12000g,离心30分钟,去除细胞碎片;
(4)、将离心去除血细胞和细胞碎片后的血浆用等体积的pbs稀释,4℃,160000g,离心16小时,富集得到所述血浆外泌体。
本发明还要求保护用于评估宫颈癌患者pd-l1表达或宫颈癌临床预后的试剂或试剂盒,所述试剂或试剂盒包括mir-1468-5ppcr引物。
作为本发明的优选实施方式,所述mir-1468-5ppcr引物包括核苷酸序列如seqidno.1所示的引物。
更优选地,还包括和引物mrq3’。
核苷酸序列如seqidno.1(ctccgtttgcctgtttcgctg)所示的引物为正向引物;引物mrq3’为反向引物,为takara公司的mir-xtmmirnafirst-standsynthesisandsybrrqrt-pcr试剂盒内含的组分。
其检测的pcr扩增程序为:
(1)预变性:95℃30s;
(2)扩增:95℃5s,60℃34s,共40个循环。
作为本发明的优选实施方式,所述包括mir-1468-5p的pcr引物的检测试剂盒还包括内参基因的引物。
更优选地,所述内参基因为u6。
作为本发明的优选实施方式,所述检测mir-1468-5p表达量的检测试剂为mir-1468-5ppcr引物。
本发明首次发现了mir-1468-5p的表达水平与pd-l1表达呈正相关,因此可以通过cca患者mir-1468-5p的表达水平对pd-l1表达进行评估;由于mir-1468-5p的表达水平可通过血浆外泌体进行检测,因此可以通过检测血浆外泌体中mir-1468-5p的表达水平即可实现pd-l1表达水平的评估,实时性、灵敏性更强,且更方便;本发明还进一步提供了通过血浆外泌体中mir-1468-5p的表达水平对pd-l1进行评估具体的方法,拓阔了pd-l1检测渠道,且检测更准确,重复性好,对于宫颈癌临床预后评估具有重要的意义。
附图说明
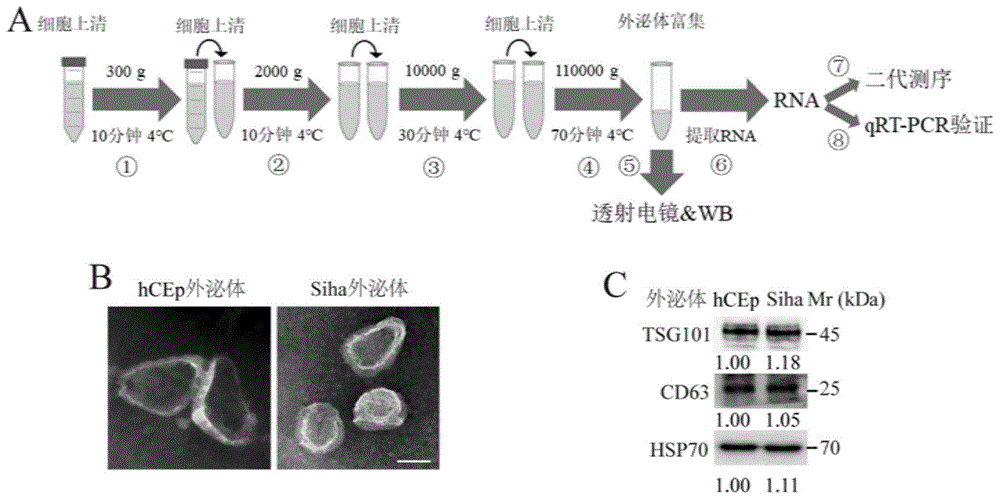
图1为hcep和siha细胞外泌体的提取和鉴定;a为细胞外泌体的提取和鉴定流程图,b为通过透射电子显微镜观察外泌体的形态,c为通过wb对外泌体特异标记物进行检测的检测结果。
图2为hcep和siha细胞外泌体中rna的分析结果;a为外泌体rna表达热图,b为瞬转rna至hcep细胞对pd-l1表达的影响结果,c为不同宫颈癌系外泌体中mirnas的表达情况。
图3为血浆外泌体的提取和鉴定;a为血浆外泌体的提取和鉴定流程图,b为通过透射电子显微镜观察外泌体的形态,c为通过wb对外泌体特异标记物进行检测的检测结果。
图4为血浆外泌体mir-1468-5p与pd-l1的相关性分析结果;a为不同类型样本血浆外泌体mir-1468-5p的相对表达量,b为不同类型样本血浆外泌体mir-1468-5p的相对表达量,***,p<0.001,c为通过spearman相关性分析对血浆外泌体中mir-1468-5p的相对表达量与pd-l1的相关性分析结果,d为通过roc曲线分析得到mir-1468-5p表达的临界值。
图5为利用kaplan-meier生存曲线得到的血浆外泌体中mir-1468-5p不同表达水平对cca临床预后的评估结果。
具体实施方式
为更好的说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。
实施例1
选取正常宫颈细胞(hcep)和宫颈癌细胞(siha),提取并鉴定其分泌的外泌体,具体流程如下(图1a):
①收集48ml细胞上清,4℃,300g,离心10分钟,去除残余细胞;
②4℃,2000g,离心10分钟,去除细胞碎片;
③4℃,10000g,离心30分钟,去除残余细胞器;
④4℃,110000g,离心70分钟,富集外泌体;
⑤外泌体鉴定:透射电镜形态学鉴定,表面特异性蛋白标志物wb鉴定;
⑥提取外泌体rna;
⑦外泌体rna进行高通量二代测序;
⑧qrt-pcr验证测序结果。
hcep和siha外泌体通过透射电镜形态学鉴定和表面特异性蛋白标志物wb鉴定的结果如图1b、1c,结果显示提取产物符合外泌体特征。
提取hcep和siha外泌体及细胞中的rna进行高通量二代测序,并进行3次生物学重复,制得hcep和siha外泌体rna表达热图(如图2a),结果表明hcep外泌体,siha外泌体,hcep细胞,siha细胞4组间mirnas差异表达明显(测序数据已上传geo数据库,编号:gse143339)。
筛选测序结果中差异表达最显著的16个mirnas为:mir-7704,mir-5787,mir-127-3p,mir-126-5p,mir-4492,mir-142-5p,mir-4488,mir-3656,mir-1468-5p,mir-126-3p,mir-5096,mir-199-3p,mir-409-3p,mir-223-3p,mir-4466和mir-144-5p。将上述16个mirnasmimics瞬时转染至hcep,结果表明仅有mir-1468-5p能够上调pd-l1表达(图2b)。
进一步提取其他宫颈癌细胞系,包括c33a,ms751,hela,caski,me180等细胞中的外泌体及其中的mirnas,进行qrt-pcr检测,结果表明(如图2c):相比于hcep细胞和外泌体,mir-1468-5p在所有宫颈癌细胞中明显高表达,尤其是宫颈癌外泌体,提示mir-1468-5p是上调pd-l1表达的重要mirna。
实施例2
分别收集67例正常人和102例cca患者的临床血样,提取并鉴定其分泌的外泌体,具体流程如下(图3a):
①收集2ml全血样本,4℃,3000g,离心30分钟,获取1ml血浆;
②4℃,8000g,离心30分钟,去除残余血细胞;
③4℃,12000g,离心30分钟,去除细胞碎片;
④将离心后的1ml血浆用1mlpbs等比例稀释,4℃,160000g,离心16小时,富集血浆外泌体;
⑤外泌体鉴定:透射电镜形态学鉴定和表面特异性蛋白标志物wb鉴定;
⑥外泌体rna提取和qrt-pcr检测。
提取的血浆外泌体经透射电镜形态学鉴定和表面特异性蛋白标志物wb鉴定的结果如图3b、3c,结果显示提取产物符合其基本特征。
利用mirneasymini试剂盒提取血浆外泌体mirnas,并通过qrt-pcr检测血浆外泌体mir-1468-5p表达,检测使用takara公司的mir-xtmmirnafirst-standsynthesisand
表1pcr反应体系
其中,正向引物由生工生物工程(上海)股份有限公司合成,核苷酸序列为:ctccgtttgcctgtttcgctg(seqidno.1),反向引物为试剂盒中的mrq3’引物。内参使用u6,正向引物为attggaacgatacagagaagat,反向引物为ggaacgcttcacgaattt。
扩增程序为:
检测结果表明(如图4a):相比于正常人,cca患者血浆外泌体mir-1468-5p的表达明显增高。
同时在和临床血样相匹配的宫颈组织病理切片上通过免疫组化检测pd-l1表达,采用h-score评分:h-score=σpi(i+1),式中pi表示阳性细胞数量占切片中所有细胞数量的百分数;i代表染色强度。结果表明(如图4b):相比于正常人,cca患者pd-l1表达明显增高。
进一步通过spearman相关性分析发现(如图4c),cca患者血浆外泌体mir-1468-5p相对表达量和肿瘤组织pd-l1表达量呈显著正相关(r=0.698,p<0.001)。
根据肿瘤组织pd-l1表达的h-score评分,定义h-score≥8为pd-l1高表达;定义h-score<8为pd-l1低表达。结合roc曲线进一步发现(如图4d),cca患者血浆外泌体mir-1468-5p相对表达量能够有效评估肿瘤组织pd-l1表达(roc曲线下面积:0.907,p<0.001),youden’s指标表明cca患者血浆外泌体mir-1468-5p评估肿瘤组织pd-l1表达量的最优界值为1.793,即cca患者血浆外泌体mir-1468-5p相对表达量≥1.793,肿瘤组织pd-l1呈高表达;cca患者血浆外泌体mir-1468-5p相对表达量<1.793,肿瘤组织pd-l1呈低表达。
利用kaplan-meier生存曲线完成血浆外泌体mir-1468-5p不同表达水平对cca临床预后的评估,结果表明(如图5):相比于血浆外泌体mir-1468-5p低表达组,高表达组的临床预后更差(p=0.0026,时序检验)。
综上,这些结果提示cca患者血浆外泌体mir-1468-5p相对表达量能够有效评估肿瘤组织pd-l1表达水平及cca临床预后。
最后应当说明的是,以上实施例仅用以说明本发明的技术方案,而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细地说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
sequencelisting
<110>广州医科大学附属第一医院(广州呼吸中心)
<120>mir-1468-5p在评估宫颈癌患者pd-l1表达中应用
<160>1
<170>patentinversion3.3
<210>1
<211>21
<212>dna
<213>人工序列
<400>1
ctccgtttgcctgtttcgctg21
- 还没有人留言评论。精彩留言会获得点赞!