多肽化合物及其制备方法与应用与流程
1.本发明涉及生物医药领域,特别是涉及一种多肽化合物及其制备方法与应用。
背景技术:
2.自从1962年从铃蟾皮肤中分离获得由22个氨基酸组成的铃蟾抗菌肽之后,人们已从两栖动物皮肤中发现了多种抗菌肽。1980年在美国天蚕体内发现了第一个昆虫来源的抗菌多肽,以后在微生物、水产动物、脊椎动物、哺乳动物中也陆续发现具有抗菌防御功能的多肽分子。生物体产生抵御致病微生物的肽类分子被统称为“抗菌肽”,或被称为宿主“防御素”。“抗菌肽”或“防御素”构成了宿主抵抗外来病原菌感染的第一道防线,保护宿主自身不受致病微生物的侵害。
3.抗菌肽(antibacterial peptide)的特征是由氨基酸组成的肽分子,氨基酸数目少于100,常携带正电荷,具有确定的抗菌活性。目前发现的生物体产生的天然抗菌肽有抑制革兰氏阳性菌、革兰氏阴性菌、真菌、病毒、寄生虫等功能。抗菌肽最为吸引人关注的优点包括:大多数抗菌肽的氨基酸数目在15-45个氨基酸之间,作用靶点为细菌的细胞膜,对宿主无毒或低毒,无耐药性,具有良好的热稳定性及生物安全性。与人类友好伴生的益生菌乳酸菌产生的乳链菌肽(nisin)是目前研究得最为清楚的抗菌肽,nisin是由34个氨基酸组成的直链肽分子,它对引起食品腐败的革兰氏阳性菌中的葡萄球菌、链球菌、微球菌具有良好的抑制生长作用,被美国、欧盟、中国的食品药品监督管理局批准作为食品添加剂应用于食品保存。
4.由于自然界中的抗菌肽不易产生耐药性,具有良好的生物安全性、环境安全性等,从而吸引了科学家以天然抗菌肽为先导化合物进行各种方式的分子改良,以期获得更为高效的抗菌效果、更长久的稳定性、更良好的生理适应性,更易于应用于日常或临床实施,更便于人工合成的抗菌肽。
技术实现要素:
5.本发明的目的是针对现有技术中存在的技术缺陷,第一方面,提供一种多肽化合物,其结构式见式ⅰ,为:(cys-poly-b
m
)
2-k-(poly-a
n
),
[0006][0007]
其中poly-b
m
与poly-a
n
均为直链肽,k为赖氨酸(lys,k),cys为半胱氨酸,(cys-poly-b
m
)
2-k是以k为分支点,连接有分支片段为poly-b
m
的两分支肽,两分支肽片段poly-b
m
的末端氨基酸均为半胱氨酸cys,且两分支肽片段末端的两个半胱氨酸通过二硫键(经氧化形成的)连接,使得两分支肽片段poly-b
m
形成环肽(环肽由k、poly-b
m
、cys、cys、poly-b
m
依次首尾连接形成);
[0008]
m为poly-b
m
直链肽所包含的氨基酸数目,n为poly-a
n
直链肽所包含的氨基酸数目;优选的,m为2-10,n为4-15;更优选的,m为2-7,n为6-12;再优选的,m为3-5,n为7-10;最优选的,m为4,n为8。
[0009]
poly-a
n
主要由碱性氨基酸组成,碱性氨基酸选自精氨酸(arg,r)、赖氨酸(lys,k)、组氨酸(his,h)中的一种或几种,优选精氨酸(arg,r)。
[0010]
poly-b
m
主要由疏水性氨基酸组成,可由同一种疏水氨基酸组成,或由多种不同疏水氨基酸组成;所述疏水性氨基酸选自苯丙氨酸(phe,f)、丙氨酸(ala,a)、亮氨酸(leu,l)、异亮氨酸(ile,i)、色氨酸(trp,w)、脯氨酸(pro,p)、缬氨酸(val,v)、蛋氨酸(met,m)和甘氨酸(gly,g)中的一种或几种;优选亮氨酸(leu,l)、异亮氨酸(ile,i)、色氨酸(trp,w)、脯氨酸(pro,p)、缬氨酸(val,v)中的一种或几种。
[0011]
所述环肽可以选用l型氨基酸,也可选用d型氨基酸,也可夹杂个别具有氨基酸特性的分子组成环肽。
[0012]
所述多肽化合物可以是与有机酸或无机酸形成的盐类化合物;或所述多肽化合物所带有的羟基可形成但不限于所形成的醚、酯、苷或甙等的化合物;或所述多肽化合物所带有的巯基可形成但不限于所形成的硫醚、硫苷,或与半胱氨酸或含半胱氨酸的肽所形成的含有二硫键的化合物;或所述多肽化合物所带有的氨基可形成但不限于所形成的酰化物、烃化物、与糖类物质所形成的苷类物质等;或所述多肽化合物所带有的羧基可形成但不限于所形成的酯、酰胺类化合物等;或所述多肽化合物所带有的亚氨基可形成但不限于所形成的苷、酰化物、烃化物等;或所述多肽化合物所带有的酚羟基可形成但不限于所形成的酯、醚、苷、甙类化合物,与有机碱或无机碱所形成的盐类化合物;或所述多肽化合物与金属离子所形成的配合物、络和物或螯合物;或所述多肽化合物所形成的水合物或溶剂物。
[0013]
第二方面,本发明提供一种药物组合物,含有上述多肽化合物,其几何异构体、其药学上可接受的盐或溶剂化合物、可药用载体或赋形剂。
[0014]
第三方面,本发明提供制备上述多肽化合物的方法,依次包括分支肽(cys-poly-b
m
)
2-k-(poly-a
n
)的合成,和对两分支肽片段cys-poly-b
m
末端的cys进行氧化形成环肽的过程。
[0015]
所述分支肽(cys-poly-b
m
)
2-k-(poly-a
n
)的合成为:首先采用多肽固相fmoc/tbu合成法从多肽的羧基端向氨基端逐一接枝延长,直至完成目标肽链的合成;
[0016]
所述分支肽(cys-poly-b
m
)
2-k-(poly-a
n
)的合成具体包括:
[0017]
(1)、肽链的合成:以fmoc-rink amide树脂(取代值为0.3mmol/g)为起始原料,用含六氢吡啶的dmf溶液去除n端fmoc保护基使n端成为自由氨基,然后加入fmoc-aa(pbf)-oh、hobt和dic进行接枝反应以引入氨基酸残基;反应完成后用纯dmf洗涤树脂,采用kaiser test检测接枝效率,若氨基酸接枝反应显示不完全,重复接枝反应;每接枝一个目标氨基酸都要经过去除保护基、接枝氨基酸、洗涤树脂的过程,完成一个氨基酸残基在目标肽链上的延伸,直至完成目标肽段poly-a
n
的合成;
[0018]
(2)、分支:继续去除n端fmoc后,加入fmoc-lys(fmoc)-oh、hobt和dic进行接枝反应以引入分支氨基酸残基lys(k);用含六氢吡啶的dmf溶液去除n端以及lys侧链fmoc保护基,使此处产生两个自由氨基(氮端以及侧链处)>k-poly-a
n
;
[0019]
(3)、分支肽的延伸:加入fmoc-aa-oh、hobt和dic继续接枝以引入后续氨基酸残
基;反应完成后用纯dmf洗涤树脂,采用kaiser test检测接枝效率,若氨基酸接枝反应显示不完全,重复接枝反应一次;每接枝一个目标氨基酸都要经过去除保护基、接枝氨基酸、洗涤树脂的过程,完成一个氨基酸残基在目标肽链上的延伸,直至完成分支肽(cys-poly-b
m
)
2-k-(poly-a
n
)的合成;
[0020]
(4)、分支肽从树脂上解离:用切割试剂将分支肽(cys-poly-b
m
)
2-k-(poly-a
n
)从树脂上切割下来,同时将n端以及侧链保护基去除,反应液加入到大量冷的无水乙醚中使分支肽(cys-poly-b
m
)
2-k-(poly-a
n
)以沉淀形式析出;离心,用乙醚洗涤后干燥即得到分支肽(cys-poly-b
m
)
2-k-(poly-a
n
)的粗品。
[0021]
所述对两分支肽片段cys-poly-b
m
末端的cys进行氧化形成环肽的过程具体为:将得到的分支肽(cys-poly-b
m
)
2-k-(poly-a
n
)的粗品溶解于dmso的水溶液中搅拌,待反应完全后冷冻干燥反应液,即得到成环的(cys-poly-b
m
)
2-k-(poly-a
n
)环肽的粗品。
[0022]
在形成环肽的过程后还包括纯化步骤,具体为:采用反相高效液相色谱仪对(cys-poly-b
m
)
2-k-(poly-a
n
)环肽的粗品进行纯化;
[0023]
优选的,色谱柱填料:agela c 18(10um,50
×
250mm);色谱操作条件:流动相a(含0.05%三氟乙酸,2%乙腈的水溶液),流动相b为90%乙腈/水,流速为每分钟25ml,紫外检测波长220nm;冻干溶剂后得到白色蓬松絮状的多肽化合物纯品,纯度>98%。
[0024]
所述多肽化合物的分子量由maldi-tof质谱进行表征具体为:采用abi公司的voyager de-pro maldi-tof ms质谱仪,基质为2,5-二羟基苯甲酸(dhb),取1mg多肽化合物和基质事先混合1min,得到混合溶液,然后取1μl混合溶液直接滴到maldi-tof质谱仪专用样品靶上,待样品自然干燥后,将样品靶放置于质谱仪靶箱内进行样品分析。
[0025]
第四方面,本发明提供上述多肽化合物或上述方法制备得到的多肽化合物在制备抗菌药物中的应用。
[0026]
所述抗菌为杀灭引起烧伤或创伤的创面常见的感染致病菌及真菌或抑制其生长。
[0027]
所述抗菌包括杀灭原核微生物中的细菌(包括球菌、杆菌、螺旋菌等,或革兰氏阴性菌和阳性菌)、放线菌(包括支原体、衣原体、立克次氏体)、蓝藻(包括蓝球藻、念珠藻、颤藻等)或抑制其生长。
[0028]
所述抗菌包括杀灭真核微生物中的真菌(包括酵母菌,霉菌、青霉菌、黏菌等)和原生致病微生物(包括阿米巴变形虫等)或抑制其生长。
[0029]
所述抗菌为杀灭金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌、鲍曼不动杆菌或抑制其生长;尤其是杀灭屎肠球菌(enterococcus faecium)、金黄色葡萄球菌(staphylococcus aureus)、肺炎克雷伯氏菌(klebsiella pneumoniae)、鲍曼不动杆菌(acinetobacter baumannii)、铜绿假单胞菌(pseudomonas aeruginosa)、大肠杆菌(enterobacter species)等耐药细菌及耐药真菌或抑制其生长。
[0030]
本发明提供的多肽化合物(cys-poly-b
m
)
2-k-(poly-a
n
)其优点在于:本发明的多肽化合物不仅抑制格兰氏阳性菌的生长,也抑制格兰氏阴性菌的生长,抑菌谱广泛;其属于两亲性分子,易溶于水,在一定浓度下具有水凝胶的特性,在表皮创面上具有良好的涂布附着性,作为外用涂布药物易于吸收也便于清除;具有良好的化学稳定性,在创面的滞留时间较为持久。该多肽化合物不易产生耐药性,对生理环境及自然环境均不会造成污染;制备纯度高,稳定性好,易于存储,便于运输;合成原料常规、易得、价廉;合成工艺易于产业化、规
模化制备,能够满足社会大量需求。
具体实施方式
[0031]
以往发现的抗菌肽均是自然界生物体产生的天然抗菌肽,根据报道多为单链形态的多肽分子。本发明设计和制备出了一种非单链形态的抗菌肽(cys-poly-b
m
)
2-k-(poly-a
n
)。
[0032]
其中,poly-a
n
是以碱性氨基酸为主要组成的直链肽;碱性氨基酸包括精氨酸(arg r)、赖氨酸(lys k)、组氨酸(his h);可在poly-a
n
中的任何位置加入任意其它类型的氨基酸分子,但需不影响poly-a
n
以碱性氨基酸为主的特点。poly-a
n
肽链可以全部由单一种类的碱性氨基酸组成,或由不同种类的碱性氨基酸组成。n为组成poly-a
n
链包含的氨基酸数目,最适宜范围为7-10。
[0033]
k代表在合成过程中采用具有两个活性氨基的赖氨酸fmoc-lys(fmoc)-oh,形成分支肽的位点,继续氨基酸的接枝反应完成分支肽cys-poly-b
m
。
[0034]
poly-b
m
是由疏水氨基酸为主要组成的分支后的直链肽,其氨基末端为cys,即cys-poly-b
m
。疏水氨基酸包括:苯丙氨酸(phe,f)、缬氨酸(val,v)、亮氨酸(leu,l)、异亮氨酸(ile,i)、蛋氨酸(met,m)、色氨酸(trp,w)、脯氨酸(pro,p)、丙氨酸(ala,a)、甘氨酸(gly,g)。可在直链肽中的任何位置参入任意其它类别的氨基酸性质的分子但需不影响该片段以疏水性氨基酸为主的特点。poly-b
m
肽链可由单一种类的疏水氨基酸组成,也可以由多种疏水氨基酸混合组成。m为poly-b
m
所包含的氨基酸数目,最适宜佳范围为4-6;可在poly-b
m
中的任何位置加入任意其它类型的氨基酸分子,但需不影响poly-b
m
以疏水性氨基酸为主的特点。
[0035]
本发明提供的分支环肽具有杀灭或抑制格兰氏阳性菌、格兰氏阴性菌的生长;本发明阐述的分支环肽不仅具有杀灭引起创面感染的金黄色葡萄球菌(质控株)、大肠埃希菌(质控株)、铜绿假单胞菌(质控株)、鲍曼不动杆菌(质控株)等,还具有抑制或杀灭eskepe(enterococcus faecium)屎肠球菌、staphylococcus aureus金黄色葡萄球菌、klebsiella pneumoniae肺炎克雷伯氏菌、acinetobacter baumannii鲍曼不动杆菌、pseudomonas aeruginosa铜绿假单胞菌、enterobacter species大肠杆菌等耐药细菌,还能抑制这些菌的生长。
[0036]
本发明阐述的分支环肽的制备方法分为两部分,第一部分为(cys-poly-b
m
)
2-k-(poly-a
n
)分支肽的合成,第二部分为环肽(cys-poly-b
m
)
2-k-(poly-a
n
)的合成。过程如下:
[0037]
一、(cys-poly-b
m
)
2-k-(poly-a
n
)分支肽的合成:
[0038]
合成多肽:以fmoc-rink amide树脂(取代值为0.3mmol/g)为起始原料,用25%六氢吡啶/dmf(体积比)去除n端fmoc保护基使n端成为自由氨基(2次,每次10分钟),然后用3倍当量的fmoc-aa(pbf)-oh/hobt/dic进行接枝以引入氨基酸残基,反应时长为1小时。反应完成之后用纯dmf洗涤树脂6次,采用kaiser test检测接枝效率,若氨基酸接枝反应显示不完全,重复接枝反应一次(每一次接枝反应之后都需进行dmf洗涤树脂及kaiser test检测,此后不再赘述)。每接枝一个目标氨基酸都要经过“去除保护基、接枝氨基酸、洗涤树脂”的过程(或一个循环)完成一个氨基酸残基在目标肽链上的延申,完成目标肽段poly-a
n
的合成。
[0039]
分支:继续去除n端fmoc后,用2倍当量的fmoc-lys(fmoc)-oh/hobt/dic进行接枝以引入分支氨基酸残基,反应时长为1小时。用25%六氢吡啶/dmf去除n端以及lys侧链fmoc保护基,使此处产生两个自由氨基(氮端以及侧链处)。
[0040]
分支肽的延伸:用6倍当量的fmoc-aa-oh/hobt/dic继续接枝以引入后续氨基酸残基,反应时长为1小时。重复以上去除fmoc保护基以及接枝步骤的循环,完成cys-polyb
m
目标肽链的合成。
[0041]
多肽从树脂上解离:用切割试剂(三氟乙酸:1,2-乙二硫醇:苯甲硫醚:苯酚:h2o:三异丙基硅烷=68.5:10:10:5:3.5:1,v/v)将多肽从树脂上切割下来并同时将n端以及侧链保护基去除(30℃下切割3小时),滤液加入到大量冷的无水乙醚中使多肽沉淀析出。离心,用乙醚洗涤3次后干燥即得到尚未形成二硫键的分支多肽(cys-poly-b
m
)
2-k-(poly-a
n
)粗品。
[0042]
二、环肽(cys-poly-b
m
)
2-k-(poly-a
n
)的合成:
[0043]
分支肽二硫键的形成:将得到的分支肽粗品按2mg/ml的浓度溶解于20%dmso/h2o中,搅拌过夜反应,ms和hplc跟踪。待反应完全后通过冷冻干燥浓缩反应液即得到cys形成二硫键成环的(cys-poly-b
m
)
2-k-(poly-a
n
)环肽粗品。
[0044]
三、纯化及表征:
[0045]
采用hp100型(美国安捷伦公司)反相高效液相色谱仪对(cys-poly-b
m
)
2-k-(poly-a
n
)环肽粗品粗品进行纯化。色谱柱填料:agela c18(10um,50x 250mm)。色谱操作条件:流动相a(含0.05%三氟乙酸,2%乙腈的水溶液),流动相b为90%乙腈/水,流速为每分钟25ml,紫外检测波长220nm。冻干溶剂后得到白色蓬松絮状的多肽纯品,纯度>98%。多肽分子量由maldi-tof质谱进行表征,与理论值的差异<1
‰
,而其纯度由分析型高效液相色谱仪(agela c18-10x250 mmm,流速每分钟1ml)给出。
[0046]
采用abi公司的voyager de-pro maldi-tof ms质谱仪,基质为2,5-二羟基苯甲酸(dhb)。取1mg多肽样品和基质溶液事先混合1min,然后取1μl混合溶液直接滴到maldi-tof质谱仪专用样品靶上,待样品自然干燥后,将样品靶放置于质谱仪靶箱内进行样品分析。要求所测多肽样品的质谱结果与其理论值的误差小于千分之一。
[0047]
环肽的存储:
[0048]
采用hplc纯化得到的(cys-poly-b
m
)
2-k-(poly-a
n
)精制纯品(通常纯度>95%)经过冷冻干燥后呈现白色蓬松絮状,将分支环肽密封在瓶中置于-20℃避光保存。
[0049]
多肽合成目前已成为常规技术。多肽合成及纯化的原理和操作参见由盛树力主编,科学技术文献出版社(1998年)出版的“多肽激素的当代理论和应用”一书的第三章“多肽的化学合成和纯化”。本发明阐述的分支环肽的合成制备方式,包括多肽固相合成、分支肽的合成、制备分子间二硫键构成分支环肽的方式仅为专业人员提供提示,但并不局限于本文所叙述的方式。
[0050]
以下结合具体实施例,更具体地说明本发明的内容,并对本发明作进一步阐述,但这些实施例绝非对本发明进行限制。
[0051]
实施例1:(cys-poly-b
m
)
2-k-(poly-a
n
)分支肽的合成
[0052]
poly-b
m
是以碱性氨基酸为主要组成部分形成的直链肽链。碱性氨基酸包括精氨酸(arg,r)、赖氨酸(lys,k)、组氨酸(his,h),可在直链肽链中的任何位置参入任意其它类
别的氨基酸,poly-b
m
肽链也可以全部由单一种类的碱性氨基酸组成,或全部由不同种类的碱性氨基酸组成。m为组成poly-b
m
肽链包含的氨基酸数目,适宜范围为2-10,最佳范围为3-8。
[0053]
首先采用手工固相fmoc/tbu合成法,以fmoc-rink amide树脂(取代值为0.3mmol/g)为起始原料,从多肽的c端向n端逐一添加缩合氨基酸,延长肽链直至完成两分支肽(cys-poly-b
m
)
2-k-(cyclic-a
n
)的合成。所用的氨基酸原料可以是l型氨基酸,也可以是d型氨基酸。
[0054]
首先以fmoc-rink amide树脂(取代值为0.3mmol/g)为起始原料,用25%六氢吡啶/dmf(体积比)去除n端fmoc保护基使n端成为自由氨基(2次,每次10分钟),然后用3倍当量的fmoc-aa(pbf)-oh/hobt/dic进行接枝以引入氨基酸残基,反应时长为1小时。反应完成之后用纯dmf洗涤树脂6次,采用kaiser test检测接枝效率,若氨基酸接枝反应显示不完全,重复接枝反应一次(每一次接枝反应之后都需进行dmf洗涤树脂及kaiser test检测,此后不再赘述)。每接枝一个目标氨基酸都要经过“去除保护基、接枝氨基酸、洗涤树脂”的过程(或一个循环)完成一个氨基酸残基在目标肽链上的延申,完成目标肽段poly-a
n
的合成。
[0055]
继续去除n端fmoc后,用2倍当量的fmoc-lys(fmoc)-oh/hobt/dic进行接枝以引入分支氨基酸残基,反应时长为1小时。用25%六氢吡啶/dmf去除n端以及lys侧链fmoc保护基,使此处产生两个自由氨基(氮端以及侧链处)。
[0056]
用6倍当量的fmoc-aa-oh/hobt/dic继续接枝以引入后续氨基酸残基,反应时长为1小时。重复以上去除fmoc保护基以及接枝步骤的循环,完成两个cys-poly-b
m
多肽片段在lys的接枝。
[0057]
用切割试剂(三氟乙酸:1,2-乙二硫醇:苯甲硫醚:苯酚:h2o:三异丙基硅烷=68.5:10:10:5:3.5:1,v/v)将多肽从树脂上切割下来并同时将n端以及侧链保护基去除(30℃下切割3小时),滤液加入到大量冷的无水乙醚中使多肽沉淀析出。离心,用乙醚洗涤3次后干燥即得到尚未形成二硫键的分支多肽(cys-poly-b
m
)
2-k-(poly-a
n
)粗品。
[0058]
线性直链肽的每一步氨基酸缩合反应完成之后用纯dmf洗涤树脂6次,并且每次缩合反应完成之后采用kaiser test检测缩合效率,若氨基酸缩合反应显示不完全,重复缩合反应一次。
[0059]
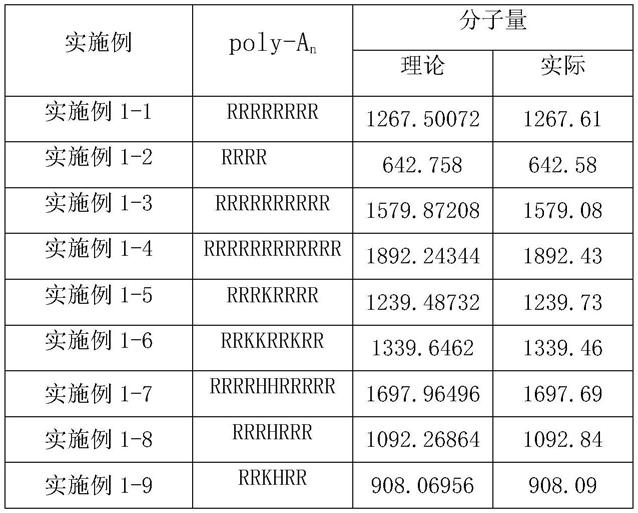
按照上述方法得到本发明的直链肽片段,表1和表2中列出部分合成得到的肽片段,并测得其质谱分子量。
[0060]
表1直链肽片段poly-a
n
的各基团列表
[0061][0062]
表1结果表明,本发明合成出的直链肽片段poly-a
n
质谱分子量与理论分子量的误差在千分之一范围之内(
‰
),说明该直链肽片段确证为对应实施例的直链肽片段。
[0063]
表2直链肽片段poly-b
m
的各基团列表
[0064][0065]
表2结果表明,本发明合成出的直链肽片段poly-b
m
质谱分子量与理论分子量的误差在千分之一范围之内(
‰
),说明该直链肽片段确证为对应实施例的直链肽片段。
[0066]
此实施例部分是为了公开直链肽片段的内容,并不是对本发明的限制,实际合成时可按以下实施例中的说明进行。
[0067]
实施例2:环肽(cys-poly-b
m
)
2-k-(poly-a
n
)的合成
[0068]
将得到的分支多肽(cys-poly-b
m
)
2-k-(poly-a
n
)粗品按2mg/ml的浓度溶解于20%dmso/h2o中,搅拌过夜反应,ms和hplc跟踪。待反应完全后通过冷冻干燥浓缩反应液即得到cys形成二硫键成环的(cys-poly-b
m
)
2-k-(poly-a
n
)分支环肽粗品。
[0069]
以上分别列举了合成制备杂环肽的直链部分与环肽部分,合成得到的环肽中氨基酸种类和排列顺序见实施例3。
[0070]
实施例3:(cys-poly-b
m
)
2-k-(poly-a
n
)环肽
[0071]
按照本发明阐述的环肽分子通式(cys-poly-b
m
)
2-k-(poly-a
n
),环肽的合成制备方式参照说明书表述的合成步骤,直链肽及环肽片段见表3。
[0072]
表3环肽分子通式(cys-poly-b
m
)
2-k-(poly-a
n
)的各基团列表
[0073][0074]
实验例一:本发明多肽化合物对耐药菌的抑制作用
[0075]
耐药菌株:为革兰氏阳性、阴性常见致病菌,如
[0076]
金黄色葡萄球菌(staphylococcus aureus,革兰氏阳性菌g+,来自atcc12600
t
)、大肠杆菌(escherichia coli,革兰氏阴性菌g-,来自atcc700415
t
)、鲍曼不动杆菌(acinetobacter baumannii,革兰氏阴性菌g-,来自atcc19606
t
)、绿脓杆菌(pseudomonas aeruginosa,革兰氏阴性菌g-,来自boston41501)。
[0077]
实验材料:药敏纸片(直径6mm,商购得到):青霉素(penicillin)10μg/片、万古霉素(vancomycin)30μg/片、头孢曲松(ceftriaxone)30μg/片、链霉素(streptomycin)10μg/片、庆大霉素(gentamycin)10μg/片、四环素(tetracycline)30μg/片、氯霉素(chloramphenicol)30μg/片、红霉素(erythromycin)15μg/片、林可霉素(lincomycin)2μg/片、氧氟沙星(ofloxacin)5μg/片。
[0078]
lb培养基:含胰化蛋白胨(tryptone)10g/l,酵母提取物(yeast extract)5g/l,nacl 10g/l,ph 7.4,高压下121℃蒸汽灭菌20min,备用。
[0079]
实验步骤:
[0080]
(1)、将四种耐药菌分别从保种管活化出来,经16s测序,确定为纯菌株后,分别转接到lb培养基上,置于37℃恒温培养箱培养1-2天,待用。
[0081]
(2)、对步骤(1)培养得到的四种耐药菌株从培养箱中取出,配制成菌悬液并将菌悬液浊度均调至0.5,分别均匀涂至新鲜的lb培养基上。
[0082]
(3)、将药敏纸片贴在涂布待测细菌的lb培养基上,置于37℃恒温培养箱培养过夜。
[0083]
(4)、观察每种药敏纸周围形成的抑菌圈,抑菌圈直径<14mm为耐药(用“+”表示),抑菌圈≥14mm且≤18mm为介于耐药与敏感之间(用“r”表示),抑菌圈>18mm为敏感(用
“-”
表示),结果见表4。
[0084]
表4四种耐药菌的敏感程度
[0085][0086]
表4结果表明:
[0087]
金黄色葡萄球菌staphylococcus aureus atcc 12600
t
(革兰氏阳性菌),对万古霉素有耐药性,对链霉素、氯霉素介于敏感和耐药之间,而对红霉素、青霉素、四环素、庆大霉素、氧氟沙星、林可霉素、头孢曲松敏感;
[0088]
鲍曼不动杆菌acinetobacter baumannii atcc 19606
t
(革兰氏阴性菌),对红霉素、万古霉素、链霉素、青霉素、氯霉素、林可霉素、头孢曲松具有耐药性,对庆大霉素介于敏感和耐药之间,对四环素、氧氟沙星敏感;
[0089]
大肠杆菌escherichia coli atcc 700415
t
(革兰氏阴性菌),对红霉素、林可霉素、青霉素、万古霉素具耐药性,对四环素介于敏感和耐药之间,对链霉素、氯霉素、庆大霉素、氧氟沙星、头孢曲松敏感;
[0090]
绿脓杆菌pseudomonas aeruginosa boston 41501(革兰氏阴性菌),对红霉素、万古霉素、链霉素、青霉素、氯霉素、庆大霉素、林可霉素、头孢曲松具有耐药性,对四环素、氧氟沙星敏感。
[0091]
以上结果说明,以上四种菌株均为耐药菌株,用于以下实验中。
[0092]
实验例二:本发明多肽化合物对几种耐药细菌的抑菌作用
[0093]
1、将表5所列的各多肽化合物冻干粉10mg/管,分别加入10ml培养液配成1mg/ml母液,培养液为lb培养基;母液于8000r/min下离心5分钟,待用。
[0094]
2、取无菌消毒培养管若干个,分别用无菌纯水将母液稀释至浓度为500μg/ml、250μg/ml、125μg/ml、100μg/ml、50μg/ml、25μg/ml、12.5μg/ml、10μg/ml、5μg/ml、2.5μg/ml、1μg/ml、0.5μg/ml、0.25μg/ml、0.1μg/ml、0.05μg/ml、0.025μg/ml,作为样品;若母液难熔,可在稀释前加入30μl dmso作为助溶剂进行溶解。
[0095]
3、在酒精灯火焰上灼烧接种环后,用接种环挑取少许实验例一得到的四种耐药菌株的菌落,分别置于含有1ml生理盐水的培养管中混匀得到菌液。
[0096]
4、用加样器吸取100μl菌液分别加入不同浓度的步骤2得到的含有各多肽化合物的培养管中。
[0097]
5、将步骤4的培养管置于37℃恒温培养箱中培养24小时,观察各个培养管中细菌的生长情况,以培养管中液体呈清亮的最小浓度为该多肽化合物的最小抑菌浓度(mic),结果见表5。
[0098]
表5各多肽化合物对不同耐药菌株的最小抑菌浓度(mic)
[0099][0100][0101]
由表5可以看出,单独的直链多肽分子和开环的两分支多肽分子对以上四种耐药细菌的抑菌作用比本发明的多肽化合物差。此外,poly-b
m
并不是选择任意的疏水氨基酸都能达到很好的效果,只有选择某几种时(如l、w、p、v时)抑菌效果才比单独的直链多肽分子
好。
[0102]
实验例三:本发明多肽化合物对真菌的抑菌作用
[0103]
1、将营养琼脂培养基铺在培养盘中待用;白色念珠菌的菌株来自解放军总医院第四医学中心烧伤科病房从临床分离获得的菌株及白色念珠菌质控菌株atcc90028。检定实验采用ls1809念珠菌显色平板(广州市迪景微生物科技有限公司出品,批号:ccp-81101d,2-8℃保存)。在每个培养盘中滴加实验例二中步骤2得到的样品,并在盘底做记号,每种菌株每个浓度制作2个检测培养盘;
[0104]
2、接种环在酒精灯火焰上灼烧冷却后,蘸取含真菌的培养液,在固体培养盘表面做均匀涂抹,然后放在37℃培养箱中孵育培养24小时,观察培养盘中真菌的生长,以实施例3-5的多肽化合物为例,结果见表6。从临床分离获得的白色念珠菌与质控白色念珠菌atcc90028结果相同。
[0105]
表6各多肽化合物对真菌的最小抑菌浓度(mic)
[0106][0107][0108]
由表6结果可以看出,单独的直链多肽分子对白色念珠菌的最小抑菌浓度均>1000μg/ml,基本没有抑菌作用。本发明的多肽化合物将直链肽片段与环状肽分子结合起来后,最小抑菌浓度(mic)为100μg/ml,具有抑菌作用。
[0109]
实验例五:本发明多肽化合物的生物安全性
[0110]
实验一:一次完整皮肤刺激试验
[0111]
1、实验材料及来源
[0112]
家兔10只(来自解放军总医院第四医学中心动物实验室),样品:本发明表3中多肽化合物溶液(将本发明表3中多肽化合物分别溶于去离子水中,配制成浓度为10mg/ml的溶液);
[0113]
2、实验步骤
[0114]
(1)在试验前24h,用脱毛剂将家兔背部脊柱两侧的毛去掉,不损伤皮肤。去毛范围,左、右各约3cm
×
3cm。
[0115]
(2)次日分别将本发明表3中多肽化合物溶液(浓度为10mg/ml)直接滴于面积为2.5cm
×
2.5cm的一侧去毛皮肤上,或滴于同样大小的2层-4层纱布上并敷贴在一侧去毛皮肤表面,然后用一层无刺激塑料膜或油纸覆盖,再用无刺激胶布固定。另一侧去毛皮肤作为空白对照(或溶剂对照)。敷贴时间为4h。试验结束后,用温水或无刺激性溶剂除去残留样品。
[0116]
(3)分别于去除样品1h、24h和48h后观察皮肤局部反应,并按表7进行刺激反应评分。
[0117]
表7皮肤刺激反应评分标准
[0118][0119][0120]
按表7的评分标准,本发明表3中多肽化合物溶液处理过的所有家兔评分均为0分,未见红斑或水肿,表明本发明多肽化合物对于动物完整皮肤无刺激性。
[0121]
实验二:一次破损皮肤刺激试验
[0122]
1、实验材料及来源
[0123]
家兔10只(来自解放军总医院第四医学中心动物实验室),样品:本发明表3中多肽化合物溶液(将本发明表3中多肽化合物分别溶于去离子水中,配制成浓度为10mg/ml的溶液);
[0124]
2、实验步骤
[0125]
(1)涂样品前,在2.5cm
×
2.5cm的去毛皮肤上,用75%酒精清洁、消毒暴露皮肤,待酒精挥发后,用灭菌刀片或注射针头在皮区内划一个“井”形的破损伤口,皮肤破损仅达表皮,不伤及真皮。
[0126]
(2)涂样品前的皮肤准备、样品的涂抹和局部皮肤反应的观察,评分方法同实验一。在观察过程中需要鉴别感染和原发性刺激反应的区别,若有感染可疑,进行重复测试。
[0127]
在各个观察时间点,按照表7对动物的皮肤红斑与水肿形成情况进行评分,并分别按时间点将3只动物的评分相加,除以动物数,获得不同时间点的皮肤刺激反应积分均值(刺激指数)。取其中最高皮肤刺激指数,按表8评定该样品对动物皮肤刺激强度的级别。
[0128]
表8皮肤刺激强度分级
[0129]
皮肤刺激指数刺激强度级别0~0.5无刺激性0.5~2.0轻刺激性2.0~6.0中等刺激性6.0~8.0强刺激性
[0130]
按表8的强度分级,本发明表3中多肽化合物溶液处理过的所有家兔评分均为0分,
表明本发明多肽化合物对于动物破损皮肤无刺激性。
[0131]
实验三:急性眼刺激试验
[0132]
1、实验材料及来源
[0133]
家兔30只(来自解放军总医院第四医学中心动物实验室),试验前检查家兔双眼,有异常者不能用于试验。
[0134]
样品:本发明表3中多肽化合物溶液(将本发明表3中多肽化合物分别溶于去离子水中,配制成浓度为10mg/ml的溶液);
[0135]
2、实验步骤
[0136]
(1)吸取样品0.1ml,滴入家兔一侧眼结膜囊内,另一侧眼滴以生理盐水作为正常对照,每个样品作3个平行试验。
[0137]
(2)滴样品后,将眼被动闭合30s后用生理盐水冲洗。于滴眼1h、24h、48h、72h、7d、14d和21d后,肉眼观察家兔眼结膜、虹膜和角膜的损伤与恢复情况。如果72h内未出现刺激反应,或第7d或第14d,眼睛刺激反应完全恢复,即可提前终止试验。必要时,用2%荧光素钠溶液或裂隙灯、放大镜检查角膜及虹膜变化。
[0138]
3、评价规定
[0139]
按表9对家兔眼角膜、虹膜和结膜的急性刺激反应进行评分,并分别计算每只动物在三个不同观察时间(24h、48h和72h)在角膜损害、虹膜损害、结膜充血和结膜水肿四方面的“平均评分”(即每只动物的24h、48h和72h评分之和除以观察次数3)。分别以动物眼角膜、虹膜和结膜充血、水肿的平均评分和恢复时间进行,按表10、表11眼刺激反应分级标准判定样品对眼睛的刺激强度。
[0140]
表9家兔急性眼刺激反应的评分标准
[0141]
[0142][0143]
表10眼刺激性反应分级标准
[0144][0145]
表11眼刺激性反应分级标准
[0146]
[0147][0148]
按表9-11的分级标准,本发明表3中多肽化合物溶液处理过的所有家兔评分均为0分,表明本发明多肽化合物对于家兔角膜、虹膜和结膜无急性刺激性。
[0149]
以上所述仅是本发明的优选实施方式,应当指出的是,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1