含有CAR核酸片段的表达质粒、含该表达质粒的靶向CD105的CAR-T细胞及其制备方法和应用
含有car核酸片段的表达质粒、含该表达质粒的靶向cd105的car-t细胞及其制备方法和应用
技术领域
1.本发明属于肿瘤生物制品领域,具体涉及含有car核酸片段的表达质粒、含该表达质粒的靶向cd105的car-t细胞及其制备方法和在例如过继免疫治疗中的应用。
背景技术:
2.近年来免疫治疗已逐渐成为肿瘤治疗领域的焦点,其中免疫细胞过继治疗成为研究的热点,基于嵌合抗原受体修饰t细胞(chimeric antigen receptor t-cell,car t)的免疫疗法已经证明是一种有希望的癌症治疗策略。嵌合抗原受体t细胞通过提取患者体内的t细胞,利用基因工程技术使识别肿瘤特异性抗原的受体表达在t细胞表面,t细胞绕过抗原提呈阶段以及mhc(major histocompatibility complex,主要组织相容性复合体)的限制,特异性识别和攻击杀伤肿瘤细胞。由于是诱导、激活自体细胞,因此该疗法没有放疗和化疗的毒副反应。
3.car-t细胞是由抗原识别结构域(配体或单链抗体scfv)、铰链区、跨膜区和胞内信号区连接而成。目标抗原的选择对于car的特异性、有效性以及基因改造t细胞自身的安全性都是关键的决定因素。cd105,又称endoglin,是血管内皮细胞增殖相关膜抗原,被认为是新生血管内皮细胞的特异标志分子之一,表达于实体肿瘤新生血管及相关肿瘤细胞表面,与某些癌症的预后密切相关,表明cd105可作为有吸引力的血管内皮靶标。car-t细胞的胞外抗原识别区通常为单链可变片段(single chain variable fragment,scfv),由重链可变片段通过柔性连接轻链可变片段组成。然而scfv并不总是有效折叠,并倾向于聚集。纳米抗体(nanobody,nb)由重链的可变区(variable domain of the heavy chain of hcabs,vhh)构成,体积小(宽2.5nm,长4.2nm),分子量小(约为15kda),可以快速扩散至全身,并且具有良好的组织穿透能力。nanobody基因序列与人vh基因家族3序列具有高度同源性,所以在人体内的免疫原性低。因此nanobody可以作为产生肿瘤抗原特异性car-t细胞的理想抗原识别区域。car-t的制备大多采用慢病毒转染,易产生插入突变等问题。crispr/cas 9技术是备受关注的一项新兴基因编辑技术,crispr/cas 9系统由非特异性的cas 9蛋白和一系列具有片段特异性的crrna(crispr rna)组成,这些crrna能够在靶向位置引导cas 9剪切dna并产生双链断裂,然后细胞会借助同源重组机制或者非同源末端连接机制对断裂的dna进行修复,产生所需要的基因的定点插入、删除或者靶向位置的基因替换。
4.恶性肿瘤已成为目前危害人类身体健康最严重的疾病之一,肿瘤传统治疗手段有手术、化疗和放疗,传统方法虽然能使病情缓解,但存在肿瘤复发率高、化疗耐药以及严重影响生活质量等问题。近年来综合治疗提高了肿瘤的治疗效果,但仍相当一部分患者复发或对常规治疗产生耐药,为此我们提出了含有car核酸片段的表达质粒、含有该表达质粒的一种cd105靶向性car-t细胞及其制备方法和在肿瘤治疗中的应用。
技术实现要素:
5.为了解决现有技术中的一个或多个技术问题,本发明在第一方面提供了一种含有car核酸片段的表达质粒,所述car核酸片段为嵌合抗原受体cd105vhh-cd8-cd137-cd3ζ片段,由cd105 vhh、cd8铰链区和跨膜区、cd137的胞内信号结构域和cd3ζ的胞内信号结构域串联构成。
6.本发明在第二方面提供了一种工程化cd105靶向性car-t细胞,所述car-t细胞转染有本发明第一方面所述的表达质粒。
7.本发明在第三方面提供了一种用于制备本发明第二方面所述的car-t细胞的方法,所述方法包括以下步骤:
8.(1)制备本发明第一方面所述的表达质粒;
9.(2)将所述表达载体转染到t细胞中,从而获得car-t细胞的方法。
10.本发明在第四方面提供了本发明第一方面所述的表达质粒在制备本发明第二方面所述的car-t细胞中的应用。
11.本发明在第五方面提供了本发明第二方面所述的car-t细胞在制备用于治疗肿瘤制剂中的应用。
12.本发明的研究者发现于,对cd105阳性肿瘤免疫治疗中,cd105 car-t的优势在于特异性的靶向,增强免疫细胞靶向识别肿瘤抗原,嵌合抗原受体依赖的肿瘤杀伤活性以及输注后在肿瘤部位的浸润。cd105 car-t细胞所拥有的这些特性源于嵌合抗原受体的功能结构,主要包含抗原识别区域及细胞激活区域,细胞内激活区域能延长细胞在体内的存活时间。另外本发明采用crispr/cas9基因编辑的方法进行制备car-t细胞,提供一种高效制备cd105 car-t细胞的方法,该方法制备的car-t能稳定表达嵌合抗原受体,具有良好的应用前景。
附图说明
13.图1:t7e1检测表明grna对aavs1位点有靶向敲除。其中,1-3泳道为pcr产物被切成3或3个条带以上;4-10泳道为对照,无变化。
14.图2:plvx-car载体示意图。
15.图3:puc-mdonor载体酶切电泳图。其中,m表示15000bp marker;1表示未酶切;2表示kpnⅰ单酶切;3表示hindⅲ单酶切;4表示双酶切。
16.图4:car片段与puc-mdonor酶切载体连接后pcr鉴定图。其中,m表示15000bp marker;1表示puc-mdonor-mock;2表示puc-mdonor-cd19 car;3表示puc-mdonor-cd105 car。
17.图5:t细胞电转后表达gfp荧光。
18.图6:t细胞电转后car的表达。
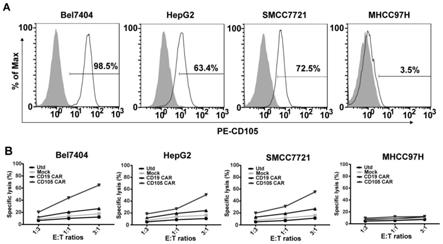
19.图7:cd105 car-t特异性杀伤cd105阳性肿瘤细胞。
具体实施方式
20.如上所述,本发明在第一方面提供了一种含有car核酸片段的表达质粒,所述car核酸片段为嵌合抗原受体cd105 vhh-cd8-cd137-cd3ζ片段,由cd105 vhh、cd8铰链区和跨
膜区、cd137的胞内信号结构域和cd3ζ的胞内信号结构域串联构成。
21.在一些优选的实施方式中,所述car核酸片段如seq id no.1所示;优选的是,所述表达质粒为插入有所述car核酸片段的puc-donor质粒。
22.本发明在第二方面提供了一种工程化cd105靶向性car-t细胞,所述car-t细胞转染有本发明第一方面所述的表达质粒。
23.在一些优选的实施方式中,所述car-t细胞还转染有包含人aavs1基因的grna识别序列的第二质粒。更优选的是,所述grna识别序列如seq id no.2所示。进一步优选的是,所述第二质粒为插入有所述grna识别序列的px330质粒。
24.本发明在第三方面提供了一种用于制备本发明第二方面所述的car-t细胞的方法,所述方法包括以下步骤:
25.(1)制备本发明第一方面所述的表达质粒;
26.(2)将所述表达载体转染到t细胞中,从而获得car-t细胞的方法。
27.在一些优选的实施方式中,所述car核酸片段通过如下方法制备:
28.(i)合成嵌合抗原受体cd105 vhh-cd8-cd137-cd3ζ核酸片段;
29.(ii)将所述核酸片段克隆至表达载体p lvx中,得到插入有所述核酸片段的plvx-car质粒;
30.(iii)利用plvx-car质粒通过pcr扩增所述核酸片段;
31.(iv)将扩增得到的所述核酸片段插入到puc-donor载体质粒中,得到插入有所述核酸片段的puc-donor-car质粒。
32.在一些更优选的实施方式中,在将扩增得到的所述核酸片段插入到puc-donor载体质粒中时采用限制性内切酶kpnⅰ/hindⅲ对puc-donor载体质粒进行双酶切。
33.在一些更具体的实施方式中,表达质粒puc-donor-car可以通过如下方法构建:全基因合成嵌合抗原受体cd105 vhh-cd8-cd137-cd3ζ片段,并将合成的片段亚克隆至经ecor i/not i双酶切后的表达载体p lvx中,测序正确后,使用去内毒素plasmid mini kit进行质粒提取,得到plvx-car质粒。以plvx-car质粒为模板,pcr法进行扩增目的片段,使用限制性内切酶kpnⅰ/hindⅲ双酶切将载体质粒puc-donor进行双酶切,酶切产物进行琼脂糖凝胶电泳,用gel extraction kit进行切胶回收。使用t4 dna快速连接酶将car片段和酶切puc-donor质粒进行连接,连接产物转入dh5α感受态细胞,感受态细胞大量培养后提取质粒,得到puc-donor-car质粒。
34.在另一些优选的实施方式中,所述方法还包括另外用包含人aavs1基因的grna识别序列的所述第二质粒转染t细胞,从而获得同时转染有本发明第一方面所述的表达载体和所述第二质粒的car-t细胞。
35.在另一些优选的实施方式中,在将所述核酸片段克隆至表达载体p lvx中时采用限制性内切酶ecor i/not i对表达载体p lvx进行双酶切。
36.在另一些优选的实施方式中,所述包含人aavs1基因的grna识别序列通过如下方法合成:
37.(i)在人aavs1基因外显子序列上,根据crispr/cas9基因编辑技术对sgrna的要求设计并合成19~23个碱基的单链grna识别序列,再合成所述识别序列的反向互补序列,从而得到双链grna识别序列;
38.(ii)使用限制性内切酶bbs i将px330质粒进行酶切,并通过琼脂糖凝胶电泳回收酶切产物,使用t4 dna连接酶将双链grna识别序列和经过酶切的px330质粒酶切产物进行连接,获得插入有grna识别序列的px330-grna质粒。
39.在一些更具体的实施方式中,首先进行重组质粒px330-grna的构建:在人aavs1基因外显子序列上,根据crispr/cas9基因编辑技术对sgrna的要求设计19~23个碱基序列进行合成,例如如序列表中seqid no.8所示,同时合成其反向互补的oligo,pcr仪上进行双链oligo的合成。使用限制性内切酶bbs i将px330质粒进行酶切,酶切产物进行琼脂糖凝胶电泳,使用gel extraction kit进行切胶回收。使用t4 dna快速连接酶将双链oligo和酶切px330质粒进行连接,得到重组质粒px330-grna。另外,还可以进一步将连接产物转入dh5α感受态细胞,感受态细胞大量培养后提取扩增的质粒px330-grna。
40.另外,可以将质粒转染293t细胞,用dna提取试剂盒提取细胞全基因组dna,对grna靶点附近的基因组dna扩增,取pcr产物使用t7e1(t7核酸内切酶i)法进行酶切鉴定敲除效率。
41.在另一些优选的实施方式中,通过如下方法将本发明第一方面所述的表达质粒和所述第二质粒同时转染至t细胞中:激活t细胞;将所述表达质粒和所述第二质粒混合并加入到电转杯中,以100v电压、5ms、1次电容条件下将所述表达质粒和所述第二质粒电转染至所述激活t细胞中,利用ripm 1640完全培养基对经过电转染的激活t细胞进行培养,得到所述car-t细胞。
42.在一些更具体的实施方式中,可以用easy-t试剂盒激活t细胞,取电转液重悬激活的t细胞,利用电转液将puc-donor-car质粒和px330-grna质粒混合。将混合质粒和激活t细胞转到电转杯中,以100v电压、5ms、1次电容条件下电转染,完成后迅速加入预热的ripm 1640完全培养基轻轻的加入电转杯中,然后再将电极杯中所有液体吸出,接种到预热好培养基的孔板中,培养4h后更换含100u/ml的rhil-2的ripm 1640完全培养基。
43.在一些更具体的实施方式中,所述方法包括以下步骤:针对19号染色体aavs1位点的ppp1r12c基因设计grna,构建crispr/cas9载体(px330-grna)。使用t7e1方法验证设计的grna是否具有切割作用。通过rt-pcr构建胞外段含有cd105纳米抗体,共刺激分子为4-1bb及结构域为cd3ζ的二代cars分子载入plvx表达载体中,测序验证序列正确性。用pcr方法获取car片段,将car片段与puc-mdonor-aavs1载体连接,构建两端带有1kb左右同源臂的外源基因的同源同组载体puc-mdonor-car。将crispr/cas9载体和同源重组载体采用电转染的方式导入到t淋巴细胞中,利用crispr/cas9基因编辑技术构建car-t细胞,使t细胞表达该嵌合抗原受体。
44.在一些优选的实施方式中,t细胞制备通过分离外周血的单个核细胞,然后培养获得t细胞。
45.在一些优选的实施方式中,对电转后的t细胞进行培养,待细胞量占培养瓶80-90%时将细胞收集换液,加入终浓度为100u/ml的il-2的完全培养液进行扩增培养,采用流式细胞仪对感染的细胞进行鉴定。
46.在一些优选的实施方式中,所述car-t细胞是采用crispr/cas9基因编辑的方法进行制备。
47.本发明在第四方面提供了本发明第一方面所述的表达质粒在制备本发明第二方
面所述的car-t细胞中的应用。
48.本发明在第五方面提供了本发明第二方面所述的car-t细胞在制备用于治疗肿瘤制剂中的应用。优选的是,所述肿瘤为cd105阳性肿瘤。更优选的是,所述肿瘤为肝肿瘤。进一步优选的是,所述肿瘤为由选自由肝癌细胞bel7404、hepg2、smcc7721和mhcc97h组成的组的肝癌细胞导致的肝肿瘤。
49.实施例
50.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
51.下述实施例中的实验方法,如无特殊说明,均为常规方法。
52.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
53.实施例1:t细胞的制备与激活
54.(1)密度梯度离心法分离外周血t淋巴细胞
55.用带有抗凝剂的采血管从健康志愿者中采取新鲜外周血。用37℃的pbs与外周血等体积混合。采用密度梯度离心法分离外周血t淋巴细胞,吸取4ml37℃无菌的淋巴细胞分离液到容积为15ml离心管中,取稀释后的外周血8ml沿离心管壁缓慢加到分离液面上,以2000rpm离心20min。离心结束后,可见管内分为四层,用巴氏管沿离心管边缘小心地吸取云雾状白膜层细胞(pbmc),收集细胞悬液到无菌的50ml离心管中,加入四倍体积的pbs,洗涤细胞2次。用完全的细胞培养基ripm 1640重悬收集的pbmc细胞,转移到细胞培养皿中,在37℃细胞培养箱中培养2h。吸取细胞培养皿中悬浮的细胞到另外的培养皿中进行培养,悬浮的细胞为t淋巴细胞,该t淋巴细胞用含有100u/ml的rhil-2的完全的ripm 1640培养基进行培养,得到含有t淋巴细胞的混合液。
56.(2)t细胞的激活
57.用easy-t试剂盒激活液提前一天处理24孔培养板,步骤如下:
58.1)按照1:500的比例在1xpbs中加入stimu-buffer(激活缓冲液),混匀。
59.2)在24孔板中选择合适数目的孔,每孔加入200μl步骤1中得到的混合液。拍打培养板均匀,用封口膜包好,放置4℃过夜。
60.3)临用前移去stimu-buffer溶液,再用200μl/孔pbs洗板一次。
61.收集分离好的t细胞,用含有100u/ml的rhil-2的完全的ripm 1640培养基重悬细胞,加入到处理过的培养板中,放入37℃,co2培养箱中培养24h,备用。
62.实施例2:crispr/cas9质粒(px330-grna)的构建
63.在人19号染色体aavs1位点的ppp1r12c基因上,根据crispr/cas9基因编辑技术对sgrna的要求设计19~23个碱基序列进行合成,如核酸序列表中seq id no.8所示,同时合成其反向互补的oligo,pcr仪上进行双链oligo的合成及退火磷酸化。使用限制性内切酶bbs i将px330质粒进行酶切,酶切产物进行琼脂糖凝胶电泳,使用gel extraction kit进行切胶回收。使用t4 dna快速连接酶将双链oligo和酶切px330质粒进行连接,连接产物转入dh5α感受态细胞,感受态细胞扩增培养后提取质粒,将鉴定正确的质粒命名为px330-grna。将质粒转染293t细胞,用dna提取试剂盒提取细胞全基因组dna,对grna靶点附近的基因组dna进行扩增,取pcr产物使用t7e1(t7核酸内切酶i)法对扩增产物进行酶切以鉴定敲除效率,结果见图1。由图1可以看出,设计的grna对aavs1具有敲除效果。
64.实施例3donor载体(puc-donor-car)的构建
65.全基因合成嵌合抗原受体cd105 vhh-cd8-cd137-cd3ζ片段(如seq id no.1所示,简称car片段),并将合成的car片段亚克隆至经ecor i/not i双酶切后的表达载体p lvx中。通过测序鉴定为正确克隆后,使用去内毒素plasmid mini kit进行质粒提取,命名为plvx-car(参见图2)。以plvx-car质粒为模板,通过pcr法对目的car片段进行扩增,使用限制性内切酶kpnⅰ/hindⅲ双酶切将载体质粒puc-donor进行双酶切(参见图3)。将酶切产物进行琼脂糖凝胶电泳,然后用gel extraction kit进行切胶回收。使用t4 dna快速连接酶将car片段和酶切puc-donor质粒进行连接。然后将连接产物转入dh5α感受态细胞,感受态细胞扩增培养后提取质粒并通过测序进行检测。将测序正确的质粒命名为puc-donor-car,pcr鉴定电泳图见图4。
66.实施例4:构建表达cd105纳米抗体的嵌合抗原受体修饰t细胞(cd105car-t)
67.(1)利用电穿孔法转染t淋巴细胞:取lonza nucleofector细胞电转试剂盒(瑞士lonza)中的电转液(solution)82μl,supplyment液18μl置于ep管中混匀,得到100μl的混合液。取混合液90μl重悬实施例1步骤(2)制备得到的激活t细胞,得到t细胞重悬液。另取剩下的10μl将puc-donor-car质粒(4μl)和和px330-grna(2μl),最终的质粒总浓度1μg/μl,得到质粒混合液。将质粒混合液和t细胞重悬液混合均匀后转到电转杯中,将电转杯放入4d-nucleofector仪,以100v电压、5ms、1次电容条件下电转染。转染完成后,迅速将预热到37℃的ripm 1640完全培养基加入电转杯中,然后再将电极杯中所有液体吸出,接种到装有预热到37℃的ripm 1640完全培养基的孔板中。于37℃培养4h后,以1000rmp离心5min,吸取上清并弃掉,用含100u/ml的rhil-2的ripm 1640完全培养基再培养48h后,得到cd105 car-t细胞。用荧光显微镜观察到gfp的表达,结果参见图5。
68.(2)利用流式细胞术检测嵌合抗原受体cd105 car在t细胞中的表达
69.分别收集1
×
106电转后的cd105 car-t细胞和未含胞外识别受体的car-t细胞(mock),加pe-anti his tag antibody(pe-抗his标签抗体)避光孵育。然后用pbs清洗,再利用流式细胞仪进行检测。结果表明,嵌合抗原受体在t细胞中表达(参见图6)。
70.实施例5:cd105 car-t对人肿瘤细胞杀伤作用的细胞毒性分析
71.用pkh26细胞膜染料对肝癌细胞bel7404、hepg2、smcc7721、mhcc97h进行染色,再分别取实施例4中制备得到的ca105 car-t细胞和实施例1步骤(2)中培养得到的激活t细胞,在24孔板中加5
×
105个效应t淋巴细胞,按分别为1:3、1:1、3:1的效靶比(e:t),在24孔板中加入靶细胞。使用ripm 1640完全培养基在37℃培养16小时后,收集效应t淋巴细胞和靶细胞,加入pi染液,在4℃避光孵育30min。在高速离心机以1200rpm离心6min,去上清,加入500μl的pbs重悬细胞。pkh26
+
pi
+
即为死亡细胞,流式细胞仪检测pkh26
+
pi
+
细胞的比例,按如下公式计算car t细胞对不同细胞的杀伤率:杀伤率=100%
×
(实验孔凋亡率-自然释放孔凋亡率)/(100-自然释放孔凋亡率)。自然释放孔为未加效应细胞的靶细胞,结果见图7。如图7所示,cd105 car-t细胞对高表达cd105的肿瘤细胞具有显著的特异性杀伤活性。
72.实施例中涉及到的序列如下:
73.(1)cd105 vhh-cd8-cd137-cd3ζ核苷酸序列(seq id no.1)
[0074][0075][0076]
(2)sig序列(seq id no.2):
[0077]
gccttacccgtgaccgccttgctcctgccgctggccttgctgctccacgccgccaggccgagc
[0078]
(3)cd105nb 184(seq id no.3):
[0079]
caggtgcagctgcaggagtctgggggaggctcggtgcaggctggagggtctctgagactctcctgtgtagcgtctggatacacagtcagtaggggctacatgggctggttccgccaggctccagggaaggagcgcgaggctgtcgcagctattcgtactggtagtggtagcacatactatgccgactccgtgaagggccgattcaccatctcccaagacaatgccaagaacacggtgtatctgcaaatgaacagcctgaaacacgaggacactggcatgtactactgtgcggcatctctttggtacggtggtaactggcaatcctgggggtcgtataactactggggccaggggacccaggtcaccgtctcctca
[0080]
(4)cd8 hinge(铰链区)序列(seq id no.4):
[0081]
gag tcc aaa tat ggt ccc cca tgc cca cca tgc cca
[0082]
(5)cd8 tm序列(seq id no.5):
[0083]
ttttgggtgctggtggtggttggtggagtcctggcttgctatagcttgctagtaacagtggcctttattattttctgggtg
[0084]
(6)cd137序列(seq id no.6):
[0085]
aaacggggcagaaagaaactcctgtatatattcaaacaaccatttatgagaccagtacaaactactcaagaggaagatggctgtagctgccgatttccagaagaagaagaaggaggatgtgaactg
[0086]
(7)cd3ζ序列(seq id no.7):
[0087]
agagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgcagagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgc
[0088]
(8)aavs1 grna序列(seq id no.8):
[0089]
caccgacagaaaagccccatcctt
[0090]
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的主旨。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1