一种制备1′,4′-反式-ABA-二醇的发酵方法
本发明涉及微生物药物生物
技术领域:
,具体涉及1′,4′-反式-aba-二醇的发酵制备方法。
背景技术:
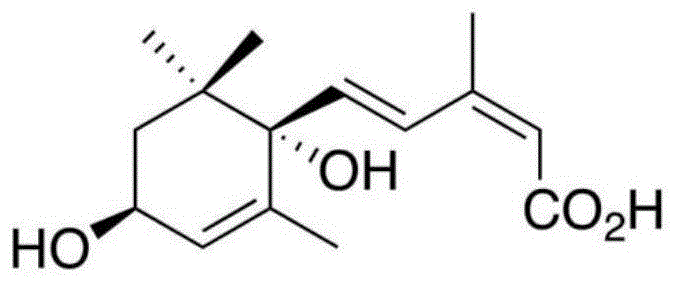
:1′,4′-反式-aba-二醇是真菌脱落酸(abscisicacid,aba)合成途径中的一种aba的前体类似物,其化学式是c15h22o4。其化学结构见附图1。1967年cornfor等曾报道过用化学合成1′,4′-反式-aba-二醇酯的方法,1972年walton等用cornfor报道的方法合成了1′,4′-反式-aba-二醇,并测试了其对菜豆离体胚轴的生长抑制效果,结果发现具有明显的生长抑制作用。1986年hirai等从1.1l灰葡萄孢霉菌(botrytiscinerea)培养基中分离到了6.0mgaba和1′,4′-反式-aba-二醇的混合物,发现1′,4′-反式-aba-二醇在b.cinerea体内可以转化为aba,因此认为它是aba的前体。1987年okamoto和vaughan等均在豌豆和鳄梨中发现了1′,4′-反式-aba-二醇,也能在体内转化为aba。1988年okamoto等通过2h标记实验发现赤松尾孢霉(cercosporapini-densiflorae)中1′,4′-反式-aba-二醇可以合成aba。而1989年christopher等从氧标记的苹果果实中分离到aba-醛和1′,4′-反式-aba-二醇,认为1′,4′-反式-aba-二醇可能是aba的代谢产物。1995年kettner等也发现灰葡萄孢霉菌(b.cinerea)bc6可以通过1′,4′-反式-aba-二醇合成aba。2004年inomata也通过18o标记实验证实了1′,4′-反式-aba-二醇是灰葡萄孢霉菌(b.cinerea)aba的合成前体。2006年王天山等也从灰葡萄孢霉菌(b.cinerea)中分离出1′,4′-反式-aba-二醇的无色晶体,并通过x射线衍射分析确定了其单晶结构,本实验室将其作为农药的名称自命名为芷香二醇。由于aba在植物生长调节中的重要作用,因此科学家也推测1′,4′-反式-aba-二醇作为其前体类似物,可能也具有植物生长调节的功能。1972年,walton等使用化学合成的14c标记的1′,4′-顺式-aba-二醇和1′,4′-反式-aba-二醇测试对菜豆离体胚轴的生长抑制效果:发现这两种物质均对菜豆离体胚轴的生长具有抑制作用,但效果稍低于aba,推测这两种物质的生长抑制活性可能与其转化为aba有关。2005年asami等研究发现1′,4′-反式-aba二醇的4′-甲氧基衍生物在水芹种子萌发和ga诱导的α-淀粉酶诱导试验中表现出与aba相当水平的抑制活性,同时由于其结构特点使其不容易像aba一样分解成红花菜豆酸类的物质而失活,因此具有成为植物生长调节剂的潜力。2005年,王天山等研究了灰葡萄孢霉菌(b.cinerea)中1′,4′-反式-aba二醇对稻谷种子的抑制活性,检测了其胚芽长抑制率、根长抑制率和根数抑制率,发现当浓度为0.5-5.0mg/l时,1′,4′-反式-aba二醇具有明显的抑制种子萌发效果,,随着1′,4′-反式-aba二醇浓度的增加,其抑制率也随之增强。虽然1′,4′-反式-aba二醇具有成为植物生长调节剂的潜力,但其合成方法十分有限,可将aba通过重氮甲烷处理将其转化为脱落酸甲酯,再通过nabh4依次还原合成,这种化学方法要通过aba作为前体,且操作复杂。而文献报道的从灰葡萄孢霉菌(b.cinerea)菌体或者植物中提取的1′,4′-反式-aba二醇含量很低,例如1995年kettner等报道灰葡萄孢霉菌(b.cinerea)bc6在合成aba的同时伴随有1′,4′-反式-aba二醇的合成,1′,4′-反式-aba二醇最高含量不超过100μg/gdw菌体,同时灰葡萄孢霉菌(b.cinerea)bc6浸染的植物叶片中1′,4′-反式-aba二醇含量大约4μg/gdw。以这样的产量来说要通过化学合成或生物中提取的方法实现1′,4′-反式-aba二醇的低成本规模化生产有很大困难,因此也限制了1′,4′-反式-aba二醇的农业应用与机理研究。本实验室长期从事灰葡萄孢霉菌(b.cinerea)代谢产物、发酵工艺技术研究。前期得到一株灰葡萄孢霉菌(b.cinerea)tbc-10,已于2006年12月15日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏号为cgmccno.1889。我们对该灰葡萄孢霉菌(b.cinerea)tbc-10进行遗传改良,获得了高产1′,4′-反式-aba二醇的菌株,并研究了该菌株发酵生产工艺;通过该发酵生产工艺,可以获得较高产量的1′,4′-反式-aba二醇,实现1′,4′-反式-aba二醇的低成本规模化生产;并获得了1′,4′-反式-aba-二醇作为植物生长调节剂和植物抗逆诱导剂的应用方法。从而完成了本发明。技术实现要素:针对现有技术的不足,本发明的目的之一,是提供一种用于生产1′,4′-反式-aba-二醇(1′,4′-trans-diol-aba)的新菌株;本发明的目的之二,是提供一种“批次液体培养基流加补料发酵工艺”,发酵生产1′,4′-反式-aba-二醇;本发明的目的之三,是提供用于生产1′,4′-反式-aba-二醇的培养基。本发明的目的之四,是提供1′,4′-反式-aba-二醇作为植物生长调节剂和抗逆诱导剂的应用方法。更具体地说,是提供一种制备1′,4′-反式-aba二醇的发酵方法,可大大提高合成1′,4′-反式-aba二醇的效率,降低成本。包含以下步骤:将能够产生1′,4′-反式-aba-二醇的丝状真菌,例如:孢霉菌属(botryotinia)的灰葡萄孢霉菌(b.cinerea),尾孢霉属(cercospora)的赤松尾孢霉菌(c.pini-densiflorae),或其它产生1′,4′-反式-aba-二醇的真菌及其遗传改良菌株,在一级液体培养基(例如,下文所述的培养基a)中培养,作为种子液;将种子液接种到第二级液体培养基(例如,下文所述的培养基b)中培养;第二级液体培养基接种第一级种子液后培养一段合适的时间,开始进行流加补料液(例如,下文所述的补料液c)的补料发酵培养。发酵结束后,从上述发酵培养液中收集1′,4′-反式-aba-二醇,并进行提取和纯化。本发明的具体实施方案是,采用已知的能够产生1′,4′-反式-aba-二醇的丝状真菌,如:孢霉菌属(botryotinia)的灰葡萄孢霉菌(b.cinerea),尾孢霉属(cercospora)的赤松尾孢霉菌(c.pini-densiflorae),或其它产生1′,4′-反式-aba-二醇的真菌及其遗传改良菌株,如灰葡萄孢霉菌(b.cinerea)的遗传改良菌株等,在液体培养基中进行二级发酵培养,在每级发酵阶段选用不同的培养基,例如下文所述的培养基a、b。在第二级发酵中,接种第一级种子液后,在适合的温度下培养一段时间,例如,在23-26℃发酵培养12-72小时后,选用合适的补料液,例如下文所述的补料液c,进行流加补料发酵培养。第二级液体培养流加补料(例如补料液c)的方式可以采用连续(匀速或非匀速)流加和/或间歇式流加方式,连续流加方式是优选的。所述的连续(匀速或非匀速)流加方式,是以一定的流加速率,如0.01-10.0l/h,(匀速或非匀速)将适合的补料液(例如补料液c)连续流加入第二级发酵罐中,直至停止发酵(下罐)前大约10-48小时。所述的间歇式流加方式,是以间隔一段时间加一次料的方式,间歇式将适合的补料液(例如补料液c)流加入第二级发酵罐中。间歇时间为每1-24小时补料1-8次,优选为间隔5-8小时补料1次,每次补料量为发酵液总体积的0.01-2.0%,优选0.05-0.5%。本领域技术人员也可以根据需要,采用其他的适合时间间隔补料。发酵条件:温度23-26℃,ph:4-8。发酵时间:5-10天。发酵结束后,发酵液采用离心或者微滤除去菌丝等固体物得到发酵清液,发酵清液上大孔吸附树脂柱,进行吸附、解析;收集解析液,减压浓缩得到1′,4′-反式-aba-二醇粗品;再经硅胶柱层析分离,以及结晶、重结晶纯化,得到1′,4′-反式-aba-二醇结晶产物。采用本发明工艺,在第二级发酵时,通过流加补料液发酵,可以为菌体持续提供合成1′,4′-反式-aba-二醇需要的碳源、氮源,维持发酵工艺需求的较好的碳氮比,提高发酵体系中细胞浓度和产物合成效率,从而提高1′,4′-反式-aba-二醇的产量。在优选的具体实施方案中,本发明还采用例如新的遗传改良菌株等技术方案来进一步提高1′,4′-反式-aba-二醇的产量。在优选的本发明方法中,本发明特别提供一株灰葡萄孢霉菌(b.cinerea)的遗传改良菌株灰葡萄孢霉菌(b.cinerea)zx2用于发酵制备1′,4′-反式-aba-二醇;其已于2019年04月29日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏号为cgmccno.17678。地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所。本发明发酵所采用的培养基a、b及补料液c的具体组成质量百分比如下:培养基a:葡萄糖0.1-5.0%,牛肉膏0.1-1.0%,蔗糖0.1-5.0%,乳糖0.1-2.0%,kh2po40.01-0.5%,mgso40.01-0.2%,蛋白胨0.1-5.0%。培养基b:补料液c:成分一般范围优选范围葡萄糖0.1-6.0%0.2-2.0%蛋白胨0.1-5.0%0.5-2.0%mgso40.001-1.0%0.005-0.1%nacl0.001-1.0%0.005-0.5%本发明优选实施方案的发酵工艺全过程为:将活化后的灰葡萄孢霉菌(b.cinerea)zx2菌种/孢子液接种于灭菌培养基a中,装于三角瓶内23-26℃摇瓶培养20-50小时后,以1-25%的接种量接种于已加有灭菌培养基b的发酵罐中进行发酵生产。菌种接种于发酵罐后于23-26℃,发酵培养12-72小时后,开始补料液c的流加补料。补料液c流加补料方式有两种,一种是连续(匀速或非匀速)流加,一种是间歇式流加,连续流加方式是优选的。采用连续流加方式时,以0.01-10.0l/h的速度连续(匀速或非匀速)流加补料液c,直至停止发酵(下罐)前约10-48小时。采用间歇式流加方式时,间歇时间可为每1-24小时补料1-8次,优选为大约间隔5-8小时补料1次,每次补料量为发酵液总体积的0.01-2.0%,优选0.05-0.5%。发酵条件:温度23-26℃,ph:4-8。发酵时间:5-10天。发酵结束后,发酵液采用离心或者微滤技术过滤除去菌丝等固体物得到发酵清液,发酵清液上大孔吸附树脂柱,进行吸附、解析;收集解析液,减压浓缩得到1′,4′-反式-aba-二醇粗品;再经硅胶柱层析分离,以及结晶、重结晶纯化,得到1′,4′-反式-aba-二醇结晶产物。本发明的全工艺流程见附图2。采用本发明工艺,菌株以较高的底物转化率和产物合成速率生产1′,4′-反式-aba-二醇;采用高效液相色谱法检测1′,4′-反式-aba-二醇含量〔检测条件:色谱柱为agilentzorbaxecilpsec185um250×4.6mm;检测器为紫外vwd检测器;检测波长254nm;进样量5μl;流动相为a水,b甲醇;流速:0.8ml/min〕,其产量可达0.6g/l。本发明还提供了1′,4′-反式-aba-二醇作为植物生长调节剂和抗逆诱导剂的应用方法。具体为:(1)用1′,4′-反式-aba-二醇处理植物种子,可以提高种子发芽率和生长素质,提高苗期的抗旱、抗寒、抗病和抗盐碱等综合抗逆能力;有效应用浓度范围为0.1-10.0ppm;可以采用浸种、或拌种、或作为种子包衣剂成分等处理方式,根据不同作物种类所用浓度可以不同。如水稻种子用0.1-0.5ppm的1′,4′-反式-aba-二醇浸种或拌种处理后,发芽率提高3-10%,促进秧苗根系发达,并可提高产量。(2)在植物苗期,外源施用1′,4′-反式-aba-二醇可以起到大幅提高植物生长素质和抗逆性的作用。一般情况下,从植物3叶期起即可采用叶面喷施的方式施用1′,4′-反式-aba-二醇,喷施的浓度一般在0.1-20.0ppm。如,在番茄等蔬菜作物、烟草等经济作物上应用时,在苗期,喷施浓度为1.0-20.0ppm的1′,4′-反式-aba-二醇2-5次,或用浓度为0.1-5.0ppm的1′,4′-反式-aba-二醇灌根,能显著增强作物整个生育期对低温、干旱、水涝、病害等逆境的抗性,促进生根及根系对水肥的吸收利用,调节花期,提高产量和品质。本发明具有以下优点:1.本发明采用遗传改良菌株灰葡萄孢霉(b.cinerea)zx2,其底物转化率和产物合成速率较高,1′,4′-反式-aba-二醇的产量可达0.6g/l。2.采用本发明发酵培养基及液体培养基流加补料发酵工艺,可以维持菌株生长和合成产物需求的较好的碳氮比,实现较高的1′,4′-反式-aba-二醇的产量。3,提取工艺流程简单,回收率高,操作方便。4.提供了1′,4′-反式-aba-二醇作为植物生长调节剂和抗逆诱导剂的应用方法。附图说明图1是1′,4′-反式-aba-二醇化学结构图。图2是本发明1′,4′-反式-aba-二醇的发酵生产工艺流程图。具体实施方式下面结合附图,对本发明的技术方案作进一步的描述。实施例一用1000ml三角瓶10个,每瓶装250ml培养基a(葡萄糖1.0%,牛肉膏0.5%,蔗糖1.0%,乳糖0.5%,kh2po40.05%,mgso40.02%,蛋白胨1.5%),于120℃灭菌30分钟,冷却后接种活化后的灰葡萄孢霉菌(b.cinerea)zx2孢子液,于25℃摇瓶培养48小时。将培养好的菌种液按5%的接种量接种于内装50l灭菌培养基b的100l发酵罐中(培养基b:葡萄糖0.5%,蔗糖0.2%,乳糖0.2%,麦麸4.0%,豆饼粉0.5%,玉米粉0.2%,酵母粉0.2%,kh2po40.05%,mgso40.01%,nacl0.05%,消泡剂0.01%),进行发酵生产。菌种接种于发酵罐,于23-26℃发酵培养72小时后,开始进行以0.05l/h的速度连续流加补料液c的流加补料(补料液c:葡萄糖0.5%,蛋白胨0.5%,mgso40.01%,nacl0.02%),直至停止发酵(下罐)前约16小时。发酵ph4-8,发酵周期8天。发酵结束后,发酵液采用离心或者微滤除去菌丝等固体物得到发酵清液,发酵清液上大孔吸附树脂柱,进行吸附、解析;收集解析液,减压浓缩得到1′,4′-反式-aba-二醇粗品;再经硅胶柱层析分离,以及结晶、重结晶纯化,得到1′,4′-反式-aba-二醇结晶产物。采用高效液相色谱法检测1′,4′-反式-aba-二醇含量〔检测条件:色谱柱为agilentzorbaxecilpsec185um250×4.6mm;检测器为紫外vwd检测器;检测波长254nm;进样量5μl;流动相为a水,b甲醇;流速:0.8ml/min〕,1′,4′-反式-aba-二醇产量可达0.6g/l。实施例二用1000ml三角瓶10个,每瓶装250ml培养基a(葡萄糖0.5%,牛肉膏0.5%,蔗糖0.5%,乳糖0.4%,kh2po40.05%,mgso40.02%,蛋白胨0.5%),于120℃灭菌30分钟,冷却后接种活化后的灰葡萄孢霉菌(b.cinerea)zx2孢子液,于25℃摇瓶培养48小时。将培养好的菌种液按5%的接种量接种于内装50l灭菌培养基b的100l发酵罐中(培养基b:葡萄糖0.5%,蔗糖0.2%,乳糖0.2%,麦麸2.0%,豆饼粉0.5%,玉米粉0.5%,酵母粉0.2%,kh2po40.05%,mgso40.01%,nacl0.02%,消泡剂0.01%),进行发酵生产。菌种接种于发酵罐后于23-26℃,发酵培养48小时后,采用间歇式流加方式流加补料液c的流加补料(补料液c:葡萄糖0.4%,蛋白胨0.5%,mgso40.01%,nacl0.01%),采用间歇式流加方式,间歇时间为每5小时补料1次,每次补料量为发酵液总体积的0.25%,直至停止发酵(下罐)前约24小时停止补料。发酵ph4-8,发酵周期8天。发酵结束后,发酵液采用离心或者微滤除去菌丝等固体物得到发酵清液,发酵清液上大孔吸附树脂柱,进行吸附、解析;收集解析液,减压浓缩得到1′,4′-反式-aba-二醇粗品;再经硅胶柱层析分离,以及结晶、重结晶纯化,得到1′,4′-反式-aba-二醇结晶产物。采用高效液相色谱法检测1′,4′-反式-aba-二醇含量〔检测条件:色谱柱为agilentzorbaxecilpsec185um250×4.6mm;检测器为紫外vwd检测器;检测波长254nm;进样量5μl;流动相为a水,b甲醇;流速:0.8ml/min〕,1′,4′-反式-aba-二醇产量可达0.5g/l。实施例三用1000ml三角瓶10个,每瓶装250ml培养基a(葡萄糖1.0%,牛肉膏1.0%,蔗糖0.5%,乳糖1.0%,kh2po40.06%,mgso40.02%,蛋白胨0.6%),于120℃灭菌30分钟,冷却后接种活化后的灰葡萄孢霉菌(b.cinerea)zx2孢子液,于25℃摇瓶培养48小时。将培养好的菌种液按5%的接种量接种于内装50l灭菌培养基b的100l发酵罐中(培养基b:葡萄糖0.2%,蔗糖0.3%,乳糖0.2%,麦麸5.0%,豆饼粉1.0%,玉米粉0.2%,酵母粉0.5%,kh2po40.02%,mgso40.01%,nacl0.05%,消泡剂0.02%),进行发酵生产。菌种接种于发酵罐后于23-26℃,发酵培养48小时后,开始进行以0.05l/h的速度连续流加补料液c的流加补料(补料液c:葡萄糖0.5%,蛋白胨0.5%,mgso40.01%,nacl0.01%),直至停止发酵(下罐)前约10小时。发酵ph4-8,发酵周期6天。发酵结束后,发酵液采用离心或者微滤除去菌丝等固体物得到发酵清液,发酵清液上大孔吸附树脂柱,进行吸附、解析;收集解析液,减压浓缩得到1′,4′-反式-aba-二醇粗品;再经硅胶柱层析分离,以及结晶、重结晶纯化,得到1′,4′-反式-aba-二醇结晶产物。采用高效液相色谱法检测1′,4′-反式-aba-二醇含量〔检测条件:色谱柱为agilentzorbaxecilpsec185um250×4.6mm;检测器为紫外vwd检测器;检测波长254nm;进样量5μl;流动相为a水,b甲醇;流速:0.8ml/min〕,1′,4′-反式-aba-二醇产量可达0.4g/l。实施例四用1000ml三角瓶10个,每瓶装250ml培养基a(葡萄糖0.6%,牛肉膏0.5%,蔗糖0.5%,乳糖0.4%,kh2po40.05%,mgso40.02%,蛋白胨0.6%),于120℃灭菌30分钟,冷却后接种活化后的灰葡萄孢霉菌(b.cinerea)tbc-10孢子液,于25℃摇瓶培养48小时。将培养好的菌种液按5%的接种量接种于内装50l灭菌培养基b的100l发酵罐中(培养基b:葡萄糖0.5%,蔗糖0.2%,乳糖0.2%,麦麸1.0%,豆饼粉0.5%,玉米粉0.1%,酵母粉0.2%,kh2po40.05%,mgso40.01%,nacl0.01%,消泡剂0.01%),进行发酵生产。菌种接种于发酵罐后于23-26℃,发酵培养48小时后,开始进行以0.08l/h的速度连续流加补料液c的流加补料(补料液c:葡萄糖0.6%,蛋白胨1.0%,mgso40.01%,nacl0.02%),直至停止发酵(下罐)前约16小时。发酵ph4-8,发酵周期6天。发酵结束后,发酵液采用离心或者微滤除去菌丝等固体物得到发酵清液,发酵清液上大孔吸附树脂柱,进行吸附、解析;收集解析液,减压浓缩得到1′,4′-反式-aba-二醇粗品;再经硅胶柱层析分离,以及结晶、重结晶纯化,得到1′,4′-反式-aba-二醇结晶产物。采用高效液相色谱法检测1′,4′-反式-aba-二醇含量〔检测条件:色谱柱为agilentzorbaxecilpsec185um250×4.6mm;检测器为紫外vwd检测器;检测波长254nm;进样量5μl;流动相为a水,b甲醇;流速:0.8ml/min〕,1′,4′-反式-aba-二醇产量可达0.02g/l。实施例五用1′,4′-反式-aba-二醇浸种,提高发芽率,促进水稻幼苗的根系生长。具体做法:将水稻宜香优2115种子表面消毒后,用0.5ppm1′,4′-反式-aba-二醇水溶液常温浸种处理24h,温室(26℃,16h光照/8h暗培养)催芽,3天后计算发芽率,并选取发芽的种子置于种子培养袋中,清水培养:两周后取出,统计根长,根面积等指标,结果发现其对水稻幼苗的根系生长有一定促进作用,如下表。以清水、s-诱抗素(aba)为对照处理。实施例六烤烟苗移栽期喷施1′,4′-反式-aba-二醇,对烟草花叶病毒病、枯斑病的发生具有较好的诱抗效果,烟草花叶病毒病发病率减少10-30%,烟叶产量提高5-15%。以清水、s-诱抗素(aba,市售,纯度90%)为对照处理。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1