一种靶向BCMA的嵌合抗原受体T细胞及其应用的制作方法
一种靶向bcma的嵌合抗原受体t细胞及其应用
技术领域
[0001]
本发明属于生物医药技术领域,涉及一种靶向bcma的嵌合抗原受体t细胞及其应用。
背景技术:
[0002]
嵌合抗原受体(chimeric antigen receptor,car)是靶向细胞表面抗原的重组受体,其结构主要包括胞外抗原结合区、跨膜区和胞内信号区三部分。其中,胞外抗原结合区负责识别抗原,跨膜区连接胞外抗原结合区和胞内信号区,影响导入car基因的表达能力,胞内信号区负责传导信号。
[0003]
嵌合抗原受体t细胞(chimeric antigen receptor t cell,car-t)利用car分子识别并结合肿瘤抗原,从而发挥t细胞对肿瘤细胞的特异性杀伤作用,目前已发展成为成熟的肿瘤免疫治疗方法,并在治疗恶性血液肿瘤方面取得了令人瞩目的成绩。
[0004]
b细胞成熟抗原(b cell maturation antigen,bcma)表达于成熟的b细胞和浆细胞上,是多发性骨髓瘤(mm)诊断和预后的生物标志物。研究发现,bcma在多发性骨髓瘤的不同阶段的表达水平相似,表明bcma可能在整个多发性骨髓瘤过程中都是有效的治疗靶点。现有技术采用bcma抗原作为胞外抗原结合区构建car分子,用于治疗多发性骨髓瘤等b细胞相关疾病,但是存在容易引发细胞因子风暴等问题。
[0005]
因此,有必要进一步优化靶向bcma的car分子结构,应用于多发性骨髓瘤治疗领域。
技术实现要素:
[0006]
针对现有技术的不足和实际需求,本发明提供了一种靶向bcma的嵌合抗原受体t细胞及其应用,所述嵌合抗原受体t细胞免疫原性低,治疗效果佳。
[0007]
为达此目的,本发明采用以下技术方案:
[0008]
第一方面,本发明提供了一种靶向bcma的嵌合抗原受体t细胞,所述嵌合抗原受体包括信号肽、抗原结合结构域、跨膜结构域和信号转导结构域;
[0009]
所述抗原结合结构域包括抗bcma单链抗体;
[0010]
所述信号转导结构域包括4-1bb、cd3ζ和tlr2。
[0011]
本发明中,将toll样受体2(tlr2)连接在4-1bb和cd3ζ的c端作为信号转导结构域,配合抗bcma单链抗体,构建的嵌合抗原受体高效靶向bcma抗原,表达所述嵌合抗原受体的t细胞对bcma阳性肿瘤具有特异性杀伤作用,杀伤作用明显,杀伤效率高。
[0012]
优选地,所述信号肽包括gm-csf信号肽。
[0013]
优选地,所述跨膜结构域包括cd28和/或cd8α,优选为cd8α。
[0014]
优选地,所述嵌合抗原受体由gm-csf信号肽、抗bcma单链抗体、cd8α、4-1bb、cd3ζ和tlr2串联组成。
[0015]
优选地,所述嵌合抗原受体包括seq id no:1所示的氨基酸序列;
[0016]
seq id no:1:
[0017]
mlllvtslllcelphpaflldivltqspaslavslgeratincrasesvsvigahlihwyqqkpgqppklliylasnletgvparfsgsgsgtdftltisslqaedaaiyyclqsrifprtfgqgtkleikgstsgsgkpgsgegstkgqvqlvqsgselkkpgasvkvsckasgytftdysinwvrqapgqglewmgwintetrepayaydfrgrfvfsldtsvstaylqisslkaedtavyycardysyamdywgqgtlvtvsstttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprqakrkprkapsrnicydafvsyserdaywvenlmvqelenfnppfklclhkrdfipgkwiidniidsiekshktvfvlsenfvksewckyeldfshfrlfdenndaailillepiekkaipqrfcklrkimntktylewpmdeaqregfwvnlraaiks。
[0018]
第二方面,本发明提供了一种核酸分子,所述核酸分子包括gm-csf信号肽编码基因、抗bcma单链抗体编码基因、cd8α编码基因、4-1bb编码基因、cd3ζ编码基因和tlr2编码基因。
[0019]
优选地,所述核酸分子包括seq id no:2所示的核酸序列;
[0020]
seq id no:2:
[0021]
atgcttctcctggtgacaagccttctgctctgtgagttaccacacccagcattcctcctggacatcgtcctgacccagtcacctgccagcctggccgtcagcctgggcgagagagccaccattaattgccgcgctagcgaatcagtgtcagtcatcggcgctcacctgatccactggtatcagcaaaagcctgggcagccaccaaagctgctcatctatctcgcctccaacctggagacaggcgtgcctgctcgctttagtggttctggtagcggcaccgatttcaccctgactatttcaagcctgcaggcagaggacgcagccatatactattgcctgcagtcccggattttccctcgcacattcggccagggcacaaaactggaaatcaaaggatctacctccggctccgggaagcccggaagcggcgaaggctcaaccaaaggccaggttcagctcgtgcagtctggttctgaactgaagaaacccggtgcatctgtgaaagtctcctgcaaggcttccgggtatactttcacagactacagtattaattgggttcgccaagctcctggacagggactggagtggatgggatggataaacacagaaactagggagcctgcatacgcctatgatttcagaggtcgcttcgtgttcagtctggatacaagtgtttcaacagcctatctgcaaattagctccctgaaagccgaggacaccgcagtttactactgtgcacgggattattcttacgctatggactattgggggcagggcacactcgtgacagtgtctagcaccacgacgccagcgccgcgaccaccaacaccggcgcccaccatcgcgtcgcagcccctgtccctgcgcccagaggcgtgccggccagcggcggggggcgcagtgcacacgagggggctggacttcgcctgtgatatctacatctgggcgcccttggccgggacttgtggggtccttctcctgtcactggttatcaccctttactgcaaacggggcagaaagaaactcctgtatatattcaaacaaccatttatgagaccagtacaaactactcaagaggaagatggctgtagctgccgatttccagaagaagaagaaggaggatgtgaactgagagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgccaggccaaaaggaagcccaggaaagctcccagcaggaacatctgctatgatgcatttgtttcttacagtgagcgggatgcctactgggtggagaaccttatggtccaggagctggagaacttcaatccccccttcaagttgtgtcttcataagcgggacttcattcctggcaagtggatcattgacaatatcattgactccattgaaaagagccacaaaactgtctttgtgctttctgaaaactttgtgaagagtgagtggtgcaagtatgaactggacttctcccatttccgtctttttgatgagaacaatgatgctgccattctcattcttctggagcccattgaga
aaaaagccattccccagcgcttctgcaagctgcggaagataatgaacaccaagacctacctggagtggcccatggacgaggctcagcgggaaggattttgggtaaatctgagagctgcgataaagtcc。
[0022]
第三方面,本发明提供了一种表达载体,所述表达载体为含有第二方面所述的核酸分子的病毒载体。
[0023]
优选地,所述病毒载体包括慢病毒载体、逆转录病毒载体或腺相关病毒载体中的任意一种,优选为慢病毒载体。
[0024]
第四方面,本发明提供了一种重组慢病毒,所述重组慢病毒采用第三方面所述的表达载体与包装辅助质粒共转染哺乳细胞制备得到。
[0025]
第五方面,本发明提供了一种第一方面所述的嵌合抗原受体t细胞的制备方法,所述方法包括将第四方面所述的重组慢病毒导入t细胞的步骤。
[0026]
第六方面,本发明提供了一种药物组合物,所述药物组合物包括第一方面所述的嵌合抗原受体t细胞。
[0027]
优选地,所述药物组合物还包括药学上可接受的载体、赋形剂或稀释剂中的任意一种或至少两种的组合。
[0028]
第七方面,本发明提供了第一方面所述的嵌合抗原受体t细胞、第二方面所述的核酸分子、第三方面所述的表达载体、第四方面所述的重组慢病毒或第六方面所述的药物组合物在制备b细胞恶性肿瘤治疗药物中的应用。
[0029]
与现有技术相比,本发明具有如下有益效果:
[0030]
(1)本发明采用串联的4-1bb、cd3ζ和tlr2作为嵌合抗原受体的信号转导结构域,配合特异性抗原结合结构域抗bcma单链抗体,构建的嵌合抗原受体t细胞具有显著增强的特异性识别肿瘤抗原的能力,更显著提高了t细胞的抗肿瘤能力;
[0031]
(2)本发明的嵌合抗原受体t细胞免疫原性低、安全性高、副反应的发生几率低,在b细胞恶性肿瘤治疗领域具有良好的临床应用前景。
附图说明
[0032]
图1为嵌合抗原受体结构示意图;
[0033]
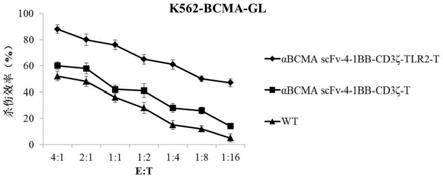
图2为不同car-t细胞对肿瘤细胞k562-bcma-gl在不同e:t比例下的杀伤效率;
[0034]
图3为不同car-t细胞与检测细胞共培养后ifn-γ的分泌情况。
具体实施方式
[0035]
为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
[0036]
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
[0037]
实施例1car载体的制备
[0038]
本实施例构建的靶向bcma的嵌合抗原受体的结构示意图如图1所示,氨基酸序列如seq id no:1所示,编码基因如seq id no:2所示;
[0039]
在上述编码基因的c端和n端分别添加限制性内切酶pme1酶切位点及其保护碱基和限制性内切酶spe1酶切位点及其保护碱基;
[0040]
利用限制性内切酶pme1和spe1对编码基因进行双酶切,琼脂凝胶电泳回收获得含有粘性末端的酶切产物,连接入同样经pme1和spe1双酶切的线性化pwpxld-egfp质粒(含粘性末端)中,连接反应在t4 dna聚合酶(invitrogent公司)的参与下进行,得到含有αbcma scfv-4-1bb-cd3ζ-tlr2的编码基因的慢病毒载体。
[0041]
本实施例同时构建含有αbcma scfv-4-1bb-cd3ζ的编码基因的慢病毒载体。
[0042]
实施例2重组慢病毒包装
[0043]
本实施例采用293t细胞制备重组慢病毒,当293t细胞铺100mm培养皿板底达80~90%时,进行慢病毒包装:
[0044]
病毒包装前2h,更换培养基为含1%胎牛血清的dmem,加入量为6ml/100mm培养皿;
[0045]
配制如表1所示的质粒混合液,pwpxld-表达质粒为表达car分子的慢病毒载体,pwpxld-egfp质粒为不含有car分子编码基因的空载体;
[0046]
表1
[0047][0048]
将36μg pei加至另一500μl opti-mem培养基内,混匀,室温静置5min;
[0049]
将表1所示的质粒混合液与pei混合,吹打混匀,室温静置25~30min;
[0050]
将上述混合液逐滴加至培养在100mm培养皿中的293t细胞上;
[0051]
培养6h后,更换培养基为含1%胎牛血清的dmem,加入量为7ml/100mm培养皿;
[0052]
包装后24h、48h和72h,收取病毒上清,同时向293t细胞补加培养基,加入量为7ml/100mm培养皿;
[0053]
1000g离心10min,0.45μm滤器过滤,得到表达car的重组慢病毒,4℃保存待用。
[0054]
实施例3t细胞激活和慢病毒转染
[0055]
采用ficoll密度梯度离心试剂盒(ge公司)从全血中分离外周血单个核细胞(pbmc),去除红细胞后,再利用macs pan-t磁珠分选出t细胞;
[0056]
分选出来的t细胞采用培养基(aim-v培养基+5%fbs+青霉素100u/ml+链霉素0.1mg/ml)稀释至细胞浓度为2.5
×
10
6
个/ml待用;
[0057]
采用cd2/cd3/cd28 t细胞激活扩增试剂盒(美天旎公司)激活t细胞,即包被磁珠与t细胞以1:2比例混合,t细胞最终密度为5
×
10
6
个/ml/cm
2
,混合后,置于37℃、5%co
2
培养箱培养刺激48h;
[0058]
t细胞激活48h后,去磁珠,300g离心5min,去上清,用新鲜培养基重悬t细胞,分别
加入表达car的重组慢病毒或空白对照慢病毒(moi=10),并加入8μg/ml polybrene和300iu/ml il-2,置于37℃、5%co
2
培养箱培养;
[0059]
24h后,300g离心5min,去上清,用含300iu/ml il-2的新鲜培养基重悬t细胞,即得car-t细胞;
[0060]
将car-t细胞密度维持在1
×
10
6
个/ml左右,每2~3天进行一次半量换液,两周后,car-t细胞数扩增了100倍。
[0061]
本实施例构建的car-t细胞包括αbcma scfv-4-1bb-cd3ζ-tlr2-t和αbcma scfv-4-1bb-cd3ζ-t,同时设置wt对照组(转染空白对照慢病毒)。
[0062]
实施例4体外检测car-t细胞对肿瘤细胞k562-bcma-gl的杀伤功能
[0063]
将实施例3制备的wt、αbcma scfv-4-1bb-cd3ζ-tlr2-t和αbcma scfv-4-1bb-cd3ζ-t分别与1
×
10
4
个肿瘤细胞k562-bcma-gl按e:t为4:1、2:1、1:1、1:2、1:4、1:8、1:16的比例混合,加入到96孔板中,每组设置3个复孔,250g离心5min后,置于37℃、5%co
2
培养箱共培养18h;
[0064]
18h后,向96孔板中加入100μl/孔的荧光素酶底物(1
×
),将细胞重悬混匀,立即通过多功能酶标仪测定rlu(relative light unit),测定时间为1秒,利用荧光素酶(luciferase)定量杀伤效率评估方法,体外比较wt、αbcma scfv-4-1bb-cd3ζ-tlr2-t和αbcma scfv-4-1bb-cd3ζ-t对k562-bcma-gl的杀伤作用,杀伤比例计算公式如下:
[0065]
100%
×
(对照孔读数-实验孔读数)/对照孔读数(不加细胞的空白组读数可以忽略)
[0066]
结果如图2所示,αbcma scfv-4-1bb-cd3ζ-tlr2-t和αbcma scfv-4-1bb-cd3ζ-t对k562-bcma-gl的体外杀伤效率显著高于wt,而αbcma scfv-4-1bb-cd3ζ-tlr2-t的杀伤效率更强,在e:t很小的情况下,即肿瘤靶细胞远大于效应t细胞,αbcma scfv-4-1bb-cd3ζ-tlr2-t也能表现出较强的肿瘤杀伤活性,说明tlr2起到了扩大胞外区传递信号、引起下级细胞杀伤作用级联放大的效果。
[0067]
实施例5
[0068]
分别将k562、k562-bcma-gl按照5
×
10
5
细胞/孔的密度接种24孔板,随后加入wt、αbcma scfv-4-1bb-cd3ζ-tlr2-t和αbcma scfv-4-1bb-cd3ζ-t,于孵箱中共培养12h;采用ifn-γelisa检测试剂盒对共培养上清进行检测。
[0069]
如图3所示,bcma-car-t与k562-bcma共培养的上清中ifn-γ细胞因子的水平较与k562共培养得到显著升高,其中,αbcma scfv-4-1bb-cd3ζ-tlr2-t与k562-bcma共培养的上清中ifn-γ细胞因子的水平又比αbcma scfv-4-1bb-cd3ζ-t高,说明αbcma scfv-4-1bb-cd3ζ-tlr2-t的杀伤能力更强。
[0070]
综上所述,本发明采用串联的4-1bb、cd3ζ和tlr2作为嵌合抗原受体的信号转导结构域,配合特异性抗原结合结构域抗bcma单链抗体,构建的嵌合抗原受体t细胞具有显著增强的特异性识别肿瘤抗原和杀伤肿瘤细胞的能力,在b细胞恶性肿瘤的治疗领域具有广泛的应用前景。
[0071]
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的
添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1