一种谷氨酸的发酵方法与流程
[0001]
本发明涉及谷氨酸发酵技术领域,特别涉及一种谷氨酸的发酵方法。
背景技术:
[0002]
谷氨酸又名α-氨基戊二酸,分子内含一个氨基和两个羧基,是一种酸性氨基酸。分子量为147,等电点3.22,微溶于水,而易溶于酸性溶液中,大量存在于谷类蛋白质中,动物脑中含量也较多。谷氨酸是生物机体内氮代谢的基本氨基酸之一,参与蛋白质、多肽及脂肪酸的合成,与谷氨酰胺一起调节体内氨水平;也可作为兴奋性神经递质参与信息传递。谷氨酸有左旋体、右旋体和外消旋体。左旋体即l-谷氨酸。天然存在的谷氨酸都是l-谷氨酸。谷氨酸在食品、医药、化妆品和农业中都有广泛应用。
[0003]
发酵法生产谷氨酸是以淀粉糖或糖蜜为原料,于大型发酵罐中通气搅拌发酵,温度控制30-40℃,ph7-8,经30-40h发酵后,除去菌体,将发酵液中谷氨酸提取出来,精制后即为成品,上述流程中采用等电点法提取,也可采用离子交换法、盐酸盐法、直接浓缩法等。经过50多年的发展,发酵法生产谷氨酸技术取得了巨大的进步,谷氨酸生产菌种由亚适量型转变为温敏型,发酵生产强度明显提升,发酵产酸水平由亚适量型的9-12%提升到温敏型的15-21%,转化率水平也由50-60%提升至65%~68%。但我国生产技术水平与国际同行业相比还有一定差距,与谷氨酸理论转化率水平相比还有较大提升空间。
[0004]
中国专利cn10885865a中公开了一种发酵生产α型谷氨酸的方法,将产谷氨酸的黄色短杆菌按8-10%接种量将种子液接入装有60l发酵培养基a的100l发酵罐中进行发酵培养,发酵培养24h,然后添加10l发酵培养基b,继续发酵培养24h,收集发酵液用于生产α型谷氨酸;整个发酵培养过程中,控制发酵温度30-36℃,通风比1∶0.7-0.9,搅拌转速200-400r/min,溶氧维持在20-30%,流加葡萄糖溶液维持残糖不低于1.0%,流加消泡剂消泡。所述发酵培养基a的制备方法为:葡萄糖80g/l,酵母浸膏20g/l,k2hpo
4 2g/l,mgso4·
7h2o 50mg/l,2-羟基乙胺40mg/l,cecl
3 10mg/l,mnso4·
h2o3mg/l,feso4·
7h2o 3mg/l,vb110mg/l,生物素7μg/l;将各原料搅拌均匀后,调节ph为6.5,121℃灭菌15min,自然冷却,制得发酵培养基a。所述发酵培养基b的制备方法为:琥珀酸5g/l,尿素2g/l,壳聚糖80mg/l;将各原料搅拌均匀后,调节ph为6.5,121℃灭菌15min,自然冷却,制得发酵培养基b。发酵结束后发酵液中最终谷氨酸浓度可达到150.7g/l,转化率64.1%。
[0005]
中国专利cn109988791a公开了一种优化的谷氨酸发酵工艺,在发酵过程中添加黄腐酸和碳酸镁,提高了发酵效率,降低了副产物的产量。所述发酵罐培养基的组分为:葡萄糖80g/l,玉米浆30g/l,k2hpo
4 2g/l,mnso4·
h2o 3mg/l,feso4·
7h2o 3mg/l,vb110mg/l,生物素7μg/l。发酵工艺为将黄色短杆菌gdk-9按10-12%接种量将种子液接入装有30l发酵培养基的50l发酵罐中进行发酵培养,控制发酵温度36-38℃,通风比1:0.6,搅拌转速400-500r/min,流加质量浓度为80%的葡萄糖维持残糖为1-1.5%,流加消泡剂消泡,发酵12-18h,添加黄腐酸5-10mg/l和碳酸镁2-4g/l,继续发酵24h结束发酵,最终发酵液中谷氨酸含量可达到168.1g/l。
[0006]
甜菜碱作为细胞内一种重要的渗透压缓冲物质,能防止细胞中离子浓度的激变。当细胞内渗透压激变时,如外部渗透压升高时,细胞开始产生或吸收甜菜碱以维持正常的渗透压平衡,同时防止细胞水分的流出和盐分的入侵,并能提高钠钾泵的功效,确保细胞的正常功能。因此,甜菜碱作为发酵助剂广泛应用于温敏型l-谷氨酸发酵生产中,通过在初始培养基中添加甜菜碱,能够缓解发酵后期由于渗透压升高导致的细菌呼吸抑制和菌体活力降低,提高菌体的氧消耗速率,抑制乳酸的积累,提高菌体生长速率和产酸速率。
[0007]
中国专利cn101705262a中公开了一种利用甜菜碱提高谷氨酸温度敏感突变株发酵产酸率的新工艺。根据甜菜碱具有提供甲基、调节菌体细胞内渗透压、促进菌体脂肪代谢和蛋白质合成等作用,可提高菌体内酶活,促进菌体生长,实现谷氨酸在发酵液中的更大程度蓄积从而提高产率的原理。在现有发酵培养基中添加甜菜碱或磷酸盐甜菜碱,使其在培养基中的浓度为0.1~15g/l。采用的菌株为谷氨酸棒杆菌、黄色短杆菌等谷氨酸温度敏感突变株;培养基为在现有普遍采用的发酵培养基[葡萄糖18%、玉米浆2%、mgso4·
7h2o0.15%、k2hpo
4 0.45%、mnso
4 0.0003%、feso
4 0.0003%、vb1 0.00004%]中添加7.5g/l甜菜碱;培养方法:将菌种接入种子培养基[葡萄糖2.5%、玉米浆3%、k2hpo4·
3h2o 0.3%、mgso4·
7h2o 0.1%、0.0002%、feso
4 0.0002%、vb
1 0.00002%,尿素0.055%]中,接种量为10%;在30℃、ph为7.0和溶氧为20%条件下于5l自动控制发酵罐中培养12h至对数期,按10%的接种量接入含有发酵培养基的30l自动控制发酵罐中,控制初始培养温度为30℃,当发酵液稀释20倍浓度od620nm值为0.35时,在5分钟内提高温度至37℃培养,通入适当空气,调节适当搅拌转速,采用分阶段供氧模式控制溶氧:0~10h为20%,10~32h为5%,通过自动流加氨水控制ph在7.0~7.2,通过流加适量泡敌消泡,并通过流加浓度为800g/l的葡萄糖溶液将残糖控制在1.5%,发酵至32h停止。放罐时,l-谷氨酸的产量为214.3g/l,糖酸转化率为63.9%,分别比对照实验(l-谷氨酸产量为180.0g/l,糖酸转化率为60.0%)提高了19.1%和6.5%。
[0008]
中国专利cn103243131b中公开了一种发酵制备l-谷氨酸的方法,本发明采用温度敏感型谷氨酸生产菌,在l-谷氨酸发酵过程中,分期于培养基中添加不同的低浓度甜菜碱,并调节和控制发酵培养温度,来提高谷氨酸的产酸量和糖酸转化率。本发明方法包括下列步骤:
[0009]
(1)种子培养
[0010]
种子培养基(/l):葡萄糖15g,玉米浆20g,k2hpo
4 3g,mgso4·
7h2o1g,vb
1 200μg,dl-蛋氨酸50μg,feso4·
7h2o、mnso4·
h2o各2mg,尿素0.55g(分消),ph7.0~7.2,121℃灭菌15min;
[0011]
方法:采用温度敏感型谷氨酸生产菌(谷氨酸黄色短杆菌、谷氨酸棒杆菌等),接种量为12%;培养温度32℃,160rpm,振荡培养14~16h至对数期;
[0012]
(2)发酵培养
[0013]
发酵培养基(/l):葡萄糖20g,玉米浆20g,盐酸盐甜菜碱0.1~0.3g,k2hpo47.5g,mgso4·
7h2o 1.5g,vb
1 200μg,vh 600μg,feso4·
7h2o、mnso4·
h2o各30mg,尿素0.55g(分消),ph7.0~7.2,121℃灭菌15min;
[0014]
方法:按12%的接种量将种子液接入含有发酵培养基全自动控制发酵罐中,控制ph值7.0~7.2;分阶段供氧模式控制溶氧:0~10h为20%,10~32h为5%;控制初始培养温
度为32℃;当相对生长
△
od=0.3左右时(此为发酵液稀释20倍浓度在620nm处的od值),转换温度到37℃,同时添加0.1~0.3g/l的盐酸盐甜菜碱;
△
od=0.6时,再次提高温度到38℃继续发酵至结束。通过流加80%的葡萄糖浓溶液将残糖控制在为0.1~3g/l。全过程流加液氨控制ph,发酵0~14h,ph为7.0~7.1,14~25h为7.2~7.3,25h至发酵结束为6.8,产酸值不再变化并有ph值上升时即为发酵终点;发酵时间为30-32h。根据实验结果,当初始培养基加入0.3g/l盐酸盐甜菜碱,变温37℃时补加0.1g/l盐酸盐甜菜碱发酵指标最高,放罐时,l-谷氨酸的产量为219.4g/l,糖酸转化率为68.1%。
[0015]
采用在发酵培养基中添加渗透压调节物质甜菜碱工艺,虽然对高渗条件下菌体呼吸抑制和菌体活力下降有缓解,但未能改变菌体所处的高渗环境,随着发酵进行,后期渗透压继续升高,菌体活力继续下降,呼吸减弱,同时菌体需要不断合成渗透压调节物质海藻糖和脯氨酸,导致后期产酸率和转化率不断下降。而且采用外源添加甜菜碱工艺,不能解决高游离氨对细胞的毒性。
技术实现要素:
[0016]
有鉴于此,本发明提供了一种谷氨酸的发酵方法。本发明采用分段控制ph工艺,菌体生长阶段控制较低ph,降低发酵液中游离氨浓度减少游离氨对细胞的毒性,改善菌体生长;产酸期控制较高ph,促进产酸和谷氨酸外排。本发明采用高价阳离子代替铵根离子,从根本上降低渗透压,改善菌体生长环境。
[0017]
为了实现上述发明目的,本发明提供以下技术方案:
[0018]
本发明提供了一种谷氨酸的发酵方法,包括以下步骤:
[0019]
将温敏型谷氨酸棒杆菌种子液接种于发酵培养基中进行发酵培养,发酵过程中控制发酵温度和发酵溶氧do值,流加氨水;氨水的流加速率根据ph调整:发酵液od≤100时,ph为6.7;发酵液od>100时,ph为7.0;
[0020]
底糖消耗完全后,流加葡萄糖溶液,发酵培养32~38h。
[0021]
本发明发现,游离氨浓度高,细胞毒性抑制生长和代谢。谷氨酸分子含有多个可解离的基团,它在发酵液中以4种电离状态存在:(1)所有基团均带有最多的[h
+
],此时整个粒子带一个正电荷,记作[1+];(2)[1+]粒子的α羧基失去一个[h
+
],整个粒子呈现电中性,记作i;(3)i粒子的末端羧基失去一个[h
+
],整个粒子带1个负电荷,记作[1-];(4)[1-]粒子的氨基失去[h
+
],整个粒子带2个负电荷,记作[2-],此时谷氨酸无法继续失去[h
+
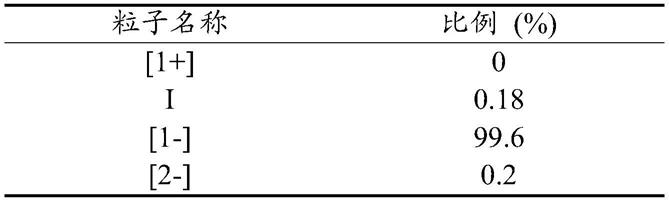
](图1)。谷氨酸的4种电离状态粒子会同时存在于液体中,随着ph的变化,四种粒子的比例会发生改变。根据pk值可以计算出ph=7.0时,四种粒子的比例如下表所示:
[0022]
表1ph=7条件下谷氨酸各种状态粒子所占比例
[0023][0024]
从表1可以看出ph=7的条件下,99.6%的谷氨酸是以[1-]的形式存在的,因此谷
氨酸在发酵液中带有大约1个负电荷。由于谷氨酸在当前发酵条件下约带一个负电荷,因此为了维持发酵液电中性必须提供正电荷离子与之匹配,目前谷氨酸发酵过程中主要通过流加氨水或液氨来调节ph,而铵根离子就是发酵液中用于匹配谷氨酸的的阳离子。同时随着发酵液的不断进行,发酵液中的游离氨浓度会不断提高。而高的游离氨对于细胞是有毒性的。游离氨基与细菌细胞膜上磷酯的磷酸根结合,使膜的通透性增加,导致细胞内的重要物质如氨基酸、嘌吟、嘧啶、k
+
等外漏;高浓度的游离氨也能影响核质和核糖体的功能。发酵液中未解离的氨的比例受ph影响较大(如图2所示)。当ph从7下降至6.7左右,未解离氨的比例下降50.9%(从0.57%下降至0.28%),ph从7上升至7.3,则未解离氨的比例提高96%(从0.57%提高至1.12%)。因此,通过降低ph可以有效减少未解离的氨的浓度。
[0025]
另外,随着发酵产酸水平提高,发酵后期谷氨酸浓度提高,发酵液渗透压明显提升,菌体在高渗条件下失水导致胞内参与代谢的各种酶系酶活迅速下降,随着菌体活力下降,菌体产酸能力降低;同时菌体为了能够适应在高渗环境下生存,需要自身合成相关渗透压相容性物质如海藻糖、脯氨酸等维持胞内外渗透压平衡,渗透压相容性物质的合成也会导致碳流损失和转化率降低。要降低谷氨酸发酵后期的渗透压,可以采用高价阳离子来代替nh
4+
离子,从而降低来自产品的渗透压20%~40%。通过采用高价阳离子,由于其带电量大,一次可以配对多个谷氨酸离子,从而大大降低渗透压。
[0026]
作为优选,流加氨水的同时流加高价阳离子溶液。
[0027]
作为优选,高价阳离子溶液为乙二胺水溶液、1,2-环己二胺水溶液、四甲基二丙烯三胺水溶液中的一种或几种。
[0028]
作为优选,高价阳离子溶液的体积百分浓度为10%~25%。
[0029]
作为优选,高价阳离子溶液的流加速率为氨水流加速率的1.1~4.5倍。
[0030]
作为优选,控制发酵温度具体为:控制初始温度32℃,发酵液od达到40以上后提温至37℃,发酵运行24h后提温至39℃;
[0031]
控制发酵溶氧do值具体为:通过调节风量、转速和罐压控制发酵液的发酵溶氧do值达到20%以上。
[0032]
作为优选,葡萄糖溶液的质量百分浓度为60%~80%,控制发酵液残糖浓度大于1g/l。
[0033]
在本发明提供的具体实施例中,葡萄糖溶液的质量百分浓度为70%。
[0034]
作为优选,发酵培养基的配方为:葡萄糖45~55g/l,玉米浆55~65g/l,豆粕水解液25~35g/l,k2hpo
4 2~4g/l,mgso4·
7h2o 1.0~2.0g/l,vb1150~250μg/l,生物素250~350μg/l,feso4·
7h2o 8~12mg/l,mnso4·
h2o8~12mg/l,琥珀酸2~4g/l;
[0035]
在本发明提供的具体实施例中,发酵培养基的配方为:葡萄糖50g/l,玉米浆60g/l,豆粕水解液30g/l,k2hpo
4 3g/l,mgso4·
7h2o 1.5g/l,vb1200μg/l,生物素300μg/l,feso4·
7h2o 10mg/l,mnso4·
h2o 10mg/l,琥珀酸3g/l;
[0036]
发酵培养基制备方法为:将上述各组分溶解于水中,灭菌,得到发酵培养基。
[0037]
作为优选,灭菌温度121~123℃,灭菌时间20min。
[0038]
作为优选,发酵培养之前还包括活化菌种、种子扩培的步骤。
[0039]
作为优选,种子扩培所用的种子培养基配方为:葡萄糖35~45g/l,玉米浆25~35g/l,豆粕水解液10~20g/l,k2hpo
4 0.5~1.5g/l,mgso4·
7h2o1.0~2.0g/l,vb
1 80~120
μg/l,生物素150~250μg/l,feso4·
7h2o 3~7mg/l、mnso4·
h2o 3~7mg/l,琥珀酸1.0~2.0g/l;
[0040]
在本发明提供的具体实施例中,种子培养基配方为:葡萄糖40g/l,玉米浆30g/l,豆粕水解液15g/l,k2hpo
4 1g/l,mgso4·
7h2o 1.2g/l,vb
1 100μg/l,生物素200μg/l,feso4·
7h2o 5mg/l、mnso4·
h2o 5mg/l,琥珀酸1.5g/l;
[0041]
种子培养基制备方法为:将上述各组分溶解于水中,调节培养基ph7.0~7.2,灭菌,得到种子培养基。
[0042]
本发明提供了一种谷氨酸的发酵方法。包括以下步骤:将温敏型谷氨酸棒杆菌种子液接种于发酵培养基中进行发酵培养,发酵过程中控制发酵温度和发酵溶氧do值,流加氨水;氨水的流加速率根据ph调整:发酵液od≤100时,ph为6.7;发酵液od>100时,ph为7.0;底糖消耗完全后,流加葡萄糖溶液,发酵培养32~38h。本发明与现有技术相比具有以下优点:
[0043]
1、采用高价阳离子代替铵根离子,由于其带电量大,一次可以配对多个谷氨酸离子,从而减少发酵液中粒子数,从根本上降低渗透压,改善菌体生长环境;
[0044]
2、采用分段控制ph工艺,菌体生长阶段控制较低ph,降低发酵液中游离氨浓度减少游离氨对细胞的毒性,改善菌体生长;产酸期控制较高ph,促进产酸和谷氨酸外排。
附图说明
[0045]
图1谷氨酸电离示意图;
[0046]
图2不同ph条件下未解离氨的比例;
[0047]
图3谷氨酸合成的代谢途径。
具体实施方式
[0048]
本发明公开了一种谷氨酸的发酵方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
[0049]
术语解释:
[0050]
微生物合成谷氨酸途径:包括糖酵解途径(emp)、磷酸戊糖途径(ppp)、三羧酸循环(tca)、乙醛酸循环和co2固定反应等。首先葡萄糖经emp途径生成丙酮酸,丙酮酸一部分经丙酮酸脱氢酶系转化为乙酰辅酶a,一部分经co2固定反应生成草酰乙酸,乙酰辅酶a和草酰乙酸经tca循环合成前体物质α-酮戊二酸,α-酮戊二酸经谷氨酸脱氢酶和氨基化反应转化为谷氨酸,之后经细胞膜排出胞外。理论上不考虑菌体生长及呼吸消耗,一分子六碳的葡萄糖最终产生一分子五碳的谷氨酸,理论糖酸转化率为81.7%(图3)。
[0051]
温度敏感型菌种:谷氨酸生产所用菌种主要为谷氨酸棒杆菌,是一种好氧型非致病性革兰氏阳性菌,根据诱导机制不同可分为两类,生物素亚适量型和温度敏感型菌种。生物素亚适量型菌种属于生物素营养缺陷型菌种,生物素是菌种生长的关键因子,影响菌体细胞的生长代谢和细胞膜的通透性,同时生物素作为三羧酸循环中丙酮酸羧化酶的辅酶,
参与三羧酸的循环中co2固定反应,最终促进了谷氨酸代谢流速度提高,对菌体产酸有关键性作用,所以说生物素在培养基中控制亚适量添加是谷氨酸发酵生产的关键。温度敏感型菌种属于短杆菌的变种,多为基因突变型菌株。在正常培养温度下,菌体生长良好,当温度提高到一定程度时由生长型向产酸型转变,具有这种特性的菌株就称为温度敏感型突变株。温度敏感型菌种巧妙地解决了生物素对细胞膜转型与生物素促进糖酵解反应之间的矛盾,据报道,生物素在培养基中含量超过100μg/l以上,则co2的固定反应可提高30%,这样既能大量的促进谷氨酸产生途径的代谢流,又能通过提高温度激活细胞膜上谷氨酸外运通道蛋白打开。由于解除了对生物素的限制,使得温敏型菌种的产酸水平大大提高,产酸能达到150~210g/l,温敏型菌种发酵强度可达到亚适量菌种的1.3倍。目前工业上大多采用温度敏感型菌种发酵生产谷氨酸。
[0052]
发酵法生产谷氨酸:是以淀粉糖或糖蜜为原料,于大型发酵罐中通气搅拌发酵,温度控制30-40℃,ph7-8,经30-40h发酵后,除去菌体,将发酵液中谷氨酸提取出来,精制后即为成品,上述流程中采用等电点法提取,也可采用离子交换法、盐酸盐法、直接浓缩法等。所用碳源是薯类、玉米、木薯淀粉等淀粉的水解糖或糖蜜,也可以是乙酸、液态石蜡(c16石蜡最好)及其他石油化工产品,碳源用以构成微生物细胞和代谢产物中的碳架和能源的营养物质。氮源主要包括有机氮源如玉米浆、水解液、酵母膏、蛋白胨等和无机氮源铵盐、硝酸盐、尿素、氨水和液氨等,氮是构成菌体细胞蛋白质和核酸等的主要元素,氮也是构成发酵产品谷氨酸氨基的主要组成元素。其他辅助原料为无机盐类,维生素等,例如微生物需要适宜的磷浓度,镁是刺激菌体生长的无机激活剂,钾盐促进产酸和调节渗透压,铁离子是细胞色素及某些酶的组分,铁硫蛋白,影响电子传递系统中的氧化还原,因此它是菌体生长和代谢所不可或缺的物质。锰离子对多种酶的活性具有重要意义,这些酶在核心碳代谢中影响碳流的分配和谷氨酸前体α-酮戊二酸的合成。因此,锰离子对于菌体生长和谷氨酸的合成都有着非常重要的意义。琥珀酸是tca循环重要中间体,tca循环偶连氧化磷酸化是细菌能量重要来源。由于谷氨酸生产菌的琥珀酸合成途径被阻断,tca循环无法走通,影响能量供应。通过外源添加琥珀酸或琥珀酸盐来打通tca循环,从而可以提高菌体的活力。
[0053]
溶液渗透压:是指溶液中溶质微粒对水的吸引力。溶液渗透压的大小取决于单位体积溶液中溶质微粒的数目:溶质微粒越多,即溶液浓度越高,对水的吸引力越大,溶液渗透压越高;反过来,溶质微粒越少,即溶液浓度越低,对水的吸引力越弱,溶液渗透压越低。根据范托夫公式,π=crt,其中π即为渗透压,单位为pa;c为溶质浓度,单位为mol/l;r为理想气体常数,8.314j*k-1
*mol-1
;t为热力学温度。范托夫公式表示,在一定温度条件下溶液的渗透压与单位体积溶液中所含不能通过半透膜的溶质的粒子数成正比,而与溶液性质无关。由于r是常数,而t会控制在一定条件下,一般用mosm来表示渗透压强度,1mosm表示1l(kg)水中含有1mmol粒子。谷氨酸发酵过程中随着谷氨酸的生成以及相应离子配体(nh
4+
)的积累会导致发酵后期罐中粒子浓度提高,根据范托夫公式,这会导致渗透压过高,最终影响菌体代谢,降低阶段转化率和产率。对于谷氨酸发酵而言,由于所采用的配体离子是1价的,因此其粒子浓度要比采用二价离子高一倍,最终导致谷氨酸发酵的后期的渗透压非常高。
[0054]
根据溶液渗透压计算公式,渗透压的大小取决于单位体积溶液中溶质微粒的数目。谷氨酸发酵液中主要粒子包括谷氨酸、铵根离子和培养基中的氨基酸、无机盐等。
[0055]
本发明提供的谷氨酸的发酵方法中的应用中所用菌种、培养基组分、试剂、仪器等
均可由市场购得。
[0056]
下面结合实施例,进一步阐述本发明:
[0057]
实施例1:
[0058]
本实施例提供一种提高谷氨酸发酵产酸和转化率的方法,包括如下步骤:
[0059]
(1)种子培养基准备:葡萄糖40g/l,玉米浆30g/l,豆粕水解液15g/l,k2hpo
4 1g/l,mgso4·
7h2o 1.2g/l,vb
1 100μg/l,生物素200μg/l,feso4·
7h2o5mg/l、mnso4·
h2o 5mg/l,琥珀酸1.5g/l,采用氢氧化钠调节培养基ph7.0~7.2,121℃灭菌20min;
[0060]
(2)种子培养:菌种采用生产用温敏型谷氨酸棒杆菌,将甘油管冻存菌种首先涂布于lb培养基活化培养过夜,挑取一定量菌落接种于装有1000ml种子培养基的5l三角瓶中,放入恒温往复式摇床中振荡培养,转速120rpm,温度32℃,培养8-12h至种子液od达到20以上后结束培养。
[0061]
(3)发酵培养基准备:葡萄糖50g/l,玉米浆60g/l,豆粕水解液30g/l,k2hpo
4 3g/l,mgso4·
7h2o 1.5g/l,vb
1 200μg/l,生物素300μg/l,feso4·
7h2o10mg/l、mnso4·
h2o 10mg/l,琥珀酸3g/l,根据发酵罐定容体积称量各组分溶解后倒入50l发酵罐中,实消灭菌,灭菌温度121~123℃,灭菌时间20min;
[0062]
(4)发酵培养:将培养好的种子液接入装有20l发酵培养基的50l发酵罐中,初始培养温度32℃,培养至发酵液od达到40以上后升温至37℃,24h后升温至39℃,调节风量、转速和罐压控制过程do20%以上,同时流加浓度25%氨水和浓度25%乙二胺溶液,乙二胺阶段流加速率按照对比实施例1中氨水阶段流加速率的1.1倍设定,氨水流加速率根据ph自动反馈调节,根据菌体生长和产酸不同阶段调整ph控制,发酵液od≤100ph 6.7,od>100ph 7.0,待底糖消耗完全后开始流加质量浓度70%的葡萄糖溶液,控制发酵液残糖浓度大于1g/l,发酵培养32h后停糖结束发酵,检测发酵液中谷氨酸、脯氨酸、海藻糖和渗透压各项指标。
[0063]
(5)发酵液检测:采用生物传感仪(sba)检测发酵过程残糖和谷氨酸,采用可见分光光度计检测发酵液od,检测波长600nm,采用渗透压仪检测发酵液渗透压,采用高效液相色谱(hplc)检测发酵液中脯氨酸和海藻糖。
[0064]
经过检测,放罐发酵液中l-谷氨酸215g/l,糖酸转化率68.8%,脯氨酸4.5g/l,海藻糖4g/l,渗透压2800mosm/kg,产酸较对比实验提高了2.4%,转化率较对比实验提高了2.7%,渗透压较对比实验降低了20%。
[0065]
实施例2:
[0066]
本实施例提供一种提高谷氨酸发酵产酸和转化率的方法,包括如下步骤:
[0067]
(1)种子培养基准备:葡萄糖40g/l,玉米浆30g/l,豆粕水解液15g/l,k2hpo
4 1g/l,mgso4·
7h2o 1.2g/l,vb
1 100μg/l,生物素200μg/l,feso4·
7h2o5mg/l、mnso4·
h2o 5mg/l,琥珀酸1.5g/l,采用氢氧化钠调节培养基ph7.0~7.2,121℃灭菌20min;
[0068]
(2)种子培养:菌种采用生产用温敏型谷氨酸棒杆菌,将甘油管冻存菌种首先涂布于lb培养基活化培养过夜,挑取一定量菌落接种于装有1000ml种子培养基的5l三角瓶中,放入恒温往复式摇床中振荡培养,转速120rpm,温度32℃,培养8-12h至种子液od达到20以上后结束培养。
[0069]
(3)发酵培养基准备:葡萄糖50g/l,玉米浆60g/l,豆粕水解液30g/l,k2hpo
4 3g/l,
mgso4·
7h2o 1.5g/l,vb
1 200μg/l,生物素300μg/l,feso4·
7h2o10mg/l、mnso4·
h2o 10mg/l,琥珀酸3g/l,根据发酵罐定容体积称量各组分溶解后倒入50l发酵罐中,实消灭菌,灭菌温度121~123℃,灭菌时间20min;
[0070]
(4)发酵培养:将培养好的种子液接入装有20l发酵培养基的50l发酵罐中,初始培养温度32℃,培养至发酵液od达到40以上后升温至37℃,24h后升温至39℃,调节风量、转速和罐压控制过程do20%以上,同时流加浓度25%氨水和浓度10%1,2-环己二胺溶液,1,2-环己二胺阶段流加速率按照对比实施例1中阶段氨水流加速率的4倍设定,氨水流加速率根据ph自动反馈调节,根据菌体生长和产酸不同阶段调整ph控制,发酵液od≤100ph 6.7,od>100ph 7.0,待底糖消耗完全后开始流加质量浓度70%的葡萄糖溶液,控制发酵液残糖浓度大于1g/l,发酵培养35h后停糖结束发酵,检测发酵液中谷氨酸、脯氨酸、海藻糖和渗透压各项指标。
[0071]
(5)发酵液检测:采用生物传感仪(sba)检测发酵过程残糖和谷氨酸,采用可见分光光度计检测发酵液od,检测波长600nm,采用渗透压仪检测发酵液渗透压,采用高效液相色谱(hplc)检测发酵液中脯氨酸和海藻糖。
[0072]
经过检测,放罐发酵液中l-谷氨酸217.5g/l,糖酸转化率69.5%,脯氨酸4g/l,海藻糖2.5g/l,渗透压2650mosm/kg,产酸较对比实验提高了3.6%,转化率较对比实验提高了3.7%,渗透压较对比实验降低了24.3%。
[0073]
实施例3:
[0074]
本实施例提供一种提高谷氨酸发酵产酸和转化率的方法,包括如下步骤:
[0075]
(1)种子培养基准备:葡萄糖40g/l,玉米浆30g/l,豆粕水解液15g/l,k2hpo
4 1g/l,mgso4·
7h2o 1.2g/l,vb
1 100μg/l,生物素200μg/l,feso4·
7h2o5mg/l、mnso4·
h2o 5mg/l,琥珀酸1.5g/l,采用氢氧化钠调节培养基ph7.0~7.2,121℃灭菌20min;
[0076]
(2)种子培养:菌种采用生产用温敏型谷氨酸棒杆菌,将甘油管冻存菌种首先涂布于lb培养基活化培养过夜,挑取一定量菌落接种于装有1000ml种子培养基的5l三角瓶中,放入恒温往复式摇床中振荡培养,转速120rpm,温度32℃,培养8-12h至种子液od达到20以上后结束培养。
[0077]
(3)发酵培养基准备:葡萄糖50g/l,玉米浆60g/l,豆粕水解液30g/l,k2hpo
4 3g/l,mgso4·
7h2o 1.5g/l,vb
1 200μg/l,生物素300μg/l,feso4·
7h2o10mg/l、mnso4·
h2o 10mg/l,琥珀酸3g/l,根据发酵罐定容体积称量各组分溶解后倒入50l发酵罐中,实消灭菌,灭菌温度121~123℃,灭菌时间20min;
[0078]
(4)发酵培养:将培养好的种子液接入装有20l发酵培养基的50l发酵罐中,初始培养温度32℃,培养至发酵液od达到40以上后升温至37℃,24h后升温至39℃,调节风量、转速和罐压控制过程do20%以上,同时流加浓度25%氨水和浓度10%四甲基二丙烯三胺溶液,四甲基二丙烯三胺流加速率按照对比实施例1中氨水流加速率的4.5倍设定,氨水流加速率根据ph自动反馈调节,根据菌体生长和产酸不同阶段调整ph控制,发酵液od≤100ph6.7,od>100ph 7.0,待底糖消耗完全后开始流加质量浓度70%的葡萄糖溶液,控制发酵液残糖浓度大于1g/l,发酵培养38h后停糖结束发酵,检测发酵液中谷氨酸、脯氨酸、海藻糖和渗透压各项指标。
[0079]
(5)发酵液检测:采用生物传感仪(sba)检测发酵过程残糖和谷氨酸,采用可见分
光光度计检测发酵液od,检测波长600nm,采用渗透压仪检测发酵液渗透压,采用高效液相色谱(hplc)检测发酵液中脯氨酸和海藻糖。
[0080]
经过检测,放罐发酵液中l-谷氨酸220g/l,糖酸转化率70.8%,脯氨酸2g/l,海藻糖2g/l,渗透压2535mosm/kg,产酸较对比实验提高了4.8%,转化率较对比实验提高了5.7%,渗透压较对比实验降低了27.6%。
[0081]
实施例4:
[0082]
本实施例提供一种提高谷氨酸发酵产酸和转化率的方法,包括如下步骤:
[0083]
(1)种子培养基准备:葡萄糖40g/l,玉米浆30g/l,豆粕水解液15g/l,k2hpo
4 1g/l,mgso4·
7h2o 1.2g/l,vb
1 100μg/l,生物素200μg/l,feso4·
7h2o5mg/l、mnso4·
h2o 5mg/l,琥珀酸1.5g/l,采用氢氧化钠调节培养基ph7.0~7.2,121℃灭菌20min;
[0084]
(2)种子培养:菌种采用生产用温敏型谷氨酸棒杆菌,将甘油管冻存菌种首先涂布于lb培养基活化培养过夜,挑取一定量菌落接种于装有1000ml种子培养基的5l三角瓶中,放入恒温往复式摇床中振荡培养,转速120rpm,温度32℃,培养8-12h至种子液od达到20以上后结束培养。
[0085]
(3)发酵培养基准备:葡萄糖50g/l,玉米浆60g/l,豆粕水解液30g/l,k2hpo
4 3g/l,mgso4·
7h2o 1.5g/l,vb
1 200μg/l,生物素300μg/l,feso4·
7h2o10mg/l、mnso4·
h2o 10mg/l,琥珀酸3g/l,根据发酵罐定容体积称量各组分溶解后倒入50l发酵罐中,实消灭菌,灭菌温度121~123℃,灭菌时间20min;
[0086]
(4)发酵培养:将培养好的种子液接入装有20l发酵培养基的50l发酵罐中,初始培养温度32℃,培养至发酵液od达到40以上后升温至37℃,24h后升温至39℃,调节风量、转速和罐压控制过程do20%以上,流加浓度25%氨水,氨水流加速率根据ph自动反馈调节,根据菌体生长和产酸不同阶段调整ph控制,发酵液od≤100ph 6.7,od>100ph 7.0,待底糖消耗完全后开始流加质量浓度70%的葡萄糖溶液,控制发酵液残糖浓度大于1g/l,发酵培养32h后停糖结束发酵,检测发酵液中谷氨酸、脯氨酸、海藻糖和渗透压各项指标。
[0087]
(5)发酵液检测:采用生物传感仪(sba)检测发酵过程残糖和谷氨酸,采用可见分光光度计检测发酵液od,检测波长600nm,采用渗透压仪检测发酵液渗透压,采用高效液相色谱(hplc)检测发酵液中脯氨酸和海藻糖。
[0088]
经过检测,放罐发酵液中l-谷氨酸212.5g/l,糖酸转化率67.5%,脯氨酸7.5g/l,海藻糖6g/l,渗透压3250mosm/kg,产酸较对比实验提高了1.2%,转化率较对比实验提高了0.75%,渗透压较对比实验降低了7.1%。
[0089]
对比例1:
[0090]
本实施例提供一种提高谷氨酸发酵产酸和转化率的方法,包括如下步骤:
[0091]
(1)种子培养基准备:葡萄糖40g/l,玉米浆30g/l,豆粕水解液15g/l,k2hpo
4 1g/l,mgso4·
7h2o 1.2g/l,vb
1 100μg/l,生物素200μg/l,feso4·
7h2o5mg/l、mnso4·
h2o 5mg/l,琥珀酸1.5g/l,采用氢氧化钠调节培养基ph7.0~7.2,121℃灭菌20min;
[0092]
(2)种子培养:菌种采用生产用温敏型谷氨酸棒杆菌,将甘油管冻存菌种首先涂布于lb培养基活化培养过夜,挑取一定量菌落接种于装有1000ml种子培养基的5l三角瓶中,放入恒温往复式摇床中振荡培养,转速120rpm,温度32℃,培养8-12h至种子液od达到20以上后结束培养。
[0093]
(3)发酵培养基准备:葡萄糖50g/l,玉米浆60g/l,豆粕水解液30g/l,k2hpo
4 3g/l,mgso4·
7h2o 1.5g/l,vb
1 200μg/l,生物素300μg/l,feso4·
7h2o10mg/l、mnso4·
h2o 10mg/l,琥珀酸3g/l,根据发酵罐定容体积称量各组分溶解后倒入50l发酵罐中,实消灭菌,灭菌温度121~123℃,灭菌时间20min;
[0094]
(4)发酵培养:将培养好的种子液接入装有20l发酵培养基的50l发酵罐中,初始培养温度32℃,培养至发酵液od达到40以上后升温至37℃,24h后升温至39℃,调节风量、转速和罐压控制过程do20%以上,流加25%氨水调节ph,氨水流加速率根据ph自动反馈调节,过程ph控制7.0,待底糖消耗完全后开始流加质量浓度70%的葡萄糖溶液,控制发酵液残糖浓度大于1g/l,发酵培养32h后停糖结束发酵,检测发酵液中谷氨酸、脯氨酸、海藻糖和渗透压各项指标。
[0095]
(5)发酵液检测:采用生物传感仪(sba)检测发酵过程残糖和谷氨酸,采用可见分光光度计检测发酵液od,检测波长600nm,采用渗透压仪检测发酵液渗透压,采用高效液相色谱(hplc)检测发酵液中脯氨酸和海藻糖。
[0096]
经过检测,放罐发酵液中l-谷氨酸210g/l,糖酸转化率67%,脯氨酸8g/l,海藻糖6.7g/l,渗透压3500mosm/kg。
[0097]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1