一种VI-B型CRISPR/Cas13基因编辑系统及其应用的制作方法
一种vi-b型crispr/cas13基因编辑系统及其应用
技术领域
[0001]
本发明涉及基因编辑技术领域,尤其涉及一种vi-b型crispr/cas13基因编辑系统及其应用。
背景技术:
[0002]
基因编辑(gene editing)技术使得dna序列定位点进行改造成为可能,比如第一代基因编辑工具锌指核酸酶(zinc finger nucleases,zfns),第二代基因编辑工具类似转录激活的小型核酸酶(transcription activator-like effector nucleases,talens),第三代基因编辑工具中的ii型及v型的crispr(成簇的规律间隔的短回文重复序列,clustered regularly interspaced short palindromic repeat)/cas(crispr-associated protein)都可以用于靶向改造基因组,但这些基因编辑系统只能靶向基因组及外来的dna,而不能对外来的rna进行靶向编辑。
[0003]
vi型的crispr(成簇的规律间隔的短回文重复序列,clustered regularly interspaced short palindromic repeat)/cas(crispr-associated protein)系统,是来自古生菌和细菌的天然免疫系统。其不同于以往基因编辑工具,利用核酸碱基互补配对原理进行目标rna序列的识别,引导cas效应蛋白进行靶向切割,适用性强、设计简单、效率高。其中,vi-b型crispr/cas13基因编辑系统是现下应用较为广泛的vi型crispr/cas系统。这一系统在原核生物中可通过识别并切割靶向的多核苷酸上双侧的原间隔序列侧翼位点pfs(protospacer flanking site)序列,从而对单链rna进行靶向编辑,而在真核生物中,vi-b型crispr/cas系统对rna的靶向编辑作用无pfs序列。
[0004]
在庞大以及各色各样的宏基因组中,隐藏了尚未培养甚至尚未发现的微生物,可能存在大量的未被发现的vi-b型crispr/cas13系统,这些系统在原核生物和真核生物,以及在体外环境中的活性也需要得到证实。
技术实现要素:
[0005]
本发明的目的在于克服现有技术的不足,提供一种vi-b型crispr/cas13基因编辑系统及其应用,本发明的基因编辑系统具有新的理化性质且可以对单链rna进行靶向编辑。
[0006]
为实现上述目的,本发明采取的技术方案为:提供一种vi-b型crispr/ca s13基因编辑系统,包括lt1cas13b蛋白和crispr rna;
[0007]
所述lt1cas13b蛋白为rna核酸内切酶,所述lt1cas13b蛋白具有seq id no:1所示的氨基酸序列,或与seq id no:1所示的氨基酸序列至少80%相同的氨基酸序列。
[0008]
本发明的vi-b型crispr/cas13基因编辑系统,发挥功能的结构包括crrna二级结构、cas13b效应蛋白功能域或cas13b-crrna复合物结构。
[0009]
本发明所述的lt1cas13b蛋白,包含986个氨基酸,是一种多结构域和多功能rna核酸内切酶。它通过两个hepn样核酸酶结构域切割与sgrna互补的单链rna。
[0010]
作为本发明所述vi-b型crispr/cas13基因编辑系统的优选实施方式,所述rna为
原核生物或真核生物的rna。在原核生物中可以识别多种不同的pfs(protospacer flanking site)序列,lt1cas13b蛋白通过不同的核酸酶结构域在pfs序列之间切割与sgrna互补的单链rna。而在真核生物中发挥作用时无pfs(protospacer flanking site)序列,cas13b蛋白核酸酶结构域可不依赖pfs序列切割与sgrna互补的单链rna。
[0011]
在原核生物中,cas13b能够识别多种邻近靶向序列两侧的原间隔序列侧翼位点(pfs)形成rna单链分子的断裂,cas13b蛋白识别靶向序列需要两个重要因素:一是与crrna间隔序列互补的核苷酸,二是互补序列相邻的原间隔序列侧翼位点(protospacer flanking site,pfs)序列。但在真核生物中,cas13b对rna的靶向编辑作用不需要原间隔序列侧翼位点(protospacer flanking site,pfs)序列。因此,根据文献中报道的cas13b的pfs选择设计protospacer序列,通过干扰实验说明cas13b在原核系统里具有切割作用。因为其在真核生物中切割rna不需要pfs,所以通过人为设计crrna中的间隔序列,这种crispr
–
cas13b系统可以靶向真核生物基因组中几乎所有感兴趣的rna序列。
[0012]
作为本发明所述vi-b型crispr/cas13基因编辑系统的优选实施方式,所述crispr rna由crispr array转录生成,所述crispr array包括间隔序列和直接重复序列。
[0013]
由于crispr rna由crispr array转录生成,所以crispr rna也包括间隔序列和直接重复序列,且crispr rna序列从5端到3端为:5
’-
间隔序列-直接重复序列-3’。
[0014]
本发明所述的crispr rna(crrna),以碱基互补配对的形式引导cas蛋白识别入侵的外源基因组。细菌在暴露于噬菌体或病毒等入侵时,外源rna的短片段逆转录出dna并作为新的间隔子整合到宿主染色体内的crispr直接重复序列之间,从而提供了感染的遗传记录,当机体再次受到外源基因入侵时,crispr array转录产生前体crrna(pre-crrna),其5'端为间隔子序列,长度为30nt,与来自外来入侵基因的序列互补;3'端为一段重复序列,长度为36nt。pre-crrna在cas13核酸酶的作用下去掉重复序列的上游7nt,形成成熟的crrna。成熟的crrna包含与间隔序列互补的外源rna序列,这段序列通常长23nt,该crrna即可作为cas13b的向导rna(sgrna)。
[0015]
作为本发明所述vi-b型crispr/cas13基因编辑系统的优选实施方式,所述间隔序列长度为23~30个碱基序列。
[0016]
作为本发明所述vi-b型crispr/cas13基因编辑系统的优选实施方式,所述间隔序列如seq id no:4所示。
[0017]
作为本发明所述vi-b型crispr/cas13基因编辑系统的优选实施方式,所述直接重复序列包含2个茎环结构。
[0018]
作为本发明所述vi-b型crispr/cas13基因编辑系统的优选实施方式,所述直接重复序列为36个碱基序列。
[0019]
作为本发明所述vi-b型crispr/cas13基因编辑系统的优选实施方式,所述直接重复序列如seq id no:3所示。
[0020]
作为本发明所述vi-b型crispr/cas13基因编辑系统的优选实施方式,所述crispr rna具有seq id no:2所示的rna序列。
[0021]
本发明还提供所述的vi-b型crispr/cas13基因编辑系统在识别、结合及编辑原核生物或真核生物rna方面的应用。
[0022]
作为本发明所述应用的优选实施方式,所述应用的具体操作如下:
[0023]
(1)将所述lt1cas13b蛋白的表达载体和所述crispr rna的表达载体转化细胞;
[0024]
(2)培养、筛选,获得转化子。
[0025]
本发明的有益效果:
[0026]
(1)本发明通过对宏基因组生物信息学分析,挖掘出一种新的vi-b型crispr/cas13基因编辑系统,该基因编辑系统应用于编辑原核生物或真核生物基因,为基因编辑工具箱提供了新的选择。
[0027]
(2)本发明提供的一种新发现的vi-b型crispr/cas13基因编辑系统,该基因编辑系统具有新的理化性质且可以对单链rna进行靶向编辑。
附图说明
[0028]
图1为本发明的vi-b型crispr/cas13b基因编辑系统组成图。
[0029]
图2为本发明的vi-b型crispr/cas13b基因编辑系统识别的guide rna分子的rna二级结构预测图。
[0030]
图3为本发明的vi-b型crispr/cas13基因编辑系统的干扰实验示意图。
[0031]
图4为确定vi-b型crispr/cas13基因编辑系统在原核生物水平发挥作用的直接重复序列的长度的结果示意图。
[0032]
图5为确定vi-b型crispr/cas13基因编辑系统在原核生物水平的发挥作用的间隔序列的长度的结果示意图。
[0033]
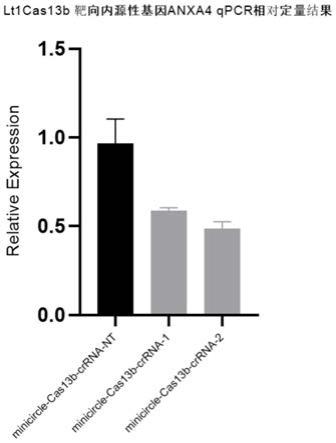
图6为本发明的vi-b型crispr/cas13基因编辑系统靶向切割内源性基因后通过qpcr相对定量得到的相对表达量柱状图。
具体实施方式
[0034]
为更清楚地表述本发明的技术方案,下面结合具体实施例进一步说明,但不能用于限制本发明,此仅是本发明的部分实施例。
[0035]
本发明所涉及的序列有:
[0036]
序列编号lt1cas13b蛋白氨基酸序列seq id no:1crispr rna序列seq id no:2crispr array的直接重复序列seq id no:3crispr array的间隔序列seq id no:4
[0037]
实施例1
[0038]
本实施例分析预测本发明所述的lt1cas13b相关的基因。
[0039]
(1)材料:宏基因组测序数据。
[0040]
(2)软件:fastqc(v0.11.5),fastp(v0.19.8),soapnuke(v1.5.2),hista2(v2.0.4),samtools(v1.9),itools(v0.23),genemark(v3.38),idba-ud(v1.1.3),bowtie2(v2.3.5.1),cd-hit(v4.6),hummer(3.1b2),blast(v2.3.0+),ordination(v1.0),wilcoxontest(v1.0),environmentalcorranalysis(v1.0)
[0041]
(3)检测方法
[0042]
本实施例的数据来源为宏基因组测序数据,通过对宏基因组的数据进行质控、拼
接和基因预测,得到宏基因组中可能的所有的基因序列。
[0043]
对宏基因组的原始数据,具体操作如下:
[0044]
(a)首先用fastqc进行指控,检查数据为原始数据还是清理过的数据,若为原始数据,则接下来使用fastp对原始数据进行清理以及去除接头,若为清理过的数据,则直接进入下一步骤;
[0045]
(b)利用多种二代测序组装软件(如idba-ud、soapdenovo2)对宏基因组数据进行组装,产生长片段contigs序列;
[0046]
(c)去除过短的contig后,再使用genemark软件中的metagenemark,进行基因预测,将得到的基因进行翻译,并过滤掉小于600氨基酸的序列;
[0047]
(d)将候选序列上的蛋白质序列利用orthofinder进行同源性聚类,生成候选蛋白家族,对蛋白家族序列进行多序列比对,确定存在hepn domain模型(e
……
rxxxxh)的候选蛋白家族;构建上述蛋白家族hmm模型,再次进行hmmer搜索比对,扩展蛋白家族;
[0048]
(e)再比对主流数据库(nr,swiss prot)得到未被注释为crispr-cas系统相关蛋白的基因;
[0049]
(f)找回对应cas蛋白的contig序列。
[0050]
实施例2
[0051]
本实施例对得到的可能与2型crispr-cas系统相关的contig进行分析,得到预测的与crispr-cas系统相关的蛋白和相关的元件;即,对实施例1得到的contig做crispr/cas13相关的crispr序列及cas13蛋白预测。
[0052]
(1)材料:实施例1中得到的可能与crispr-cas系统相关的contig序列。
[0053]
(2)软件:crisprcasfinder(v4.2.19),python(v3.7.4),bedtools(v2.25.0)。
[0054]
(3)检测方法:
[0055]
具体操作如下:
[0056]
(a)使用crisprcasfinder对得到的可能与2型crisprcasfinder系统相关的contig进行分析和预测,得到cas蛋白,spacer,direct repeat等crispr-cas系统相关的蛋白和元件;
[0057]
(b)注释候选vi型蛋白家族亚分类:收集cas13a,cas13b,cas13c及cas13d效应蛋白的hmm文件,对蛋白家族进行hmmer比对,根据效应蛋白分类以及是否存在cas1,cas2,csx27,csx28,wyl辅助蛋白将候选vi型蛋白家族分为4种亚型和未知型;
[0058]
(c)构建系统发育树,确定新的vi型效应蛋白:将所有已知的cas13蛋白序列和候选vi型蛋白家族序列构建系统发育树,将发育树上不同于现有cas13蛋白的分支家族确定为新的vi型效应蛋白。
[0059]
本发明的crispr/cas13基因编辑系统组成,如图1所示。由图1可知,本发明所述的lt1cas13b基因编辑系统包含以下组件:核酸内切酶cas13b基因,crrna(包括重复序列和间隔序列)。cas13基因包含986个氨基酸;成熟的crrna引导cas13b蛋白切割靶向目标序列。
[0060]
实施例3
[0061]
本实施例为预测本发明的cas13b基因编辑系统识别的guide rna分子的rna二级结构,得到的rna二级结构如图2所示。
[0062]
(1)材料:repeat序列;
[0063]
(2)软件:nupack(http://www.nupack.org/partition/new);
[0064]
(3)预测方法:通过使用在线应用nupack模拟体外37℃下repeat rna的二级结构,得到图2所示的rna二级结构。
[0065]
由图2可知,pre-crrna在lt1cas13核酸酶的作用下形成成熟的crrna,形成向导rna(guide rna),guide rna包含两个茎环结构。
[0066]
实施例4
[0067]
本实施例通过干扰实验确定本发明的新的vi-b型crispr/cas13基因编辑系统在原核生物水平的切割能力,以及在真核生物当中的潜在基因编辑能力。
[0068]
(1)材料:实施例1-3预测的crispr/cas13基因编辑系统相关基因。
[0069]
(2)验证方法:本实施例对本发明新发现的vi-b型crispr/cas13基因编辑系统构建原核验证体系,验证其切割作用,具体操作如下所示:
[0070]
(a)在pet28a载体上插入本发明所述的新发现的vi-b型crispr/cas13基因编辑系统(包括核酸内切酶cas13b,crispr array),lt1cas13b蛋白进行大肠杆菌密码子优化,在crispr array中添加人为合成的间隔序列,并且在lt1cas13b蛋白、crispr array上源添加强异源启动子j23119,构建原核表达pet28a-cas13b质粒;
[0071]
(b)在pacyc184质粒的氯霉素基因的第一个起始密码子后插入人为合成的与crispr array间隔序列对应的target序列,并在其上下游插入文献报道的pfs序列,构建pacyc184-target质粒;
[0072]
(c)把含有pacyc184-target或空载的pacyc184质粒以及pet28a-cas13b共同电转入大肠杆菌dh5a,37℃复苏1h后按梯度稀释菌液,并滴在含有卡那霉素(50ug/ml)及氯霉素(30ug/ml)双抗性的sob培养基上37℃孵育12-16h,观察不同浓度梯度下的单克隆菌落数。
[0073]
干扰实验结果如图3所示,其结果表明,结合文献报道的pfs序列,通过干扰实验验证cas13b能够在大肠杆菌体内有效靶向切割rna序列。图3右列为lt1cas13b靶向切割目标质粒,图3左列为单独的lt1cas13b,梯度稀释观察单克隆菌落数,发现右列的菌落数明显减少,说明lt1cas13b能够在大肠杆菌体内有效靶向切割rna序列。
[0074]
实施例5
[0075]
本实施例通过干扰实验确定本发明的vi-b型crispr/cas13基因编辑系统在原核生物水平的发挥作用的直接重复序列的长度。
[0076]
材料:实施例1-3预测的crispr/cas13基因编辑系统相关基因。
[0077]
验证方法:本实施例对本发明的vi-b型crispr/cas13基因编辑系统构建直接重复序列分别为36bp、33bp、30bp、25bp、20bp原核验证体系,验证其切割作用,具体操作如下:
[0078]
(a)在pet28a载体上插入本发明的vi-b型crispr/cas13基因编辑系统(包括核酸内切酶cas13b,crispr array),cas13b蛋白进行大肠杆菌密码子优化,逐渐缩短crispr array中的直接重复序列,构建直接重复序列分别为36bp、33bp、30bp、25bp、20bp原核验证体系,在crispr array中添加人为合成的间隔序列,并且在lt1cas13b蛋白序列、crispr array上源添加强异源启动子j23119,构建得到质粒:pet28a-cas13b-36dr、pet28a-cas13b-33dr、pet28a-cas13b-30dr、pet28a-cas13b-25dr、pet28a-cas13b-20dr;
[0079]
(b)在pacyc184质粒的氯霉素基因的第一个起始密码子后插入人为合成的与crispr array间隔序列对应的target序列,构建pacyc184-target质粒;
[0080]
(c)把上述pet28a-cas13b质粒(pet28a-cas13b-36dr、pet28a-cas13b-33dr、pet28a-cas13b-30dr、pet28a-cas13b-25dr、pet28a-cas13b-20dr)以及pacyc184-target共同电转入大肠杆菌dh5a,37℃复苏1h后按梯度稀释菌液,并滴在含有卡那霉素(50ug/ml)及氯霉素(30ug/ml)双抗性的sob培养基上37℃孵育12-16h,观察不同浓度梯度下的单克隆菌落数。
[0081]
结果如图4所示,lt1cas13b有效靶向切割rna所需crrna的dr序列长度为36。
[0082]
实施例6
[0083]
本实施例通过干扰实验确定本发明新的vi-b型crispr/cas13基因编辑系统在原核生物水平的发挥作用的间隔序列的长度。
[0084]
(1)材料:实施例1-3预测的crispr/cas13基因编辑系统相关基因。
[0085]
(2)验证方法:本实施例对本发明新发现的vi-b型crispr/cas13基因编辑系统构建间隔序列分别为23bp、22bp、21bp、20bp,根据实施例5中得出的结论及结合小rna测序的结果将直接重复序列设为36bp,在原核验证体系中验证其切割作用,具体操作如下所示:
[0086]
(a)在pet28a载体上插入本发明新发现的vi-b型crispr/cas13基因编辑系统(包括核酸内切酶cas13b,crispr array),lt1cas13b蛋白进行大肠杆菌密码子优化,将直接重复序列设为36bp,逐渐缩短crispr array中的间隔序列,构建间隔序列分别为23bp、22bp、21bp、20bp原核验证体系,在lt1cas13b蛋白、crispr array上源添加强异源启动子j23119,构建原核表达pet28a-c as13b质粒:pet28a-cas13b-36dr-23spacer、pet28a-cas13b-36dr-22spacer、pet28a-cas13b-36dr-21spacer、pet28a-cas13b-36dr-20spacer;
[0087]
(b)在pacyc184质粒的氯霉素基因的第一个起始密码子后插入人为合成的与crispr array间隔序列对应的target序列,构建pacyc184-target质粒;
[0088]
(c)把上述pet28a-cas13b质粒(pet28a-cas13b-36dr-23spacer、pet28a-cas13b-36dr-22spacer、pet28a-cas13b-36dr-21spacer、pet28a-cas13b-36dr-20spacer)以及pacyc184-target共同电转入大肠杆菌dh5a,37℃复苏1h后按梯度稀释菌液并滴在含有卡那霉素(50ug/ml)及氯霉素(30ug/ml)双抗性的sob培养基上37℃孵育12-16h,观察不同浓度梯度下的单克隆菌落数。
[0089]
结果如图5所示:lt1cas13b有效靶向切割rna所需crrna的间隔序列长度最短为23nt,由此得出间隔序列长度范围为23-30nt。
[0090]
实施例7
[0091]
本实施例通过靶向真核内源性基因anxa4及qpcr相对定量的方法确定本发明的vi-b型crispr/cas13基因编辑系统在真核核生物水平的切割能力。
[0092]
(1)材料:实施例1-3预测的crispr/cas13基因编辑系统相关基因。
[0093]
(2)验证方法:本实施例对vi-b型crispr/cas13基因编辑系统构建真核验证体系,验证其切割作用,具体操作如下:
[0094]
(a)根据下列原则设计靶向内源性基因anxa4的crrna,在anxa4外显子上设计两个靶点crrna-1、crrna-2,取间隔序列(spacer)长度均为23nt:
[0095]
1)crrna包括间隔序列(spacer)和直接重复序列(direct repeat,dr),序列从5端到3端为:5
’-
间隔序列-直接重复序列-3’。
[0096]
2)crrna的间隔序列长度为23~30个碱基序列;
[0097]
3)crrna的间隔序列与anxa4基因的正义链反向互补;
[0098]
4)crrna的直接重复序列为36个碱基序列;
[0099]
5)crrna的直接重复序列应包含2个茎环(stem loop)结构;
[0100]
6)在crrna的间隔序列中间为seed区,与靶序列结合时不能发生错配。
[0101]
(b)在minicircle载体(minicircle载体已于文献[1]darquet am,rangara r,kreiss p,schwartz b,naimi s,dela
è
re p,crouzet j,scherman d.minicircle:an improved dna molecule for in vitro and in vivo gene transfer.gene ther.1999 feb;6(2):209-18.doi:10.1038/sj.gt.3300816.pmid:10435105.[2]chen zy,he cy,ehrhardt a,kay ma.minicircle dna vectors devoid of bacterial dna result in persistent and high-level transgene expression in vivo.mol ther.2003 sep;8(3):495-500.doi:10.1016/s1525-0016(03)00168-0.pmid:12946323.[3]kay ma,he cy,chen zy.a robust system for production of minicircle dna vectors.nat biotechnol.2010 dec;28(12):1287-9.doi:10.1038/nbt.1708.epub 2010 nov 21.pmid:21102455;pmcid:pmc4144359.中公开)上插入本发明的vi-b型crispr/cas13基因编辑系统(包括核酸内切酶lt1cas13b,crispr array),lt1cas13b蛋白进行人源优化,并插入上述设计合成的crrna序列。在lt1cas13b蛋白上源添加启动子ef-1α,在crrna上源添加人源启动子u6,构建真核表达minicircle-cas13b-crrna质粒,包括间隔序列(spacer)靶向内源基因anxa4的minicircle-cas13b-crrna-1、minicircle-cas13b-crrna-2质粒及未靶向任何内源性基因的质粒;
[0102]
(c)将上述构建的minicircle-cas13b-crrna质粒通过hp转染的方式分转入空白的hek293细胞中,以转入minicircle-cas13b-crrna-1、minicircle-cas13b-crrna-2质粒为实验组,以转入minicircle-cas13b-crrna-nt质粒为阴性对照组,另设一组未转质粒的hek293细胞为空白对照,培养48h后收细胞,提取rna,并将其逆转录为cdna,以gapdh为内参基因进行qpcr相对定量分析,观察实验组的目标内源性基因anxa4的相对空白对照组的表达量是否下降。
[0103]
qpcr相对定量结果如图6所示,其结果表明,实验组的目标内源性基因anxa4的相对空白对照组的表达量下降。证明本发明中的vi-b型crispr/cas13基因编辑系统在真核生物中具有靶向切割作用。
[0104]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1