用于实体瘤免疫检查点抑制剂疗法预测的KMT2家族基因变异标志物和试剂盒的制作方法
用于实体瘤免疫检查点抑制剂疗法预测的kmt2家族基因变异标志物和试剂盒
技术领域
[0001]
本发明涉及临床分子诊断学领域,具体而言,涉及一种用于实体瘤免疫检查点抑制剂疗法预测的kmt2家族基因变异标志物和试剂盒。
背景技术:
[0002]
肿瘤免疫治疗现已发展得如火如荼,其中免疫检查点抑制剂(抗pd-1/pd-l1抑制剂)更是近年肿瘤治疗领域的“明星”药物,已进入非小细胞肺癌、黑色素瘤以及肾癌等实体瘤的一线治疗。但是我们也要看到虽然免疫检查点抑制剂效果不错,但整体orr依然只有20%左右,所以如何精准筛选获益人群成为临床医生迫切需要解决的问题。
[0003]
pd-l1,tmb(肿瘤突变负荷,tumor mutational burden)以及msi(微卫星不稳定,microsatellite instability)是三个获得fda认可或nccn指南推荐的免疫治疗生物标志物(biomarker),但是这三个生物标志物各有优缺点。pd-l1作为免疫治疗biomarker应用最为广泛,pd-l1 ihc检测也被fda获准作为pembrolizumab一线用药的伴随诊断。但是,多个临床试验结果显示pd-l1表达对免疫治疗疗效的预测能力并不一致,部分pd-l1阴性患者依然能从免疫治疗获益,且持续缓解时间并不逊于pd-l1阳性患者;tmb同样是非小细胞肺癌nccn指南推荐的免疫治疗biomarker,但是鉴于不同公司或实验室对于tmb算法的不同,tmb阈值难以建立共识;msi已经作为肿瘤关键biomarker让fda同意基于msi状态,而不是组织病理类型,进行用药治疗,但是肿瘤中msi-h比例太低,临床推广有一定局限性。最重要的一点就是现有研究(纳入11348例实体瘤)发现,pd-l1阳性、tmb高表达以及msi-h三者重叠率仅为0.6%,提示任一biomarker单用都会遗漏很多潜在免疫治疗获益人群。所以需要进一步探索免疫治疗biomarker。
[0004]
随着二代测序在肿瘤精准治疗中的开展日益广泛,特定基因的体细胞突变被发现可能影响肿瘤免疫功能或对免疫治疗的响应,即提示特定体细胞突变可能是潜在的免疫治疗预测因子。egfr突变和alk重排是ici免疫治疗不良预后的潜在预测因子。一项回顾性分析发现,这些患者中只有3.6%对ici免疫治疗有反应,而egfr野生型和alk阴性或未知患者的反应率为23.3%。对包括使用pd-(l)1抑制剂治疗的3025名晚期nsclc患者的5项试验进行的荟萃分析发现,在egfr突变的患者中,与多西他赛相比,总体生存率没有改善。egfr突变或alk重排的肺癌显示较低的pd-l1和cd8+t细胞浸润,这可能是ici免疫治疗反应不佳的原因。除了egfr和alk的改变tp53和kras的协同突变以及同源重组修复和错配修复(hrr-mmr)或hrr和碱基切除修复(hrr-ber)的dna损伤反应(ddr)通路中的协同突变被认为是ici免疫治疗疗效较好的正向预测因子,而kras和stk11的协同突变与ici免疫治疗不良预后有关。但是以上这些基因突变作为biomarker依然不能覆盖所有潜在免疫治疗获益人群。pd-l1检测由于不同抗pd-(l)1药物都有各自对应的pd-(l)1检测抗体和平台,导致缺乏统一的标准;另外pd-l1的表达具有动态变化的特点,导致pd-l1表达与免疫治疗效果之间的关系仍有一些争议;另一方面,虽然大量随机对照研究和大样本真实世界研究都已证实tmb与免
疫疗效之间的相关性,但是tmb依然只能反映肿瘤突变数量,而不能提示肿瘤微环境的状态,且tmb检测对技术平台要求较高,工作周期较长,成本较高都制约其临床应用。因此,本领域仍然需要更高效、更准确地鉴定适用于免疫检查点抑制剂治疗的实体瘤患者的方法和工具。
技术实现要素:
[0005]
本发明涉及使用kmt2家族基因变异作为生物标志物来预测癌症患者对免疫检查点抑制剂疗法的敏感性。
[0006]
具体的,本发明涉及一种标志物,其用于预测实体瘤患者对免疫检查点抑制剂疗法敏感性,和/或用于预测实体瘤患者肿瘤突变负荷程度,所述标志物包括变异的kmt2家族基因;
[0007]
所述kmt2家族基因选自kmt2a、kmt2c、kmt2d中的至少一种。
[0008]
根据本发明的再一方面,本发明还涉及一种试剂盒,其用于预测实体瘤患者对免疫检查点抑制剂疗法敏感性,和/或用于预测实体瘤患者肿瘤突变负荷程度,所述试剂盒包括kmt2家族基因变异的检测剂;
[0009]
所述kmt2家族基因选自kmt2a、kmt2c、kmt2d中的至少一种。
[0010]
本发明的有益效果为:
[0011]
本发明中筛选kmt2家族基因变异作为预测实体瘤患者中对免疫检查点抑制剂疗法敏感的群体的生物标志物,相对于其他基因组合的共突变而言,预测结果更精准;且本发明中采用的kmt2家族基因变异在实际应用中可以作为独立预测风险因素,提高检测效率。该方法有利于简化检测内容,降低患者检测成本,加快检测报告出具时间,且相比pd-l1免疫组化方法需要人工判读免疫组化片子以及tmb需要人为确定阈值这两点来说,且基因突变状态的检测更为可靠。
附图说明
[0012]
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0013]
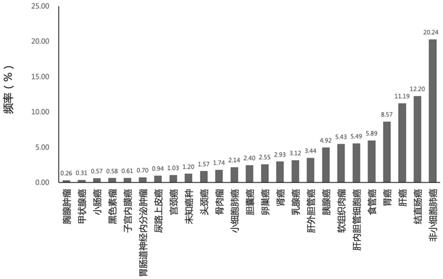
图1为本发明一个实施例中10010例中国实体瘤患者癌症类型分布百分比;
[0014]
图2为本发明一个实施例中kmt2(a/c/d)家族基因在实体瘤中突变频率分布;
[0015]
图3为本发明一个实施例中kmt2(a/c/d)家族基因在突变频率分布;
[0016]
图4为本发明一个实施例中kmt2家族基因(kmt2a/c/d)在实体瘤中不同变异形式的突变频率分布;
[0017]
图5为本发明一个实施例中kmt2家族基因(kmt2a/c/d)变异与野生型患者肿瘤突变负荷(tmb)的比较;
[0018]
图6为本发明一个实施例中kmt2家族基因(kmt2a/c/d)不同变异个数间肿瘤突变负荷(tmb)的比较;
[0019]
图7为本发明一个实施例中kmt2 a/c/d变异与野生型患者肿瘤突变负荷(tmb)的
比较;
[0020]
图8为本发明一个实施例中kmt2家族基因(kmt2a/c/d)突变位点分析图;
[0021]
图9为本发明一个实施例中kmt2家族基因(kmt2a/c/d)变异与野生型患者接受使用免疫检查点抑制剂的免疫疗法的疗效比较;
[0022]
图10为本发明一个实施例中cox多因素回归分析与使用免疫检查点抑制剂的免疫疗法疗效相关的独立风险因素;
[0023]
图11为本发明一个实施例中kmt2家族基因变异个数与野生型患者肿瘤突变负荷(tmb)的比较;
[0024]
图12为本发明一个实施例中kmt2家族基因(kmt2a/c/d)变异个数与野生型患者接受使用免疫检查点抑制剂的免疫疗法的疗效比较(a)以及独立风险因素展示(b)。
具体实施方式
[0025]
现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
[0026]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
[0027]
本发明涉及一种标志物,其用于预测实体瘤患者对免疫检查点抑制剂疗法敏感性,和/或用于预测实体瘤患者肿瘤突变负荷程度,所述标志物包括变异的kmt2家族基因;
[0028]
所述kmt2家族基因选自kmt2a、kmt2c、kmt2d中的至少一种。
[0029]
根据本发明的再一方面,本发明还涉及一种试剂盒,其用于预测实体瘤患者对免疫检查点抑制剂疗法敏感性,和/或用于预测实体瘤患者肿瘤突变负荷程度,所述试剂盒包括kmt2家族基因变异的检测剂;
[0030]
所述kmt2家族基因选自kmt2a、kmt2c、kmt2d中的至少一种。
[0031]
另外,本发明还涉及如上所定义的kmt2家族基因变异的检测剂在制备用于预测实体瘤患者对免疫检查点抑制剂疗法敏感性,或者在制备用于预测实体瘤患者肿瘤突变负荷程度的试剂盒的试剂盒中的应用。
[0032]
如本文所用,术语“免疫检查点”是指免疫系统中存在的一些抑制性信号通路。机体在正常情况下,免疫检查点可以通过调节自身免疫反应的强度来维持免疫耐受,然而机体在受到肿瘤侵袭时,免疫检查点的激活会抑制自身免疫,有利于肿瘤细胞的生长和逃逸。通过使用免疫检查点抑制剂,可以恢复机体正常的抗肿瘤免疫反应,从而控制和清除肿瘤。
[0033]
本发明所述免疫检查点包括但不限于程序性死亡受体1(pd1)、pd-l1、细胞毒性t淋巴细胞相关抗原4(ctla-4);也包括一些新发现的免疫检查点例如淋巴细胞活化基因3(lag3)、cd160、t细胞免疫球蛋白和粘蛋白-3(tim-3)、t细胞活化的v结构域免疫球蛋白抑制剂(vista)、腺苷a2a受体(a2ar)等等。
[0034]
优选的免疫检查点抑制剂为pd1抑制剂和/或pd-l1抑制剂。
[0035]
所述pd1抑制剂进一步可以选择为nivolumab(opdivo;bms-936558)、pembrolizumab(mk-3475)、jembrolizumab、lambrolizumab、pidilizumab(ct-011)特瑞普利单抗(js001)以及ipilimumab中的一种或多种。
[0036]
所述pd-l1抑制剂进一步可以选择为atezolizumab(mpdl3280a)、js003、durvalumab、avelumab、bms-936559、medi4736以及msb0010718c中的一种或多种。
[0037]
术语“突变负荷”、“突变负荷(mutation burden)”和“突变负荷(mutational burden)”在本文中可互换使用。在肿瘤的背景下,突变负荷在本文中又称为“肿瘤突变负荷”、“肿瘤突变负荷”或“tmb”。
[0038]
在本发明中,基因变异可以包括点突变(point mutation)和片段突变(fragment mutation);点突变可以是单核苷酸多态性(snp)、碱基取代,单碱基插入或碱基缺失,或沉默突变(例如,同义突变);片段突变可以是融合/重排突变,扩增突变、插入/缺失和截短突变。
[0039]
在一些实施方案中,所述基因变异包括融合/重排突变、插入/缺失和截短突变中的至少一种。
[0040]
在一些实施方案中,评估kmt2家族三基因(kmt2a-gene id:4297nm_005933;kmt2c-gene id:58508nm_170606;kmt2d-gene id:8085nm_003482)突变包括确定其编码区是否存在突变,例如移码突变。在一些实施方案中,所述突变在kmt2家族(a/c/d)三基因的kmt2a中位于22-11940位核苷酸、kmt2c的218-14953位核苷酸、kmt2d的1220-17833位核苷酸。在一些优选实施方案中,评估kmt2家族基因(kmt2a/c/d)突变包括确定其编码区是否存在使kmt2(a/b/c)家族三蛋白截短的突变。
[0041]
在一些实施方式中,所述实体瘤患者所罹患的肿瘤选自非小细胞肺癌、结直肠癌、肝癌、胃癌、食管癌、肝内胆管细胞癌、软组织肉瘤、胰腺癌、肝外胆管癌、乳腺癌、肾癌、卵巢癌、胆囊癌、小细胞肺癌、骨肉瘤、头颈癌、宫颈癌、尿路上皮癌、胃肠道神经内分泌肿瘤、子宫内膜癌、黑色素瘤、小肠癌、甲状腺癌和胸腺肿瘤
[0042]
在一些实施方式中,所述实体瘤为临床分期为iii期和/或iv的实体瘤。
[0043]
iii期:分为iiia和iiib期。许多iiia期和几乎所有iiib期的肿瘤很难或是根本无法手术切除。例如,肿瘤累及纵膈淋巴结,或肿瘤侵犯肺内邻近结构。还有一种情况,由于各种因素,肿瘤无法一次完整切除,只能分多次取出,这种情况很难彻底清除肿瘤。
[0044]
iv期:包括:癌细胞转移至对侧肺的多个部位,或肺周围或心脏周围积液,或经血流转移至身体其他部位。癌细胞一旦进入血流,可以转移至身体的任何部位,但更多见的转移部位是脑、骨、肝和肾上腺。
[0045]
鉴于kmt2家族基因为一种能够编码蛋白质的基因,可编码组蛋白赖氨酸甲基转移酶2,因而其基因的突变通常也会表现在转录水平和反应水平上,本领域技术人员可以从rna和蛋白水平对其突变进行检测以间接反映其是否发生基因变异,这些都可以应用于本发明。
[0046]
在一些实施方式中,所述检测剂于核酸水平进行检测。
[0047]
核酸水平(dna或rna水平)的检测剂可选用本领域技术人员所公知的试剂,例如能够与该dna或rna杂交,且标记有荧光标记的核酸(通常为探针或引物)等。并且本领域技术人员也容易想到将mrna反转录成cdna后对cdna进行检测,这些技术手段的常规置换不超出
本发明的保护范围。
[0048]
在一些实施方式中,所述检测剂用于执行以下任一种方法:
[0049]
聚合酶链反应、变性梯度凝胶电泳、核酸测序法、核酸分型芯片检测、变性高效液相色谱法、原位杂交、生物质谱法以及hrm法。
[0050]
在一些实施方式中,所述聚合酶链反应选自限制性片段长度多态性法、单链构象多态性法、taqman探针法、竞争性等位基因特异性pcr和等位基因特异性pcr。
[0051]
在一些实施方式中,所述生物质谱法选自飞行质谱仪检测。
[0052]
在一些实施方式中,所述核酸测序法选自snapshot法。
[0053]
在本发明的一些实施方式中,所述核酸测序法可以为转录组测序或基因组测序。在本发明另外一些实施方案中,所述核酸测序法是高通量测序,也称作二代测序(“ngs”)。二代测序在并行的测序过程中同时产生数千至数百万条序列。ngs区别于“sanger测序”(一代测序),后者是基于单个测序反应中的链终止产物的电泳分离。可用本发明的ngs的测序平台是商用可得的,包括但不限于roche/454flx、illumina/solexa genomeanalyzer和applied biosystems solid system等。转录组测序也可以通过二代测序平台快速全面地获得某一物种特定细胞或组织在某一状态下的几乎所有的转录本及基因序列,可以用于研究基因表达量、基因功能、结构、可变剪接和新转录本预测等。
[0054]
在一些实施方式中,所述检测剂于蛋白水平进行检测。
[0055]
在一些实施方式中,所述检测剂用于执行以下任一种方法:
[0056]
生物质谱法、氨基酸测序法、电泳法以及用特异性针对突变位点所设计的抗体进行检测。
[0057]
用特异性针对突变位点所设计的抗体进行检测的方法进一步可以为免疫沉淀、免疫共沉淀、免疫组化、elisa以及western blot等。
[0058]
在一些实施方式中,所述试剂盒还包括样品的处理试剂;进一步地,所述样品的处理试剂包括样品裂解试剂、样品纯化试剂以及样品核酸提取试剂中的至少一种。
[0059]
在一些实施方式中,所述样品选自所述实体瘤患者的血液、血清、血浆、脑脊髓液、组织或组织裂解液、细胞培养上清、精液以及唾液样品中的至少一种。
[0060]
本文使用的“组织或组织裂解液”也可与“裂解物”、“裂解的样品”、“组织或细胞提取物”等用语通用,表示包含裂解的组织或细胞的样品和/或生物样品材料,即其中组织或细胞的结构完整性已经被破坏。为了释放细胞或组织样品的内容物,通常用酶和/或化学试剂处理所述材料,以溶解、降解或破坏这样的组织或细胞的细胞壁和细胞膜。熟练的技术员非常熟悉用于得到裂解物的适当方法。该过程被术语“裂解”包括,通常该过程需要使用样品裂解试剂和/或样品纯化试剂。
[0061]
在一些实施方式中,所述组织为癌组织或癌旁组织。
[0062]
在一些实施方式中,所述组织为原发灶。
[0063]
检测样品还可以为血液、血清、血浆,在一些实施方式中它们来自外周血。
[0064]
根据本发明的再一方面,本发明还提供了一种用于预测实体瘤患者对免疫检查点抑制剂疗法敏感性的方法,所述方法包括:
[0065]
使用如上所述的检测剂测量kmt2家族基因变异的存在与否。
[0066]
诊断的理想场景是这样的情形,其中单一事件或过程会造成各种疾病,例如,在感
染性疾病中。在所有其它情况下,正确的诊断可能非常困难,尤其当疾病的病因学不能完全理解时,如在许多癌症类型的情况下。如熟练的技术人员将明白的,对于给定的多因子病,没有生化标志物的诊断是100%特异性且同100%灵敏度。相反地,可使用生化标志物(例如,kmt2家族基因变异)来以某种可能性或预测值评估例如疾病的存在与否或严重性。因此,在常规的临床诊断中,通常综合考虑各种临床症状和生物学标志物来诊断、治疗和控制潜在的疾病。
[0067]
在一些实施方式中,所述方法用于实体瘤患者在进行免疫检查点抑制剂疗法后的预后评估。
[0068]
下面将结合实施例对本发明的实施方案进行详细描述。
[0069]
实施例
[0070]
本发明实施例所采用的研究方法如下:
[0071]
全面的基因组分析
[0072]
研究了来自中国实体瘤癌患者的ffpe肿瘤样品和配对的外周全血对照样品。所有患者均提供书面知情同意书。在origimed进行靶向捕获的下一代测序(ngs),涉及包含450个癌症相关基因的组合。通过dna ffpe tissue kit和dna mini试剂盒(qiaamp)分别从肿瘤含量不低于20%的全部未染色ffpe切片和全血中提取dna,然后用dsdna hs测定试剂盒(qubit)定量。使用kapa hyper prep kit(kapa biosystems)将~250bp超声处理的dna片段化构建文库,然后进行pcr扩增和定量。使用自定义组合进行杂交捕获,该组和覆盖了2.6mb的人类基因组,靶向450个癌症相关基因和某些经常重排的内含子。将捕获后的文库混合、变性并稀释至1.5~1.8pm,随后按照制造商的方案在illumina nextseq 500上进行配对末端测序。
[0073]
其中样品使用以下三组引物对扩增actin基因来进行质量检测:
[0074]
i)5
’-
cacactgtgcccatctatgagg-3’和5
’-
cacgctcggtgaggatcttc-3’,
[0075]
ii)5
’-
cacactgtgcccatctatgagg-3’和5
’-
tcgaagtccagggcaacatagc-3’,和
[0076]
iii)5
’-
cacactgtgcccatctatgagg-3’和5
’-
aaggctggaagagcgcctcggg-3’,其分别扩增100bp、200bp和300bp的片段。当三组引物均扩增到目的片段时判定组织样品质量合格。
[0077]
基因组改变分析
[0078]
评估了基因组改变,包括单碱基取代(snv)、短和长插入缺失、拷贝数变异(cnv)和基因重排和融合。使用burrows-wheeler aligner进行原始读段与人类基因组参考序列(hg19)的比对,然后使用picard的markduplicates算法进行pcr去重。读取深度小于30x,链偏好性(strand bias)大于10%或vaf<0.5%的变体被移除。定义为来自dbsnp数据库(版本147)的或频率超过外显子组测序项目6500(esp6500)的1.5%的或超过1000基因组计划的1.5%的常见单核苷酸多态性(snp)也被排除在外。通过以下标准判断所鉴别的突变是否为真:
[0079]
(1)对于点突变:
[0080]
该点突变所在位置的测序覆盖深度>500次;包含该点突变的每个读段质量值>40,包含该点突变的每个读段上与该点突变相对应的碱基质量值>21;包含有该点突变的读段的条数≥5条;包含有该点突变的所有读段中正向的读段与反向的读段比例<1/6;和肿瘤组
织的变异等位基因频率/对照组织的变异等位基因频率≥20;
[0081]
(2)对于插入缺失(indel):
[0082]
如果插入缺失中连续相同的碱基<5,则该插入缺失所在位置的测序覆盖深度>600次;包含该插入缺失的每个读段质量值>40;包含该插入缺失的每个读段上与该插入缺失突变相对应的碱基质量值>21;包含有该插入缺失的读段的条数≥5条;包含有该插入缺失的所有读段中正向的读长与反向的读长比例<1/6;所述肿瘤组织的变异等位基因频率/对照组织的变异等位基因频率≥20;
[0083]
如果插入缺失中连续相同的碱基≥5且<7,则该插入缺失所在位置的测序覆盖深度>60次;包含该插入缺失的每个读段质量值>40;包含该插入缺失的每个读段上与该插入缺失突变相对应的碱基质量值>21;包含有该插入缺失的读段的条数≥5条;包含有该插入缺失的所有读段中正向的读长与反向的读长比例<1/6;所述肿瘤组织的变异等位基因频率/对照组织的变异等位基因频率>20;且所述肿瘤组织的变异等位基因频率≥10%;
[0084]
如果插入缺失中连续相同的碱基≥7,则该插入缺失所在位置的测序覆盖深度>60次;包含该插入缺失的每个读段质量值>40;包含该插入缺失的每个读段上与该插入缺失突变相对应的碱基质量值>21;包含有该插入缺失的读段的条数≥5条;包含有该插入缺失的所有读段中正向的读长与反向的读长比例<1/6;所述肿瘤组织的变异等位基因频率/对照组织的变异等位基因频率>20;且所述肿瘤组织的变异等位基因频率≥20%。
[0085]
(3)扩增突变
[0086]
指基因拷贝数变异的变异类型。扩增就是拷贝数增多的cnv。cnv,即拷贝数变异,一般指长度为1kb到几个mb基因组大片段的拷贝数复制、缺失。
[0087]
tmb计算
[0088]
除了基因组改变的常规检测之外,tmb也通过基于ngs的算法确定。通过计数体细胞突变来估计tmb,所述体细胞突变包括所检查的编码区序列的每兆碱基的snv和插入缺失。排除了dbsnp中的驱动基因突变和已知的种系改变。
[0089]
免疫组化
[0090]
如前所述进行免疫组织化学(ihc)染色程序[19]。简而言之,进行脱蜡、再水化和靶标回收,然后与针对pd-l1的单克隆抗体(dako,克隆22c3和28-8)一起孵育。将载玻片与即用型显色试剂一起孵育,所述显色试剂由二抗分子和与葡聚糖聚合物主链偶联的辣根过氧化物酶(hrp)分子组成。随后加入发色团和增强剂进行的酶促转化导致可见反应产物在抗原位点沉淀。然后将样品用苏木精复染。
[0091]
公共数据库队列数据获取
[0092]
为了进一步验证kmt2家族基因变异对于免疫检查点抑制剂治疗的临床预测作用,我们在肿瘤基因组学数据库cbioportal网站(http://www.cbioportal.org/)中下载了一个纳入1610例实体瘤队列数据,包括患者临床基线资料、免疫检查点抑制剂治疗疗效评估数据以及患者基因组数据。
[0093]
实施例1患者临床特征
[0094]
总共有10010名中国实体瘤患者参与了这项研究。患者的主要瘤种分布如图1所示:10010患者中非小细胞肺癌2026例(20.24%),肝癌1120例(11.19%),胃癌858例(8.57%),食管癌590例(5.89%),胆管癌550例(5.49%),软组织肉瘤544例(5.43%),胰腺
癌492例(4.92%)(详见图1)。
[0095]
患者临床特征如表1所示。kmt2家族基因(kmt2a/c/d)突变与野生型两组患者的性别比例没有显著性差异,发生kmt2家族基(kmt2a/c/d)突变患者中位诊断年龄高于野生型患者(59vs.57,p<0.001)。对10100例患者进行tmb检测结果显示整体人群的tmb中位数为4.6muts/mb,kmt2家族基因(kmt2a/c/d)突变患者tmb显著高于野生型(9.2vs.4.3,p<0.001)。病理分期以iv期偏多(17.52%vs.17.42%vs.26.55%vs.29.02%,p=0.001)。
[0096]
表1.实体瘤患者临床特征
[0097]
[0098][0099]
实施例2致病性kmt2家族基因(kmt2a/c/d)突变在中国实体瘤癌人群中的发生频率以及和免疫治疗生物标志物tmb之间的相关性
[0100]
在10010名中国人群实体瘤患者中有1231名患者携带kmt2家族基因(kmt2a/c/d)突变,总体突变比例为12.30%。其中尿路上皮癌(40.43%),宫颈癌(29.13%),小细胞肺癌(26.64%),食管癌(23.05%),结直肠癌(14.33%),胃癌(14.57%)突变比例较高(详见图2)。
[0101]
kmt2a、kmt2c和kmt2d在中国实体瘤患者中的突变比例分别为1.56%,5.78%和6.07%(图3)。
[0102]
kmt2家族基因(kmt2a/c/d)三基因主要变异形式的突变频率见图4.,kmt2a变异类型包括0.31%扩增,0.37%融合/重排,6.62%点突变和插入/缺失,3.25%截短变异;kmt2c变异类型包括0.25%纯合缺失,0.80%融合/重排,21.09%点突变和插入/缺失,19.01%截短变异;kmt2d变异类型包括0.25%基因扩增,1.23%融合/重排,14.16%点突变和插入/缺失,32.68%截短变异。
[0103]
全瘤种中,kmt2家族基因(kmt2a/c/d)三基因变异患者的tmb显著高于野生型(中位tmb:9.2vs.4.3,p<2.22e-16)(图5);
[0104]
kmt2家族基因(kmt2a/c/d)三基因中突变个数越多,tmb越高(0:中位tmb=4.3vs.1:中位tmb=8.3vs.2:中位tmb=33.2vs.3:中位tmb=99.55,p-value<2.2e-16)(图6)。
[0105]
全瘤种中,kmt2a基因变异患者的tmb显著高于野生型(中位tmb:12.4vs.4.6,p<2.22e-16);kmt2c基因变异患者的tmb显著高于野生型(中位tmb:10.0vs.4.6,p<2.22e-16);kmt2d基因变异患者的tmb显著高于野生型(中位tmb:10.0vs.4.6,p<2.22e-16),详见图7。
[0106]
kmt2家族基因(kmt2a/c/d)三基因突变位点比较分散,没有明显的热点突变区域(图8)。
[0107]
实施例3 kmt2家族基因(kmt2a/c/d)变异作为免疫治疗biomarker的临床数据验证
[0108]
为了进一步验证kmt2家族基因(kmt2a/c/d)突变对于免疫检查点抑制剂(icis)治疗的预测价值,我们通过下载公共数据库队列信息进行外部验证。我们在cbioportal网站(http://www.cbioportal.org/)下载了robert m.samstein等人上传的队列数据,robert m.samstein队列纳入了1610名接受抗pd-(l)1单药治疗或抗pd-(l)1+抗ctla-4联合治疗方案的实体瘤癌患者,具体患者基线资料可参考文献(samstein rm,lee c-h,shoushtari an et al.tumor mutational load predicts survival after immunotherapy across multiple cancer types.nature genetics 2019.)。1610个患者中,kmt2家族基因(kmt2a/c/d)突变患者有392名(24.35%),kmt2家族基因(kmt2a/c/d)变异组的患者接受免疫治疗后的中位总生存时间(median os)较kmt2家族基因(kmt2a/c/d)野生型患者延长(中位os:35vs.16月,p=5e-04)(图9的a图),在kmt2a突变患者、kmt2c突变患者和kmt2d突变患者中,中位总生存时间显著长于野生型患者(图9的b图-d图)。cox多因素分析结果进一步说明kmt2家族(kmt2a/c/d)三基因变异是免疫治疗预后的独立预测风险因素(hr:0.75,95%ci:0.63-0.90,p=0.002)(图10的a图)。
[0109]
进一步分析kmt2家族基因突变个数与免疫治疗疗效的相关性,robert m.samstein队列中1218例为kmt2家族基因野生型(突变个数0),291例有一个kmt2家族基因突变(突变个数1),81例有2个kmt2家族基因突变(突变个数2),20例有3个kmt2家族基因突变(突变个数3),随着kmt2家族基因突变个数增加,tmb逐渐升高,突变个数3组的tmb显著高于其他三组(p<2.2e-16)(图11)。同样生存分析结果也显示kmt2基因突变个数≥2组的中位os显著长于突变个数=1组以及没有kmt2基因突变组(p=0.0028)(图12的a图)。kmt2基因突变个数≥2组的中位os为na(95%ci:27-na),kmt2基因突变个数<2组的中位os为32(95%ci:17-58),kmt2基因突变个数为0(野生型)组的中位os为17(95%ci:15-19)。cox多因素回归分析进一步证实kmt2家族基因突变个数大于等于2个是免疫治疗独立预测因素。kmt2基因突变≥2组vs.kmt2基因突变个数为0(野生型):hr:0.52,95%ci:0.34-0.78,p=0.002;但是尚无充分证据证明在kmt2基因突变个数=1组vs.kmt2基因突变个数为0(野生型)是稳定的预测因素:hr:0.85,95%ci:0.70-1.04,p=0.114(图12的b图)。
[0110]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实
施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0111]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1