一种PARP蛋白降解剂及其制备方法与应用与流程
一种parp蛋白降解剂及其制备方法与应用
技术领域
1.本发明涉及抗肿瘤药物制备领域,具体涉及一种靶向降解parp蛋白的化合物及其制备方法与应用。
背景技术:
2.聚二磷酸腺苷核糖聚合酶[poly(adp-ribose)polymerase,parp]是一种与dna修复,尤其是dna单链损伤ber修复密切相关的核酶,包括18种亚型,其中parp-1在真核细胞内含量最高。当肿瘤细胞dna受到化疗药物或电离辐射等损伤时,parp-1很快被激活,并以nad+为底物,将聚腺苷二磷酸核糖基(adp)转移到特定蛋白,parp-1催化特定蛋白聚腺苷二磷酸核糖化(par化),启动dna修复过程。研究表明,parp-1参与了ber、hr和nhej等dna修复途径。
[0003]
parp抑制剂能够通过抑制papr的par化功能使受损dna不能及时得到有效修复,或者parp抑制剂结合到parp1(或parp2)的nad+结合口袋,造成构象异构,使parp被捕获在受损dna处,无法进行后续的修复,二者均可对肿瘤细胞起到杀伤作用。虽然parp抑制剂在临床已取得惊人的成果,但传统parp小分子抑制剂并不能影响parp蛋白的含量,一旦停药,parp蛋白可以很快恢复活性;易出现耐药的现象。而基于protac技术的parp蛋白降解剂,即使停药之后,肿瘤细胞也需要一定时间来恢复核内parp蛋白的含量,可有效持久地抑制肿瘤的生长。
[0004]
目前,已报道了几种parp1/2降解剂,包括化合物1zhao,q.;lan,t.;su,s.;rao,y.induction of apoptosis in mda-mb-231breast cancer cells by a parp1-targeting protac small molecule.chem.comm.2019,55,369-372.化合物2(irucaparib-ap5),3(irucaparib-ap6),和4(iveliparibap6)wang,s.;han,l.;han,j.;li,p.;ding,q.;zhang,q.-j.;liu,z.-p.;chen,c.;yu,y.uncouplingof parp1 trapping and inhibition using selective parp1 degradation.nat.chem.biol.2019,15,1223-1231.化合物5.cao,c.-g.;yang,j.;chen,y.-w.;discovery of sk-575as a highly potent and efficacious proteolysis targeting chimera(protac)degrader of parp1 for treating cancers.j.med.chem 2020.doi:10.1021/acs.jmedchem.0c00821。
[0005][0006]
基于niraparib衍生物和nutlin-3衍生物的化合物1在mda-mb-231细胞中特异性诱导parp1裂解和细胞凋亡。据报道,通过使用不同长度的所有聚乙二醇(peg)接头制备的化合物2和3是有效且有效的parp1降解剂,其化合物对大鼠新生心肌细胞最大降解浓度(dc50)分别为36nm和82nm。但是,这些化合物不能完全降解细胞内parp1蛋白,从而限制了它们的治疗效果。
技术实现要素:
[0007]
为了克服现有技术的不足,本发明提供一种parp蛋白降解剂及其制备方法与应用,该化合物采用的是双靶点分子结构,通过protac(proteolysis-targeting chimeras)技术,即利用细胞内负责清除残次蛋白的泛素化降解系统,达到靶向降解目标蛋白。该类分子的一端的结构靶向结合e3连接酶mdm2,另外一端的结构靶向结合parp蛋白,两端的结构通过链(linker)相连接,形成一个完整的化合物分子,该化合物通过e3连接酶泛素化目标蛋白并引导目标蛋白进入蛋白酶体降解系统,对目标蛋白特异性降解。
[0008]
本发明所提供的化合物相比于parp抑制剂尼拉帕尼可较低浓度在诸如mda-mb-231的乳腺癌细胞中起到增殖抑制的作用。因此该化合物在抗肿瘤领域有潜在的应用价值。
[0009]
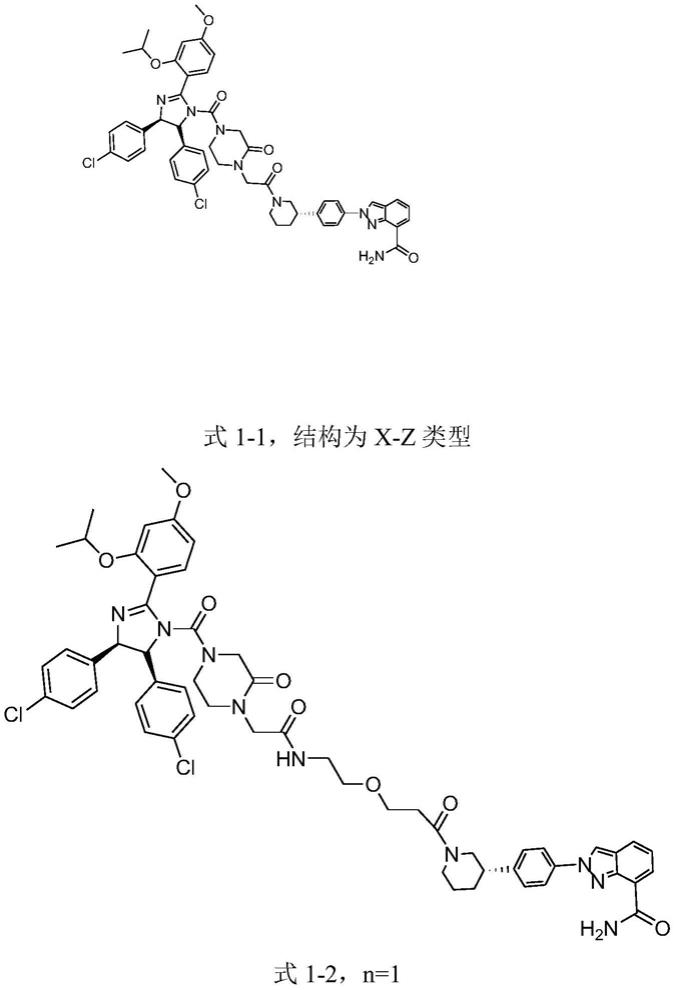
详言之,一种parp蛋白降解剂,如式
ⅰ-
1或
ⅰ-
2所示:
[0010]
x-y-z(
ⅰ-
1)或x-z(
ⅰ-
2)
[0011]
其中,x表示parp蛋白的配体,z表示e3连接酶的配体,y表示连接x和z的链;
[0012]
所述x为式
ⅱ-
1,所述z为式
ⅱ-
2所示的化合物,
[0013][0014]
所述y为式
ⅲ-
1所示的化合物,所述y为式
ⅲ-
1所示的化合物,
[0015][0016]
各n分别独立地为1-10之间的整数
[0017]
详言之,该parp蛋白降解剂为:
[0018][0019]
式1-1,结构为x-z类型
[0020][0021]
式1-2,n=1
[0022][0023]
式1-3,n=2
[0024][0025]
式1-4,n=3
[0026][0027]
式1-5,n=4
[0028][0029]
式1-6,n=5
[0030]
上述化合物的制备工艺如下:
[0031]
附图说明
[0032]
图1为本发明实施例4所示parp蛋白降解剂对不同的肿瘤细胞系的parp蛋白降解示意图,可见,式1-4所示的化合物nn3显著降解mda-mb-231、mcf-7parp蛋白。
具体实施方式
[0033]
下面将进一步详细描述本发明的实施例,所述实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
[0034]
实施例1式1-1所示的化合物的制备
[0035][0036]
式1-1
[0037]
nutlin酸中间体(123.31mg,0.25mmol),hatu(70mg,0.184mmol)和diea(90μl)的混合物将干燥的dmf(3.78ml)在圆底烧瓶中在室温下搅拌0.5小时。然后,加入尼拉帕尼(79mg,0.25mmol)的0.5ml无水dmf溶液慢。将反应混合物在室温下搅拌12小时。通过淬灭反应将水和混合物用饱和nacl水溶液洗涤一次,用乙醚萃取乙酸乙酯。将有机层用无水na2so4干燥,并蒸发真空得到粗产物,将其通过硅胶柱进一步纯化色谱法(dcm:meoh=40:1),得到产物。
[0038]1h nmr(400mhz,chloroform-d)δ9.18
–
8.96(m,1h),8.54(d,j=5.4hz,1h),8.32(dd,j=6.7,3.6hz,1h),7.99
–
7.75(m,3h),7.61(dd,j=8.4,3.4hz,1h),7.41(t,j=7.6hz,2h),7.30(d,j=4.3hz,1h),7.27(d,j=7.4hz,1h),7.15
–
7.01(m,4h),7.00
–
6.81(m,4h),6.71
–
6.44(m,2h),6.20(dd,j=10.8,3.3hz,1h),5.67
–
5.18(m,2h),4.65(t,j=13.0hz,2h),4.25(dd,j=37.8,15.8hz,1h),4.11(s,1h),3.96(d,j=15.9hz,1h),3.92
–
3.68(m,6h),3.47(s,2h),3.27
–
3.06(m,3h),3.05
–
2.72(m,2h),2.65(t,j=12.1hz,1h),
2.14(d,j=10.6hz,1h),1.83
–
1.57(m,2h),1.46
–
1.33(m,6h).[m-h]939.80。
[0039]
实施例2式1-2所示的化合物的制备
[0040][0041]
式1-2
[0042]
nutlin酸中间体(123.31mg,0.25mmol),hatu(70mg,0.184mmol)和diea(90μl)的混合物将干燥的dmf(3.78ml)在圆底烧瓶中在室温下搅拌0.5小时。然后,加入nh
2-peg
1-cootbu(33.26mg,0.25mmol)的0.5ml无水dmf溶液慢。将反应混合物在室温下搅拌12小时。通过淬灭反应将水和混合物用饱和nacl水溶液洗涤一次,用乙醚萃取乙酸乙酯。将有机层用无水na2so4干燥,并蒸发真空得到粗产物,将其通过硅胶柱进一步纯化色谱法(dcm:meoh=40:1),得到产物。
[0043]
在0℃下,向溶于dcm(1ml)的nutlin衍生物酯(140mg,0.020mmol)溶液中加入tfa(2ml)。在室温下搅拌17小时后,将所得混合物用甲苯(10ml)稀释并蒸发。通过快速柱色谱法(最初3:99甲醇-二氯甲烷,分级至1:9甲醇-二氯甲烷)纯化残余物,得到123mg nutlin衍生物酸中间体。
[0044]
nutlin衍生物酸中间体(123.31mg,0.25mmol),hatu(70mg,0.184mmol)和diea(90μl)的混合物将干燥的dmf(3.78ml)在圆底烧瓶中在室温下搅拌0.5小时。然后,加入尼拉帕尼(79mg,0.25mmol)的0.5ml无水dmf溶液慢。将反应混合物在室温下搅拌12小时。通过淬灭反应将水和混合物用饱和nacl水溶液洗涤一次,用乙醚萃取乙酸乙酯。将有机层用无水na 2so 4干燥,并蒸发真空得到粗产物,将其通过硅胶柱进一步纯化色谱法(dcm:meoh=40:1),得到产物。
[0045]1h nmr(400mhz,chloroform-d)δ9.05(s,1h),8.54(d,j=3.6hz,1h),8.32(d,j=7.0hz,1h),8.03
–
7.74(m,3h),7.59(t,j=8.6hz,1h),7.41(dd,j=8.3,6.0hz,3h),7.26(s,1h),7.16
–
6.79(m,8h),6.68
–
6.35(m,2h),6.20(s,1h),5.69
–
5.41(m,2h),5.31(s,1h),4.83
–
4.48(m,2h),4.01
–
3.70(m,9h),3.62
–
3.40(m,7h),3.13(s,3h),2.84
–
2.61(m,3h),2.14(d,j=12.3hz,1h),1.86
–
1.54(m,3h),1.44
–
1.29(m,6h).[m+h]1056.50。
[0046]
实施例3按照上述制备方法制备式1-3所示化合物。
[0047][0048]
式1-3
[0049]1h nmr(400mhz,chloroform-d)δ9.07(s,1h),8.56(s,1h),8.33(d,j=7.1hz,1h),8.04(s,1h),7.88(dq,j=25.5,9.0,8.1hz,3h),7.61(d,j=8.5hz,1h),7.41(dd,j=19.7,8.8hz,2h),7.15
–
6.78(m,8h),6.56(d,j=8.0hz,1h),6.49(s,1h),6.07(s,1h),5.59(d,j=9.5hz,1h),5.49(d,j=9.4hz,1h),4.85
–
4.67(m,1h),4.66
–
4.53(m,1h),4.13(d,j=7.5hz,1h),3.99(q,j=14.5,12.8hz,2h),3.86(d,j=8.0hz,6h),3.74(d,j=14.1hz,1h),3.64(dd,j=12.2,5.1hz,4h),3.58
–
3.38(m,5h),3.30(s,1h),3.13(d,j=10.6hz,3h),2.98(s,1h),2.91(s,1h),2.67(dd,j=21.5,9.3hz,4h),2.25
–
1.99(m,2h),1.37(d,j=16.6hz,6h).[m+h]1100。
[0050]
实施例4按照上述制备方法制备式1-4所示化合物。
[0051][0052]
式1-4(nn3)
[0053]1h nmr(400mhz,chloroform-d)δ9.07(s,1h),8.55(s,1h),8.37
–
8.21(m,1h),7.96
–
7.74(m,3h),7.58(d,j=8.4hz,1h),7.41(d,j=7.7hz,3h),7.26(d,j=7.6hz,2h),
7.08(d,j=7.5hz,2h),7.03(d,j=7.5hz,2h),6.93(d,j=7.8hz,2h),6.88(d,j=7.7hz,2h),6.54(d,j=8.4hz,1h),6.48(s,1h),6.31(d,j=18.1hz,1h),5.57(d,j=9.6hz,1h),5.48(d,j=9.6hz,1h),4.78
–
4.52(m,2h),4.04
–
3.89(m,2h),3.85(s,5h),3.81(d,j=4.4hz,2h),3.73
–
3.55(m,10h),3.52(s,3h),3.41(s,2h),3.27(s,2h),2.98
–
2.86(m,1h),2.80(d,j=12.1hz,1h),2.72
–
2.58(m,3h),1.85
–
1.56(m,4h),1.35(dd,j=13.8,4.4hz,6h).[m+na]1166.60。
[0054]
实施例5按照上述制备方法制备式1-5所示化合物。
[0055][0056]
式1-5
[0057]1h nmr(400mhz,chloroform-d)δ9.11(s,2h),8.55(d,j=4.6hz,2h),8.33(dd,j=8.3,2.1hz,2h),8.20
–
8.00(m,2h),7.99
–
7.75(m,6h),7.67
–
7.49(m,1h),7.49
–
7.33(m,5h),7.18
–
6.99(m,1h),6.90(d,j=8.4hz,1h),6.63
–
6.41(m,1h),6.21(d,j=7.9hz,3h),5.84
–
5.07(m,2h),4.91
–
4.43(m,3h),4.26
–
[0058]
3.55(m,6h),3.48
–
3.05(m,5h),3.05
–
2.44(m,6h),2.42
–
2.04(m,8h),1.30(d,j=18.5hz,9h),1.03
–
0.68(m,6h).[m+na]1212.40。
[0059]
实施例6按照上述制备方法制备式1-6所示化合物。
[0060][0061]
式1-6
[0062]1h nmr(400mhz,chloroform-d)δ9.07(d,j=2.9hz,1h),8.61(s,1h),8.31(d,j=6.4hz,1h),8.17(s,1h),8.05(d,j=8.7hz,3h),7.98(d,j=8.7hz,2h),7.93(d,j=8.3hz,1h),7.60(d,j=8.5hz,1h),7.30(s,1h),7.27(s,1h),7.09(d,j=8.4hz,4h),7.03(d,j=8.5hz,3h),6.94(d,j=8.4hz,2h),6.89(d,j=8.3hz,2h),6.64(s,2h),6.48(d,j=2.2hz,1h),6.31(d,j=2.9hz,1h),5.58(d,j=9.7hz,1h),5.49(d,j=9.7hz,1h),4.62(dt,j=9.9,5.5hz,3h),4.00
–
3.92(m,4h),3.85(s,5h),3.77(d,j=15.6hz,1h),3.71
–
3.64(m,6h),3.63(s,5h),3.60
–
3.54(m,5h),3.54
–
3.44(m,5h),3.39(q,j=5.1hz,3h),3.28(dt,j=13.3,5.9hz,2h),3.12(p,j=7.1,6.2hz,2h),1.40
–
1.34(m,6h).[m+h]1234.55。
[0063]
实施例4本发明化合物对parp的降解活性较强,下面以式1-1到1-6所示小分子化合物为例进行测试。
[0064]
1、主要溶液配制:
[0065]
受试化合物以及阳性对照药物尼拉帕尼和nutlin的配置:称取适量的受试化合物粉末,溶解于dmso中,使得终浓度为10mmol/l,10μl/管,-20℃避光保存,临用解冻,按所需浓度稀释。
[0066]
rpmi 1640培养液:每袋rpmi 1640粉剂先溶于约800ml双蒸水,加入1.5g nahco3,2.5g葡萄糖,0.11g丙酮酸钠,充分溶解,用双蒸水补充至1000ml。0.22μm微孔滤膜过滤除菌,等量分装,4℃保存备用。使用前加入10%胎牛血清,1
×
双抗。
[0067]
dmem培养液:每袋dmem粉剂先溶于约800ml双蒸水,加入1.5g nahco3,2.5g葡萄糖,0.11g丙酮酸钠,充分溶解,用双蒸水补充至1000ml。0.22μm微孔滤膜过滤除菌,等量分装,4℃保存备用。使用前加入10%胎牛血清,1
×
双抗。
[0068]
pbs缓冲液(ph 7.4):称取nacl 8.0g,kcl 0.2g,na2hpo4
·
12h2o 1.44g,kh2po4
·
12h2o 0.24g,溶于900ml双蒸水中,hcl调节ph至7.4,用双蒸水定容至1000ml,高压灭菌,室温储存。
[0069]
2、免疫印迹分析检测细胞的蛋白表达量
[0070]
(1)电泳:取变性后的蛋白样品等量上样于5%的浓缩胶与10%的分离胶中(主要成份为ddh2o,30%聚丙烯酰胺,1.5m tris-hcl(ph8.8)或1.0m tris-hcl(ph6.8),10%sds,10%过硫酸铵,temed),每孔蛋白上样量约40μg,100v恒压电泳,待溴酚蓝快跑到凝胶底部时结束电泳。
[0071]
(2)转膜:电泳结束后,拆卸玻璃板取出凝胶,切去浓缩胶,再依目的蛋白分子量的大小对分离胶适当剪切后泡于预冷转膜液中以免变干,同时将滤纸与海绵也泡于预冷转膜液中。裁剪一块与凝胶大小相仿的pvdf膜于甲醇中浸泡2min使膜活化,再按以下排列顺序制作“三明治”:负极上依次叠放1块海绵垫、2张滤纸、凝胶、pvdf膜、2张滤纸、一块海绵垫。注意:pvdf膜贴于凝胶上之后必须赶走气泡。接着按正确的正负电极方向安装好电泳槽进行湿转,四周放上冰块进行降温,调整电压为恒流200v(1.5h)。
[0072]
(3)封闭:转膜结束后将pvdf膜先于tbst中清洗5min,再放入5%的封闭液中于脱色摇床上封闭0.5-1h。
[0073]
(4)抗体孵育:将一抗用封闭液或者一抗稀释液按1:500-1:1000稀释后覆盖于pvdf膜上于室温下孵育2h或4℃过夜,然后用tbst清洗三次,每次5min。将二抗按1:5000稀释后,在摇床上与pvdf膜于室温下孵育1h,再用tbst清洗三次,每次5min。
[0074]
(5)化学发光,显影,定影:将a和b两试剂等体积混合,滴加到imagestation 4000mm成像仪上,然后把pvdf膜正面朝下覆盖在ecl试剂上,按成像仪的操作说明进行曝光,得到蛋白条带结果。
[0075]
3、结果:本发明parp蛋白降解剂对parp的降解活性如下:在mda-mb-231、mcf-7细胞系中,经实施例4所得化合物nn3处理48h后,蛋白质免疫印迹结果分析,可以明显观察到化合物nn3在不同剂量下对parp蛋白的降解效果。mda-mb-231细胞系中化合物nn3在12.5um,25um下对parp蛋白的降解作用如图所示。
[0076]
实施例5对不同来源的肿瘤细胞系的半数抑制率
[0077]
不同肿瘤细胞系:实验选取人源乳腺癌细胞系:mcf-7、hcc1937、mda-mb-231、skbr3、mx-1正常乳腺细胞mcf-10a,以便考察化合物nn3对不同来源的肿瘤细胞系的半数抑制率活性。将相应细胞培养于含10%胎牛血清、青霉素100iu/ml和链霉素100μg/ml的
rpmi1640培养液中。细胞置于37℃,5%co2饱和湿度培养箱中培养,取对数生长期的细胞用于实验。取对数生长期的细胞,按4
×
104个/ml接种于96孔培养板中,每孔180μl。
[0078]
实验组分别加入实施例1-6制备的初始浓度为200um并经对半稀释后的化合物20μl,阴性对照组不加药,阳性对照药尼拉帕尼、nutlin-3a(购自上海博邦),每组设3个平行孔,37℃培养48h。加入5mg/ml的mtt溶液20μl/孔,继续培养4h后,去除上清液,加入150μl dmso,微量振荡仪振荡10min,用酶标仪在570nm波长处测吸光度(od值)。根据吸光度计算细胞生长抑制率[细胞生长抑制率=(对照组od-实验组od)/对照组od
×
100%],并用logit法计算ic50值,实验重复3次,取平均值。
[0079]
本发明实施例4对不同乳腺癌细胞株显示出不同的生物学活性。相比阳性对照药尼拉帕尼,nutlin-3a,化合物nn3显示了更强的抗肿瘤作用,而对正常乳腺细胞mcf-10a无细胞毒性。
[0080]
表1 parp降解剂细胞水平生物活性检测(48h化合物200um作用下的最大抑制率或ic50(um);ns:未测)
[0081]
化合物命名分子量mda-mb-231mx-1mcf-7skbr3hcc1937mcf-10a1-1nn010115.59%34.97%10.19%18.63%无抑制作用ns1-2nn11055无抑制作用无抑制作用无抑制作用11.39%无抑制作用ns1-3nn21099.4199.03um16.71%42.401um40.14%40.06%ns1-4nn3114322.15um24.6%20.88um45.33%47.02%38.21%1-5nn41187161.52um80.26um54.32um199.11um29.63%ns1-6nn51231159um59.50um117.93um266.47um243.45umns 尼拉帕尼32070.40um49.91um38.69um70.23um97.15um87.16um nutlin581.4964.04um50.45um42.66um75.61um66.44um63.82um
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1