一种具有睡眠改善作用的酪蛋白肽及其制备方法和应用与流程
[0001]
本发明属于功能多肽技术领域,具体涉及一种具有睡眠改善作用的酪蛋白肽及其制备方法和应用。
背景技术:
[0002]
睡眠是一种重要的生理现象。良好的睡眠对维持正常的生理活动和身心健康起着重要的作用。失眠给患者的身心健康带来困扰,使人们的昼夜节律紊乱,降低了他们的活动能力,严重影响了患者的生活质量和生活质量。睡眠也是记忆细胞的新陈代谢过程:老化的细胞将用于每个记忆信息的排列,输入新的细胞进行储存。这些包括运动、语言区、平衡键以及日常生活中的一些过去事件和记忆。它们都是物质,所以它们也以物质的方式存在。
[0003]
如果一个人长期缺乏睡眠导致记忆细胞不能健康地生活,一些健康问题,甚至疾病,如失语症,痉挛,或休克和昏厥引起的强制性睡眠,将很容易发生。随着时间的推移,也很容易产生癌变。有规律的生活是一个良好的基础,但长期的“规律”疲劳是危险的。科学家建议有经济能力的人最好顺其自然,不要为了提倡道德而损害他们的健康。根据中国睡眠研究学会最新公布的睡眠调查数据,中国人失眠的发生率在38.2%。
[0004]
目前市面上有很多物理辅助睡眠的产品,但是此类产品对于助睡眠是治标不治本,待适应后,此类产品将无法促进人的睡眠。如智能床垫、智能灯泡、遮光眼罩、声音模仿装置。
[0005]
市面上也有药物类治疗失眠的,主要是镇静类、抗抑郁药、抗组胺药、安眠药等等。安定类的药物若长期服用,会出现成瘾性和依赖性的问题,一旦形成依赖,就离不开安眠药,会把它当成生活中必不可少的东西,如果不用安眠药,就难以入睡或通宵不眠。不仅因为缺药而高度紧张,而且有全身难受的感觉,出现生理、情绪、行为以及认知能力方面的综合症状。一些医学家临床观察发现,经常服用安眠药的人,他们的服药剂量渐渐增大,明显超过正常人,而且到后来,他们服用安眠药已不能达到增进睡眠的目的,反而变得兴奋欣快,步态不稳,口齿不清,有的甚至出现神志恍惚等症状。事实证明,长期服用安眠药的人,极容易发生安眠药依赖性。长期服用安眠药可使记忆力和智力减退。这种情况在老年人更加明显。医学家还发现,60岁以上的人常服安眠药,直接影响大脑平衡和保持头脑清醒的能力,致使他们有随时跌跤和骨折的危险。国外研究还表明,长期服用安眠药与老年性痴呆的发病有一定关系。服用安眠药引起的睡眠,与正常睡眠不完全相同。睡眠时往往恶梦多,并有定时早醒和白天嗜睡现象,对体力和精力的恢复均不利,对性格情感也有改变。一些安眠药成瘾的人,性格也会逐渐发生改变,变得情感冷淡,或脾气暴躁,常为小事发脾气,自私、固执。
[0006]
由于药物会对身体有所损伤,非药物治疗的保健食品成为失眠人群越来越多的选择,市面上有很多用于改善睡眠的保健食品加入了一些昂贵的中药材人参等药材,成本很大,功效也并没有全面的去发挥,造成效果一般或无效。还有一些需要的药品种类较多,存在制造方法复杂,好多成分提取不完整,造成成分的流失,保健食品的助睡眠功能失效。
技术实现要素:
[0007]
有鉴于此,本发明的目的在于提供一种新型的具有睡眠改善作用的酪蛋白肽及其制备方法和应用。
[0008]
本发明提供了一种具有睡眠改善作用的酪蛋白肽t1,所述酪蛋白肽t1的氨基酸序列为如seq id no:1所示的klppvgpy。
[0009]
本发明提供了一种具有睡眠改善作用的酪蛋白肽t2,所述酪蛋白肽t2的氨基酸序列为如seq id no:2所示的apiasllppy。
[0010]
本发明提供了一种具有睡眠改善作用的酪蛋白肽组合物,包括所述酪蛋白肽t1和所述酪蛋白肽t2;
[0011]
所述酪蛋白肽t1和酪蛋白肽t2的摩尔比为(1~10):(1~10)。
[0012]
本发明提供了所述具有睡眠改善作用的酪蛋白肽t1或所述具有睡眠改善作用的酪蛋白肽t2的提取分离方法,包括以下步骤:
[0013]
1)将酪蛋白溶液经匀浆和均质,得到性质稳定的匀浆液;
[0014]
2)将所述匀浆液在48~52℃条件下搅拌1~1.5h,调节ph值至7.0~7.4,得到预处理匀浆液;
[0015]
3)将所述预处理匀浆液依次经胰蛋白酶和木瓜蛋白酶作用下酶解,灭酶后,得到酶解液;
[0016]
4)所述酶解液去除色素后,依次过30000da陶瓷膜和1kd有机膜,收集膜下物,得到酪蛋白肽混合物;
[0017]
5)用sephadex g-50层析柱对所述酪蛋白肽混合物进行粗分离纯化,收集出峰时间为12~15min的组分;
[0018]
6)采用纳升级液相色谱-q exactive质谱联用系统对所述组分进行分析,得到的两种单链多肽分别为酪蛋白肽t1和酪蛋白肽t2。
[0019]
优选的,步骤1)中所述匀浆液中颗粒粒径为0.10~0.15mm;
[0020]
所述均质的压力为25兆帕,所述均质的时间为2h。
[0021]
优选的,步骤3)中胰蛋白酶在匀浆液中的质量浓度为0.5%~0.7%,所述胰蛋白酶的酶解时间为1~1.2h;
[0022]
所述木瓜蛋白酶在匀浆液中的质量浓度为0.2%~0.4%,所述木瓜蛋白酶的酶解时间为4~4.5h。
[0023]
优选的,步骤3)中所述胰蛋白酶在匀浆液中的质量浓度为0.6%;所述胰蛋白酶的酶解时间为1h;
[0024]
所述木瓜蛋白酶在匀浆液中的质量浓度为0.2%~0.4%;所述木瓜蛋白酶的酶解时间为4h。
[0025]
优选的,步骤6)中所述分析的参数如下:流动相流速为300nl/min;进样量为1μl;
[0026]
流动相梯度程序如下:
[0027]
时间(min)02.036.038.041.042.045.0a相体积百分含量%97976310109797b相体积百分含量%3337909033
[0028]
其中,a相为甲酸和纯净水的体积比为0.1:100的混合液;b相为甲酸和乙腈的体积
比为0.1:100的混合液。
[0029]
本发明提供了一种用于治疗失眠症的药物,包括所述酪蛋白肽t1、所述酪蛋白肽t2或所述酪蛋白肽组合物。
[0030]
本发明提供了所述酪蛋白肽t1和/或所述酪蛋白肽t2在制备治疗失眠症的药物中的应用。
[0031]
优选的,当所述药物包含所述酪蛋白肽t1或所述酪蛋白肽t2时,所述酪蛋白肽t1或所述酪蛋白肽t2的浓度不低于25μg/ml。
[0032]
本发明提供的具有睡眠改善作用的酪蛋白肽t1和t2,是以酪蛋白为原料,通过生物酶解技术,将其制备为酪蛋白肽,并进一步分离纯化,得到了两条具有阿片性质的生物活性肽。经斑马鱼试验和动物实验均证明,与模型对照组比较,酪蛋白纯肽、酪蛋白肽t1和t2在本实验浓度(27.8μg/ml、83.3μg/ml和250μg/ml)下对咖啡因诱导的斑马鱼失眠症均具有显著的睡眠改善作用,同时与阳性氯化锂给药组和酪蛋白纯肽给药组相比,在一定浓度下酪蛋白肽t1和酪蛋白肽t2的对咖啡因诱导的斑马鱼失眠症均具有显著的睡眠改善作用。与不同浓度的酪蛋白肽(62.5μg/ml、250μg/ml、1000μg/ml)给药组相比,酪蛋白肽t1和酪蛋白肽t2对咖啡因诱导的斑马鱼失眠症均具有显著的睡眠改善作用。
附图说明
[0033]
图1为酪蛋白肽t1的二级质谱图;
[0034]
图2为酪蛋白肽t2的二级质谱图;
[0035]
图3为本发明制备的酪蛋白肽t1和t2及供试品对斑马鱼失眠症的睡眠改善作用(失眠时间);
[0036]
图4为本发明制备的酪蛋白肽t1和t2及供试品对斑马鱼失眠症的睡眠改善作用柱状图。
具体实施方式
[0037]
本发明提供了具有睡眠改善作用的酪蛋白肽t1,所述酪蛋白肽t1的氨基酸序列为如seq id no:1所示的klppvgpy。
[0038]
本发明还提供了一种具有睡眠改善作用的酪蛋白肽t2,所述酪蛋白肽t2的氨基酸序列为如seq id no:2所示的apiasllppy。
[0039]
在本发明中,所述酪蛋白肽t1和酪蛋白肽t2的制备方法没有特殊限制,采用本领域所熟知的制备方法即可,例如根据多肽的氨基酸序列人工合成。在本发明实施例斑马鱼动物实验中,所用的酪蛋白肽t1和t2均委托上海强耀生物技术有限公司合成。所述酪蛋白肽t1和t2采用回肠收缩实验表明均具有阿片活性,属于阿片肽。实验表明,在相同浓度下,所述酪蛋白肽t1的睡眠改善作用显著强于酪蛋白肽t2。
[0040]
本发明还提供了具有睡眠改善作用的酪蛋白肽组合物,包括所述酪蛋白肽t1和酪蛋白肽t2。所述酪蛋白肽t1和酪蛋白肽t2的摩尔比为1~10:1~10,更优选为3~5:4~7。所述酪蛋白肽组合物的制备方法,优选将所述酪蛋白肽t1和酪蛋白肽t2按比例混合,得到酪蛋白肽组合物。
[0041]
本发明提供了所述具有睡眠改善作用的酪蛋白肽t1或酪蛋白肽t2的制备方法,包
括以下步骤:
[0042]
1)将酪蛋白溶液经匀浆、均质,得到性质稳定的匀浆液;
[0043]
2)将所述匀浆液在48~52℃条件下搅拌1~1.5h,调节ph值至7.0~7.4,得到预处理匀浆液;
[0044]
3)将所述预处理匀浆液依次经胰蛋白酶和木瓜蛋白酶作用下酶解,灭酶后,得到酶解液;
[0045]
4)所述酶解液去除色素后,依次过30000da陶瓷膜和1kd有机膜,收集膜下物干燥,得到酪蛋白肽混合物;
[0046]
5)用sephadex g-50层析柱对所述酪蛋白肽混合物进行粗分离纯化,收集出峰时间为12~15min的组分;
[0047]
6)将所述组分采用纳升级液相色谱-q exactive质谱联用系统进行分析,得到的两种单链多肽分别为酪蛋白肽t1和酪蛋白肽t2。
[0048]
本发明将酪蛋白溶液经匀浆处理,得到的匀浆液进行均质,得到性质稳定的匀浆液。
[0049]
在本发明中,所述酪蛋白溶液的质量浓度优选为8%~12%,更优选为10%。本发明对所述酪蛋白的来源没有特殊限制,采用本领域所熟知的酪蛋白的来源即可,例如本发明实施例中,所述酪蛋白购自新西兰恒天然集团公司。所述匀浆处理优选采用胶体磨研磨。研磨后得到的匀浆液中颗粒粒径优选为0.10~0.15mm,更优选0.12mm。所述均质优选采用高压均质仪进行。所述均质的压力优选为25兆帕。所述均质的时间优选为2h。所述匀浆后均质有利于使得到的匀浆液质地细腻、不分层,提高匀浆液的稳定性。
[0050]
得到匀浆液后,本发明将所述匀浆液在48~52℃条件下搅拌1~1.5h,调节ph值至7.0~7.4,得到预处理匀浆液。
[0051]
在本发明中,所述匀浆液的温度优选为50℃。所述搅拌的时间优选为1.2h。所述在48~52℃条件下搅拌1~1.5h,有利于匀浆液与蛋白酶充分结合,提高酶解效率。
[0052]
在本发明中,所述匀浆液的ph值优选为7.2。调节ph值有利于为后续酶解提供适宜的酶解环境。
[0053]
得到预处理匀浆液后,本发明将所述预处理匀浆液依次在胰蛋白酶、木瓜蛋白酶作用下酶解,灭酶后,得到酶解液。
[0054]
在本发明中,所述胰蛋白酶在匀浆液中的质量浓度优选为0.5%~0.7%,优选为0.6%。所述胰蛋白酶的酶解时间优选为1~1.2h,更优选为1h。所述木瓜蛋白酶在匀浆液中的质量浓度优选为0.2%~0.4%,更优选为0.3%。所述继续酶解的时间优选为4~4.5h。本发明对所述胰蛋白酶、木瓜蛋白酶的来源没有特殊限制,采用本领域所熟知的胰蛋白酶、木瓜蛋白酶即可,例如通过常规的商品购买途径获得即可。利用胰蛋白酶、木瓜蛋白酶进行组合酶解,得到的酪蛋白酶t1和t2最多,且生物活性最高。
[0055]
本发明对所述灭酶的方法的没有特殊限制,采用本领域所熟知的灭酶方法即可。在本发明实施例中,所述灭酶优选采用高温短时灭酶。所述灭酶的温度优选为100~120℃,所述灭酶的时间优选为2~5min。
[0056]
得到灭酶的酶解液后,本发明将所述酶解液去除色素,依次过30000da陶瓷膜和1kd有机膜,收集膜下物干燥,得到酪蛋白肽混合物。
[0057]
在本发明中,去除色素的方法优选为采用活性炭脱色。所述活性炭的加入质量浓度3%~4%。所述活性炭的作用是吸附酶解液的呈色物质,以便进行脱色。所述干燥的方法优选冷冻干燥。所述冷冻干燥的参数优选如下:
[0058]
冷冻温度-50℃-45℃-40℃-35℃-30℃-25℃-20℃冷冻时间3.3h2h1h1h1h1h2h冷冻温度-15℃-10℃-5℃0℃5℃10℃28℃冷冻时间2h2h1h2h1h3h4h
[0059]
。在本发明实施例中,30000da陶瓷膜的购买来源为江苏久吾高科技股份有限公司。1kd有机膜的购买来源为江苏久吾高科技股份有限公司。
[0060]
得到酪蛋白肽混合物后,本发明用sephadex g-50层析柱对所述酪蛋白肽混合物进行粗分离纯化,收集出峰时间为12~15min组分。
[0061]
在本发明中,用sephadex g-50层析柱进行粗分离纯化的方法优选包括以下内容:
[0062]
上样用溶液为浓度120mg/ml的酪蛋白肽混合物溶液。所述sephadex g-50层析柱的规格优选为3*100cm。所述流动相为体积浓度10%甲醇水溶液,所述流动相的流速优选为1ml/min。在214nm处测定吸光度,按照色谱峰收集流份并将各流份浓缩后用真空干燥机冷冻干燥成粉。分离纯化共收集得到12个组分,采用回肠收缩实验检测阿片活性,出峰时间为12~15min的组分5的阿片活性最强,因此,将组分5进一步检测其组成和结构。
[0063]
得到阿片活性强的组分后,将所述组分采用纳升级液相色谱-q exactive质谱联用系统进行分析,得到的两种单链多肽为酪蛋白肽t1和酪蛋白肽t2。
[0064]
在本发明中,纳升级液相色谱-q exactive质谱联用系统的分析参数优选如下:流动相流速优选为300nl/min;流动相梯度程序如下:
[0065]
时间(min)02.036.038.041.042.045.0a相体积百分含量%97976310109797b相体积百分含量%3337909033
[0066]
其中,a相为0.1%甲酸+100%纯净水;b相:100%乙腈+0.1%甲酸,此处百分比均为体积浓度。进样量优选为1μl上清。
[0067]
在本发明中,经过上述分析,得到组分5中含有两条单链多肽,且两条单链多肽占组分5的总质量的62%。所述两条单链多肽分别为所述酪蛋白肽t1和所述酪蛋白肽t2。
[0068]
本发明提供了一种用于治疗失眠症的药物,包括所述酪蛋白肽t1和/或所述酪蛋白肽t2。所述药物中酪蛋白肽t1和/或所述酪蛋白肽t2的浓度不低于25μg/ml,更优选为50~100μg/ml。当所述药物中同时包含酪蛋白肽t1和酪蛋白肽t2时,酪蛋白肽t1和酪蛋白肽t2的摩尔比优选为1~10:1~10,更优选为3~5:4~7。本发明对所述药物的剂型没有特殊限制,采用本领域所熟知的多肽药物剂型即可。本发明对所述药物的制备方法没有特殊限制,采用本领域所熟知的药物制备方法即可。
[0069]
本发明提供了所述酪蛋白肽t1和/或所述酪蛋白肽t2在制备治疗失眠症的药物中的应用。
[0070]
在本发明中,在所述药物中,所述药物中酪蛋白肽t1或所述酪蛋白肽t2的浓度优选不低于25μg/ml。
[0071]
基于酪蛋白肽t1、所述酪蛋白肽t2的改善睡眠的作用,本发明优选提供了所述酪
蛋白肽t1、所述酪蛋白肽t2在治疗失眠症中的应用,或者所述酪蛋白肽t1和/或所述酪蛋白肽t2在制备治疗失眠症的保健食品或保健品中的应用。
[0072]
下面结合实施例对本发明提供的一种具有睡眠改善作用的酪蛋白肽及其制备方法和应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0073]
实施例1
[0074]
新型酪蛋白肽的制备方法
[0075]
步骤一.取酪蛋白500kg进行调浆,加入无离子水5000l,得到浓度为10%的酪蛋白溶液。
[0076]
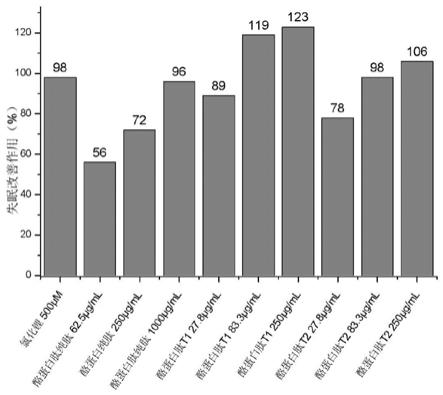
步骤二.将步骤一的酪蛋白溶液搅拌均匀,采用胶体磨进行处理1.2h时间,然后利用高压均质机在25兆帕压力下处理2h时间,保证匀浆液质地细腻、不分层,提高匀浆液的稳定性。
[0077]
步骤三.将高压均质后的匀浆液进行投料,进行搅拌处理,并升温至50℃,保温1h。
[0078]
步骤四.将步骤三的酪蛋白溶液用0.5m naoh溶液调ph值至7.2,并保持温度恒定。
[0079]
步骤五.向步骤四的调ph的酪蛋白溶液加入0.6%的胰蛋白酶(3.0kg),酶解1h后,再加入0.3%的木瓜蛋白酶(1.5kg),继续酶解4h。
[0080]
步骤六.将步骤五中的酶解液升温至110℃保持5min,对蛋白酶进行灭活。
[0081]
步骤七.将步骤六的灭酶溶液降温至55℃,加入4%的活性炭(40kg),保温1小时后,过30000da陶瓷膜,然后过1kd有机膜,喷雾干燥,得到酪蛋白肽混合物。
[0082]
酪蛋白肽混合物基本理化性质测定指标如下:蛋白质含量测定(gb5009.9)、水分含量的测定(gb5009.3)、灰分含量的测定(gb5009.4)。结果见表1。
[0083]
表1酪蛋白肽混合物的基本理化性质
[0084]
项目蛋白质含量(%)水分含量(%)灰分含量(%)酪蛋白肽混合物923.64.4
[0085]
实施例2
[0086]
酪蛋白肽的粗分离纯化
[0087]
凝胶的溶胀:称取适量的sephadex g-50凝胶干粉,加入过量的去离子水,置于室温下膨胀2天,然后抽真空去除凝胶空隙中的空气,沸水水浴条件下充分溶胀2h,充分溶胀后移去表面漂浮的不易下沉的较小颗粒以及内部的空气和细菌,去离子水反复洗涤2~3次备用。
[0088]
装柱与平衡:取洁净的3
×
100cm的层析柱垂直固定在铁架台上,关闭出水口,将层析柱中加入蒸馏水(约1/3处),将溶胀的凝胶边搅拌边倒入层析柱内,待凝胶在重力的作用下完全沉降,装柱完毕。注意:柱中的凝胶不可以分层,如出现分层,需要接上恒流泵,用2倍床体积的洗脱液平衡柱子,使柱床稳定。
[0089]
上样:将实施例1中生产的酪蛋白肽混合物加水溶解,配制成120mg/ml的溶液,采用sephadex g-50层析柱(3
×
100cm)进行分离纯化,流动相为10%甲醇,流速为1ml/min,洗脱液214nm处测定吸光度,按照色谱峰收集流份并将各流份浓缩后用真空干燥机冷冻干燥成粉。
[0090]
收集得到了12个组分,12个组分的出峰时间情况见表2。
[0091]
表2 12个组分的出峰时间情况
[0092][0093][0094]
实施例3
[0095]
酪蛋白肽的阿片活性检测
[0096]
利用酪蛋白的水解产物对豚鼠的回肠具有收缩的作用,通过体外实验评价不同组分酪蛋白肽的生物活性。
[0097]
1.试验材料
[0098]
豚鼠(10只,200~300g,雌雄各半,购自于济南朋悦实验动物繁育有限公司);台式液自配;纳洛酮(北京凯因生物科技有限公司);通气钩、铁支架、剪刀、烧杯、培养皿等。
[0099]
2.试验仪器
[0100]
麦氏浴槽、肌力换能器、bl-410生物技能实验系统。
[0101]
3.实验方法
[0102]
回肠肌收缩频率扫描装置的安装。
[0103]
离体肠肌制备:用木槌击豚鼠头部致昏死,立即剖开腹腔,找到回盲部,然后在离回盲部1cm处剪断,取出回肠约10cm左右一段,置于氧饱和的台氏液培养皿中,沿肠壁除去肠系膜,然后将回肠剪成数小段(约1~1.5cm),用注射器吸取台氏液将肠内容物冲洗干净。
[0104]
离体肠肌处理:取一小段肠管置于盛有台氏液的培养皿中,在其两端对角壁处,分别用缝针穿线,并打结。注意保持肠管通畅,勿使其封闭。
[0105]
肠管固定:取一小段肠管置于盛有台氏液的培养皿中,在其两端对角壁处,分别用缝针穿线,并打结。注意保持肠管通畅,勿使其封闭。肠管一端连线系于浴槽固定钩上,然后放入37℃麦氏浴槽中。再将肠管的另一端系结在张力换能器的悬臂梁上。
[0106]
肠肌稳定:调节张力至1g,稳定10~30分钟。
[0107]
待离体回肠稳定10~30min后,记录一段正常收缩曲线后,依次于麦氏浴槽中滴加实施例2中收集的不同组分酪蛋白肽,接触2分钟,并观察收缩幅度,待其达到收缩高峰后,即可再加入另一组分的酪蛋白肽进行评价。
[0108]
进行t检验数据处理,确定哪一组分的活性最强。
[0109]
结果分析
[0110]
不同组分对豚鼠回肠的作用结果见表3。
[0111]
表3不同组分对豚鼠回肠的作用结果
[0112][0113]
注:每组数据与加样前的数据进行比较,t检验*p<0.05&**p<0.01。
[0114]
由表3可以看出,组分5的阿片活性最强,其可以显著性的抑制回肠收缩频率;不加样品的回肠收缩频率为126次/分钟,回肠收缩幅度为7.58mm;加入不同的组分后大部分呈现抑制回肠收缩频率和收缩幅度的效果,其中组分5的活性最强,其收缩频率为95.51次/分钟,收缩幅度为3.08mm,针对此组分进行纯化,分析其多肽组成,并进一步鉴定其氨基酸组成结构。
[0115]
实施例4
[0116]
组分5的纯度及结构的鉴定
[0117]
采用纳升级液相色谱-q exactive质谱联用系统,对实施例2所得到的组分5进行纯度和结构鉴定。
[0118]
1.色谱条件:
[0119]
(1)流动相:a相:100%纯净水+0.1%甲酸;b相:100%乙腈+0.1%甲酸;
[0120]
(2)流动相流速:300nl/min
[0121]
(3)进样量:1μl上清
[0122]
(4)流动相梯度程序如下表4所示。
[0123]
表4流动相梯度程序
[0124]
时间(分)02.036.038.041.042.045.0a(%)97976310109797b(%)3337909033
[0125]
利用纳升级液相色谱-q exactive质谱联用,从组分5中纯化得到了2条具有阿片活性的多肽,鉴定其结构为klppvgpy(seq id no:1,lys-leu-pro-pro-val-gly-pro-tyr)和apiasllppy(seq id no:2,ala-pro-ile-ala-ser-leu-leu-pro-pro-tyr)的单链多肽。通过液质联用技术测定两条单链多肽占组分5总质量的62%,通过液质联用技术测定两条肽单链在酪蛋白肽混合物的质量百分含量分别为3.9%和2.1%。因此,将klppvgpy命名为酪蛋白肽t1(二级质谱图见图1),将apiasllppy命名为酪蛋白肽t2(二级质谱图见图2)。
[0126]
实施例5
[0127]
酪蛋白肽斑马鱼试验
[0128]
1.实验动物
[0129]
野生型ab品系斑马鱼,以自然成对交配繁殖方式进行。年龄为5dpf,共330尾,每实验组为30尾(用于酪蛋白纯肽、t1和t2的浓度摸索实验)。
[0130]
野生型ab品系斑马鱼,以自然成对交配繁殖方式进行。年龄为5dpf,共210尾,每实验组为30尾(用于供试品对咖啡因诱导的失眠斑马鱼的睡眠改善作用评价)。
[0131]
斑马鱼饲养于28℃的养鱼用水中(水质:每1l反渗透水中加入200mg速溶海盐,电导作用为480~510μs/cm;ph值为6.9~7.2;硬度为53.7~71.6mg/l caco3),实验动物使用许可证号为:syxk(浙)2012-0171。饲养管理符合国际aaalac认证的要求。
[0132]
2.实验样品
[0133]
酪蛋白纯肽,白色粉末,由中食都庆(山东)生物技术有限公司生产提供,阴凉柜20℃保存。
[0134]
酪蛋白肽t1和酪蛋白肽t2两个多肽委托上海强耀生物技术有限公司合成,-18℃冰箱保存。
[0135]
咖啡因,白色粉末,购自阿拉丁试剂(上海)有限公司,批号为404-520-2。临用前用dmso配制成浓度为50mm的母液。
[0136]
3.仪器与试剂
[0137]
解剖显微镜(szx7,olympus,japan);6孔板(fisher scientific,china);96孔板(fisher scientific,china);精密电子天平(cp214,奥豪斯,china);行为分析仪(v3.11,viewpoint life sciences,france)。
[0138]
4.确定最大耐受浓度(mtc)浓度组别
[0139][0140]
5.mtc检测结果
[0141]
酪蛋白纯肽在2000μg/ml浓度时,斑马鱼死亡率为100%(30/30);在1000μg/ml浓度时,斑马鱼死亡率为0(30/30);在<1000μg/ml浓度范围内,斑马鱼无明显异常,因此酪蛋白纯肽的mtc为1000μg/ml。
[0142]
酪蛋白肽t1在2000μg/ml浓度时,斑马鱼死亡率为23.3%(7/30);酪蛋白肽t2在2000μg/ml浓度时,斑马鱼死亡率为33.3%(10/30);酪蛋白肽t1和酪蛋白肽t2在500μg/ml
浓度时,斑马鱼死亡率为0(30/30);在<1000μg/ml浓度时,斑马鱼无明显异常,因此酪蛋白肽t1和酪蛋白肽t2的mtc均为500μg/ml(见表5)。
[0143]
表5酪蛋白纯肽、酪蛋白肽t1和酪蛋白肽t2在耐受浓度下斑马鱼死亡数量统计(n=30)
[0144][0145][0146]
实施例6
[0147]
1.模型制作
[0148]
用200μmol/l的咖啡因处理5dpf野生型ab系斑马鱼,建立斑马鱼失眠模型。
[0149]
2.实验方法
[0150]
2.1改善睡眠作用评价
[0151]
[0152][0153]
浓度确定依据是根据浓度摸索实验,酪蛋白纯肽对斑马鱼的mtc为1000μg/ml,酪蛋白肽t1和酪蛋白肽t2的mtc均为500μg/ml。酪蛋白肽t1和酪蛋白肽t2改善睡眠作用评价的实验浓度设置为27.8μg/ml(低剂量)、83.3μg/ml(中剂量)、250μg/ml(高剂量)。
[0154]
2.2斑马鱼给药组设置及测试方法
[0155]
随机选取5dpf野生型ab系斑马鱼于6孔板中,每孔30尾,用咖啡因诱导斑马鱼建立失眠模型,分别水溶给予酪蛋白纯肽(低剂量62.5μg/ml、中剂量250μg/ml、高剂量1000μg/ml),酪蛋白肽t1(低剂量27.8μg/ml、中剂量83.3μg/ml、高剂量250μg/ml)和t2(低剂量27.8μg/ml、中剂量83.3μg/ml、高剂量250μg/ml),阳性对照药氯化锂500μm浓度,同时设置正常对照组(养鱼用水处理斑马鱼)和模型对照组,每孔(实验组)容量为3ml。供试品处理18h后,将斑马鱼转移至96孔板中,每孔(即每浓度组)1尾,每个实验组随机选择10尾斑马鱼应用行为分析仪测定斑马鱼的失眠时间,以失眠时间评价供试品对咖啡因诱导的斑马鱼失眠症的睡眠改善作用。供试品对失眠症斑马鱼的睡眠改善作用的计算按照如下式i得到:
[0156][0157]
用方差分析和dunnett’s t-检验进行统计学分析,p<0.05表示具有显著性差异,提供具有代表性的实验图谱。
[0158]
实验结果
[0159]
模型对照组斑马鱼失眠时间(9272s)与正常对照组(6400s)比较p<0.01,表明模型建立成功;阳性对照药氯化锂500μm浓度组斑马鱼失眠时间为6465s,与模型对照组比较p<0.01,睡眠改善作用为98%,说明氯化锂对咖啡因诱导的斑马鱼失眠症具有明显的睡眠改善作用。
[0160]
酪蛋白纯肽(低、中、高)62.5μg/ml、250μg/ml、1000μg/ml浓度时斑马鱼失眠时间分别为7663s、7204s、6515s,睡眠改善作用分别为56%、72%和96%;酪蛋白肽t1(低、中、高)27.8μg/ml、83.3μg/ml和250μg/ml浓度时斑马鱼失眠时间分别为6716s、5854s、5739s,睡眠改善作用分别为89%、119%和123%;酪蛋白肽t2(低、中、高)27.8μg/ml、83.3μg/ml和250μg/ml浓度时斑马鱼失眠时间分别为7032s、6457s和6228s,睡眠改善作用分别为78%、98%和106%。与模型对照组比较(p<0.05&p<0.01)提示酪蛋白纯肽、酪蛋白肽t1和酪蛋白肽t2在本实验浓度下对咖啡因诱导的斑马鱼失眠症均具有显著的睡眠改善作用,并且与氯化锂和酪蛋白纯肽相比,酪蛋白肽t1和酪蛋白肽t2在本实验浓度下对咖啡因诱导的斑马鱼失眠症也均具有显著的睡眠改善作用。详见表6、图3和图4。
[0161]
表6供试品对斑马鱼睡眠改善作用定量数据(n=10)
[0162][0163]
注:与模型组对比,*p<0.05,**p<0.01;与阳性药物
[0164]
实施例7
[0165]
酪蛋白肽t1和t2的模拟体内消化反应
[0166]
人体摄入的多肽后,需要经过胃肠消化道才能被吸收利用;为此,展开了酪蛋白肽t1和t2的体外消化稳定性测定,用胃蛋白酶和胰蛋白酶模拟胃肠道消化,将酪蛋白肽t1和t2(100mg)注入3ml 0.1mol/l的磷酸缓冲液,加入2ml胃蛋白酶-瓜尔胶混合溶液,利用2mol/l hcl调ph值至1.5,于37℃恒温水浴中磁力搅拌30min;将上述溶液中加入5m l磷酸缓冲液,利用naoh溶液调节ph为6.9;然后分别加入125μl mgcl
2-cacl2、125μl胰蛋白酶,补水至50ml,于37℃摇床孵育120min。沸水浴灭酶,将样品于离心机以转速8000rpm离心10min取上清,并进行质谱分析。
[0167]
酪蛋白肽t1和酪蛋白肽t2经过模拟体内消化反应后,稳定率结果如下表7所示,其中稳定率=(酶解后峰面积/酶解前峰面积)
×
100%。
[0168]
表7 t1和t2体外经过胃蛋白酶和胰蛋白酶消化稳定性结果
[0169]
样品名称酶解前峰面积酶解后峰面积稳定率(%)酪蛋白肽t1(869.5da)2301.521753.7576.2%酪蛋白肽t2(1040.59da)2962.652405.6781.2%
[0170]
酪蛋白肽t1在体外经过胃蛋白酶-胰蛋白酶消化酶解后,稳定性为76.2%,酪蛋白肽t2在体外经过胃蛋白酶-胰蛋白酶消化酶解后,稳定性为81.2%;说明酪蛋白肽t1和酪蛋白肽t2在胃蛋白酶-胰蛋白酶作用下,不容易被酶解破坏。
[0171]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1